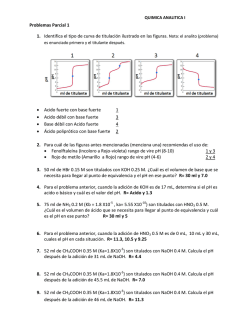
C H HCl C H Cl + --→ 2. Diseño de un reactor PFR con una - DePa
1. Ajuste de ecuaciones LHHW Se estudia la formación de cloruro de etilo usando óxido de zirconio sobre gel de sílice como catalizador en presencia de metano. La reacción es: C2 H 4 + HCl ⎯⎯ → C2 H 5Cl Si la desorción del producto controla la cinética total, obtenga una expresión del tipo LHHW para la velocidad de reacción. Desprecie las resistencias interna y externa de transporte. Por cuestiones didácticas considere que a esa temperatura Keq=1. a)Evalúe las constantes de la ecuación de velocidad a 350 °F con base a los siguientes casos: rA (104) Lb mol/(hr*lb cat) 2.71 2.63 2.44 2.58 2.69 CH4 (I) 7.005 7.090 7.001 9.889 10.169 Presión parcial C2H4 (A) HCl (B) 0.300 0.370 0.416 0.215 0.393 0.289 0.511 0.489 0.420 0.046 C2H5Cl (C) 0.149 0.120 0.181 0.334 0.175 2. Diseño de un reactor PFR con una ecuación tipo LH. Un reactor PFR se utiliza para llevar a cabo la reacción irreversible en fase gaseosa 2 A ⎯⎯ → 3B que presenta la siguiente ecuacion tipo LH: ⎛ ⎞ PA ( − rA ) = 0.5 ⎜ ⎟ ⎝ 1 + 0.2 PA + 0.1PB ⎠ 2 (1) La presión inicial total es de 5 atm. El flujo molar total es de 10 kmol/h, de los cuales FA0=3 Kmol/h, FB0=0 y el balance inertes. Determine la cantidad de catalizador necesaria para alcanzar una conversión del 80%. R=19.29 kg Efecto de la temperatura en el equilibrio. Se ha determinado que la reacción gaseosa reversible de primer orden: k1 ⎯⎯ →B A ←⎯ ⎯ Presenta los siguientes datos: k1=103 exp [-4800/RT] seg-l ΔCp = cpB- cpA = 0 ΔHR = -8000 cal/mol a 300°K K= 10 a 300°K La alimentación esta formada por A puro y La presión total del sistema permanece constante. Determine: a) La conversión de equilibrio en función de la temperatura.
© Copyright 2026