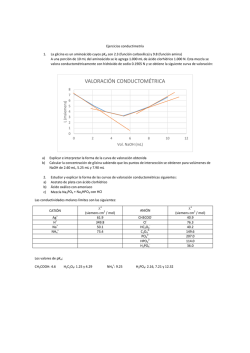
Problemas Parcial 1 1. Identifica el tipo de curva
QUIMICA ANALITICA I Problemas Parcial 1 1. Identifica el tipo de curva de titulación ilustrado en las figuras. Nota: el analito (problema) es enunciado primero y el titulante después. Acido fuerte con base fuerte Acido débil con base fuerte Base débil con Acido fuerte Ácido poliprótico con base fuerte 1 3 4 2 2. Para cuál de las figuras antes mencionadas (menciona una) recomiendas el uso de: Fenolftaleína (Incoloro a Rojo-violeta) rango de vire pH (8-10) 1y3 Rojo de metilo (Amarillo a Rojo) rango de vire pH (4-6) 2y4 3. 50 ml de HBr 0.15 M son titulados con KOH 0.25 M. ¿Cuál es el volumen de base que se necesita para llegar al punto de equivalencia y el pH en ese punto? R= 30 ml y 7.0 4. Para el problema anterior, cuando la adición de KOH es de 17 mL, determina si el pH es acido o básico y cuál es el valor del pH. R= Acido y 1.3 5. 75 ml de NH3 0.2 M (Kb = 1.8 X10-5 , ka= 5.55 X10-10) son titulados con HNO3 0.5 M. ¿Cuál es el volumen de ácido que se necesita para llegar al punto de equivalencia y cuál es el pH en ese punto? R= 30 ml y 5 6. Para el problema anterior, cuando la adición de HNO3 0.5 M es de 0 mL, 10 mL y 30 mL, cuales el pH en cada situación. R= 11.3, 10.5 y 9.25 7. 52 ml de CH3COOH 0.35 M (Ka=1.8X10-5) son titulados con NaOH 0.4 M. Calcula el pH después de la adición de 31 mL de NaOH. R= 4.4 8. 52 ml de CH3COOH 0.35 M (Ka=1.8X10-5) son titulados con NaOH 0.4 M. Calcula el pH después de la adición de 45.5 mL de NaOH. R= 7.0 9. 52 ml de CH3COOH 0.35 M (Ka=1.8X10-5) son titulados con NaOH 0.4 M. Calcula el pH después de la adición de 46 mL de NaOH. R= 11.3 10. En una titulación de 30 ml de una solución de hidróxido de sodio de concentración desconocida, se necesitaron 45.2 ml de ácido clorhídrico 0.1 M para neutralizar la solución de la base hasta el punto final de la fenolftaleína. ¿Cuál es la Molaridad del hidróxido? R= 0.15 M Rxn: NaOH + HCl NaCl + H2O 11.2 ml de amoniaco casero (NH3) se titularon con 34.9 ml de ácido clorhídrico 0.11M: a. ¿Cuál es la Molaridad del amoniaco? R=1.92 M b. ¿Cuál es el pH del punto de equivalencia? pH = 9 c. ¿Cuál es la conc. en % , si la densidad de la solución de amoniaco es 0.985 g/ml? R=3.3% Reacción: NH3 + HCl NH4Cl (NH3 = base y NH4+ es el ácido). Punto de equivalencia: moles NH3 = moles HCl (V*M)NH3 = (V*M) HCl Punto b) pKa + pKb = 14 Ka*Kb = Kw (10-14) Por ejemplo NH3 pKb = 4.75 , pKa = 9.25 NH3 no posee H+ ni tampoco OH ¿Cómo podemos relacionarlo con el pH? El NH3 reacciona con H2O (NH3 + H2O NH4+ + OH- ) y el OH liberado por el amoniaco es responsable del pH ( en otras palabras NH3 es una base) En el equilibrio Kb= [NH4+ ]*[ OH-]/[ NH3] [NH4+ ]=[ OH-]= X Kb= X2/[ NH3] calcula el pOH y de la ecuación pH + pOH = 14 se obtiene el pH. con [ OH-] se 12. El carbonato de sodio puro se utiliza como patrón primario, para determinar la molaridad de un ácido (Ej. HCl). Si se disuelven 0.875g de Na 2CO3 en agua (50 ml Solución) y se titulan con HCl de concentración desconocida, consumiendo 35.6 ml de esta solución, cual es la concentración molar del HCl. a. ¿Cuál es la Molaridad del HCl? R=0.46 M Reacción: Na2CO3 + 2HCl 2 NaCl + CO2 + H2O Punto de equivalencia: 2*moles Na2CO3 = moles de HCl 2*(V*M)Na2CO3 = (V*M) HCl
© Copyright 2026