GUIA 02-2016 - QUIMICA Medicina, USAC
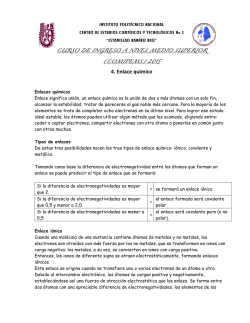
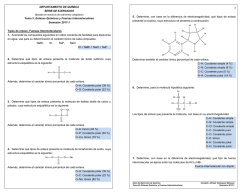
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUÍA DE ESTUDIO 2016 SEMANA 2 ELECTRONEGATIVIDAD, UNIONES Y ENLACES QUIMICOS Elaborado por: Licda. Lucrecia C. de Leiva Lea en el libro de texto el capítulo 5: COMPUESTOS Y SUS ENLACES. I. ELECTRONEGATIVIDAD 1. Complete el siguiente cuadro indicando el tipo de enlace que se forma a partir de la diferencia de electronegatividad en los siguientes compuestos. COMPUESTO Ejemplo Cl2 Ejemplo NaCl DIFERENCIA DE ELECTRONEGATIVIDAD 3.16 - 3.16 = 0 3.16 - 0.93 = 2.23 TIPO DE ENLACE COMPARTEN ó TRANSFIEREN ELECTRONES No polar (puro) Comparten Iónico Transfieren a. HBr b. O2 c. P2S5 d.CS2 e. MgO f. KCl g. FeCl2 h. CO2 i. H2 j. Cl2O 2. Realizar en hoja adicional los ejercicios 5.57 y 5.59 página 188, capítulo 5 del libro de texto, revise la respuesta en la pagina 202. 1/5 II. RESUELVA EL SIGUIENTE CRUCIGRAMA: HORIZONTALES 1. Enlace en donde se comparten tres pares de electrones entre dos átomos de elementos no metálicos. 3. Ion con carga negativa. 7. Enlace en donde dos átomos comparten un par de electrones, pero estos han sido aportados por un solo átomo. También llamado Dativo. 8. Regla que siguen los átomos en la cual existe una tendencia a obtener una configuración electrónica estable. 9. Ion con carga positiva. 10. Tipo de enlace en el cual los electrones del átomo de un metal se transfieren a el átomo de un no metal. 11. Enlace en donde se comparten dos pares de electrones entre 2 átomos. VERTICALES 2. Capacidad relativa de un elemento para atraer electrones en un enlace. 4. Enlace covalente en el que los electrones se comparten de manera desigual 5. Enlace en donde dos átomos no metálicos comparten electrones. 6. Enlace covalente en el que la diferencia de electronegatividad se encuentra entre 0 - 0.4 2/5 III. Indique el número de electrones que deben perder los átomos de cada uno de los siguientes elementos para obtener una configuración electrónica estable indicando a que gas noble pertenece la configuración lograda. ELEMENTO Ejemplo Be NUMERO DE ELECTRONES QUE PIERDE Simbología del ion formado SIMILAR a la CONFIGURACION ELECTRONICA DEL GAS NOBLE 2 Be+2 He a. Al b. Ca c. Rb d. Ba e. Li IV. Indique el número de electrones que deben ganar los átomos de cada uno de los siguientes elementos para obtener una configuración electrónica estable indicando a que gas noble pertenece la configuración lograda. ELEMENTO NUMERO DE ELECTRONES QUE GANA Ejemplo O 2 SIMBOLOGÍA DEL ION FORMADO SIMILAR A LA CONFIGURACION ELECTRONICA DEL GAS NOBLE O -2 Ne a. P b. Br c. S d. N e. I 3/5 V. 1. Llene la siguiente tabla que compara las propiedades de los compuestos iónicos y covalentes. Propiedad Compuesto iónico Compuesto covalente Estado físico Puntos de fusión Alto/bajo Puntos de ebullición Altos/bajos Solubilidad en agua Alta/baja Solubilidad en solventes no polares Alta/baja Conductividad eléctrica cuando están disueltos en agua Conducen / no conducen 2. Clasifique a las siguientes sustancias como compuestos iónicos o covalentes según las características que aparecen en la siguiente tabla: COMPUESTO IÓNICO /COVALENTE CARACTERISTICAS a. Compuesto líquido, insoluble en agua pero soluble en solventes apolares y no conduce la electricidad b. Sustancia sólida, soluble en agua, conduce la electricidad, c. punto de fusión alto. Sustancia liquida, inflamable, no conduce la electricidad 3. Complete la siguiente tabla indicando lo que solicita de las sustancias siguientes: SUSTANCIAS SUS SOLUCIONES CONDUCEN LA ELECTRICIDAD SI / NO SUS PUNTOS DE FUSION SON ALTO / BAJO a. CaCl2 b. CH4 c. KCl 4/5 VI. Escriba las estructuras de Lewis: ELEMENTO ESTRUCTURA DE LEWIS Ión - Br Br Mg Mg +2 S S-2 K K+ Al Al +3 COMPUESTO ESTRUCTURA DE LEWIS ESTRUCTURA DE LEWIS Número y TIPOS DE ENLACES COVALENTES (doble o triple) O2 N2 CO2 HCN VII. II. Lea en el libro de texto pag.163, La química en la salud: Algunos iones importantes en el cuerpo. Haga un resumen de su ubicación, función y resultado de su escasez o exceso. SOLUCION DEL CRUCIGRAMA I. 1. a) 0.56. polar ; b) 0, puro; c) 0.39, no polar; d) 0.3, no polar; e) 2.3, iónico; f) 2.1, iónico; g) 1.33, polar; h) 0.89, polar; i) 0, puro; j) 0.28, no polar 2. a) Covalente; b) Iónico, c) Covalente 3. a) si; alto b) no ; bajo c) si; alto 5/5
© Copyright 2026