Enlaces Químicos y Fuerzas Intermoleculares
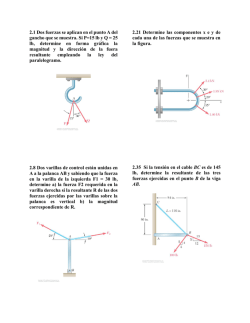
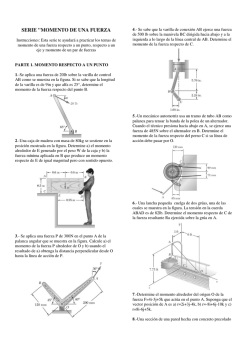
DEPARTAMENTO DE QUÍMICA SERIE DE EJERCICIOS (Basada en reactivos de exámenes colegiados) Tema 3: Enlaces Químicos y Fuerzas Intermoleculares Semestre 2017-1 2 5. Determine, con base en la diferencia de electronegatividad, qué tipos de enlace presenta la nicotina, cuya estructura se presenta a continuación: H H Tipos de enlace, Fuerzas Intermoleculares 1. Acomode los compuestos siguientes en orden creciente de facilidad para disolverse en agua, use para su determinación el carácter iónico de cada compuesto. NaBr, KI, NaF, NaCl KI < NaBr < NaCl < NaF H H H C C O S O H O Además, determine el carácter iónico porcentual de cada enlace. O–H: Covalente polar (39 %) O–S: Covalente polar (22 %) C K O Ca P O O Además, determine el carácter iónico porcentual de cada enlace. O–K: Iónico (84 %) O–P: Covalente polar (39 %) O–Ca: Iónico (79 %) 4. Determine qué tipos de enlace presenta la molécula de bicarbonato de sodio, cuya estructura esquelética es la siguiente: H O C O Na O Además, determine el carácter iónico porcentual de cada enlace. O–H: Covalente polar (39 %) O–C: Covalente polar (22 %) O–Na: Iónico (82 %) H Determine también el carácter iónico porcentual de cada enlace. C–H: Covalente simple (4 %) C–N: Covalente simple (6 %) C–C: Covalente puro (0 %) N–H: Covalente polar (19 %) 6. Determine, para la molécula hipotética siguiente: H H H C C Cl .. K .. .. O H H N H N 3. Determine qué tipos de enlace presenta la molécula de fosfato doble de calcio y potasio, cuya estructura esquelética es la siguiente: N C .. O H C C C 2. Determine qué tipos de enlace presenta la molécula de ácido sulfúrico cuya estructura esquelética es la siguiente: C C H H H H .. O .. H Los tipos de enlace que presenta la molécula, con base en su electronegatividad. C–H: Covalente simple C–N: Covalente simple C–Cl: Covalente simple C–C: Covalente puro C–O: Covalente polar C–K: Iónico N–H: Covalente polar O–H: Covalente polar. 7. Determine, con base en la diferencia de electronegatividad, qué tipo de fuerza intermolecular se ejerce entre las moléculas de KCl y HBr. Fuerza intermolecular ion–dipolo Serie de Ejercicios de Química Tema III: Enlaces Químicos y Fuerzas Intermoleculares Compiló: Alfredo Velásquez Márquez Semestre 2017-1 3 8. Determine, con base en la diferencia de electronegatividad, qué tipo de fuerza intermolecular se ejerce entre las moléculas de los pares siguientes: a) LiF y CsI b) NaBr y KCl c) ClF y HI d) NaI y H2 a) Fuerza intermolecular ion–dipolo b) Fuerza intermolecular ion–ion c) Fuerza intermolecular ion–dipolo d) Fuerzas de Van der Waals 9. Determine, con base en la diferencia de electronegatividad, qué tipo de fuerza intermolecular se ejerce entre las moléculas de los pares siguientes: a) NaF y IF b) F2 y HCl c) HI y HBr d) I– y LiF 4 Estructuras de Lewis y Geometría Molecular 11. Establezca las estructuras de Lewis para las moléculas siguientes: H2O NH3 NH4 + ClO3 – 12. Establezca las estructuras de Lewis para las moléculas siguientes: KMnO4 H2SO4 NaClO4 HTeO3 – H4PO4 + 13. Establezca la estructura de Lewis y la geometría molecular con respecto al átomo central para las moléculas siguientes: NaHCO3 KLiSO4 KrF2 H3SeO3 + PCl4 3– 14. Establezca la estructura de Lewis y la geometría molecular con respecto al átomo central para las moléculas siguientes: CaCl2 a) Fuerza intermolecular ion–dipolo b) Fuerzas de Van der Waals c) Fuerza intermolecular dipolo–dipolo d) Fuerzas intermolecular ion–ion CH4 NaKHSO4 + IF4 – PCl5 BBr3 + 15. Para las moléculas XeF2, XeF3 , establezca: a) Estructura de Lewis con cargas formales. b) Geometría molecular. + 10. Determine, con base en la diferencia de electronegatividad, qué tipo de fuerza intermolecular se ejerce entre las moléculas de los pares siguientes: a) CsCl y H2 b) KCl y NaCl c) Cl– y Br2 b) XeF2, geometría lineal; XeF3 , geometría en forma de T 16. Proponga la estructura de Lewis para las moléculas siguientes: SiO2 a) Fuerzas de Van der Waals b) Fuerza intermolecular ion–ion c) Fuerzas de Van der Waals SiO3 2– SiO4 4– Además, determine la geometría molecular con respecto al átomo central. SiO2: lineal 2– SiO3 : trigonal plana 4– SiO4 : tetraédrica 2– 17. Para el ion HBO3 , determine: a) la estructura de Lewis con cargas formales. b) La geometría molecular. b) Trigonal plana Serie de Ejercicios de Química Tema III: Enlaces Químicos y Fuerzas Intermoleculares Compiló: Alfredo Velásquez Márquez Semestre 2017-1 Serie de Ejercicios de Química Tema III: Enlaces Químicos y Fuerzas Intermoleculares Compiló: Alfredo Velásquez Márquez Semestre 2017-1 5 18. Para la molécula de trifluoruro de cloro, desarrolle: a) La estructura de Lewis. b) La geometría molecular. 6 22. Complete la tabla siguiente, donde se muestra según el caso, el átomo central (A), los pares electrónicos libres (:) y los enlaces químicos (—). b) Forma de T Distribución: Enlaces : Enlaces : Geometría molecular: A 19. Los elementos X y Y forman, con hidrógeno y oxígeno, los compuestos siguientes: HX, 6+ Y se sabe que el ion XO + H2XO4 , 6+ XO , A . + YO A + tiene 19 electrones y el ion YO tiene 20 electrones. .A. Determine: a) Qué elementos son X y Y. + b) La estructura de Lewis del ion H2XO4 . .. a) X = Cloro; Y = Aluminio .. .. O b) . + Cl .. O .. .. H A O .. .. H .. O .. A Distribución: Enlaces : Enlaces : Geometría molecular: 20. Con base en la molécula hipotética siguiente: H .. .. Si Te .. Cl O N H O .. O .. 0 Plana trigonal 2 1 Angular A 4 1 Tetraédrica .A. 3 0 Forma de T 5 1 Piramidal cuadrada 3 2 Piramidal trigonal A .. .. C .. .. .. H 3 A H Determine la geometría molecular con respecto a los átomos de C, Si, Te, Cl y N. C: Plana trigonal Si: Tetraédrica Te: Angular Cl: Pirámide trigonal N: Pirámide trigonal . .. A .. A – 21. Para el ion de OXeF3 , proponga: 2– a) La estructura de Lewis con cargas formales. b) La geometría molecular. – TeO32 Piramidal trigonal – TeO42 Tetraédrica b) Cuadrada plana Serie de Ejercicios de Química Tema III: Enlaces Químicos y Fuerzas Intermoleculares 2– 23. Determine la diferencia en geometría molecular entre los iones TeO3 y TeO4 . Compiló: Alfredo Velásquez Márquez Semestre 2017-1 Serie de Ejercicios de Química Tema III: Enlaces Químicos y Fuerzas Intermoleculares Compiló: Alfredo Velásquez Márquez Semestre 2017-1 7 + 24. Para las moléculas XeCl5 y XeCl2, determine: b) Las geometrías moleculares son: .. .. Cl .. .. Cl .. Piramidal cuadrada . . .. Xe .. .. Cl .. .. .. Cl .. .. + Xe .. .. .. Cl .. .. Cl .. .. .. a) Las estructuras de Lewis son: .. Cl .. .. a) Estructuras de Lewis con cargas formales. b) Geometría molecular. Lineal 25. Determine si la molécula de agua es polar o no polar. Es polar 26. Determine si la molécula de SbCl5 es polar o no polar. Es no polar 27. Determine el tipo de fuerza intermolecular se ejerce entre los pares de moléculas siguientes: a) H2S y NH4 + b) H2 y AlCl3 a) Ion-dipolo b) Fuerzas de Van der Waals 28. Determine el tipo de fuerza intermolecular se ejerce entre los pares de moléculas siguientes: a) O2 y H2O + b) H3SO4 y PCl3 a) Fuerzas de Van der Waals b) Ion-dipolo Serie de Ejercicios de Química Tema III: Enlaces Químicos y Fuerzas Intermoleculares Compiló: Alfredo Velásquez Márquez Semestre 2017-1
© Copyright 2026