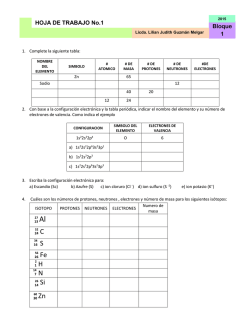
CLASES DE REACCIONES QUIMICAS. BALANCEO DE
COLEGIO DEL SAGRADO CORAZÓN – CALLE 74 “Formamos en valores, educamos para la paz” TALLER DE RECUPERACIÓN DE QUÍMICA – III PERIODO DOCENTE: ALEX REYES BEDOYA GRADO. 10° TALLER: QUÍMICA ORGÁNICA Logro: Realizar con habilidad y destreza cualquier clase de cálculo estequiométrico, cálculo porcentual, fórmula empírica y fórmula molecular. Escribir y balancear cualquier tipo de reacción química. Unidad Temática CLASES DE REACCIONES QUIMICAS. I. CLASIFICA LAS SIGUIENTES ECUACIONES Marca con una X de acuerdo a la clase de reacción a la que pertenezca, recuerda que una misma reacción puede tener 2 o tres clasificaciones: Síntesis = S; Descomposición = D; Sustitución Simple = SS; Sustitución Doble = SD; Exotérmica = Ex; Endotérmica= Ent.; Con Transferencia De Electrones= CTe- ; Sin Transferencia De Electrones= STe- REACCIÓN S D S.S S.D Ex. Ent. C.Te- S.Te- Fe H2SO4 FeSO4 H2 CaCO3 Calor CaO CO2 LiCl + AgNO3 LiNO3 + AgCl C O2 CO2 H 6.05 Kcal Zn H2SO4 ZnSO4 H2O H2O H2 O2 ; H 68.3 Kcal 2Mg O2 2MgO Calor Cl2 KBr KCl Br2 Para más información sobre esta temática, visite esta página de Internet: Física y Química: Tipos de reacciones químicas. Recuperado el 7 de Julio de 2011 http://www.youtube.com/watch?v=VZ8SWIRs2Bg BALANCEO DE ECUACIONESQUIMICAS. II. Balancear las siguientes reacciones por el método Redox. a. HNO3 + H2S NO + S + H2O b. MnO2 + HCl MnCl2 + Cl2 + H2O c. KMnO4 + HCl KCl + MnCl2 + H2O + Cl2 d. HNO3 + P + H2O H3PO4 + NO e. HNO3 + HBr NO + Br2 + H2O f. KCl + KMnO4 + H2SO4 KHSO4 + MnSO4 + H2O + Cl2 g. En la siguiente reacción de oxidación-reducción 2Ca + O2 2CaO el número de electrones transferidos y aceptados por cada átomo es: a) 1 b) 2 c) 3 d) 4 Para más información de esta temática, visite esta página de Internet: REDOX: ¿Qué se oxida y qué se reduce?. Recuperado 7 de Julio de 2011: http://www.youtube.com/watch?v=Z36LiGwO8kQ&feature=related CALCULO ESTEQUIOMETRICO. III. ENTRENESE CON EJERCICIOS MASA-MASA 1. Al reaccionar cloruro de bario (BaCl2) con solución de ácido sulfúrico se forma un precipitado de sulfato de bario (BaSO 4) y este al reaccionar con carbonato de sodio (Na2CO3) se obtienen 200g de carbonato de bario: I. BaCl2 + H2SO4 BaSO4 + 2HCl II. BaSO4 + Na2CO3 BaCO3 + Na2SO4 La masa, en gramos de cloruro de bario que reacciona es de: a) 105,5 b) 157,7 c) 211,1 d) 315,4 2. Un compuesto muy utilizado en diversos procesos industriales es el carbonato de sodio, que se obtiene por calentamiento del carbonato ácido de sodio, produciéndose además; bióxido de carbono y agua. Calcular la masa, en kilos de carbonato de sodio que se produce a partir de 80Kg de carbonato ácido. 3. La descomposición del Dicromato de Amonio se describe por la ecuación: (NH4)2Cr2O7 Cr2O3 + N2 + H2O Calcular la masa, en gramos de Oxido de Cromo (III) que se produce a partir de 480g de Dicromato de Amonio. 4. Calcular la masa, en gramos de Hidrógeno liberada por la interacción de 40g de zinc con exceso de ácido clorhídrico es según la ecuación: Zn + 2HCl ZnCl2 + H2 5. Una demostración muy vistoza es el, llamado volcán químico que se desarrolla al calentar dicromato de amonio, que en el proceso se descompone em trióxido de cromo (III), agua y nitrógeno. La masa en g de resíduo sólido que se obtiene por calentamiento de 14g de dicromato de amonio es: a) 8,44 b) 9,09 c) 14,0 d) 15,9 6. El clorato de potasio se obtiene por reacción del hidróxido de potasio con cloro gaseoso, de acuerdo a la reacción: KOH + Cl2 KClO3 + KCl + H2O Calcular la masa, en gramos, de clorato de potasio que se obtiene a partir de 120g de KOH. CALCULOS MASA-MOL 1. En la combustión de etanol (C2H5OH) se produce dióxido de carbono y agua. Calcular la masa, en gramos de oxigeno que se requiere para quemar 10 moles de etanol. 2. Dada la reacción: Ca(OH)2 + SO2 Ca(HSO3)2 a. Balancear la ecuación b. ¿Cuántas moles de dióxido de azufre se consumen cuando se producen 280g de la sal? 3. Una manera de eliminar el NO de las emisiones de humo es hacerlo reaccionar con amoniaco: NH3 + NO N2 + H2O a. Balancea correctamente la ecuación. b. ¿Cuántos moles de amoniaco se necesitan para obtener 11,6 moles de nitrógeno? c. ¿Cuántos moles de amoniaco se necesitan para obtener 45g de nitrógeno? CALCULOS MOL-MOL 1. Dada la reacción: Ca(OH)2 + SO2 Ca(HSO3)2 ¿Cuántos moles de Ca(HSO3)2 se producen con 38,02 moles de hidróxido? 2. La reacción entre el aluminio y el oxígeno se describe por la ecuación: Al + O 2 Al2O3 ¿Cuántos moles de óxido de aluminio se obtienen por reacción de 12,8 moles de aluminio con exceso de oxigeno? 3. La descomposición del Dicromato de Amonio se describe por la ecuación: (NH4)2Cr2O7 Cr2O3 + N2 + H2O ¿Cuántos moles de agua se produce a partir de 60,5 moles de Dicromato de Amonio? CALCULOS VOLUMEN-VOLUMEN 1. Calcular el volumen de O2 que reacciona con 100L de ácido sulfhídrico para producir dióxido de azufre y agua. 2. ¿Cuántos litros de hidrógeno son necesarios para convertir 30L de nitrógeno en amoniaco? CALCULOS MASA-VOLUMEN 1. ¿Qué volumen de ácido sulfhídrico puede obtenerse por la acción del ácido clorhídrico sobre 500g de sulfuro ferroso? 2HCl + FeS H2S + FeCl2 2. ¿Cuántos litros de oxígeno se obtienen al descomponer por calor 300g de óxido de mercurio? REACTIVO LIMITE 1. Calcular la masa, en gramos de Ca3(PO4)2 que se puede obtener a partir de 140g de Ca(OH)2 y 100g de ácido fosfórico de acuerdo con la reacción: Ca(OH)2 + H3PO4 Ca3 (PO4)2 + H2O 2. El yodato de sodio se obtiene por la reacción de I2 sobre disolución de hidróxido de sodio en caliente según la ecuación: NaOH + I2 NaIO3 + NaI + H2O Si se disponen de 10g de NaOH y 0,4 moles de yodo, calcula: a. Reactivo límite. b. Rendimiento teórico de NaIO3 que puede obtenerse. c. Moles de reactivo en exceso que sobran, una vez acabada la reacción. 3. el zinc y el azufre reaccionan para formar sulfuro de zinc, sustancia que se utiliza para recubrir internamente las pantallas de los televisores. ¿Cuántos g de sulfuro se obtienen cuando 24g de zinc se hacen reaccionar con 13g de azufre? 4. Se hacen reaccionar 4 moles de hidrógeno con 4 moles de oxígeno, el número de moles que sobran del reactivo en exceso y los moles de agua que se obtienen son a) 1 mol de O2 y 2 moles de H2O c) no sobran reactivos y 4 moles de H2O b) 1 mol de H2 y 4 moles de H2O d) 1 mol de O2 y 4 moles de H2O PORCENTAJE DE PUREZA 1. El clorato de potasio se obtiene por reacción del hidróxido de potasio con cloro gaseoso, de acuerdo a la reacción: KOH + Cl2 KClO3 + KCl + H2O Calcular la masa en g, de clorato de potasio que se obtiene a partir de 80g al 60% de pureza de hidróxido de potasio. 2. El compuesto C2H6O al reaccionar con oxígeno produce dióxido de carbono y agua. Calcular la masa en gramos de dióxido de carbono que se obtiene al reaccionar 47,5g al 40% de pureza de C2H6O con oxígeno. 3. En los procesos químicos es común que las materias primas no sean del 100% de pureza, factor a tener en cuenta cuando se realiza la reacción química. Una forma de obtener CO2 es adicionando solución de ácido sulfúrico sobre bicarbonato de sodio. La ecuación correspondiente es: NaHCO3 + H2SO4 CO2 + Na2SO4 + H2O A partir de 2kg de bicarbonato de sodio del 99% de pureza, la masa en kg de dióxido de carbono que se produce es: a) 0,471 b) 0,943 c) 1,047 d) 1,885 4. ¿Cuántos g de cloruro de plata (AgCl) se pueden preparar al hacer reaccionar24g de cloruro de calcio (CaCl2) al 75% de pureza con un exceso de nitrato de plata (AgNO3)?. Además se produce Ca(NO3)2. REACTIVO LIMITE CON PORCENTAJE DE PUREZA 1. Se hacen reaccionar 2,4g de MnO2 al 70% de pureza con 0,038 moles de HCl según la siguiente ecuación: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O ¿Cuántos g de cloro se producirán? 2. Se hacen reaccionar 2,4g de Metano (CH4) al 70% de pureza con 0,038 moles de oxígeno mediante una reacción de combustión total ¿Cuántos g de dióxido de carbono se producirán? Además se produce agua. PORCENTAJE DE EFICIENCIA O RENDIMIENTO 1. La propanona (C3H6O) puede obtenerse por reacción del metilacetileno (C3H4) con agua. Si la reacción tiene el 75% de eficiencia y se parte de 150g de metilacetileno, la masa en g de propanona obtenida es: a) 61,2 b) 81,6 c) 163,1 d) 217,5 2. Al someter a la combustión fuerte 2,4 moles de propano, C3H8 con O2 se forman 9,4 moles de CO2. Determina el porcentaje de rendimiento de la reacción, además se produce agua. 3. El trisulfuro de tetrafósforo se utiliza para la fabricación de cerillas de fósforo. Su obtención se realiza partiendo de los elementos, conforme a la ecuación: P 4 + 3S P4S3 En cierto ensayo se hicieron reaccionar 10g de fósforo con un exceso de azufre. ¿Cuánto P4S3 se obtiene si el porcentaje de eficiencia o rendimiento fue de un 80%? 4. Calcule cuantos gramos de hidrógeno, se obtienen a partir de 3 moles de HCl en una reacción con magnesio metálico, cuyo porcentaje de eficiencia o rendimiento de la reacción es del 70%. Mg + HCl MgCl2 + H2. 5. En la reacción de 16,8g de hierro con exceso de vapor de agua se obtuvieron 18,5g de magnetita (FeзO 4). El rendimiento de la reacción es: a) 20,6% b) 26,5% c) 53% d) 79,6% REACTIVO LIMITE CON PORCENTAJE DE EFICIENCIA 1. Cuando se hacen reaccionar 14g de ácido sulfúrico con 12g de Al(OH)3 se forman 85,5g de Al2(SO4)3. Calcular el % de eficiencia de la reacción. Además se produce agua. 2. Considere la reacción indicada por la ecuación: HNO2 + HI NO + I2 + H2O. Si se mezclan 5,875g de ácido nitroso del 80% de pureza con 12,5g de yoduro de hidrogeno de 64% de pureza y la reacción tiene el 90% de eficiencia la masa en gramos de yodo formado es: a) 3,57 b) 7,14 c) 8,14 d) 16,3 3. ¿Qué cantidad de AgCl de 70% de pureza se obtienen con 80g de AgNO 3 del 90% de pureza y 70g de NaCl de 80% de pureza? La reacción tiene un rendimiento del 95%. Rta/ 82,44g de AgCl. MASAS ATÓMICAS: C= 12; H= 1; O= 16; N= 14; Cr= 52; Mg= 24; Cl=35,5; K= 39; Ca=40; S= 32; Mn= 55; Ag= 108; Na= 23; Zn= 65,4; Ni= 58,7; P= 31; Cu= 63,5; Be= 11; Al= 27; Si= 28; Fe= 56; Ba= 137; W= 183,85; Ti= 47,9 IV. CALCULO PORCENTUAL, FORMULA EMPIRICA Y FORMULA MOLECULAR. 1. Hallar la composición porcentual para los siguientes compuestos: a) Carbonato de potasio b) Ácido fosfórico c) Agua 2. Calcule el contenido de nitrógeno en cada uno de los siguientes fertilizantes: a) NH4NO3 b) (NH4)2SO4 c) HNO3 d) Fe4[Fe(CN)6]3 3. Hallar el porcentaje de agua presente en la sal de Epson cuya fórmula es: MgSO 3 * 7H2O. d) e) NH3 Óxido carbonoso f) C6H5NH2 Nota: la sumatoria de los porcentajes de los elementos de cualquier compuesto debe dar 100%. 4. Calcule el porcentaje de CaO presente en CaCO3 5. En los fertilizantes se emplean compuesto químicos que aportan Nitrógeno a las plantas. De los siguientes compuestos el que aporta mayor masa de Nitrógeno por cada 100g de compuesto es: A. Nitrato de Calcio B. Nitrato de Amonio C. Úrea D. Sulfato de Amonio 6. Indique la fórmula empírica del compuesto siguiente si una muestra contiene 37.5% de C, 6.25% de H y 50% de Oxígeno en masa. A.C4HO5 B.CH2O C.C2H4O2 D.C3H6O3 7. Con base en la fórmula estructural siguiente, (CH2CO)2C6H3(COOH), calcule el porcentaje de carbono presente. A. 64.70% B. 66.67% C. 69.25% D. 76.73% 8. Determine la fórmula empírica de un compuesto que contiene 52.9% de aluminio y 47.1% de oxígeno. A. AlO B. Al2O3 C. Al3O2 D. Al4O6 9. Se queman en aire 1,515g de vapor de zinc y se obtienen 1,886g de óxido de zinc. Deduce la fórmula empírica del óxido formado. 10. El análisis de un compuesto orgánico indica que posee el 84% de carbono y el 16% de hidrógeno. La F.E es: A. CH4 B. C4H9 C. C7H16 D. C14H22 11. El análisis de una muestra de un compuesto puro presenta el siguiente resultado: 52,17% de C, 13,04% de Hidrógeno y el resto oxígeno. Si su masa molecular es de 138, calcule F.E y F.M. 12. El análisis de 4,50g de un compuesto ácido orgánico, permitió obtener 8,8g de CO2 y 4,5g de agua. Se sabe que la MM es 90 g/mol. Determine su FM. R/ C4H10O2 13. A partir de 3,750g de un compuesto formado por Plata, Carbono y Oxígeno se obtienen 3,540g de Cloruro de Plata y 1,087g de Dióxido de Carbono. Si el compuesto tiene una masa molar de 303,7g/mol, calcular su F M. R/ Ag2C2O4 14. Al analizar 0,26 g de un óxido de nitrógeno, se obtiene 0,079 g de Nitrógeno y 0,181 g de Oxígeno. Se sabe que la masa molar del compuesto es 92 g/mol. Calcular: a) La composición porcentual. b) La Fórmula Empírica y la Fórmula Molecular. R/ 30,43 % N y 69,57 % O b) NO 2 y N2O4 MASAS ATÓMICAS: C= 12; H= 1; O= 16; N= 14; Cr= 52; Mg= 24; Cl=35,5; K= 39; Ca=40; S= 32; Mn= 55; Ag= 108; Na= 23; Zn= 65,4; Ni= 58,7; P= 31; Cu= 63,5; Be= 11; Al= 27; Si= 28; Fe= 56; Ba= 137; Ti= 47,9; As= 74,9 INSTRUCCIÓN O PROCEDIMIENTOS: Inicialmente debe estudiar la base teórica la cual le va a servir para resolver los ejercicios, además debe repasar el despeje de fórmulas. Revise y repase todas las evaluaciones y superaciones realizadas durante el período CRITERIOS EVALUATIVOS: Se tendrá en cuenta la presentación, el orden, la redacción, el procedimiento. Que los ejercicios estén bien desarrollados que haya coherencia y cohesión en sus respuestas FECHA Y CONDICIONES DE ENTREGA: Entregar Septiembre 21 del 2015 En hojas tamaño carta (Sin rayas), hoja de presentación, a mano, tinta color negro. Deben aparecer las preguntas con sus respectivas respuestas en orden y con buena presentación. La evaluación de Nivelación: Martes 13 de Octubre de 2015. Proverbios 16:9 El corazón del hombre traza su rumbo, pero sus pasos los dirige el Señor.
© Copyright 2026