Presentación Unidad 2 CINÉTICA
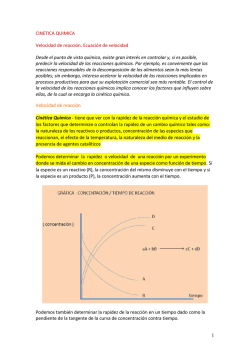
UNIVERSIDAD DEL ZULIA FACULTAD DE INGENIERÍA CICLO BÁSICO DEPARTAMENTO DE QUÍMICA CÁTEDRA QUIMICA II CINETICA MARACAIBO, FEBRERO DE 2015 Profesora: Ing. Neida Núñez CINÉTICA Es una parte de la química que se encarga de estudiar la velocidad o rapidez con la que ocurren las reacciones químicas, el mecanismo de cómo se consumen los reactantes y los factores que alteran la velocidad de una reacción química. CINÉTICA Reacciones Lentas Algunas reacciones termodinámicamente espontáneas no parecen ocurrir en absoluto, mientras que otras reacciones alcanzan el equilibrio con mucha rapidez. Las reacciones ocurren a diferentes velocidades Reacciones Rápidas VELOCIDAD DE REACCIÓN Puede alterarse modificando ciertos factores. El conocimiento de los factores que alteran la velocidad de reacción es de extraordinaria importancia práctica, pues puede enseñarnos como acelerar las reacciones deseables y cómo retardar las indeseables. Varía muchísimo de una reacción a otra. La velocidad de reacción es la velocidad a la que se forman los productos o se consumen los reactantes. Se define como el cambio en la concentración de uno de los reactivos o productos dividido por el intervalo de tiempo en el cual tiene lugar el cambio, se expresa en mol/L..s Velocidad promedio de desaparición de R = Velocidad promedio de formación P = P t R t El signo menos en la ecuación asegura que la velocidad sea positiva. ∆[R] = [R]t=2 - [R]t=1 ∆t = t2 - t1 VELOCIDAD DE REACCIÓN Velocidad inicial. Velocidad instantánea. Es la velocidad de reacción instantánea al comenzar la reacción, es decir, en el tiempo igual cero (t = 0). Es la pendiente de una tangente dibujada en el gráfico de concentración en función del tiempo. La velocidad de reacción no es constante. Al principio de una reacción, cuando la concentración de reactivos es mayor, la velocidad es mayor, a medida que la reacción avanza, al ir disminuyendo la concentración de los reactivos también disminuye la velocidad de la reacción. VELOCIDAD DE REACCIÓN Las diferentes maneras de informar la velocidad de una reacción, está relacionada con la estequiometria. Al dar la velocidad de una reacción hay que tener el cuidado de especificar la especie a la que se refiere la velocidad Es la velocidad promedio dividida por el coeficiente estequiométrico de la especie monitorizada aA + bB → cC + dD Velocidad única promedio Velocidad única promedio 1 A 1 B a t b t 1 Velocidad de A a 1 C 1 D c t d t 1 1 Velocidad deB Velocidad deC b c 1 Velocidad deD d LEY DE VELOCIDAD Orden de reacción Es la potencia a la cual la concentración de los reactivos se eleva en la ley de velocidad; el orden global de la reacción, es la suma de los ordenes individuales Los órdenes de reacción no tienen relación con los coeficientes estequiométricos. La ley de velocidad resume la dependencia entre la velocidad y la concentración. Es una característica de la reacción que se determina experimentalmente. aA + bB → cC + dD Velocidad de reacción = k[A]m [B]n m y n = orden de reacción k = constante de velocidad k = Ae- Ea/RT Ea ln k = - RT + lnA A = factor de frecuencia Ea = Energía de activación R = Constante de los gases T = Temperatura absoluta Las unidades de k dependen del orden global de la reacción. MÉTODO DE LAS VELOCIDADES INICIALES Al tener los órdenes de reacción, se puede determinar la constante de velocidad k, con los datos experimentales de concentración y velocidad inicial para cualquiera de los experimentos. Se hacen una serie de experimentos donde la concentración inicial del reactivo se varía y se observa como varía la velocidad inicial de la reacción. Al duplicarse la concentración inicial de ese reactivo, Teniendo los datos experimentales de concentración y velocidad, se relacionan de tal manera que permitan determinar el orden de reacción para uno de los reactivos. Si la reacción es de orden cero respecto a ese reactivo la velocidad inicial de reacción no cambia. Si la reacción es de primer orden respecto a ese reactivo la velocidad inicial de reacción se duplica. Si la reacción es de segundo orden respecto a ese reactivo la velocidad inicial de reacción se multiplica por cuatro. Si el orden de reacción respecto a ese reactivo es tres la velocidad de inicial de reacción se multiplica por ocho. TEORÍAS QUE EXPLICAN LA VELOCIDAD DE REACCIÓN Teoría de las colisiones. Para que se produzca una reacción química, los átomos, iones o moléculas involucrados deben experimentar choques o colisiones. Para que el choque de dos partículas garantice la reacción entre ellas, las partículas deben cumplir las dos condiciones siguientes: Colisionar con la debida orientación. Disponer de la energía cinética suficiente para que tengan lugar el reordenamiento de los enlaces y la formación de una nueva sustancia. Energía insuficiente TEORÍAS QUE EXPLICAN LA VELOCIDAD DE REACCIÓN Teoría del estado de transición El complejo activado tiene una estructura que se halla entre la de los reactivos y la de los productos. Los enlaces antiguos están debilitados y se están formando los nuevos. La energía de activación, Ea, es la energía necesaria para llegar al complejo activado desde los reactivos. Los reactivos pasan por un estado intermedio transitorio de alta energía y corta duración: estado de transición, en donde existe el complejo activado. FACTORES QUE AFECTAN LA VELOCIDAD DE REACCIÓN Naturaleza de los Reactivos Dependiendo del tipo de reactivo que intervenga, una determinada reacción tendrá una Energía de Activación. Grado de división de los Reactivos Mientras mas pequeñas sean las partículas de los reactivos, mas se facilita el contacto entre ellas y por tanto, las colisiones efectivas. Concentración de los Reactivos Al haber más partículas en el mismo espacio, aumentará el número de colisiones. Temperatura Reacción Al aumentar la temperatura, también lo hace la velocidad a la que se mueven las partículas y, por tanto, aumentará el número de colisiones de Catalizador si lo hubiera Los catalizadores modifican el mecanismo de reacción, empleando pasos elementales con mayor o menor energía de activación. CONCENTRACIÓN Y TIEMPO Velocidad Ecuación Diferencial d A ; Velocidad dt d A dt Ecuación Integrada [A] [A]0 d [A] m [A] k A k A m m t kdt 0 CONCENTRACIÓN Y TIEMPO Reacciones de orden cero A P Ecuación Diferencial Ecuación Integrada d A dt k t d [A] [A] [A] 0 0 -k t [A] = [A]0 - kt kdt CONCENTRACIÓN Y TIEMPO Reacciones de primer orden A P Ecuación Diferencial Ecuación Integrada d A dt k A [A] d [A] t [A] 0 [A]0 ln[A] -k t ln[A] = - kt + ln[A]0 kdt CONCENTRACIÓN Y TIEMPO Reacciones de segundo orden A P Ecuación Diferencial Ecuación Integrada d A dt 1 A k [A]2 d [A] 2 [A] [A] [A] t 0 0 k t 1 A kt 1 A 0 kdt CONCENTRACIÓN Y TIEMPO Tiempo de vida media (t1/2) Tiempo necesario para que [A]o se reduzca a la mitad Reacción de orden cero Reacción de segundo orden Reacción de primer orden t1/ 2 A0 2k t1/ 2 t1/ 2 0.693 k 1 k A 0 VARIACIÓN DE LA CONSTANTE DE VELOCIDAD CON LA TEMPERATURA Ecuación de Arrhenius Se utiliza para predecir como cambia la velocidad de reacción a distintas temperaturas k = Ae- Ea/RT Ea ln k = - RT + lnA ln k m = -Ea/R ln 1/T k1 k2 Ea 1 R T2 1 T1 Mecanismo de reacción Secuencia particular de etapas elementales que describen los cambios que se considera que tienen lugar a medida que los reactivos se transforman en productos Permite determinar la ley de velocidad Los mecanismos en varias etapas presentan intermediarios Una de la etapas es la mas lenta de todas las que conforman el mecanismo. Etapa determinante de la velocidad de la reacción global En un proceso elemental, el orden respecto a cada reactivo es igual a su coeficiente estequiometrico en dicha reacción
© Copyright 2026