CS Fe HN Si Zn - QUIMICA Medicina, USAC
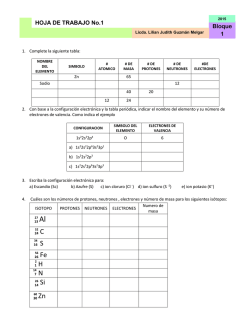
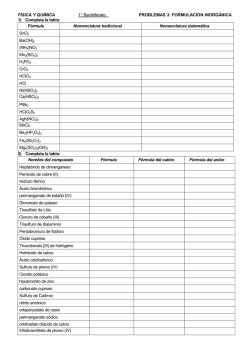
HOJA DE TRABAJO PRIMER PARCIAL 2016 Licda. Lilian Judith Guzmán Melgar 01 - 07 1. Complete la siguiente tabla: NOMBRE DEL ELEMENTO SIMBOLO # ATOMICO Zn # DE MASA # DE PROTONES # DE NEUTRONES #DE ELECTRONES 65 Sodio 12 40 12 20 24 2. Con base a la configuración electrónica y la tabla periódica, indicar el nombre del elemento y su número de electrones de valencia. Como indica el ejemplo CONFIGURACION 1s22s22p4 SIMBOLO DEL ELEMENTO ELECTRONES DE VALENCIA O 6 a) 1s22s22p63s23p1 b) 1s22s22p3 c) 1s22s22p63s23p3 3. Escriba la configuración electrónica para: a) Escandio (Sc) b) Azufre (S) c) ion cloruro (Cl -) d) ion sulfuro (S -2) 4. e) ion potasio (K+) Cuáles son los números de protones, neutrones , electrones y número de masa para los siguientes isótopos: Numero de ISOTOPO PROTONES NEUTRONES ELECTRONES masa 27 Al 52 C 13 24 34 S 16 56 Fe 2 1 H 14 7 N 26 14 Si 26 60 30 Zn 5. Los isotopos más abundantes del Boro tienen números de masa de 10 y 11. ¿Cuántos Protones y neutrones tiene cada isotopo? 6. El cobre tiene 2 isotopos con números de masa 63 y 65. ¿Cuántos protones, neutrones tiene cada uno de los isotopos? 7. Dibuje el diagrama de Bohr de los siguientes elementos y iones a) Mn b) Ca+ c) Br 8. Complete la siguiente tabla según el ejemplo: DIFERENCIA DE ELEMENTOS ELECTRONEGATIVIDAD 0) K y Cl 2.34 a) P y Cl b) C y Cl c) NaBr d) Br2 e) S y O TIPO DE ENLACE IONICO 9. Complete la siguiente tabla con lo que se le solicita: # TOTAL DE COMPUESTO ESTRUCTURA DE LEWIS ELECTRONES a) CBr4 b) H2O c) H2SO4 d) NaHCO3 e) PO4-3 f) H2CO3 TIPOS DE ENLACES PRESENTES 10. Indique que tipo de fuerza intermolecular presentan los siguientes compuestos: COMPUESTOS TIPO DE FUERZA INTERMOLECULAR a) H2O b) HCl c) Br2 11. Balancee al tanteo las siguientes ecuaciones, indique los coeficientes que balancean las ecuaciones y de qué tipo de reacción se trata como el ejemplo: ECUACIÓN a) b) c) d) e) f) K + H2O → KOH + H2 Zn + Pb(NO3)2 → Zn(NO3)2 + Pb K2SO4 + BaCl2 → KCl + BaSO4 KOH + FeCl3 → KCl + Fe(OH)3 C3H8 + O2 → CO2 + H2O NaClO3 → NaCl + O2 COEFICIENTES 1,1 ,1,1 TIPO DE REACCION Simple sustitución 12. Calcule el número de oxidación de cada elemento en los siguientes compuestos: COMPUESTO NUMEROS DE OXIDACIÓN a) KMnO4 K= Mn= O= b) H2O2 H= O= c) KClO3 K= Cl= O= d) CuO Cu= O= e) Na3PO4 Na= P= O= f) Cu(NO3)2 Cu= N= O= ECUACION 13. Balancee las siguientes ecuaciones por el método de redox, indique en la tabla lo que se solicite: a) Cu + HNO3 → Cu(NO3)2 + NO + H2O b) Zn + NaNO3 + NaOH → NaZnO2 + NH3 +H2O c) SnCl2 + HgCl2 →SnCl4 + Hg2Cl2 d) I2O5 + CO →I2 + CO2 e) As2S5 + HNO3 → H3ASO4 + H2SO4 + H2O + NO2 a) b) c) d) e) ELEMENTO QUE SE OXIDA ELEMENT O QUE SE REDUCE # ELECTRONES GANADOS # ELECTRONE S PERDIDOS AGENTE OXIDANTE AGENTE REDUCTOR ELECTRONES TRASNFERIDOS COEFICIENTES QUE BALANCEAN LA ECUACIÓN 14. Calcule el peso molecular de cada uno de los siguientes compuestos: a) KMnO4 b) Na3PO4 c) CaCO3 d) PbCl2 e) CaCl2 15. ¿Cuántas moles hay en? a) 75 g de NaCl b) 36 g de H2S04 c) 26 g de KCl 16. ¿Cuántos gramos hay en? : a) 4 moles HNO3 b) 8 moles CH3CH2OH d) 64 g C12H22O12 C) 5 moles NaHCO3 17. Calcular el % de composición de oxigeno (O) en cada uno de los siguientes compuestos: a) CaCO3 b) Cu(NO3)2 c) CaSO4 18. ¿Cuántos gramos de O2 se necesitan para quemar 10 g de C2H5OH? C2H5OH + 3 O2 → 2CO2 + 3H2O 19. Con respecto a la ecuación siguiente: 3NO2 + H2O → 2HNO3 + NO Calcule: a) Moles de HNO3 que se pueden producir a partir de 63 moles de NO2 b) Moles de NO que se pueden producir a partir de 12.3 moles de NO2 20. Con respecto a la ecuación siguiente: Al2(SO4)3 + 3 Ba(NO3)2 → 3 BaSO4 + 2 Al(NO3)2 Calcular: a) Gramos de BaSO4 que se puede preparar a partir de 0.225 moles de Al(SO4)3 b) Moles de Al2(NO3)3 que se pueden preparar a partir de 0.750 moles de Ba(NO3)2 21. Calcular la densidad de cada una de las siguientes sustancias a) Una masa de 30.5 g y un volumen de 73 ml b) Una masa de 83 g y un volumen de 15 ml 22. Calcule la masa de cada uno de los siguientes compuestos: a) Un volumen de 20 ml y una densidad de 0.78g/ml b) Un volumen de 470 ml y una densidad de 0.88 g/ml 23. Calcule el volumen de cada una de las siguientes sustancias: a) 350 g de cloroformo que tiene una densidad de 1.49 g/ml b) 3.5 g de ácido acético que tiene una densidad de 1.05 g/ml
© Copyright 2026