COLECCIÓN DE EJERCICIOS UNIDAD 4 - DePa
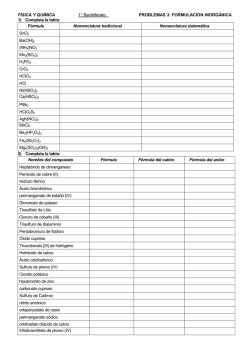
COLECCIÓN DE EJERCICIOS UNIDAD 4 NOMENCLATURA Elaborada por las maestras: Norma López, Gisela Hernández y Norma Ortega 1. Escribe la fórmula de las siguientes especies químicas: 1 Ácido fosfórico 2 Ácido nítrico 3 Ácido sulfúrico 4 Ácido clorhídrico 5 Ácido perclórico 6 Ácido fosforoso 7 Ácido sulfuroso 8 Ácido carbónico 9 Bromuro de aluminio 10 Carbonato ácido de sodio 11 Carbonato de aluminio 12 Carbonato de cadmio 13 Carbonato de plata 14 Carburo de amonio 15 Cianuro de aluminio 16 Cianuro de sodio 17 Cloruro de aluminio hexahidratado 18 Cloruro de cobalto (II) heptahidratado 19 Cloruro de cobre (I) 20 Cloruro de estaño (II) dihidratado 21 Cloruro de estaño (IV) 22 Cloruro de hierro (III) 23 Cloruro de litio 24 Cloruro de magnesio 25 Cromato de bario 26 Cromato de potasio 27 Dicromato de potasio 28 Dihidrogenfosfato de talio 29 Dióxido de manganeso 1 30 Disulfuro de cobre (II) y hierro (II) 31 Fluoruro de amonio 32 Fosfato de calcio 33 Fosfato de cinc 34 Fosfato de cromo (III) 35 Hidrogencarbonato de sodio 36 Hidrogenfosfato de calcio 37 Hidrogensulfuro de sodio 38 Hidróxido de bario 39 Hidróxido de cadmio 40 Hidróxido de calcio 41 Hidróxido de cinc 42 Hidróxido de cobalto (II) 43 Hidróxido de litio 44 Hidróxido de magnesio 45 Hidróxido de níquel (III) 46 Hidróxido de plomo (II) 47 Hidróxido de potasio 48 Ion calcio 49 Ion hierro (III) 50 Ion hipoclorito 51 Ion oxalato 52 Ion tiocianato 53 Manganato de calcio 54 Manganato de potasio 55 Nitrato de aluminio 56 Nitrato de amonio 57 Nitrato de cobre (I) 58 Nitrito de mercurio (II) 59 Óxido de aluminio 60 Óxido de azufre (IV) 61 Óxido de cobalto (III) 62 Óxido de fósforo (III) 63 Óxido de potasio 2 64 Óxido de vanadio (V) 65 Permanganato de potasio 66 Peróxido de sodio 67 Sulfito de cesio 68 Sulfato de amonio 69 Sulfato de cobre (II) pentahidratado 70 Sulfato de hierro (II) 71 Sulfato de magnesio 72 Sulfato de manganeso (II) dihidratado 73 Sulfato de níquel (II) hexahidratado 74 Sulfato doble de aluminio y potasio 75 Sulfuro de amonio 76 Sulfuro de bario 77 Sulfuro de cinc 78 Sulfuro de estroncio 79 Sulfuro de níquel (II) 80 Tricloruro de magnesio y sodio 81 Trióxido de azufre 82 Yodato de potasio 83 Yoduro de hierro (II) 84 Peryodato de antimonio (V) 85 Tetrafluoruro de xenón 2. Escribe los nombres de las siguientes especies químicas: 1 (NH4)2Cr2O7 2 (NH4)2Fe(SO4)26H2O 3 Ag + 4 AgNO3 5 Al4C3 6 AlCl3 6 H2O 7 Ba(OH)2 8 BaCrO4 9 BeO 10 BF3 11 Ca3(PO4)2 3 12 CaCl2 2 H2O 13 CaH2 14 CaSO4 15 CCl4 16 Cd(H2PO4)2 17 Co(NO3)2 18 CO2 19 CoCl2 3 H2O 20 CoSO4 21 Cr 3+ 22 CS2 23 Cu 2+ 24 Cu(C2H3O2)2 25 Cu(NO3)2 26 Cu(OH)2 27 CuO 28 Fe(HCO3)2 29 Fe(NO3)3 6 H2O 30 Fe(SCN)3 31 Fe3+ 32 H2 33 H2O2 34 H2S 35 H3PO4 36 HClO2 37 Hg2Cl2 38 HSe- 39 I2 40 In2(CrO4)3 41 K3PO4 42 K4Fe(CN)63 H2O 43 KClO2 44 KIO3 45 KMnO4 4 46 LiNO2 47 Mn 7+ 48 MnO2 49 MnSO4 2 H2O 50 N2O4 51 Na2CO3 52 Na2SO3 53 Na3PO4 54 NaBiO3 55 NaH 56 NaHCO3 57 NaIO2 58 NH3 59 NH4+ 60 NH4Cl 61 NH4OH 62 Ni 2+ 63 Ni(HS)3 64 NiCO3 65 NiSO4 6 H2O 66 NO 67 NO2 68 Pb(NO3)2 69 PbCrO4 70 Pd(ClO)2 71 RbOH 72 S8 73 ScCl3 74 Sn 4+ 75 SnCl2 2 H2O 76 SO2 77 SrCO3 78 SrS 79 XeF6 80 ZnCl2 5 3. Completa la siguiente tabla escribiendo la fórmula del compuesto que se forma en cada celda (catión + anión). Consultar las reglas de la solubilidad en agua para marcar con (ac) a los compuestos solubles y con (s) a los insolubles. SCN- CN- ClO2- BrO3- MnO4- O22- Se2- N3- P3- AsO43- C4- H+ Li+ Na+ Ag+ NH4+ Be2+ Mg2+ Ca2+ Sn2+ Pb2+ Mn2+ Fe2+ Zn2+ Cu2+ B3+ Cr3+ Ga3+ Al3+ Fe3+ Co3+ Sn4+ V5+ 6 4. Para cada compuesto, indica el número de oxidación del elemento que aparece subrayado. N° de N° de Compuesto N° de oxidación Compuesto Compuesto oxidación oxidación CsF Ni(HSO4)2 Pb(OH)4 BeO H3PO4 K3PO4 MnO2 Li2Cr2O7 NH4OH Au2O3 N2O5 CO2 PtO H2MnO4 Cr(NO3)2 B2(SO4)3 Cl2O3 Al(ClO2)3 C3N4 I2 O HCl H2O2 CrO3 Ag2S Na2O CuO B(CN)3 KMnO4 Au2O HgNO3 MnCl2 Pt2O As(HSO3)3 SrS BF3 CaMnO4 AuCl3 Co(NO3)2 N2O3 Na2Se NiSO4 Hg2Cl2 5. El oxígeno se combina con otros no metales para formar a los llamados oxoaniones. Algunos no metales como el Cl, N, P y S, forman una serie de oxoaniones que contienen un número diferente de átomos de oxígeno. Para nombrarlos, hay que tomar en cuenta el número de oxidación del no metal enlazado al oxígeno, de acuerdo con los siguientes prefijos y sufijos: Número de oxidación creciente del no metal Hipo ____ ito ; ____ ito ; ____ato ; per ____ato Número creciente de átomos de oxígeno De acuerdo con lo anterior, escribe las fórmulas y los nombres para los oxoaniones del bromo. N° de oxidación del bromo Fórmula del oxoanión Nombre del oxoanión 7
© Copyright 2026