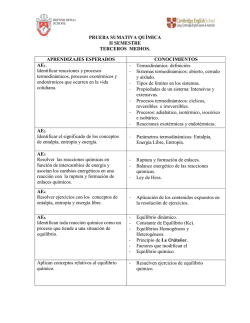
Termodinámica I: conceptos básicos y tipos de reacción
SGUICEL005QM11-A16V1 Termodinámica I: conceptos básicos y tipos de reacción Ítem 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Alternativa A B A C C E A C C E E D E D E Habilidad Comprensión Comprensión Comprensión Comprensión Reconocimiento ASE Reconocimiento Reconocimiento Reconocimiento ASE Comprensión Comprensión Comprensión Reconocimiento Comprensión EJERCITACIÓN PSU Ítem Alternativa Defensa 1 A Habilidad de Pensamiento Científico: Distinción entre ley, teoría e hipótesis y caracterización de su importancia en el desarrollo del conocimiento científico. El enunciado corresponde a la ley de conservación de la energía, que surge de la Primera ley de la termodinámica. Esta establece que la energía total del universo siempre se conserva, de modo que si en un sistema capaz de intercambiar energía con su entorno, la energía aumenta, necesariamente debe disminuir la energía del entorno y si disminuye la del sistema, la energía del entorno debe mostrar un aumento equivalente. Corresponde a una ley, porque surge de la identificación de una relación constante entre variables. Por lo tanto, se cumple siempre y es aceptada universalmente. 2 B El valor de ΔH indica la diferencia de entalpía de la reacción, que puede entenderse como el calor absorbido o liberado por la reacción, a presión constante. Si el valor de ΔH es negativo, significa que el contenido de calor de los productos es menor que el de los reactantes, y por lo tanto, se ha liberado calor. Por lo tanto, la reacción se puede catalogar como exotérmica. 3 A Un cambio físico implica solo una alteración en las fuerzas intermoleculares, permitiendo un cambio de estado, sin modificar la estructura de la molécula en cuestión. Los procesos de las otras alternativas implican combustión u oxidación, por lo que corresponden a cambios químicos. 4 C Para que la reacción se considere como endotérmica, su ΔH debe ser positivo, ya que en este caso el contenido de calor de los reactantes es menor que el de los productos, lo que implica que se ha absorbido energía calórica. 5 C La energía de activación corresponde al mínimo de energía necesario para iniciar la reacción, por lo que de no existir, será imposible lograr la obtención de productos, estableciéndose como la limitante del proceso. 6 E En una reacción exotérmica, el calor contenido en los reactantes es mayor que el de los productos. Por lo tanto, la reacción libera energía en forma de calor y presenta una diferencia de entalpía negativa. 7 A El calorímetro corresponde a un instrumento capaz de medir la variación entre la cantidad de energía calórica al estado inicial y al estado final. A presión constante, esta variación corresponde a la entalpía de reacción. 8 C La entalpía se define como la suma de la energía interna de un sistema y el producto de su presión por su volumen. Por lo tanto, el cambio de entalpía está dado por, ΔH=ΔU+ΔPV A presión y volumen constantes, el cambio de entalpía corresponde al cambio de energía interna del sistema. 9 C Por definición un sistema cerrado intercambia energía, pero no materia con su entorno. 10 E Una función de estado es aquella que solo depende del estado del sistema y no de cómo llegó a él. Por lo tanto, nos permite conocer lo que ocurre al momento que la reacción alcanza su equilibrio y comparar el estado inicial con el final. Sin embargo, no nos entrega información sobre los cambios registrados durante la transformación. 11 E El trabajo, al igual que el calor, no son funciones de estado. Esto quiere decir que dependen del camino recorrido, es decir, de la forma en que se realizará la transformación termodinámica y no solo del estado inicial y final. 12 D En función de su variación de energía libre (ΔG), las reacciones se pueden clasificar como exergónicas o endergónicas. Una reacción exergónica es aquella en que la variación de energía libre es negativa, por lo que libera energía. Al escribirlo en una ecuación química, la energía debe aparecer en los productos. 13 E La primera ley de la termodinámica se basa en el principio de la conservación de la energía, el cual establece que la energía del universo permanece constante. Así, la energía solo se transfiere entre un sistema y su entorno, pero no se acaba. 14 D Un sistema adiabático se caracteriza por un aislamiento térmico absoluto entre el sistema y el medio, impidiendo el flujo desde y hacia el sistema de energía calórica. Debido a esto el sistema tampoco puede intercambiar materia con el entorno (es cerrado), pero sí puede intercambiar energía en forma de trabajo. 15 E En un cambio de estado solo se alteran las propiedades físicas de la materia, manteniéndose las características químicas inalteradas. Para el caso de las diferencias macroscópicas, estas se expresan particularmente asociadas a los estados clásicos de la materia, así como también con respecto al plasma.
© Copyright 2026