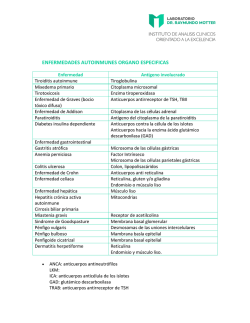
detección de adulteración de leche con suero de quesería por
CENTRO DE CIENCIAS BÁSICAS DEPARTAMENTO DE MICROBIOLOGÍA DEPARTAMENTO DE ING. BIOQUÍMICA DETECCIÓN DE ADULTERACIÓN DE LECHE CON SUERO DE QUESERÍA POR MEDIO DE UN SISTEMA TIPO ELISA TESIS QUE PRESENTA NORMA ANGÉLICA CHAVEZ VELA PARA OBTENER EL GRADO DE DOCTOR EN CIENCIAS BIOLÓGICAS TUTORES: DRA. EVA MARÍA SALINAS MIRALLES DR. JUAN JAUREGUI RINCÓN AGUASCALIENTES, AGS., DICIEMBRE DE 2008 DEDICATORIAS Dedico este trabajo a todas aquellas personas que con su amor y apoyo hicieron posible su realización, especialmente a: Mi esposo Luis y a mis hijos Jorge Luis y Alex por estar siempre a mi lado, agradeciéndoles las horas robadas para poder realizar este trabajo y el apoyo y entusiasmo dado. Mis padres Irma y Raúl con cariño y respeto Mis hermanos Beatríz, Sergio y Raúl ii AGRADECIMIENTOS Quiero expresar mi gran reconocimiento y gratitud al a la Dra. Eva María Salinas Miralles, quien a lo largo de la realización de esta tesis ha seguido de cerca, mi tarea investigadora demostrando su constante dedicación e interés por mi formación. Asimismo, agradezco al Dr. Juan Jáuregui Rincón, el haberme dado la oportunidad de iniciarme en el campo de la investigación, así como sus valiosas orientaciones y ayuda durante todos estos años. A la Dra. Laura Alicia palomares por su paciente y amable asistencia y asesoramiento continuo que ayudaron a la realización de este trabajo. Mis más sinceras gracias a la Biol. Karla Elizabeth Macías Herrera, compañera y amiga, cuyo apoyo y colaboración fue muy importante en el desarrollo de la tesis. También quiero dar las gracias a los Drs. José Luis y Andrés Quintanar Stephano por las facilidades y ayuda invaluable proporcionadas para poder llevar a cabo la realización del trabajo. A Luis, Jorge Luis y Alex por su apoyo, entusiasmo y comprensión para la conclusión de esta meta. A mis compañeros y amigos. Al Consejo Nacional de Ciencia y Tecnología (CONACYT), por la beca que me otorgó para realizar los estudios de doctorado y por haber aportado parte de los recursos que permitieron realizar esta investigación. iii CUERPO TUTORIAL • Dra. Eva Salinas Miralles (UAA) • Dr. Juan Jauregui Rincón (UAA) • Dra. Laura Alicia Palomares Aguilera (IBT) iv v vi vii viii ix x xi xii xiii xiv RESUMEN La leche es un producto de gran valor nutricional y se considera producto básico en la alimentación humana, principalmente de los niños, razón por la cual el sector lechero tiene gran importancia socioeconómica a nivel mundial. La leche se produce y procesa para venderse como tal directamente a los consumidores o a los industriales como materia prima para elaborar una gran variedad de productos. Industrias procesadoras y comercializadoras de leche tienen problemas de adulteración de leche con suero de quesería, dado que este no se percibe sensorialmente y que además tiene un menor precio que la leche. Para la detección de lactosuero se encuentra la detección de un glucomacropéptido (GMP) que está presente sólo en suero de quesería y no en leche. Los métodos existentes para detectar GMP requieren mucho trabajo, tiempo y presentan problemas de sensibilidad y precisión a bajas concentraciones. Así pues se requiere una metodología más rápida, sensible y precisa para poder detectar este GMP como indicativo de la presencia de suero de quesería. Las técnicas inmunológicas presentan estas características, razón por la cual en este trabajo se desarrollaron dos inmunoensayos con el fin de detectar GMP como indicador de la adulteración de leche líquida con lactosuero. Los inmunoensayos desarrollados en este trabajo fueron el inmuno blot y un sistema inmunoadsorbente ligado a enzima (ELISA). En ambos métodos se utilizaron anticuerpos policlonales anti-GMP de obtención propia. Las dos técnicas inmunológicas desarrolladas para detectar GMP, presentaron alta sensibilidad. En el caso del inmuno blot el límite de detección fue de hasta 0.001% (w/v) de este péptido puro adicionado a la leche y el límite más bajo de suero líquido detectado en leche fue de hasta 0.5% (v/v) y de hasta 0.001% (p/v) de suero de quesería en polvo. xv Resumen En el caso del sistema ELISA, se desarrolló y validó un sistema de tipo sándwich en el que se usaron anticuerpos policlonales de conejo anti-GMP como anticuerpos de captura y un conjugado biotinilado del mismo anticuerpo para la detección. Los anticuerpos fueron altamente específicos. El ensayo tuvo un límite de detección de 0.1%(v/v) de suero de quesería líquido en leche. El método desarrollado es preciso, exacto, específico y reproducible. Además, esta técnica es más sencilla y menos costosa de realizar que otras que se han reportado, ya que no requiere de equipo y materiales complejos y caros. Los anticuerpos fueron altamente específicos para el GMP. Además, se logró detectar exitosamente GMP en alimentos comerciales que contiene suero de leche, tales como suplemento dietético, yogur saciedad y margarina. Debido a que en la actualidad, han salido al mercado alimentos novedosos que dicen contener GMP por sus propiedades nutraceúticas, el análisis desarrollado en este trabajo podría usarse para identificar la presencia de este péptido como un control de calidad. xvi INDICE GENERAL PÁG RESUMEN 1 1. ANTECEDENTES 1.1 La leche 1 1.1.1 Definición 1 1.1.2 Composición de la leche 1 1.1.2.1 Lípidos 2 1.1.2.2 Lactosa 3 1.1.2.3 Proteínas 3 1.1.2.4 Vitaminas 6 1.1.3 1.1.2.5 Sales y minerales 6 Importancia de la leche 7 1.1.3.1 Importancia nutricional 7 1.1.3.2 Importancia económica 8 1.1.4 Aspectos socioeconómicos del sector lácteo 1.2 9 1.1.4.1 Producción mundial de leche 9 1.1.4.2 Producción de leche en México 9 1.1.5 Calidad de la leche 10 1.1.6 Adulteración de la leche 11 1.1.6.1 Suero de quesería como adulterante en leche 12 1.1.6.2 Detección de suero de quesería 13 1.1.6.3 Glucomacropeptico (GMP) 13 Técnicas inmunológicas 18 1.2.1 Técnicas inmunoenzimáticas o ensayos inmunoadsorbentes ligado a enzimas (ELISA) 19 1.2.2 Tipos de ensayos ELISA 21 xvii 1.3 1.2.3 Fases de un ensayo ELISA 22 1.2.4 Sistema biotina-avidina o biotina-estreptavidina en ELISA 23 1.2.5 Los anticuerpos policlonales en el sistema ELISA 24 Antecedentes del uso del sistema ELISA en alimentos 25 1.3.1 Antecedentes de la aplicación del sistema ELISA en leche 26 2. HIPÓTESIS 27 3. OBJETIVOS 28 3.1 Objetivo general 28 3.2 Objetivos específicos 28 4. MATERIALES Y METODOS 29 Materiales 29 Métodos 29 4.1 Aislamiento y purificación del glucomacropeptido (GMP) de suero de leche 30 4.1.1 Precipitación con etanol y ultrafiltración 30 4.1.2 Fraccionamiento con acido tricloroacético (TCA) 31 Evaluación de un método para detectar GMP por electroforesis y tinción con plata 31 4.2.1 Electroforesis 31 4.2.2 Tinción con plata 34 Obtención de anticuerpos policlonales específicos contra el GMP 35 4.3.1 Inducción de la producción de anticuerpos policlonales contra el GMP 36 4.3.2 Extracción del suero de los animales inmunizados 37 4.3.3 Purificación de los anticuerpos policlonales 38 4.2 4.3 xviii 4.4 4.5 4.6 Determinación de la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP 44 4.4.1 Pureza 44 4.4.2 Reactividad y especificidad de los anticuerpos policlonales frente al GMP 44 Desarrollo de un método mediante inmuno blot para detectar GMP 46 4.5.1 Análisis de muestras de leche y de alimentos procesados 46 Elaboración y validación de un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia 47 4.6.1 Estandarización de un sistema ELISA tipo sándwich 48 4.6.2 Validación del ensayo 54 5. RESULTADOS 57 5.1 Aislamiento y purificación del GMP de suero de leche. 57 5.2 Obtención de anticuerpos policlonales específicos contra el GMP 59 5.3 Determinación de la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP 60 5.3.1 Pureza 5.3.2 Reactividad y especificidad 60 Desarrollo de un método mediante inmuno blot para detectar GMP 63 5.4.1 Análisis de muestras de leche y de alimentos procesados 63 Elaboración y validación un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia 68 5.5.1 Estandarización de un sistema ELISA tipo sándwich 68 5.5.2 Validación del ensayo 68 5.4 5.5 62 6. DISCUSIONES 6.1 Aislamiento y purificación del GMP de suero de leche. xix 72 6.2 Obtención de anticuerpos policlonales específicos contra el GMP 73 6.3 Determinación de la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP 77 6.4 Desarrollo de un método mediante inmuno blot para detectar GMP 79 6.5 Elaboración y validación un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia. 81 7. CONCLUSIONES 86 8. BIBLIOGRAFÍA 87 xx ÍNDICE DE FIGURAS Figura 1. Porcentaje por país de la producción mundial de leche en el año 2005. 9 Figura 2. Importaciones Mexicanas de leche de vaca entera y descremada en polvo. 10 Figura 3. Estructura primaria del GMP bovino. 14 Figura 4. Fases de un ensayo ELISA. 23 Figura 5. Esquema general de la metodología para la obtención de anticuerpos policlonales específicos contra el GMP. 35 Figura 6. Biotinilación de anticuerpos con un éster de la biotina, el sulfo-N-hidroxi-succinimida biotinamidocaproato. 48 Figura 7. Análisis electroforético de GMP obtenido por dos diferentes métodos. 57 Figura 8. Análisis electroforético de GMP obtenido y comercial. 58 Figura 9. Inmuno blots para verificar producción de anticuerpos antiGMP con los antisueros obtenidos de los conejos. 59 Figura 10. Inmno blots para verificar producción de anticuerpos antiGMP por los diferentes conejos. 60 Figura 11. Análisis electroforético para ver pureza de anticuerpos policlonales anti-GMP en diferentes etapas de purificación. 61 xxi Figura 12. Inmuno blot para probar reactividad de los anticuerpos policlonales anti-GMP de conejo, con diferentes etapas de purificación. 62 Figura 13. Imuno blot para probar especificidad de los anticuerpos policlonales anti-GMP de conejo. 63 Figura 14. Límite de detección de GMP mediante análisis inmuno blot usando anticuerpos policlonales anti-GMP. 65 Figura 15. Análisis inmuno blot de muestras de leche adulterada con concentraciones crecientes de suero líquido y de suero en polvo. 66 Figura 16. Análisis inmuno blot de diferentes alimentos comerciales con suero de quesería usando anticuerpos policlonales anti-GMP. Figura 17. Representación lineal de la curva estándar en el ELISA sándwich de suero de quesería. xxii 67 69 ÍNDICE DE TABLAS Tabla 1 Composición de la leche de vaca. 2 Tabla 2 Preparación de gel de separación para electroforesis con diferentes concentraciones de acrilamida. 32 Tabla 3 Porcentaje de proteína recuperada en muestras de anticuerpos anti-GMP en diferentes etapas de purificación. 61 Tabla 4 Límites de detección de GMP puro y de suero de quesería, mediante inmuno blots utilizando anticuerpos policlonales antiGMP. 64 Tabla 5 Condiciones óptimas para desarrollar sistema ELISA tipo sándwich en la detección de GMP utilizando anticuerpos policlonales anti-GMP. 68 Tabla 6 Porcentaje de suero de quesería detectado en productos alimenticios a los que se les adicionó 10% de suero de quesería. 69 Tabla 7 Porcentaje de suero de quesería detectado por dos analistas diferentes en productos alimenticios a los que se les adicionó 10% de suero de quesería 70 xxiii 1. ANTECEDENTES 1.1 LA LECHE 1.1.1 Definición La leche es el líquido segregado por las hembras de los mamíferos a través de las glándulas mamarias, que tiene como finalidad básica alimentar a la cría durante su crecimiento. Para consumo humano se utilizan fundamentalmente la leche de vaca, de oveja y de cabra. La más consumida a nivel mundial es la leche de vaca. La leche de vaca se ha definido como la secreción, excluyendo el calostro, que se obtiene mediante los métodos de ordeña normales de las glándulas mamarias de vacas saludables y normalmente alimentadas, en la etapa de lactancia (Kirk y col., 1996). En general la leche está compuesta por agua, grasa, proteínas, azúcares y minerales, además de otras sustancias que están presentes en menor concentración. La Norma Oficial Mexicana NOM-091-SSA1-1999. define a la leche de vaca como "el producto proveniente de la secreción natural de las glándulas mamarias de las vacas sanas" y excluye al producto obtenido 15 días antes del parto y 5 días después de éste o cuando tenga calostro. 1.1.2 Composición de la leche Los principales componentes de la leche son el agua, los lípidos, los carbohidratos, las proteínas y las sales. Estos componentes se encuentran distribuidos en forma de emulsión, suspensión y solución en un estado físico 1 Antecedentes complejo. Aunque cualitativamente la composición y propiedades de la leche son constantes, estudios desarrollados por algunos autores para determinar la composición de la leche a lo largo del tiempo, han demostrado que existen variaciones considerables en los contenidos de grasa y de proteína de la leche. Estas variaciones se atribuyen a diversos factores como son la herencia genética, el ciclo de lactación, la edad, la alimentación, la temperatura ambiental, la época del año y el estado de salud (Anguita, 1996). Tabla 1: Composición de la leche de vaca Componente Agua Sólidos Mínimo (%p/v) 84 Máximo (%p/v) 10.6 17.9 89.0 • Lípidos 2.6 8.4 • Proteínas 2.4 6.5 • Lactosa 2.4 6.1 • Cenizas 0.6 0.9 La composición de la leche presentada en la tabla anterior corresponde a los rangos máximos y mínimos de sus características nutricionales. El total del valor monetario de la leche se debe a los sólidos de la leche ya que el agua, tiene un valor monetario esencialmente despreciable. De hecho, ésta es la base para los sistemas de pago de leche en muchos países avanzados en lechería (SAGARPA, 2004). Lípidos Los triacilglicéridos son los componentes más importantes de los lípidos de la leche ya que constituyen aproximadamente el 98%. Estos son una importante fuente de energía, aunque contiene solo el 12% del total de ácidos grasos en forma de ácidos grasos de cadena corta y media. Dentro de la categoría de lípidos 2 Antecedentes también están incluidos los fosfolípidos, los esteroides, los pigmentos, las vitaminas liposolubles A, D, E y K. Los ácidos grasos de los triacilglicéridos lácteos son muy variados y complejos: saturados, insaturados, con número impar de carbono, hidroxilados y ramificados. En la leche predominan los ácidos grasos saturados, mientras que es pobre en ácidos grasos poliinsaturados esenciales como el linoleico y linolénico. En promedio, la leche contiene alrededor de un 3.85% (p/v) de grasa, contenido variable en función de la especie y de la raza. Lactosa Es el principal carbohidrato de la leche (45 – 50 g/l en la leche de vaca). Tiene aproximadamente el 15 % de la dulzura de la sacarosa y contribuye, junto con las sales, al sabor global de la leche (Badui, 1994). Proteínas Las proteínas que contiene la leche son básicamente de dos tipos: micelares (de 75 a 85%) que son caseínas asociadas con el calcio, el fosfato y el citrato, que tienen una estructura aleatoria abierta y precipitan a un pH de 4.6; y las proteínas del suero (de 15 a 22%) que tienen una estructura globular y son solubles a un pH de 4.6. También hay de un 2 a 4% de una fracción de proteosas peptona que son una fracción pequeña de la leche compuestas por un grupo muy heterogéneo de fosfoglucoproteínas de pesos moleculares que varían de 4 a 200 kDa (Badui, 1994; Kirk y col. 1996). Caseínas Las caseínas constituyen la fase micelar inestable de la leche, compuesta de partículas sólidas en suspensión, que difunden la luz y dan a la leche su aspecto blanco opaco. La leche de vaca contiene cuatro tipos de caseínas y su concentración es de cerca de 25 g/l de leche. La proporción entre ellas es 3 Antecedentes aproximadamente la siguiente: αs1: αs2: β:κ (4:1:4:1). En su estado natural, existen en forma de micelas, que son partículas con diámetro dentro del rango entre 50 nm y 250 nm. Algunas propiedades de estas son: a) Son fosfoproteínas, en las que algunas unidades del aminoácido serina están substituidas con un grupo fosfato para formar fosfato de serina. b) Las caseínas más importantes en cuanto a cantidad son las αs1 y β:, no contienen los aminoácidos cistina ni cisteína, por lo que no tienen la capacidad de formar enlaces de azufre (-S-S-) intermoleculares o intramoleculares. c) Las cuatro caseínas son proteínas hidrofóbicas; es decir, contienen muchos aminoácidos con cadenas laterales no polares. En el caso de la caseína κ, la región amino terminal (residuos 1 a 105) es altamente hidrofóbica y el resto, la región carboxilo terminal (residuos 106 a 169), es hidrofílica. d) Las caseínas contienen cantidades relativamente altas de prolina, un aminoácido que dificulta la formación de estructuras secundarias (tales como hélices u hojas plegadas). Son proteínas esencialmente desordenadas, sin estructura específica, por lo que pueden adoptar muchos estados conformacionales en solución para adaptarse a la presencia de fuerzas cambiantes. e) No tienen actividad biológica, no se pueden cristalizar y no son susceptibles de ser desnaturalizadas térmicamente en la región de temperaturas usuales en la industria de quesería. En la industria láctea, la caseína-κ, es útil principalmente para la elaboración de quesos debido a que al ser hidrolizada por la renina (quimosina) es posible que se precipite en para-κ-caseína la cual al reaccionar con el calcio genera paracaseinato de calcio. 4 Antecedentes Proteínas séricas de la leche Las proteínas séricas de la leche son aquellas que permanecen en el lactosuero después de la precipitación de las caseínas por la acidificación de la leche a pH 4.6 y a 20°C (Whitney, 1988) o bien por vía enzimática. El calentamiento de la leche las desnaturaliza, provocando su floculación y el desenrollamiento de su estructura globular. Las proteínas séricas a diferencia de las caseínas no están fosforiladas y raramente están glicosiladas, son compactas, globulares, solubles en un intervalo de pH muy amplio y en estado nativo no se asocian con las caseínas. Son muy sensibles al calor y menos al ácido. Las proteínas mayoritarias del suero son: β-lactoglobulina, α-lactoalbúmina, seroalbúmina e inmunoglobulinas. a) β-lactoglobulina: es la proteína mayoritaria del suero de la leche (50%) cuyo peso molecular es de 18.36 kDa, es susceptible de ser desnaturalizada por efecto del calor, del pH (valores superiores a 8.6) y a altas concentraciones de calcio. Existe un grupo sulfhidrilo libre por cada molécula, que le permite a esta proteína interactuar con la κ-caseína durante el calentamiento de la leche. b) α-lactoalbúmina: es la segunda proteína más abundante del suero y tiene actividad biológica ya que es parte constitutiva del sistema enzimático requerido para la síntesis de la lactosa, por lo que también se le conoce como proteína B de dicho sistema. No contiene grupos sulfhidrilo libres, pero sí cuatro puentes disulfuro de cistinas, lo que la hace tener 2.5 veces más azufre que las caseínas. Una característica importante de esta es su alto contenido de triptofano. c) Seroalbúmina: esta proteína es idéntica a la albúmina del suero sanguíneo en todas sus propiedades inmunológicas, excepto en el comportamiento electroforético a pH 4.0. Se encuentra en la leche en bajas cantidades (1.2%). Su principal característica química es que contiene un alto número de cistinas. 5 Antecedentes Inmunoglobulinas: son glicoproteínas con alto contenido de grupos azufrados. Son importantes componentes del glóbulo de grasa y contribuyen a las propiedades antibacterianas naturales de la leche recién obtenida. Enzimas Existen una gran cantidad de enzimas en la leche de vaca (más de 60), asociadas a las micelas de caseína, a la membrana de los glóbulos grasos o bien dispersas en el suero. Las enzimas más importantes de la leche pertenecen a los grupos de óxido-reductasa y de las hidrolasas. Algunas enzimas son factores de degradación de los constituyentes de la leche como las lipasas y las proteasas. Otras enzimas presentan actividad antibacteriana y aportan una protección limitada a la leche, ejemplo de estas son la lactoperoxidasa y la lisozima. Algunas enzimas como es el caso de la catalasa se utilizan como indicadores de calidad higiénica (Charley, 1987; Badui, 1994; Anguita, 1996). Vitaminas La leche contiene la mayoría de las vitaminas; las liposolubles se encuentran interaccionando con la fase lipídica, mientras que las hidrosolubles se localizan en el suero. La vaca tiene la capacidad de sintetizar las vitaminas hidrosolubles y la vitamina K a través de su microflora intestinal. Sales y minerales En la leche se encuentran cloruros, fosfatos y citratos de calcio, magnesio, sodio y potasio, y que se encuentran tanto en estado coloidal como en solución. La relación de concentración de sales desempeña un papel muy importante en la estabilidad de los productos lácteos, de tal forma que los iones de calcio y 6 Antecedentes magnesio tienden a desestabilizar el sistema proteico, mientras que los citratos y el fósforo lo estabilizan (Badui, 1994). 1.1.3 Importancia de la leche 1.1.3.1 Importancia Nutricional La importancia de la leche se basa en su alto valor nutritivo, ya que sus componentes se encuentran en forma y proporción adecuadas para las necesidades nutricionales del ser humano, de tal manera que cada una de las leches de los mamíferos representa el alimento más balanceado y propio para sus correspondientes crías (Badui, 1994). Las proteínas de la leche presentan un alto valor biológico y tanto las caseínas como las proteínas del lactosuero, lactoalbúmina y lactoglobulina, tienen una elevada proporción de aminoácidos esenciales. Ambos tipos de proteínas, caseínas y seroproteínas se complementan respecto al contenido de aminoácidos esenciales, si bien la caseína es algo deficitaria en aminoácidos sulfurados (metionina y cisteínas), se halla compensada por el resto de proteínas. La ingestión de leche provee al organismo de aminoácidos como: fenilalanina, tirosina, leucina, lisina, valina, isoleucina, treonina, metionina, cisteína, histidina, triptófano. Su alto contenido en lisina, indispensable para el crecimiento, lo hace de gran valor biológico (Jiménez, 2001; Anguita, 1996). La leche es una importante fuente de calcio, que junto con la vitamina D y la lactosa, hacen que su absorción sea más completa. La leche de vaca contiene 125 mg de calcio por 100 gr de alimento. Este mineral es imprescindible en ciertas etapas de la vida, épocas de crecimiento, adolescencia, mujeres embarazadas, 7 Antecedentes lactantes. Actualmente se está tendiendo a recomendar un aumento en la cantidad de requerimiento diarios de calcio como prevención de osteoporosis. Con base en todo lo anterior, se afirma que la leche es uno de los alimentos más completos para el ser humano dadas las características de sus nutrimentos, considerándose a nivel mundial como un alimento ideal y necesario para la alimentación humana, ya sea consumido en forma fluida o a través de derivados como el queso, entre otros. En la infancia, el consumo de leche se hace imprescindible. Se recomienda medio litro de leche al día en la primera infancia y esta cantidad se incrementa hasta un litro en la adolescencia (Jiménez, 2001; Martín del Campo, 2006). 1.1.3.2 Importancia Económica El creciente consumo de leche de vaca en México y en el mundo se debe a que este producto es una de las fuentes de proteína económicamente más accesibles y por lo tanto de mayor demanda en las población de bajos recursos, ya que es difícil el acceso a proteínas de origen animal como las que derivan de carne de bovino, cerdo, aves o pescados. La leche se produce y procesa para ser vendida como tal directamente a los consumidores o a los industriales para ser utilizada como materia prima en la elaboración de una gran variedad de productos como yogur, queso, leche fermentada, mantequilla entre otros, además, se utiliza también en la alimentación animal, originando así fuentes de ingreso y de empleo. Debido a esto, el sector lechero tiene una gran importancia socioeconómica a nivel mundial (García y col., 2005; Martín del Campo 2006). 8 Antecedentes 1.1.4 Aspectos socioeconómicos del sector lácteo 1.1.4.1 Producción mundial de leche La producción mundial de la leche crece en forma exponencial. México ocupó en 2006 el lugar 15. Según datos de la FAO (2006a), la producción mundial de leche de vaca en el año 2005 fue de 239 millones de toneladas. Como país individual, la India es el principal productor con el 15 % de la producción total, mientras que la producción de México representó el 3% (figura 1). Francia 2% Otros 46% India 15% Brasil 9% USA 4% Fed Rusia 4% Pakistán 3% Mexico 3% Alemania 2% Etiopia 3% Colombia China 3% 4% Nva. Zelanda 2% Figura 1. Porcentaje por país de la producción mundial de leche en el año 2005 (ton/año) ( FAO, 2006a). 1.1.4.2 Producción de leche en México La producción de leche en el país ha presentado tendencias al crecimiento, sin embargo México no ha sido un país autosuficiente respecto a la producción de esta, por lo que ha tenido que recurrir a la importación de diversos productos lácteos para cubrir la demanda nacional. Si bien la producción de leche se desarrolla en todo el país, el desarrollo principal se da en el altiplano y en las 9 Antecedentes zonas áridas y semiáridas del norte del país, siendo los principales productores los estados de Durango, Coahuila, Guanajuato, Jalisco, Aguascalientes, Chihuahua, México, San Luis Potosí, Hidalgo, Querétaro y Baja California (SAGARPA, 2006). En los países desarrollados se producen grandes volúmenes de leche, provocando excedentes de producción que terminan vendiéndose en el mercado internacional con grandes subsidios (SAGARPA, 2006). En México, la importación de leche en polvo se ha incrementado en los últimos años (figura 2), en 2004 se importaron 175,985 ton de leche en polvo, de las cuales el 80.5 % correspondió a leche descremada (FAO, 2006b). Adicionalmente, México importa una gran cantidad de subproductos lácteos como el suero deshidratado cuya importación ascendió en 2004 a 57,514 ton, y la lactosa que fue de 22,833 ton (FAO, 2006b). Entera Descremada toneladas 160,000 140,000 120,000 100,000 80,000 60,000 40,000 20,000 0 2001 2002 2003 2004 Año Figura 2. Importaciones mexicanas de leche de vaca entera y descremada en polvo (FAO , 2006b). 1.1.5 Calidad de la leche La calidad se puede definir como el cumplimiento de un conjunto de requisitos que permiten la idoneidad para el uso de un producto o servicio determinado. Estos requisitos corresponden a un grupo de especificaciones ya establecidas y que se relacionan directamente con las diferentes propiedades de cada producto en particular. 10 Antecedentes En un afán por conservar y/o mantener las propiedades óptimas de un producto, en ocasiones es sometido a adulteraciones. Por adulteración se puede entender al conjunto de actividades que tienen la finalidad de encubrir o disimular la naturaleza de un producto, su composición o características comerciales o sanitarias, o fenómenos alterativos y defectos de proceso del mismo. De igual forma, la adulteración pretende obtener mayores rendimientos en el producto final, con la lógica ganancia económica. Con base en lo anterior, los productos alimenticios son susceptibles de sufrir adulteraciones y la leche no es una excepción (Martín del Campo, 2006). 1.1.6 Adulteración de la leche La leche puede ser adulterada en forma voluntaria o involuntaria. En esencia, la adulteración de leche se puede definir como algo que se agrega a esta y que produce cambios en el volumen y/o en su composición química (Hazard, 1997). La leche como producto procesado puede llegar al consumidor en diferentes presentaciones y en cualesquiera de ellas puede existir adulteración con diversos propósitos, uno de ellos es el de obtener mayor rendimiento en el producto final, tal es el caso de la adición de suero de quesería; este es la fase acuosa separada de la cuajada que resulta de la coagulación enzimática de la leche en el proceso de elaboración del queso, conocido también como lactosuero o suero lácteo. El lactosuero representa del 80% al 90% del volumen total de la leche que entra a dicho proceso. El suero de quesería puede ser adicionado líquido o en polvo a la leche fluida o deshidratada, según se trate (Alcázar y col., 2000). 11 Antecedentes 1.1.6.1 Suero de quesería como adulterante en leche El suero de quesería se define como "el líquido resultante de la coagulación de la leche en la fabricación de queso tras la separación de la mayor parte de las caseínas y de la grasa”. La utilización del lactosuero en la industria alimentaria en México es relativamente reciente debido a la falta de tecnología para su procesamiento. Las características sensoriales y nutritivas lo hacen apropiado para emplearse en sustitución de la leche, además de su precio, que puede ser hasta 4 ó 5 veces menor. Se ha propiciado la adición de lactosuero a la leche por parte de las plantas industrializadoras con el propósito de obtener un mayor rendimiento económico, lo cual constituye una adulteración según los términos que la legislación vigente señala (Secretaría de Salud y Asistencia, 1999). Esta práctica no solo genera problemas a los consumidores, que creyendo adquirir leche pudieran estar obteniendo productos con propiedades nutrimentales inferiores, sino que también pueden representar fraudes económicos para los industriales, y en consecuencia éstos productos pueden tener un gran impacto desfavorable en sus procesos, así como en la calidad y denominación de sus productos (Bertoni y col., 2001; Martín del Campo, 2006). La presencia de agregados de suero de quesería en leche fluida y deshidratada ha representado un grave problema constante que ha sido manifestado en diversos foros por los productores nacionales de lácteos, quienes han exigido a las autoridades de la Secretaría de Agricultura, Ganadería y Desarrollo Rural que regulen estas anomalías que causan, por un lado, pérdidas económicas a los mismos ganaderos al competir su producto contra importaciones de menor precio que contienen suero lácteo en su composición y, por otro lado, un engaño a los consumidores al ofrecerles leche adulterada con suero a un precio tal como si se tratara de un producto conteniendo exclusivamente sólidos no grasos provenientes de la leche empleada, tal y como lo exige el Reglamento de la 12 Antecedentes Ley General de Salud en Materia de Control Sanitario de Actividades, Establecimientos Productos y Servicios, de la Secretaría de Salud. De manera similar existen regulaciones sanitarias internacionales relacionadas con la presencia de suero de quesería como agente adulterante que tienen la finalidad de lograr una sana competencia en el mercado internacional, principalmente en el de leche deshidratada (Martín del Campo, 2006). 1.1.6.2 Detección de suero de quesería en leche Existen varios métodos para detectar la presencia y en algunos casos conocer la cantidad de suero como agente adulterante en la leche en sus diferentes presentaciones. Entre estos se encuentra la determinación de la proporción de caseína del suero presente en la leche, que se hace a través de la cuantificación de nitrógeno no caseico (Karman y van Boekel,1986), la cuantificación de grupos sulfhidrilo por gramo de proteína (Hill y col.,1988), la determinación del aumento en los niveles de amonio en leche mediante el uso de un potenciómetro (Montana y col., 1982), así como la determinación del contenido de cistina mediante un método polarográfico desarrollado por Mrowetz y Klostermeyer (1976) en el que mediante una reacción se reduce la cistina a cisteina, la cual se hace reaccionar posteriormente con cloruro de metil mercurio. La polarografía se usa para determinar la cantidad residual de cloruro metil mercurio no consumida por los grupos SH libres y los procedentes de la cistina (Miralles, 2001). 1.1.6.3 Glucomacropéptido (GMP) Cuando la κ-caseína es tratada con la quimosina durante la obtención de quesos, la proteína es hidrolizada entre los aminoácidos 105 y 106 de la κcaseína, que son fenilalanina y metionina respectivamente, dando como resultado dos fracciones que son: para-κ-caseina (residuo 1 – 105) y GMP (residuo 106 – 169) el cual es removido con el suero. 13 Antecedentes κ-caseina Quimosina para-κ-caseina + glucomacropéptido hidrofóbico soluble (Charley, 1987). El GMP queda soluble en el suero después de separar la cuajada, pero no está presente en la leche, por lo tanto la detección de GMP puede utilizarse como indicador de adulteración de leche con suero de quesería. Estructura del GMP El GMP es un glicopéptido que contiene residuos ácidos, grupo fosfato y unidades de oligosacáridos, incluyendo N-acetilneuramínico (ácido siálico), galactosa, y N-acetilgalactosamina. La secuencia de aminoácidos se muestra en la figura 3 (Li y Mine, 2004). 106 110 120 H.Met - Ala - lIe - Pro - Pro - Lys - Lys - Asn - Gln - Asp - Lys - Thr - Glu - lIe - Pro - Thr lIe 130 - Asn - Thr - lIe Ala - Ser - Gly - Glu - Pro - Thr - Ser - Thr - Pro - Thr -lThr l- Glu - Ala Val Variante B I lIe l 140 150 Glu - Ser - Thr - Val - Ala – Thr - Leu - Glu -IAspl- Ser - Pro - Glu - Val - lIe - Glu - Ser Pro Variante B IAla I P 160 169 Pro - Glu - lIe - Asn - Thr - Val - Gln - Val - Thr -Ser - Thr - Ala - Val.OH Figura 3. Estructura primaria del GMP bovino (Whitney, 1988). Los números pequeños y cursivos indican su posición en la secuencia de κ-caseína. 14 Antecedentes El GMP no contiene aminoácidos aromáticos ni azufrados y es invisible a la longitud de onda de 280 nm (longitud de onda de detección común para proteínas). Además, el GMP posee una carga neta negativa, incluso a pH de 3.0, así que no puede recuperarse por intercambio catiónico. No se mueve con el resto de las proteínas nativas en geles de poliacrilamida en electroforesis (PAGE). Su bajo peso molecular de 8,000 Da lo hace difícil de visualizar con colorante azul de Coomasie en electroforesis desnaturalizante o en duodecil sulfato de sodio (SDS)PAGE. El procedimiento de cuantificación requiere de un tratamiento previo de la leche que es la precipitación con ácido tricloroacético de las otras proteínas del suero, dejando solamente al GMP en solución (Greenber, 1986; Brody, 2000). El punto de unión de los oligosacáridos no es uniforme, aunque se está de acuerdo en que el enlace glucosídico es a través de un oxígeno y de treonina. Fiat y Jolles (1989) demostraron que la treonina 26 ó 28 de la cadena del péptido lleva un sacárido. Hay evidencia (Kanamori y col. 1980) de que la treonina 30 ó 31 también participa. Varios reportes indican que múltiples residuos de azúcares pueden enlazarse a una sola cadena del péptido. En contraste a estas variaciones, una parte del fosfato está siempre en la serina 44 (serina 149 de la cadena de (-caseina). Detección del GMP El empleo de técnicas cromatográficas para la determinación de GMP ha dado muy buenos resultados;Olieman y van de Bedem (1983) desarrollaron un método cromatográfico capaz de detectar la presencia del GMP, los resultados de esta investigación sugirieron un límite inferior en la detección del GMP del 0.8%, sin embargo, el método tiene el inconveniente de dar resultados falsos positivos en el caso de leches en las que se haya desarrollado una población relativamente alta de bacterias psicrotrofas como Pseudomonas sp. ya que durante el almacenamiento refrigerado antes de su procesado, se generan péptidos de peso molecular similar al del GMP. Otra técnica que también se ha utilizado mucho es la 15 Antecedentes electroforesis en gel de poliacrilamida-SDS, con la que se ha logrado detectar 0.5% de sólidos de suero. Galindo y col. (2006) mediante cromatografía líquida de alta resolución (HPLC) detectaron hasta 1% v/v de suero líquido en leche, sin embargo este método también presenta el inconveniente de dar falsos positivos. Todos estos métodos además de presentar el inconveniente de dar resultados falsos positivos, requieren mucho tiempo (desde 1 a 3 días) pues se tiene que obtener y purificar previamente el GMP (Tomczak, 2007). Así pues se requiere una metodología más rápida, sensible y precisa para poder detectar este GMP como indicativo de la presencia de suero de quesería. Actividad Biológica del GMP A este péptido se le han atribuido las siguientes funciones fisiológicas: a) Unión a la toxina del cólera . b) Inhibición de la adhesión bacteriana y viral. c) Supresión de secreción gástrica. d) Promoción del crecimiento de bifidobacterias. e) Modulación de las respuestas del sistema inmune. a) Habilidad de unirse a la toxina del cólera. La toxina del cólera producida por Vibrio cholerae está formada por una subunidad A y 5 subunidades B. Esta últimas forman el sitio de unión al que se une a oligosacáridos de la pared celular. Una vez unido, la subunidad A activa a la adenilato ciclasa en la célula produciendo pérdida de agua celular, lo que causa diarrea y posiblemente la muerte (Brody, 2000). Kawasaki y col. (1992) han demostrado que el GMP es capaz de unirse a la toxina cólera a través de sus oligosacáridos, inhibiendo de esta manera la unión a oligosacaridos de la pared celular. 16 Antecedentes En investigaciones más recientes, realizadas por Nakajima y col (2005), se ha visto que el GMP tiene capacidad de unirse a bacterias patógenas intestinales como Salmonella enteritidis . b) Inhibicición de adhesión bacteriana y viral. Muchos virus y bacterias se unen a su hospedero como una parte del proceso de colonización. La unión al intestino u otras mucosas superficiales es llevada a cabo por adhesinas, material capsular de la superficie celular bacteriana. Nesser y col. (1994) evaluaron el papel del GMP en la inhibición de la adhesión de bacterias a la superficie oral y encontraron que el GMP previene la aglutinación de Streptococcus mutans, S. sanguis, y Actinomyces viscosus. Se cree que el mecanismo por el cual el GMP reduce la caries dental es por cambios en la composición microbiana de la placa dental (Brody, 2000). En la actualidad el GMP se añade a pastas dentríficas junto a otros péptidos derivados de las caseínas, denominados caseínfosfopéptidos (CPP), por su demostrada capacidad de inhibir el crecimiento de bacterias cariogénicas. Además, el GMP y los CPP inhiben la desmineralización y favorecen la remineralización del esmalte dental al formar en la superficie del diente nanoagregados con fosfato cálcico amorfo que constituyen un reservorio útil en el mantenimiento del estado de súper saturación de iones del esmalte dental (Nesser y col., 1994). c) Supresión de secreción gástrica. El GMP inhibe las secreción gástrica durante la primera y segunda hora después de comer. También se ha encontrado que este péptido estimula a la hormona colecistocina que es una hormona inhibitoria del apetito, y que regula las funciones intestinales. Así pues, se cree que el GMP puede ofrecer protección en los intestinos en humanos (Brody, 2000). 17 Antecedentes d) Promoción del crecimiento de bifidobacterias Las bifidobacterias predominan en el intestino bajo e inhiben el crecimiento de bacterias patógenas, por tanto protegen contra enfermedades gastrointestinales. Petschow y Talbott (1991) reportaron que el GMP promueve crecimiento y actividad de algunas especies de bifidobacterias. e) Modulación de la respuesta inmune Se ha visto que el GMP induce la proliferación de linfocitos B y linfocitos T, regulando la respuesta inmune. Eso podría permitir a un animal recién nacido tener un mecanismo de defensa pasivo contra un amplio espectro de antígenos del medio ambiente (Brody, 2000). 1.2 TÉCNICAS INMUNOLÓGICAS Son técnicas que utilizan la reacción antígeno-anticuerpo para el análisis cualitativo y cuantitativo de diversas sustancias. En general se utiliza un anticuerpo como reactivo para detectar o cuantificar algo de interés (el antígeno). Estas técnicas analíticas son de gran sensibilidad y especificidad y actualmente son las técnicas analíticas más ampliamente utilizadas, siendo aplicadas a una extraordinaria variedad de sustancias, tanto pequeñas como grandes moléculas, células, tejidos, componentes intra o extracelulares, virus, etc. En la actualidad son las técnicas que se están aplicando con mayor éxito en el análisis de los alimentos (Harlow y Lane, 1988; Anguita, 2006). La ventaja que tienen estos métodos que utilizan la propiedad de la interacción específica entre un anticuerpo y un antígeno determinado, es que se puede utilizar la capacidad del anticuerpo para unirse a otros compuestos sin perder su afinidad por el antígeno y utilizarlos en diversas técnicas: con enzimas 18 Antecedentes como son los ensayos inmunoadsorbentes ligados a enzimas o ELISA, con fluorocromos (ensayos inmunofluorométricos), con elementos radiactivos (ensayos inmunoradioactivos), con sustancias quimioluminiscentes (luminoinmunoensayo o LIA). La aplicación de estas técnicas inmunológicas al análisis de los alimentos para la detección de constituyentes naturales, plaguicidas, microorganismos, toxinas y otros componentes de los alimentos, está adquiriendo cada día mayor auge debido a las ventajas que aportan frente a los métodos convencionales. Su sensibilidad, rapidez, especificidad y bajo costo, hacen que sean especialmente útiles para el análisis de alimentos. Las técnicas inmunológicas en el análisis de alimentos presentan muchas ventajas con respecto a otros métodos como son la cromatografía de gases, la cromatografía en capa fina, la cromatografía de alta resolución y la electroforesis. Entre las principales ventajas destacan que se requiere una menor cantidad de muestra para el análisis, reducción del tiempo de análisis e instrumental poco complejo. Uno de los inmunoensayos que se utiliza mucho en alimentos es el ELISA (Harlow y Lane, 1988; Anguita, 1996). 1.2.1 Técnicas inmunoenzimáticas o ensayos inmunoadsorbentes ligado a enzimas (ELISA) Los ELISA, se basan en la detección de un antígeno inmovilizado sobre una fase sólida mediante anticuerpos que directa o indirectamente producen una reacción cuyo producto, puede ser medido espectofotométricamente. Estas técnicas, emplean marcadores enzimáticos para la detección y amplificación de las reacciones antígeno-anticuerpo. La degradación de un sustrato por la enzima, produce una reacción colorimétrica que permite cuantificar las reacciones antígeno-anticuerpo. 19 Antecedentes Estos métodos han sido ampliamente utilizados, ya que reducen el uso de costosos y sofisticados equipos y el tiempo de análisis y son adecuadas para análisis de rutina de un gran número de muestras. Los métodos inmunoenzimáticos constituyen en la actualidad las técnicas inmunológicas más ampliamente utilizadas. Al marcar o conjugar los anticuerpos o los antígenos con una enzima se debe mantener la actividad de la enzima y preservar la actividad del anticuerpo o la capacidad del antígeno de unirse a su anticuerpo específico (Anguita, 1996; Crowther, 2001). El empleo de enzimas como sustancias marcadoras en los inmunoensayos, fue introducido por Engvall y Perlmann (1971). Las enzimas presentan ciertas ventajas con respecto a otras sustancias marcadoras, como son su disponibilidad en formas altamente purificadas, su facilidad de manejo, su estabilidad a lo largo del tiempo, su bajo costo y la facilidad de su acoplamiento a las proteínas. La enzima deberá tener una alta actividad catalítica y un rango amplio de sustratos que den productos solubles o insolubles. La enzima ideal dependerá del costo, estabilidad, tamaño y facilidad de conjugación. Las enzimas que se utilizan con mayor frecuencia en las técnicas inmunoenzimáticas son la peroxidasa de rábano y la fosfatasa alcalina. Estas enzimas presentan la ventaja de que se pueden conjugar por técnicas simples y tienen varios sustratos. Los sustratos solubles que más se utilizan para la peroxidasa son: ο-fenildiamina (OPD), la 2,2´azino- (3 etil-benzotiazolina) sulfónico (ABTS) y la tetrametilbencidina (TMB). El sustrato soluble más usado para la fosfatasa alcalina es el ρ-nitrofenil fosfato (ρ-NPP) (Harlow y Lane, 1988; Crowther, 2001) 20 Antecedentes 1.2.2 Tipos de ensayos ELISA. Se han desarrollado múltiples variantes de ensayos ELISA que permiten desde la cuantificación de un antígeno en solución, la detección de un anticuerpo en una solución o la determinación de la clase (isotipo) de un anticuerpo, sin embargo, son tres los principales métodos en los que se basan todos los ELISAs: a) ELISA directo (ensayo ELISA simple de dos capas). Las placas ELISA se preparan recubriendo los pocillos con las soluciones en las que se sospecha se encuentra el antígeno y el antígeno se adhiere a la fase sólida por adsorción pasiva. Después de lavar, se adicionan anticuerpos marcados con una enzima y después de un periodo de incubación y lavados, se adiciona el sustrato de la enzima y se desarrolla una reacción colorimétrica resultante de la degradación del sustrato por la enzima. b) ELISA indirecto. Las placas ELISA se preparan de una forma idéntica a la anterior. El sistema de detección emplea dos anticuerpos: uno primario contra el antígeno, y uno secundario contra el primario, este anticuerpo secundario estará marcado con una enzima. La detección tiene mayor sensibilidad por presentar una amplificación de señal debida a la unión de dos o más anticuerpos secundarios por cada primario. Es el ensayo más popular, pues un mismo anticuerpo secundario marcado y un mismo sistema enzimático permite cuantificar una gran cantidad de antígenos. c) ELISA sándwich (ensayo de captura de antígeno y detección mediante inmuno complejos). Se trata de un ensayo muy empleado en el que se recubre el pocillo con un primer anticuerpo anti-antígeno. Después de lavar el exceso de anticuerpo se aplica la muestra problema en la que se encuentra el antígeno, que será retenido en el pocillo al ser reconocido por el primer anticuerpo. Después de un segundo lavado que elimina el material no retenido se aplica una solución con un segundo anticuerpo anti-antígeno marcado con una 21 Antecedentes enzima. Así pues cada molécula de antígeno estará unida a un anticuerpo en la base que lo retiene y un segundo anticuerpo, al menos, que lo marca. Este ensayo tiene una gran especificidad y sensibilidad debido a la amplificación de señal que permite el segundo anticuerpo (Crowther, 2001). Los factores que determinan cuál es el formato de ELISA idóneo para el desarrollo de una aplicación específica son: la muestra objeto de análisis (tipo y cantidad), el tiempo disponible para efectuar cada determinación, el grado de exactitud requerido o los medios materiales disponibles (infraestructura, equipos de análisis) y especialización de los técnicos (Gosling, 1990). 1.2.3 Fases de un ensayo ELISA Las 4 fases de un ensayo ELISA son las siguientes: a) Conjugación del anticuerpo o del antígeno con una enzima (peroxidasa, fosfatasa alcalina). El anticuerpo conjugado con la enzima se emplea en ensayos directos e indirectos, sándwich, etc (figura 4a). b) Unión del antígeno o del anticuerpo a los pocillos. Esta unión se realiza con facilidad a la superficie de plásticos tratados que tienen gran afinidad por proteínas (figura 4b). c) Formación de una o más capas de inmunocomplejos (figura 4c). d) Revelado de la reacción enzimática. Después de un lavado para eliminar todas las moléculas marcadas no fijadas en forma de inmunocomplejos se añade el sustrato enzimático en solución. Se deja reaccionar y se lee la densidad óptica (D.O.) mediante espectrofotometría. En el esquema se muestra la reacción asociada a un ELISA directo (figura 4d). 22 Antecedentes a. Marcaje del Anticuerpo b. Unión del anticuerpo o del antígeno a la fase sólida + Enzima a´. Marcaje del antígeno + Enzima d. Reacción entre el enzima y el sustrato forma un producto colorido que se mide por espectrofotometría c . Se forman una o más capas de complejos inmunes sobre la fase sólida + Sustrato Pocillo recubiertos de anticuerpo ELISA Competitivo de Antígeno Pocillo recubiertos de antígeno ELISA Indirecto Solución coloreada Medidas de la D.O. de solución patrón (diluciones seriadas del antígeno aplicadas al pocillo) ELISA Directo Figura 4. Fases de un ensayo ELISA: (a) conjugación del anticuerpo o antígeno a enzima; (b) unión de antígeno (o anticuerpo) a los pocillos; (c) formación de inmunocomplejos; (d) revelado de la reacción enzimática. 1.2.4 Sistema biotina-avidina o biotina- estreptavidina- en ELISA. La unión específica entre la avidina o la estreptavidina con la biotina (vitamina hidrosoluble) ha sido explotado en el ELISA, ya que la biotina puede acoplarse muy fácilmente a anticuerpos sin alterar sus propiedades y estos anticuerpos biotinilados pueden detectarse con estreptavidina o avidina marcada o conjugada con una enzima. La biotinilación normalmente no tiene un efecto adverso sobre los anticuerpos, y las condiciones de acoplamiento son suaves. Los anticuerpos acoplados a biotina son estables bajo condiciones normales de almacenamiento (-20° C). La avidina, una glicoproteína básica tetramérica presente en gran abundancia en la clara de huevo, y la estreptavidina, su equivalente sintetizado 23 Antecedentes por bacterias del género Streptomyces tienen una alta afinidad por la biotina (Ka 1014 M-1) y por tanto su unión al anticuerpo biotinilado es irreversible. Debido a que la avidina y la estreptavidina pueden acomplejarse de forma sencilla con diversas actividades enzimáticas implicadas en reacciones colorimétricas o quimioluminiscentes, el sistema biotina/avidina o biotina/estreptavidina es un sistema de elección como intermediario en las reacciones de detección de antígenos. El complejo que se forma por la unión avidina (estreptavidina)-biotina permite amplificar la sensibilidad de las reacciones inmunoenzimáticas (ELISA). En una primera fase, el pequeño tamaño molecular de la biotina favorece que por cada inmunoglobulina se unan varias moléculas de biotina. Posteriormente, al contener la avidina (estreptavidina) varios lugares de union con la biotina, permite que por cada inmunoglobulina conjugada a la biotina, se unan varias moléculas de avidina (estreptavidina). Por consiguiente, se permite detectar la molécula del antígeno con una sensibilidad mayor (Harlow y Lane; 1988; Anguita, 1996; Crowther, 2001). Ambas proteínas se encuentran comercialmente disponibles marcados con enzimas, colorantes fluorescentes o iodo. La estreptavidina es preferida en la mayoría de las aplicaciones ya que esta tiene un punto isoeléctrico más favorable y es una proteína neutra, mientras que la avidina es alcalina y se ha reportado que puede presentar uniones inespecífica atribuidas a la basicidad de su molécula y a su contenido de cadenas hidrocarbonadas (hexosas y aminoazúcares). 1.2.5 Los anticuerpos policlonales en el sistema ELISA Cuando se administra un inmunógeno “in vivo”, se produce la estimulación de distintas células del sistema inmunitario (como macrófagos, linfocitos T y B). Entre otras de las respuestas que se producen, los linfocitos B activados y diferenciados a células plasmáticas, secretan una mezcla de anticuerpos derivados de la activación de numerosos clones de linfocitos B sensibles a dicho 24 Antecedentes antígeno. A este tipo de respuesta se le denomina policlonal, y al suero de un animal que contiene una mezcla de anticuerpos frente a un inmunógeno se denomina antisuero policlonal. Por tanto, los anticuerpos policlonales son anticuerpos derivados de diferentes líneas de células B. Estos son una mezcla de inmunoglobulina secretadas en contra de un antígeno específico, cada una reconociendo diferentes epítopos (Campbell 1984; Harlow y Lane, 1988). Muchos de los inmunoensayos, emplean anticuerpos policlonales ya que la obtención de estos es más sencilla, más económica y requiere menor tiempo que los anticuerpos monoclonales. Además, los anticuerpos policlonales reconocen varios epítopos diferentes de un mismo antígeno, siendo adecuados para la detección de antígenos en muestras que son procesadas (Holden y col., 2005). 1.3 ANTECEDENTES DEL USO DEL SISTEMA ELISA EN ALIMENTOS El sistema ELISA debido a su gran sensibilidad y facilidad de realizar, ha sido utilizado en el área de alimentos con el fin de detectar sustancias alergénicas o adulterantes que se encuentran en estos. Ejemplos de esto son: 1. Debido a que hay personas intolerantes al gluten, proteína presente en algunos cereales, se ha aplicado el sistema ELISA para la detección de este compuesto. Valdés y col. (2003) mediante un sistema ELISA sándwich han identificado gliadina (componente del gluten) con una sensibilidad de 0.78 ng/gr. 2. Watanabe y col. (2002) mediante el sistema ELISA tipo sándwich utilizando anticuerpos monoclonales, detectaron el antibiótico dihidroestreptomicina en leche. El límite de detección fue de 10 ng/ml de leche. 25 Antecedentes 3. Park y col. (2003) desarrollaron un sistema ELISA tipo sándwich para detectar contaminación por hongos en productos agrícolas básicos como granos, cereales, frutas y verduras. Ellos emplearon una mezcla de anticuerpos monoclonales para la detección de Aspergillus penicillium y Fusarium. El límite de detección para estos antígenos fue de 100 ng/gr. 4. Holden y col. (2005) mediante un ensayo ELISA tipo sándwich, usando anticuerpos policlonales de conejo, desarrollaron un sistema para detectar la leguminosa lupina (Lupinus spp.), que se adiciona a alimentos para mejorar el valor nutritivo de estos, pero que puede producir una gran variedad de respuestas alérgicas (urticaria, angiodema, rinoconjuntivitis). El límite de detección fue de 1 µg/g. 1.3.1 Antecedentes de la aplicación del sistema ELISA en leche. Se ha desarrollado un gran número de sistemas ELISAs para detectar diferentes adulteraciones en productos lácteos. Los antígenos han sido caseínas, lactoglobulinas, inmunoglobulinas y otras proteínas. Se han utilizado tanto anticuerpos monoclonales como policlonales en una gran variedad de formatos como son: ELISA indirecto, directo, competitivo y sándwich. Los principales trabajos de investigación se han aplicado para detectar adulteración de leche de oveja, cabra y búfalo con leche de vaca, ya que estas adulteraciones afectan la calidad de los quesos (Anguita, 1996; Hurley y col., 2004) Recientemente, Bremer y col. (2008) desarrollaron un sistema ELISA para detectar suero de quesería en polvo en leche deshidratada y en mantequilla en polvo. Ellos desarrollaron el sistema utilizando anticuerpos monoclonales anti-κcaseína. El límite de detección del sistema desarrollado fue 0.1 % (p/p). 26 2. HIPOTESIS Que el desarrollo de un sistema ELISA tipo sándwich, pueda detectar de manera rápida y con alta sensibilidad, GMP como indicador de la adulteración de leche líquida con suero de quesería, para permitir saber a los compradores de leche si la leche que se quiere comprar está adulterada con suero de quesería. 27 3. OBJETIVOS 3.1 Objetivo general Desarrollar un sistema de detección sencillo, rápido y sensible, cualitativo y cuantitativo, basado en una reacción inmunológica, para detectar adulteraciones en leche por la adición de suero de quesería. 3.2 Objetivos específicos: 1. Aislar y purificar glucomacropeptido (GMP) de suero de leche 2. Evaluar un método para detectar GMP por electroforesis desnaturalizante y tinción con plata. 3. Obtener anticuerpos policlonales específicos contra el GMP 4. Determinar la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP 5. Desarrollar un método mediante inmuno blot para detectar GMP utilizando anticuerpos policlonales de obtención propia. 6. Elaborar y validar un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia. 28 4. MATERIALES Y METODOS Materiales: Material biológico: Leche cruda recién obtenida. La leche cruda de vaca utilizada en este trabajo fue proporcionada por la Posta Zootécnica del Centro de Ciencias Agropecuarias de la Universidad Autónoma de Aguascalientes. Esta se utilizó en los inmunoensayos como control negativo de la presencia de suero de quesería (leche sin adulterar). Suero en polvo Se trabajó con suero de quesería comercial en polvo obtenido en el mercado. Conejos Se trabajó con conejos adultos hembras de la cepa Nueva Zelanda, los cuales fueron proporcionados por el bioterio de la Universidad Autónoma de Aguascalientes. Métodos: El trabajo experimental se llevó a cabo en tres etapas. La primera etapa consistió en obtención e identificación del GMP a partir de suero de leche proveniente de quesería; en la segunda etapa se trabajó en la obtención y purificación de anticuerpos policlonales anti-GMP; en la tercera etapa, con los anticuerpos policlonales anti-GMP obtenidos, se desarrollaron técnicas inmunológicas como el inmuno blot y ELISA para detectar GMP como indicativo de la presencia de suero de quesería. 29 Materiales y métodos 4.1 Aislamiento y purificación del glucomacropeptido (GMP) de suero de leche De los métodos que se han utilizado para obtener y purificar el GMP, se aplicaron dos en este proyecto: 1) Precipitación con etanol y ultrafiltración; 2) fraccionamiento con ácido tricloroacético (Olieman, 1983). 4.1.1 Precipitación con etanol y ultrafiltración. Esta metodología es una combinación de dos técnicas reportadas por Li y Mine (2004) que maneja cambios bruscos de temperatura y pH para eliminar proteínas y dejar sólo al GMP. Los pasos que se siguieron fueron: • Se resuspendió suero en polvo (proveniente de quesería) a una concentración del 10% en agua y se ajustó el pH de esta solución a 3.5 con HCl. • Se calentó el suero a 100°C durante una hora y po steriormente la muestra se enfrió colocándola en hielo. • Se adicionó un volumen igual de etanol absoluto frío y se ajustó el pH a 9 con NaOH. • Se centrifugaron las muestras a 5, 000 × g durante 30 min • Se recuperó el sobrenadante y se le ajustó el pH a 3.5 con HCl. • La muestra se ultrafiltró con una membrana de corte de 10 KDa (Amicon 8050, Millipore Corporation, Bedford, EUA). Dado que el PM del GMP es de 6500 – 8,000 Da, el ultrafiltrado (permeato) es lo que se recolectó. • Se ultrafiltró el permeato con una membrana de corte de 5 KDa. El GMP queda en el residuo. A este residuo se le ajustó el pH a 7.4 • Se analizó por electroforesis el residuo que presuntivamente contenía al GMP. 30 Materiales y métodos 4.1.2 Fraccionamiento con acido tricloro acético (TCA). • Se prepararon 50 ml de suero en polvo al 10% y se adicionó 0.5 volúmenes de TCA al 24% (la concentración final de TCA en esta solución es de 8%). La adición del ácido se realizó en un periodo de 2 min con agitación magnética a 25°C. • La muestra después de precipitada se mantuvo en reposo 2 horas y se centrifugó a 5, 000 × g por 30 min • A 30 ml del sobrenadante se le añadieron 0.4 volúmenes de una solución de TCA al 50% (la concentración final de TCA en la solución fue de 14.8%) y se dejó en reposo a baja temperatura (4-6 °C), durante 24 h. • La muestra precipitada se centrifugó a 5, 000 × g por 30 min. • El material precipitado es el GMP el cual se lavó con un solución de etanol-éter (1:1) seguido de una centrifugación a 5, 000 × g por 30 min. • El precipitado obtenido se resuspendió en una solución amortiguadora 75 mM Tris HCl pH 8.0. • Después de obtener el GMP en solución, se cuantificó proteína por el método de Bradford (1976), usando albúmina sérica bovina (BSA) como estándar. 4.2 Evaluación de un método para detectar GMP por electroforesis y tinción con plata. 4.2.1 Electroforesis. Las diferentes muestras obtenidas de GMP se analizaron por electroforesis en geles de poliacrilamida con duodecil sufato de sodio (SDS-PAGE) bajo condiciones reductoras, con la finalidad de detectar presencia y pureza del péptido. La electroforesis se desarrolló según metodología propuesta por Laemmli (1970). 31 Materiales y métodos Soluciones utilizadas: todos los reactivos utilizados fueron de Sigma (Sigma-Aldrich, Steinheim, Alemania). 1. Gel de separación: En la tabla 2 se muestra la formulación para geles de acrilamida a diferentes porcentajes. Para el análisis del GMP se preparó un gel al 13.5% de acrilamida. Tabla 2. Preparación de gel de separación para electroforesis con diferentes concentraciones de acrilamida Concentración final de acrilamida en el gel separador 10% 13.5% 16% • Agua destilada 4.02 ml 2.85 ml 2.05 ml • Tris-HCl pH 8.8 2.5 ml 2.5 ml 2.5 ml 3.33 ml 4.5 ml 5.3 ml Persulfato de amonio (APS) 0.44 M 50 µl 50 µl 50 µl Tetrametilen etilen- diamina (TEMED) 5 µl 5 µl 5 µl 10 ml 10 ml 10 ml (1.5 M Trizma base, 0.014 M SDS) • Acrilamida (30% acrilamida/0.8% bisacrilamida) • • TOTAL 2. Gel de concentración: 3.5 ml • Agua bidestilada • Tris-HCl pH 6.8 (0.5 M Trizma Base, 0.014 M SDS) 5.0 ml • Acrilamida 1.3 ml (30% acrilamida/ 0.8% bisacrilamida) • APS 0.44 M 50 µl • TEMED 10 µl TOTAL 10 ml 32 Materiales y métodos 3. Solución para solubilizar muestras: Tris-HCl pH 6.8 (0.5 M Trizma Base, 0.014 M SDS) 2.5 ml • SDS 0.35 M 4.0 ml • Glicerol 2.0 ml • Azul de bromofenol 0.0058 M 400 µl • β-mercaptoetanol 1.0 ml 4. Solución de corrida: Es una solución de 0.025 M Trizma base, 0.25 M Glicina, 3.5 mM SDS, pH 8.3 (Gallagher, 1995). Preparación de las muestras a analizar: • La solución obtenida de GMP se ajustó a una concentración de 1 µg de proteína /µl y posteriormente se disolvieron 20 µg de GMP en 10 µl de solución de solubilización de muestras. • Para tener un control negativo de la presencia del GMP en las electroforesis se obtuvo leche cruda ya que esta no debe tener GMP y se le dio tratamiento con 8% v/v TCA para eliminar caseínas y posteriormente un segundo tratamiento con TCA al 14% para precipitar y concentrar el GMP. El precipitado se resuspendió en 20 µl de solución de solubilización de muestras. • Como control positivo del GMP purificado, se utilizó GMP comercial (Arla Foods Amba, Viby, Dinamarca). Condiciones de la electroforesis: • Gel de poliacrilamida: se utilizó al 10, 13.5 y 16 % (p/v) con el fin de determinar con cual se obtenía mejor separación de las bandas proteicas. • Electroforesis continua y se realizó en un equipo “Bio-Rad Mini Protean 3”. 33 Materiales y métodos • Se corrió la electroforesis a 80 volts por 1.5 h. • Los marcadores de peso molecular que se utilizaron fueron: miosina, fosforilasa b, albúmina sérica bovina, ovoalbúmina, anhidrasa carbónica, inhibidor de tripsina, lisozima, aprotinina,cadena b de la insulina con pesos moleculares de 220,97, 66 45, 30, 20.1, 14, 6.5, 3.5 y 2.5 kDa respectivamente. 4.2.2 Tinción con plata La tinción con nitrato de plata tiene un límite de detección mejor que otras tinciones de geles como el azul de Coomassie, razón por la que se eligió trabajar con esta (Crester y col. 2001). • El gel de electroforesis se fijó 1 h o toda la noche con una solución de metanolácido acético-agua (45:10:45), en agitación. • Posteriormente el gel se fijó 30 min en una solución de etanol 10% - ácido acético 5% en agitación. • Se lavó con agua destilada 30 min en agitación. • El gel se lavó con ditiotreitol (DTT) (3 mg/ 200 ml) durante 30 min en agitación. • Se enjuagaron suavemente los geles con agua destilada. • El gel se tiñó con una solución de nitrato de plata recién preparada al 0.2% (en agua desionizada) 30 min en agitación. • Se lavó el gel suavemente con agua des-ionizada. • Se reveló el gel con una solución de carbonato de sodio al 3% con formaldehído (0.5 ml/1 L), utilizando un poco de esta solución y sustituyéndolo por fresco durante 5-10 min. • El revelado se detuvo con ácido acético al 1%. 34 Materiales y métodos 4.3 Obtención de anticuerpos policlonales específicos contra el GMP La obtención de anticuerpos policlonales se llevó a cabo en 4 etapas: 1. Inducción de la producción de anticuerpos policlonales contra GMP. 2. Extracción del suero de los animales inmunizados. 3. Purificación de los anticuerpos policlonales. 4. Verificación de la pureza y reactividad de anticuerpos frente al GMP. Un esquema de la metodología que se siguió se observa en la figura 5. Extracción de suero preinmune GMP (1mg) + Adyuvante de Freund 1. Inducción de la producción de anticuerpos anti-GMP 2. Extracción del suero de animales inmunizados 1ª etapa con (NH4)2 SO4 (p.p inmunoglobulinas) sangre 3. Purificación de Anticuerpos Anticuerpos puros 2ª etapa con ac. caprílico (p.p proteínas que no son IgG) 3ª etapa purificación por inmunoafinidad 4. Verificar pureza, reactividad y especificidad de anticuerpos frente al GMP Pureza (Electroforesis y tinción con plata) Reactividad y Especificidad (Inmuno blot ) Figura 5. Esquema general de la metodología para la obtención de anticuerpos policlonales específicos contra el GMP. 35 Materiales y métodos 4.3.1 Inducción de la producción de anticuerpos policlonales contra el GMP Para la inducción de anticuerpos inicialmente se planteó utilizar el GMP obtenido por los métodos propios ya que era difícil conseguir GMP comercial, sin embargo, debido a que posteriormente se pudo adquirir el péptido comercial se decidió desarrollar el proyecto con este último. Preparación del inmunógeno (GMP): Para la inmunización de los animales se utilizó GMP comercial el cual previamente se diafiltró con una membrana de corte de 10 kDa, con el fin de eliminar sales y aminoácidos libres que estaban presentes con este péptido. Inmunización: Se inmunizaron 7 conejos con 1 mg de GMP por conejo. Antes de las inoculaciones se tomó muestra de sangre de la vena marginal de la oreja de cada conejo con el fin de obtener suero preinmune y con este comprobar la ausencia de reactividad de los animales frente al GMP. Se rasuró la zona del lomo del animal donde se procedió a inyectar subcutáneamente el GMP. Se realizaron 4 pautas de inmunización de la siguiente manera: • Primera inmunización: se inyectó 1 mg del inmunógeno, para esto se preparó una emulsión mezclando 2 ml de solución salina de GMP (0.5 mg/ml) con 2 ml de Adyuvante Completo de Freund (ACF). Se aplicaron 10 inyecciones subcutáneas (SC) de unos 400 µl cada una. • Siguientes 3 inmunizaciones de refuerzo: Se preparó una emulsión de 2 ml de solución salina de GMP (0.5 mg/ml) con 2 ml de Adyuvante Incompleto de Freund (AIF). Se aplicaron 10 inyecciones SC de unos 400 µl cada una. Estas inmunizaciones de refuerzo se hicieron cada 6 semanas. 36 Materiales y métodos Durante todo el proceso los conejos permanecieron en jaulas metabólicas en un animalario. 4.3.2 Extracción del suero de los animales inmunizados. Entre los 10 a 14 días posteriores a cada inmunización se extrajo de las venas marginales de la oreja, una muestra de 10 ml sangre de cada conejo con la que posteriormente se probó si hubo producción de anticuerpos anti-GMP mediante inmuno blot. Para obtener el suero, la sangre extraída se procesó de la siguiente manera: • Se dejó que se formara el coágulo a temperatura ambiente 30 min y se despegó cuidadosamente el coágulo de las paredes del tubo con ayuda de un aplicador. • Se centrifugaron los tubos a 500 × g /10 min y se separó el suero (llevándose la mayor cantidad de suero posible). • Se dió una segunda centrifugada a 500 × g 10 min. • Se juntaron los sueros de un mismo conejo y se mezclaron suavemente con una pipeta. • El suero obtenido se alicuotó en viales de 100 µl y se congeló a -20° C para posteriormente verificar la producción de anticuerpos específicos contra el GMP mediante análisis por inmuno blot . Una vez que mediante inmuno blots se observó una buena producción de anticuerpos anti-GMP en las muestras de sueros extraídos, se procedió a la sangría final de los conejos con el fin de obtener un gran volumen de suero. • Se pesaron los conejos y por vía intraperitoneal se anestesiaron con pentobarbital sódico (40 mg/kg de peso). • Se colocaron los animales en una mesa de cirugía en cúbito dorsal, sujetándoles las patas al lado de la mesa y se les rasuró el abdomen. • Se les hizo una incisión en la línea media del esternón a la sínfisis del pubis. 37 Materiales y métodos • Con la mano se retraen los órganos y por disección Roma se expuso la arteria aorta abdominal con una troca del número 16, conectada a un tubo. • Se desangraron los animales colectando la sangre en tubos de 50 ml hasta que murió el animal. • Se dejó que se formara el coágulo a temperatura ambiente (20 - 30 min.) y se procedió a obtener el suero por el método descrito anteriormente (IV.2.3.2). • Se tomó una muestra de suero (200 µl) que se congeló a –20° C para analizarlo posteriormente por inmunoblot. Con el suero restante se procedió a purificar los anticuerpos policlonales. 4.3.3 Purificación de los anticuerpos policlonales La purificación de los anticuerpos policlonales del suero de los conejos se hizo en tres etapas: una primera utilizando una solución saturada de sulfato de amonio, una segunda etapa que involucra precipitación con ácido caprílico y finalmente se purificaron por inmunoafinidad. a) Purificación de anticuerpos por precipitación con sulfato de amonio. • Una vez que se tuvo el suero de los conejos inmunizados, se midió el volumen, se transfirió a un recipiente limpio y se agitó suavemente con barra magnética. • Mientras se agitaba el suero, se añadió lentamente 0.5 volúmenes de solución saturada de sulfato de amonio (NH4)2SO4 (4.1 M). Se dejó a 4° C toda la noche. • Se centrifugaron las muestra a 3,000 × g durante 30 min. a 10° C para recuperar las Ig precipitadas. • El precipitado se resuspendió en 0.5 volúmenes de solución tampón de fosfatos (PBS) pH 7.4 (NaCl 0.14 M, KCl 2.7 mM, Na2HPO4 0.1 M, y KH2PO4 1.8 mM) 38 Materiales y métodos • La muestra de anticuerpos en PBS se ultrafiltró a 4° C con una membrana de celulosa regenerada de corte de 10 kDa. La ultrafiltración se dejó hasta tener un volumen de 10 ml de remanente (precipitado). Este se lavó y ultrafiltró varias veces con PBS hasta que se eliminó el (NH4)2SO4. Nota: La eliminación del (NH4)2SO4 se verificó tomando muestra del permeato (filtrado) y añadiendo unas gotas de CaCl2 4.0 M con lo que se observó la formación de precipitado (CaSO4). Puesto que el calcio también reacciona con las sales de fosfato (PO4-3) que tiene el PBS, se adicionaron unas gotas del CaCl2 4.0 M al PBS, se agitó y se calibró con esta muestra un espectrofotómetro a 485 nm. Posteriormente a las muestras de permeato se adicionó CaCl2 y se les midió absorbancia a la misma longitud de onda. Cuando la absorbancia dió cero, se consideró que se había eliminado el (NH4)2SO4. b) Purificación de anticuerpos por precipitación con ácido caprílico. • El volumen de remanente de anticuerpos se ajustó con PBS al volumen que se tenía inicialmente de suero. Se tomó una muestra (200 µl) que se congeló a 20°C para analizarlo posteriormente por electroforesis e inmunoblot con el fin de verificar presencia y especificidad de los anticuerpos anti-GMP. • La muestra restante se siguió procesando para purificar los anticuerpos policlonales con ácido caprílico. Para esto se transfirió a un recipiente limpio y se agitó con barra magnética suavemente. • Se añadieron 2 volúmenes de solución tampón de acetato de sodio 60 mM pH 4.0 • Se midió el pH de la mezcla y se ajustó a 4.8 con ácido acético glacial. • Lentamente (gota a gota) y agitando con barra magnética, se añadió ácido caprílico (0.75 ml/ 10 ml del volumen original de suero). Se continuó agitando durante 30 min. a temperatura ambiente. 39 Materiales y métodos • Se centrifugó a 5,000 × g durante 10 min. y se decantó cuidadosamente, recuperando el sobrenadante. • El sobrenandante se ultrafiltró a 4° C con una mem brana de celulosa regenerada de corte de 10 kDa. La ultrafiltración se dejó hasta tener un volumen de 10 ml de remanente (precipitado). Este se lavó y ultrafiltró varias veces con PBS hasta que se eliminó el ácido caprílico. Nota: La eliminación del ácido caprílico se verificó tomando muestra del permeato (filtrado) y midiéndole pH. El pH inicial de la muestra era de 4.8 y se lavó y ultrafiltró con PBS hasta que fuera de 7.2, que es el pH del PBS. • Una vez que se terminó de ultrafiltrar la muestra, el volumen de remanente (precipitado) de anticuerpos se ajustó con PBS al volumen que se tenía al empezar esta segunda etapa de purificación de anticuerpos. Se tomó una muestra (200 µl) que se congeló a -20°C para analizarlo posteriormente por electroforesis e inmuno blot y para cuantificar proteína por el método de Bradford. • La muestra restante se congeló a -60°C para posteriormente purificar los anticuerpos policlonales por inmunoafinidad (Harlow y Lane, 1988). c) Purificación de anticuerpos por inmuno afinidad La purificación se llevó a cabo en una columna HP NHS-activada (Sepharose) (GE Healthcare Bio-Sciences Corporation, Piscataway, EUA). El agua y los reactivos químicos usados para la preparación de buffer fueron de alta pureza. Todos las soluciones utilizadas se filtraron a través de un filtro de 0.45 µm (Millipore Corporation, Bedford, EUA). La columna fue operada con una bomba peristáltica Gallenkamp. Los pasos que se siguieron fueron: 40 Materiales y métodos Acoplamiento del ligando (GMP) a la columna de afinidad • Se disolvió GMP comercial en buffer de acoplamiento (NaHCO3 0.2 M, NaCl 0.5 M, pH 8.3) a una concentración exacta 10 mg/ml de proteína) y se ultrafiltró con una membrana de celulosa regenerada de 10 kDa de corte con el fin de eliminar las sales y aminoácidos libres que acompañan a este GMP comercial. • Se lavó el isopropanol que viene en la columna para prevenir desactivación de los grupos NHS con HCl 1mM frío usando 3x2 ml a una velocidad de flujo de 0.5 ml/min (es importante cuidar de no exceder una velocidad de flujo de 1 ml/min para esta columna, pues se puede compactar su relleno o empaque). • Se equilibró la columna con 5 volúmenes de solución de acoplamiento. • Inmediatamente se inyectó 1ml de la solución del GMP a la columna y se selló esta. • Se dejó el GMP 30 min. a 25º C (o 4 h a 4º C). Lavado y desactivación de la columna después de acoplarse el GMP. Es necesario desactivar algún exceso de grupos activos que no acoplaron al ligando y lavar los ligandos unidos no específicamente, para ello se llevó a cabo el siguiente procedimiento: - Solución A: etanolamina0.5 M, NaCl 0.5 M, pH 8.3. - Solución B: acetato 0.1 M, NaCl 0.5M, pH 4.0. a) Se inyectó 3x2ml de solución A. b) Se inyectó 3x2ml de solución B. c) Se inyectó 3x2ml de solución A. d) Se dejó la columna por 15-30 min. a temperatura ambiente o 4 h a 4º C. e) Se inyectó 3x2ml de solución B. f) Se inyectó 3x2ml de solución A. g) Se inyectó 3x2ml de solución B. 41 Materiales y métodos h) Finalmente, se inyectaron 2ml solución 0.1 M NaH2PO4, 0.5 M NaCl pH 7 con el fin de ajustar el pH de la columna. Medida de la eficiencia de acoplamiento. a) Después del acoplamiento, se lavó la columna con 3 volúmenes de la columna con solución de acoplamiento (NaHCO3 0.2 M, NaCl 0.5 M, pH = 8.3). Se guardó esta solución de lavado. b) Se equilibró una columna desaladora (HiTrap desaladora de 5 ml) con solución NaH2PO4 0.1 M, NaCl 0.15 M, pH 7.0. − Se cargó 1.0 ml de la solución de lavado que se guardó del paso (a) y se dejó correr. Se descartó el eluyente. − Se cargaron 2 ml de solución de acoplamiento y se dejaron correr en la columna. Se descartó el eluyente. − Se añadieron 1.5 ml de solución Glicina-HCl 100 mM, NaCl 0.5M, pH 2.7 para eluir proteínas (en este caso GMP). − Se colectó el eluyente y se midió proteína por el método de Bradford. El rendimiento de la columna con este protocolo anterior se obtiene: CÁLCULOS: Solución de acoplamiento cargada donde: A = = A Concentración de proteína en la solución de acoplamiento, cargada en columna HiTrap NHS X Volumen de solución de acoplamiento cargado en la columna HiTrap NHS Cantidad no acoplada = B A B= proteína sol. acoplamiento después de columna desaladora X 1.5 volumen colectado HiTrapdesalting x V volumen cargado de sol.acoplamiento 0.5 Rendimiento del acoplamiento % = 42 A - B * 100 A Materiales y métodos Nota: El rendimiento aceptable con esta columna es normalmente 90% www.gehealthcare.com/hitrap Purificación de los anticuerpos: • Preparación de la muestra de anticuerpos: La solución de anticuerpos parcialmente purificados y que se encontraban en PBS se diafiltró a 4° C contra solución de unión (Tris HCl 75 mM pH 8.0), con una membrana de corte de 10 kDa. Se centrifugó la solución de anticuerpos inmediatamente antes de aplicarla a la columna y se le determinó proteína por método de Bradford. • Se equilibró la columna HiTrap de 1 ml que tenía acoplado el GMP, con 10 volúmenes de una solución de unión, • Por bombeo con una bomba peristáltica se aplicó 1 ml de solución de anticuerpos sobre la columna a una velocidad de flujo de 0.2 ml/min • Se lavó la columna con solución de unión utilizando 5-10 volúmenes de la columna o hasta que no apareciera material proteico en la elución, lo cual se verificó por medición de la absorbancia a 280 nm de los eluyentes. • Se eluyeron los anticuerpos anti-GMP con 3-5 volúmenes de la columna, con una solución de elución (Glicina-HCl 100 mM, NaCl 0.5 M, pH 2.7). Las fracciones obtenidas se neutralizaron con 5- 20 µl de solución Tris HCl 1 M pH 9.0. • Con los anticuerpos anti-GMP purificados se determinó pureza y reactividad frente al GMP mediante inmuno blot y electroforesis (Ver 3.2.1. y 3.4.2). • Se cuantificó proteína por el método de Bradford. Una vez que se comprobó la pureza y reactividad de los anticuerpos eluidos, se juntaron todas las fracciones de estos para desalarlos y concentrarlos por diafiltración a 4° C, con una membrana de corte de 10 kDa, usando para ello una solución de fosfato de sodio 0.1 M pH 7.0. Se determinó la concentración final de proteína por método de Bradford. 43 Materiales y métodos Los anticuerpos puros anti-GMP se alicuotaron y congelaron a -20° C para con ellos desarrollar un método inmuno blot y un sistema ELISA tipo sándwich para detectar GMP. 4.4 Determinación de la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP 4.4.1 Pureza Para ver la pureza de los anticuerpos obtenidos, se llevó a cabo una electroforesis en geles de poliacrilamida al 10% según metodología desarrollada por Laemmli (1970). La electroforesis continua se realizó en un equipo “Bio-Rad Mini Protean III” (Bio-Rad) a 80 volts por 1.5 h y posterior tinción con plata de los geles (metodología ya descrita anteriormente en apartado 3.2.2). 4.4.2 Reactividad y especificidad de los anticuerpos policlonales frente al GMP a) Reactividad La reactividad de los anticuerpos frente al GMP se verificó mediante inmuno blot, para el cual se siguieron los siguientes pasos: • Se realizó electroforesis continua de 20 µg de GMP en gel poliacrilamida al 13.5% (p/v). • Las fracciones proteicas se transfirieron electroforéticamente a una membrana de Polivinildieno fluorado (PVDF) (Millipore Corporation, Bedford, EUA) por dos h a 100 mAmp usando para ello una solución de transferencia (0.024 M Trizma base, 0.186 M glicina, 4.1 M metanol). • Una vez hecha la transferencia de las proteínas a la membrana, se lavó esta con la solución de transferencia limpia y se puso a secar para posteriormente llevar a cabo la inmunotinción. 44 Materiales y métodos Inmunotinción de blot • Se equilibró la membrana de PVDF en metanol al 100% y se bloqueó con una solución tampón NaCl 0.5 M, Tris HCl 0.02 M (TBS) con leche en polvo al 5% por 1 h en agitación a temperatura ambiente. • El blot se incubó 1 h en agitación a temperatura ambiente con los anticuerpos anti-GMP diluidos 1:500 en TBS con leche en polvo 5%. Este tiempo de incubación se determinó de manera experimental. • Se lavó la membrana 1 x 5 min. con agua destilada, 2 x 10 min. con TBS al 0.2% Tween 20 (TTBS) y se incubó por 2 h con el anticuerpo secundario anti conejo de cabra unido a fosfatasa alcalina (PA) (Zymed, San Francisco, EUA) diluido 1:10,000 en la solución de TBS más leche en polvo al 5%. • Después se lavó la membrana con TTBS (2 x 15 min y 5 x 5 min) y se incubó con 5-bromo-4-cloro-3-indol fosfato/nitro azul tetrazolio (BCIP/NBT) (SigmaAldrich, Steinheim, Alemania) hasta la aparición de bandas de intensidad satisfactoria (2-10 min). Nota: Todos los pasos de lavado y de incubación se realizaron en agitación suave. b) Especificidad: Esta se determinó desarrollando inmuno blots de muestras de GMP, suero de quesería y leche sin suero de quesería. La leche se trató previamente con una solución de TCA a una concentración final de 8%, con el fin de precipitar la κcaseína (Benitez y col. 2001) la cual puede dar reacción cruzada con el GMP y posteriormente se trató con TCA a una concentración final de 14% concentrar y precipitar el GMP si estuviera presente. 45 para Materiales y métodos 4.5 Desarrollo de un método mediante inmuno blot para detectar GMP Se usó un estuche para Western blot de un solo paso (GenScript Corporation, Piscataway, EUA) con el fin de analizar muestras de leche u otros productos que contengan suero de quesería. La metodología que se siguió utilizando este estuche fue de acuerdo a las instrucciones del fabricante: • El GMP se transfirió electroforéticamente desde un gel de acrilamida al 13.5% a una membrana de nitrocelulosa WestClearTM por 2 h a 100 mAmp con solución de transferencia. • Las membranas se incubaron por 5 min. en una solución de pretratamiento y posteriormente se lavaron. • Se incubaron las membranas por 40 min. a temperatura ambiente con agitación constante, con una solución Western Blot, que contenía los anticuerpos anti-GMP (dilución 1:1,000). • Se lavó la membrana y se desarrolló el blot con la solución ChromoSensorTM One-Solution TMB substrate. Nota: La dilución de los anticuerpos anti-GMP se determinó previamente determinando el título de los mismos, es decir, realizando inmuno blots de GMP con diluciones crecientes de los anticuerpos: 1:500, 1:1,000, 1:2,000, 1:4,000 y 1:8,000. 4.5.1 Análisis de muestras de leche y alimentos procesados Una vez desarrollado el inmuno blot para detectar GMP con los anticuerpos policlonales obtenidos, se determinó el límite de GMP y de suero de quesería que se puede detectar por este método. Para esto se analizaron las siguientes muestras: a) GMP puro en cantidades crecientes. 46 Materiales y métodos b) Leche con concentraciones crecientes de GMP. c) Leche con cantidades crecientes de suero de quesería líquido (SQL). d) Leche con cantidades crecientes de suero de quesería en polvo (SQP). Adicionalmente, se analizaron alimentos procesados que contienen suero de quesería, como fue yogur, suplemento dietético y margarina. El tratamiento al que se sometieron las muestras analizadas fue el siguiente: • 25 ml de las muestras lácteas líquidas se mezclaron con una solución de TCA a una concentración final de 8%, con el fin de precipitar la κ- caseína (Benítez y col. 2001) la cual puede dar reacción cruzada con el GMP. Se dio un segundo tratamiento con TCA a una concentración final de 14% al sobrenadante, para precipitar el GMP (Benítez y col. 2001; Galindo y col. 2006). El precipitado se disolvió en 200 µl de 75 mM Tris HCl, pH 8.0 y se tomaron 20 µl de estas para analizarse finalmente por inmuno blot. • En el caso de la margarina, se disolvieron previamente 2 gr de esta en 3 ml de cloroformo-metanol (2:1) para remover lípidos. Posteriormente el GMP fue solubilizado por adición de agua (Nakano y col. 2007), precipitado por tratamiento de TCA a una concentración final del 14%, disuelto en 20 µl de 75 mM Tris HCl, pH 8 y analizado por inmuno blot. 4.6 Elaboración y validación de un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia. Se desarrolló un sistema ELISA tipo sándwich utilizando el sistema de amplificación biotina-ExtrAvidina donde la ExtrAvidina se encuentra marcada con peroxidasa de rábano (Sigma-Aldrich, Steinheim, Alemania). En esta técnica desarrollada, los anticuerpos anti-GMP se fijaron a una fase sólida y actuaron como anticuerpos de captura del antígeno problema (GMP). Los antígenos fueron reconocidos por los mismos anticuerpos conjugados con la biotina y el complejo 47 Materiales y métodos formado se detectó con un conjugado comercial de ExtrAvidina /peroxidasa (Sigma-Aldrich, Steinheim, Alemania). El desarrollo del sistema ELISA se llevó a cabo en 2 etapas. 1. Estandarización de un sistema ELISA tipo sándwich 2. Validación del método 4.6.1 Estandarización de un sistema ELISA tipo sándwich Para poder desarrollar el sistema ELISA sándwich se necesitó primeramente conjugar los anticuerpos anti-GMP con la biotina. a) Conjugación de los anticuerpos anti-GMP con la biotina Los anticuerpos purificados anti-GMP se conjugaron con un éster de la biotina utilizando el compuesto denominado sulfo-N-hidroxi-succinimida biotinamido caproato (BAC-Sulfo-NHS) (figura 6). Para esto se utilizó un estuche comercial: ImmunoprobeTM Biotinylation (Sigma-Aldrich, Steinheim, Alemania). Posteriormente se separaron los anticuerpos biotinilados de los que no reaccionaron por un proceso de filtración rápida en el que se utilizó una columna de filtración en gel empaquetada con Sephadex. Sulfo-N- hidroxi-succinimida biotinamidocaproato IgG ≥ pH 7.0 biotina IgG biotinilado Sulfo succinimida Figura 6: Biotinilación de anticuerpos con un éster de la biotina, el sulfo-N-hidroxi-succinimida biotinamidocaproato. 48 Materiales y métodos Conjugación de los anticuerpos purificados con la biotina • De acuerdo a las instrucciones del fabricante, se preparó una solución del éster de la biotina en dimetilsulfóxido (DMSO) a una concentración de 1 mg/ml. • Los anticuerpos purificados se disolvieron en PBS de pH 7.2, a una concentración de 0.4 mg/ml. Nota: se recomienda una concentración de anticuerpos de 1 mg/ml, pero la solución de anticuerpos puros anti-GMP tenía una concentración de 0.4 mg/ml. • Se añadió 38 µl de solución de biotina a la del anticuerpo. • La mezcla se incubó durante 30 min a temperatura ambiente. Separación de los anticuerpos marcados con biotina. • Se equilibró la columna de filtración con 30 ml de PBS 0.1 M pH 7.2 (6 x 5 ml) antes de pasar los anticuerpos marcados. • Se aplicó la solución de anticuerpos marcados a la columna. • Se eluyeron los anticuerpos marcados con 9 ml de PBS (9 x 1 ml). Se recolectaron fracciones de 1 ml a los que se les determinó presencia de proteína por medición de absorbancia a 280 nm. • Los anticuerpos marcado quedaron en las fracciones 3, 4 y 5. • Los anticuerpos conjugados, fraccionados en alícuotas de 10 µl, se conservaron a –20° C hasta el momento de su utiliza ción. Determinación del nivel de biotinilación (relación biotina/proteína). La proporción de biotina unida a los anticuerpos se determinó por un ensayo avidina-HABA (4´-hidroxiazobencene-2-ácido carboxílico). La absorción del complejo avidina-HABA a 500 nm disminuye proporcionalmente con el aumento de biotina, debido a que el colorante HABA es desplazado de la avidina debido a la alta afinidad de la biotina por la avidina. • Se diluyeron 0.1 ml de fracción proteica biotinilada con 0.9 ml de PBS y se le determinó absorbancia a 280 nm (“muestra de proteína”). 49 Materiales y métodos • Se incubó 0.1 ml de fracciones proteicas biotiniladas con 10 µl de pronasa (enzima proteolítica) durante 1.5 h a temperatura ambiente o toda la noche a temperatura ambiente (“muestra de biotina”). • Se mezcló 0.1 ml de solución HABA con 3.2 ml de una solución de avidina (“solución avidina-HABA”) • Se calibró espectrofotómetro a 500 nm con una mezcla de 0.9 ml de solución avidina-HABA con 0.1 ml de PBS • Se mezcló 0.9 ml de solución avidina-HABA con 0.1 ml de muestra tratada con pronasa o “muestra de biotina” y se registró la absorbancia de esta a 500 nm. CALCULOS: 1. Determinación de mg y nmols de proteína presente: Proteína (mg/ml) = (A280 x 10 )/ E280 Donde 10 : factor de dilución E: coeficiente de extinción de IgG E280 IgG = 1.4 2. Determinación del número de nmoles de IgG en la muestra nmols/ ml = mg proteína/ml x 106 PM IgG donde 106 : conversión de moles/L a nmoles/ml) PM IgG = 150,000 Da 3. Obtención de A500 corregida: A500 corregida = A 500 avidina-HABA - A 500 biotina 50 Materiales y métodos 4. Concentración de biotina (nmoles/ml): Biotina(nmoles/ml) : (A500 corregida: x 10 x 106 ) E500 Donde 10 : factor de dilución 106 : conversión de moles/l a nmoles/ml E: coeficiente de extinción de avidina-HABA E500 Avidina-HABA = 34,000 ( de una solución 1M de biotina) 5. Relación biotina / proteína: Biotina (nmoles biotina.) Proteína (nmoles proteína) b) = nmol biotina . nmoles IgG Estandarización del sistema ELISA tipo sándwich Soluciones utilizadas 1. Solución de 50 mM carbonato/ bicarbonato pH 9.6 0.1 M Na2 CO3, 0.035 M Na2CO34 pH 9.6 2. Solución de citratos pH 9.6 ácido cítrico 0.05 M, 0.1 M Na2HPO4 pH 5.2 3. PBS pH 7.4 7.5 mMM Na Cl, 0.5 mM Na2HPO4, 0.5 mM NaH2PO4 4. PBS-Tween (PBST : PBS - 0.05%(v/v) Tween 20 51 Materiales y métodos 5. Solución de bloqueo (PBST-BSA : PBST-1% BSA 6. Sustrato (OPD) solución citratos 1.2 ml H2O 4.8 ml ο-fenildiamina (OPD) 1 pastilla de 2 mg (Sigma-Aldrich, Steinheim, Alemania) H2O2 al 30% 6 µl Procedimiento de ELISA sándwich • Se sensibilizaron placas ELISA de 96 pocillos (COSTAR® Cat No 3590, Cambridge,Ma, EUA) con 50 µl por pocillo de anticuerpos policlonales de conejo anti-GMP a una concentración de 1 µg/ml en solución de carbonato /bicarbonato. Las placas se almacenaron a 4° C toda la noche. • Se realizaron 3 lavados de 1 min. a cada uno a los pocillos de la placa con 150 µl de PBST • Se bloquearon las placas con 150 µl de PBST-BSA 30 min. a temperatura ambiente, y posteriormente se vaciaron. • Se preparó una dilución 1:100 del antígeno o de la muestra a analizar (GMP, suero de quesería, leche con suero de quesería procesada, etc.) en solución PBST-BSA, y se añadieron 50 µl de esta solución a cada pocillo. Las placas se mantuvieron a 37° C con agitación durante 1 h. • Se lavaron nuevamente las placas 3 x 1 min. y posteriormente se añadieron 50 µl por pocillo de anticuerpos anti-GMP biotinilados a una concentración de 52 Materiales y métodos 1.3 µg/ml en PBS-T-BSA. Las placas se incubaron por 1 h a 37° C en agitación. • Se conjugaron los anticuerpos biotinilados con ExtrAvidina®- HRP (SigmaAldrich, Steinheim, Alemania), añadiendo para esto 50 µl por pozo de la enzima diluida 1:2,000 en PBS y se incubaron durante 1 h a 37º C con agitación. • Se lavó nuevamente la placa, se agregó a cada pozo 50 µl de sustrato OPD y se mantuvo protegida de la luz por 30 min. (revelado). • Se detuvo la reacción con 50 µl por pocillo de H2SO4 4 N. • Se leyeron las absorbancias a 490 nm en un lector de placas de ELISA (BioRad Modelo 550, CA, EUA). Nota: Las placas se sellaron con una película de plástico adherible. Es importante aclarar que los tiempos y concentraciones que se indican en el procedimiento ELISA son resultado de diferentes ensayos donde se probaron las siguientes variables: 1. Tiempo de incubación de antígeno (1 h a 37° C y toda la noche a 4° C). 2. Tiempo de incubación de anticuerpo conjugado (1.0, 1.5, 2.0, 2.5, 3.0 h). 3. Tiempo de revelado (15, 20, 25, 30, 35, 40, 45, 50, 55 y 60 min.). 4. Concentración de enzima ExtraAvidina® (Dilución 1:1,000, 1:2,000, 1:4,000). 5. Concentración de anticuerpo sin conjugar. 6. Concentraciones de anticuerpo conjugado. 7. Concentración de antígeno. Las últimas tres variables se determinaron mediante titulación, para lo cual el procedimiento fue el siguiente: • Se desarrolló el sistema ELISA usando diferentes concentraciones de los anticuerpos anti-GMP de captura o sin marcar (2, 1, 0.5, 0.25, 0.125, 0.0626 53 Materiales y métodos µg/ml) y diferentes concentraciones de GMP (20, 10, 5, 2.5, 1.25, 0.625 µg/ml). Se hicieron tres réplicas de cada concentración a probar. Se manejó una concentración de anticuerpos anti-GMP biotinilados constante de 1µg/ml. • Se seleccionó la concentración de anticuerpos de captura que dió mejor respuesta y con esta, se desarrolló nuevamente otro sistema ELISA, variando ahora la concentración de los anticuerpos marcados o de detección (2, 1.33, 1, 0.5, 0.25, 0.125, 0.625 µg/ml) la concentración del antígeno (20, 10, 5, 2.5, 1.25, 0.625 µg/ml). • Se eligió la concentración de antígeno que dió mejor respuesta o resultado. • Se llevó a cabo un sistema ELISA utilizando la concentración de mejor respuesta tanto del antígeno como del anticuerpo sin conjugar. Se utilizaron concentraciones variables del anticuerpo marcado (2, 1.33, 1, 0.5, 0.25, 0.125, 0.625 µg/ml). • Finalmente, se seleccionó la concentración de anticuerpos marcados que dió mejor respuesta. 4.6.2 Validación del ensayo a) • Curva estándar para detectar suero de quesería por ELISA Se preparó una curva estándar mediante análisis de leche con concentraciones conocidas de suero líquido (0.0%, 0.25%, 0.5%, 1.0%, 2.5%, 5.0 %, 10,0% y 20% v/v). Cada concentración se analizó por triplicado. • Cada curva estándar se hizo por triplicado, durante 3 días consecutivos. Para validar el método ELISA sándwich para detectar suero de quesería en leche, se determinaron los siguientes parámetros: precisión, reproducibilidad, límite de detección y límite de cuantificación. 54 exactitud, Materiales y métodos b) • Precisión Se realizaron 12 mediciones de una bebida láctea sin suero de quesería o sin GMP al que se le adicionó un 10% (v/v) de suero de quesería. • Las muestras se procesaron con TCA a 8% de concentración final, como se describió anteriormente (apartado 3.5.1). • Se determinó la concentración experimental promedio, la desviación estándar, el coeficiente de variación y el intervalo de confianza. c) • Exactitud: Se realizó la prueba de t de Student a los valores obtenidos en la prueba de precisión. d) • Reproducibilidad: Se realizaron mediciones de una bebida láctea sin suero de quesería o sin GMP al que se le adicionó un 10% (v/v) de suero de quesería. • Las mediciones se realizaron por triplicado durante 9 días diferentes por dos analistas. De los datos obtenidos se determinó la F experimental: F = [ (n( Yprom - µo)2 / (Σ (Yprom -Yi)2 ] (n – 1) Donde: n: es el número total de determinaciones. Yprom : es la media de los resultados obtenidos. µo : es la media teórica. Yi: son los valores individuales de los resultados obtenidos (% de suero de quesería obtenido) . 55 Materiales y métodos e) Límite de detección (LD) y cuantificación (LC): El límite de detección o concentración mínima detectable y el límite de cuantificación se calcularon a través de mediciones de muestras blanco, es decir de muestras de leche sin GMP y sin suero de quesería. Se aplicó la siguiente fórmula (ICH, guideline Q2, 2000). Límite de detección LD = Límite de cuantificación LC = 3.3 SD S 10 SD S Donde SD = la desviación estándar de la respuesta obtenida (concentración) del blanco y S es igual a la pendiente de la curva de calibración. f) Especificidad: La especificidad del método se hizo mediante estudios de reactividad cruzada. Para esto, se analizaron 2 productos lácteos industrializados que no contienen suero de quesería: bebida láctea marca1, bebida láctea marca2, las cuales se procesaron con TCA a 8% de concentración final, como se describió anteriormente (apartado 3.5.1) y se analizaron por ELISA por cuadruplicado. 56 5. RESULTADOS 5.1 Aislamiento y purificación del GMP de suero de leche El método que resultó mejor para la obtención de GMP fue el de la precipitación con etanol y ultrafiltración, pues con este, según el análisis electroforético realizado, se obtuvieron dos bandas proteicas de 14 y 20.1 kDa de PM (figura 7) los cuales coinciden con los resultados obtenidos en la electroforesis del GMP comercial puro (control positivo) (figura 8) y con los PM que reportan Mikkelsen y col. (2006) para este mismo compuesto. En el análisis de la muestra de GMP obtenido por fraccionamiento con TCA, además de estas dos bandas proteicas, se obtuvieron 3 adicionales, con PM de 30, 45 y 66 kDa. La leche cruda sometida a tratamiento con TCA al 8% y posterior tratamiento con TCA al 14%, no mostró ninguna fracción proteica. kDa 66 45 30 20.1 14 a b c d Figura 7: Análisis electroforético de GMP obtenido por dos diferentes métodos. Geles de electroforesis Tris-glicina teñidos con plata. a) GMP obtenido con TCA; (b) GMP obtenido por precipitación de etanol y ultrafiltración.; (c) leche cruda tratada con doble tratamiento de TCA (control negativo de GMP); (d) suero de quesería sin tratar (control positivo de GMP). Las flechas indican las bandas proteicas del GMP. 57 Resultados En el análisis electroforético de suero de quesería sin tratar, se observaron varias bandas proteicas, entre las que se aprecian una fracción de 14 y otra de 20.1 kDa. kDa 20.1 14 GMP comercial GMP obtenido Figura 8: Análisis electroforético de GMP obtenido y comercial. Gel de electroforesis Trisglicina teñidos con plata. (a) GMP comercial (Arla Foods, Amba, Viby, Dinamarca) (b) GMP obtenido por precipitación de etanol y ultrafiltración. Las flechas indican las bandas proteicas del GMP. El rendimiento o porcentaje de GMP obtenido respecto a las proteínas presentes en el suero de quesería utilizado fue de 30%. La detección de GMP por electroforesis con SDS-PAGE se hizo con concentraciones de poliacrilamida al 13.5 y 16%, dando mejor resultado la primera, ya que obtuvo una mejor separación y resolución de las bandas proteicas. Con la tinción con plata se logró visualizar bien a este péptido en los geles. 58 Resultados 5.2 Obtención de anticuerpos policlonales específicos contra el GMP En los análisis de GMP mediante inmuno blots con los antisueros obtenidos tras las sucesivas inmunizaciones, se obtuvieron dos bandas proteicas de PM de 14 y 20.1 kDa, que son los que corresponden al PM del GMP (Mikkelsen, 2006) lo que confirma la producción de anticuerpos contra este péptido. Estas fracciones proteicas fueron más intensas en las últimas inmunizaciones en comparación con las primeras, lo que sugiere que se incrementó la producción de anticuerpos con las inmunizaciones sucesivas (figura 9b y 9c). El inmuno blot desarrollado con el suero preinmune no mostró ninguna banda de proteína, indicando esto la ausencia de anticuerpos frente al GMP (figura 9 a). En el caso de inmuno blots de muestras de leche sin adulterar (control negativo del GMP), los antisueros no detectaron ninguna banda proteica (figura 9) kDa 20.1 14 L GMP (a) L GMP (b) L GMP (c) Figura 9: Inmno blots para verificar producción de anticuerpos anti-GMP con los antisueros obtenidos de los conejos. L:, 10 µl de leche procesada sin suero de quesería (control negativo de GMP); GMP: 20 µg de GMP puro. Las membranas se incubaron con (a) suero preinmune; (b) suero de la 1ª extracción; (c) muestra de suero de 2ª extracción. La dilución del suero fue 1:500. 59 Resultados Por medio de inmuno blots se comprobó que todos los animales inmunizados con GMP produjeron anticuerpos contra este péptido en una cantidad similar según se apreció por la intensidad de las bandas proteicas obtenidas (figura10). kDa 20.1 14 L GMP antisuero de conejo 1 L GMP L GMP antisuero de conejo 3 antisuero de conejo 2 L GMP antisuero de conejo 4 Figura 10: Inmno blots para verificar producción de anticuerpos anti-GMP por los diferentes conejos. Las muestras se incubaron se incubaron con antisuero de 4 diferentes conejos inmunizados. L: 10 µl de leche procesada sin suero de quesería (control negativo de GMP); GMP: 20 µg de GMP puro. Dilución del suero 1:500. 5.3 5.3.1 Determinación de la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP Pureza En la electroforesis de la muestra de suero sin purificar, se observó una fracción proteica mayoritaria de gran tamaño (figura 11a) con PM aproximado a 66 kDa. Una vez que esta banda proteica se eliminó con el sulfato de amonio, en todas las demás muestras obtenidas del proceso de purificación, se observaron dos fracciones proteicas, una de PM aproximado a 23 kDa y otra de 50 kDa 60 Resultados (figura 11). Estas dos bandas son únicas en la muestra procedente de la última etapa de purificación que fue la cromatografía de afinidad. En la muestra tratada sólo con sulfato de amonio y ácido caprílico, destaca una banda de PM aproximado de 70 kDa que desaparece al someter al antisuero a cromatografía de afinidad. Tabla 3: Porcentaje de proteína recuperada en muestras de anticuerpos anti-GMP en diferentes etapas de purificación Muestra Proteína (mg/ml) a) Antisuero GMP sin purificar % Proteína 71 b) Suero tratado con sulfato de amonio 29.9 42.15 c) Suero tratado con sulfato de amonio y ácido 5.8 8.17 0.44 0.62 caprílico d) Muestra c purificada por inmunoafinidad kDa 70 * 66 44 30 20 . a . . c B d Figura 11. Análisis electroforético para ver pureza de anticuerpos policlonales anti-GMP en diferentes etapas de purificación. Gel de electroforesis Tris-glicina teñidos con plata. Se analizaron 10 µl de muestras de antisuero anti- GMP en cada etapa (a) muestra sin purificar; (b) muestra tratada son sulfato de amonio; (c) muestra b tratada además con ácido caprílico; (d) muestra c purificada por inmunoafinidad. Las flechas cortas indican las bandas proteicas mayoritarias de 23 y 50 kDa de PM. Las flechas largas indican la banda de 70 kDa y el * señala la fracción de 66 kDa. 61 Resultados 5.3.2 Reactividad y Especificidad a) Reactividad Se analizaron mediante SDS-PAGE muestras de GMP puro y posteriormente se probaron por inmunoblot los anticuerpos policlonales anti-GMP obtenidos en cada etapa de purificación. Los antisueros resultantes de las tres etapas de purificación detectan dos bandas de 20.1 y 14 kDa, correspondientes a las descritas para el GMP. No se aprecian variaciones en la intensidad de las bandas obtenidas. kDa 20.1 14 GMP GMP GMP GMP a b c d . Figura 12. Inmuno blot para probar reactividad de los anticuerpos policlonales anti-GMP de conejo, con diferentes etapas de purificación. Se desarrolló inmunoblot de 20 µg de GMP con muestras de los antisueros anti-GMP: (a) sin purificar, (b) tratado con sulfato de amonio; (c) tratado con (NH4)2SO4 y ácido caprílico; (d) antisuero c purificado por inmunoafinidad. Los antisueros se utilizaron a una dilución de 1:500. b) Especificidad La figura 13 muestra que los anticuerpos policlonales resultantes tras el proceso completo de purificación detectan 3 bandas proteicas, de 45, 20.1 y 14 kDa en muestras de suero de quesería. Las bandas de 20.1 y 14 kDa 62 Resultados corresponden a las observadas en muestras de GMP puro, el inmunógeno original. Las bandas no aparecen en muestras de leche sin adulterar. kDa 45 30 20.1 14 M L GMP SLQ Figura 13. Inmuno blot para probar especificidad de los anticuerpos policlonales anti-GMP de conejo. Se desarrolló inmuno blot de: L: 10 µl de leche procesada sin suero (control negativo); GMP: 10 µg de GMP puro; SLQ: 10 µl de suero líquido de quesería; M: marcador de PM. Los anticuerpos policlonales anti-GMP se usaron a una dilución de 1:1,000. 5.4 Desarrollo de un método mediante inmuno blot para detectar GMP. Con el estuche para Western blot de un solo paso y los anticuerpos policlonales anti-GMP purificados, se logró detectar GMP mediante inmuno blot en un tiempo total de 4.5 h. 5.4.1 Análisis de muestras de leche y alimentos procesados El inmuno blot con anticuerpos anti-GMP detectó 0.1 µg de GMP puro (figura 14a) y una concentración de hasta 0.001% (p/v) de este péptido puro 63 Resultados adicionado a la leche (figura 14b) que correspondería aproximadamente a un 0.6 % (v/v) de suero (Etzel, 2004). Cuando el GMP se adicionó a la leche y posteriormente las muestras se procesaron para remover la κ-caseina, no hubo modificación en las bandas visualizadas de GMP (figura 14b). La banda de 20.1 kDa fue siempre más intensa que la de 14 kDa y cuando la concentración de GMP se redujo, la última desaparece. Para identificar directamente suero de quesería en leche, se analizaron muestras de leche adulterada con suero de quesería líquido o en polvo (figura 15). La incubación de las membranas con los anticuerpos policlonales mostró tres bandas de 45, 20.1 y 14 kDa. Cuando la concentración de suero era baja, solamente se visualizó el GMP formando polímeros de PM 20.1 kDa. Se usaron muestras de leche no adulterada y GMP como controles negativo y positivo, respectivamente. El límite más bajo de suero líquido detectado en leche fue de hasta 0.5% (v/v) (figura 15a) y de hasta 0.001% (p/v) de suero de quesería en polvo (figura 15b). En la tabla 4 se muestran en resumen los límites de detección obtenidos para GMP puro y suero de quesería, mediante inmunoblot con los anticuerpos policlonales anti-GMP. Tabla 4. Límites de detección de GMP puro y de suero de quesería, mediante inmuno blots utilizando anticuerpos policlonales anti-GMP. Muestra Límite de detección 0.100 µg GMP puro GMP en leche 0.001% p/v Suero de quesería líquido en leche 0.50 % v/v Suero de quesería sólido en leche 0.001% p/v 64 Resultados kDa a 45 30 20.1 14 L 0.05 0.10 0.25 0.50 0.75 1.0 2.0 4.0 6.0 8.0 Cantidad de GMP (µ µg) b kDa 45 30 20.1 14 L 0.0005 0.001 0.0025 0.005 0.01 % de GMP en leche (p/v) Figura 14. Límite de detección de GMP mediante análisis inmuno blot usando anticuerpos policlonales antiGMP. (a) Cantidades crecientes de GMP; (b) Leche con concentraciones crecientes de GMP. Los anticuerpos se usaron a una dilución de 1:1,000; L: 10 µl de leche procesada sin suero (control negativo). Las flechas indican las bandas de PM características del GMP. 65 Resultados kDa a 45 30 20.1 14 0.25 0.5 1.0 2.0 5.0 L GMP % suero en leche (v/v) b kDa 45 30 20.1 14 L 0.0005 0.001 0.005 0.010 0.025 GMP % suero en leche (p/v) Figura 15. Análisis inmuno blot de muestras de leche adulterada con concentraciones crecientes de (a) suero líquido o (b) suero en polvo, usando anticuerpos policlonales anti-GMP purificados y diluidos 1:1,000; L: 10 µl de leche procesada sin adulterar (control negativo); GMP: 10 µg de GMP (control positivo). Las flechas indican las bandas de PM características del GMP en suero de quesería. 66 Resultados Se usaron los anticuerpos policlonales para identificar GMP mediante análisis inmuno blot en alimentos comerciales con suero de quesería. En la margarina se identificaron tres bandas proteicas de 45, 20.1 y 14 kDa de PM. En el suplemento dietético y yogur, solamente el agregado de 20.1 kDa fue detectado (figura 16). kDa 45 30 20.1 14 L SD MA YO GMP Figura 16. Análisis inmuno blot de diferentes alimentos comerciales con suero de quesería usando anticuerpos policlonales anti-GMP diluidos 1:1,000. L: 10 µl de leche procesada sin suero (control negativo); SD: 10 µl de suplemento dietético procesado; MA: 5 µl de margarina procesada; YO: 10 µl de yogur procesado; GMP: 10 µg de GMP puro (control positivo). 67 Resultados 5.5 Elaboración y validación un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia 5.5.1 Estandarización de un sistema ELISA tipo sandwich En la conjugación de los anticuepos anti-GMP con la biotina, la relación de biotina/ proteína conseguida fue de 2.4 nmol de biotina por cada nmol de proteína. Las condiciones que se estandarizaron para detectar GMP como indicador de la presencia de suero de quesería, utilizando anticuerpos policlonales de obtención propia en un sistema ELISA tipo sándwich se muestran en la tabla 5. Tabla 5. Condiciones óptimas para desarrollar sistema ELISA tipo sándwich en la detección de GMP utilizando anticuerpos policlonales anti-GMP. Reactivo Anticuerpo de captura (sin marcar) Anticuerpo de detección (conjugado) Enzima Peroxidasa ExtrAvidina® Sustrato de enzima: OPD (ο-fenildiamina) Concentración Condiciones de incubación 1 µg/ml Toda la noche 4° C 1.33 µg/ml 1 h a 37°C Dilución 1:2,000 1 h a 37° C 1 tableta 2 mg 30 min. T ambiente Para el antígeno (GMP o suero de quesería) que es parámetro a detectar, el tiempo de incubación fue de 1 h a 37° C. 5.5.2 Validación del ensayo a) Curva estándar para detectar suero de quesería por ELISA Con relación a la curva estándar para detectar suero de quesería en leche bovina (figura 17), se observó que los valores de absorbancia aumentan proporcionalmente con la concentración en un rango de 0- 20% v/v. Cada punto de la gráfica corresponde a la media de los resultados de tres análisis diferentes realizadas durante tres días. 68 Resultados y = 0.143106x + 0.550140 Y = 20.550140 + 0.143106X R = 0.994 R-Sq = 99.4 % Absorbancia 0.75 0.65 0.55 0.45 -0.5 0.0 0.5 1.0 1.5 Log (% suero) Figura 17. Representación lineal de la curva estándar en el ELISA sándwich de suero de quesería. Dilución de los anticuerpos de captura 1:100 y de los anticuerpos de detección 1:75. Dilución del conjugado ExtrAvidina peroxidasa 1:2000. b) Precisión: Las 12 muestras de producto lácteo con 10% de suero de quesería que se analizaron por ELISA dieron los resultados que se muestran en la tabla 6. Tabla 6. Porcentaje de suero de quesería detectado en productos alimenticios a los que se les adicionó 10% de suero de quesería. Muestra 1 2 3 4 5 6 %suero 10.79 10.29 9.34 10.12 8.62 9.80 Muestra 7 8 9 10 11 12 69 %suero 10.12 9.80 9.04 9.96 9.80 9.96 Resultados De estos datos se obtuvieron los siguientes valores: Concentración experimental promedio: 9.79% Desviación estándar: 0.576 Coeficiente de variación: 5.9 Xmáxima = 10.79 Xmínima = 8.62 Intervalo de confianza ±0.326 %(v/v) de suero lo que equivale a un 3.62 % de este intervalo de confianza. c) Exactitud: En la prueba de t de Student se obtuvo un resultado de 1.263. d) Reproducibilidad De las muestras a las que se añadió 10% de suero de quesería, analizadas por dos personas diferentes durante 9 días se obtuvieron los resultados que se muestran en la tabla 7. Tabla 7. Porcentaje de suero de quesería detectado por dos analistas diferentes en productos alimenticios a los que se les adicionó 10% de suero de quesería. Día % suero obtenido por analista 1 % suero obtenido por analista 2 1 2 3 4 5 6 7 8 9 9.64 10.79 9.33 9.79 8.89 9.79 10.44 10.11 8.89 9.79 10.28 8.75 10.28 10.61 10.44 9.95 9.33 9.04 De los datos de la tabla 7 se obtuvo un valor F de 0.007 70 e) Límite de detección y de cuantificación Del análisis de los datos obtenidos se tuvo un límite de detección de 0.10% (v/v) de suero de quesería y un límite de cuantificación de 0.29% (v/v). f) Especificidad: Los productos lácteos industrializados sin suero de quesería que se analizaron no dieron respuesta alguna. 71 6. DISCUSIONES 6.1 Aislamiento y purificación del GMP de suero de leche El objetivo principal de este trabajo fue desarrollar un sistema ELISA para detectar adulteración de leche con suero de quesería. Para esto se requerían anticuerpos específicos contra un componente exclusivo del suero de quesería, como es el caso del GMP. La obtención de este péptido de manera comercial era difícil, razón por la que se decidió separarlo y purificarlo a partir de suero de leche en polvo. Son numerosas las técnicas para la extracción y purificación de GMP, sin embargo, entre las más utilizadas, se encuentra la de fraccionamiento con ácido tricloro acético (TCA) (Olieman, 1983) y la de precipitación con etanol y ultrafiltración (Brody, 2000). Al analizar por electroforesis y tinción con plata las muestras resultantes de ambas técnicas de purificación se comprobó que la precipitación con etanol y ultrafiltración generó GMP puro, ya que se obtuvieron 2 fracciones proteicas de 26.1 y 14 kDa de PM que se corresponden con las observadas al analizar muestras de GMP comercial. Sin embargo, en la purificación con TCA además de las fracciones proteicas características del GMP, se observaron 3 bandas adicionales, lo que indica un menor grado de pureza en la muestra obtenida. Con esto también quedó demostrada la identidad del compuesto purificado. Se ha señalado ya por otros autores (Kawasaki y col., 1992; Brody y col., 2000; Galindo y col., 2006) que el GMP como un monómero tiene un peso molecular de 6.8 kDa sin considerar la porción glucosídica. Sin embargo, este péptido forma agregados, de manera que se originan dímeros, trímeros, tetrámeros, etc. Este hecho explica la presencia de GMP con diferentes pesos moleculares. El mecanismo de agregación no es conocido, ni está claro por qué el GMP no se disocia en presencia de SDS. Se ha mencionado que el SDS se une a 72 Discusiones la porción proteica de la molécula del péptido GMP, y evita las interacciones hidrofóbicas con otras moléculas de GMP, pero las cadenas glicosiladas de diferentes moléculas de GMP pueden interactuar a través de puentes de hidrógeno, lo que resulta en mayores pesos moleculares de este péptido (Galindo y col., 2006). Para detectar GMP por electroforesis y tinción con plata, debido al bajo PM reportado para este péptido como monómero, se realizaron electroforesis con acrilamida al 16 y 13.5%. Se obtuvieron mejores resultados al analizar el GMP con la menor concentración de acrilamida (13.5%), debido a la formación del polímero por las moléculas de GMP, obteniéndose el patrón característico de bandas proteicas de 14 y 21.5 kDa de PM al analizar el GMP comercial. Los geles se visualizaron mediante tinción con plata, la cual se seleccionó por el mejor nivel de detección que se reporta que tiene (menos de 1 nanogramo), en comparación con otros métodos (Crester y col. 2001). 6.2 Obtención de anticuerpos policlonales específicos contra el GMP En lo referente a la obtención de anticuerpos específicos contra el GMP, se utilizaron conejos ya que estos son los animales más empleados en la obtención de anticuerpos policlonales, porque son de fácil manejo y mantenimiento, generan un buen volumen de suero y responden bien a una gran variedad de antígenos. Para la inducción de los anticuerpos anti-GMP se utilizó GMP comercial. En las inmunizaciones, además del GMP se utilizó adyuvante de Freund para inducir una fuerte respuesta de anticuerpos. La acción de los adyuvantes es debida a que incorpora dos componentes: (1º) sustancia diseñada para formar un depósito protector al catabolismo rápido del antígeno, de tal forma que ayuda a que la respuesta de anticuerpos sea más persistente y (2º) componente que estimula la respuesta inmune en forma inespecífica; estos actúan aumentando el nivel de un gran número de péptidos conocidos como linfocinas que estimulan la actividad de 73 Discusiones células procesadoras de anticuerpos y causan una reacción inflamatoria en el sitio de inyección. El adyuvante de Freund es uno de los mejores para estimular una respuesta fuerte y prolongada, con la desventaja de que puede producir granulomas muy agresivos y persistentes (Harlow y Lane, 1988; Rojas, 2001). Como recomendación general basada en estudios anteriores, Harlow y Lane (1988) recomiendan utilizar una dosis de 0.5 – 1.0 mg de antígeno en cada inmunización para conejos, lo que justifica la cantidad de GMP (1 mg) que se inyectó en este trabajo. Se extrajo sangre entre los 10 y 14 días posteriores a cada inmunización para probar la producción de anticuerpos, ya que en este tiempo se da el máximo título de anticuerpos. Así mismo, se inyectaron dosis de refuerzos para incrementar la producción de anticuerpos, pues las respuestas primarias generalmente son muy débiles y predominan las Ig de isotipo IgM, primeras inmunoglobulinas que se producen tras una respuesta inmune. La respuesta a inyecciones subsecuentes es cuantitativa y cualitativamente diferente ya que la producción de anticuerpos se incrementa exponencialmente después de la 2ª inyección y hay un incremento en la producción de imunoglobulinas de isotipo IgG (Harlow y Lane, 1988). Esto último justifica el que las dos bandas proteicas de GMP que se observaron en los inmunoblots del GMP, aumentaran de intensidad al utilizar los antisueros provenientes de extracciones con mayor número de refuerzos. A diferencia de los inmuno blots con los antisueros anti-GMP, con el suero preinmune no se detectaron bandas proteicas al analizar muestras de GMP, indicando con esto que en los animales antes de la inmunización no había anticuerpos presentes contra este péptido, ni cualquier otro anticuerpo que diera reacción cruzada con el GMP y quedando así demostrado que si hubo inducción de la producción de anticuerpos específicos anti-GMP. 74 Discusiones Los anticuerpos policlonales anti-GMP se purificaron en tres etapas: la primero utilizando sulfato de amonio para posteriormente dar un tratamiento con ácido caprílico y finalmente se hizo un último paso de purificación por inmunoafinidad. La precipitación selectiva de las inmunoglobulinas con sulfato de amonio es el método más utilizado en la separación de las proteínas de sus soluciones y, en particular, en la separación de los anticuerpos o inmunoglobulinas del inmunosuero total. El fundamento de la técnica es que al añadir elevadas concentraciones de iones fuertemente cargados, como amonio o sulfato, a una solución en la que las proteínas se encuentran unidas a las moléculas de agua formando puentes de hidrógeno, los iones de amonio y de sulfato compiten con las moléculas proteicas por el agua, y así las proteínas, pierden su unión con las moléculas de agua, disminuyendo su solubilidad y precipitan (Harlow y Lane, 1988; González, 1994). La causa por la que precipita únicamente ciertos tipos de proteínas depende del número y posición de grupos polares, del peso molecular de la proteína, del pH de la solución y de la temperatura en la cual se lleva a cabo. La precipitación de anticuerpos con sulfato de amonio, depende de la especie animal en la que se han producido. En el caso de los anticuerpos de conejo, estos precipitan con un 40-50% de solución saturada, que son las concentraciones que se utilizaron en este trabajo (Harlow y Lane, 1988). La purificación parcial de los inmunosueros por precipitación con sulfato amónico presenta las siguientes ventajas: a) La solución de sulfato amónico, a valores de saturación, presenta una molaridad suficientemente elevada como para producir la precipitación de casi todas las proteínas, a las que protege frente a la desnaturalización previniendo además el crecimiento microbiano. b) Es un método económico, sencillo y aplicable a volúmenes grandes de suero. c) Es útil para la concentración y purificación de anticuerpos de cualquier especie. 75 Discusiones d) Minimiza las interacciones inespecíficas entre los anticuerpos y determinados metabolitos o sustancias cuya superficie posee una configuración molecular similar a la de los epítopos del antígeno a analizar (Harlow y Lane, 1988; González, 1994). Sin embargo, el sulfato de amonio presenta la desventaja de que los anticuerpos que se obtiene no son puros, ya que estarán contaminados con proteínas de alto peso molecular y proteínas que quedan atrapadas en precipitados de grandes floculos. Por esta razón es conveniente combinar la precipitación con sulfato de amonio con otro método de purificación. En este caso el método que se eligió fue el uso de ácido caprílico. El uso del ácido caprílico para purificar anticuerpos, se justifica por el hecho de que en condiciones ligeramente ácidas, la adición de ácidos grasos de cadena corta, tal como este ácido, precipita a la mayoría de las proteínas del suero, con excepción de las moléculas de IgG (Harlow y Lane, 1988). Una vez que los anticuerpos se purificaron parcialmente con sulfato de amonio y ácido caprílico, se procedió a purificarlos por inmunoafinidad. Esta purificación se basa en la interacción específica entre dos moléculas que son: antígeno-anticuerpo y es una de las técnicas más utilizadas para la purificación de proteínas. Bajo condiciones apropiadas puede llevarse a cabo en un solo paso. La columna que se utilizó fue una columna cromatográfica de Sepharosa activada con NHS (N-hidroxisuccinimida) que está diseñada para el acoplamiento covalente del ligando (GMP en este caso) a través de sus grupos de amina primarias. Al momento de hacer pasar la solución de anticuerpos por la columna, quedaron unidos a esta los anticuerpos específicos por el GMP. Los factores que influyen en el éxito de la purificación son: la pureza del antígeno (GMP en este caso), la velocidad de flujo con que se suministran las muestras y la concentración de proteína (anticuerpos). 76 Discusiones La ventaja de esta técnica de purificación por afinidad, es que permite separar anticuerpos específicos de una mezcla. Sin embargo, tiene limitadas aplicaciones en el caso de los anticuerpos policlonales como son: a) Utiliza condiciones severas (como cambios bruscos de pH) para eluir los anticuerpos cuando están unidos y esto puede dañar y/o desnaturalizar los anticuerpos y a los antígenos de la columna. b) Generalmente los anticuerpos policlonales se unen a numerosos sitios en un antígeno, presentando por ello gran avidez, lo que hace que la elución de los anticuerpos sea difícil. Al realizar un análisis electroforético de las muestra obtenidas durante las etapas de purificación a las que se sometió el antisuero y compararlas con una muestra sin purificar, se observó que el número de fracciones proteicas diminuyeron conforme se avanzó en el proceso de purificación. Estos resultados coincidieron con los obtenidos en la cuantificación de proteínas totales por análisis de Bradford. En relación a estos últimos análisis se observó que conforme se avanza en la etapa de purificación, la concentración de proteína disminuye, lo que es lógico por las proteínas que se van eliminando en cada etapa de purificación, sin embargo, esto no significa que la cantidad presente de anticuerpos IgG disminuya, lo que se demostró mediante los inmuno blots, pues como se mencionó anteriormente la respuesta de los anticuerpos de cada etapa de purificación frente al GMP dieron igual respuesta, pues se apreció igual intensidad de las bandas proteicas observadas. 6.3 Determinación de la pureza, reactividad y especificidad de los anticuerpos policlonales anti-GMP La justificación de haber hecho el análisis por electroforesis desnaturalizante para determinar la pureza de los anticuerpos, es porque este es un método sencillo que permite además de separar bien las cadenas ligeras y pesadas de los anticuerpos, detectar la presencia de algunas otras fracciones proteicas. 77 Discusiones Si las fracciones obtenidas de anticuerpos están puras, se esperaría obtener polipéptidos de entre 22-25 y 50-55 kDa, que correspondería a las cadenas ligeras y pesadas de las IgG respectivamente. En el análisis electroforético de la muestra de anticuerpos sin purificar, se observó una gran fracción de proteína de PM aproximado a 66 kDa, la cual por el PM y por la concentración en que se encontraba, probablemente corresponda a la albúmina. En las muestras tratadas con sulfato de amonio y las tratadas con ácido caprílico, mostraron entre las bandas obtenidas, una de PM aproximado a 70 kDa la cual puede corresponder a las cadenas pesadas de las IgMs cuyo PM está reportado entre 70-75 kDa. Las bandas proteicas que se observaron en todas las etapas de purificación, de PM aproximado a 23 y 50 kDa, corresponderían a las cadenas ligeras de los anticuerpos cuyo peso molecular es entre 20 a 25 kDa y a las cadenas pesada de las IgG, cuyo PM es de 50-55 kDa. Estas dos bandas proteicas fueron únicas en la muestra procedente de la purificación por inmunoafinidad, lo que confirma la pureza de la solución de anticuerpos policlonales obtenidos. Respecto a la reactividad frente al GMP de los anticuerpos policlonales obtenidos en cada etapa del proceso de purificación, quedó demostrado mediante inmuno blot que la capacidad de unión de estos no cambia, según se apreció en la intensidad de las bandas proteicas obtenidas (figura 12), que en todos casos fueron iguales. La técnica del inmuno blot que se utilizó para ver la producción y reactividad de los anticuerpos policlonales, es muy eficiente, pues aunque el SDS desnaturaliza a algunos antígenos irreversiblemente en la electroforesis SDSPAGE según describen algunos autores (Reynolds, 1970; González 1994), la reacción del antígeno con los anticuerpos policlonales no se impide debido a que estos reaccionan frente a muchos epítopos de la molécula antigénica (Harlow y Lane, 1988). 78 Discusiones Con relación a la especificidad de los anticuerpos anti-GMP obtenidos, esta quedó demostrada mediante análisis inmuno blots realizados con muestras procesadas de leche sin suero, las cuales no dieron reacción alguna con los anticuerpos, pues no se observó ninguna banda proteica, indicando así que no hay reactividad cruzada con otros componentes de la leche, por lo tanto no hay posibilidad de obtener resultados falsos positivos. Este hecho aumenta la veracidad de la prueba para determinar adulteración de leche con suero de quesería. En el análisis de las muestras de suero analizadas se observaron tres fracciones proteicas de 45, 20.1 y 14 kDa, las cuales se pueden decir que es GMP en diferentes estados de agregación, pues como se mencionó con anterioridad, en este péptido las cadenas glucosídicas de las diferentes moléculas de GMP pueden interactuar a través de enlaces por puentes de hidrógeno, lo que trae como resultado masas moleculares mayores para este compuesto (Galindo y col., 2006). Las bandas de 20.1 y 14 kDa corresponden a las observadas en muestras de GMP puro, el inmunógeno principal. 6.4 Desarrollo de un método mediante inmuno blot para detectar GMP Mediante el sistema inmuno blot, se desarrolló un método fácil, rápido, sensible y específico para detectar GMP como índice de adulteración de la leche con suero de quesería. Con este ensayo se detectó exitosamente GMP en leche adulterada con suero líquido o suero en polvo. Este método se desarrolló usando anticuerpos policlonales anti-GMP los cuales reconocieron dos bandas proteicas de 14 y 20.1 kDa características del GMP puro. Cuando se analizó suero de quesería, se visualizó una banda más de 45 kDa de PM. Ya se mencionó con anterioridad que el GMP como monómero tiene un PM de 6.8 kDa, sin considerar la porción glicosídica, pero se ha demostrado que este péptido forma agregados originando dímeros, trímeros, tetrámeros, etc. (Galindo y col., 2006). Este hecho 79 Discusiones explica la identificación del GMP con bandas de diferentes pesos moleculares. En este trabajo, los agregados de GMP de 20.1 kDa son más abundantes que los de 14 y 45 kDa, tanto en GMP puro como en suero de quesería. La sensibilidad del inmunoensayo para detectar suero de quesería fue mayor que la que se reporta para otros métodos, por cromatografía en fase reversa Olieman y Van Riel (1989) detectaron hasta 0.8% (p/v) de suero en polvo, mientras que en este trabajo se obtuvo un límite de detección de 0.001% (p/v) de suero deshidratado. Usando HPLC, Galindo y col. (2006) detectaron hasta 1% (v/v) de suero de quesería líquido en leche. Para realizar este análisis es necesario purificar previamente GMP y esto requiere al menos 6 h. Mediante inmuno blots se detectó hasta 0.5 % (v/v) de suero de quesería en 4.5 h. Además, el equipo de HPLC es más complejo y caro que el inmuno blot desarrollado en este trabajo. Por lo tanto, el método inmuno blot para detectar GMP por anticuerpos policlonales anti-GMP resultó ser un método más sencillo, rápido, más sensible y menos caro. Otra ventaja del método inmuno blot es su especificidad para detectar GMP, mientras que en otros métodos tales como HPLC y SDS-PAGE, no es definitiva la identificación del GMP, debido a péptidos de peso molecular similar al GMP que pueden estar presentes en la leche por acción de micoorganismos psicrófilos (Alcázar y col. 2000). Estos pueden dar resultados falsos positivos en el análisis de leche. El análisis inmuno blot detectó exitosamente GMP en alimentos comerciales que contiene suero de leche, tales como suplemento dietético, yogur y margarina. Actualmente, el GMP se usa como un alimento nutraceútico por sus propiedades nutricionales y biológicas tales como: estimulante de las bifidobacterias, fuente de ácido siálico, actividad antiviral y modulador de las secreciones gástricas (Brody, 2000). La digestión del GMP da origen a otros péptidos bioactivos que poseen actividad antitrombótica (Chabance y col., 1995). En el presente, han salido al mercado alimentos novedosos que dicen contener GMP por sus propiedades 80 Discusiones nutraceúticas, el análisis mediante inmuno blot desarrollado en este trabajo, podría usarse para identificar la presencia de este péptido como un control de calidad. 6.5 Elaboración y validación un sistema ELISA para la detección de GMP utilizando anticuerpos policlonales de obtención propia. El sistema ELISA que se eligió para este trabajo fue el tipo sándwich debido a que esta es una de las técnicas con mayor aplicación en el análisis de los alimentos por su gran especificidad y sensibilidad, en comparación con otras variantes de ELISA. La especificidad de esta técnica se atribuye a la utilización de anticuerpos específicos (anticuerpos de captura), que se adsorben a los pocillos de las placas capturando los antígenos de la muestra frente a los que se obtuvieron. Por otro lado, la conjugación de la biotina con los anticuerpos de detección y su revelado con avidina o estreptavidina amplifica la respuesta inmunológica, aumentando la sensibilidad. Esto se debe a que al encontrarse las inmunoglobulinas unidas a muchas moléculas de biotina, el conjugado de estreptavidina-peroxidasa encuentra más lugares de anclaje a los anticuerpos que cuando se utilizan como conjugado los anticuerpos anti-inmunoglobulinas de especie marcadas con el mismo enzima. Además, debido a la elevada afinidad de la avidina por la biotina su unión es más eficaz, más rápida y más estable, lo que disminuye la variabilidad interna de los ensayos. La conjugación anticuerpo-biotina está basada en la reacción del grupo carboxílico de la biotina con los grupos amino libres de las proteínas. Debido a lo anterior, es que en este trabajo los anticuerpos anti-GMP se conjugaron con la biotina. Para esto, se utilizó un éster de la biotina denominado biotinamido caproato –N-hidroxissuccinimida (BAC-Sulfo-NHS). Este reactivo es hidrosoluble y fácil de manejar, reaccionando con los anticuerpos a través de los grupos amino libres de las proteínas, normalmente los del aminoácido lisina. Debido al bajo peso molecular de la biotina y a las condiciones de la conjugación, su unión con el anticuerpo evita los efectos perjudiciales que tienen lugar cuando 81 Discusiones los anticuerpos se conjugan con un enzima; además no afecta a la afinidad del anticuerpo por el antígeno (Wilchek y Bayer, 1988). Para detectar los anticuerpo biotinilados se suele utilizar avidina o estreptavidina. La avidina presenta uniones no específicas atribuidas a la basicidad de su molécula y a su contenido de cadenas hidrocarbonadas (hexosas y aminoazúcares). Para contrarrestar los efectos negativos de la avidina, esta proteína ha sido modificada y comercializada como ExtrAvidina® (Sigma-Aldrich, Steinheim, Alemania). La ExtrAvidina es una forma modificada de la avidina que conserva la alta afinidad y la especificidad de esta para biotina, pero no muestra los efectos inespecíficos vinculante a pH fisiológico que se ha informado de la avidina. Además, en esta proteína se combina la alta actividad específica de avidina, con el bajo fondo de tinción que produce la estreptavidina. En el presente trabajo, los anticuerpos biotinilados se detectaron con un conjugado comercial de ExtrAvidina® unida a la peroxidasa de rábano (HRP). http://www.sigmaaldrich.com/sigma/datasheet/e2886dat.pdf). El desarrollo del sistema ELISA se hizo utilizando anticuerpos policlonales anti-GMP. El uso de anticuerpos policlonales en lugar de anticuerpos monoclonales, se justifica por el hecho de que en el caso de los alimentos, diferentes técnicas de procesamiento a que se someten estos, pueden afectar a sus proteínas o péptidos, por ejemplo, mediante la destrucción de epítopos específicos. Mediante el uso de anticuerpos policlonales, la probabilidad de detección de péptidos o proteínas que se alteran o modifican como sucede en el caso de los alimentos cuando se someten a diferentes técnicas de procesamiento (pasteurización, calentamiento, acidificación, etc), es mayor ya que los anticuerpos reconocen epítopos diferentes. Se acepta por tanto que el uso de anticuerpos policlonales es favorable para el análisis de alimentos (Holden et al. 2005). Los inmunoensayos deben ser consistentes en sus resultados, para lo que es necesario una apropiada estandarización del ensayo analítico, seguido de la 82 Discusiones validación del método a lo largo de los diferentes estudios, para alcanzar óptimos resultados. Para estandarizar el sistema ELISA desarrollado en este trabajo, fue necesario determinar las condiciones de trabajo óptimas de los reactivos químicos y biológicos, la temperatura y el tiempo de incubación en cada etapa, la dilución idónea de las muestras y la preparación de estándares y controles. El tiempo de análisis para detectar GMP como indicador de la presencia de suero de quesería mediante el sistema ELISA ya estandarizado es de 3.5 h, tiempo menor al que se reporta por otros métodos de análisis. Respecto a la validación, esta es importante ya que con esta se obtienen pruebas de que un método es lo suficientemente fiable para producir resultados previstos. Entre los parámetros que se evaluaron en este trabajo para validar el método desarrollado se encuentra la precisión, exactitud, reproducibilidad, límite de detección y de cuantificación. Respecto a la precisión, esta se define como la dispersión de los datos obtenidos para una muestra procesada varias veces y se expresa como el coeficiente de variación (CV). El sistema ELISA desarrollado es preciso, con una certeza del 95%, ya que se tuvo un intervalo de confianza 3.62% que es menor al 5%. Por otra parte, Crowther (2001) afirma que con un coeficiente de variación menor o igual a 15 en los intra e inter-ensayos hay evidencia de que un ensayo es preciso, y en este trabajo el coeficiente de variación obtenido fue de 5.9. Las normas vigentes de la Organización Mundial de la Salud admiten un rango entre el 5 % y el 20 % (Ochoa, 2004). En lo referente a exactitud, esta indica la capacidad del método analítico para dar resultados lo más próximo posible al verdadero valor. Si la diferencia entre el valor hallado y el valor verdadero es pequeña, la exactitud es buena. 83 Discusiones Mediante la prueba t de Student se demostró que el sistema ELISA desarrollado es exacto ya que el valor obtenido fue menor al de tablas. Mediante análisis de varianza de resultados obtenidos de muestras de leche con suero de quesería analizadas por personas diferentes en diferentes días, se determinó que el método es reproducible pues el valor de F obtenido fue menor que el de tablas. En lo referente al límite de detección, esta es la menor cantidad de analito que puede detectarse en una muestra, pero no necesariamente ser cuantificada bajo las condiciones experimentales establecidas. Para obtener el límite de detección se analiza un blanco adecuado, o una muestra libre del analito estudiado que en este trabajo fue leche sin suero de quesería o sin GMP. El límite de detección de suero de quesería mediante el sistema ELISA utilizando anticuerpos policlonales anti-GMP fue de 0.1% (v/v), mejor que el del inmuno blot que se desarrolló en este trabajo, en el que el límite de detección fue de 0.5% (v/v). Por HPLC Galindo y col. (2006) detectaron 1% (v/v) de suero de quesería Bremer y col. (2008), mediante un sistema ELISA por inhibición y utilizando anticuerpos monoclonales anti-κ-caseina, tuvieron un límite de detección de 0.1% (p/p) de suero en polvo en leche deshidratada, nivel aparentemente igual al alcanzado en este trabajo, sin embargo es importante considerar que en la leche líquida, que es la que se utilizó en este trabajo, los sólidos presentes (incluyendo los del suero de quesería) se encuentran en menor concentración (12% en promedio) por tratarse de una muestra con agua. El sistema ELISA desarrollado para detectar suero de quesería es mejor que otros métodos que se reportan como son SDS-PAGE Electroforesis capilar (Olieman y col, 1983; Alcázar y col, 2000) y HPLC (Galindo y col., 2006), ya que el método resultó ser más sensible a concentraciones menores, además de que es más sencillo de realizar y, requiere menor tiempo pues no se necesita purificar el GMP y no utiliza equipo y materiales 84 Discusiones complejos y caros. Además, por el ELISA se pueden analizar varias muestras al mismo tiempo. El límite de cuantificación es la mínima concentración del analito que puede determinarse con precisión y exactitud, bajo las condiciones experimentales establecidas. Este es un término cuantitativo (menor cantidad medible), mientras que el límite de detección es cualitativo (menor cantidad detectable). El límite de cuantificación para el sistema ELISA desarrollado fue de 0.29%(v/v) de suero de quesería, lo que significa que a partir de esta concentración se puede discernir con seguridad si una muestra tiene o no, suero de quesería (Ochoa, 2004) Los anticuerpos fueron altamente específicos por el GMP en el sistema ELISA desarrollado, ya que productos lácteos sin suero de quesería o sin GMP (según especificaciones en la etiqueta) no dieron reactividad, lo cual coincide con los resultados obtenidos mediante el sistema inmuno blot desarrollado en este trabajo. Así pues, esto reduce la posibilidad de obtener resultados falsos positivos. Con el sistema ELISA de este trabajo, se logró detectar exitosamente GMP en alimentos comerciales que contienen suero de leche, tales como suplemento dietético, yogur saciedad y margarina. Debido a que en la actualidad, han salido al mercado alimentos novedosos que dicen contener GMP por sus propiedades nutraceúticas, el análisis desarrollado en este trabajo, podría usarse para identificar la presencia de este péptido como un control de calidad. En resumen, la técnica del ELISA tipo sándwich utilizando anticuerpos policlonales anti-GMP podría utilizarse para detectar GMP como índice de adulteración con suero de quesería, ya que es una técnica rápida, sencilla, económica, sensible, y precisa que es idónea para ser desarrollada en programas oficiales de inspección y en las industrias lácteas. 85 7. CONCLUSIONES En este trabajo se logró desarrollar dos métodos mediante inmunoensayos para detectar adulteración de leche de vaca con suero de quesería. Ambos métodos se basaron en la detección de un glucomacropeptido (GMP) que está presente sólo en suero de quesería pero no en leche. Los inmunoensayos desarrollados resultaron ser más sensibles, rápidos, exactos, específicos y precisos que otros métodos que se han desarrollado hasta ahora. Para el desarrollo de los métodos se utilizaron anticuerpos policlonantes anti-GMP de obtención propia. Uno de los inmunoensayos desarrollados se basó en la técnica de inmuno blot, mediante la cual se tuvo una sensibilidad de hasta 0.5% (v/v) de suero líquido. Con esta metodología el tiempo de análisis fue de 4.5 h. El otro inmunoensayo fue un sistema ELISA tipo sándwich con el que se logró mejor sensibilidad que fue de 0.1% (v/v) de suero líquido en leche. El tiempo de análisis con este método es de 3.5 h. La detección del GMP fue exitosa con ambos métodos, tanto en leche adulterada con suero de quesería, así como en productos alimenticios que contienen lactosuero. Además el ELISA es menos costoso que otros métodos que requieren equipo y reactivos caros. Los sistemas desarrollados son una buena alternativa para aplicarse en el análisis de leche en programas oficiales de inspección y/o en las industrias lácteas. 86 8. BIBLIOGRAFIA Alcázar MC, Rosas J, Jaramillo AC, Peña S. 2000. Detección de glucomacropéptido (GMP) como indicador de adulteración con suero de quesería en leche deshidratada. Vet Mex. 37(3):217-22. Anguita A.1996. Tesis doctoral: Detección de leche de vaca en mezclas lácteas y quesos madurados de oveja y cabra, utilizando anticuerpos monoclonales, policlonales y técnicas inmunoenzimática (ELISA). Madrid España. p 13-53. Badui DS. 1994. Química de los alimentos. Ed. Alambra Mexicana. 3ª. Ed. México. p. 375-398. Benítez E, Ponce P, Noa M. 2001. Detección de suero de quesería en leche en polvo por HPLC de filtración en Gel. Rev de-Salud-Animal 23(1):27-31. Bertoni G, Calamari L, Maianti MG. 2001. Producing specific milks for speciality cheeses. Proc Nutr Soc. 60: 231-246. Bradford MM. 1976. A rapid an sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochem 72: 248- 254. Bremer M, Kemmers-Voncken A, Borres E, Frankhuizen R, Haasnoot W. 2008. Enzyme-Linked immunosorben assay for the detection of bovine rennet whey powder in milk powder and buttermilk powder. Int. Dairy J. 18: 294 -302. Brody EP. 2000. Biological activities of bovine glycomacropeptide. Br J Nutr 84(1):S39-S46. 87 Bibliografía Capbell AM. 1984. Monoclonal antibody technology. Elsevier Science Publishers, Amsterdam. p. 1-30. Charley H. 1987. Tecnología de alimentos: procesos químicos y físicos en la preparación de alimentos. México. Limusa p.371-411. Chabance B, Jolles P, Izquierdo C, Mazoyer E, Francoual C, Drout F. 1995. Characterization of an antithrombotic peptide from k-casein in newborn plasma alter milk ingestion. Br J Nutr. 73:583-590. Crester S, Tulmann N, Figuera A. 2001. Detection of single sequence repeat polymorphism in denaturing polyacrylamide sequencing gels by silver staining. Plant Mol Biol Rep 19:299-306. Crowther J. 2001. The ELISA guidebook. Humana Press. Totowa New Jersey. 415 p. Engvall E, Perlmann P. 1971 Enzyme-linked immunosorbent assay (ELISA), quantitative assay of immunoglobulin G. Immunochemistry. 8(9): 871-874. Etzel M. 2004. Manufacture and Use of Dairy Protein Fractions. J. Nutr. 134: 996S1002S. FAO. 2006a. Base de datos PRODSTAT. 21 octubre. www.fao.org FAO. 2006. Base de datos TRADESTAT. 21 octubre. www.fao.org Gallagher SR. 1995. Current Protocols in Protein Science. John Wiley & Sons, Inc. USA. 10.1.1-10.1.34. 88 Bibliografía González A. 1994. Tesis doctoral: Utilizacion de anticuerpos policlonales frente a Pseudomonas fluorescens para determinar la calidad higienica de la leche y de la carne. Madrid España.168 p. COLISA Galindo L, Valbuena E, Rojas E. 2006. Estandarización de la detección del glicomacropéptido por PAGE-SDS como índice de adulteración de leche. Revista Científica FCV-LUZ 16(3):308-314. Greenber R. 1986. Detection of added whey protein concentrate in nonfat dry milk by amino acid analysis. Agric Biol Chem. 34:30-32. Gosling JP. 1990. A decade of development in immunoassay methodology. Clinical Chemistry. 36(8):1408-1427. Guzmán VE. 2004. Las pruebas de ELISA. Gac. Med.Mex. 140 (3):S48-S49. Kirk R, Sawyer R, Egan H. 1996. Composición y análisis de alimentos de Pearson. CECSA, 2da. Edición. México. p: 583-670. Hazard T.1997. Variación de la composición de la leche. In: Curso taller Calidad de Leche e Interpretación de Resultados de Laboratorio. Serie Carillanca. Temuco, Chile. 62: p.33- 44. Harlow E, Lane D. 1988. Antibodies a laboratory manual. Ed. Cold Spring Harbor Laboratory. EUA. 726 p. Hill SD, Richter PL, Dill CW. 1988. Sulfur-based method to detect adulteration of nonfat dry milk with whey. Cult Dairy Prod J. 23:16-18. 89 Bibliografía Holden L, Fæste C, Egaas E. 2005. Quantitative Sandwich ELISA for determination of Lupine (Lupinus spp.) in foods. J Agric Food Chem. 53:5866-5871. http://www.sigmaaldrich.com/sigma/bulletin/BK101bul.pdf http://www.sigmaaldrich.com/sigma/datasheet/e2886dat.pdf http:// www.gehealthcare.com/hitrap Hurley IP, Coleman RC, Ireland HE, J Williams. 2004. Measurement of bovine IgG by indirect competitive ELISA as a means of detecting milk adulteration. J Dairy Sci. 87(3): 543-549. ICH Harmonised Tripartite Guideline Q2. 2000. Validation Of Analytical Procedures: Text And Methodology Q2(R1). http://www.tga.gov.au/docs/pdf/tgmp0201g.pdf Jiménez B, Martínez A, J Bouza. 2001. Bioactive milk peptidos and proteins. Asr Pharmceutica. 42: 135-145. Kanamori M, Kawaguchi N, Ibuki F, Doi H. 1980. Attachment sites of carbohydrate moieties to peptide chain of bovine κ-casein from normal milk. Agricultural and Biological Chemistry. 44: 1844-1861. Karman AH, van Boekel MAJS. 1986. Evaluation of the Kjeldahl factor for conversion of the nitrogen content of milk and milk products to protein content. Neth. Milk Dairy J., 40, 315-336. Kawasaki Y, Kawakami H, Tanimoto M, Dosako S, Tomizawa A, Kotake M, Nakajima F. 1993. pH-Dependent molecular weight changes of k-casein glycomacropeptides and its preparation by ultrafiltration. Milchwissenschaft. 48: 191-196. 90 Bibliografía Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of the bacteriophage T4. Nature 227:680-685. Li E, Mine Y. 2004. Technical note: comparation of chromatographic profile of glycomacropeptide from cheese whey isolated using different methods. J Dairy Sci. 87: 174-177. Martín del Campo T.2006. Tesis doctoral: Identificación de parámetros de autenticidad en Leche y productos lácteos. México.p. 60-63. Miralles B. 2001. Tesis doctoral: Detección de caseinato y suero en leche y productos lácteos mediante técnicas electroforéticas, cromatográficas y espectroscópicas. Madrid, España. p. 7-33. Mikkelsen TL, Rasmussen E, Olsen A, Barkholt V, Frөkiær. 2006. Immunogenecicy of k-casein and glycomacropeptide. J Dairy Sci 89:824-830. Montana LS, Caroppo S, Francani R, Emaldi GC. 1982. Ammonia content in milk and some milk products. Sci Tec Lattiero-Casearia. 33:95-10. Mrowetz G, Klostermeyer H. 1976. Polarographic determination of the whey protein percentage in dried milks. Milchwissenschaft, 31, 346-349. Nakajima K, Tamura N, Hattori K, Yoshida T, Hara-Kudo Y, Ikedo M, Hattori M. 2005. Prevention of Intestinal Infection by Glycomacropeptide. Bioscience, Biothecnology and Biochemistry. 69(12):2297-2301. Nakano T, Ikawa N, Ozimek L. 2007. Detection of sialylated phosphorylated κcasein glycomacropeptide electrophoresed on polyacrylamide gels and cellulose acetate strips by the thiobarbituric acid and malachite green dye reactions. J Agric Food Chem 55(7): 2714-2726. 91 Bibliografía Nesser JR, Golliard M, Woltz A, Rouvet M, Dillman ML, Guggenheim B. 1994. In vitro modulation of oral bacterial adhesion to saliva-coated hydroxiapatite beads by milk derivatives. Oral Microbiology and Inmunnolology. 9: 193-201. Ochoa R. 2004. Bases metodológicas para la evaluación de anticuerpos en ensayos clínicos de vacunas mediante técnicas inmunoenzimáticas. Finlay Ediciones. La Habana Cuba. p. 55-78 Olieman, C. Y J.W. Van dem Dedem. 1983. A sensitive HPLC method of detecting and estimating rennet whey total solids in skim milk powder. Neth Milk Dairy. 37:27-36 Olieman C, Van Riel J. 1989. Detection of rennet whey solids in skim milk powder and buttermilk powder with reversed-phase HPLC. Neth Milk Dairy J. 43:171174. Park W, Shon D, Kim Y. 2003. Application of an enzyme-linked immunosorbent assay for detecting mold contamination in agricultural commodities and comparison with conventional assays. Food & Agricultural Immunology. 15(3): 159-166. Petschow BW, Talbot RD. 1991. Response of Bifidobacterium species to growth promoters in human and cow milk. Pediatric Reserch. 29:208-213. Reynolds JA, Tanford C.1970. Binding of dodecyl sulfate to proteins at high binding ratios. Possible implications for the state of proteins in biological membranes. Proceedings of the National Academy of Sciences of USA. 66(3):1002-1007. Rojas EO. 2001. Inmunología. 2ª ed. Editorial Médica Panamericana. México. p.7599. 92 Bibliografía SAGARPA. 2004. Situación actual de la producción de leche de bovino en México 2004. www.sagarpa.gob.mx/ganaderia/estudio/sitlech04.pdf SAGARPA. 2006. Análisis de la leche. SAGARPA. 20 octubre. http://siap.sagarpa.gob.mx/InfOMer/analisis/anleche.html Secretaría de Salud. Norma Oficial Mexicana NOM-091-SSA1-1999. Bienes y Servicios. Leche Pasteurizada de Vaca. Disposiciones y Especificaciones Sanitarias. Tomczak TL, Noemberg LE, L Bileski C. 2007. Review: Isolation and purification of milk whey glycomacropeptide. B.CEPPA.Curitiba.25 (1):121-132. Thompson M, Ellison S, Wood R. 2002. Harmonized guidelines for single-laboratory validation of methods of analysis (IUPAC Technical Report). Pure Appl. Chem. 74(5): 835–855. Valdés I, García E, Llorente M, Méndez E. 2003. Innovative approach to low-level gluten determination in foods using a novel sandwich enzyme-linked immunosorbent assay protocol. Eur J Gastroenterol Hepatol. 15:465-474. Watanabe H, Atsuko S, Kido Y, Tsuji A. 2002. Monoclonal-based enzyme-linked immunosorbent assay and immunochromatographic rapid assay for dihydrostreptomycin in milk. Anal Chim Acta. 472: 45-53. Whitney R, 1988. Proteins of milk. Fundamentals of dairy chemistry. 3a. ed. Van Nostrand Reinhold Company Inc. New York. p. 81-169. Wilchek H, Bayer EA. 1988 The avidin-biotin complex in bioanalytical applications. Anal. Riochem. 171: 1-32. 93 Bibliografía www.gehealthcare.com/hitrap 94
© Copyright 2026