SN,E,ReacRX-QOID2K16 - Departamento de Química Orgánica
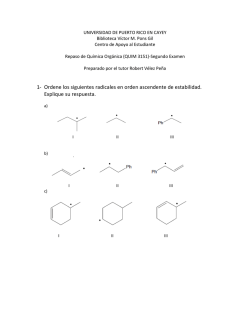
Reacciones Ionicas: Sustitución Nucleofílica y Reacciones de Eliminación – Mecanismos Reacciones de Haluros de Alquilo" Facultad de CC.QQ. y Farmacia – USAC Química Orgánica I – Sección D - 2016 t Introducción: Reactividad de los Haluros de Alquilo" La polaridad de un enlace carbono-halógeno causa que el carbono tenga una carga parcial positiva" En los halogenuros de alquilo esta polaridad causa que el carbono se active frente a reacciones de substitution con nucleopfilos " " Los enlaces Carbono-halogen se vuelven menos polares, más largos y débiles al pasar del fluor al yodo" Chapter 6 2 u Reactividad de los Alcoholes" Eliminación" Sustitución del hidrógeno del grupo –OH" (Sustitución electrofílica en el Oxígeno)" Sustitución nucleofílica del grupo -OH" Base puede neutralizar protón hidroxílico generando alcóxiido como base conjugada u Estructura y Reactividad de los Eteres" Oxígeno sp3 => → Compuestos análogos al agua en los cuales grupos alquilo o arilo han reemplazado a los hidrógenos" → Presentan bajos momentos dipolares" → Nucleófilos reaccionan en sitios electrofílicos (grupos alquilo R y Rʼ) por sustitución del grupo –ORʼ u -OR" → El O es un sitio nucleofílico y débilmente básico " t Reacciones de Sustitución Nucleofílica" En esta reacción un nucleofilo es una especie con un par de electrones sin compartir que reacciona con un carbono deficiente en electrones" Un grupo saliente es sutituido por el nucleófilo" Ejemplos de sustitución nucleofílica: obtención de alcoholes, éteres, halogenuros de alquilo a partir de haluros de alquilo" " Chapter 6 5 t Nucleófilo" El nucleófilo reacciona en el carbono deficiente en electrones" Un nucleófilo puede ser un ion o una molécula con un par de electrones sin compartir" Chapter 6 6 t Grupo Saliente" Es un sustituyente que puede irse como una especie relativamente estable, al ser base débil" Puede irse como un anión o una especie neutra" Chapter 6 7 Posibilidades mecanísticas en las SN: SN2 , SN1" t Cinética de una Reacción de Sustitución Nucleofílica : Una Reacción SN2 " Se mide la velocidad inicial de la siguiente reacción" " " La velocidad es directamente proporcional a la concentración inicial de cloruro de metio y de hidróxido" La ecuación de velocidad refleja esta dependencia" Reacción SN2 : sustitución, nucleofílica, de 2o orden (bimolecular)" 8 Chapter 6 t Mecanismo para la Reacción SN2" " El estado de transicion es el estado de mayor energía de la reacción" Es una especie muy inestable de vida muy corta (10-12 s)" En el estado de transición de esta reacción los enlaces están parcialmente roto y parcialmente formados" Tanto el clorometano como el hidróxido participan en el estado de transición y esto explica por qué la reacción es de segundo orden" Reacción en una sola etapa" " Chapter 6 9 En el estado de transición de SN2 el carbono que sufre el ataque está momentáneamente pentacoordinado, en hibridación sp2 t Diagramas de Energía Libre" Reacción Exergónica : ΔGo negativo (favorece productos)" Reacción Endergónica : ΔGo positivo (no favorece productos) " La reacción de clorometano con hidróxido es muy exergónica " " "" " " La constante de equilibrio es muy grande" Chapter 6 11 Hay una relación directa entre ΔG‡ y la temperatura de la reacción " " A mayor temperatura se incrementa la velocidad" " A temperatura cercana al ambiente, un incremento de 10oC aumenta la velocidad al doble" Tempertauras elevadas causan más colisiones moleculares con suficiente energía para alcanzar el estado de transición y reaccionar" Chapter 6 12 Un diagrama de energía de una reacción SN2 típica" Diagrama de energía para la reaccion de clorometano con hidróxido:" Una reacción con ΔG‡ arriba de 84 kJ mol-1 requerirá calor para que se de dentro de un tiempo razonable" Esta reacción tiene un ΔG‡ = 103 kJ mol-1 por lo que requiere calentamiento" Chapter 6 13 t La estereoquímica de las Reacciones SN2" El ataque por detrás del nucleófilo resulta en una inversión de la configuración" En sistemas cíclicos un compuesto cis puede reaccionar y dar un producto trans" Chapter 6 14 " " Chapter 6 15 Posibilidades mecanísticas en las SN: SN2 , SN1" t La Reacción del Cloruro de ter-Butilo con Ion Hidróxido: Una Reacción SN1" El cloruro de ter-Butilo sufre sustitución con hidróxido" La velocidad es independiente de la concentración de hidroxido y depende solo de la concentración del cloruro de ter-butilo" Reacción SN1: Sustitución, nucleofílica, de 1r orden (unimolecular)" La velocidad depende solo de la concentración del haluro de alquilo " Solamente el halogenuro de alquilo (pero no el nucleófilo) participa en el estado de transición del paso determinante de la reacción" Chapter 6 16 t Reacciones en varios pasos y el paso deteminante de la reacción" En reacciones de varios pasos, la velocidad del paso mas lento será la velocidad de la reacción completa " Este paso se denomina el paso determinante de la reacción" En el ejemplo inferior k1>>k2 o k3 y el primer paso es el determinate " 17 Chapter 6 t Mecanismo para la Reacción SN1 (siguente diapositiva)" El proceso de sustitución en sí, es una reacción que comprende dos etapas" El paso 1 es el determinante (lento) porque requiere la formación de un producto iónico inestable " En el paso 1 las moléculas de agua ayudan a estabilizar los iones producidos" Chapter 6 18 Chapter 6 19 " SN2" " SN1" El carbocatión es atacado por el nucleófilo: En la solvólisis del cloruro de ter-butilo el nucleófilo es el propio disolvente que colapsa con el carbocatión. Otra molécula de disolvente abstrae el protón que sobra." " t Carbocationes" Un carbocatión tiene sólo 6 electrones, es de hibridación sp2 y tiene un orbital p vacío" Mientras más sustituido es un carbocatión, es más estable y es más fácil de formar. Recordar que los carbocationes alílicos y bencílicos, al estabilizarse por resonancia, son tan estables como los alquílicos terciarios. " 21 Chapter 6 La Hiperconjugación estabiliza el carbocatión por donación de electrones de un enlace σ vecino (carbono-hidrógeno) al orbital p vacío" Mas sustitución provee más oportunitdad para hiperconjugación" Chapter 6 22 Estereoquímica de las Reacciones SN1 " t Cuando el grupo saliente se va de un centro estereogénico de una molécula quiral en una reacción SN1, se da una racemización" " Esto es porque el intermeidiaro (carbocatión) no es quiral " Racemización: transformación de un compuesto ópticamente activo en una mezcla racémica, por lo tanto ópticamente inactiva" Chapter 6 23 Chapter 6 24 t Solvólisis" Una molécula del solvente es el nucleófilo en una reacción de sustitución " Si el solvente es agua, la reacción es una hidrólisis" Si el solvente es alcohol, se tiene una alcohólisis" Y si es amoníaco, una amonólisis" Chapter 6 25 Las reacciones SN1, como la solvólisis de cloruro de ter-butilo, tienen una cinética de primer orden. Velocidad = k[(CH3)3CCl] mol·L-1·s-1" " " " Esto quiere decir que en la etapa limitante de la velocidad sólo interviene el halogenuro de alquilo (sustrato) y no el nucleófilo, al contrario de lo que ocurría en el mecanismo SN2" " El perfil de energía del proceso SN1 es:" " SN1" " " La reacción SN1 carece de estereoespecificidad al transcurrir a través " de un intermedio carbocatiónico plano." t Factores que Afectan la Velocidad de las Reacciones SN1 y SN2 " t Efectos de la Estructura del Sustrato" l Reacciones SN2" En Reacciones SN2 los haluros de alquilo siguen el siguente orden general de reactividad:" Impedimento Estérico: el arreglo espacial de los átomos o grupos cercanos al sitio de reacción estorban o retardan la reacción " En haluros terciarios o de neopentilo, el carbono del centro reactivo está muy impedido estéricamente para reaccionar" 28 Chapter 6 Efecto estéricos en la SN2" La reacción SN2 es muy sensible a impedimentos estéricos ya que su ET es una bipirámide trigonal y hay, por tanto, cinco grupos muy próximos entre sí. " " El aumento de los sutituyentes en el carbono reaccionante ocasiona una disminución drástica de la velocidad de reacción. " R1" R2" R3" krel" H" H" H" 145" H" H" 1" El alargamiento lineal de la cadena de uno de los sustituyentes del carbono reaccionante disminuye sólo ligeramente la velocidad. " CH3" H" CH3" CH3" 7.8·10-3" CH3" CH3" CH3" < 5·10-4" H" H" CH2CH3" 0.80" H" H" CH2CH2CH3" 0.82" H" H" CH(CH3)2" 3.6·10-3" H" H" C(CH3)3" 1.3·10-5" La ramificación de una de las cadenas sustituyentes en posición contigua al centro reactivo (posición β) disminuye severamente la velocidad de reacción." u Reacciones SN1! Generalmente solo los haluros terciarios sufren reacciones SN1 debido a que solo ellos pueden formar carbocationes relativamente estables" u El Postulado de Hammond-Leffler! El estado de transición para una reacción exergónica es muy similar al material de inicio" El estado de transición para una reacción endergónica es muy similar al producto" Generalmente, el estado de transición es más similar a la especie de energía más cercana." 30 Chapter 6 En el primer paso de una reacción SN1 el estado de transición es muy similar al carbocatión " El estado de transición se verá estabilizado por todos los factores que estabilizan a los carbocationes" El estado de transición que conduce a carbocationes terciarios es mucho más estable y menor en energía que los estados de transición que conducen a otros carbocationes. " Chapter 6 31 u Efectos de la Concentración y Fuerza del Nucleófilo" l Reacción SN1" La velocidad no depende de la identidad o concentración del nucleófilo" l Reacción SN2: La velocidad es directamente proporcional a la concentración del nucleófilo" Nucleófilos fuertes también reaccionan más rápidamente" Un nucleófilo con carga negativa es siempre más reactivo que su ácido conjugado neutro. " Cuando se comparan nucleófilos con el mismo átomo nucleofílico, la nucleofilicidad es paralela a la basicicdad. " Metóxido es un mucho mejor nucleófilo que el metanol" Chapter 6 32 u Efectos de la Concentración y Fuerza del Nucleófilo " → A menor electronegatividad del átomo que tiene el par electrónico, mejor nucleófilo:" "H2S > H2O ; PH3>NH3" "R3C- > - NH2 > RO- > HO- > R2NH >" "ArO- > NH3 > F- > H2O " → A mayor volumen: menor nucleofilia y mayor basicidad" "C3H7NH2 > (C3H7)2NH2 > (C3H7)3N" "C2H5O- > (CH3)3CO- " La reacción SN2 será más fácil si se efectúa con un buen nucleófilo atacante. ¿Qué hace que un nucleófilo sea bueno?." " " • La carga " Entre un par de nucleófilos que contienen el mismo átomo reactivo, la especie con carga negativa neta es la más reactiva: " " • La electronegatividad " La nucleofilia aumenta al disminuir la electronegatividad del átomo reactivo " " • La solvatación " La solvatación, es decir, la interacción entre el nucleófilo y el disolvente, modifica e invierte incluso la relación aparente nucleofilia-basicidad". u Efectos del solvente en las Reacciones SN2 : Solventes Polares Próticos y Solventes Apróticos" Solventes Polares Próticos" Poseen un átomo de hidrógeno unido a un átomo fuertemente electronegativo " Solvatan a los nucleófilos y los hacen menos reactivos " " Nucleófilos grandes son menos solvatados y por lo tanto, más reactivos en solventes polare próticos " " " Nucleófilos grandes son también más polarizables y pueden donar más densidad electrónica" u Nucleofilicidad Relativa en solventes polares próticos:" Chapter 6 35 Solventes Polares Aproticos" No tienen un hidrógeno unido a un átomo electronegativo" Solvatan bien a los cationes pero no solvatan a los aniones debido a que los centros positivos en el solvente están impedidos estéricamente. " Los solventes polares aproticos generan nucleófilos desnudos y muy reactivos donde la tendencia para la nucleofilicidad es la misma que para la basicidad. " Son excelentes solventes para reacciones SN2 " Chapter 6 36 u Efecto del disolvente en la SN2" Cuanto más concentrada esté la carga en el átomo reactivo, mayor será en principio su nucleofilia, pero mayor su interacción con el disolvente, y éste actúa como pantalla disminuyendo la nucleofilia " Por tanto, la naturaleza del disolvente es de primordial importancia en una reacción de sustitución nucleófila. " Hay dos tipos fundamentales de disolventes:" " " • Próticos " Tienen hidrógenos unidos a oxígeno o nitrógeno y, por ello, forman enlaces de hidrógeno con el nucleófilo. Dan lugar a solvatación fuerte, enmascaran la nucleofilia y las reacciones se ralentizan." " • Aproticos " No tienen hidrógenos unidos a oxígeno o nitrógeno y, por ello,no forman enlaces de hidrógeno. La solvatación es débil y las reacciones se aceleran." Efecto del disolvente en la SN2" " " Disolvente" Carácter" Vel. relativa" CH3OH metanol" Prótico" 1" HCONH2 formamida" Prótico" 12.5" HCONHCH3 N-metilformamida" Prótico" 45.3" HCON(CH3)2 N,N-dimetilformamida (DMF)" aprótico" 1.2x106" La reacción se produce mucho más rapidamente en DMF, disolvente que no contiene hidrógenos que puedan asociarse al nucleófilo. Los hidrógenos de la formamida, su N-metilderivado y del metanol se asocian fuertemente por enlace de hidrógeno al cloruro, retardando considerablemente la reacción." u Efectos del Disolvente en Reacciones SN1: La habilidad de ionización" " Disolventes Polares próticos son excelentes disolventes para reacciones SN1" Disolventes Polares próticos estabilizan el estado de transición similar al carbocation disminuyendo ΔG‡" Los más comunes son mezclas de etanol-agua o metanol agua" Chapter 6 39 u La Naturaleza del Grupo Saliente" Los mejores grupos salientes son bases débiles que son relativamente estables" El grupo saliente puede ser un anion o una molécula neutra " Orden de reactividad de los haluros:" Este orden es el opuesto a la basicidad:" Otras bases débiles que son buenos grupos salientes:" El grupo hidroxido puede transformarse en un buen grupo saliente por protonación" 40 Chapter 6 u La Naturaleza del Grupo Saliente " → Muy buenos grupos salientes:" "I-, Br-, H2O, Cl- , alquilsulfonato, alquilsulfato, " "p-toluensulfonato" → Buenos grupos salientes:" "CN-, NH3, RNH2" → Malos grupos salientes:" "HO-, RO-" → Muy malos grupos salientes:" "H2N-, C-" Grupo Saliente" La reacción SN2 será más fácil si se efectúa sobre un sustrato que contiene un buen grupo saliente " Un grupo buen saliente debe poseer una basicidad muy moderada " (debe ser una base más débil que el nucleófilo)" Buenos Grupo" pKb" Grupo" pKb" I-" 19.2" CN-" 4.8" RSO3-" 16-19" CH3S-" 4.0" Br-" 18.7" CH3O-" -1.5" Cl-" 16.2" HO-" -1.7" H2O" 15.7" NH2-" -21" F-" 10.8" CH3-" -36" CH3COO-" 9.3" Malos " " Muy malos ¿Por qué un grupo es más o menos básico?. " Un grupo que sea capaz de acomodar su densidad electrónica será poco básico y, por tanto, buen grupo saliente. Los factores que aumentan la estabilidad electrónica de una especie son: " • El tamaño " " • La electronegatividad " " • La deslocalización por resonancia " Cuanto mayor es el tamaño del átomo que soporta la carga negativa, más dispersada y estable se encuentra ésta y menos básica es la especie. Este es el factor que predomina en los haluros: mayor tamaño I- > Br- > Cl- > F- menor tamaño base débil I- < Br- < Cl- < F- base fuerte mejor saliente I- > Br- > Cl- > F- peor saliente" Comparando átomos de la misma fila del sistema periódico, cuanto mayor es la electronegatividad del átomo que soporta la carga negativa, menos básico y mejor grupo saliente (en los haluros predomina el efecto de tamaño porque de uno a otro cambiamos de fila del sistema periódico). mal saliente F- > HO- > NH2- > CH3- pésimo saliente" La resonancia permite la deslocalización de la carga y su estabilización. Por ello los sulfonatos son bases muy débiles y buenos grupos salientes. " u Resumen SN1 vs. SN2" En ambos casos los yoduros de alquilo reaccionan más rápido debido a ser buenos grupos salientes" Chapter 6 44 • Competencia entre SN1 Y SN2" SN1" SN2" Los disolventes polares favorecen el mecanismo SN1. " " " " " " " " " " " El intermedio carbocatión tiene una carga neta y se estabiliza por solvatación. El ET se parece más al carbocatión que a los reactivos y disfruta de esta estabilización parcialmente." Los disolventes polares dificultan el mecanismo SN2. " " " " " " " " " " El ET tiene un desarrollo de cargas mínimo y no se favorece especialmente por la polaridad del disolvente. Sin embargo, el nucleófilo puede estar solvatado por un disolvente polar y dificultarse el mecanismo SN2." La presencia de grupos salientes buenos favorece el mecanismo SN1." La presencia de grupos salientes buenos favorece el mecanismo SN2." La fortaleza del nucleófilo no afecta a la velocidad del mecanismo SN1." La fortaleza del nucleófilo aumenta la velocidad del mecanismo SN2." La sustitución en el carbono reaccionante favorece el mecanismo SN1." La sustitución en el carbono reaccionante impide el mecanismo SN2." La proporción de moléculas que reaccionarán según los mecanismos SN1 ó SN2, con las implicaciones estereoquímicas que ello conlleva (racemización o inversión), depende de su estructura:" " Sustrato" SN1" SN2" Nunca se da en disolución." Muy rápida con buenos nucleófilos y buenos grupos salientes." primario" Nunca se da en disolución." Igual al anterior. Difícil cuando el carbono contiguo está ramificado." secundario" Lenta. Se acelera con un buen grupo saliente y en disolventes próticos. " Lenta. Se acelera con una concen-tración alta de un buen nucleófilo y en disolventes apróticos." terciario" Muy rápida, sobre todo en disolventes polares próticos y con buenos grupos salientes." Extremadamente lenta." metil" Reacciones competitivas o colaterales a la SN" t Reacciones de Eliminación en Haluros de Alquilo" l Deshidrohalogenación" Usada para la sintesis de alquenos" Eliminación compite con sustitución " Bases fuertes como alcóxidos y temperatura elevada favorecen eliminación" Sustrato con H en β " " 47 Chapter 6 u Empleo del Acetiluro como Nu-: Reacciones de Alquilación de Iones Acetiluro Mecanismo SN2" CH 3CH 2CH 2C N aN H2 C H i nN H3( l) o - 78C N H2 C Na CH 3CH 2CH 2C H SN2 Br CH 3CH 2CH 2C C H H CCH3 Síntesis en Varias Etapas" HC CH ? Br Análisis Retrosintético Empezando con el Producto: Sustratos por Etapa " HC CH ? Br Completar con los Reactivos" HC CH ? 1) NaNH2, NH3 Br 2) H2, Lindlar's cat. Br HBr ROOR, hν ¿Cuántas Etapas?" HC CH ? H CH3 CH2CH(CH3)2 H 5 Etapas" HC CH 1) NaNH2, NH3 2) CH3I 3) NaNH2, NH3 4) (CH3)2CHCH2Br 5) Li, NH3 H CH3 CH2CH(CH3)2 H Proponga Mecanismo" Br O 1) NaOCH3 2) heat CH3OCH2 O + NaBr 2 Etapas SN2 " CH3O Br 1) NaOCH 3 2) h eat O CH3OCH2 O SN2 Br CH3O O SN2 intramolecular + NaBr Química Organometálica Reacción de Grignard" CH3 Br + Mg δ− δ+ CH3 MgBr Grignard Reagent "CH3 MgBr " excellent nucleophile very strong base Los Reactivos de Grignard son bases ecepcionalmente fuertes" H2O CH 3OH CH 3CH 2CH 2MgBr + CH 3CO 2H HC CH CH 3NH2 CH 3CH 2CH3 La Síntesis de Williamson" t En la síntesis de Williamson se requiere un sustrato con un carbono sp3 deficiente en electrones, y un reactivo con un oxígeno nucleofílico." t El sustrato puede ser un halogenuro de alquilo primario o un alcohol, también primario, que previamente se ha transformado en un tosilato (buen grupo saliente)." t La reacción se lleva a cabo mediante un mecanismo SN2, usando como reactivo nucleofílico la sal de un alcohol (de cualquier tipo) o la sal de un fenol." t Debido a que los reactivos son fuertemente básicos, un sustrato distinto al primario dará cantidades significativas del producto de eliminación. " u Ejemplos de la Síntesis de Williamson" K OH I OH N aO H OH O C H B r2 O O O OH O Me O OH OH O A g 2 O / C H 3 I (xs) HO HO O O Me O Me O O Me O Me t La Reacción E2 " La Reacción E2 es la remoción concertada del protón, formación del doble enlace, y salida del grupo saliente." Tanto la concentración del haluro de alquilo como de la base afectan la velocidad y por lo mismo, es una reacción de 2o. orden" Chapter 6 60 Eliminación Bimolecular E2" La eliminación bimolecular E2 transcurre sin intermedios y consta de un único ET, en el que la base abstrae el protón, el grupo saliente se va y los dos carbonos implicados se rehibridizan de sp3 a sp2. " La cinética depende del haluro y de la base/nucleófilo y es, por tanto, de segundo orden. La reacción E2 es bimolecular La reacción E2 tiene lugar con una estereoquímica definida: el grupo saliente y el hidrógeno sobre el carbono en posición contigua han de estar en disposición antiperiplanar E2: Características" H t Conformacion del sustrato: X H Antiperiplanar vrs. Sinperiplanar." " " " t Estereoselectividad:" "- Producto Zaitsev:" " %>: C=C + sust, " "Termodinámico: + estable" "Base débil, pequeña." "-Producto Hoffman: " " %> → C=C ─ sust," "Cinético: + rápido" "Base fuerte, grande, pequeña." " X Anti periplanar (alterna: menor energía) Br B Sin periplanar (eclipsada: mayor energía) - CH3CH2OK B: (CH3CH2)3COK 71 % 11 % 29 % 89 % Estereoquímica de la reacción de eliminación E2." Reacciones estereoespecíficas E2." Si se mira esta reacción desde el extremo izquierdo de la molécula, se ve la disposición anti y coplanar del hidrógeno y del bromo El protón que será abstraído y el grupo que se queda deberían ser anticoplanares, de manera que se minimice cualquier impedimento estérico entre la base y el grupo que se queda. E2: Diasterómeros" Ph Br H Br H H CH3 Ph CH3 H H H Ph Ph CH3 ≡ Ph Ph H Ph Ph CH3 Br => Reacción estereoespecífica: (S, R) produce el producto trans, (R, R) produce solo cis." E2: Compuestos Cíclicos" t La posición de los grupos salientes debe ser trans- diaxial." Productos de Saytzeff y de Hofmann" Formación del producto de Hofmann: las bases voluminosas también pueden participar en deshidrohalogenaciones que no sigan la regla de Saytzeff. El impedimento estérico a menudo evita que una base voluminosa abstraiga un protón que dé lugar al alqueno más sustituido. En estos casos, abstrae un protón menos impedido, normalmente el que da lugar a la formación del alqueno menos sustituido, llamado producto de Hofmann. La reacción de la figura da lugar principalmente al producto de Saytzeff con el ión etóxido como base (relativamente poco impedido), pero mayoritariamente al producto de Hofmann cuando reacciona con el ión terc-butóxido voluminoso" La regla de Saytzeff afirma que los enlaces dobles más sustituidos son más estables. Sin embargo, en una reacción de eliminación el uso de una base voluminosa dará lugar al producto menos sustituido, también conocido como producto de Hofmann. El producto de Hofmann se obtiene porque el impedimento estérico evita que la base atrape al protón que produce el enlace doble más sustituido." Productos de Saytzeff y de Hofmann." t La Reacción E1: compite con la reacción SN1; necesita un carbocatión intermediario (riesgo: transposiciones); orientación Zaitsev." " Chapter 6 69 Eliminación Unimolecular E1" ¿Cómo se produjeron los alquenos a partir de carbocationes?" El carbocatión puede sufrir otro proceso alternativo:" El nucleófilo, actuando como base, puede extraer un protón del carbono adyacente al carbocatión (posición β), dando lugar a una olefina. Evoluciones Posibles del Carbocatión" La proporción entre sustitución y eliminación no depende del grupo saliente porque el carbocatión formado es el mismo, pero sí de la relación basicidadnucleofilia de la base-nucleófilo atacante. " Cualquier hidrógeno contiguo al carbono que soporta el grupo saliente puede participar en la reacción E1. Por tanto, en el carbocatión generado a partir del 2-bromooctano se pueden obtener dos alquenos, el 1- y el 2octeno Mayor proporción El alqueno obtenido en mayor proporción es el más estable (más sustituido), esta observación empírica se conoce como regla de Zaitzev." Competencia Sustitución-Eliminación" El camino más rápido y, por tanto, el que prevalezca será el que conlleve el estado de transición más bajo en energía. " La altura relativa de los ET depende de:" a) la estructura del sustrato de partida" b) la nucleofilia-basicidad del nucleófilo-base" c) la polaridad del disolvente." Reglas Generales Sustitución-Eliminación" Nu débil Base débil" Nu fuerte Base débil" Nu fuerte Base fuerte" Nu fuerte Base fuerte (impedidos)" Sustrato" H2O, ROH" I-, Br-, RS-, N3-, RCOO-, PR3" HO-, CH3O-, EtO-, H2N"- (CH3)3CO-, [(CH3)2CH] 2N" Metil" No reacciona" SN2" SN2" SN2" Primario no impedido" No reacciona" SN2" SN2" E2" Primario ramificado" No reacciona" SN2 lenta" E2" E2" Secundario" SN1 lenta, E1" SN2" SN2 SN1, E1, E2" E2" Terciario" SN1, E1" SN1, E1" E2" E2" " En el caso de los nucleófilos HO-, CH3O-, EtO-, H2N-,(CH3)3CO-, el disolvente suele ser el correspondiente ácido conjugado. En los demás casos se supone un disolvente polar aprótico como la dimetilformamida, el dimetilsulfóxido o la acetona. " t Substitución versus Eliminación" l SN2 versus E2" Sustrato Primario " Si la base es pequeña, SN2 compite fuertemente debido a que no hay impedimento estérico en la aproximación al carbono" Sustrato Secundario" Se favorece E2 por el impedimento estérico " " Chapter 6 75 Sustrato Terciario " Hay mucho impedimento estérico y la eliminación predomina, en especial a temperaturas altas" " " " " > " Temperatura" Temperatura alta favorece eliminación sobre sustitución" Tamaño de la Base/Nucleófilo" Bases grandes impedidas estéricamente favorecen la eliminación porque no pueden acercarse directamente al carbono lo suficiente para que reaccione en una sustitución." ter-butóxido de Potasio es una base extremadamente voluminosa y se usa para favorecer una reacción E2 " 76 Chapter 6 Bases voluminosas para las reacciones E2" Utilización de bases voluminosas: si el sustrato es propenso a llevar a cabo reacciones de sustitución, una base voluminosa puede minimizar la cantidad de producto de sustitución. Los grupos alquilo grandes en una base voluminosa dificultan su aproximación para atacar a un átomo de carbono (sustitución), pero se puede abstraer un protón con facilidad (eliminación). Alguna de las bases fuertes voluminosas que se suelen utilizar frecuentemente para la eliminación son el ión terc-butóxido, la diisopropilamina, la trimetilamina y la 2,6dimetilpiridina. Las bases voluminosas y los haluros de alquilo impedidos son condiciones que favorecen la eliminación por encima de la sustitución. Cuadros Comparativos: SN1 – SN2 – E1 – E2 i. Condiciones Ideales" FACTOR" SN1" SN2" E1" E2" Sustrato" 3º > 2º > 1º" 1º > 2º > 3º " 3º > 2º > 1º" 3º > 2º > 1º" Solvente" Polar prótico" Polar aprótico" Polar prótico" Poco polar" Nu: ó B:" Débil, diluido, solvólisis" Fuerte y concentrado" Débil, diluida, solvólisis" Fuerte, concentrada" Bueno" Bueno" Bueno" Bueno" Moderado" Moderado" Fuerte" Fuerte" GS" ∆" Cuadros Comparativos: SN1 – SN2 – E1 – E2 ii. Reacción Favorecida en la Competencia" FACTOR MAGNIFICADO" SN1 vrs SN2" E1 vrs E2" SN vrs E" ∆" -" -" E" [ Nu: ]" SN2" E2" E" Fuerza de Nu: ó B:" SN2" E2" E" Ramificacion del Sustrato" SN1" -" E" Polaridad del disolvente" SN1" E1" SN" Preparación de Alquenos" t E2 – Reacciones de Eliminació de haluros de alquilo y tosilatos " " " Br NaOEt, EtOH heat + NaBr Otra base para la deshidrohalogenación: KOH / EtOH" t E1 – Deshidratación de alcoholes catalizada por ácido" OH H2SO4 (aq) heat + H2O Síntesis de alquinos: reacción de deshidrohalogenación." En algunos casos, se puede generar un triple enlace carbono-carbono eliminando dos moléculas de HX de un dihaluro. La deshidrohalogenación de un dihaluro geminal o vecinal da lugar a un haluro vinílico. En condiciones fuertemente básicas, puede tener lugar una segunda deshidrohalogenación para dar un alquino. Las base fuertes pueden deshidrohalogenizar los dihaluros vecinales o geminales para producir haluros vinílicos. Los haluros vinílicos pueden estar aislados o pueden reaccionar con una segunda base equivalente para producir el correspondiente alquino. La segunda deshidrohalogenación requiere condiciones extremadamente básicas y calor.
© Copyright 2026