Resultados con Viekirax/Exviera en el pre y postrasplante hepático
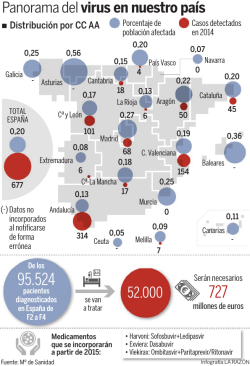
Abordaje del tratamiento de la hepatitis por VHC postrasplante hepático. Antivirales de acción directa: experiencia con 3D (Paritaprevir/Ritonavir, Ombitasvir, Dasabuvir). Alejandra Otero Ferreiro Unidad de Trasplante Hepático Hospital Universitario de A Coruña ES/HCV/1015/0898 ¿De dónde venimos? La infección por el VHC es una de las principales causa de enfermedad crónica hepática. La hepatopatía producida por la infección de VHC es la indicación más frecuente de trasplante hepático a nivel mundial. La recidiva de la infección por VHC en el injerto es universal y la progresión de la fibrosis se acelera tras el trasplante. La recurrencia de la infección pos-trasplante puede ser agresiva (< 5%) El 20% – 30% de los receptores desarrollan una cirrosis en 5 años Los regímenes de tratamiento con interferón + ribavirina (“standar of care”) se asocian a una tasa de respuesta baja (13-43%) y con importantes efectos secundarios. La incorporación de los IPs de 1º generación (Boce/Tela)+IFN+RBV aumentaron la tasa de respuesta a un 20-70% pero con importantes efectos secundarios (anemia) La aparición de AAD en regímenes libres de interferón suponen una esperanza para el tratamiento de VHC postrasplante tanto en tasa de respuesta como de tolerancia al tratamiento. ES/HCV/1015/0898 1.Charlton M, et al. Liver Transpl 2004;10:1120−30. 2.Crespo G, et al. Gastroenterology 2012;142:1373-83. 3.Barcena R, et al. Clin Transplant 2010 ;24:366-74. 4.Ross AS, et al. Clin Transplant 2004;18:166-73. Tres mecanismos de acción en fases diferentes del ciclo de replicación del VHC Unión del receptor del VHC y endocitosis 3. INHIBICIÓN A MITAD/FINAL DEL CICLO DE VIDA con un inhibidor de NS5A del VHC Transporte y liberación Ombitasvir (ABT-267) 1. INHIBICIÓN TEMPRANA con un inhibidor de la proteasa NS3/4A del VHC Paritaprevir (ABT-450) Traducción y procesamiento de poliproteínas Fusión y desenvoltura GOLGI RE 3 NS5A: FUNDAMENTAL PARA LA REPLICACIÓN, ENSAMBLAJE Y SALIDA DEL VHC Ensamblaje del virión ARN (+) RE 1 2 2. INHIBICIÓN A MITAD DEL CICLO DE VIDA con un inhibidor no nucleósido de la polimerasa NS5B Replicación del ARN Dasabuvir (ABT-333) INHIBIDOR DE PROTEASA INHIBIDOR DE POLIMERASA Lindenbach & Rice. Nature 2005:436;933−38. ES/HCV/1015/0898 Tres mecanismos de acción en fases diferentes del ciclo de replicación del VHC ABT - 450 Paritaprevir ABT - 333 Dasabuvir Replicón de genotipo 1a 50 (10 5 cells) (105 células) Frecuencia of de Frequency colonias resistentes resistant colonies >1% Paritaprevir ABT - 450 + +ABT Ombitasvir - 267 ~ 0,5% 0.5% Paritaprevir + Dasabuvir >>1% % Ombitasvir ABT - 267 ++ Dasabuvir ABT - 333 10X10+ x10X + 10ECx EC50 50 (106 6células) cells) (10 Frecuencia de colonias resistentes (%) 10 10Xx EC50 Ombitasvir 0,0050 0,0040 0,0030 0,0020 0,0010 < 0,0001 0,0000 Frecuencia Frequency ofde coloniascolonies resistentes resistant 10 x Ombitasvir + 10 x Dasabuvir 0.0027% 0,0027% Paritaprevir ABT - 450 + +Ombitasvir ABT - 267 ++ Dasabuvir ABT - 333 0.0011% 0,0011% 0.0045% 0,0045% 5 x ++ 5x 5X 5 x++ 5Xx EC 5 EC50 50 10X 10 x++10x 10 x++ 10Xx EC 10 EC50 50 10 x Ombitasvir + 10 x Paritaprevir 10 x Dasabuvir + 10 x Paritaprevir Triple combinación, 5 x o 10 x cada uno No sobrevivió ninguna colonia (< 0,0001%) al usar los tres fármacos en combinación, tampoco a bajas concentraciones (5 x por encima de las EC50 correspondientes). 66 (10 (10 células) cells) Frecuencia de Frequency of resistant colonias resistentes colonies < 0,0001% < 0,0001% Pilot-Matias, T, et al. In vitro combinatory effect of HCV NS3/4A protease inhibitor ABT-450, NS5A inhibitor ABT267, and non-nucleoside NS5B polymerase inhibitor ABT-333. Presentado en la 47 Reunión Anual de la Asociación Europea para el Estudio del Hígado (EASL 2012), 18-22 de abril, 2012, Barcelona, España. Póster 867 EC50 = concentración eficaz media. ES/HCV/1015/0898 Resultados del estudio de fase III – GT1 FV Discontinuaciones RVS12 Recaída 3D + RBV durante 12 semanas (n = 473) Placebo durante 12 semanas (n = 158) 96% 1,5% 0,2% 0.6%3 0.6%3 GT1, no cirróticos, tratamiento previo con P/R 3D + RBV durante 12 semanas (n = 297) Placebo durante 12 semanas (n = 97) 96% 2,4% 0% 1.0%4 0 %4 TURQUOISE-II1,2 (n = 380) GT1, sin tratamiento previo y tratamiento previo con P/R; con P/R, con cirrosis compensada (CPA) 3D + RBV durante 12 semanas (n = 208) 3D + RBV durante 24 semanas (n = 172) 92% 97% 5,9% 0,6% 0,5% 1,7% 1.9%5 2.3%5 PEARL-II1,2 (n = 179) GT1b, no cirróticos, tratamiento previo con P/R 3D + RBV durante 12 semanas (n = 88) 3D - RBV durante 12 semanas (n = 91) 98% 100% 0% 0% 2.2%6 0 %6 PEARL-III1,2 (n = 419) GT1b, no cirróticos, sin tratamiento previo 3D + RBV durante 12 semanas (n = 210) 3D - RBV durante 12 semanas (n = 209) 99,5% 100% 0% 0,5% 0% 0 %7 0 %7 PEARL-IV1,2 (n = 305) GT1a, no cirróticos, sin tratamiento previo 3D + RBV durante 12 semanas (n = 100) 3D - RBV durante 12 semanas (n = 205) 97% 90% 1% 5% 1% 2,9% 0 %7 1%7 Estudio Población Pauta SAPPHIRE-I1,2 (n = 631) GT1, no cirróticos, sin tratamiento previo SAPPHIRE-II1,2 (n = 394) 3D: tres antivirales de acción directa, ombitasvir/paritaprevir/ritonavir y dasabuvir P/R: peginterferón + ribavirina; CPA, Child-Pugh A FV: fallo virológico por EAs 1. Ficha técnica de Viekirax® (ombitasvir/paritaprevir/ritonavir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h982.htm 2. Ficha técnica de Exviera® (dasabuvir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h983.htm 3. Feld JJ, et al. N Engl J Med. 2014;370(17):1594–603 4. Zeuzem S, et al. N Engl J Med. 2014;370(17):1604–14 5. Poordad F, et al. N Engl J Med. 2014;370(21):1973–82 6. Andreone P, et al. Gastroenterology. 2014;147(2):359–65. 7. Ferenci P, et al. N Engl J Med. 2014;370(21):1983–92 ES/HCV/1015/0898 Resultados Fase III – Poblaciones especiales y GT4 Discontinuaciones por EAs RVS12 Recaída FV GT1, recurrente en receptores de trasplante hepático con puntuación 3D + RBV durante 24 semanas de fibrosis 2 o menos en METAVIR (leve a moderada) 97% 2.9% 0% 0%3 TURQUOISE-I1,2 (n = 63) GT1, coinfección por VHC/VIH, con y sin cirrosis, 3D + RBV durante 12 semanas (n = 31) sin tratamiento previo y 3D + RBV durante 24 semanas (n = 32) tratamiento previo con P/R 94% 91% 3,2% 6,3%b 0% 3,1% 0%4 M14-1031,2 (n = 38) GT1, receptores en tratamiento de sustitución de opioides, no cirróticos 97% 0% 0% 2,6%5 PEARL-I1,2 (n = 135) GT4, no cirróticos sin tratamiento previo: 2Da + RBV durante 12 semanas (n = 42) sin tratamiento previo : 2Da - RBV durante 12 semanas (n = 44) tratamiento previo con P/R: 2Da + RBV durante 12 semanas (n = 49) 100% 91% 100% 0% 4,5% 0% 0% 2,3% 0% 0%6 Estudio Población CORAL-I1,2 (n = 34) P/R: peginterferón/ribavirina; GT: genotipo C-P A, Child-Pugh A a. 2D: dos antivirales de acción directa – ombitasvir y paritaprevir/r; b. Ambas recaídas parecen ser resultado de una reinfección Pauta 3D + RBV durante 12 semanas 1. Ficha técnica de Viekirax® (ombitasvir/paritaprevir/ritonavir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h982.htm 2. Ficha técnica de Exviera® (dasabuvir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h983.htm 3. Kwo PY, et al. N Engl J Med. 2014 Dec 18;371(25):2375-82 4. Sulkowski MS, et al. JAMA. 2015 Feb 23 5. Lalerazi J et al. J Hepatol. 2015 Mar 31. pii: S0168-8278(15)00237-8. 6. Hézode C. et al. Lancet. 2015 Mar 30. pii: S0140-6736(15)60159-3. ES/HCV/1015/0898 Pauta terapéutica recomendada conforme a la ficha técnica de la UE GENOTIPO GT1b GT1a CIRROSIS TRATAMIENTO DURACIÓN Sin cirrosis Con cirrosis compensada 1212SEMANAS SEMANAS Sin cirrosis Con cirrosis compensada † 24 SEMANAS 24 SEMANAS GT4 12 SEMANAS Sin cirrosis Con cirrosis compensada 24 SEMANAS Poblaciones Especiales Receptores de Trasplante Hepático con VHC GT1 § Receptores de Trasplante Hepático con VHC GT4 § 24 SEMANAS Los pacientes coinfectados con VIH deben seguir las mismas recomendaciones que los pacientes monoinfectados. Para aquellos pacientes con GT1 de subtipo desconocido o GT1 mixto, seguir las recomendaciones para pacientes con GT1a. † En pacientes con GT1a con cirrosis compensada con valores basales favorables (AFP < 20 ng/ml, recuento de plaquetas ≥ 90 x 109/l y albúmina ≥ 35 g/l), las tasas de recidiva fueron similares en sujetos tratados durante 12 o 24 semanas. § Pacientes que no habían recibido tratamiento para la infección por el VHC después del trasplante y que tenían una puntuación METAVIR de la fibrosis de F2 o menos. = RBV. Ribavirina. Para consultar las indicaciones de administración específicas, incluida la modificación de la dosis, ver la Ficha Técnica respectiva. 1. Ficha técnica de Viekirax® (ombitasvir/paritaprevir/ritonavir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h982.htm 2. Ficha técnica de Exviera® (dasabuvir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h983.htm ES/HCV/1015/0898 Eficacia y seguridad de 3D + RBV en receptores de trasplante hepático con infección por VHC de GT1 recurrente CORAL-I ES/HCV/1015/0898 CORAL-I: objetivo y diseño del estudio Criterio principal de valoración RVS12 3D + RBV (N = 34) Día 0 • Semana 24 Trasplante hepático debido a infección por VHC ≥ 12 meses antes de la selección • Sin tratamiento previo después del trasplante • Se permite tratamiento con pegIFN/RBV antes del trasplante • Puntuación en Metavir ≤ F2 confirmada por biopsia hepática en la selección RVS24 A Semana 72 DOSIS TAC/CYA: Las dosis recomendadas durante el tratamiento 3D fueron: • TAC 0,5 mg una vez por semana ó 0,2 mg cada 3 días • CYA 1/5 de la dosis diaria pretratamiento con 3D administrada una vez al día 1. Ficha técnica de Viekirax® (ombitasvir/paritaprevir/ritonavir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h982.htm 2. Ficha técnica de Exviera® (dasabuvir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h983.htm 3. Kwo PY, et al. N Engl J Med. 2014 Dec 18;371(25):2375-82. ES/HCV/1015/0898 CORAL-I: características basales 3D + RBV (N = 34) Mediana del tiempo desde el trasplante (meses) Hombre (%) Edad media (años) Estadio de fibrosis (%) F0/F1/F2 IL28B no CC (%) Subtipo del VHC (%) GT1a/GT1b Media de ARN del VHC (log10 UI/ml) Tratamiento inmunosupresor (%) TAC/CSA Media de aclaramiento de creatinina (ml/min) Media de ALT (U/l) Media de AST (U/l) Media de GGT (U/l) 39,5 79,4 59,6 17,6/38,2/44,1 76,5 85,3/14,7 6,6 85,3/14,7 90,5 78,9 63,9 170,3 1. Ficha técnica de Viekirax® (ombitasvir/paritaprevir/ritonavir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h982.htm 2. Ficha técnica de Exviera® (dasabuvir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h983.htm 3. Kwo PY, et al. N Engl J Med. 2014 Dec 18;371(25):2375-82. ES/HCV/1015/0898 CORAL-I: manejo de la dosis de los inmunosupresores Comparación de los valores de Cmín de ciclosporina observados en el periodo de preinclusión frente a los observados durante el periodo de tratamiento con 3D Comparación de los valores de Cmín de tacrolimus observados en el periodo de preinclusión con respecto a los valores de Cmín previstos en el modelo durante las primeras cuatro semanas del periodo terapéutico con 3D ANTES DEL TRATAMIENTO CON 3D (OBSERVADO) DURANTE EL TRATAMIENTO CON 3D (PREVISTO) Las dosis de TAC variaron de 0,25 mg a 0,5 mg administradas con una mediana del intervalo posológico de 10 días. Dos sujetos recibieron 0,2 mg de TAC con una mediana del intervalo de administración de 5 días. La parte inferior de la caja indica el percentil 25, la línea en el interior de la caja marca la mediana, el diamante negro presente en la caja es la media y la parte superior representa el percentil 75. Las líneas que aparecen por encima y por debajo de la caja indican los valores superior e inferior con un margen de 1,5 veces del intervalo intercuartílico. Cuatro sujetos con errores de dosificación de TAC se excluyeron de la figura. Concentración de ciclosporina (ng/ml) Concentración de tacrolimus (ng/ml) Concentraciones mínimas de tacrolimus antes y durante el tratamiento con 3D Concentraciones mínimas de ciclosporina antes y durante el tratamiento con 3D ANTES DEL TRATAMIENTO CON 3D DURANTE EL TRATAMIENTO CON 3D Las dosis de CSA variaron de 25 mg a 75 mg QD al administrarlas con 3D. La parte inferior de la caja indica el percentil 25, la línea en el interior de la caja marca la mediana, el diamante negro presente en la caja es la media y la parte superior representa el percentil 75. Las líneas que aparecen por encima y por debajo de la caja indican los niveles superior e inferior en un margen de 1,5 x del intervalo intercuartílico. Kwo PY, et al. N Engl J Med. 2014 Dec 18;371(25):2375-82 ES/HCV/1015/0898 CORAL-I: eficacia en receptores de trasplante hepático 100 97,1 • Un paciente presentó recidiva virológica (día 3 posterior al tratamiento) Pacientes (%) 75 50 25 33 34 0 Motivos por los que no se logra RVS RVS12 • En el momento de la recidiva, este paciente disponía de las variantes de aminoácidos R155K en proteasa NS3, M28T + Q30R en NS5A y G554S en NS5B, ninguna estuvo presente en el periodo inicial • No se produjo la pérdida del seguimiento de ningún paciente 1. Ficha técnica de Viekirax® (ombitasvir/paritaprevir/ritonavir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h982.htm 2. Ficha técnica de Exviera® (dasabuvir) comprimidos http://ec.europa.eu/health/documents/community-register/html/h983.htm ES/HCV/1015/0898 CORAL-I: AA desarrollados por > 95% de los pacientes Acontecimiento, n (%) 3D + RBV (N = 34) Cualquier AA 33 (97,1) Fatiga 17 (50,0) Cefalea 15 (44,1) Tos 11 (32,4) Anemia 10 (29,4) Diarrea 9 (26,5) Insomnio 9 (26,5) Astenia 8 (23,5) Náuseas 8 (23,5) Espasmos musculares 7 (20,6) Exantema 7 (20,6) Dolor de espalda 6 (17,6) Mareos 6 (17,6) Edema periférico 6 (17,6) Rinorrea 6 (17,6) Kwo PY, et al. N Engl J Med. 2014 Dec 18;371(25):2375-82. ES/HCV/1015/0898 CORAL-I: anomalías de laboratorio Acontecimiento, n (%) 3D + RBV (N = 34) ALT grado 3/4 (> 5 × LSN) 0 AST grado 3/4 (> 5 × LSN) 0 Bilirrubina total grado 3/4 (> 3 × LSN) 2 (5,9) Fosfatasa alcalina grado 3/4 (> 5 × LSN) 0 Creatinina ≥ 2,1 mg/dl 0 Aclaramiento de creatinina < 50 ml/min 0 • Ningún episodio de rechazo agudo o crónico • Un paciente (2,9%) interrumpió el fármaco del estudio el día 144 del estudio por AA (exantema moderado, deterioro de la memoria y ansiedad) pero logró una RVS12 • 2 sujetos presentaron AA graves Hipotensión y taquicardia asociados al uso de tamsulosina (Flomax) tras cirugía programada Dolor y edema periférico moderado en extremidades de un paciente diabético con antecedentes de edema • Los aumentos en bilirrubina total se produjeron en un único punto temporal y fueron, principalmente, indirectos. Acontecimiento, n (%) 3D + RBV (N = 34) < LIN – 10,0 g/dl (Grado 1) 11 (32,4) • Ningún paciente interrumpió el tratamiento del estudio por anemia < 10,0 – 8,0 g/dl (Grado 2) 9 (26,5) • 5/34 (14,7%) sujetos recibieron eritropoyetina < 8,0 - 6,5 g/dl (Grado 3) 1 (2,9) < 6,5 g/dl (Grado 4) 0 Estos pacientes disponían de dosis de RBV iniciales de 1.000 a 1.200 mg al día • Ningún sujeto precisó una transfusión Kwo PY, et al. N Engl J Med. 2014 Dec 18;371(25):2375-82. ES/HCV/1015/0898 Estudios clínicos de fase IIIb y IV en marcha con 3D y 2D ES/HCV/1015/0898 Estudios clínicos en marcha: datos en poblaciones especiales Study TURQ-I M13-101 M13-102 MALACH-I Design RUBY-II TURQ-III TURQ-IV TURQCPB Primary Completion Date Treatment Status 300 Nov 2016 Sept 2015 3D + RBV 12w or 24w Recruiting 93 June 2017 Oct 2015 2D + PegIFN +RBV 24w Ongoing 500 Oct 2016 Oct 2016 Long Term Data Ongoing GT1, naive 314 July 2015 Nov 2014 GT1, exp 150 July 2015 Nov 2014 40 March 2016 May 2015 40 July 2016 May 2016 50 Nov 2015 June 2015 36 Dec 2015 Nov 2015 50 Oct 2016 July 2015 Population GT1, HIV-HCV co-infected, with Darunavir once or twice-daily subjects Single Group, Open GT1, virologic failures in previous Label Abbvie trials Single Group, Open Subjects who achieved or not SVR in Label previous Abbvie studies Randomized, Parallel, Open Label Randomized, Parallel, Open Label MALACH- Randomized, Parallel, Open Label II RUBY-I N Estimated Completion Date GT1, naïve, severe renal impairment or end stage renal disease with or without cirrhosis Non randomized, GT1a y GT4, severe renal impairment Open label ore end stage renal disease Single Group, Open GT1b, compensated cirrhosis, RBV Label free Single Group, Open GT1b, compensated cirrhosis Label (Russian/Belarus) Single Group, Open Label Non-Randomized GT1 y GT4, decompensated cirrhosis Parallel, Open Label (CPB) 3D vs Telaprevir + PegIFN 12w 3D vs Telaprevir + PegIFN 12w 3D ± RBV 12w or 24w Ongoing Ongoing Recruiting Gt1a- 3D GT4- 2D 3D 12w 3D + RBV 12w Waiting recruiting Ongoing Recruiting 3D/2D + RBV 12w or 24w Recruiting www.clinicaltrials.gov ES/HCV/1015/0898 Estudios clínicos en marcha: datos en poblaciones especiales Study N Estimated Completion Date Primary Completion Date 1650 Dec 2020 Sept 2015 600 Mar 2020 Aug 2015 Design Population Single Group, Open Label Single Group, Open Label Long-Term Outcomes according label. Fibrosis regression (OUS) Long-Term Outcomes according label. Fibrosis regression (US) M14-224 Single Group, Open Label GT1, retreatment with SOF in DAA failures 20 Oct 2016 Feb 2016 AGATE-I Randomized, Parallel, Open Label GT4, compensated cirrhotic, naïve and pretreated (DAAs) 190 Jan 2017 Sep 2016 CORAL-I Non-Randomized Parallel, Open Label amend #4 Post-transplanted (F1-F3) naive or prior peg/RBV NR 40 Mar 2017 Jan 2017 CORAL-I Non-Randomized Parallel, Open Label amend #5 Liver transplant CPA cirrhosis Early treatment post transplant Post-kidney transplant 40 40 25 TOPAZ-I TOPAZ-II Mar 2017 Jan 2017 Treatment 3D ± RBV 12w or 24w 3D ± RBV 12w or 24w 3D + Sofosbuvir ± RBV 12w or 24w 2D ± RBV 12w, 16w or 24w 3D ± RBV 24w Status Recruiting Ongoing Recruiting Recruiting Recruiting 3D + RBV for 12w or 24w Recruiting 3D ± RBV for 12w 3D ± RBV for 12w M14-478 TBD Pediatric TBD Selection M14-529 TBD GT1, 3D QD TBD Selection www.clinicaltrials.gov ES/HCV/1015/0898 Tratamiento con 3D en pacientes receptores de trasplante hepático: Experiencia de Unidad de Trasplante Hepático de A Coruña. ES/HCV/1015/0898 CHUAC: características basales 3D/2D + RBV (N =22) Mediana del tiempo desde el trasplante (meses) 77,5 Hombre (%) 86,3 Edad media (años) 63,3 Estadio de fibrosis (%) F0/F1/F2 4,5/63,6/31,8 Subtipo del VHC (%) GT 1a GT 1b GT 4 18 77,5 4,5 Media de ALT (U/l) 95,1 Media de AST (U/l) 109,59 Media de GGT (U/l) 191,68 ES/HCV/1015/0898 Datos no publicados. EOXI Coruña CHUAC: características basales 3D/2D + RBV (N =22) Tratados antes del trasplante (IFN/RVB) n/% Elastografía Kpa (mediana) RNA media (UI/ml) Creatinina (mg/dl ) /TFG ml/mto (media) 12 (54,5%) 7,1 4.618.653 1,2 / 80 Inmunosupresión: Tacrolimus n/% * 14 (63,6%) Ciclosporina n/% 6 (27,3%) MMF en monoterapia n/% 2 (9,1%) 1 paciente tacrolimus + everolimus* * Contraindicado en F.T. actualmente ES/HCV/1015/0898 Datos no publicados. EOXI Coruña Diseño del tratamiento RVS12 3D/2D + RBV (n= 22) Día 0 Semana 24 • Trasplante hepático debido a infección por VHC • Estadío de fibrosis ≤ F2 • 1 paciente con genotipo 4: 2D+Ribavirina • Se incluyeron pacientes con insuficiencia renal. ES/HCV/1015/0898 RVS24 A Semana 72 DOSIS TAC/CyA: Las dosis recomendadas durante el tratamiento 3D fueron: • TAC 0,5 mg una vez por semana • CYA 1/5 de la dosis diaria pretratamiento con 3D administrada una vez al día • MMF: No se realizó reajuste Datos no publicados. EOXI Coruña Diseño del seguimiento Bioqumica Niveles Bioqumica Niveles RNA Bioqumica Niveles RNA Bioqumica Niveles RNA Bioqumica Niveles RNA Inicio Semana 1 Semana 4 S-6 Semana 12 Semana 24 semana 1 post-tto Fin ES/HCV/1015/0898 Datos no publicados. EOXI Coruña Inmunosupresión: Tacrolimus Dosis basalmg/dia Nivel basal ng/ml Dosis inicio mg/semana Nivel s-1 ng/ml Nivel s-4 ng/ml Ajuste dosis 1 1 5,7 0.5 4,7 7,1 No 2 1 1,80 0.5 5,2 9,0 No 3 1 8,2 0.5 6.8 6,2 No 4 2 6,0 0.5 3,2 5,0 No 5 2 3,8 0.5 3,7 9,0 No 6 2 4,8 0.5 5.8 5,2 No 7 2 4,6 0.5 2,7 5,3 No 8 1 4.3 0.2 6,7 6,0 No 9 1.5 3,4 0.5 2,9 10 Si 10 5 8,1 0.5 6,1 4,9 No 11 1 12 0.5 5,7 12 Si 12 1 3,0 0.5 2,0 6,8 No 13 1 4,2 0.5 3,4 9,0 No 14 5 9,3 0,5 6,6 8,7 No ES/HCV/1015/0898 Datos no publicados. EOXI Coruña Inmunosupresión: Ciclosporina Dosis basal mg/dia Nivel basal Dosis inicio tto Nivel s-1 (mg/dia) (mg/dia) Nivel s-4 (mg/dia) Ajuste de dosis 1 125 646 25 564 435 No 2 100 515 20 96 (C0) 75 (C0) Si 3 150 910 25 500 1002 No 4 125 554 25 341 350 No 5 100 345 25 531 528 No 6 150 462 50 557 1060 No Datos no publicados. EOXI Coruña ES/HCV/1015/0898 Niveles Tacrolimus Nivel tacro ng/ml ES/HCV/1015/0898 tiempo Datos no publicados. EOXI Coruña Niveles de ciclosporina (n=6) Niveles Ciclosporina media min/max basal Semana 1 (n=5) Semana 4 (n=5) 572 498 675 345-910 341-564 350-1060 Nivel CyA ng/ml ES/HCV/1015/0898 tiempo Datos no publicados. EOXI Coruña Niveles Everolimus* Supresión EVER 35 Inicio 3 D 30 25 20 Nivel evero ng/ml Edema MMII Cefalea Anemia 15 10 5 0 Basal * Contraindicado en F.T. ES/HCV/1015/0898 Semana 1 Semana 2 Semana 4 Datos no publicados. EOXI Coruña Efectos adversos Acontecimiento Cualquier AA n (%) Hiper-bilirrubinemia * Anemia ** Cefalea 3D /2D+ RBV (N = 22) 15 (68) 9 (40,0) 8 (36,0) 4 (18,0) Náuseas 2 (9,0) *3 pacientes grado 3: BT >4 mg/dl (BT indirecta) **2 pacientes Hgb < 8 mg/dl. Los 2 pacientes se trasfundieron. Ningún paciente presentó rechazo Datos no publicados. EOXi Coruña ES/HCV/1015/0898 BT mediana mg/dl Hiperbilirrubinemia 16 Inicial semana 1 semana 4 1,0 (0,4-2,7) 2,3 (0,4-15) 1,6 (0,5-13) 15 14 13 12 10 8 7,2 6 6 4,8 5,7 5,3 4 2 0 2,7 1,6 0,5 bil inicial semana1 semana 4 semana 12 Datos no publicados. EOXI Coruña ES/HCV/1015/0898 Anemia *Dos pacientes se trasfundieron Ribavirina • Dosis inicial: 200-1000 mg (90% recibió 800-1000 mg) • 8 pacientes (36%) requirieron reducción de dosis de ribavirina. 3 pacientes requirieron suspensión de ribavirina Datos no publicados. EOXI Coruña ES/HCV/1015/0898 Función renal N=22 Creatinina mg/dl n (%) >/= 1,5 <1,5 TFG ml/mto >60 41-60 <40 ES/HCV/1015/0898 4 (18%) 18 (81%) n (%) 12 (54,5%) 6 (27,2%) 4 (18,1%) Creatinina mg/dl TFG ml/mto 1,8 38 1,8 40 1,8 40 2,3 23 Datos no publicados. EOXI Coruña Función renal: Evolución de creatinina en 4 pacientes con insuficiencia renal > 1,5 mg/dl 2,5 2 1,5 Pac 1 Pac 2 Pac 3 Pac 4 1 0,5 0 mg/dl basal Semana 4 Semana 12 Datos no publicados. EOXI Coruña ES/HCV/1015/0898 Función renal: Evolución de TFG en 4 pacientes con insuficiencia renal < 40 ml/mto 60 50 40 30 Pac 1 Pac 2 Pac 3 Pac 4 20 10 0 ml/mto ES/HCV/1015/0898 basal semana 4 semana 12 Datos no publicados. EOXI Coruña Resultados: G1b (17 pacientes) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b 1b Basal 1000 UI/ml 312 8412 3679 337 8910 537 217 2688 919 33640 710 10400 3600 1269 1134 3046 1280 S-4 neg 26 neg neg 301 neg neg neg neg 33 101 31 32 neg neg 26 neg S-6 neg neg neg neg neg neg S-12 neg neg neg neg neg neg neg neg neg neg neg neg neg neg S-24 neg neg neg neg neg neg neg neg neg neg neg neg neg neg S-4 postto neg neg neg neg neg neg neg neg neg neg neg neg neg neg neg Datos no publicados. EOXI Coruña ES/HCV/1015/0898 neg Resultados: G1a (4 pacientes) y G4 (1 paciente) neg 1 2 3 4 5 1a 1a 1a 1a 4 Basal *1000 11540 47 33 5274 3618 S-4 neg neg neg neg neg S-12 neg neg neg neg neg S-24 neg neg neg neg neg neg neg neg neg S-6 S-4 pos-tto ES/HCV/1015/0898 Datos no publicados. EOXI Coruña Resultados: RNA negativo 100 100 100 90 80 70 68 60 50 40 30 20 10 0 15/22 22/22 22 /22 19/19 16/16 Semana 4 Semana 6 Semana 12 EOT RVS 4 Datos no publicados. EOXI Coruña ES/HCV/1015/0898 Conclusiones 1.-La combinación de Paritaprevir/ritonavir, Ombitasvir y Dasabuvir es seguro en el contexto del trasplante hepático, incluso en pacientes con insuficiencia renal. 2.-Es necesario realizar ajustes en la inmunosupresión. Los niveles tras el ajuste se mantiene bastante estables. 3.-Los efectos secundarios más importantes fueron el aumento de la bilirrubina y la anemia 4.-Con solo el 73% de los pacientes analizados, la combinación de Paritaprevir/ritonavir, Ombitasvir y Dasabuvir es eficaz para el tratamiento del VHC postrasplante. 15/22 ES/HCV/1015/0898 22/22 22 /22 19/19 16/16 Muchas gracias
© Copyright 2026