AVISO URGENTE DE SEGURIDAD: Acción de seguridad en campo
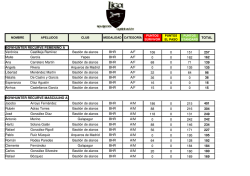
Smith & Nephew Orthopaedics Aurora House Spa Park Harrison Way Leamington Spa Warwickshire CV31 3HL T 01926 482400 www.smith&nephew.com 3 de Junio de 2015 AVISO URGENTE DE SEGURIDAD: Acción de seguridad en campo relativa a dispositivos médicos Producto afectado: Referencia FSCA: Acción Correctiva de seguridad: Detalles del producto afectado: Prótesis de superficie BIRMINGHAM HIP™ (BHR) R-2015-08 Modificación y retirada del mercado del producto BHR Véase a continuación Distinguido Dr.Llopis: El motivo de la presente carta es informarle de la acción correctiva de seguridad voluntaria (FSCA, Field Safety Corrective Action) adoptada referente las Prótesis de superficie BIRMINGHAM™ HIP (BHR™), producto fabricado por Smith & Nephew Orthopaedics Ltd., Leamington Spa, Reino Unido. Esta FSCA proporciona información actualizada referente al rendimiento clínico del sistema BHR en ciertos grupos de pacientes. Extracto: El uso del sistema BHR en mujeres va a estar contraindicado, Los componentes de la cabeza femoral BHR con un diámetro de 46mm o menor, así como sus correspondientes cotilos acetabulares, no deben utilizarse más y deben devolverse a Smith & Nephew; y Los pacientes que necesiten una cabeza femoral de 48 mm tienen un riesgo elevado moderado de revisión con lo que no deben considerarse candidatos para la implantación del sistema BHR. Las cabezas de 48 mm solo deberían utilizarse en la circunstancia específica de cambio intraoperatorio a un tamaño menor al de 50 mm obtenido con plantilla preoperatoria al medir 48 mm en el momento de la intervención. Esta acción en campo se ha comunicado a las autoridades competentes. ™ Marca comercial de Smith & Nephew 1/5 Antecedentes Según comunicó Smith & Nephew en enero de 2015 mediante la acción correctiva de seguridad voluntaria R2014-12, los análisis estadísticos detallados de los datos de registro del sistema BHR del Registro Nacional de Reemplazo Articular de Inglaterra y Gales (NJREW), del Registro Nacional de Reemplazo Articular de la Asociación Australiana de Ortopedia (AOANJRR) y del Registro Sueco de Artroplastia de Cadera indican que los pacientes que sean mujeres, los varones de 65 años de edad o más y los pacientes que precisen componentes de la cabeza femoral de 48 mm de diámetro o más pequeños tienen un mayor riesgo de revisión prematura que otros pacientes. Se destacó además que la supervivencia global del implante del sistema BHR conforme representan dichos registros sigue siendo aceptable. Motivo de la presente FSCA Como parte de estos procesos de vigilancia poscomercialización y de seguimiento clínico posterior a la comercialización, Smith & Nephew ha llevado a cabo un análisis de datos recientes del Registro Nacional de Reemplazo Articular de Inglaterra y Gales (NJREW), (la cohorte más grande del registro de artroplastia de pacientes de BHR). A continuación realizamos una Evaluación de riesgos para la salud a fin de revisar este análisis. Los datos indican que el rendimiento del sistema BHR continua siendo bueno en la población masculina que necesita componentes de la cabeza femoral de 50 mm de diámetro o mayores. Sin embargo, las tasas de revisión asociadas con el sexo femenino, y tamaños de cabeza femoral más pequeños independientemente del sexo, son menos buenas y sobrepasan el punto de referencia de las tasas de revisión actuales establecido por el Instituto Nacional de Excelencia para la Salud y los Cuidados del Reino Unido (NICE). Información relativa a la seguridad de los pacientes Smith & Nephew han revisado estos datos y han determinado que: El sistema BHR debería estar contraindicado para todos los pacientes que sean mujeres y, a falta de la aprobación por nuestro organismo notificado, se deberían hacer cambios en las instrucciones de uso que reflejen este hecho, Los componentes de la cabeza femoral de 46 mm de diámetro y de menor tamaño, así como sus correspondientes cotilos acetabulares, no deberían utilizarse más y se retirarán del mercado, y Pendiente de aprobación por nuestro organismo notificado, se añadirá una advertencia en las instrucciones de uso que indique que los pacientes que, a partir de una plantilla radiográfica preoperatoria, parezcan precisar cabezas femorales de 48 mm no deberían ser considerados candidatos adecuados para la implantación del BHR. Los pacientes que necesiten una cabeza femoral del tamaño de 48 mm tienen un riesgo elevado moderado de precisar cirugía de revisión antes de lo previsto. Aunque Smith & Nephew ha concluido que el mayor riesgo asociado a este tamaño de cabeza no es superior al posible beneficio para el paciente en la circunstancia específica de cambio 2/5 intraoperatorio a un tamaño menor al de 50 mm obtenido con plantilla preoperatoria al medir 48 mm en el momento de la intervención, los cirujanos deben usar su mejor criterio médico cuando consideren esta información en relación con la historia clínica general del paciente y el pronóstico a la hora de determinar su idoneidad como tratamiento quirúrgico. Este Aviso de seguridad no modifica las prácticas actuales de seguimiento de los pacientes para este producto. Smith & Nephew no está aconsejando que una paciente que tenga colocado un sistema BHR, o que los pacientes de cualquier sexo que tengan colocado un BHR con una cabeza femoral de 48 mm o menor, deban revisarse de forma proactiva, salvo que esto sea necesario conforme al criterio clínico de cada uno de los médicos que tratan a dichos pacientes. Estamos recomendando que los médicos mantengan su protocolo de seguimiento rutinario para los pacientes que se hayan sometido a una artroplastia de reparación superficial de cadera. Los pacientes que experimenten síntomas, incluidos movilidad limitada, dolor, inflamación, bursitis, pseudotumores, masas tisulares, acumulación de líquido o acumulación local de un exceso de partículas metálicas o hipersensibilidad al metal, pueden precisar una cirugía de revisión, con los consiguientes riesgos y la posibilidad de deterioro funcional. La necesidad de realizar un seguimiento adicional, incluida la necesidad de tomar imágenes de diagnóstico y realizar análisis de sangre, deberá determinarse en función de cada caso tras una valoración detallada de las circunstancias clínicas de los pacientes. En algunas jurisdicciones, las sociedades ortopédicas o las autoridades nacionales competentes han recomendado protocolos de seguimiento y tratamiento posoperatorio de los pacientes con artroplastia de reparación superficial de cadera según el tipo de producto y la presentación clínica. Estos protocolos pueden conllevar la selección tanto de pacientes sintomáticos como asintomáticos. Medidas que debe adoptar el usuario 1. Cumplimentar el formulario de devolución y enviarlo a la atención del departamento de Calidad, según los datos de contacto que se indican en esta carta, para confirmar la recepción de este Aviso de seguridad. 2. Asegurarse de que esta información de seguridad se transmite a todas las personas de su organización que deban conocerla. 3. Tener presente este aviso y la medida resultante durante un periodo razonable para garantizar la efectividad de la medida correctiva. 4. Solicitar al departamento de gestión de materiales de su centro que revise el inventario y localice los productos sin utilizar de entre la lista que se indica a continuación y los ponga en cuarentena de inmediato para su posterior devolución a Smith & Nephew. 3/5 Productos retirados Descripción Cabeza resurfacing BHR Cotilo acetabular BHR Cotilo displasia BHR Nº de producto 74121138, 74123140, 74121142, 74123144, 74121146, 74121148, 74121150, 74123152, 74121154, 74123156, 74121158; 74123160, 74123162 74120144, 74120146, 74122146, 74122148, 74120148, 74120150, 74122050, 74122152, 74120152, 74120154, 74122154, 74122156, 74120156, 74120158, 74122158, 74122160, 74120160, 74120162, 74122162, 74122164, 74120164, 74120166; 74122166, 74122168 74120246, 74122248, 74120250, 74122252, 74120254, 74122256, 74120258, 74122260, 74120262, 74122264, 74120266 Smith & Nephew se compromete a distribuir únicamente productos de la más alta calidad, así como a prestar apoyo a los cirujanos que utilicen dichos productos. Si usted o sus pacientes desean obtener más información sobre la acción que hemos adoptado, encontrará información adicional en www.smith-nephew.com/BHR. Si tiene cualquier pregunta, no duden en ponerse en contacto con nosotros: Consultas técnicas del producto: Consultas sobre la acción de seguridad: Cristina Gallego Hip Marketing Manager Jordi Folch Técnico Responsable S&N Ingrid Vila Técnico RA/QA [email protected] [email protected] [email protected] Tel. 93.373.73.01 93.373.74.53 Tel. 93.373.73.01 (ext. 2272) Fax. 93.373.74.53 Tel. 93.373.73.01 (ext. 2420) Fax. Fax. 93.373.74.53 Atentamente, Dr. Andy Weymann Chief Medical Officer Advance Surgical Devices Division Smith & Nephew 4/5 -------------------------------------------------------------------------------------------------------------------------------Formulario de devolución Por favor, rellene y envíe esta información a la persona de contacto especificada más arriba para evitar la duplicidad de solicitudes. Confirmamos la recepción de este Aviso de seguridad. En nuestro centro tenemos ______ [Ctd.] dispositivos afectados, cuya devolución vamos a efectuar. Centro: Nombre: Referencia: R-2015-08 Fecha/firma: 5/5
© Copyright 2026