Unidad 1 (Q.O.I 1S 2016 P. III Fundamentos 1.1
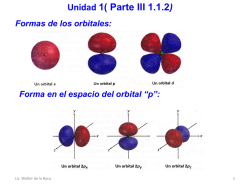
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio del orbital “p”: Lic. Walter de la Roca 2 Diagrama de distribución de electrones Lic. Walter de la Roca 3 Reglas de llenado de diagramas electrónicos Regla 1: Los orbitales de energía más baja se llenan primero; esto es una afirmación que se llama principio de aufbau. El orden es 1s2s2p3s3p4s3d. Regla 2: Los electrones se comportan en cierto modo como si giraran en torno a un eje, casi como la Tierra gira sobre su eje. Este giro, o espín puede tener dos orientaciones que se llaman arriba y abajo . Sólo dos electrones pueden ocupar un orbital y deben tener espín opuesto (el principio de exclusión de Pauli) Lic. Walter de la Roca 4 Regla 3: Si están disponibles dos o más orbitales de igual energía, un electrón ocupa cada uno hasta que todos los orbitales están medio llenos. Sólo entonces un segundo electrón puede ocupar cualquiera de los orbitales (regla de Hund). Todos los electrones de los orbitales medio llenos tienen el mismo espín. Configuraciones electrónicas de algunos elementos Lic. Walter de la Roca 5 Realizar el llenado de los siguientes elementos: Nitrógeno, Oxígeno y Flúor Tipos de enlaces que pueden ser formados: 1. Enlace Iónico 2. Enlace covalente ¿Qué es electronegatividad? H 2.1 He Li Be 1.0 1.5 B C N O F Ne 2.0 2.5 3.0 3.5 4.0 Na Mg 0.9 1.2 Al Si P S Cl 1.5 1.8 2.1 2.5 3.0 K Ca Sc 0.8 1.0 Ti Rb Zr Sr Y V Cr Mn Fe Nb Mo Tc Co Ni Cu Zn Ga Ge As Ru Rh Pd Ag Cd In Sn Sb Ar Se Br 2.8 Kr Te I Xe 2.5 ¿Cuál es elemento más electronegativo? Lic. Walter de la Roca 6 Los tipos de enlaces se clasifican según la diferencia de electronegatividad entre los elementos que forman el enlace. Diferencia mayor de 2.0 iónico Diferencia menor covalente Entre los covalentes también se pueden dividir en: Covalentes iónicos diferencia de 0.5 y 2.0 Covalente no iónicos entre 0 y menos 0.5 Ejemplos: Enlace Iónico: NaCl (3.0 (Cl)- 0.9 (Na) = 2.1) Enlace covalente no polar CH4 C-H (2.5-2.1= 0.4) Enlace covalente polar CF4 C-F (4.0 (F) -2.5 (C) = 1.5) Lic. Walter de la Roca 7 Actividad en clase: Determinar que tipo de enlaces tienen los siguientes compuestos: Cl Cl H H Cl H H I C H Cl Cl H C H H K Cl C Br H O H O S O H O También existe otro tipo de enlace que se denomina de covalente de coordinación El cual se forma cuando un átomo comparte sus electrones con otro que no tiene. Ejemplo: H H .. N H H + Na+ H .. N H + Na Lic. Walter de la Roca 8 Enlace covalente: ¿Por qué se unen los átomos? Debido a que los enlaces que resultan luego de unirse tienen una mayor estabilidad, que los átomos separados. Sabemos que todos lo átomos quieren estar como el gas noble más cercano, en otras palabras tener su octeto completo del nivel de valencia. Los metales alcalinos Grupo 1A, adquieren su configuración de gas noble perdiendo un electrón, por lo cual podríamos decir que estos elementos son donadores de electrones. Lic. Walter de la Roca 9 En cambio los halógenos Grupo 7A, les es más fácil ganar un electrón para llegar a su gas noble más cercano, por lo cual estos elementos tiene gran afinidad por electrones. En el caso de los grupos de en medio como los del Grupo 4A como es el carbono no es ni donador ni afín a los electrones debido a que necesitaría ganar 4 electrones para llegar a la siguiente configuración de gas noble o perder 4 electrones para llegar al anterior configuración de gas noble, por lo cual implica que no puede formar enlaces iónicos como los anteriores vistos. Lic. Walter de la Roca 10 El carbono para llegar a su octeto tiene compartir electrones con los otros átomos que se una y este tipo de enlace es denominado enlace covalente, lo mismo pasaría con el silicio. Una de las formas de representación más utilizadas para representar los enlaces es la estructura de Lewis, especialmente cuando queremos entender la combinación de electrones para la formación de enlaces entre diferentes átomos y la otra forma es utilizando líneas o rayas para representar un para de electrones y esta representación se conoce como estructura de Kekulé. Lic. Walter de la Roca 11 11 Ejemplos: . . C. . + 4 H. H . .. . H .C ... H H H C H H ó H Estructuras Kekulé Lewis Metano (CH4) 2 H. + .O... : .. . H .O ..: ó H .. H O: H Estructuras Kekulé Lewis Agua (H2O) 3H. + . .N . .. H ... . N. H H ... H H .. N H Estructuras Lewis Kekulé Amoniaco (NH3) Lic. Walter de la Roca 12 .. 3 H. + . C . + .O... : H + H. ..... . H .C.. O: . .. H H ó H H C O H H Estructuras Lewis Kekulé Metanol (CH3OH) La cantidad de enlaces covalentes que forma un átomo depende de cuántos electrones de valencia tenga y cuántos electrones más de valencia necesita para tener una configuración de gas noble (octeto lleno). H S O Dos enlaces (Halógenos, F-, Cl-, Br-, I-) X Un enlace N B C Si Tres enlaces Cuatro enlaces Lic. Walter de la Roca 13 Tabla de algunos compuestos Lic. Walter de la Roca 14 Existen también electrones que no están compartidos, que también se le denomina como “n” y que se pueden clasificar como bases de Lewis. Carga en los átomos: Lic. Walter de la Roca 15 Los enlaces covalentes pueden ser de dos tipos: 1. Enlaces sigma (σ) 2. Enlaces pi (π) Enlaces sigma se forman de la unión frontal de dos orbitales atómicos hibridizados o no hibridizados H .. H H C H equivalente H H : C : H Cuatro enlaces tipo sigma entre el carbono e hidrógeno .. H Lic. Walter de la Roca 16 Ejemplos: ¿Cuántos enlaces sigma tienen los siguientes compuestos? .. .. H H H C O H H C H C H H .. H H H H C C H C C H H H H H H H H H C N C C H H H H H Enlaces pi se forman de la unión lateral de dos orbitales atómicos “p” H H C C H H: equivalente H Lic. Walter de la Roca H : C : : C :H :H Cinco enlaces sigma: Cuatro C-H Un C-C Un enlace pi: C-C (lateral orbital "p") 17 Ejemplos: ¿Cuántos enlaces sigma y pi tienen los siguientes compuestos orgánicos? H H H H H C C C C H H H H3C C H3C C H : C CH2 Lic. Walter de la Roca CH2 C CH3 HC C CH2 CH CH2 H CH3 N :O : H CH3 H H H H C C C H H :O : H C H H3C C CH2 CH CH2 18 Resumen de lo aprendido 1. Forma de los orbitales atómicos. 2. Reglas de llenado de orbitales. 3. Tipos de enlaces. 4. Como determinar el tipo de enlace. 5. Enlace covalente. 6. Representaciones de las estructuras Lewis y Kekulé. 7. Valencia de los elementos más comunes en compuestos orgánicos. 8. Tipos de enlaces covalentes 9. Enlaces sigma(σ) y pi (π) como identificarlos. Lic. Walter de la Roca 19 Bibliografía: Química Orgánica Capitulo No. 1 ,John McMurry, Octava Edición Lic. Walter de la Roca 20
© Copyright 2026