Presentacion Disoluciones
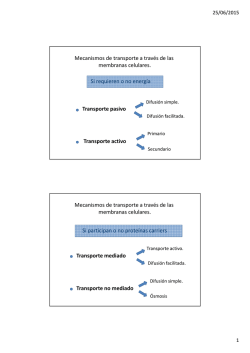
Disoluciones químicas Recordemos…. ¿Qué son las disoluciones químicas? Mezcla homogénea, constituida por dos o más componentes Soluciones = disoluciones COMPONENTES DE UNA DISOLUCION SOLUTO: Es la sustancia que se disuelve en el solvente SOLVENTE O DISOLVENTE: Es la sustancia que disuelve el soluto Ejemplos: Solución Solvente Soluto Refresco (l) H2O Azúcar, CO2 Aire (g) N2 O2, CH4 Soldadura (s) Cr Mn, C , P , Si , S EL AGUA COMO DISOLVENTE El agua es conocida como el disolvente universal, es decir, el líquido que más sustancias disuelve y ello hace que sea una de las sustancias más importantes en el ámbito de las disoluciones. Soluto polar: Si se disuelve en agua. Soluto no polar: No se disuelve el agua, pero sí en disolventes no polares. Clasificación de disoluciones DISOLUCIONES ESTADO CONCENTRACION Disoluciones sólidas Disoluciones diluidas (insaturadas) Disoluciones liquidas Disoluciones concentradas (saturadas) Disoluciones gaseosas Disoluciones supersaturadas I) Clasificación de disoluciones según su estado: Disoluciones sólidas: son las aleaciones de los metales Ejemplos: Bronce (Cu-Sn) Latón (Cu-Zn) Acero (Fe-Cu) Amalgama (Hg – METAL) Disoluciones líquidas Sólido en líquido Azúcar en agua Sal en agua Líquido en líquido Alcohol en agua • Disoluciones gaseosas aire smog Gas en líquido CO2 en agua (Bebidas gaseosas) II) Clasificación de disoluciones según su concentración: Diluidas o insaturadas: Son las que tienen una pequeña cantidad de soluto en un determinado volumen de disolución por lo que se podría disolver mas soluto en el solvente, es decir, menos de la cantidad que se requiere para ser saturada. Concentradas o saturadas: Son aquellas en las que existe un equilibrio dinámico entre soluto y disolvente, es decir, la máxima cantidad de soluto que se puede disolver en el solvente, correspondiente al valor de solubilidad de acuerdo con la temperatura. Supersaturadas o sobresaturadas: Son las que contienen más soluto que el presente en las disoluciones saturadas por lo cual queda una parte sin disolver. Insaturada Saturada Sobresaturada Estos vasos, que contienen un tinte rojo, demuestran cambios cualitativos en la concentración. Las soluciones a la izquierda están más diluidas, comparadas con las soluciones más concentradas de la derecha. SOLUBILIDAD “Cantidad de sustancia que se disuelve en una cantidad de disolvente a una temperatura dada para formar una disolución saturada” FACTORES QUE AFECTAN TEMPERATURA PRESIÓN NATURALEZA DE LAS SUSTANCIAS FACTORES QUE AFECTAN LA SOLUBILIDAD NATURALEZA DE SUSTANCIAS TEMPERATURA PRESIÓN GRÁFICAS DE SOLUBILIDAD CONCENTRACIÓN DE LAS DISOLUCIONES La concentración de una disolución es la cantidad de soluto presente en una cantidad dada de solución. UNIDADES DE CONCENTRACIÓN 1) Unidades físicas o porcentuales Porcentaje en masa Porcentaje masa/masa ( ó porcentaje peso/peso) % masa = Es la masa de soluto que esta contenida en 100 g de disolución. masa del soluto x 100 masa de disolución Es el volumen de soluto que se encuentra en 100 ml de disolución. Porcentaje por volumen % volumen/volumen ( % v/v ) % v/v = volumen del soluto volumen disolución x 100 Porcentaje masa/ volumen Es la masa de soluto que se encuentra en 100 ml de disolución. ó porcentaje peso/volumen ( % m/v ) ó ( % p/v ) % m/v = masa de soluto x 100 volumen de disolución Partes por millón Es la masa de soluto que se encuentra por cada millón de gramos de disolución ó ( ppm ) ppm = mg de soluto Kg de disolución Unidades de Concentración 2) Unidades químicas Una de las unidades de concentración más comunes en química es Molaridad “M“ La molaridad es el numero de moles de soluto en 1 litro de solución. M = molaridad = moles de soluto Litros de solución MOLALIDAD (m): Es el número de moles de soluto por kilogramo de disolvente. m = molalidad = moles de soluto m = n / kg masa de disolvente (kg) NORMALIDAD ( N ): Número de equivalentes-gramo de soluto por litro de disolución. N = Normalidad = n° Eq-g litros de disolución n° Eq = masa mEq FRACCIÓN MOLAR ( Xi ) : Indica la relación entre la cantidad de moles de un componente de la disolución y el total de moles de la disolución. La suma de las fracciones molares de los componentes es 1. Xi = Fracción molar= n componente n totales PROPIEDADES COLIGATIVAS •Abatimiento de la presión de vapor •Elevación ebullición del punto de •Abatimiento del punto de congelación •Presión osmótica Presión de vapor AUMENTO DEL PUNTO DE EBULLICIÓN Y DESCENSO DEL PUNTO DE CONGELACIÓN ÓSMOSIS DILUCIONES C1*V1=C2*V2 ¡GRACIAS! REFERENCIAS Brown L, 2004. Química la ciencia central. Pearson.
© Copyright 2026