Unidad 1 (Q.O.I 1S 2015 P. IV Enlace e hibridacion 1.1.2)
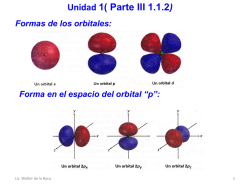
Unidad 1 (Parte IV, 1.1.2 (cont.) ) Teorías de la formación de enlaces covalentes: 1. Teoría del enlace de valencia: 2. Teoría del orbital molecular: Teoría de valencia: De acuerdo con la teoría del enlace, el enlace covalente se forma cuando se acercan mucho dos átomos, de tal manera que un orbital ocupado por un elec|rón en un átomo se traslapa con un orbital ocupado por un electrón en el otro. Lic. Walter de la Roca 1 Las ideas clave de la teoría del enlace de valencia son las siguientes: 1. Los enlaces covalentes se forman por traslape de dos orbitales atómicos, cada uno de los cuales contiene un electrón. 2. Los espines de los dos electrones son opuestos. 3. Cada átomo enlazado retiene sus orbitales atómicos internos, pero el par de electrones en los orbitales atómicos de valencia son compartidos por ambos átomos. 4. Mientras mayor es el traslape de orbitales, el enlace es más fuerte. ¿Qué enlace sigma será el más fuerte y por qué? •Dos orbitales “s” •Dos orbitales “p” Lic. Walter de la Roca 2 Como dijimos anteriormente, los enlaces se producen, debido a que la energía del producto es menor que los átomos sin combinar. A continuación veremos el diagrama de energía de la formación del enlace del hidrógeno molecular: Lic. Walter de la Roca 3 ¿A que distancia están los dos núcleos en la molécula de H2? No tan cerca que provoquen la repulsión de los núcleos por tener la misma carga (+), pero no tan lejos que no puedan compartir los electrones en el enlace. Lic. Walter de la Roca 4 Lic. Walter de la Roca 5 Teoría del orbital molecular En esta teoría la formación del enlace covalente se debe a la combinación matemática de los orbitales atómicos (funciones de onda) que forman orbitales moleculares, llamados así porque pertenecen a toda la molécula y no a un átomo individual. Lic. Walter de la Roca 6 La combinación aditiva tiene menos energía que los dos orbitales atómicos 1s del hidrógeno y se llama orbital molecular (OM) de enlace. Los electrones en este orbital molecular pasan la mayor parte del tiempo en la región intermedia entre los átomos, enlazando los átomos. La combinación sustractiva tiene más energía que los dos orbitales 1s del hidrógeno y se denomina orbital molecular de antienlace o antienlazante. Ninguno de los electrones que contiene puede ocupar la región central los núcleos, donde hay un nodo que contribuye al enlazamiento. Como consecuencia, los núcleos se repelen. Lic. Walter de la Roca 7 Ideas claves de la teoría del orbital molecular: 1. Los orbitales moleculares son a las moléculas lo que los orbitales atómicos a los átomos. 2. Los orbitales moleculares describen las regiones del espacio en una molécula en que es más probable encontrar a los electrones y tienen forma, tamaño y nivel de energía específicos. 3. Los orbitales moleculares se forman combinando orbitales atómicos. 4. Los orbitales moleculares que tienen menos energía que los orbitales atómicos iniciales son denominados de enlace; 5. Los orbitales moleculares con más energía que los orbitales atómicos iniciales son denominados antienlazantes ó de no enlace. Lic. Walter de la Roca 8 Hibridaciones del carbono Configuración electrónica del estado basal del carbono ¿Cuántos enlaces covalentes podría formar según esta configuración el “C”? Lic. Walter de la Roca 9 Linus Pauling propuso una respuesta en 1931 al demostrar matemáticamente cómo se puede combinar, o hibridar, un orbital s y tres orbitales p de un átomo, para formar cuatro orbitales atómicos equivalentes con orientación de tetraedro. Carbono excitado Lic. Walter de la Roca Carbono hibridizado 10 Forma del carbono hibridizado sp3 Carácter de s y p de carbono hibridizado sp3: s = 1/4 = 25% p = 3/4 = 75% ¿A que orbital se parece más a un “p” o “s”? Lic. Walter de la Roca 11 Si unimos el carbono hibridizado sp3, puede unirse con 4 átomos de hidrógeno 1s, para originar el metano que se puede representar de la siguiente manera. Concluyendo, podríamos decir que la hibridación del carbono le da la posibilidad de combinarse con otros cuatro átomos, y los orbitales tienen igual energía, por lo cual no habría ninguna preferencia por ninguno, son equivalentes, además la forma geométrica nos da la forma más estable posible en el espacio. Lic. Walter de la Roca 12 Representaciones: Etano Combinaciones de orbitales hibridizados: Enlace σ (sigma) se forma de la unión frontal de dos orbitales Lic. Walter de la Roca 13 Ángulos del etano: ¿Cuántos enlaces sigma tiene la molécula de etano? Lic. Walter de la Roca 14 Conclusiones de la hibridación sp3: 1. La hibridación combina tres orbitales “p” y un orbital “s”, generando cuatro orbitales hibridizados sp3 2. El carbono con esta hibridación podrá formar cuatro enlaces sigma (σ) 3. La forma de orbital hibridizado tiene dos lóbulos, como el “p”, pero uno de los lóbulos es mayor que el otro. 4. El orbital se parece más al orbital “p”, pues posee un 75% de carácter “p” y 25% de carácter “s”. 5. La forma de los cuatro orbitales hibridizados es tetraédrica. 6. Los ángulos que forman entre los enlaces hibridizados es de 109.5°. Lic. Walter de la Roca 15 Hibridación sp2 del carbono (Doble enlace) Lic. Walter de la Roca 16 Carácter de s y p de carbono hibridizado sp2: s = 1/3 = 33.33% p = 2/3 = 66.66% ¿A que orbital se parece más a un “p” o “s”? Forma de los orbitales sp2 y p (Trigonal Plana): Los enlaces hibridizados sp2 forman enlaces sigma Lic. Walter de la Roca 17 Los orbitales no hibridizados “p” forma enlaces π (pi) que son uniones laterales de los mismos. ¿Qué enlace se romperá más fácilmente? Sigma o Pi ¿Cuántos enlaces sigma puede formar el etileno y cuántos enlaces pi? Lic. Walter de la Roca 18 Representaciones del etileno: Enlaces σ y π en el etileno: Lic. Walter de la Roca 19 Lic. Walter de la Roca 20 Conclusiones de la hibridación sp2 1. Se mezclan dos orbitales “p” y un orbital “s”, originando tres orbitales hibridizados y un orbital “p” no hibridizado. 2. El carbono con esta hibridación puede formar tres enlaces sigma y un enlace pi. 3. La forma del orbital hibridizado tiene dos lóbulos, como el “p”, pero uno de los lóbulos es mucho mayor que el otro. 4. El orbital se parece más al “p”, pero menos que el sp3, pues en este caso el carácter “p” es 66.67% y “s” es 33.33%. 5. La forma de los orbitales hibridizados sp2 es trigonal plana. 6. Los ángulos que forman entre los enlaces hibridizados sp2 es de 120°C y los ángulos entre los hibridizados y el orbital p no hibridizado es de 90°C. Lic. Walter de la Roca 21 Hibridación sp del carbono (Triple enlace) ¿Cuántos enlaces σ? ¿Cuántos enlaces π? Lic. Walter de la Roca 22 Representación de los orbitales hibridizados: (Lineal) Forma enlaces sigma con los orbitales hibridizados sp y los p no hibridizados forma enlaces pi Representación del acetileno: Lic. Walter de la Roca 23 Formación de los enlaces en el triple enlace 1σ y 2π: Lic. Walter de la Roca 24 Conclusiones de la hibridación sp 1. Se mezclan un orbital “p” y un orbital “s”, originando dos orbitales hibridizados y dos orbitales “p” no hibridizados. 2. El carbono con esta hibridación puede formar dos enlaces sigma y dos enlaces pi. 3. La forma del orbital hibridizado tiene dos lóbulos, como el “p”, pero uno de los lóbulos es muchísimo más grande que el otro. 4. El orbital se parece más al “s”, tiene 50% de carácter “s” y 50% de “p”. 5. La forma de los orbitales hibridizados sp es lineal. 6. Los ángulos que forman entre los enlaces hibridizados sp es de 180°C y los ángulos entre los hibridizados y los orbitales p no hibridizado es de 90°C. Lic. Walter de la Roca 25 Longitud de enlace y fuerza del enlace Lic. Walter de la Roca 26 Energías y fuerzas de enlace: Resumamos: Los enlaces son más fuertes en tanto más cortos y menos energéticos son, y al contrario, los enlaces son más débiles en tanto más largos y más energéticos son. Por lo cual el ordenamiento creciente a la fuerza del enlace: p < sp3 < sp2 < sp < s Lic. Walter de la Roca 27 Hibridación de átomos de Nitrógeno: El concepto de hibridación no solo es aplicable al carbono, sino también lo pueden sufrir otros elementos, pero los que nos interesan en nuestro curso son el oxígeno y el nitrógeno. Nitrógeno: Analicemos el átomo de hidrógeno en el amoniaco NH3. El ángulo H-N-H del enlace en el amoniaco, medido experimentalmente, es de 107.3° cercano al valor del tetraédrico de 109.5° que se encuentra en el metano. H H N Lic. Walter de la Roca H : 28 Lic. Walter de la Roca 29 Oxígeno: Ahora analicemos el caso del oxígeno en la molécula de agua se ha determinado experimentalmente que el ángulo entre los átomos de hidrógeno es de 104.5 °, es menor que el tetraédrico, pero es muy similar al esperado de 109.5° H H O : .. Lic. Walter de la Roca 30 a. ¿Enlaces sigma? b. ¿Enlaces pi? c. ¿Enlace sigma Carbono-Carbono más pequeño? d. ¿Enlace sigma Carbono-Carbono más largo? e. ¿Enlace sigma más pequeño? f. Orbitales de electrones del OH g. Orbitales de electrones del NH2 10 CH2 9 CH .. : OH H3C 1 CH 2 8 CH2 CH 3 11 CH2 CH 4 CH2 5 C CH 6 7 NH2 .. Lic. Walter de la Roca 31 a. ¿Enlaces sigma? b. ¿Enlaces pi? c. ¿Enlace sigma Carbono-Carbono más pequeño? d. ¿Enlace sigma Carbono-Carbono más largo? e. ¿Enlace sigma más pequeño? f. Orbitales de electrones libres del OH j CH 2 g. Orbitales de electrones libres del C=O h. Orbitales de electrones libres del C≡N..i CH .. h HO CH a H3C b c CH2 CH k CH 2 gCH 2 d CH e f C C H .. ..O ñ CH2 l CH 2 m C Lic. Walter de la Roca n N .. 32 Resumen de lo aprendido: 1. 2. 3. 4. 5. 6. 7. 8. 9. ¿Qué es la teoría del enlace de valencia? ¿Qué es la teoría del orbital molecular? Configuración del carbono basal Hibridación sp3 del carbono, como se forma, que forma tiene en el espacio y ejemplos de compuestos orgánicos. Hibridación sp2 del carbono, como se forma, que forma tiene en el espacio y ejemplos de compuestos orgánicos. Hibridación sp del carbono, como se forma, que forma tiene en el espacio y ejemplos de compuestos orgánicos. Longitud y fuerza del enlace de carbonos hibridizados. Hibridación de N, O, S y P Clasificación de fuerza y longitud de enlaces. Lic. Walter de la Roca 33 Bibliografía: 1. Capitulo No. 1 ,John McMurry, Química Orgánica. Séptima Edición 2. Capitulo No. 2 , Francis A. Carey, Química Orgánica. Noventa Edición. 3. Capitulo No. 2, Igor Slowing, “Un texto básico de Orgánica”, Lic. Walter de la Roca 34
© Copyright 2026