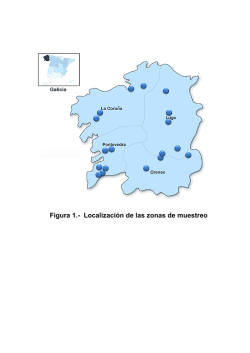
CÓMO INVESTIGAR UNA EPIDEMIA O BROTE DE UNA
Curso de Brotes de Enfermedades Ambientales y Ocupacionales 35 CÓMO INVESTIGAR UNA EPIDEMIA O BROTE DE UNA ENFERMEDAD AMBIENTAL U OCUPACIONAL∗ INTRODUCCIÓN Los funcionarios en salud pública de todo el mundo se enfrentan con una amplia gama de enfermedades comunitarias que surgen de causas muy distintas. Para enfermedades infecciosas, cuando el problema se identifica fácilmente, el funcionario a menudo ya está familiarizado con procedimientos bien establecidos para la evaluación epidemiológica, el control de brotes y la protección de la población. Sin embargo, la situación puede ser muy distinta cuando el funcionario se encuentra con una enfermedad para la cual no es claramente evidente el origen infeccioso o genético. Los problemas ambientales son de dos tipos: los que atraen la atención, debido a que son situaciones que causan preocupación; y los que surgen debido a situaciones de exposición potencial. Aunque las enfermedades siempre existirán en las comunidades (cáncer, etc.) las situaciones de exposición inevitablemente estarán relacionadas con patrones de enfermedad percibidos (o reales), aunque los nexos en realidad no pueden demostrarse o en el mejor de los casos sean muy tenues. Desechos químicos tóxicos, love canal, Nueva York, EUA Ejemplo de un problema ambiental de preocupación pública. El llamado Love Canal era un canal hecho por el hombre de 3000 pies de largo al sureste de las Cataratas del Niágara, N.Y., originalmente cavado en el siglo diecinueve como parte de un plan para producir energía hidroeléctrica. De 1942 a 1953 fue llenado con desechos químicos (clorobenceno y compuestos relacionados) generados en la producción de plaguicidas orgánicos por una compañía química local. El tiradero completo fue sellado pero más tarde se usó como parte de un desarrollo residencial. Para 1975, comenzó a hacerse aparente que las sustancias estaban escapando por infiltración en el suelo. La preocupación pública creció respecto a posibles efectos en la salud humana y algunos años más tarde se comenzaron los estudios epidemiológicos para evaluar los riesgos para la salud, al mismo tiempo que se comenzaron los trabajos de ingeniería para aislar el sitio y eliminar una mayor exposición. Debido a que se sugirió una amplia gama de enfermedades como resultado de la exposición a las sustancias del Canal, se llevó a cabo una amplia encuesta sobre salud comunitaria conducida entre una muestra de hogares localizados a diferentes distancias del área. La comunidad como conjunto tenía una población de alrededor de 4000 personas, de las cuales 300 vivían en hogares que estaban justo junto al canal. No se observaron patrones consistentes en aumento de morbilidad. Una atención particular se centró en anomalías reproductivas debido a la supuesta sensibilidad elevada del feto al daño químico. Los resultados de este estudio en particular no mostraron una evidencia clara de mayor riesgo para aborto espontáneo, malformaciones congénitas neonatales o peso bajo al nacer. La incidencia de cáncer en la zona censal en donde se encuentra el Love Canal se comparó con la incidencia en otras partes del estado de Nueva York. No se observaron diferencias consistentes para cáncer en general ni para cánceres en lugares específicos, especialmente leucemia y cáncer hepático. Las frecuencias de aberraciones cromosómicas fueron medidas en ex residentes de hogares seleccionados cerca o junto al canal y en controles apareados de una zona censal comparable en algún otro lado de las Cataratas del Niágara. Nuevamente, no se observaron diferencias que pudieran sugerir daño genético por exposición a las sustancias del canal. Naturalmente, en todos estos estudios, la interpretación estuvo grandemente obstaculizada por información incierta respecto a la exposición y por el tamaño relativamente pequeño de la población expuesta. * Janerich, D:T: et al Cancer Incidence in the Love Canal area. Science, 212: 1404-1407. ∗ Adaptado de Organización Mundial de la Salud. Investigación de brotes de enfermedades ambientales. Manual de entrenamiento. Ginebra, Suiza. OMS, 1993. OMS/PEP/91.35. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 36 La preocupación o la alarma pública hace necesario que se evalúen todas las relaciones entre condiciones ambientales y patrones de enfermedad. Los procedimientos por medio de los cuales se pueden evaluar y controlar enfermedades causadas por el ambiente se ajustan a los mismos principios epidemiológicos básicos usados en la investigación de enfermedades infecciosas. Sin embargo, en la práctica, se necesita estar familiarizado con el conocimiento básico de los peligros ambientales, con los aspectos clínicos relacionados y con los procedimientos técnicos de laboratorio. En la práctica de la salud pública hay una necesidad creciente de mayores conocimientos sobre cómo reconocer, investigar y controlar peligros en salud ambiental. Por ejemplo, las exposiciones químicas de amplias poblaciones o el potencial de dichas exposiciones, surgen de actividades industriales, comerciales y/o por el consumo de sustancias cada vez más diversificado. Tales exposiciones pueden involucrar un amplio espectro de materiales que producen una variedad de efectos en las personas expuestas, pueden actuar en los diferentes órganos y sus efectos pueden expresarse como una enfermedad clínica aguda evidente, alteraciones subclínicas, muerte prematura u otra enfermedad que aparece mucho tiempo después de la exposición, dependiendo de la dosis y la intensidad de la exposición. Cada año se introducen nuevas sustancias para el uso humano, lo cual conduce a la posibilidad de nuevos o aumentados efectos en la salud. Para estar preparados para tales posibilidades, los profesionales de la salud deben mantener un conocimiento sobre las sustancias ambientales potencialmente peligrosas, un entendimiento de cómo estos materiales pueden afectar a la salud humana y estar familiarizados con la mejor manera de emplear las técnicas epidemiológicas y toxicológicas cuando se investigan y se manejan enfermedades ambientales y ocupacionales; por lo que a continuación presentaremos una visión general de la metodología epidemiológica en el contexto práctico del terreno. Aunque se describen procedimientos epidemiológicos en secuencia conceptual lógica (indagación inicial, definición de caso, definición de la población bajo riesgo, medición del riesgo en exceso, etc.) debe hacerse notar que en la realidad, los diversos componentes de una investigación epidemiológica pueden surgir todos al mismo tiempo o en una secuencia distinta. Si eso ocurre, es importante que los funcionarios de salud pública que lleven a cabo la investigación tengan muy clara la secuencia conceptual del razonamiento epidemiológico para evitar pasar por alto un componente esencial. Contaminación de alimentos por bifenilos polibromados (BPB) en Michigan, E.U.A. Ejemplo de un problema ambiental por exposición potencial. En el verano de 1972, una fábrica de sustancias químicas distribuyó por error 25 bolsas de un kilo de BPB (un retardante de llamas con potencial carcinogénico) a granjas lecheras en todo Michigan, para usarse como aditivo alimentario para el ganado. La sustancia produjo muertes extensas entre el ganado, pérdidas de crías y menor producción de leche, pero la confusión no se identificó sino 9 meses más tarde. Debido a que los BPB persisten en los tejidos, fue posible medir niveles de contaminación en las reses y en productos lácteos. Tal vigilancia condujo a una extensa cuarentena y a la destrucción de animales y productos en los que los niveles de BPB excedían los límites establecidos. Los informes de varias enfermedades en familias de las granjas afectadas llevó a realizar estudios epidemiológicos diseñados para detectar posibles efectos en la salud humana causados por BPB. Los casos de enfermedad (“ Síndrome de BPB”) consistieron en su mayoría en síntomas informados subjetivamente: dolor de cabeza, dolor de articulaciones, pérdida de apetito, comezón en la piel, etc. Los estudios de ocurrencia de enfermedad en familias expuestas a BPB (familias en granjas en cuarentena o que recibían productos alimenticios directamente de esas granjas), no pudieron mostrar relaciones entre enfermedad notificada y niveles de BPB en el suero (ver tabla abajo). Se encontraron bajos niveles de BPB en toda la población de Michigan, pero no en Canadá ni en los estados cercanos. Se encontró que la sustancia se concentraba en la leche materna. Se estableció una vigilancia continua de posibles efectos en la salud de familias en granjas expuestas. No se ha observado aumento de enfermedad, incluyendo cánceres, pero se debe subrayar que a menudo toma 20 años o más antes de que se detecte cáncer en gente expuesta a un carcinógeno ambiental. Reich, M.R. Environmental politics and science: the case of BPB contamination in Michigan. American journal of public health, 1983, 73: 302-313. La escena es la de un episodio agudo, y se debe actuar razonablemente rápido, estableciendo las prioridades. Se debe tratar de establecer cuál es el agente que causa la enfermedad, donde reside el agente, su modo de transmisión, quienes están en riesgo de enfermar y cuál es la exposición específica que ha causado la enfermedad. Se trata de determinar más o menos sobre la investigación de la situación, utilizando la experiencia clínica, el conocimiento sobre la Curso de Brotes de Enfermedades Ambientales y Ocupacionales 37 enfermedad (en el caso de saber de que enfermedad se trata), los datos de laboratorio y la información epidemiológica. Estos elementos ayudarán a comprender porqué se presentó la epidemia. Generalmente existe presión sobre el funcionario de salud para que dé una respuesta rápida, eficaz y económica al problema de la epidemia (brote, accidente). En este sentido, él mismo debe estar capacitado para ejecutar un plan de contingencia que dé respuesta al acontecimiento acaecido. Es conveniente recordar que en la mayoría de los brotes en los que se trabaja, los hechos han ocurrido ya, por consiguiente los estudios que se realizan son retrospectivos. Por lo que hay que recabar los datos y organizarlos de tal manera que se pueda reproducir las circunstancias que han conducido al agente causal a producir la enfermedad. El Cuadro 1 proporciona una pauta de los principales elementos a considerar en un proceso de investigar epidemiológicamente en el terreno. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 38 CUADRO 1 GUÍA PARA UNA INVESTIGACIÓN EPIDEMIOLÓGICA DE CAMPO 1. Prepararse para el trabajo de campo (por ejemplo trámites administrativos, viaje, contactos, designación del investigador principal, etc.) 2. Confirmar la existencia de una epidemia. 3. Verificar el diagnóstico. 4. Identificar y contar los casos: - Formular una definición de caso - Desarrollar un listado de casos 5. Tabular y orientar los datos en términos de tiempo, lugar y personas. 6. Aplicar medidas, inmediatas de control (si es indicado). 7. Formular una hipótesis. 8. Prueba de hipótesis. 9. Planear estudios sistemáticos adicionales. 10. Implementar/Evaluar todo el contexto de medidas preventivas y de control. 11. Iniciar la vigilancia 12. Comunicar los hallazgos: - Preparar un resumen de la investigación para las autoridades. - Preparar un reporte por escrito. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 39 NOTIFICACIÓN INICIAL La notificación inicial de un brote puede venir de distintas fuentes, una llamada telefónica, una conversación privada, o una declaración escrita. ¿Cuáles son las primeras acciones que deben emprenderse para responder a la notificación y determinar si se justifica un estudio epidemiológico? Cuando se informa por primera vez del brote, siempre se debe reunir información acerca de: a) la(s) persona(s) que inicia(n) el informe, b) las características del brote sospechado, y c) las personas directamente afectadas por el brote. En el Cuadro 2 se da un ejemplo para un Formulario de Respuesta Inicial. Específicamente, la información sobre el individuo que informa del brote debe incluir lo siguiente: nombre, domicilio, número de teléfono y afiliación a organizaciones. La información sobre el brote sospechoso debe incluir: el suceso de salud sospechado, la(s) exposición(es) sospechosa(s), el número de casos, el área geográfica de interés, el periodo y cómo se descubrió el brote. Los datos sobre las personas afectadas debe incluir: nombre, edad, sexo, dirección, teléfono, persona contacto, modo de contactarla y contacto con el médico. Sin importar la fuente del informe, el contacto inicial es muy importante. Se puede seguir una serie de pasos organizativos para facilitar la respuesta al brote. Primero, si no se ha hecho, se debe designar a un individuo como responsable o encargado de este brote. CORROBORAR LA EXISTENCIA DEL BROTE O CONTINGENCIA Antes de suponer que ha ocurrido un verdadero brote, se debe reunir información al menos sobre algunos casos; ésta debe usarse para realizar una estimación general y rápida de la posibilidad que haya ocurrido un evento de importancia epidemiológica. Para decidir si un brote de alguna enfermedad existe, se debe realizar una comparación entre la incidencia actual y la incidencia usual de los casos en la población expuesta al factor de riesgo. En el caso de contingencias químicas, puede ocurrir: 1. Evento agudo, cuando involucra la exposición a un agente químico que puede ser altamente tóxico y generar un impacto inmediato sobre la salud pública, siendo necesario primero la evaluación rápida del riesgo; y posteriormente, un estudio planificado dependiendo del efecto de la sustancia en estudio, las características del riesgo e historia natural de la enfermedad. Enfermedad del legionario, Filadelfia, Pensilvania, E.U.A. Un brote rápido y sorpresivo de neumonitis con alta mortalidad (182 casos, 29 muertes) ocurrió en Pensilvania, EUA, en un periodo de 2 a 3 semanas entre julio y agosto de 1976. La enfermedad afectó principalmente a personas que habían asistido a una convención de la Legión Americana (una organización de veteranos de guerra) que tuvo lugar en un hotel (Hotel A) en la ciudad de Filadelfia entre el 21 y el 24 de julio. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 40 CUADRO 2 FORMULARIO PARA LA RESPUESTA INICIAL ANTE BROTES DE ENFERMEDADES Fecha: ________________ Nombre de la persona que llena el formato: INFORMACIÓN DE LA PERSONA QUE NOTIFICA EL BROTE Apellidos: Nombre(s): Dirección y teléfono: Otra información (afiliación a organizaciones, solicitud de anonimato, etc.) INFORMACIÓN SOBRE EL BROTE DE LA ENFERMEDAD Problema de salud (por ejemplo neumonía, cáncer o síntomas predominantes): Exposición sospechada (si procede): N° de casos sospechosos hasta ahora: Fecha de primer caso sospechoso: Fecha en que ocurrió por primera vez la exposición sospechosa: Fecha del caso más reciente: ¿Todavía ocurre la exposición sospechosa? ¿Cómo se descubrió por primera vez el brote? Área geográfica: Curso de Brotes de Enfermedades Ambientales y Ocupacionales 41 La investigación epidemiológica comenzó por establecer una definición de caso: fiebre con tos o con evidencia radiológica de neumonitis, desarrollándose entre el 1º de julio y el 18 de agosto y afectando cualquier persona que haya asistido a la convención de la Legión Americana o que haya entrado al Hotel A entre el 1º de julio y el momento de implantación de la enfermedad. Rápidamente se establecieron sistemas de vigilancia de casos, tanto a través del registro pasivo de casos (informados por médicos y hospitales o por una línea telefónica especial) como por medio de búsquedas activas diarias de nuevos casos diagnosticados en hospitales en todo el estado. Se llevaron a cabo encuestas epidemiológicas especiales y estudios de casos y controles para evaluar la frecuencia de neumonitis en huéspedes de otros hoteles de Filadelfia en el mismo periodo, los patrones de mortalidad por neumonía entre residentes de Filadelfia en años pasados y los patrones de enfermedad y de actividad durante el encuentro entre todos los miembros de la Legión en el estado que asistieron a la convención. El brote se limitó a personas que habían estado en el Hotel A, o que al menos habían estado en las aceras o en la calle afuera del hotel. No habían habido aumentos paralelos en mortalidad por neumonía en los dos veranos anteriores. La incidencia era un poco más alta en personas mayores y en fumadores. Aunque las características clínicas de la epidemia sugerían fuertemente que el brote era causado por una infección bacteriana, los extensos estudios de laboratorio no pudieron identificar a ningún agente. Debido a esta falla inicial y a que no se observó evidencia que sugiriera que era una enfermedad infecciosa propagada por el contacto entre personas (no se observaron casos secundarios entre los compañeros de cuarto de los casos ni en miembros de sus familias), una atención considerable se centró en posibles etiologías ambientales. Un interés particular se puso en posibles exposiciones en el aire o en el agua a metales pesados (especialmente níquel) o a gases tóxicos. Sin embargo, los extensos estudios ambientales no lograron apoyar para estas ideas. Posteriormente, se descubrió la bacteria denominada Legionella y se demostró convincentemente que había causado no sólo el brote de la Legión Americana sino también brotes de enfermedades respiratorias previas en otros lugares del mundo donde la etiología había sido oscura. Frazer, B.N. et al. Legionnaires` disease. Description of an epidemic of pneumonia. New England journal of medicine, 1977, 297: 1189-1197. 2. Evento crónico, que involucra la exposición a un agente químico peligroso en bajas concentraciones, o con características toxicológicas acumulativas, y cuyos efectos a la salud generalmente requieren de un largo período de exposición previo. El desafío es que estas enfermedades existen normalmente en la comunidad y por ello es difícil determinar si existen a consecuencia del evento. Leucemia Infantil, Woburn, Massachusetts, E.U.A. A fines de 1979, la atención pública se centró en un aparente conglomerado de casos de leucemia infantil en el poblado de Woburn, Massachusetts, EUA. Desde 1972, seis de tales casos se habían diagnosticado en familias que vivían en un área residencial de seis manzanas. La preocupación respecto a estos casos se puso de relieve por una preocupación simultánea sobre contaminación del agua en el poblado así como por prácticas pasadas de disposición de desechos industriales tóxicos en la localidad. El vecindario en cuestión estaba cerca de una ex-área industrial (de producción de plaguicidas y otras sustancias) y cerca de dos de once pozos que proporcionan el abasto de agua del poblado. Ambos pozos (Pozos G y H) se encontraron contaminados con sustancias orgánicas (tricloroetileno y otros disolventes orgánicos relacionados) en varias ocasiones entre 1967 y 1979. La investigación epidemiológica sobre la ocurrencia de leucemia infantil en el poblado comenzó con la vigilancia y confirmación del diagnóstico de todos los casos identificados en residentes del poblado para el periodo 1969-1979. Los certificados de defunción y los registros médicos en hospitales y consultorios médicos fueron las fuentes de información para la vigilancia. El número resultante de casos observados en zonas censales individuales fue comparado con las cifras esperadas calculadas en base a las tasas nacionales de incidencia de leucemia. El número observado de casos (6) fue 7,5 veces mayor que la cifra esperada (0,8) en la zona censal 3334 Para investigar la posible relación de esta aparente concentración de casos con la contaminación de pozos u otros factores ambientales locales, se llevó a cabo un estudio de casos y Curso de Brotes de Enfermedades Ambientales y Ocupacionales 42 controles mediante cuestionario. Se llevaron a cabo entrevistas con uno o ambos padres de cada uno de los 12 pacientes de leucemia de Woburn y de 24 niños controles seleccionados de las listas vigentes de inscripción en escuelas públicas y apareados por edad y sexo, dos para cada caso de leucemia. No se encontraron diferencias significativas en esta comparación con respecto a una amplia gama de exposiciones ambientales potenciales y a historias familiares de cáncer. No queda claro si esta ocurrencia de leucemia infantil refleja una relación etiológica con sustancias potencialmente causantes de cáncer en el agua local o simplemente fue el resultado de una concentración aleatoria de tales casos en espacio y tiempo. Cutler, J.K. et al. Childhood Leukemia in Woburn Massachusetts. Public health reports, 1986, 101: 201-205. ¿Qué información es necesario tener inmediatamente?. 1. Características demográficas de los casos: edad, raza, sexo, profesión, ocupación, domicilio, y otros. 2. Características del brote o contingencia sospechado, tipo de accidente, dimensión, localización, presencia insegura de condiciones ambientales o personales. Por ejemplo, si se trata de un evento en una fábrica, se debe obtener información de la historia ocupacional de los casos, tales como tipo de empleo, antigüedad en la ocupación y puesto de trabajo, posibles exposiciones, antecedentes de enfermedad (personal y familiar), hábitos, uso de equipo de protección personal y otras. DESCRIPCIÓN DE LOS CASOS SEGÚN TIEMPO, LUGAR Y PERSONA De esto se ocupa la epidemiología descriptiva. Se han encontrado tantos casos como se ha podido por lo que la caracterización debe realizarse de modo que la hipótesis pueda ser desarrollada investigando la fuente, modo de transmisión y duración de la epidemia. Para formular las hipótesis necesarias, la información inicialmente recolectada de los casos debe ser organizada de tal manera que permita responder a los siguientes tipos de preguntas: Respecto a tiempo: 1. ¿Cuál es el período exacto del brote? o ¿cuándo ocurrieron los casos? 2. Dado el diagnóstico, ¿cuál es el período probable de exposición? 3. ¿Existe un incremento de casos? 4. ¿El brote se debe a una fuente común, propagada o ambas? 5. ¿Cuál es la secuencia en el tiempo para la aparición de los hallazgos clínicos? Respecto a lugar: 1. ¿Cuál es la distribución geográfica más significativa de los casos (por lugar de residencia, trabajo, algún otro lugar)? 2. ¿Existen casos nuevos en otras áreas? 3. ¿Cuáles son las tasas de ataque? 4. ¿Cuáles son las condiciones climáticas del lugar donde apareció el brote? Respecto a las características de las personas involucradas: 1. ¿Cuáles son las tasas de ataque específicas por edad y sexo? 2. ¿Cuáles son los grupos de edad y sexo que tuvieron el más alto y más bajo riesgo de enfermar? 3. ¿Qué características de los casos son significativamente diferentes de aquéllas de la población general? 4. ¿Qué factores pudieron haber contribuido en la ocurrencia de los casos? Curso de Brotes de Enfermedades Ambientales y Ocupacionales 43 Los instrumentos de la epidemiología descriptiva que nos ayudan en la respuesta a estas preguntas son: De tiempo: La curva epidémica es la representación gráfica de como los casos han ocurrido en el tiempo; haciendo la curva se puede conocer más sobre la manera en la cual la enfermedad se ha propagado y su amplitud. De lugar: Un mapa donde se marcan los casos por su domicilio o lugar de exposición; esta imagen puede aportar fuertes evidencias del sitio en donde las personas tienen mayor riesgo de adquirir la enfermedad. De persona: Las características de los pacientes nos pueden dar un índice de quién es más susceptible de desarrollar la enfermedad. Tales características son edad, sexo, grupo étnico, profesión, estado nutricional, y otras. Con estos datos se puede poner en evidencia cuál subgrupo poblacional tuvo el mayor riesgo de contraer la enfermedad. ESTABLECIMIENTO Y/O VERIFICACIÓN DEL DIAGNÓSTICO No esté convencido de un diagnóstico sólo porque una autoridad lo dijo; sea escéptico. Tampoco es conveniente suponer nada, verifique y establezca el diagnóstico con fundamentos clínico-ambientales. Es conveniente identificar la información relevante (signos, síntomas, hallazgos laboratoriales de los casos reportados, etc.). Derivar una conclusión lógica a partir de la información disponible y establecerla como una hipótesis. Identificar y cuantificar las sustancias químicas involucradas, en el caso de desconocerse, mediante muestras ambientales, determinando la o los tipos de sustancia(s) y los nivel(es); y se buscará bibliografía o tarjetas de datos acerca de sus posibles efectos tóxicos y el tratamiento médico adecuado. Se debe contactar con los responsables del almacenamiento, transporte, industrialización o manipulación de la sustancia involucrada, a fin de obtener información técnica detallada sobre el riesgo. También se deberá investigar acerca de las condiciones meteorológicas que predominaban cuando sucedió la contingencia, con la finalidad de prever su dispersión. Por ejemplo, en el caso de un escape o derrame de una sustancia química es necesario conocer la temperatura ambiente, dirección y velocidad del viento, existencia de lluvia, etc. En el caso de una contaminación se deberá recordar que el personal que atenderá el evento contará con el equipo de protección individual que debe proveerse principalmente al personal de rescate y realizar acciones de limpieza adecuada del área contaminada. DEFINICIÓN OPERACIONAL DE CASO E IDENTIFICACIÓN Y CUANTIFICACIÓN DE LOS CASOS La definición de caso es un aspecto muy importante de la investigación. Usted tiene que decidir en un momento dado: ¿a qué voy a llamar caso? Debe de ser una definición concreta que se utilizará durante toda la investigación. Aunque cabe señalar que si se realiza el análisis con una definición de caso sin encontrar nada, es decir, sin demostrar porqué las personas enfermaron; en estas circunstancias, es posible modificar la definición de caso, y analizar nuevamente la población; lo cual es científicamente aceptado, pero se debe tener la precaución de no cambiar las definiciones durante el análisis. Los objetivos básicos de la definición de caso son dos: 1. En la etapa inicial de la investigación, es identificar otros casos que presenten características clínicas (signos y síntomas) similares a los casos iniciales, que puedan estar relacionados con el brote y, por lo tanto, deban ser investigados. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 2. 44 En las etapas más avanzadas de la investigación, es necesario identificar entre los individuos, aquéllos que tienen más probabilidad de estar relacionados entre sí, ya sea por exposición al mismo agente etiológico, a la misma fuente, o por el modo de transmisión. Además, se debe eliminar del total de casos investigados, aquéllos que definitivamente no se relacionan con el brote, para poder efectuar un análisis adecuado del problema. En esta etapa, la definición de caso deberá ser más precisa que en la anterior, y se deberán considerar los siguientes criterios: Clínico: Son los síntomas y signos más frecuentes de una enfermedad, la duración de cada uno de ellos y la secuencia en que se manifiestan en la historia natural. Un caso clínicamente compatible es aquel que presenta un síndrome clínico compatible con la enfermedad pero que no cumple con algún criterio impuestos en nuestra definición. Laboratorio: Un caso que es confirmado por uno o más de los métodos de laboratorio. Se refiere a la evidencia de la enfermedad o efecto a la salud e incluyen, entre otros, el aislamiento del agente, pruebas serológicas, inmunológicas, funcionales, morfológicas, toxicológicas y químicas. La definición de caso que incluye este aspecto es más específica, pero en algunas ocasiones las pruebas de laboratorio son muy costosas o no son específicas. Epidemiológico: Un caso epidemiológico es aquel paciente que ha tenido contacto con una o más personas enfermas y en quien la transmisión del agente es plausible. Un caso puede ser relacionado epidemiológicamente con un caso confirmado por laboratorio, si por lo menos uno de los casos en la cadena de transmisión ha sido confirmado por el laboratorio. En situaciones ideales, los casos que cumplen con los requisitos de la definición de caso, se consideran confirmados. En la definición de caso pueden participar elementos clínicos, de laboratorio y epidemiológicos, ya sean todos juntos o algunos de ellos. Puntos importantes al elegir una definición de caso. 1. Escoja una definición del caso que distinga casos epidémicos de casos esporádicos de una enfermedad endémica. 2. Una definición de caso que especifique criterios objetivos y documentados. 3. Escoja una definición que no incluya elementos relacionados con la hipótesis etiológica que más tarde puedan ser sujeto de análisis epidemiológico. 4. Basada en información clínica que esté disponible regularmente bajo condiciones locales. ¿Cuándo se debe elegir una definición de caso amplia?. Por ejemplo, escoger la que sea más sensible. - Cuando se trata de determinar la prevalencia de un problema en una población. ¿Cuáles son las desventajas de usar una definición amplia? - Es más probable incluir personas que no son casos, lo cual disminuye la especificidad. - La recolección de los datos puede ser muy costosa si un gran número de personas cumplen la definición de caso. ¿Cuándo se debe usar una definición de caso más limitada? - Cuándo se está planificando un estudio epidemiológico analítico para identificar factores de riesgo particulares en los casos; entonces la especificidad es mayor. Se debe decidir de manera algo intuitiva cuál es el mejor medio de localizar los casos y suponer con bastante certeza si la mayoría de los casos está en el hospital, en la comunidad, en una escuela o sí la mayoría de ellos se encuentra en otra parte del país. Debemos lanzar el anzuelo tan lejos como sea posible para atrapar la mayor parte de los casos, utilizando una definición de caso aceptable. No pierda tiempo en detalles de un caso u otro, hay que recordar la variación biológica normal; ciertas personas que se piensa que están afectadas por la enfermedad debido a que se expusieron, puede que no enfermen. Igual de perturbador pueden resultar las personas que se adaptan a su definición de caso, pero no forman parte de la epidemia, lo cual es necesario considerar para evitar el sesgo en la selección de los casos. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 45 FORMULACIÓN DE HIPÓTESIS Conforme avanza la descripción epidemiológica del problema, aparecerán diversas sugerencias respecto a la causa de la enfermedad. Saldrán ideas a partir de las características clínicas de los casos, de la situación geográfica o estacional en que ocurren los casos, de la ocupación, de las condiciones sociales y los antecedentes genéticos de los pacientes, de información existente respecto a las condiciones ambientales y posiblemente también de tratamientos exitosos. Todos estos hechos merecen ser considerados al principio de la investigación epidemiológica, particularmente si no se identifica rápidamente una sola causa. Si no se está seguro del grupo de población en riesgo de contraer la enfermedad, se tendrá que comparar las tasas de incidencia entre dos grupos de población diferentes. Si la tasa de incidencia es más elevada en la población A, comparada con la población B hay una buena evidencia para decir que la población A tiene un riesgo mayor de contraer la enfermedad. Consecuentemente se podrá estudiar cuidadosamente la población A para tratar de encontrar cuál fue la exposición a la cual estuvieron sometidas las personas de esta población. La siguiente etapa es postular cuales exposiciones son susceptibles de haber producido la enfermedad. Entonces hay que desarrollar una hipótesis que explique cuál es el agente, la fuente, su modo de difusión y la duración de la exposición; es necesario utilizar la intuición clínica, el laboratorio y otras fuentes razonables de información que le ayuden a producir hipótesis fundamentadas y biológicamente aceptables. Para decidir si una hipótesis etiológica justifica la investigación, se debe considerar si existe solamente la posibilidad de exposición ambiental, o si ésta es real y suficientemente alta como para causar enfermedad. Generalmente existe una exposición multicausal, pero realmente interesan sólo aquellas que resultan en una dosis lo suficientemente alta como para afectar a los individuos sensibles en la población expuesta. Este concepto es importante cuando consideramos, por ejemplo, las posibilidades de efectos en la salud en poblaciones localizadas cerca de lugares con depósitos de desechos tóxicos. En el área del tiradero de tóxicos de Love Canal en el estado de Nueva York (EUA) existía el potencial para exposiciones tóxicas. Sin embargo, en las casas en las que la posibilidad de exposición alta parecía ser la mayor, las mediciones ambientales indicaron una dosis real relativamente baja. Las incertidumbres respecto al cáncer causado por exposición acumulativa y la gran preocupación pública, condujeron a investigaciones epidemiológicas extensas respecto a los efectos potenciales en poblaciones que vivían cerca de Love Canal. Cuando se están considerando varias hipótesis etiológicas, es importante tener en mente ciertos criterios que han sido propuestos para considerar a las sustancias como una causa de enfermedad. Estos incluyen: 1. 2. Todos los casos deben haber recibido una dosis de la sustancia. En caso de exposición aguda, la implantación de la enfermedad debe ocurrir dentro de un tiempo razonable después de ocurrida la exposición (entre horas y unos cuantos días), excepto en el caso de algunas sustancias que puedan inducir enfermedades inespecíficas y subsecuentemente una enfermedad específica en algún órgano. 3. La recuperación debe tener lugar después de la exposición, a menos que: - el paciente muera - haya ocurrido un daño permanente en un órgano - haya desarrollado alergia. 4. En episodios agudos, los síntomas y signos comúnmente pueden no incluir: fiebre, linfadenopatía súbita, leucocitosis, diarrea persistente después que cesa la exposición, exudación inflamatoria. 5. El esquema de enfermedad incluyendo síntomas y signos en diferentes pacientes, debe ser más o menos consistente entre la población afectada. 6. Debe conocerse que la sustancia sospechosa produce el tipo de enfermedad y lesiones observadas, y no algo vagamente similar. 7. El material tóxico sospechoso debe producir lesiones idénticas/similares de toxicidad en una especie animal apropiada. Curso de Brotes de Enfermedades Ambientales y Ocupacionales 46 Es conveniente recordar que estos criterios son guías, no reglas. Cada uno de ellos hace una causa química más posible, pero algunos de estos criterios puede no estar presente en una instancia particular. Comprobación de hipótesis: Se debe probar y evaluar la hipótesis, modificándola en caso necesario. La comprobación de hipótesis es necesaria para sacar conclusiones respecto a la etiología de las enfermedades, a partir de estudios analíticos. Para cualquier situación particular pueden existir varias posibilidades etiológicas. Aunque se pueden usar los datos para probar varias hipótesis al mismo tiempo, es más productivo si el estudio puede probar aquella hipótesis con mayor posibilidad, o un número limitado de hipótesis. DEFINICIÓN DE LA POBLACIÓN BAJO RIESGO Una vez que se ha establecido la definición de caso, es importante seleccionar la población bajo riesgo; es el grupo de personas que expuestas a factores de riesgo son capaces de enfermar por la acción propia del agente causal, en virtud de las condiciones intrínsecas o extrínsecas del individuo que le predisponen a padecer el efecto en la salud. Por ejemplo, todas las personas de una población que no han desarrollado sensibilidad para padecer asma por exposición a diisocianato de tolueno están bajo riesgo de desarrollar la enfermedad, mientras estén expuestas. Las personas que padecen en forma crónica una enfermedad, se excluyen de la población en riesgo en los estudios de incidencia de la enfermedad. Existen poblaciones que por condiciones ambientales específicas y/o factores internos propios del organismo, presentan una mayor probabilidad de manifestar un efecto adverso en su salud que otras poblaciones. Al excluir de nuestro análisis a los grupos de población en los que la enfermedad no puede ocurrir (y no ocurre), se evita "diluir" las evaluaciones con gente que no está bajo riesgo. Por ejemplo, si la enfermedad sólo afecta a niños, entonces la población "bajo riesgo" es la de niños que viven en el área de brote. Cuando se conoce el factor causal específico, a menudo la población puede limitarse a un pequeño segmento de la población total del área en la que ocurrió el brote. Sin embargo, para comparar la ocurrencia de enfermedad en grupos con o sin exposición a los factores causales, la definición de la población bajo riesgo debe basarse en características descriptivas generales de una población, y no incluir una exposición específica a un factor ambiental peligroso. La definición de la población bajo riesgo se vuelve más difícil en situaciones en las que la enfermedad de interés tiene una naturaleza crónica, que no es distinguible de otras enfermedades endémicas normalmente observadas; o tiene largo período de latencia entre la exposición expuesta y la aparición de la enfermedad clínica. Finalmente, puede ser necesario definir poblaciones bajo riesgo en situaciones en las que ha ocurrido un grupo de casos, tales como cáncer, y donde la naturaleza clínica de la enfermedad sugiere una causa ambiental, pero no hay una evidencia clara para confirmar alguna exposición en particular. Tales concentraciones de casos puede ocurrir como resultado de una agrupación aleatoria de casos no relacionados con ninguna exposición en común. Sin embargo, la investigación epidemiológica de estas concentraciones necesita buscar posibles causas ambientales antes de aceptar la explicación de una aglomeración fortuita. La definición de poblaciones bajo riesgo puede ser arbitraria, cubriendo periodos variables y abarcando desde la población total de una ciudad o pueblo hasta manzanas particulares en una ciudad, distritos escolares u otras subunidades de la comunidad. Si se sugieren posibles fuentes de exposición ambiental, como en el caso de la contaminación de agua de pozo en Worburn, Masachusetts, EUA (ver recuadro), las definiciones de poblaciones se pueden centrar en la gente que utilice dichas fuentes. Aunque es necesario definir una población bajo riesgo en tales situaciones, de modo que el análisis epidemiológico pueda llevarse a cabo, es importante reconocer la naturaleza arbitraria de la definición y la incertidumbre de su relación con cualquier exposición ambiental real. SELECCIÓN DE UN DISEÑO DE INVESTIGACIÓN El tipo de estudio elegido para una situación particular depende de una variedad de factores, entre ellos, la naturaleza de la enfermedad, su frecuencia en la población, la frecuencia de los factores postulados como de riesgo, los recursos disponibles para apoyar los estudios y la experiencia del profesional de salud pública. Generalmente iniciamos con un estudio descriptivo (más barato) y después hacemos un estudio analítico (Figura 1). Los estudios primeramente se dividen en experimentales y observacionales. Un experimento es una investigación en la cual el investigador desea estudiar los efectos de la exposición, y decide cuales sujetos estarán o no expuestos al factor, con o sin aleatorización. Si se comparan sujetos expuestos a un factor Curso de Brotes de Enfermedades Ambientales y Ocupacionales 47 con sujetos no expuestos, se está conduciendo un experimento controlado. Amerita una metodología especial para calcular y seleccionar una muestra de la población en la cual se realizará el estudio, lo que equivale a la previa fijación de criterios (Cuadro 3). ESTABLECER VIGILANCIA (Búsqueda de casos) MEDIR ENFERMEDAD EN EXCESO DEFINIR POBLACIÓN BAJO RIESGO CONSIDERAR HIPÓTESIS Y SIGNIFICADO BIOLÓGICO REALIZAR ESTUDIO Y ANALIZAR RESULTADOS) DISEÑO DE ESTUDIO: •tamaño de muestra •información sobre enfermedad, exposición, comparabilidad, comparación de variables •ética •recursos •control de calidad ESTABLECER HIPÓTESIS ESCOGER DISEÑO DE ESTUDIO •transversal •cohortes •casos y controles INDAGACIÓN INICIAL DEFINIR ENFERMEDAD (Definición operacional de caso) EPIDEMIOLOGÍA ANALÍTICA EPIDEMIOLOGÍA DESCRIPTIVA NO SE DOCUMENTA EXCESO SIGNIFICATIVO DE LA ENFERMEDAD SIN ACCIÓN QUE RECOMENDAR OTROS ESTUDIOS GRUPO CONSULTIVO DE TRABAJO AGENCIAS COLABORADORAS ELIMINAR O MODIFICAR CAUSA SOSPECHOSA DE LA ENFERMEDAD Y ESTUDIAR SU REDUCCIÓN EPIDEMIOLOGÍA INTERVENTIVA SECUENCIA EN INVESTIGACIONES EPIDEMIOLÓGICAS DE CAMPO FIGURA 1 Curso de Brotes de Enfermedades Ambientales y Ocupacionales 48 CUADRO 3 CARACTERÍSTICAS PRINCIPALES DE DIVERSOS ESTUDIOS POSIBLES EN EPIDEMIOLOGÍA AMBIENTAL Estudio Estudio descriptivo. Población Diversas subpoblaciones. Exposición Registros de mediciones anteriores. Efecto en salud Estadísticas de mortalidad y morbilidad, Los factores de confusión son: Difíciles de distinguir. registros de casos, etc. Estudio transversal. Comunidad o grupos especiales; Actual Actual En general fáciles de medir. grupos expuestos y no expuestos Estudio prospectivo. Comunidad o grupos especiales; Definida al principio del estudio (puede grupos expuestos y no expuestos cambiar durante éste). Ha de determinarse durante el estudio. En general fáciles de medir. Problemas Ventajas Difícil de establecer las relaciones causa- Económicos, útil para la formulación de resultado y exposición-efecto. hipótesis. Difícil de establecer la relación causa- Puede efectuarse con rápidez; puede resultado; la exposición actual puede no basarse en poblaciones numerosas; guardar relación con la enfermedad puede estimar la amplitud del problema actual. (prevalencia). Caro y prolongado; las categorías de Permite estimar la incidencia y el riesgo exposición pueden cambiar; alta tasa de relativo; se puede estudiar muchas abandono. afecciones; permite deducir la relación causa-resultado. Estudio retrospectivo de Grupos especiales; profesionales, Ocurrida en el pasado: se necesitan Lo que consta en registros de Con frecuencia difíciles de medir Cambios de la relación exposición/efecto Menos costoso y más rápido que el cohortes. enfermos, personas aseguradas, etc. registros de mediciones anteriores. diagnósticos y mediciones anteriores. dado su carácter retrospectivo (por a lo largo del estudio; necesidad de estudio prospectivo de cohortes, ejemplo, hábito de fumar anterior). basarse en registros tal vez inexactos. proporciona respuesta análoga si se dispone de suficientes registros. Estudio de series cronológicas. Comunidad numerosa de varios Actual, es decir, cambios diarios de la Actual, es decir, variaciones diarias de millones de personas; grupos exposición. la mortalidad. En general grupos pequeños; Ocurrida en el pasado; determinada por Conocido al principio del estudio. enfermos (casos) y no enfermos registros o mediante entrevistas. A menudo difíciles de distinguir. Numerosos factores de confusión, a Útil para estudios sobre efectos agudos. menudo difíciles de medir. susceptibles, v. gr. asmáticos. Estudio controlado de casos. Difícil de generalizar por ser pequeño el Relativamente económico y rápido; útil grupo de estudio; incorporación de para estudiar enfermedades poco algunos sesgos. frecuentes. Medibles; pueden controlarse Costoso; consideraciones éticas; Resultados bien aceptados; pruebas aleatorizando a los sujetos. necesario el acuerdo de los sujetos del convincentes de causalidad. Eliminables neutralizándolos. (testigos). Estudio experimental (de Comunidad o grupos especiales. Controlada/conocida. intervención). Ha de medirse durante el estudio. estudio; abandonos. Fuente: Koning, H.W. Establecimiento de normas ambientales; pautas para la adopción de decisiones. Ginebra, OMS, 1988. Los diseños de estudios observacionales son los más comúnmente usados en epidemiología ambiental (Figura 2); en éstos la información se recolecta sistemáticamente, pero no hay intervención activa del investigador: pueden ser descriptivos y/o analíticos. Los estudios descriptivos determinan la distribución de las enfermedades y sus tendencias según tiempo, persona y lugar; generan hipótesis etiológicas, planeación de la salud y sugieren nuevos estudios. No obstante, en la práctica no hay estudios exclusivamente descriptivos; la actitud analítica y la experiencia, obligan a dar o a encontrar una explicación para cada hecho, o a establecer una hipótesis. 1. Tipos de estudios descriptivos: 1.1 Informes de casos y series de casos: Describen las características principales de un estudio observacional, y se utilizan en la generación de hipótesis en enfermedades raras, casos inusuales, para desarrollar investigación y vigilancia epidemiológica. Por no usar controles, tienen un valor científico limitado. 1.2 Estudios de correlación o ecológicos: Este tipo de estudio genera hipótesis etiológicas a nivel de un grupo. Los grupos pueden ser definidos por factores demográficos, límites geográficos o por períodos de tiempo, por lo que no mide exposición y enfermedad individual. Generalmente utilizan datos secundarios (incidencia, prevalencia y mortalidad); e información de exposición de grupos de interés, por ejemplo, datos de venta de cigarrillos, resultados del monitoreo ambiental o índices del estado socioeconómico. La comparación puede ser realizada en grupos cruzados o dentro de un grupo por un período de tiempo. Falacia ecológica: Puede encontrarse una asociación etiológica errónea por no medir las variables confusoras. Se utiliza para: a) Comparar la frecuencia de una enfermedad entre varios grupos durante el mismo período. b) Comparar la frecuencia de una enfermedad en una población en varios períodos de tiempo. Ventajas: − − − Bajo costo, porque puede usarse fuentes de datos disponibles. Se usa para generar hipótesis. Puede ser un diseño apropiado cuando la exposición es uniforme dentro de unos grupos, pero diferente en grupos cruzados. Desventajas: − − Sujeto a sesgos. No se pueden hacer inferencias individuales a partir de datos de grupos. Dificultad para calcular riesgo. − Transversales Ecológicos Serie de casos DESCRIPTIVOS Casos y controles A partir del efecto Cohorte A partir de la exposición ANALÍTICOS OBSERVACIONALES TIPOS DE ESTUDIO EPIDEMIOLÓGICOS SIN ASIGNACIÓN CONTROLADA DEL FACTOR DE EXPOSICIÓN FIGURA 2 − Los factores de confusión no son controlados. 1.3 Estudios transversales: También llamados de prevalencia. Permiten una imagen en un punto específico del tiempo acerca de la magnitud de un problema de salud pública en una comunidad. Se selecciona una muestra representativa de la población total y se mide exposición y enfermedad en estas personas. El tiempo de estudio es relativamente corto. Los estudios transversales son relativamente fáciles y económicos y resultan útiles para investigar exposiciones que constituyen características fijas de los individuos, como el grupo étnico, el nivel socioeconómico o el grupo sanguíneo. En los brotes o epidemias de una enfermedad, los estudios transversales que implican la medición simultánea de varias exposiciones y la detección de diversos efectos adversos, constituyen a menudo el primer paso correcto para la investigación de la causa. Ejemplo: − − Prevalencia de depresión y estado de empleo. Prevalencia de bronquitis crónica asociada a la contaminación del aire urbano. Ventajas de los estudios descriptivos: − − − − − − Rápido y barato (en general). Se tiene una muestra representativa de la población. (no existe sesgo en la selección por enfermedad o exposición). Se pueden estudiar múltiples enfermedades y exposiciones. Nos ayuda a planear y evaluar los servicios de atención médica. Complementa la historia natural de las enfermedades. Son una etapa inicial para un estudio de cohorte. Desventajas: − − − − No son útiles para enfermedades de baja frecuencia. No se puede medir la incidencia. Los casos que se detectan son una mezcla de incidentes y prevalentes. La exposición y el estado de enfermedad se determinan simultáneamente. No se puede determinar el tiempo entre la exposición y la enfermedad. No se puede responder a las preguntas de: ¿la exposición precede a la enfermedad?, ¿es plausible el período de latencia?. Los principales puntos a considerar en el diseño de un estudio de prevalencia son: a) Definir la población de referencia. b) Determinar si el estudio se realizará sobre el total de la población o en una muestra. c) Determinar el tamaño de la muestra poblacional y las formas de selección de la misma. d) Elaborar y validar los instrumentos o técnicas mediante los cuales se determinará la presencia o ausencia de las variables independientes y de las variables dependientes. e) Asegurar la comparabilidad de la información obtenida en los diferentes grupos. f) Determinar el tipo de análisis epidemiológico y estadístico de los datos. g) Determinar la conducta a seguir con los casos detectados. La estructura básica de los datos de prevalencia se expone en el Cuadro 4. Como puede observarse en el Cuadro 4, este diseño nos permite establecer las tasas de prevalencia correspondientes a expuestos y no expuestos a la variable independiente o establecer la "carga total" de la enfermedad en la población, considerando casos antiguos y nuevos de la patología en estudio. Otra alternativa de análisis, utilizada con frecuencia, es la determinación de los porcentajes de exposición en enfermos y no enfermos. De acuerdo con el Cuadro 4, tenemos que la proporción de expuestos en los enfermos es a/n y en los no enfermos b/n . 1 2 CUADRO 4 DISPOSICIÓN DE LOS DATOS EN UN ESTUDIO DE PREVALENCIA Variable dependiente Presente Ausente Total Tasa Presente a b m 1 a/m 1 Ausente c d m 2 c/m 2 Total n 1 n 2 n Variable independiente n /n 1 El análisis de los datos obtenidos por un estudio de este tipo, en el cual se pueden establecer tasas en diversos subgrupos, incluye: a) Medidas de asociación: Riesgo relativo y riesgo atribuible. b) Medidas de impacto potencial: Riesgo atribuible porcentual en los expuestos y riesgo atribuible porcentual poblacional. c) Límites de confianza del RR d) Chi cuadrada (X2) Los límites de confianza y la Chi cuadrada son equivalentes como pruebas de significación estadística de los valores obtenidos. Es decisión de cada investigador definir cuál de ellos se calcula. Fuentes de información en los estudios tranversales: • Registros hospitalarios: • • • • expedientes clínicos registros especiales protocolos de autopsias exámenes de laboratorio y gabinete • Fuentes oficiales. • • • 2. Ministerio de salud servicios de salud laboratorios Tipos de estudios analíticos: Prueban hipótesis etiológicas y estiman efectos en la salud. Además, pueden generar hipótesis etiológicas nuevas y preventivas, sugiriendo mecanismo de causalidad y acciones para la prevención de la enfermedad. Para probar la hipótesis, se estima una medida de asociación para determinar la magnitud, precisión y significancia estadística de esta asociación. 2.1 Estudio de cohorte: También llamado de seguimiento, incidencia, longitudinales o prospectivos. Procedimiento en el que dos o más grupos de individuos, libres de enfermedad y que difieren según el grado de exposición a una potencial causa de la misma, son comparados con respecto a la incidencia de esa enfermedad en cada uno de los grupos, para determinar si el estado de exposición está relacionado con el riesgo de enfermar (Cuadro 5). CUADRO 5 ESTRUCTURA BÁSICA PARA EL ESTUDIO DE COHORTES Efecto Sí No TOTAL SI a b a+b NO c d c+d Exposición RR= (a/a+b)/(c/c+d) El criterio que aquí prevalece es que la causa antecede a la enfermedad; se clasifican los individuos sin enfermedad a partir de la exposición, siendo muy importante su selección y la medición de la exposición. La población en riesgo de desarrollar el evento resultante (incidencia de una enfermedad o mortalidad) es seguida durante un tiempo a través de exámenes o vigilancia, durante o después del cual nuevos casos o muertes son identificados. Tipos de estudios de cohorte: Concurrente o prospectivo: La exposición y no exposición son determinadas en el presente, y el seguimiento es por varios años midiendo la incidencia. No concurrente, histórico o retrospectivo: La exposición es definida en base a hechos del pasado y el resultado definido en el presente. Combinado: La exposición es determinada en el pasado y la medición del efecto es hacia el futuro. Ventajas: − − − − − Determina incidencia y riesgo relativo. Se utiliza en enfermedades de prevalencia alta. Puede estudiar varios efectos de una exposición. Es posible estudiar la historia natural de una enfermedad después de una exposición. Los factores asociados a la selección de sujetos no pueden sesgar la estimación del factor de exposición. Desventajas: − − − − En general es costoso. Se necesita un gran número de sujetos a estudiar. Poco útil para padecimientos de baja frecuencia. Las pérdidas en el seguimiento reducen el tamaño de la muestra y pueden causar sesgo, ya que no se conoce en algunas ocasiones la causa de las pérdidas y no se puede suponer que pasa con esos casos. − − Pueden existir cambios en los criterios diagnósticos y progresos tecnológicos. Cambios de exposición durante el período de seguimiento. 2.2 Estudio de casos y controles: También llamado estudio retrospectivo, casos-comparación y casos-referencia (Figura 3). Involucra un diseño hacia atrás o no direccional que compara un grupo de casos y un grupo de no casos (controles) con respecto al nivel de exposición a un factor de riesgo habitualmente ocurrida en el pasado o que se inició en el pasado y aun continúa en el presente. El pareamiento se usa frecuentemente en los estudios de casos y controles, lo que se justifica por la necesidad de controlar los factores de riesgo ajenos a la hipótesis, los cuales de hecho deben ser controlados en el análisis después del pareamiento) o por el fortalecimiento de la eficiencia estadística. Es uno de los diseños utilizados con más frecuencia en epidemiología analítica. ENFERMOS (CASOS) NO ENFERMOS (CONTROLES) TENER LA CARACTERÍSTICA NO TENER LA CARACTERÍSTICA ESTUDIO DE CASOS Y CONTROLES PRINCIPIOS PARA ESTUDIOS DE CASOS - CONTROLES FIGURA 3 Características generales: − − − − La selección de los sujetos en estudio se hace a partir de la presencia (casos) o ausencia (controles) de la enfermedad. La selección de los casos y controles es independiente del antecedente de la exposición. Puede basarse en casos incidentes o prevalentes. Permite estimar el efecto de la exposición, al comparar la frecuencia de la exposición entre los casos a la frecuencia de la exposición entre los controles. CUADRO 6 ¿CUÁNDO UN BROTE AMERITA EL HACER UN ESTUDIO DE CASOS Y CONTROLES? Un brote necesita investigarse con un estudio de casos y controles, si al menos presenta dos o más de los siguientes criterios: - Riesgo alto - Etiopatología rara - Contaminación ambiental persistente - Biomarcadores disponibles - Exposición variable dentro de la comunidad - Ruta de exposición identificable - No existe información previa de eventos similares - El problema es endémico en un lugar determinado más que un tiempo determinado Problemas en el diseño de casos y controles: − La selección de los controles es la etapa más difícil de un estudio de casos y controles, ya que el investigador debe asumir que los sujetos de comparación son representativos de la misma población en la cual se desarrollan los casos (sesgo de selección). − Es difícil obtener información exacta respecto a exposiciones anteriores en base a recuerdos (sesgo de memoria) o registros establecidos. − Si el sujeto tiene el conocimiento de que la exposición provoca la enfermedad, entonces puede haber cambios de conducta, que pueden modificar el efecto de la exposición, lo cual da errores en la medición. Ventajas: − Permite estudiar enfermedades que ocurren con poca frecuencia, pero también se puede investigar enfermedades con períodos de latencia diferentes. - Más barato y de menor duración que los de cohorte. Se puede estudiar múltiples factores etiológicos de una enfermedad. − Utiliza pequeños tamaños de población. − Desventajas: No se puede calcular estimadores directos de incidencia ni de prevalencia de la enfermedad en los expuestos y no expuestos. − La información sobre el factor bajo estudio es obtenida después de la ocurrencia de la enfermedad y los grupos de casos y no − casos que se comparan son seleccionados a partir de dos poblaciones separadas. Consecuentemente, es difícil asegurar que los casos y no casos en la población en estudio sean comparables con respecto de factores de riesgo extraños y otras fuentes de distorsión. Puede ser incompleto el control de las variables extrañas, por lo que se debe tratar de medir las variables confusoras para no − subestimar el efecto de la variable causal. Es raramente posible el estudio detallado de los mecanismos de transmisión o propagación. − Planeación y conducción del estudio de casos y controles: Definición del caso: Todos los casos deben ser comparables, de modo que es importante que se utilicen criterios diagnósticos estrictos para la enfermedad que se está estudiando. Cuando se dispone de información limitada en relación al diagnóstico, es necesario definir los casos definitivos y probables. Fuentes para la selección de casos: Generalmente se seleccionan pacientes que están bajo tratamiento en un centro médico ya que esto es relativamente fácil y − barato. Sin embargo en salud ocupacional y ambiental se puede aplicar para evaluar el efecto de medidas de prevención y control en grupos de trabajadores. Otras fuentes pueden ser la comunidad, registros de consulta, registro civil, etc. − La selección de pacientes de la población en general comprende la localización de parte de los individuos afectados y la obtención − de datos de los mismos; es decir, una muestra al azar de la población. Este tipo de muestreo no se realiza con frecuencia debido a su costo y dificultad logística. Definición del grupo control: Los controles deben ser comparados con los casos, ya que intentan brindar una estimación de la tasa de exposición que podría esperarse que ocurriera en los casos, si no hubiera asociación entre la enfermedad en estudio y la exposición. El grupo control es usado para comparar la historia de exposición en los individuos que están libres de la enfermedad en estudio. a) Fuentes de selección: − − − − − b) Controles hospitalarios. Personas que de haber enfermado por la causa que buscamos hubieran acudido al mismo hospital por dicha causa. Controles comunitarios que sean comparables a los casos. Amigos, vecinos, parientes, etc. Trabajadores de una industria. Elegibilidad: − Los criterios deben ser similares a los casos en cuanto al riesgo de exposición, deben proceder de la misma población base de los casos. − c) No debe incluir a aquéllos en los que se conoce el antecedente (positivo o negativo) de asociación a la exposición. ¿Cuántos controles deberían utilizarse para cada caso? − Si el tamaño del grupo de casos es limitado, se puede aumentar el poder estadístico del estudio incrementando la proporción de controles por cada caso. Existe poca ventaja estadística al aumentar el número de controles por caso por arriba de 4:1. − Una razón de 1:1 es aceptable si existe una población de estudio suficientemente grande. Métodos para la selección de controles: − Muestra al azar: individuos no expuestos al factor de riesgo, seleccionados sistemáticamente de modo que cada control potencial tenga la misma probabilidad de ser seleccionado. − Muestras de pares pareados: se seleccionan uno o más controles para cada caso en base a criterios definidos (sexo, edad, profesión, hábitos, condición socioeconómica y otros). Desarrollo de un instrumento para captar información y recopilar datos: Las fuentes de datos sobre enfermedades son: certificados de defunción, registro de casos, archivos de hospitales y clínicas, servicios médicos de empresas e informes de patología, entre otros. Los datos sobre exposición se pueden obtener de entrevistas con el sujeto de estudio o su sustituto (familiares, vecinos, compañeros de trabajo y empleador) revisión de expedientes médicos, revisión de registros de monitoreo ambiental. Análisis de datos: El Cuadro 7 muestra la estructura de datos en el análisis de resultados de los estudios de casos y controles. El análisis es una comparación entre los casos y los controles en lo que respecta a la frecuencia de una cierta exposición. Cuando los casos no están pareados con los controles se debe calcular la razón de productos cruzados, RPC (o razón de disparidades, odds ratio [OR], etc). El pareamiento, se realiza con uno o más controles por caso en base a sus similitudes con respecto a la(s) variable(s) seleccionada(s). El objetivo es eliminar sesgos de comparación entre casos y controles, las variables pareadas deben ser independientes del factor de riesgo estudiado. CUADRO 7 Efecto SI NO SI a b NO c d Total a+c b+d Exposición RPC = (ad)/(bc) Interpretación de los datos: El resultado de la RPC debe relacionarse con los límites de confianza, puede aplicarse la prueba de chi cuadrada y también hacerse análisis para muestras estratificadas si es necesario; cuyos resultados se interpretan en base al nivel de significancia y asociación causal. Este tipo de estudios es bastante susceptible de presentar sesgos, los que se deben tomar en cuenta al interpretar los resultados. DISEÑO DE CUESTIONARIOS Y METODOLOGÍAS DE ENCUESTAS∗ La recolección de datos puede realizarse de distintas formas. El método seleccionado depende de los objetivos y diseño del estudio, así como de la disponibilidad de personal, tiempo y recursos financieros. Un factor importante que se debe considerar en la selección del método, es si el estudio pretende producir resultados cuantitativos con cierto grado de precisión, o bien, datos cualitativos que proporcionen información de tipo descriptivo (Cuadro 8). La entrevista estructurada es el método de recolección comúnmente utilizado. Existen otros métodos como cuestionarios autoaplicados (entrevistas indirectas), centros de estadísticas vitales y censos, o ciertas fuentes secundarias que pueden proveer documentos e información diversa. Los métodos que obtienen datos mediante entrevistas a personas, se denominan encuestas. Para desarrollar una encuesta se requiere de una serie de pasos secuenciales para asegurarse buenos resultados (Cuadro 9). Si los entrevistados constituyen una muestra representativa de la ∗ Centers for Diseases Control. Curso Epidemiología, Bioestadística y Comunicaciones en Salud Pública. Bolivia. CDC/USAID/CCH. 1993. CUADRO 8 MÉTODOS DE RECOLECCIÓN DE INFORMACIÓN CENSO ENCUESTA Toda la población Una muestra de la población Técnicas Instrumentos Primaria: Observación Guía de observación Secundaria: Cédulas/Formatos Revisión documental población, estos estudios se denominan encuestas por muestreo. Si la muestra es suficientemente grande como para permitir análisis estadístico, es común emplear entrevistas estructuradas en lugar de no-estructuradas, ya que las primeras se prestan mejor a análisis cuantitativos; y las segundas, pueden crear serias dificultades en el procesamiento de datos, particularmente si la muestra es grande. En la entrevista estructurada se emplea un cuestionario (o guión de entrevista) con objeto de asegurar que a todos los encuestados se les hacen las preguntas en el mismo orden. El contenido exacto de cada pregunta se especifica de antemano, y el encuestador se concreta a leer cada pregunta al entrevistado. CUADRO 9 PLANIFICACIÓN DE UNA ENCUESTA: Una lista de verificación. 1. Planteamiento de los objetivos 2. Población objetivo 3. Marco muestral 4. Diseño de la muestra 5. Método de medición 6. Instrumento de medición 7. Selección de trabajadores de campo 8. Prueba preliminar 9. Organización del trabajo de campo 10. Organización del manejo de datos 11. Análisis de datos Cuestionario: Es una forma impresa diseñada para ayudar en el proceso de recolección de la información y es por ello un instrumento de medición que se aplica a través de una secuencia de preguntas. El cuestionario debe ser planeado cuidadosamente en tal forma que facilite la obtención de los datos. Debe ayudar a recoger la información de manera completa, eficiente, uniforme y evitando la recolección de datos inútiles o irrelevantes al estudio. Por ser un instrumento de medición, el cuestionario tiene el riesgo de generar sesgos. El cuestionario debe recoger al menos dos clases de datos: a) Generales, administrativos o de información básica y b) Datos sobre el problema en estudio. Los primeros ayudarán a identificar las unidades de observación e incluyen nombre, edad, sexo, residencia habitual, fecha de estudio, etc. A través de ellos puede medirse el rendimiento del personal y la distribución de algunas características generales. En cuanto a los segundos, se refieren al tema en estudio y deben estar en perfecto acuerdo con los objetivos planteados en el mismo. Elaborar un cuestionario es una de las actividades difíciles y que requiere de buen conocimiento sobre el tema que se esté estudiando. Hay sin embargo lineamientos generales que pueden orientar la construcción del mismo. 1. El diseño del cuestionario dependerá de: − − − − El propósito para el cual será utilizado y las circunstancias bajo las cuales se recogerá la información. Los recursos materiales y humanos que se disponga para realizar el estudio. La complejidad de los datos que se necesita recopilar. La necesidad de ayudas visuales. 2. Tipos de preguntas que puede realizarse: Se debe decidir qué tipo de preguntas van a estructurar el cuestionario de acuerdo con el objetivo, la población y las variables bajo estudio. a) Preguntas abiertas: Inducen respuestas detalladas, no específicas, pueden obtener frases que son comunes dentro de la población, pero no para el investigador. Parece que funcionan mejor en entrevistas cara a cara. Ventajas: − − − Útiles para la investigación, porque proporcionan información detallada. Sirven para obtener datos sobre actitudes, ya que las respuestas de los encuestados se registran palabra por palabra. Es posible elaborar preguntas de selección múltiple o cerradas en versiones posteriores del mismo cuestionario. Desventajas: − − Se requiere de mucho tiempo. Son difíciles de procesar estadísticamente. b) Preguntas de selección múltiple o preguntas cerradas: Son preseleccionadas, deben ser exhaustivas y mutuamente excluyentes, pueden ser dicotómicas o múltiples, y funcionan bien tanto para las entrevistas cara a cara como para los formularios autoadministrados. Ventajas: − − − Permiten una gran variedad de respuestas. Evitan los extremos de las categorías de respuestas con dicotomía. Pueden hacer recordar al entrevistado las experiencias que ya había olvidado. Desventajas: − Pueden hacer que el encuestado piense que un ítem es conocido cuando en realidad no lo es. Preguntas cerradas con dicotomía: las ventajas es que son útiles en los cuestionarios largos y complejos, son simples de codificar, procesar y analizar. Sus desventajas: pueden ser codificadas erróneamente y dar como resultado una respuesta totalmente contraria, o pueden quedarse sin responder si el encuestado no se compromete a adoptar una postura completamente positiva o negativa. 3. En el diseño del cuestionario y en el entrenamiento de los encuestadores deben tomarse en cuenta las siguientes recomendaciones: − Investigue/utilice preguntas ya formuladas en otras encuestas. Las respuestas estandarizadas son útiles para comparar datos recopilados por diferentes investigadores. − − Incluya todas las preguntas necesarias para obtener información suficiente. Solicite que el encuestado proporcione solamente la información que usted no posee. La identificación de datos tales como la región, ciudad y otros, deberían ser parte de la información precodificada. − − − − − − − − Limítese a tratar un asunto por pregunta. Elimine las preguntas que sólo responden lo que a usted "le gustaría saber". Haga un mínimo de preguntas abiertas. Trate de evitar preguntas incómodas o comprometedoras. Evite cualquier lenguaje que pudiera sugerir la respuesta. Si quiere obligar al encuestado a elegir entre categorías específicas, no incluya la categoría "No sé". Proporcione un número suficiente de categorías de respuestas y que sean mutuamente excluyentes. Asegúrese de indicar las unidades de medida para las variables continuas (peso, años, etc.). 4. Procesamiento de datos del cuestionario. − Cuando sea posible, codificar las respuestas para que la información pueda ser transferida a programas de computación o tabuladas en alguna forma. − − Suministre un espacio para cada dígito que usted espera que el entrevistador codifique. Utilice el mismo esquema de codificación en todo el cuestionario. 5. Orden del cuestionario. − − − Coloque las preguntas en secuencia lógica. Agrupe las preguntas por temas. Cuando cambie de tema, incluya una oración o párrafo que sirva de transición. Esto ayudará al encuestado a concentrarse en el nuevo tema. − Comenzar por las preguntas más fáciles, pasando gradualmente a las más difíciles y delicadas, a medida que la tensión del principio disminuya. − − − − No divida una pregunta en dos páginas. Si el cuestionario está impreso en ambas caras del papel, ponga la frase "voltee la página". Evite prolongar el tiempo de la entrevista. Imprima los cuestionarios lo más profesionalmente que sea posible. 6. Efectuar una prueba preliminar del cuestionario, para validarlo. − En la prueba, interrogar entre 30 y 50 personas es suficiente, siempre que sean seleccionados de forma que reflejen la diversidad esperada de la muestra. Es probable que sea necesario hacer más de una prueba, si la primera da lugar a un número importante de modificaciones; es mejor efectuar otra prueba para asegurarse que los cambios introducidos son satisfactorios. − Capacitar ampliamente a los encuestadores, con el objeto de familiarizarlos con la intención y significado de las diferentes preguntas. MÉTODOS DE MUESTREO* En general, no es posible estudiar la totalidad de la población en la que se está interesado. Por lo tanto, es necesario elegir una muestra y relacionar sus características con las del total de la población. La muestra necesita: 1) representar al total de la población, 2) ser del tamaño suficiente como para minimizar las variaciones en la muestra, y 3) tener una adecuada cobertura que represente a todos los grupos potenciales de interés. Después de haber seleccionado la unidad estadística básica (individuos o grupos de individuos), se procederá a determinar la manera en que se realizará la selección de las unidades. Para este efecto es útil distinguir a la población total de la muestra que será seleccionada a partir de ella. La población será constituida por elementos, siendo cada uno de ellos casos potenciales de estudio. En ciertos estudios, la población resulta ser tan pequeña que todos los elementos bien pueden incluirse en la muestra. Sin embargo, a menudo se trata de grupos muy numerosos de personas; por lo tanto, es necesario recurrir a muestras para representarlos. Si la muestra es realmente representativa y comprende varios casos, los resultados serán muy similares a los que se habrían obtenido estudiando el total de la población. 1. Tipos de muestreo Existen dos tipos fundamentales de muestras: 1) Muestras probabilísticas y 2) Muestras no probabilísticas. 1.1 Muestreo probabilístico. Una muestra probabilística tiene más posibilidades de ser representativa de la población que una no probabilística. La característica esencial de una muestra probabilística es que cada elemento de la población total (cada individuo, cada trabajador de campo, cada clínica) tiene la probabilidad conocida de pertenecer a la muestra, es decir, igual probabilidad de ser seleccionado. De esta forma la muestra es autoponderada, y los resultados del análisis de la muestra pueden considerarse como representativos de la población. Existen varias maneras de seleccionar muestras probabilísticas, que a continuación se describen: 1.1.1 Muestreo aleatorio simple. En este procedimiento a cada elemento de la población se le asigna un número único, empleando una tabla de números aleatorios, una calculadora o una computadora para seleccionar elementos hasta alcanzar el tamaño de muestra deseado. Este procedimiento puede resultar largo y tedioso cuando la muestra es grande. Por otra parte, es necesario que se cuente anticipadamente con una lista de todos los elementos que integran la población (denominada marco muestral). Ventajas: - Fáciles de entender. - Fáciles de analizar: media o proporción de la muestra. - Teoría estadística y, por consiguiente, paquetes de computación. * Ver apéndice 5. Desventajas: - Se requiere una lista de la población. - Son caras o imposibles cuando: a. Existe dispersión geográfica. b. No existe una lista. c. El tamaño de la muestra es demasiado grande. 1.1.2 Muestreo sistemático. Es una variante del muestreo aleatorio simple y resulta más rápida y fácil de realizar. El total estimado de elementos de la población se divide entre el tamaño de muestra deseado, obteniéndose así el intervalo de muestreo (n). Para formar la muestra se enlistan arbitrariamente todos los elementos de la población y se selecciona cada n-ésimo elemento, empezando con un número entre uno y n, seleccionado aleatoriamente. A diferencia del muestreo aleatorio simple, que exige que se tenga anticipadamente la lista de todos los elementos que integran la población (marco muestral), el muestreo sistemático permite la obtención simultánea del marco muestral y de la muestra, disminuyendo costos. Sin embargo, es preferible disponer anticipadamente del marco muestral lo que permite obtener, mediante muestreo sistemático, el tamaño preciso de muestra. Si no se conoce el total de la población, el tamaño de la muestra tampoco podrá conocerse. Supóngase, por ejemplo, que se desea sacar una muestra de 20 hogares en una población. Para eso se deberá conocer el número de hogares de la comunidad, si no es así, deberá estimarse. Si se estiman 200 hogares, el intervalo de muestreo será de 20, es decir, que a medida que se elabora la lista de hogares, se interroga un hogar de cada diez. Ventajas: - Más fácil de implementar. - Más rápido. Desventajas: - Prejuicio de la lista ordenada - Estimación de la varianza 1.1.3 Muestreo estratificado. Si queremos asegurarnos de la representatividad de la muestra a nivel de ciertos sub-conjuntos de la población estudiada, podemos recurrir a la estratificación tanto con el muestreo aleatorio simple como el sistemático. La estratificación consiste en dividir la población en grupos o "estratos" mutuamente excluyentes, de acuerdo a alguna variable o característica clave, y seleccionar después muestras separadas para cada estrato. Las muestras se estratifican comúnmente en función de factores tales como sexo, profesión, residencia rural-urbana o diversas regiones de un país. 1.1.4 Muestreo por conglomerados. Este tipo de muestreo por conglomerados o grupos de elementos se puede seleccionar mediante muestreo aleatorio simple, sistemático o estratificado y estudiar todos los elementos de los conglomerados muestreados. Los conglomerados pueden ser áreas geográficas (provincias, distritos, comunas, manzanas) o unidades tales como clínicas, escuelas, clubes o grupos de trabajadores de campo. Esta técnica tiene la desventaja de que si los conglomerados contienen personas similares (alta correlación interclase), es difícil estimar la precisión con la cual se puede generalizar a la población en estudio. Ventajas: - Requiere de una lista de conglomerados y no de elementos. - La muestra no está dispersa. - Reduce los costos de la encuesta. Desventajas: - Complicaciones en los cálculos matemáticos de la varianza muestreal y, por ende, en las pruebas estadísticas. - Generalmente se requiere de tamaños mayores de muestra para obtener resultados estadísticamente significativos a un nivel de confianza determinado. 1.1.5 Muestreo por etapas múltiples. La técnica de selección más comúnmente empleada en poblaciones numerosas y diversificadas es la de muestreo por etapas múltiples. Primero, la población se divide en conglomerados naturales, de los cuales se selecciona una muestra; a ésta se le denomina la primera etapa de muestreo, la segunda etapa consiste en sacar una muestra de elementos (encuestas, casos) de los conglomerados muestreados. A veces más de dos etapas de muestreo son necesarias. Por ejemplo, en la primera etapa se seleccionan provincias; en la segunda, se seleccionan distritos dentro de las provincias; en la tercera etapa, se seleccionan aldeas dentro de los distritos; y finalmente, en la cuarta etapa se seleccionan personas dentro de las aldeas. En cada etapa se pueden utilizar diferentes técnicas de muestreo: aleatorio simple, sistemático o estratificado. Ventajas: - En cada etapa, se elabora una lista solamente para las unidades muestreadas. - Combinación de conglomerados y la estratificación. Desventajas: - Muchas decisiones en cada etapa. - El análisis depende de cómo se seleccionó una muestra en cada etapa. - Los paquetes de computación son inútiles. 1.1.6 Selección con probabilidades proporcionales al tamaño (PPT). Este procedimiento es una variante del muestreo multi-etápico. Consiste en seleccionar cada conglomerado con una probabilidad proporcional a su tamaño y sacar un número igual de elementos dentro de cada conglomerado muestreado. La selección PPT es útil cuando los conglomerados son muy diferentes en tamaño, permitiendo reducir tanto la varianza muestral como los costos de la recopilación de datos. 1.2. Muestreo no probabilístico. En este tipo de muestreo se desconoce la probabilidad de selección de cada elemento. Un muestreo no probabilístico puede ser accidental (tomando los casos que están disponibles) o deliberado (seleccionando explícitamente ciertos tipos de casos). Se puede fijar anticipadamente el número preciso de personas a estudiar en cada categoría seleccionada, a este procedimiento se le denomina muestreo por cuota ya que la "cuota" de cada sub-grupo se fija por anticipado. Los procedimientos no probabilísticos no son válidos para obtener muestras realmente representativas de grandes poblaciones. Estos procedimientos casi siempre tienden a sobrerepresentar ciertos elementos de la población y a sub-representar a otros. Dada la ausencia de probabilidades conocidas de selección, no hay forma precisa de ajustar tales distorsiones. Las posibilidades de sesgos aumentan en este tipo de muestreo. 2. Tamaño de la muestra* El tamaño de la muestra debe fijarse tomando en cuenta dos criterios: los recursos disponibles, que fijan el tamaño máximo de la muestra y las necesidades del plan de análisis, que fija el tamaño mínimo de muestra. Además, el tamaño de la muestra debe ser suficiente para 1) permitir un análisis confiable; 2) proporcionar el grado de precisión deseado en la estimación de proporciones y 3) probar si las diferencias entre proporciones son estadísticamente significativas. Si los recursos disponibles para * Ver apéndice 6. el estudio son insuficientes para obtener una muestra del tamaño adecuado, el investigador deberá buscar financiamiento adicional, o bien, modificar el plan de análisis de datos. Una de las observaciones más comunes hechas en las revistas es que el poder o el tamaño de la muestra no es adecuado para concluir que el efecto o la asociación está presente. La probabilidad de un error tipo I, o error alfa, es la probabilidad de encontrar una asociación estadísticamente significativa cuando de hecho no existe asociación. Esto también es el valor de P. La probabilidad de un error tipo II, o error beta, es la probabilidad de encontrar una asociación no estadísticamente significativa cuando la asociación está presente. Sólo hay dos formas para reducir simultáneamente el error tipo I y II. Incrementar el tamaño de la muestra y la duración del período de estudio, si es un estudio de base poblacional. El poder estadístico (o 1-β) es la probabilidad de encontrar una asociación estadísticamente significativa cuando verdaderamente existe dicha asociación. Al igual que otros factores, la potencia de una prueba depende del tamaño de la muestra (cuanto mayor sea la muestra, mayor será su potencia). La potencia depende también del nivel de significancia elegido; para una muestra de un tamaño determinado, cuanto mayor sea el nivel de significación (es decir, menor la probabilidad de un error tipo I), menor será su potencia (mayor será la probabilidad de un error tipo II). Frecuentemente en los estudios se establece como objetivo una potencia de 0,8 con un nivel de significancia de 0,5, ello significa que la probabilidad de cometer el error tipo II (0,2) es cuatro veces mayor que la probabilidad de cometer un error tipo I (0,05), lo que refleja que en general, un error tipo I se considera mucho más grave que uno tipo II. La potencia debe hacerse constar cuando se presenta un resultado negativo. Hay tres niveles de medición que pueden ser afectados por la muestra seleccionada: - Precisión: ¿Qué tan grande debe ser la muestra? - Validez Interna: ¿Qué exactitud tienen las mediciones? - Validez Externa: ¿Puedo generalizar a toda la población? Validez interna, es el grado en que los resultados de una observación son correctos para el grupo específico de personas objeto del estudio. Para que un estudio tenga alguna utilidad, debe ser internamente válido, aunque un estudio de perfecta validez interna puede no ser útil si sus resultados no son comparables con los de otros estudios. El generalizar los resultados (validez externa) a otra población diferente a la del estudio, debe ser hecho con precaución. Los estudios pueden tener una validez interna, que es válida sólo para la población en estudio, pero no es capaz de generalizarse a otra población. Los problemas de validez son originados en la selección de la población que pueden producir una mayor distorsión de los resultados dando problemas en la inferencia estadística. Cálculo para el tamaño de muestra. 1.Especificar los errores alfa y beta: 0,05 o menor para alfa y 0,20 o menor para beta (que es, 0,80 o mayor para el poder). 2. Especificar el efecto del tamaño. Depende del diseño del estudio. a) Para un estudio de casos y controles, la proporción de controles y la proporción de casos necesita ser especificada. b) Para un estudio transversal o de cohorte, la proporción de sujetos expuestos con la enfermedad y la proporción de sujetos expuestos sin enfermedad deben ser especificadas. c) Si en una variable continua existe diferencia en la prueba de los promedios, ésta debe ser especificada usando la fórmula para el tamaño de muestra, así como también la desviación estándar de la variable. 3. Fórmula para el cálculo de una muestra, para proporciones: n= z 2 ( pq) d2 ⇒ n= ni 1 + ni / N ni = Tamaño inicial de la muestra. z = Desviación en relación a una distribución normal estándar. Generalmente es fijada en 1,96 lo que corresponde a un nivel de confianza de 95%. p = proporción de la población objeto de estudio, que se estima tiene una característica determinada; si no se dispone de tal estimación, úsese 50% (0,50). q = complemento = 1,0 - p d = Precisión con la que se generalizan los resultados, poder de la muestra, 0,05 y a veces 0,02 Por ejemplo, si se estima que la proporción de la población que tiene una característica determinada es 0,50, el valor de z es igual a 1,96 y el grado de precisión deseado es de 0,05, el tamaño de la muestra es: (1,96) 2 (0,50) (0,50) ni = = 384 (0,50) 2 Luego se calcula el tamaño definitivo de la muestra (n) mediante: n= ni 1 + (ni ) /( N ) n = Tamaño definitivo de la muestra. ni = Tamaño inicial de la muestra (cuando el tamaño de la población es superior a 10.000). N = Tamaño de la población. Si por ejemplo, se cálculo ni = 384 y el tamaño de la población estudiada es igual a 10.000 personas, entonces n es: n= 384 384 = = 369,79 = 370 personas 1 + (384) /(10 000) 1,0384 4. Fórmula para el tamaño de una muestra, para promedios: ni = Z2 S2 d2 ⇒ n= ni 1 + ni / N Z2 = Valor de probabilidad basado en la distribución normal S2 = Varianza d2 = Relación de precisión (error máximo de estimación) ni = Tamaño de muestra inicial n = Tamaño definitivo N = Tamaño de la población Z = 1,96 5. En el caso en que se desee probar si existe diferencia significativa (d') entre las proporciones de dos sub-muestras, suponiendo un número igual de observaciones (n1 = n2 = n) en cada sub-muestra, la fórmula para n' es similar a la precedente: 2 z 2 pq (d ' ) 2 n' = Por ejemplo, supóngase que se desea comparar la proporción de personas que usan equipo de protección en el trabajo entre un grupo experimental y uno de control. Si se espera que la proporción que usa equipo (p) sea de 0,40 y se desea concluir, con un 95% de confianza, que una diferencia observada de 0,10 o más es significativa, el tamaño de la muestra podrá entonces calcularse de la siguiente manera: n' = 2(1,96) 2 (0,40)(0,60) = 184 (0,10) 2 Por lo tanto, se necesita una muestra de 184 casos en el grupo experimental y de 184 en el grupo control. Para diferencia entre proporciones: n= ( Po Qo P1 Q1)(Z1 − a / 2 Z1 − B ( P1 − Po) n = Tamaño de cada grupo Po = Proporción de enfermos no expuestos (o proporción de expuestos en estudios de casos y controles). P1 = Proporción de la enfermedad en expuestos (o proporción de expuestos). Qo = 1 - Po Q1 = 1 - P1 Z1-a/2 = Z - score para el nivel α (por ejemplo, 1,96 para dos colas, α de 0,05). Z1 - B = Z - score para β (por ejemplo, 0,84 de poder (1- β ) de 0,80). 6. Para diferencia en las medias: ni = Z 2S 2 d2 ⇒ n= n 1 + ni / N ni = Tamaño inicial n = Tamaño definitivo de la muestra N = Tamaño población Z2 = Valor de probabilidad basado en la distribución normal S2 = Varianza d2= Relación de precisión (error máximo de estimación Si no se conoce la varianza de la muestra (S2) se puede realizar un estudio piloto, con al menos 30 elementos aleatorios, calcular S2, y utilizar esta información para obtener ni. Fuentes de error: 1. 2. Los errores pueden provenir de cualquier fuente que no sea el diseño de la muestra: - Información intencionada inexacta de los entrevistados. - Información involuntariamente inexacta de los entrevistados. - Diseño deficiente del cuestionario. - Falta de respuesta. - Errores de cobertura. - Errores de captura. Estrategias para minimizar los errores que no son de muestreo. - Entrevistadores capacitados - Verificación de datos - Elaboración del cuestionario REALIZACIÓN DEL ESTUDIO Y ANÁLISIS DE LOS RESULTADOS Cuando se haya completado los preparativos del estudio se puede proceder a la recolección de datos, seguida de la organización de los mismos y del análisis correspondiente. El análisis comienza una vez que se han reunido los datos, al verificar que estén completos y sean exactos, organizándolos para la tabulación, presentación y las pruebas estadísticas. Los datos pueden presentarse de formas diversas, como tablas de frecuencia, histogramas, diagramas de barra, tabulaciones cruzadas, diagramas circulares o gráficos de sectores, etc. (ver apéndice 2). 1. Análisis de datos: Para resumir o describir las distribuciones de las escalas interválicas o de razón hay dos instrumentos básicos, las medidas de tendencia central (también llamadas medidas de centralización, que indican el punto medio de la distribución) y las medidas de variabilidad o dispersión, que indican la dispersión de los valores (ver apéndice 3). La medición de la frecuencia de la enfermedad se basa en los conceptos fundamentales de prevalencia e incidencia. Es importante señalar que el cálculo de esta frecuencia depende de una estimación correcta del número de personas que se está considerando. Lo ideal es que estas cifras incluyan sólo a potencialmente susceptibles de padecer la enfermedad en estudio. Por ejemplo, es evidente que los varones no deben ser incluidos en los cálculos de frecuencia del carcinoma de cuello uterino. La prevalencia de una enfermedad es el número de casos (viejos y nuevos) de la misma en una población y en un momento dado, mientras que su incidencia es el número de casos nuevos que se producen durante un período determinado en una población específica. Se trata de instrumentos esencialmente distintos para medir la ocurrencia de la enfermedad; la relación entre incidencia y prevalencia varía de unas enfermedades a otras. Hay enfermedades de alta prevalencia y baja incidencia, como la diabetes; o de baja prevalencia y alta incidencia, como el resfriado común; los resfriados son más frecuentes que la diabetes, pero sólo durante un intervalo muy corto; mientras que una persona que se convierte en diabética, la padecerá de forma permanente. Los datos de prevalencia e incidencia adquieren mayor utilidad si se convierten en tasas. Una tasa se calcula dividiendo el número de casos por el número correspondiente de personas de la población expuesta al factor de riesgo, y se expresa como casos por 10n personas (para mayor información acerca de tasas ver apéndice 4). La medición de la frecuencia de la enfermedad o de otros estados de salud sólo es el comienzo del proceso epidemiológico. El paso esencial consiste en la comparación de la frecuencia entre dos o más grupos de personas en los que la exposición haya sido distinta. En sentido cualitativo, una persona puede haber estado o no expuesta a un factor de estudio; y cuantitativamente las personas expuestas pueden haber tenido distintos niveles y duraciones de exposición. El proceso de comparación de frecuencias puede utilizarse para calcular el riesgo que una exposición dé lugar a un efecto sobre la salud. Pueden establecer tanto comparaciones absolutas como relativas; las medidas describen la fuerza de una asociación entre exposición y evolución (ver apéndice 7). 2. Sesgos y confusión Sesgo (error sistemático). En epidemiología se habla de error (o sesgo) sistemático cuando existe una tendencia a obtener resultados que difieren de forma sistemática de los valores verdaderos. El principal interés del diseño del estudio es eliminar la influencia de sesgos potenciales. Si un estudio tiene un error sistemático pequeño su exactitud se considera elevada. La exactitud no depende del tamaño de la muestra. Aunque hay muchos tipos de sesgos, éstos se agrupan generalmente en tres categorías principales: selección, información y distorsión. 2.1 Sesgo de selección: Se produce cuando existe una diferencia sistemática entre las características de la población seleccionada para un estudio y las características de la población no seleccionada. Un sesgo de selección evidente es el que se produce cuando los participantes se seleccionan a sí mismos para el estudio, debido a que no se encuentran bien, o porque están especialmente preocupados por la exposición, lo que puede incrementar o disminuir la asociación. En los estudios de casos y controles los participantes (casos y controles) están seleccionados para el estudio por similitud en exposiciones previas. Los sesgos en este tipo de estudio pueden ser de diagnóstico, vigilancia y de referencia. En un estudio de cohorte, se elige a los sujetos de estudio sobre la base de su situación de exposición. La meta es formar dos grupos de personas que tengan riesgos similares ante el resultado de salud de interés, salvo en lo referente a la exposición particular que se estudia. El sesgo de selección se presenta con frecuencia en los estudios de cohorte, cuando las personas se pierden durante el seguimiento o representan grupos altamente autoseleccionados. Tipos de sesgos de selección: Sesgo de vigilancia: Cuando solamente se seleccionan los casos entre grupos con vigilancia médica más estricta en enfermedades asintomáticas, benignas o difíciles de detectar con un examen rutinario. También puede ocurrir cuando los casos y los controles se obtienen a partir de sistemas de vigilancia diferentes. Sesgo de diagnóstico: Cuando se conoce el estado de exposición de un individuo, esto puede influir en la solicitud de exámenes de laboratorio y/o en la interpretación de los resultados. Sesgo de admisión al hospital (referencia): Ocurre cuando hay tasas de hospitalización diferentes entre casos y controles; además, factores tales como la severidad de la enfermedad o la clase social de los pacientes pueden afectar. Sesgo de no respuesta: Cuando los casos que rechazan la entrevista tienen una exposición diferente a los controles que rechazan la entrevista, puede ocurrir un sesgo en la estimación del efecto. Sesgo de supervivencia: Cuando los casos que mueren son excluidos del estudio. Prevención del sesgo de selección: - Se puede prevenir en el momento de diseñar el estudio, pero en la etapa del análisis no es posible corregirlo. - De ser posible, estudiar al total de la población expuesta. - Si se limita a utilizar una muestra, se debe seleccionar aleatoriamente de un censo completo o del total de la población en estudio. - Obtener la tasa de participación más alta posible. - Tratar de encontrar la diferencia entre los participantes y no participantes. ¿Tendrán los no participantes exposición más alta o menor? ¿Tendrán menor o mayor susceptibilidad a desarrollar la enfermedad o quizás debido a condiciones preexistentes, sexo, edad, etc.? Criterios para su prevención en estudios de casos y controles: - Seleccionar los casos y controles sin considerar su exposición a los factores de riesgo. - Utilizar una definición de caso que esté basada en un criterio diagnóstico objetivo y no cambiarla durante el estudio. - Lo ideal es tomar los casos de un área geográfica definida y seleccionar los controles aleatoriamente en la misma área. - Recordar que cuando se realiza un estudio de casos y controles en un hospital, los pacientes no representan a la población en general. - Los registros hospitalarios no son completos. - No todos los pacientes con una enfermedad determinada son hospitalizados. - Algunos pacientes mueren antes de llegar al hospital En estudios retrospectivos: Seleccionar el grupo de expuestos y no expuestos sin considerar su estado de enfermedad. 2.2 Sesgo de información: También llamado sesgo de observación, clasificación o medición. Es un error sistemático que ocurre durante la recolección de datos de la exposición o de la enfermedad, produciendo una estimación errónea del efecto de una exposición sobre el riesgo de una enfermedad. Ocurre después que los sujetos han sido incluidos en el estudio. - En estudios de casos y controles, y cohortes retrospectivas: ocurre cuando el estado de la exposición es recordado de diferente manera por los dos grupos. - En estudios de cohortes (prospectivos y retrospectivos): puede ocurrir cuando la información sobre la incidencia de enfermedad es obtenida de diferente manera (cuestionarios) para los casos y para los controles. Tipos de sesgos de información: Sesgo no diferencial: Este sesgo no incrementa falsamente ni una asociación positiva ni una asociación negativa; sin embargo, reduce la magnitud de la verdadera asociación y, por lo tanto, aumenta las posibilidades de que no se encuentre asociación alguna. Por ejemplo cuando se utiliza un cuestionario que no indaga toda la información requerida. Sesgo diferencial: Su magnitud hace variar el estado de exposición o enfermedad, cuando se utilizan fuentes de información para los casos diferentes a la de los controles. Por ejemplo, si la información de los casos se extrajo de registros médicos y la información sobre los controles se obtuvo de entrevistas personales. Sesgo de memoria: Ocurre cuando los enfermos y los sanos recuerdan de diferente manera sus exposiciones. Prevención: - Se debe escoger un grupo control con una enfermedad algo parecida a la de los casos. - Ayudar a recordar utilizando para ello calendarios o recuerdos de eventos especiales. Sesgo del entrevistador: Ocurre cuando el entrevistador aplica la entrevista de diferente manera en los casos y en los controles u obtiene mayor información en un caso que en otro. Prevención: -Que los entrevistadores desconozcan la clasificación del sujeto como caso o control (estudio ciego). En la práctica esto es difícil. -Utilizar un cuestionario estandarizado para casos y controles que no tenga preguntas abiertas. Sesgo de calidad de los datos: Se presenta cuando la información de los archivos médicos es diferente entre los pacientes. Sesgo de omisión (premeditado): Ocurre cuando el sujeto "olvida" o miente al proporcionar información sobre su exposición. Prevención: -Para preguntas especiales, hacerlas de la manera más natural evitando emitir juicios (es difícil). La prevención de sesgos de información debe realizarse durante la etapa del diseño, es muy difícil intervenir durante el análisis. En general se debe verificar la exposición utilizando otras fuentes de datos como los archivos médicos o registros ambientales. 2.3 Sesgo de distorsión (Confusión): Acción de una o más variables extrañas que parcial o totalmente enmascaran o deforman la asociación entre la exposición y la enfermedad, debido a una interrelación entre la exposición, la enfermedad y un tercer factor que es el confusor. Un factor de confusión debe cumplir con ciertas condiciones: -Estar asociado con la exposición pero no ser una consecuencia de la exposición. -Ser un factor de riesgo para la enfermedad (estar asociado con la enfermedad en los expuestos y no expuestos). -No debe ser un paso intermedio en la secuencia causal entre la exposición y la enfermedad. Control del fenómeno de confusión: Hay varios métodos para controlar el fenómeno de confusión, ya sea mediante el diseño del estudio o durante el análisis de los resultados. Los métodos habitualmente utilizados para controlar la confusión mediante el diseño de un estudio epidemiológico son: -asignación aleatoria o aleatorización. -restricción. -apareamiento. En el análisis, el fenómeno de confusión puede controlarse mediante: -estratificación. -aplicación de un modelo estadístico (modelos multivariados). Pasos para controlar el factor de confusión: -Hacer un análisis crudo: Riesgo relativo (RR) o razón de productos cruzados (RPC) crudos. -Hacer el análisis estratificado del factor de confusión potencial. -Comparar las medidas crudas (RR o RPC) por cada estrato. -Evaluar y controlar la confusión: -Con la medida ajustada de Mantel y Haenzel (RR o RPC), que resume las medidas para cada estrato. Se encuentra en el paquete de EPI-INFO. -Cuándo existe más de un factor de confusión debe realizarse un análisis multivariado. 3. Criterios de causalidad El conocimiento de la causa de la enfermedad es importante en las ciencias de la salud, no sólo para el diagnóstico y aplicación correcta de la terapia medicamentosa, sino para evaluar el factor, condición, característica o combinación de ellos, capaces de jugar un papel significativo en la etiología de la enfermedad. Lógicamente la causa precede la enfermedad y debe ser suficiente para producirla o iniciarla; de tal manera que la enfermedad no se desarrolla en su ausencia. La inferencia causal determina las asociaciones causales, es decir, la relación causa-efecto; para ello utiliza una serie de criterios, que miden la asociación entre un factor de perturbación potencial y los efectos a la salud. La causalidad es una fuente de error; sin embargo, ésta se distingue del sesgo porque la causalidad representa un error aleatorio. La principal forma de reducir el error ocasionado por la causalidad es incrementar el tamaño de la muestra del estudio. Sin embargo, este incremento sólo permite reducir el error aleatorio en la medida que se obtenga más información exacta. En forma específica, se debe considerar la distribución de la exposición, la situación de enfermedad o salud y otros factores de riesgo; cuanto más información se tenga, menor será la influencia del error aleatorio. El valor de P es la probabilidad de que la causalidad, por sí sola, sea la causa de las diferencias observadas entre los grupos de comparación. Criterios de causalidad: Bradford Hill sugirió en 1965 que se consideraran los siguientes aspectos al tratar de distinguir las asociaciones causales de aquéllas no causales: Fuerza de asociación: Cuando una asociación entre una posible causa y un efecto es intensa, según la magnitud de la razón de riesgos, es más plausible que sea causal que cuando la asociación es débil, en cuyo caso puede haber sufrido el efecto de factores de confusión o sesgos. Los riesgos relativos que pasan de un valor de dos pueden considerarse fuertes. La fuerza de una asociación no corresponde a una característica biológicamente consistente, sino más bien a una característica que depende de la prevalencia relativa de otras causas. Consistencia: Se demuestra en la observación repetida de una asociación en poblaciones diferentes bajo circunstancias distintas. Sin embargo, la falta de consistencia no excluye una asociación causal, ya que distintos niveles de exposición y otras condiciones pueden disminuir el impacto del factor causal en determinados estudios. Además, cuando se interpretan los resultados de varios estudios, debe darse mayor peso a los mejor diseñados. Especificidad: El criterio de especificidad requiere que una causa conduzca a un efecto particular y no a efectos múltiples. Si se encuentra que el factor en estudio se asocia sólo con una enfermedad, o si se encuentra que la enfermedad está asociada sólo con un factor (después de probar muchas asociaciones posibles), se sugiere una interpretación causal. Sin embargo, no se puede utilizar este criterio para rechazar una hipótesis causal, ya que muchos factores tienen efectos múltiples y todas las enfermedades, o la mayoría, tienen causas múltiples. Temporalidad: La relación temporal es esencial: la causa debe preceder al efecto. ¿La exposición ocurre antes de la enfermedad? ¿Transcurre suficiente tiempo entre la exposición y la aparición de la enfermedad? Si la enfermedad es debida a exposición durante el embarazo ¿ocurrió ésta cuando el feto es más o menos susceptible a mutagénesis o teratogénesis?. Gradiente biológico (relación dosis-respuesta): La observación de que la frecuencia de la enfermedad aumenta con la dosis o el nivel de exposición, habitualmente apoya una interpretación causal. Pero en ausencia de tal efecto, el investigador tal vez no pueda excluir ciertas explicaciones alternativas, tales como un efecto umbral o un efecto de saturación. Además, un efecto observado de dosis-respuesta puede deberse completamente a una distorsión graduada o a un sesgo. Plausibilidad: Si el efecto bajo estudio tiene sentido en el contexto del conocimiento biológico actual, estaremos en mayor posibilidad de aceptar una interpretación causal. Sin embargo, la plausibilidad biológica no puede extraerse de una hipótesis, ya que el estado actual del conocimiento puede ser inadecuado para explicar nuestras observaciones. En general, mientras menos sepamos sobre la etiología de la enfermedad y de enfermedades similares, menos seguros estaremos al rechazar una interpretación causal en base a este criterio. Coherencia: Si los hallazgos no se encuentran en conflicto grave con nuestro entendimiento de la historia natural de la enfermedad o con muchos otros hechos aceptados sobre la ocurrencia de la enfermedad (por ejemplo tendencias seculares), se refuerza una interpretación causal. En esencia, este criterio combina aspectos de consistencia y plausibilidad biológica. Evidencia experimental: Rara vez se encuentra disponible esta evidencia para poblaciones humanas. Clínicamente, es un criterio deseable de alta validez. Analogía: El discernimiento proveniente de la analogía parece estar obstaculizado por la imaginación inventiva de los científicos, quienes pueden encontrar analogías en todas partes. Sin embargo, las analogías simples que ofrece Hill (si un fármaco produce defectos de nacimiento, tal vez otro algo similar los cause también) bien podrían aumentar la credibilidad de que una asociación sea causal. TOMA DE DECISIONES SEGÚN LOS RESULTADOS DE LA INVESTIGACIÓN 1. Hay que plantear la posibilidad de realizar estudios adicionales. Al desarrollar un estudio epidemiológico analítico y al evaluar sus resultados, los trabajadores en salud pública deben reconocer que las respuestas a preguntas sobre etiología pueden no haberse alcanzado en un solo esfuerzo epidemiológico. Comúnmente, y especialmente en situaciones en que la etiología de la enfermedad ha permanecido en la obscuridad por mucho tiempo, se necesitarán múltiples estudios para establecer la etiología. 2. Implementar y evaluar las medidas de control y prevención. El objetivo de las investigaciones epidemiológicas es el de proporcionar un conocimiento sobre las relaciones de causa-efecto y de dosis-respuesta, que puedan usarse en intervenciones en salud pública diseñadas para prevenir, controlar o eliminar un problema de salud. Tales acciones, interrumpiendo la cadena causal que produce la enfermedad, pueden por sí mismas dar una evidencia epidemiológica ulterior respecto a la etiología de la enfermedad. Si la acción en salud pública, recomendada por observaciones epidemiológicas descriptivas o analíticas, en verdad elimina o controla substancialmente el problema de una enfermedad, la relación sospechada de causa-efecto gana un fuerte apoyo. 3. Establecer la vigilancia epidemiológica de la enfermedad. Una vez que se ha llegado a la conclusión de que están ocurriendo casos de una enfermedad más frecuentemente de lo esperado, el próximo paso epidemiológico es establecer un sistema de información de casos por medio del cual se pueda evaluar el patrón de la enfermedad sobre una base continua. Dependiendo del tipo de evento que se trate, la vigilancia epidemiológica será temporal o permanente. Por ejemplo, si se presenta una explosión o derrame de un compuesto químico en una fábrica, la vigilancia epidemiológica será temporal; mientras que en los casos de intoxicación por plaguicidas en trabajadores agrícolas es más importante establecer una vigilancia permanente de los casos. Descripción del sistema de vigilancia epidemiológica: Es un sistema continuo de recolección, análisis e interpretación de los datos de salud que son esenciales para la planeación, realización y evaluación de la práctica de salud pública, integrando la diseminación oportuna de los datos y su aplicación a la prevención y control de los problemas de salud pública. La vigilancia epidemiológica es el estudio permanente del proceso salud-enfermedad en la comunidad, a través del sistema nacional de salud, para conocer la situación de salud, con el objeto de detectar o prever cambios para recomendar y aplicar en su caso, medidas de intervención. Objetivos de la vigilancia epidemiológica: - Detectar cambios en la tendencia de los eventos de salud. - Detección de epidemias, brotes y problemas emergentes. - Estimar los problemas de salud. - Identificar la evolución de los factores de riesgo para una enfermedad determinada. - Planeación y evaluación de los programas. Características del sistema: - Simple: ¿Es sencillo usar el sistema? - Flexible: ¿Puede adaptarse a cambios en las necesidades sin mucho incremento en recursos? - Aceptable: ¿El personal de salud participa en el sistema? - Sensible: ¿Qué porcentaje de los casos en la población detecta el sistema? - Especificidad: ¿Qué porcentaje de los "no casos" en la población están incluidos en el sistema? - Valor predictivo positivo: ¿De los casos detectados, cuántos de ellos son casos verdaderos? 4. - Representativo: ¿Son los casos detectados representativos de todos los casos en la población? - Oportuno: ¿Qué tanto es el retraso entre las etapas del sistema? - Análisis costo beneficio positivo. Diseminación de los hallazgos. El problema, sus posibles causas y los resultados de estudios epidemiológicos, deben ser cuidadosa y plenamente explicados; esto es particularmente importante cuando una investigación no puede confirmar un factor peligroso sospechoso, ya que las conclusiones negativas habitualmente son más difíciles de comunicar convincentemente que los hallazgos positivos (incluso los hallazgos falsos-positivos). En este proceso de acción en salud pública a través de la comunicación pública, son esenciales los análisis consistentes, claros y francos del problema bajo estudio y de los resultados de los estudios epidemiológicos. El epidemiólogo ambiental debe ser capaz de: - Orientar a la comunidad en materia de salud ambiental - Comunicar a la comunidad los elementos relacionados con el riesgo. - Motivar a la población a tomar medidas preventivas y de control. - Educar a la población sobre el manejo de contingencias en salud ambiental. La comunidad tiende a desconfiar y rechazar la epidemiología ambiental debido a que su enfoque de riesgos se basa en criterios estadísticos que ignoran muchos factores que son importantes según la percepción del riesgo por parte de la población, como por ejemplo: - Los riesgos involuntarios son más objetables que los riesgos voluntarios. - Los riesgos conocidos o habituales son más aceptables que nuevos riesgos exóticos. - Algunas enfermedades son más temidas (por ejemplo cáncer) que otras (diarrea). - Algunos malos eventos que suceden en un tiempo y lugar determinado son vistos peor por la comunidad, aún a pesar de que sean raros. Esta es una razón del porqué los accidentes aéreos causan más impacto en el público, que los accidentes automovilísticos, aún a pesar de las estadísticas de estos. - Contar con nuestra propia protección es menos cuestionada que contar con protección de otras personas (especialmente si ésta proviene de alguna institución gubernamental). - Vivir con un riesgo ambiental es injusto si otras personas se benefician de esto, pero no comparten el riesgo (por ejemplo los basureros). - Generalmente los estudios existentes no consideran factores socioeconómicos y culturales de las comunidades que influyen en la ocurrencia de casos, lo cual determina errores y sesgos.
© Copyright 2026