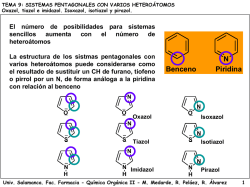
Tema 7.- Heterociclos pentagonales con un sólo - OCW Usal
TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Furanos, tiofenos y pirroles Existe un gran número de compuestos pentagonales insaturados con un solo heteroátomo, pero los más frecuentes y de mayor interés son furano, tiofeno y pirrol 4 5 4 3 O1 2 5 3 S 1 4 2 5 3 N 1 H 2 X X X X X Tienen carácter aromático, lo que afecta a sus propiedades, no reaccionan de igual manera que otros compuestos con heteroátomos unidos a doble enlace, por ejemplo las enaminas o los derivados enólicos TIOFENO > PIRROL > FURANO Debido a esta diferencia en el carácter aromático, el furano es el que más se comporta como si fuera un heteroátomo unido a un sistema de dobles enlaces. Esta diferencia se debe a que el átomo de oxígeno del furano atrae los electrones más fuertemente que el N ó el S de pirrol y tiofeno Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 1 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Furanos, tiofenos y pirroles Un ejemplo de como influye la aromaticidad en las propiedades es la basicidad, en el caso de pirrol La mayor basicidad viene dada por el menor carácter ácido del correspondiente ácido conjugado H N N H pKa = -0.27 N pKa < 0 muy ácido predomina poco básico pKa >> 0 poco ácido reacciona muy básico se protona en el anillo N + pKa = 5.2 ( valores grandes de pKa) H NH2 pKa = 5.2 Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 2 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Furanos, tiofenos y pirroles En otro aspecto en el que influye la aromaticidad es en la tautomería, ya que en el pirrol predomina la estructura tautómera aromática En los hidroxiderivados si hay equilibrio entre los tautómeros (aromático y forma cetónica) H N H N H X OH H O N H N H predomina O O H H O X H H H H O N No aromáticos N H O N H H H O S OH S H H O H S O equilibrio predomina O O OH predominan N H H H O X H H H H equilibrio S S Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 3 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Furanos, tiofenos y pirroles Propiedades físicas: No solubles en agua Son compuestos polares debido a la distribución electrónica en el anillo por efecto del heteroátomo RMN-1H 6.22 N 6.68 6.24 O 7.29 6.99 S 7.18 H J 2,3 = J 2,4 = J 2,5 = J 3,4 = 2.70 1.44 1.87 3.35 J 2,3 = J 2,4 = J 2,5 = J 3,4 = 1.75 0.85 1.40 3.30 J 2,3 = J 2,4 = J 2,5 = J 3,4 = 4.90 1.04 2.84 3.50 Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 4 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Derivados naturales de interés Furano, tiofeno y pirrol. Los tres sistemas se encuentran en diversos productos naturales como anillos simples HOOC COOH NH2 O N H porfobilinógeno (precursor de porfirinas) N N H H N CHO S Polienino Furfural (degradación azúcares) N N N N Fe N N Mg N N N Porfirina ROOC MeOOC HOOC HOOC También forman parte de muchos compuestos bioactivos y de fármacos O HEMINA CLOROFILA HN N O S N H NO2 Ranitidina Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 5 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Síntesis más representativas Existen síntesis generales y síntesis más representativas de alguno de ellos en particular, especialmente síntesis específicas de pirroles Pueden hacerse análisis retrosintéticos de diversas formas, que pueden dar idea de como abordar la síntesis en cada caso particular X X X X R2 R1 R3 R2 4 R1 R4 HX OH R2 R3 R1 R4 HX O R2 R1 R3 4 X = O, S, NH R OO XH2 Es un método muy adecuado. Depende de la disponibilidad del compuesto 1,4-dicarbonílico X R R3 Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 6 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Síntesis más representativas # PAAL-KNORR. Pirroles NH3 N H O O - H2O - H2O HO NH O 2 NH O N H NH2 O OH Para furanos y tiofenos P2S5 O Ph Ph O O S O H3PO4 Ph O Ph H2S Ph O O HCl Ph S Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 7 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Síntesis más representativas El mecanismo puede variar dependiendo del reactivo H2S Ph HCl O O Ph S - H2O - H2O Ph Ph O HS OH Ph O Ph O Ph S Ph HO O HS S P2S5 Ph O S Ph S P S S O P O P O - SH2 Ph Ph S S Ph Ph S HS Ph HS S Ph Ph S Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez Ph 8 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Síntesis más representativas # KNORR. Pirroles R2 O 1 R R2 1 R O R3 R2 N 4 1 R R H+ O N H R 4 R R2 R1 R1 4 O H2N R3 R2 3 R OH R3 4 R N R2 R1 R3 N H R4 R3 N R2 R4 R1 R3 R4 N H Favorecida por R2 = COOEt y otros atractores de electrones que favorecen Las aminocetonas suelen prepararse "in situ" O EtOOC EtOOC O N OEt O H H EtOOC N O H+ O EtOOC NOH O R2 O R3 R1 N H R4 HOAc Zn EtOOC Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez NH2 O 9 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Síntesis más representativas # HANTZSCH (pirroles) y FEIST-BENARY (furanos) EtOOC Cl O EtOOC NH2 O R NH R EtOOC O EtOOC Cl O N R EtOOC Cl COOR O R COOR Base R Ts COOR R O OH O # Otras de Pirroles. A través de isonitrilos EtOOC Cl N C COOR R N H COOR R COOR R COOR R Ts N C Ts N C Ts N Ts N N Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 10 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Propiedades generales y reactividad Son aromáticos con una estabilización que sigue el orden benceno > tiofeno >pirrol > furano lo que marca la reactividad de estos compuestos. Además se trata de compuestos “p"-excedentes, por lo que el anillo es especialmente rico en electrones X -- Rico en electrones -- Aromático -- Nucleófilo frente a electrófilos X -- Dieno con heteroátomo -- Como nucleófilo frente a electrófilos -- Como dieno rico en electrones frente a dienófilos atractores de electrones Sustitución Electrofílica Aromática SEA PIRROL y TIOFENO Adición electrofílica AE Diels-Alder DA FURANO Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 11 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica SEA. Reacción característica debido a su carácter aromático. Comparable al benceno, pero más reactivos E E+ E+ X X E El orden de reactividad en la SEA es el siguiente: pirrol > furano > tiofeno > benceno Br2 MeOOC X MeOOC X Br X = NH ; Vr = 5.6 x 108 X = O ; Vr = 1.2 x 102 X = S ; Vr = 1 Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 12 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica # Orientación. La SEA se produce fundamentalmente en la posición 2. La estabilidad de los intermedios (que refleja la de los estados de transicióna través de los que se produce) da una idea de por qué se produce dicha orientación E+ X X X E H E+ X E H X E H X E H X E H X E E X Puede variar dependiendo de las condiciones, reactivo, sustrato, etc.... Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 13 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica # Reacciones Furano se descompone en ácidos HNO3 / Ac2O 20ºC N H NO2 N H SO2Cl2 N H Cl N H Br N H N H CH2O Me2NH / H+ N H CHO N SO3-pir. SO3H El furano no da la reacción Ph N2+ Cl- N H O El furano no da la reacción N H NBS O N H POCl3 Me C N Me BF4- N H N N Ph Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 14 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica VILSMEIER-HAACK O N H Cl N H X Cl Cl P O N Cl H N X H Cl O O P Cl Cl H Cl- Cl N H H N X H N X O X H Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez H 15 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica # Nitración. Furano y pirrol se pueden descomponer en medio ácido, por lo que la nitración se pueden llevar a cabo en otras condiciones para evitarlo O NO2Ac N H N H NO2 O2N H O N H N AcO- NO2 Este mecanismo es por el que transcurre la reacción con tiofeno y pirrol El furano es el menos aromático y da la sustitución a través de un mecanismo de adición electrofílica - eliminación O O H NO2 AcO- H AcO O Base H (piridina) NO2 O NO2 Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 16 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica # Reacción de MANNICH Se produce con el pirrol según el siguiente mecanismo H N H O H N AcO H - H2O H H N H H HOAc N H N H N N H N # Apertura del furano en medio ácido H+ O H H H O H O H2O / H+ H2O O OH OO Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 17 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica # Efecto de los sustituyentes Igual que en la sustitución electrofílica en el benceno, l os sustituyentes ejercen un efecto orientador y activante-desactivante Los sustituyentes dadores de electrones en 2 orientan a 5 ( y 3) mientras que los atractores en 2 lo hacen a 4 y 5 E E+ X G E X G X G E E+ X W X W E X W G = grupo dador de electrones W = grupo atractor de electrones Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 18 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica Pueden observarse variaciones, pero son las líneas generales. Los sustituyentes en el N del pirrol pueden orientar a 3. Cuando las posiciones 2 y 5 están ocupadas, puede producirse la sustitución en 3 Cuando hay sustituyentes en 3 predomina la orientación a 5 (posiciones más reactivas al lado del heteroátomo) O O2N Ac2O O2N BF3·Et2O N NO2 N NO2 N N H H H H O CH2O HCl Cl S COOMe S COOMe NO2+ S CHO AcONO2 O2N O CHO O NO2 O 2N + S S Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 19 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Carácter ácido. Derivados organometálicos El pirrol tiene un NH con un cierto carácter ácido pKa = 17.5 (más débil que el agua) pero puede desprotonarse con bases fuertes CH3I NaNH2 N H N Na más iónico más reactivo en el N N CH3 EtMgBr H HCOOEt N MgBr H N O N H CHO más covalente más reactivo en el C Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 20 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Sustitución Electrofílica Con bases más fuertes se puede desprotonar en el anillo en posición 2 efecto estabilizante del heteroátomo X C3H7CHO BuLi N N Li N OH O 1) BuLi C6H13 2) C6H13Br BuLi S O 1) BuLi C H 6 13 2) C6H13Br O C6H13 COOMe Br ClCOOMe S Li S MgBr Mg O También se puede metalar en otras posiciones si existe un halógeno O Br Li BuLi S S Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 21 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Otras reacciones # Cicloadiciones Se pueden comportar como dienos, especialmente el furano por ser el menos aromático de los tres COOEt NH COOEt NH COOEt COOEt COOEt O COOEt COOEt O O O O COOEt COOEt O COOEt O X O O O más rápido O O O O O más estable O O O O "endo" O O O "exo" Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 22 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Otras reacciones # Sustitución nucleofílica aromática Como en el benceno, la presencia de grupos atractores favorece la sustitución nucleofílica aromática de halógenos y grupos salientes O2N O2N O2N S S S Br Et2NH CHO Br NEt2 O2N N3Na S O2N N3 Br NEt2 NEt2 S S O CHO N O S Br NEt2 Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 23 TEMA 7: HETEROCICLOS PENTAGONALES CON 1 SOLO HETEROÁTOMO Problemas 1.-Explicar la siguiente síntesis del sistema de porfirina N H H+ N H 2.-Predecir el producto de la siguiente reacción HN NH O H N AcONO2 S O O 3.-Explicar los pasos de la síntesis de cis-jasmona que se presentan a continuación CHO H2SO4 Ph3P CHEt + Et H HOAc O BuLi Et O Et O Br COOEt 4.-Explicar la siguiente síntesisO COOEt HOAc / NO2Na (NO+) EtOOC N H Univ. Salamanca. Fac. Farmacia - Química Orgánica II - M. Medarde, R. Peláez, R. Álvarez 24
© Copyright 2026