Nota : * El número de identificacion primario se puede consultar en
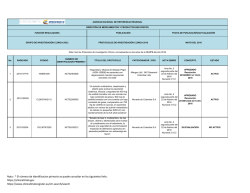
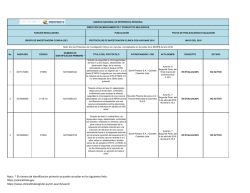
AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 1 2 3 RADICADO 2015147716 2015152005 2015152004 CODIGO 150998-005 CLDK378A2112 CICL670F2202 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO NCT02462928 “Seguridad y eficacia de Abicipar Pegol (AGN-150998) en pacientes con degeneración macular neovascular asociada a la edad” NCT02299505 “Un estudio multicéntrico, aleatorizado y abierto para evaluar la exposición sistémica, eficacia y seguridad de 450 mg de ceritinib tomados con una comida con bajo contenido de grasa y 600 mg de ceritinib tomados con una comida con bajo contenido de grasa, comparados con 750 mg de ceritinib en ayunas, en pacientes adultos con cáncer de pulmón metastásico de células no pequeñas (NSCLC) con reordenamiento de la ALK (ALK positivo)”. NCT02435212 “Estudio de fase II, multicéntrico, de dos brazos, abierto y aleatorizado para evaluar el cumplimiento con el tratamiento, la eficacia y la seguridad de una formulación mejorada de deferasirox (gránulos) en pacientes pediátricos con sobrecarga de hierro”. Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Allergan Ltd / INC Research Colombia Ltda Acta No. 2 segunda parte del 22 de febrero del 2016 Numeral 3.15.1 APROBADO Resolución 2016009051 el 15-032016 ACTIVO Novartis de Colombia S.A Acta No. 2 APROBADO segunda parte del Resolución 22 de febrero del 2016012432 del 14-042016 2016 Numeral 3.15.2 ACTIVO Novartis de Colombia S.A Acta No. 2 APROBADO segunda parte del Resolución 22 de febrero del 2016018150 del 19-052016 2016 Numeral 3.15.3 ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 4 5 6 RADICADO 2015078075 2014120791 2015168878 CODIGO GO29058 CLCZ2696D2301 CAIN457A2310 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO NCT02340221 “Estudio fase III, doble ciego, placebo controlado, aleatorizado con taselisib más fulvestrant versus placebo más fulvestrant en mujeres posmenopáusicas con cáncer de mama HER2 negativo metastásico o localmente avanzado y con receptor de estrógeno positivo que presentan recurrencia o progresión de la enfermedad durante o después de la terapia con inhibidores de la aromatasa” NCT01920711 "Un estudio multicentrico, aleatorizado, doble ciego, de grupos paralelos, con control activo para evaluar la eficacia y seguridad de LCZ696 en comparación con valsatrán sobre la morbilidad y mortalidad en pacientes con falla cardiaca (clase II-IV) de la NYHA) con fraccion de eyección preservada" NCT02471144 “un estudio clínico aleatorizado, doble ciego, con control activo y placebo en múltiples centros para demostrar la a eficacia de secukinumab subcutáneo en comparación con placebo y etanercept (en un brazo de ciego simple) después de doce semanas de tratamiento, y para evaluar la seguridad, tolerabilidad y eficacia a largo plazo en sujetos de 6 a menos de 18 años de edad con psoriasis en placa crónica grave” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Acta No. 2 APROBADO segunda parte del Resolución 22 de febrero del 2016015583 del 03-052016 numeral 2016 3.15.4 ACTIVO Novartis de Colombia S.A. Acta No. 2 segunda parte del 22 de febrero del 2016 Numeral 3.15.11 ACTIVO Novartis de Colombia S.A Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016015588 del 03-052016 Numeral 2016 3.15.1 Productos Roche S.A APROBADO Resolución 2016009035 el 15-032016 ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 7 8 9 10 RADICADO 2015171511 / 16005016 2015159798 2015173238 2015172000 CODIGO SGSC-002 WA29748 GS-US-296-1080 17712 NUMERO DE IDENTIFICACION PRIMARIO * NCT02672540 NCT02550652 NCT02545504 NCT02200614 TITULO DEL PROTOCOLO “Estudio aleatorizado, ciego simple, multicéntrico, de fase II sobre la seguridad y efectividad de SANGUINATE™ en comparación con una solución salina normal en pacientes adultos con enfermedad de células falciformes con crisis vaso-oclusivas (VOC)” “Estudio aleatorizado, controlado con placebo, doble ciego, multicéntrico para evaluar la seguridad y la eficacia de Obinutuzumab en pacientes con Nefritis Lúpica de clase III o IV según ISN/RPS 2003” “GS-5745 combinado con mFOLFOX6 como tratamiento de primera línea para adenocarcinoma avanzado gástrico o de la unión gastroesofágica” “Estudio multinacional de fase III, aleatorizado, doble ciego, controlado con placebo para evaluar la eficacia y la seguridad de ODM-201 en varones con cáncer de próstata no metastásico de alto riesgo resistente a la castración” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Prolong Pharmaceuticals LLC / Quintiles Colombia Ltda Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.2 EN EVALUACION NO ACTIVO Productos Roche S.A. Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016015586 del 03-052016 Numeral 2016 3.15.3 ACTIVO Gilead Sciences, Inc. / ICON Clinical Research Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016021880 del 14-062016 Numeral 2016 3.15.4 ACTIVO Acta No. 6 Bayer S.A. / ICON Holdings Segunda Parte, del Clinical Research International 18 de marzo del Limited Sucursal Colombia 2016 Numeral 3.15.6 EN EVALUACION NO ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 11 12 13 14 RADICADO 2015165972 16004562/ 2015136513 2015155199 2015155029 CODIGO LFB-FVIIa-007-14 M13-813 MK-3475-170 A4091058 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO NCT02448680 “Estudio de fase III sobre la seguridad, farmacocinética y eficiencia del factor de coagulación VIIa (recombinante) en pacientes con hemofilia A o B congénita desde ≥6 meses de edad hasta <12 años con inhibidores del factor VII o IX: PerSept 2” LFB USA Inc. / PSI CRO Colombia S.A.S. Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.7 EN EVALUACION NO ACTIVO NCT02573324 “Estudio aleatorizado, controlado con placebo, en fase 2b/3 de ABT-414 con quimiorradiación concurrente y temozolomida auxiliar en sujetos con diagnóstico reciente de glioblastoma (GBM) con amplificación del receptor del factor de crecimiento epidérmico (RFCE) (Intellance 1)” NCT02576990 "Estudio de fase II de Pembrolizumab (MK3475) en sujetos con linfoma de células B grandes mediastínico primario refractario o recidivante (rrPMBCL)" NCT02528188 “Estudios de Fase 3, Aleatorizado, Doble Ciego, con Control Activo, Multicéntrico de la Seguridad y Eficacia a Largo Plazo de la Administración Subcutánea de Tanezumab en Sujetos con Osteoartritis de Cadera o Rodilla” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search Abbvie SAS Merck Sharp and Dohme Colombia S.A.S Pfizer Inc. / Inventiv Health Clinical Colombia S.A.S. Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016021865 del 14-062016 Numeral 2016 3.15.8 ACTIVO Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.9 EN EVALUACION NO ACTIVO Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.10 EN EVALUACION NO ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 15 16 17 RADICADO 2015155036 2016006297 2016006296 / 2016020777 CODIGO B1801381 03-CL-1202 ML-3341-306 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO NCT02509026 “Estudio abierto, multicéntrico de interrupción y reinicio del tratamiento con etanercept en pacientes con espondiloartritis axial no radiográfica con una respuesta adecuada en la semana 24” Pfizer Inc. / Inventiv Health Clinical Colombia S.A.S. Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016015585 del 03-052016 Numeral 2016 3.15.11 ACTIVO NCT02636868 “Estudio Multinacional, Multicéntrico, Enmascarado, Aleatorizado, Controlado para Evaluar la Seguridad y la Eficacia de Lucinactant Inhalado en Recién Nacidos Prematuros de 26 a 32 Semanas de Edad Gestacional con Síndrome de dificultad Respiratoria” Discovery Laboratorios, Inc. / Colombia S.A.S. APROBADO Acta No. 7 Resolución Segunda Parte, del 4 de abril del 2016 2016015622 del 03-05Numeral 3.15.1 2016 ACTIVO NCT02679573 “Estudio de fase 3, multicéntrico, aleatorizado, doble ciego y controlado con APROBADO Acta No. 7 comparador para evaluar la seguridad y la Resolución Melinta Therapeutics, Inc / PSI- Segunda Parte, del eficacia de la delafloxacina intravenosa con CRO Colombia S.A.S 4 de abril del 2016 2016021881 del 14-06pasaje a vía oral en sujetos adultos con Numeral 3.15.3 2016 neumonía bacteriana adquirida en la comunidad” ACTIVO Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search ACTA SEMPB CONCEPTO ESTADO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 18 19 20 20 RADICADO 2016006329 2016019505 2016021009 2016020760 CODIGO MK3475-181 CRFB002H2301 CA209-274 EMR 100070-005 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO NCT02564263 “Estudio de fase III, randomizado y abierto, de pembrolizumab en monoterapia comparado con docetaxel, paclitaxel, o irinotecan como agente único, a elección del médico, en participantes con adenocarcinoma y carcinoma de células escamosas de esófago, avanzado o metastásico, en progresión luego de un tratamiento estándar de primera línea (KEYNOTE-181)” Merck Sharp & Dohme Colombia S.A.S. Acta No. 7 Segunda Parte, del 4 de abril del 2016 Numeral 3.15.4 EN EVALUACION NO ACTIVO NCT02375971 “Estudio RAINBOW: estudio aleatorizado, controlado para evaluar la eficacia y seguridad de ranibizumab en comparación con terapia con láser para tratar niños nacidos prematuramente con retinopatía de la prematuridad" Novartis de Colombia S.A Acta 9 Segunda Parte del 23 de mayo de 2016 Numeral 3.15.1 EN EVALUACION NO ACTIVO Bristol Myers Squibb de Colombia S.A Acta 9 Segunda Parte del 23 de mayo de 2016 Numeral 3.15.2 EN EVALUACION NO ACTIVO Merck KGaA Acta 9 Segunda Parte del 23 de mayo de 2016 Numeral 3.15.3 EN EVALUACION NO ACTIVO NCT02632409 NCT02576574 “Estudio de Fase 3, randomizado, a doble ciego, multicéntrico, de nivolumab adyuvante versus placebo en pacientes con carcinoma urotelial invasivo de alto riesgo. (CheckMate 274: CHECKpoint pathway and nivoluMAb clinical Trial Evaluation 274)" “Ensayo de fase III, abierto, multicéntrico de avelumab (MSB0010718C) frente al doblete basado en platino como tratamiento de primera línea del cáncer de pulmón de células no pequeñas PD-L1+ en estadio IV o recurrente” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 21 22 23 RADICADO 2016020480/1602 9464 2016020972 2016034153 CODIGO BAY 94-8862 / 16275 MK 0887A-087 ICL-23-ABSSSI1 NUMERO DE IDENTIFICACION PRIMARIO * EudraCT: 2015-002168-17 NCT02741271 NCT02600611 TITULO DEL PROTOCOLO “Estudio multicéntrico, aleatorizado, doble ciego, doblemente enmascarado, de grupos paralelos, con control activo, para evaluar la eficacia y seguridad de finerenone en comparación con eplerenona en la morbilidad y mortalidad de pacientes con insuficiencia cardíaca crónica, con fracción de eyección reducida después de una reciente insuficiencia cardiaca descompensada, así como factores de riesgo adicionales como diabetes mellitus tipo 2 o enfermedad renal crónica o ambas” “Estudio clínico de fase III, randomizado, controlado con tratamiento activo, de grupos paralelos, destinado a estudiar la eficacia y la seguridad a largo plazo de furoato de mometasona / fumarato de formoterol (MF/F, MK-0887A[SCH418131]), comparado con furoato de mometasona (MF, MK-0887 [SCH032088]), en niños con asma persistente” “Estudio de fase 3, aleatorizado, doble ciego, multicéntrico, para evaluar la seguridad y la eficacia de iclaprim intravenoso en comparación con vancomicina en el tratamiento de infecciones bacterianas agudas de la piel y sus estructuras relacionadas cuya causa presunta o confirmada son patógenos grampositivos” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Bayer S.A Acta 9 Segunda Parte del 23 de mayo de 2016 Numeral 3.15.4 EN EVALUACION NO ACTIVO Merck Sharp & Dohme Colombia S.A.S. Acta 9 Segunda Parte del 23 de mayo de 2016 Numeral 3.15.5 EN EVALUACION NO ACTIVO Motif Biosciense Inc / Covance Colombia Services Ltda. Acta 13 Segunda Parte del 13 de junio de 2016. Numeral 3.15.1 EN EVALUACION NO ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 24 25 26 27 RADICADO 2016036306 2016036284 2016036696 2016036186 CODIGO MK 3475-158 EMR 100070-008 R475-PN-1523 A5481053 NUMERO DE IDENTIFICACION PRIMARIO * NCT02628067 NCT02625623 EudraCT 2015-003783-36 NCT01740427 TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Merck Sharp & Dohme Colombia S.A.S. Acta 13 Segunda Parte del 13 de junio de 2016. Numeral 3.15.2 EN EVALUACION NO ACTIVO Merck KGaA Acta 13 Segunda Parte del 13 de junio de 2016. Numeral 3.15.3 EN EVALUACION NO ACTIVO “Estudio de fase 3, aleatorizado, doble Regeneron Pharmaceuticals, Inc ciego, de dosis múltiples, controlado con Acta 13 Segunda / ICON Holdings Clinical placebo, para evaluar la seguridad a largo Parte del 13 de Research International Limited plazo y la eficacia de Fasinumab en junio de 2016. Sucursal Colombia pacientes con dolor debido a osteoartritis Numeral 3.15.4 de la rodilla o la cadera" EN EVALUACION NO ACTIVO EN EVALUACION NO ACTIVO “Estudio clínico de pembrolizumab (MK3475) para evaluar los biomarcadores predictivos en participantes con tumores sólidos avanzados (KEYNOTE 158) “Ensayo de fase III, abierto, multicéntrico de avelumab (MSB0010718C) como tratamiento de tercera línea de adenocarcinoma gástrico o de la unión gastroesofágica no resecable, recurrente o metastásico” “Estudio de Palbociclib en combinación con Letrozol comoTratamiento de Mujeres Posmenopáusicas con Cáncer de mama Avanzado con Receptores Hormonales Positivos, HER 2 Negativo, para Quienes la Terapia de Letrozol se considera apropiada” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search Pfizer Inc / Inventiv Health Clinical Colombia S.A.S. Acta 13 Segunda Parte del 13 de junio de 2016. Numeral 3.15.5 AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 28 29 30 RADICADO 2016076862 2016076868 2016076878 CODIGO M13-542 M13-545 M15-555 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO NCT02706847 "Estudio de Fase 3, Aleatorizado, Doble Ciego para Comparar ABT 494 con Placebo en Sujetos con Artritis Reumatoide Activa Moderada a Severa que están en Tratamiento con Dosis Estables de Medicamentos Modificadoras de la Artritis Reumatoide Sintéticas Convencionales (DMARsc) y que tienen una Respuesta Inadecuada o Intolerancia a los DMARs Biológicos (DMARb)" Abbvie SAS No aplica REQUERIDO NO ACTIVO NCT02706873 "Estudio de Fase 3, Aleatorizado, Doble Ciego para Comparar ABT-494 Una Vez al Día como Monoterapia con Metotexate (MTX) como Monoterapia en Sujetos con Artritis Reumatoide Activa Moderada a Severa Sin Tratamiento Previo con MTX" Abbvie SAS No aplica REQUERIDO NO ACTIVO NCT02706951 "Estudio de Fase 3, Aleatorizado, Doble Ciego para Comparar ABT-494 como Monoterapia con Metotrexate (MTX) en Sujetos con Artritis Reumatoide Activa Moderada a Severa que tienen una Respuesta Inadecuada al MTX Incorpora Enmiendas 1 y 2" Abbvie SAS No aplica REQUERIDO NO ACTIVO Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 31 32 33 RADICADO 2016077601 2016077677 2016077841 CODIGO GA29350 NN2211-4232 MK 3475-240 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO EUDRACT:2016-000335-40 "Estudio de Fase II de dos cohortes, aleatorizado, a doble ciego, de grupos paralelos en pacientes con Artritis Reumatoide activa que evalúa la eficacia y seguridad de GDC-0853 en comparación con placebo y Adalimumab en pacientes con una respuesta inadecuada a la terapia previa con Metotrexato (Cohorte 1) y en comparación con placebo en pacientes con una respuesta inadecuada a la terapia previa para el FNT (Cohorte 2)" Genetech, Inc / Quintiles Colombia Ltda No aplica REQUERIDO NO ACTIVO NCT02730377 "LIRA-PRIME: Eficacia en el control de la glucemia con Victoza® (liraglutida) como complemento de la metformina frente a OAD como complemento de la metformina luego de hasta 104 semanas de tratamiento en sujetos con diabetes de tipo 2 no controlados correctamente con la monoterapia con metformina y tratados en un entorno de atención primaria" Novo Nordisk A/S No aplica REQUERIDO NO ACTIVO NCT02702401 "Estudio de Fase III de Pembrolizumab (MK3475) versus el mejor tratamiento médico de soporte como terapia de segunda línea en participantes con carcinoma hepatocelular avanzado tratado previamente de manera sistémica (KEYNOTE 240)" Merck Sharp & Dohme Colombia S.A.S No aplica APLAZADO NO ACTIVO Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 JULIO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 34 RADICADO 2016077939 CODIGO IPI-145-22 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO NCT02576275 "Estudio de fase III, Aleatorizado, Doble ciego de Duvelisib administrado en combinación con Rituximab y Bendamustina versus Placebo administrado en combinación con Rituximab y Bendamustina en sujetos con Linfoma No-Hodgkin Indolente previamente tratados" Infinity Pharmaceuticals, Inc./ INC Research Colombia Ltda. No aplica REQUERIDO NO ACTIVO Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search
© Copyright 2026