Nota : * El número de identificacion primario se puede consultar en
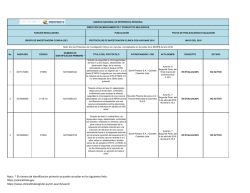
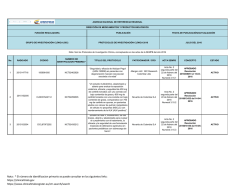
AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 MAYO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 1 2 3 RADICADO 2015147716 2015152005 2015152004 CODIGO 150998-005 CLDK378A2112 CICL670F2202 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO NCT02462928 “Seguridad y eficacia de Abicipar Pegol (AGN-150998) en pacientes con degeneración macular neovascular asociada a la edad” NCT02299505 “Un estudio multicéntrico, aleatorizado y abierto para evaluar la exposición sistémica, eficacia y seguridad de 450 mg de ceritinib tomados con una comida con bajo contenido de grasa y 600 mg de ceritinib tomados con una comida con bajo contenido de grasa, comparados con 750 mg de ceritinib en ayunas, en pacientes adultos con cáncer de pulmón metastásico de células no pequeñas (NSCLC) con reordenamiento de la ALK (ALK positivo)”. NCT02435212 “Estudio de fase II, multicéntrico, de dos brazos, abierto y aleatorizado para evaluar el cumplimiento con el tratamiento, la eficacia y la seguridad de una formulación mejorada de deferasirox (gránulos) en pacientes pediátricos con sobrecarga de hierro”. Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Allergan Ltd / INC Research Colombia Ltda Acta No. 2 segunda parte del 22 de febrero del 2016 Numeral 3.15.1 APROBADO Resolución 2016009051 el 15-032016 ACTIVO Novartis de Colombia S.A Acta No. 2 APROBADO segunda parte del Resolución 22 de febrero del 2016012432 del 14-042016 2016 Numeral 3.15.2 Novartis de Colombia S.A Acta No. 2 segunda parte del 22 de febrero del 2016 Numeral 3.15.3 EN EVALUACION ACTIVO NO ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 MAYO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 4 5 6 RADICADO 2015078075 2014120791 2015168878 CODIGO GO29058 CLCZ2696D2301 CAIN457A2310 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO NCT02340221 “Estudio fase III, doble ciego, placebo controlado, aleatorizado con taselisib más fulvestrant versus placebo más fulvestrant en mujeres posmenopáusicas con cáncer de mama HER2 negativo metastásico o localmente avanzado y con receptor de estrógeno positivo que presentan recurrencia o progresión de la enfermedad durante o después de la terapia con inhibidores de la aromatasa” NCT01920711 "Un estudio multicentrico, aleatorizado, doble ciego, de grupos paralelos, con control activo para evaluar la eficacia y seguridad de LCZ696 en comparación con valsatrán sobre la morbilidad y mortalidad en pacientes con falla cardiaca (clase II-IV) de la NYHA) con fraccion de eyección preservada" NCT02471144 “un estudio clínico aleatorizado, doble ciego, con control activo y placebo en múltiples centros para demostrar la a eficacia de secukinumab subcutáneo en comparación con placebo y etanercept (en un brazo de ciego simple) después de doce semanas de tratamiento, y para evaluar la seguridad, tolerabilidad y eficacia a largo plazo en sujetos de 6 a menos de 18 años de edad con psoriasis en placa crónica grave” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Acta No. 2 APROBADO segunda parte del Resolución 22 de febrero del 2016015583 del 03-052016 numeral 2016 3.15.4 ACTIVO Novartis de Colombia S.A. Acta No. 2 segunda parte del 22 de febrero del 2016 Numeral 3.15.11 ACTIVO Novartis de Colombia S.A Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016015588 del 03-052016 Numeral 2016 3.15.1 Productos Roche S.A APROBADO Resolución 2016009035 el 15-032016 ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 MAYO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 7 8 9 10 RADICADO 2015171511 / 16005016 2015159798 2015173238 2015172000 CODIGO SGSC-002 WA29748 GS-US-296-1080 17712 NUMERO DE IDENTIFICACION PRIMARIO * NCT02672540 NCT02550652 NCT02545504 NCT02200614 TITULO DEL PROTOCOLO “Estudio aleatorizado, ciego simple, multicéntrico, de fase II sobre la seguridad y efectividad de SANGUINATE™ en comparación con una solución salina normal en pacientes adultos con enfermedad de células falciformes con crisis vaso-oclusivas (VOC)” “Estudio aleatorizado, controlado con placebo, doble ciego, multicéntrico para evaluar la seguridad y la eficacia de Obinutuzumab en pacientes con Nefritis Lúpica de clase III o IV según ISN/RPS 2003” “GS-5745 combinado con mFOLFOX6 como tratamiento de primera línea para adenocarcinoma avanzado gástrico o de la unión gastroesofágica” “Estudio multinacional de fase III, aleatorizado, doble ciego, controlado con placebo para evaluar la eficacia y la seguridad de ODM-201 en varones con cáncer de próstata no metastásico de alto riesgo resistente a la castración” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO Prolong Pharmaceuticals LLC / Quintiles Colombia Ltda Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.2 EN EVALUACION NO ACTIVO Productos Roche S.A. Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016015586 del 03-052016 Numeral 2016 3.15.3 ACTIVO Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.4 EN EVALUACION NO ACTIVO Acta No. 6 Bayer S.A. / ICON Holdings Segunda Parte, del Clinical Research International 18 de marzo del Limited Sucursal Colombia 2016 Numeral 3.15.6 EN EVALUACION NO ACTIVO Gilead Sciences, Inc. / ICON Clinical Research AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 MAYO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 11 12 13 14 RADICADO 2015165972 16004562/ 2015136513 2015155199 2015155029 CODIGO LFB-FVIIa-007-14 M13-813 MK-3475-170 A4091058 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO NCT02448680 “Estudio de fase III sobre la seguridad, farmacocinética y eficiencia del factor de coagulación VIIa (recombinante) en pacientes con hemofilia A o B congénita desde ≥6 meses de edad hasta <12 años con inhibidores del factor VII o IX: PerSept 2” LFB USA Inc. / PSI CRO Colombia S.A.S. Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.7 EN EVALUACION NO ACTIVO NCT02573324 “Estudio aleatorizado, controlado con placebo, en fase 2b/3 de ABT-414 con quimiorradiación concurrente y temozolomida auxiliar en sujetos con diagnóstico reciente de glioblastoma (GBM) con amplificación del receptor del factor de crecimiento epidérmico (RFCE) (Intellance 1)” Abbvie SAS Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.8 EN EVALUACION NO ACTIVO NCT02576990 "Estudio de fase II de Pembrolizumab (MK3475) en sujetos con linfoma de células B grandes mediastínico primario refractario o recidivante (rrPMBCL)" Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.9 EN EVALUACION NO ACTIVO NCT02528188 “Estudios de Fase 3, Aleatorizado, Doble Ciego, con Control Activo, Multicéntrico de la Seguridad y Eficacia a Largo Plazo de la Administración Subcutánea de Tanezumab en Sujetos con Osteoartritis de Cadera o Rodilla” Acta No. 6 Segunda Parte, del 18 de marzo del 2016 Numeral 3.15.10 EN EVALUACION NO ACTIVO Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search Merck Sharp and Dohme Colombia S.A.S Pfizer Inc. / Inventiv Health Clinical Colombia S.A.S. AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 MAYO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 15 16 17 RADICADO 2015155036 2016006297 2016006296 / 2016020777 CODIGO B1801381 03-CL-1202 ML-3341-306 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO NCT02509026 “Estudio abierto, multicéntrico de interrupción y reinicio del tratamiento con etanercept en pacientes con espondiloartritis axial no radiográfica con una respuesta adecuada en la semana 24” Pfizer Inc. / Inventiv Health Clinical Colombia S.A.S. Acta No. 6 APROBADO Segunda Parte, del Resolución 18 de marzo del 2016015585 del 03-052016 Numeral 2016 3.15.11 ACTIVO NCT02636868 “Estudio Multinacional, Multicéntrico, Enmascarado, Aleatorizado, Controlado para Evaluar la Seguridad y la Eficacia de Lucinactant Inhalado en Recién Nacidos Prematuros de 26 a 32 Semanas de Edad Gestacional con Síndrome de Dificultad Respiratoria” Discovery Laboratorios, Inc. / Colombia S.A.S. APROBADO Acta No. 7 Resolución Segunda Parte, del 4 de abril del 2016 2016015622 del 03-05Numeral 3.15.1 2016 ACTIVO NCT02679573 “Estudio de fase 3, multicéntrico, aleatorizado, doble ciego y controlado con Acta No. 7 comparador para evaluar la seguridad y la Melinta Therapeutics, Inc / PSI- Segunda Parte, del eficacia de la delafloxacina intravenosa con CRO Colombia S.A.S 4 de abril del 2016 pasaje a vía oral en sujetos adultos con Numeral 3.15.3 neumonía bacteriana adquirida en la comunidad” Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search ACTA SEMPB CONCEPTO EN EVALUACION ESTADO NO ACTIVO AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN/ACTUALIZACIÓN GRUPO DE INVESTIGACIÓN CLÍNICA (GIC) PROTOCOLOS DE INVESTIGACIÓN CLÍNICA 2016 MAYO DEL 2016 Nota: Son los Protocolos de Investigación Clínica, conceptuados en las actas de la SEMPB del año 2016 No. 18 RADICADO 2016006329 CODIGO MK3475-181 NUMERO DE IDENTIFICACION PRIMARIO * TITULO DEL PROTOCOLO PATROCINADOR / CRO ACTA SEMPB CONCEPTO ESTADO NCT02564263 “Estudio de fase III, randomizado y abierto, de pembrolizumab en monoterapia comparado con docetaxel, paclitaxel, o irinotecan como agente único, a elección del médico, en participantes con adenocarcinoma y carcinoma de células escamosas de esófago, avanzado o metastásico, en progresión luego de un tratamiento estándar de primera línea (KEYNOTE-181)” Merck Sharp & Dohme Colombia S.A.S. Acta No. 7 Segunda Parte, del 4 de abril del 2016 Numeral 3.15.4 EN EVALUACION NO ACTIVO Nota : * El número de identificacion primario se puede consultar en los siguientes links: https://clinicaltrials.gov https://www.clinicaltrialsregister.eu/ctr-search/search
© Copyright 2026