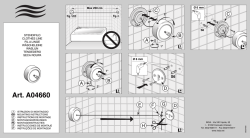
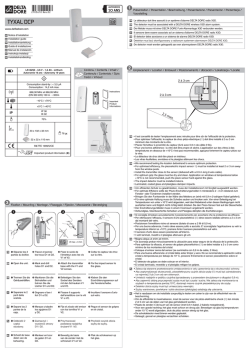
IT SV DE NL FR PT EN ES
EN HyperionTM PFO Occluder Instruction for Use ES Oclusor HyperionTM PFO Instrucciones de Uso DE HyperionTM PFO-Okkluder Gebrauchsanleitung NL HyperionTM PFO Occluder Handleiding PT Oclusor PFO HyperionTM Instruções de Uso FR IT Dispositif HyperionTM d’occlusion de la PFO Mode d’Emploi Occlusore per PFO HyperionTM Istruzioni per l'uso SV HyperionTM PFO ocklusionsanordning Användningsinstruktioner 01 Manufacturer Hersteller Fabricant Produttore Fabricante Fabrikant Fabricante Tillverkare Caution Achtung Attention Attenzione Precaución Let op Cuidado Iakttag försiktighet Date of Manufacture Herstellungsdatum Date de fabrication Data di produzione Fecha de fabricación Fabricagedatum Data de fabric Tillverkningsdatum Do not use if package is damaged Nicht verwenden, wenn die Verpackung beschädigt ist Ne pas utiliser si le conditionnement est endommagé Non usare se la confezione è danneggiata No usar si el envase está dañado Niet gebruiken indien de verpakking beschadigd is Não utilizar se a embalagem estiver danificada Använd inte produkten om förpackningen har skadats MR Conditional MR Conditional MR Sicherheit RM Conditionnel Condizioni per la RM Condicional a RM MR Conditioneel Condicional para RM MR säker under vissa betingelser Keep Dry Trocken halten Conserver au sec Conservare all’asciutto Mantener seco Droog houden Não reutilizar Förvaras torrt 02 Serial Number Seriennummber Numéro de série Numero di serie Número de serie Serienummer Número de série Serienummer Use By Verwendbar bis Utiliser avant Utilizzare entro Utilizar antes de Te gebruiken tot uiterlijk Utilizar até Sista förbrukningsdatum Sterilized Using Ethylene Oxide Sterilisiert mit Äthylenoxid Stérilisation par oxyde d´éthylène Sterilizzato con ossido di etilene Esterilizado mediante óxido de etileno Gesteriliseerd met ethyleenoxide Esterilizado utilizando óxido de etileno Steriliserad med etylenoxid Catalogue Number Artikelnummer Numéro de référence Numero di catalogo Número de catálogo Catalogusnummer Número de catálogo Katalognummer Consult instructions for use Bitte die Gebrachsanleitung lesen Consulter le mode d´emploi Leggere le istruzioni per I´uso Consultar las instrucciones de uso Raadpleeg de gebruiksaanwijzing Consultar as instruções de utilização Studera bruksanvisningen Temperature limitation Temperaturbegrenzung Limitation de la température Temperatura limite Limitación de temperatura Temperatuurbegrenzing Limitação de temperature Temperaturspärr Latex Free Latexfrei Sans latex Senza lattice Sin látex Latexfri Sem látex Latexfri Lot Number Lot-Nummer Numéro de lot Numero di lotto Número de lote Lotnummer Número de lote Lotnummer Do not reuse Nicht widerverwenden Ne pas réutiliser Non riutilizzare No reutilizar Niet opnieuw gebruiken Não reutilizar Inte för återanvändning Keep Away From Sunlight Vor direktem Sonnenlicht schützen Conserver à l’abri de la lumière solaire Conservare al riparo della luce Mantener alejado de la luz solar Niet blootstellen aan zonlicht Esterilizado por óxido de etileno Förvaras inte i närheten av solljus 01 ● Patients with intra-cardiac mass or vegetation, thrombus, or tumor. English TM Hyperion PFO Occluder Instruction for Use benefits of this technique. 4. Warnings interventional treating practice or be guided by professionals ovale, which can be observed by echocardiography. ● Confirm correct placement. Advance the sheath close to the right atrial ● The HyperionTM PFO Occluder should only be used by those physicians position is unstable. Recapture the device and re-deploy. If still disc and administer an injection of contrast medium to confirm correct unsatisfactory, recapture the device and replace with a new device. position. ● Physicians must be prepared to deal with urgent situations which require removal of embolized devices that result in critical hemodynamic ● Embolized devices must be removed as they may disrupt critical cardiac ♦ Care should be taken not to entrap right atrial Chiari networks or large Eustachian valves under the right atrial side of the device. ● Post-Implant ♦ Patients should take appropriate endocarditis prophylaxis for Contents supplied STERILE using Ethylene Oxide sterilization process. Do functions. Embolized devices should not be withdrawn through 6 months following device implantation. The decision to continue not use if sterile barrier is damaged. If damage is found, call your company intracardiac structures unless they have been adequately collapsed endocarditis prophylaxis beyond 6 months is at the discretion of the representative. the right atrial disc. Assure secure position across the patent foramen device does not conform to the original configuration or if the device compromise. This includes the availability of an on-site surgeon. WARNING ♦ Do not release the PFO Occluder from the delivery cable if the ● With gentle tension on the delivery cable, pull the sheath back to deploy ● Patients allergic to nickel may suffer an allergic reaction to this device. trained in transcatheter defect closure techniques. Read “Instruction for Use” carefully before use, users should have the patients who are pregnant must be weighed against the potential within the sheath. For single patient use only. Do not reuse, reprocess or resterilize. Reuse, ● Do not use if the sterile barrier has been compromised in any way. reprocessing or resterilization may compromise the structural integrity of ● MR Conditional physician. ♦ Patients should be treated with antiplatelet/anticoagulation therapy, such as aspirin for 6 months post implant. The decision to continue 7. Disposal ● Dispose of all packaging materials as appropriate. ● Dispose of PFO Occluder and accessories following standard solid biohazard waste procedures. 8. Storage and Expiry Date ● Store in a cool, dry place with temperature 0-30°C degree. ● The expiry date of HyperionTM PFO Occluder is three years. antiplatelet/anticoagulation therapy beyond 6 months is at the the device and/or lead to device failure which, in turn, may result in patient Through non-clinical testing, Hyperion devices have been shown to be injury, illness or death. Reuse, reprocessing or resterilization may also MR Conditional. A patient with an implanted Hyperion device can be create a risk of contamination of the device and/or cause patient infection scanned safely under the following conditions: or cross-infection, including, but not limited to, the transmission of infectious ♦ Static magnetic field of 3T or less for a hypercoagulable state and initiation of aggressive anticoagulant publication, are meant solely to generally describe the product at the time disease(s) from one patient to another. Contamination of the device may ♦ Spatial gradient magnetic field of 720G/cm or less therapy should be given. Thrombolysis and surgical removal should of manufacture and do not constitute any express warranties. Comed B.V. be considered if the patient does not respond to anticoagulant will not be responsible for any direct, incidental, or consequential damages therapy. resulting from the abnormal use of the product. lead to injury, illness or death of the patient. After use, dispose of product and packaging in accordance with hospital, 5. Precautions administrative and/or local government policy. ● Handling 1. Product Description HyperionTM PFO Occluder is a self- expanding double-disc nitinol mesh occlusion device. The 2 discs are connected by a short waist allowing free The HyperionTM PFO Occluder and Delivery System are for single use 6. Directions for Use only. Do not reuse or resterilize. ● Patients should be fully heparinized throughout the procedure using ● Device Size Selection ♦ Transesophageal echocardiography (TEE) or intracardiac motion of each disc. In order to increase its closing ability, the discs contain echocardiography (ICE) is required to measure the distance from thin Polyester fabric. the defect to the aortic root in the 30 degree view, and the distance from the defect to the superior vena cava orifice in the bacaval 90 2. Indications for Use The HyperionTM PFO Occluder is a percutaneous, transcatheter occlusion discretion of the physician. ♦ If a left-sided thrombus is identified, a patient should be evaluated degree view.. ♦ Size the device such that the radius of the right atrial disc will not adequate dosing so as to keep the ACT greater than 200. catheter through the PFO into the left atrium and introduce an exchange “J” guidewire intothe left atrium. ● Pass the delivery cable through the loader and screw the device on to the delivery cable. ● Once the device is securely attached to the cable, immerse the device and loader in saline solution and pull the device into the loader. exceed the lesser of the two measurements, except in the case of aneurysm of the septum) in patients with a history of stroke or transient an atrial septal aneurysm, where consideration should be given to ● Remove the catheter leaving the guidewire in place. ischemic at tacks (TIAs) diagnosed by echocardiography with right-to-left placing a larger occluder in an effort to cover the aneurysm. Refer to ● Insert the dilator into the delivery sheath and secure to the sheath with shunting during the Valsalva maneuver. section 7.3 for device selection. 3. Contraindications ● Presence of thrombus at the intended site of implant, or documented evidence of venous thrombus in the vessels through which access to the defect is gained. ● Active endocarditis or other infections producing bacteremia. ● Patients whose vasculature, through which access to the defect is gained, is inadequate to accommodate the appropriate sheath size. ● Anatomy in which the PFO device size required would interfere with patient has aspirin intolerance) is recommended to be started at least 24 hours prior to the procedure. ♦ Antibiotics should be administered periprocedurally. ♦ Patients should be fully heparinized throughout the procedure using adequate dosing so as to keep the ACT greater than 200. ♦ Transesophageal echocardiography (TEE) or intracardiac echocardiography (ICE) is required as an aid in placing the PFO other intra-cardiac or intravascular structures, such as valves or Occluder. If TEE is used, the patient’s esophageal anatomy must be pulmonary veins. adequate for place and manipulation of the TEE probe. ● Patients who are unable to take antiplatelet or anticoagulant therapy. ● Patients with known hypercoagulable states. 02 ♦ Aspirin (3-5 mg/kg/day) (or alternative antiplatelet/anticoagulant if ♦ Fluoroscopic x-ray guidance is used during placement of the device. The risk of increased x-ray exposure for Descriptions or specifications in Comed B.V. printed matter, including this ● Following percutaneous puncture of the femoral vein, pass a diagnostic device intended to close all types PFOs (i.e. classical as well as those with ● Procedural 9. Disclaimer of Warranty and Limitation of Remedy the locking mechanism. Introduce the dilator/delivery sheath assembly. Once the delivery sheath has reached the inferior vena cava, remove the dilator to allow back bleeding to purge all air from the system. ● Connect the hemostasis valve and flush with a syringe before the left atrium is entered. ● Advance the sheath over the guidewire through the PFO and into the left atrium. Correct position of the delivery sheath is verified by a test injection of contrast medium. Once in satisfactory position, remove the guidewire and flush the sheath with saline. ● Introduce the loader to the delivery sheath. Advance the device into the sheath by pushing (not rotating) the delivery cable. ● Under fluoroscopic and echocardiographic guidance, deploy the left atrial disc by pulling firmly against the atrial septum, which can be felt and observed via echocardiography. 03 Deutsch/German HyperionTM PFO-Okkluder Gebrauchsanleitung Vor der Verwendung “Gebrauchsanleitung” sorgfältig lesen. Anwender sollten in der interventionellen Behandlung geübt sein oder unter professioneller Begleitung handeln. WARNHINWEIS Inhalt wird nach Sterilisationsverfahren mit Ethylenoxid STERIL geliefert. Nicht verwenden, wenn die Sterilbarriere beschädigt ist. Kontaktieren Sie bei Feststellen einer Beschädigung Ihren zuständigen Firmenrepräsentanten. Nur für die Einpatientenanwendung. Nicht wiederverwenden, wiederaufbereiten oder resterilisieren. Eine Wiederverwendung, Wiederaufbereitung oder Resterilisation kann die strukturelle Integrität des Produkts beeinträchtigen bzw. ein Versagen des Produkts verursachen, was wiederum zu Verletzung, Krankheit oder Tod des Patienten führen kann. Eine Wiederverwendung, Wiederaufbereitung oder Resterilisation des Produkts birgt weiterhin ein Kontaminationsrisiko in sich bzw. kann zur Infektion oder Kreuzinfektion des Patienten führen, insbesondere zur Übertragung infektiöser Krankheiten von einem Patienten auf den anderen. Die Kontamination des Produkts kann zu Verletzung, Krankheit oder Tod des Patienten führen. Produkt und Verpackung sind nach der Verwendung entsprechend den geltenden Krankenhaus- bzw. kommunalen/staatlichen Vorschriften zu entsorgen. 1. Produktbeschreibung Der HyperionTM PFO-Okkluder ist ein selbst-expandierendes DoppelschirmVerschluss-implantat aus Nitinolgeflecht. Die 2 Schirmchen sind über einen kurzen Mittelstent verbunden, der die freie Beweglichkeit beider Schirmchen ermöglicht. Zur Verbesserung des Verschlussverhaltens tragen die Schirmchen ein dünnes Polyestergewebe. 2. Therapeutische Indikationen Der HyperionTM PFO-Okkluder ist ein perkutan über einen Katheter applizierbares Verschlussimplantat, das für den Verschluss aller PFOFormen (sowohl klassischer als solcher mit Septumaneurysma) bei Patienten vorgesehen ist, die in der Vorgeschichte einen Schlaganfall oder transiente ischämische Attacken (TIAs) erlitten haben und die durch Echokardiographie mit Rechts-Links-Shunten während des Valsalva-Manövers diagnostiziert wurden. 3. Kontraindikationen ● Vorliegen eines Thrombus an der vorgesehenen Implantationsstelle oder dokumentierter Nachweis einer Venenthrombose in den Gefäßen, durch die Zugang zum Defekt erhalten wird, ● Akute Endokarditis oder andere, eine Bakteriämie verursachende Infektionen, ● Patienten, deren Blutgefäße, durch die der Zugang zum Defekt erhalten 04 wird, unzureichend oder zur Aufnahme der angemessenen Kathetergröße nicht ausreichend sind, ● anatomische Gegebenheiten, unter denen die Größe des PFO-Implantats andere endokardiale oder endovaskuläre Strukturen wie z. B. Klappen oder Lungenvenen beeinträchtigen würde, ● Patienten, die für eine Therapie mit Thrombozytenaggregationshemmern / Gerinnungshemmern nicht geeignet sind, ● Patienten mit bekannter Hyperkoagulabilität, ● Patienten mit vorliegender intrakardialer Masse oder Wucherung, Thrombus oder Tumor. 4. Warnhinweise ● Bei Patienten mit Nickelallergie kann dieses Verschlussimplantat zu einer allergischen Reaktion führen. ● Der HyperionTM PFO-Okkluder sollte nur von Ärzten verwendet werden, die in katheterinterventionellen Defekt-verschlusstechniken geübt sind. ● Die Ärzte müssen mit Notfallsituationen umgehen können, die die Entfernung von embolisierten, zu kritischer hämodynami-scher Insuffizienz führenden Implantaten erfordern. Dazu gehört die Bereitschaft eines Chirurgen vor Ort. ● Embolisierte Implantate müssen entfernt werden, weil sie kritische Herzfunktionen stören können. Embolisierte Implantate sollten nur dann durch endokardiale Struk¬turen zurückgezogen werden, wenn sie in der Hülse passend zusammengefaltet wurden. ● Nicht verwenden, wenn die Sterilbarriere in irgendeiner Weise durchbrochen wurde. ● MR-Sicherheit Bei nicht klinischen Untersuchungen wurde nachgewiesen, dass Hyperion Implantate MR-kompatibel sind. Patienten mit Hyperion Implantaten können sich unter den folgenden Umstäden sicher einem MRT-Scan unterziehen: ♦ Statisches Magnetfeld mit einer Feldstärke von maximal 3 Tesla. ♦ Raumgradient-Feldstärke von maximal 720 G/cm. 5. Vorsichtsmaßregeln ● Handhabung Der HyperionTM PFO-Okkluder und das Applikationssystem sind nur für den Einmal¬gebrauch bestimmt. Nicht wieder-verwenden oder resterilisieren. ● Auswahl der Implantatgröße ♦ Zur Messung des Abstands zwischen Defekt und Aortenwurzel und des Abstands zwischen Defekt und Einmündung der oberen Hohl¬vene muss die Transösophageale Echokardio¬graphie (TEE) oder die Intrakardiale Echokardiographie (ICE) eingesetzt werden (30°-Blick bzw. bicavaler 90°-Blick). ♦ Bemessen Sie das Implantat so, dass der Radius des rechtsatrialen Schirmchens den kleineren der beiden Messwerte nicht überschreitet, ausgenommen im Falle eines Vorhofseptum-Aneurysmas, bei dem erwogen werden sollte, einen größeren Okkluder einzusetzen, um das Aneurysma zu überdecken. Zur Auswahl des Implantats siehe Abschnitt 7.3. ● Procedere ♦ Es wird empfohlen, spätestens 24 Std. vor dem Eingriff eine Aspirin¬therapie (3-5 mg/kg/Tag) oder bei Aspirin-Intoleranz eine andere Antikoagulations-/ antithrombo¬zytäre Therapie zu beginnen. ♦ Periprozedural sollten Antibiotika verabreicht werden. ♦ Die Vollheparinisierung der Patienten während der gesamten Prozedur wird empfohlen, wobei eine angemessene Dosierung die ACT auf über 200 Sek. halten sollte. ♦ Als Hilfsmittel zur richtigen Platzierung des PFO-Okkluders muss die Transösophageale Echokardio-graphie (TEE) oder die Intrakardiale Echokardiographie (ICE) eingesetzt werden. Für den Einsatz der TEE muss die ösophageale Anatomie des Patienten Raum für die TEE-Sonde und deren Manipulation bieten. ♦ Die Platzierung des Implantats erfolgt unter Röntgenkontrolle. Das Risiko einer erhöhten Röntgen¬exposition für schwangere Patientinnen muss gegen die möglichen Vorteile dieser Technik abgewogen werden. ♦ Geben Sie den HyperionTM PFO-Okkluder aus dem Applikations¬draht nur dann frei, wenn das Implantat der ursprünglichen Konfiguration entspricht und wenn die Positionierung des Implantats stabil ist. Holen Sie das Implantat zurück und setzen Sie es erneut ein. Ist das Ergebnis weiterhin unbefriedi¬gend, holen Sie das Implantat wieder ein und ersetzen Sie es durch ein neues. ♦ Es sollte darauf geachtet werden, keine Teile des rechtsatrialen Chiari-Netzes oder große Eustachische Klappen unter der rechtsatrialen Seite des Implantats einzuklemmen. ● Nach der Implantation ♦ Die Patienten sollten über 6 Monate nach dem Einsetzen des Implantats eine geeignete Endokarditis-Prophylaxe einhalten. Die Entscheidung, ob die Endokarditis-Prophylaxe über die 6 Monate hinaus fortgesetzt wird, liegt im Ermessen des Arztes. ♦ Die Patienten sollten bis 6 Monate nach der Implantation eine Therapie mit Thrombozyten¬aggregations¬hemmern / Gerinnungshemmern wie z. B. Aspirin erhalten. Die Entscheidung, ob die Therapie mit Thrombozytenaggregations-hemmern / Gerinnungshemmern über die 6 Monate hinaus fortgesetzt wird, liegt im Ermessen des Arztes. ♦ Falls ein linksseitiger Thrombus festgestellt wird, sollte der Patient auf Hyperkoagulabilität untersucht werden und es sollte eine aggressive Antikoagulantien-Therapie eingeleitet werden. Wenn der Patient nicht auf die Antikoagulantien-Therapie anspricht, sollte eine Thrombolyse und operative Entfernung erwogen werden. 6. Anwendungsvorschriften ● Die Vollheparinisierung der Patienten während der gesamten Prozedur wird empfohlen, wobei eine angemessene Dosierung die ACT auf über 200 Sek. halten sollte. ● Führen Sie nach perkutaner Punktion der Femoralvene einen Diagnostikkatheter durch das PFO in das linke Atrium ein und legen Sie einen „J“-förmigen Katheterwechsel¬draht in den linken Vorhof. ● Legen Sie den Applikationsdraht durch den Loader und schrauben Sie das Implantat auf den Applikationsdraht. ● Wenn das Implantat sicher am Kabel befestigt ist, tauchen Sie Implantat und Loader in Kochsalzlösung und ziehen das Implantat in den Loader. ● Entfernen Sie den Katheter und lassen Sie den Führungsdraht dabei liegen. ● Führen Sie den Dilatator in die Applikationshülse ein und sichern Sie die Hülse mit dem Verschlussmechanismus. Führen Sie den Verbund Dilatator/ Applikationshülse ein. Wenn die Applikationshülse die untere Hohlvene erreicht hat, entfernen Sie den Dilatator, um durch Backbleeding alle Luftblasen aus dem System auszutreiben. ● Schließen Sie dann das Hämostaseventil an und spülen Sie mit einer Spritze, bevor der linke Vorhof erreicht wird. ● Schieben Sie die Hülse über den Führungsdraht durch das PFO in den linken Vorhof vor. Die korrekte Position der Applikations¬hülse wird durch eine Prüfinjektion mit Kontrastmittel verifiziert. Wenn die Position zufrieden stellend ist, entfernen Sie den Führungsdraht und spülen die Hülse mit Kochsalzlösung. ● Führen Sie den Loader in die Applikationshülse ein. Bewegen Sie das Implantat in die Hülse, indem Sie den Applikations¬draht vorschieben (nicht drehen) ● Unter Röntgen- und Echokardiographie-kontrolle entfalten Sie das linksatriale Schirmchen, indem Sie es fest gegen das Vorhofseptum ziehen, was fühlbar ist und durch Echokardiographie beobachtet werden kann. ● Mit leichtem Zug auf das Applikationskabel ziehen Sie die Hülse zurück, um das rechtsatriale Schirmchen zu entfalten. Vergewissern Sie sich, dass das Implantat fest über dem PFO liegt, was mit Echokardiographie beobachtet werden kann. ● Bestätigen Sie die korrekte Positionierung. Bewegen Sie dazu die Hülse dicht an das rechtsatriale Schirmchen heran und injizieren Sie Kontrastmittel, um die korrekte Positionierung zu bestätigen. 7. Entsorgung ● Entsorgen Sie alle Verpackungs-materialien nach Vorschrift. ● Entsorgen Sie PFO-Okkluder und Zubehörteile entsprechend den Standard¬vorschriften für festen infektiösen Sonderabfall. 8. Lagerung und Verwendbarkeitsdauer ● An einem kühlen, trockenen Ort bei 0-30 °C lagern. ● Die Verwendbarkeitsdauer des HyperionTM PFO-Okkluders beträgt drei Jahre. 9. Garantieerklärung und Haftungsbeschränkung Beschreibungen oder Spezifikationen in den Druckwerken von Comed B.V. – diese Publikation eingeschlossen – dienen nur der allgemeinen Beschreibung des Produkts zum Zeitpunkt seiner Herstellung und stellen keine Garantieerklärung dar. Comed B.V. haftet nicht für direkte, beiläufig entstandene oder Folgeschäden, die durch unsachgemäßen Gebrauch dieses Produkts entstehen. 05 ● Anatomie dans laquelle le dispositif d’occlusion de la PFO gênerait França/French Dispositif HyperionTM d’occlusion de la PFO Mode d’Emploi Veuillez lire attentivement le “ Mode d’emploi” avant d’utiliser ce dispositif. Les utilisateurs doivent maîtriser la pratique du cathétérisme interventionnel d’autres structures intracardiaques ou intravasculaires, telles que ● Procédure ♦ valvules ou veines pulmonaires. (3-5 mg/kg/jour) (ou d’un anticoagulant/antiplaquettaire similaire en ● Patients ne pouvant pas prendre un traitement antiplaquettaire ou anticoagulant. pas utiliser si la barrière stérile est endommagée. En cas de dommages, veuillez appeler votre représentant. Destiné à être utilisé chez un seul patient. Ne pas réutiliser, retraiter ● Retirez le cathéter en laissant le fil-guide en place. l’intervention. ● Insérez le dilatateur dans la gaine de mise en place et fixez-le à la gaine Les antibiotiques doivent être administrés de façon périprocédurale. au moyen du mécanisme de blocage. Introduisez l'ensemble dilatateur/ ● Patients avec masse ou végétation, thrombus ou tumeur ♦ Les patients doivent être complètement héparinés pendant toute gaine de mise en place. Une fois que la gaine de mise en place a atteint l’intervention, au moyen d'un dosage suffisant pour maintenir un la veine cave inférieure, retirez le dilatateur afin de permettre au retour intracardiaques. ACT supérieur à 200. ♦ ● Les patients allergiques au nickel peuvent présenter une réaction intracardiaque (EIC) est requise comme aide à la mise en place du allergique à ce dispositif. dispositif d'occlusion de la PFO. Si l'ETO est utilisée, l'anatomie de ● Le dispositif HyperionTM d’occlusion de la PFO ne doit être utilisé que par des praticiens formés aux techniques transcathéter d'obturation. ● Les praticiens doivent être prêts à traiter des situations urgentes L’échocardiographie transœsophagienne (ETO) ou l'échocardiographie ♦ gauche. Corrigez la position de la gaine de mise en place et vérifiez-la à l’aide d’une injection test d'agent de contraste. Une fois que la position Un guidage radioscopique est utilisé au cours de la mise en place est satisfaisante, retirez le fil-guide et rincez la gaine avec la solution du dispositif. Le risque d’exposition radiologique pour les patientes compromettre l’intégrité de la structure du dispositif et/ou entraîner une gravement l'hémodynamique. Ces situations impliquent la disponibilité enceintes doit être considéré par rapport aux bénéfices potentiels de cette technique. sur place d'un chirurgien. ● Les dispositifs embolisés doivent être retirés du fait qu’ils peuvent ♦ Ne pas larguer le dispositif d’occlusion de la PFO du câble de mise restérilisation peut aussi engendrer un risque de contamination du dispositif perturber les fonctions cardiaques critiques. Les dispositifs embolisés en place si le dispositif n’est pas conforme à la configuration d’origine et/ou provoquer une infection ou une surinfection du patient, y compris mais ne doivent pas être retirés par la voie de structures intracardiaques, à ou si la position du dispositif est instable. Récupérez et redéployez sans s’y limiter, la transmission d’une ou de plusieurs maladies infectieuses moins qu'ils aient été adéquatement comprimés à l'intérieur de la gaine. le dispositif. Si cela n'est pas satisfaisant, récupérez le dispositif et d’un patient à l'autre. La contamination du dispositif peut entraîner une blessure, une maladie ou la mort du patient. Après utilisation, éliminer le produit et son emballage conformément à la réglementation hospitalière, administrative et/ou régionale en vigueur. remplacez-le par un autre. ● Ne pas utiliser si la barrière stérile a été compromise de quelque façon que ce soit. ♦ ● IRM conditionnel IRM conditionnels. Un patient porteur d’un dispositif Hyperion peut subir saline. ● Introduisez le chargeur dans la gaine de mise en place. Avancez le dispositif dans la gaine en poussant (sans tourner) le câble de mise en place. ● Sous contrôle radioscopique et guidage échocardiographique, déployez le disque atrial gauche en tirant fermement contre le septum interauriculaire, ce qui peut être senti et observé par échographie. ● Avec une tension douce sur le câble de mise en place, rétractez la gaine Veillez à ne pas emprisonner le réseau de Chiari de l'oreillette droite et déployez le disque auriculaire droit. Assurez-vous de la bonne ou une valve d'Eustache proéminente sous le côté auriculaire droit position du dispositif sur la persistance du foramen ovale, ce qui peut du dispositif. Des essais non cliniques ont montré que les dispositifs Hyperion étaient la pénétration dans l’oreillette gauche. ● Avancez la gaine sur le fil-guide à travers la PFO et dans l'oreillette manipulation de la sonde d’ETO. qui exigent le retrait de dispositifs embolisés qui peuvent compromettre une maladie ou la mort du patient. La réutilisation, le retraitement ou la de sang de purger tout l'air qui se trouve dans le système. ● Connectez la valve hémostatique et rincez à l’aide d’une seringue avant l'œsophage du patient doit être appropriée à la mise en place et à la ou restériliser. La réutilisation, le retraitement ou la restérilisation peut défaillance du dispositif, ce qui peut ensuite provoquer une blessure, chargeur dans une solution saline et tirez le dispositif dans le chargeur. cas d’intolérance du patient à l’aspirine) au moins 24 heures avant ♦ 4. Avertissements Le contenu est fourni STÉRILE après stérilisation à l’oxyde d'éthylène. Ne vissez le dispositif au câble de mise en place. ● Une fois le dispositif bien fixé au câble, immergez le dispositif et le ● Patients souffrant d’hypercoagulabilité connue. ou être guidés par des professionnels. AVERTISSEMENT Il est recommandé de commencer l’administration d’aspirine ● Après l’implantation être fait par échocardiographie. ● Confirmation de la mise en place correcte. Avancez la gaine à proximité 1. Description du produit une IRM en toute sécurité juste après l’implantation du dispositif dans Les patients doivent prendre la prophylaxie endocardite appropriée du disque auriculaire droit et injectez du produit de contraste afin de Le dispositif HyperionTM d’occlusion de la PFO est un dispositif d’occlusion les conditions suivantes : pendant 6 mois après l’implantation du dispositif. La décision de confirmer la position correcte. autodéployable à double disque en mailles de nitinol. Les 2 disques sont ♦ Champ magnétique statique de 3T maximum poursuivre cette prophylaxie au-delà de 6 mois est du ressort du connectés par une courte zone interdisque qui permet un libre mouvement ♦ Champ magnétique à gradient spatial de 720G/cm maximum médecin. 7. Élimination Les patients doivent recevoir un traitement antiplaquettaire/ ● Éliminez tous les matériaux d’emballage comme il convient. 5. Précautions anticoagulant, tel qu’aspirine, pendant 6 mois après l’implantation. ● Éliminez le dispositif d'occlusion de la PFO et les accessoires ● Manipulation La décision de poursuivre le traitement antiplaquettaire/ conformément aux procédures normalisées en vigueur pour les déchets anticoagulant au-delà de 6 mois est du ressort du médecin. solides d’activités de soins à risques infectieux. ♦ à chaque disque. Afin d'augmenter la capacité d'obturation du dispositif, les disques contiennent une fine membrane en polyester. 2. Indications d’utilisation Le dispositif HyperionTM d’occlusion de la PFO et le système de mise en Le dispositif HyperionTM d’occlusion de la PFO est un dispositif transcathéter place sont seulement destiné à un usage unique. Ne pas réutiliser ou percutané destiné à obturer tous les types de persistance du foramen ovale (aussi bien classiques que ceux accompagnés d’un anévrysme du septum) chez les patients ayant des antécédents d’apoplexie ou d'accident restériliser. ● Choix de la taille du dispositif ♦ Une échocardiographie transœsophagienne (ETO) ou une ischémique transitoire (AIT) diagnostiqués par échocardiographie avec échocardiographie intracardiaque (EIC) est requise afin de mesurer shunt droite-gauche au cours de la manœuvre de Valsalva. la distance entre l’anomalie et la racine aortique dans une vue à 30 3. Contre-indications ● Présence d’un thrombus au site prévu d’implantation ou preuve ♦ ♦ Si un thrombus gauche est détecté, le patient concerné doit être examiné afin de déterminer une éventuelle hypercoagulabilité, dans 8. Stockage et date de péremption lequel cas un traitement anticoagulant agressif devra être instauré. ● Stocker dans un endroit frais et sec, à une température de 0–30 ºC. Une thrombolyse et le retrait chirurgical doivent être envisagés si le ● La durée de vie du dispositif HyperionTM d’occlusion de la PFO est de patient ne répond pas au traitement anticoagulant. trois ans. degrés et la distance entre l’anomalie et l'orifice de la veine cave 6. Mode d’emploi 9. Exclusion de garantie et limitation des voies de recours supérieure en vue bicavale à 90 degrés. ● Les patients doivent être complètement héparinés pendant toute Les descriptions ou les spécifications présentées dans les imprimés de ♦ Choisissez la taille du dispositif de telle sorte que le rayon du disque documentée de thrombus veineux dans les vaisseaux par lesquels se auriculaire droit ne dépasse pas la plus petite de ces deux mesures, fait l’accès à l’anomalie. sauf en cas d’anévrysme du septum interauriculaire, où la mise en l’intervention, au moyen d'un dosage suffisant pour maintenir un ACT Comed B.V., y compris la présente publication, sont uniquement destinées supérieur à 200. à décrire de façon générale le produit au moment de sa fabrication et ne ● Après la ponction percutanée de la veine fémorale, faites passer constituent aucunement une garantie expresse. Comed B.V. n’assume ● Endocardite active ou autres infections produisant une bactériémie. place d'un dispositif occlusif plus grand devrait être envisagé pour un cathéter diagnostique à travers de la PFO dans l’oreillette gauche et aucune responsabilité pour les dommages directs, accessoires ou indirects ● Patients dont le système vasculaire, par lequel se fait l'accès à l’anomalie, tenter de couvrir l'anévrysme. Pour le choix du dispositif, voir la introduisez un fil-guide en « J » d’échange dans l’oreillette gauche. dus à une utilisation anormale du produit. est incompatible à la taille de la gaine appropriée. 06 section 7.3. ● Faites passer le câble de mise en place par le biais du chargeur et 07 ● Pazienti che non possono essere sottoposti a una terapia antiaggregante Italiano/Italian Occlusore per PFO Hyperion Istruzioni per l'uso TM piastrinica o anticoagulante. ● Pazienti con stati di ipercoabilità nota. ● Pazienti con massa intracardiaca, vegetazione, trombo o tumore. l’apparecchio; gli utenti devono avere seguito la pratica di trattamento per intervento o essere guidati da professionisti. ● I pazienti allergici al nichel potrebbero manifestare una reazione allergica a questo dispositivo. ● L’occlusore per PFO HyperionTM deve essere utilizzato esclusivamente da medici esperti in tecniche transcatetere di occlusione dei difetti. AVVERTENZA ● I medici devono essere pronti ad affrontare situazioni di emergenza il meccanismo di blocco. Introdurre l'unità composta dal dilatatore e dalla guaina di applicazione. Dopo che la guaina di applicazione ha l’intera procedura con dosaggi adeguati, in modo da mantenere l’ACT ♦ Sono richieste l’ecocardiografia transesofagea (TEE) o l’ecocardiografia intracardiaca (ICE) a supporto dell’inserimento dell’occlusore per PFO. Se si utilizza la TEE, l’anatomia esofagea effettuando un’iniezione diprova con un mezzo di contrasto. Una volta ♦ Durante l’inserimento del dispositivo occorre utilizzare i raggi X come con ossido di etilene.Non utilizzare in caso di danni della barriera sterile. Se compromissione emodinamica. Ciò richiede la disponibilità di un per le pazienti in gravidanza rispetto ai potenziali vantaggi di questa tecnica. ♦ Non rilasciare l’occlusore per PFO dal cavo di applicazione se il Esclusivamente monopaziente. Non risterilizzare, non rigenerare e non ● I dispositivi embolizzati devono essere rimossi, in quanto potrebbero riutilizzare. Il riutilizzo, la rigenerazione o la risterilizzazione potrebbero ostacolare le funzioni cardiache vitali. I dispositivi embolizzati non dispositivo non è conforme alla configurazione originale o se la compromettere l’integrità strutturale del dispositivo e/o comportare problemi devono essere tirati attraverso le strutture intracardiache, a meno che sua posizione è instabile. Ricatturare il dispositivo e rilasciarlo di funzionamento di quest’ultimo, con il rischio di provocare lesioni, malattie non siano stati adeguatamente compressi all’interno della guaina. nuovamente. Se la posizione è ancora insoddisfacente, ricatturare il possono inoltre comportare un rischio di contaminazione del dispositivo e/ o provocare infezioni o contagi al paziente, inclusa, in modo non limitativo, ● Non utilizzare nel caso in cui la barriera sterile sia stata compromessa in qualunque modo. ● Sicuro per la risonanza magnetic in condizioni specifiche. accedere all’atrio sinistro. ● Fare avanzare la guaina sul filo di guida attraverso il PFO e nell’atrio sinistro. Verificare la posizione corretta della guaina di applicazione guida. Ponderare il rischio di aumento dell’esposizione ai raggi X o decesso del paziente. Il riutilizzo, la rigenerazione o la risterilizzazione sanguinamento, in modo da eliminare l’aria dal sistema. ● Collegare la valvola emostatica e ripulire con una siringa prima di manipolazione della sonda TEE. che richiedono la rimozione dei dispositivi embolizzati, con grave chirurgo in sede. raggiunto la vena cava inferiore, rimuovere il dilatatore per permettere il del paziente deve essere adeguata per l’inserimento e la Il contenuto è stato reso STERILE in base a un processo di sterilizzazione si rileva un danno, rivolgersi al rappresentante dell’azienda. ● Inserire il dilatatore nella guaina di applicazione e fissarlo ad esso con ♦ I pazienti devono essere sottoposti a eparinizzazione totale durante superiore a 200. 4. Avvertenze Leggere attentamente le “Istruzioni per l’uso” prima di utilizzare procedura. ♦ Somministrare antibiotici in modo periprocedurale. dispositivo e sostituirlo con un dispositivo nuovo. ♦ Prestare attenzione a non intrappolare la rete del Chiari nell’atrio destro o le grandi valvole di Eustachio sotto il lato atriale destro del dispositivo. la trasmissione di malattie infettive fra pazienti. La contaminazione del Test non clinici hanno stabilito che i dispositivi Hyperion possono essere dispositivo può provocare lesioni, malattie o decesso del paziente. considerate sicuri per la risonanza magnetic in condizioni specifiche. Dopo l’uso, smaltire il prodotto e la confezione in ottemperanza alle norme I pazienti portatori del dispositivo Hyperion possono essere sottoposti in vigore dell’ospedale e degli enti amministrativi e/o statali locali. a risonanza magnetic immediatamente dopo l’impianto nelle seguenti a una profilassi adeguata per l’endocardite per 6 mesi. La decisione ● Operazioni successive all’impianto ♦ Dopo l’impianto del dispositivo, i pazienti devono essere sottoposti trovata una posizione soddisfacente, rimuovere il filo di guida e lavare la guaina con una soluzione salina. ● Introdurre il caricature nella guaina di applicazione. Fare avanzare il dispositivo nella guaina spingendo (senza ruotare) il cavo di applicazione. ● Utilizzando una guida fluoroscopica e ecocardiografica, applicare il disco atriale sinistro tirando saldamente contro il setto atriale, che si percepisce e si può osservare mediante ecocardiografia. ● Esercitando una leggera tensione sul cavo di applicazione, tirare indietro la guaina per applicare il disco atriale destro. Trovare una posizione salda attraverso il forame ovale pervio osservando con ecocardiografia. ● Verificare che la posizione sia corretta. Fare avanzare la guaina vicino al disco atriale destro e somministrare un'iniezione di mezzo di contrasto per verificare che la posizione sia corretta. condizioni: di continuare la profilassi per l’endocardite per più di 6 mesi è a 7. Smaltimento 1. Descrizione del prodotto ♦ Campo magnetico statico di 3 Tesla o meno discrezione del medico. ● Smaltire in modo adeguato tutti i materiali di imballaggio. L’occlusore per PFO HyperionTM è un dispositivo di occlusione autoespandente ♦ Campo magnetico con gradiente spaziale di 720 Gauss/cm o meno ♦ I pazienti devono essere sottoposti a terapia antiaggregante piastrinica/anticoagulante ad esempio con aspirina per 6 mesi dopo a doppio disco in maglia metallica di Nitinol. I 2 dischi sono collegati fra loro da ● Smaltire l’occlusore per PFO e gli accessori in base alle procedure standard per lo smaltimento dei rifiuti solidi con rischi biologici. un breve raccordo che permette il movimento di ciascun disco. Per aumentare 5. Precauzioni l’impianto. La decisione di continuare la profilassi antiaggregante la capacità di chiusura, i dischi contengono tessuto di poliestere. ● Manipolazione piastrinica/anticoagulante per più di 6 mesi è a discrezione del 8. Conservazione e data di scadenza medico. ● Conservare in un luogo fresco e asciutto a una temperatura di 0–30°C. L’occlusore per PFO HyperionTM e il sistema di applicazione sono 2. Indicazioni per l’uso L’occlusore per PFO HyperionTM PFO è un dispositivo percutaneo transcatetere per l’occlusione di tutti i tipi di PFO (classici o con aneurisma esclusivamente monouso. Non riutilizzare e non risterilizzare. ● Scelta delle dimensioni del dispositivo ♦ Per misurare la distanza dal difetto alla radice aortica con una vista ♦ Se si rileva una trombosi dal lato sinistro, occorre valutare lo stato ● L’occlusore per PFO HyperionTM è valido per tre anni. di ipercoaguabilità del paziente e iniziare eventualmente una terapia anticoagulante aggressiva. Se il paziente non risponde alla terapia 9. Scarico di responsabilità e limitazione di garanzia anticoagulante, considerare la trombolisi e la rimozione chirurgica. Le descrizioni o le specifiche contenute nei materiali stampati di Comed del setto) in pazienti con una storia di infarti o attacchi ischemici transitori a 30 gradi e la distanza dal difetto all’orifizio della vena cava (TIA) diagnosticati con ecocardiografia con shunting da destra a sinistra superiore da una vista a 90 gradi è necessario effettuare durante la manovra di Valsalva. un'ecocardiografia transesofagea (TEE) o un’ecocardiografia 6. Istruzioni per l’uso una descrizione generale del prodotto al momento della produzione, e non intracardiaca (ICE). ● I pazienti devono essere sottoposti a eparinizzazione totale durante comportano alcuna garanzia esplicita. Comed B.V. non è responsabile per i 3. Controindicazioni ● Presenza di un trombo nel punto previsto dell’impianto, o evidenza ♦ Determinare le dimensioni del dispositivo in modo che il raggio del disco atriale non superi la misurazione inferiore delle due, salvo documentata di trombo venoso nei vasi attraverso i quali si accede al il caso di aneurisma del setto atriale; in questo caso, si dovrà difetto. considerare di applicare un occlusore di dimensioni maggiori per ● Endocartite attiva o altre infezioni con produzione di batteremia. cercare di coprire l’aneurisma. Fare riferimento alla sezione 7.3 per ● Pazienti il cui sistema vascolare attraverso il quale si accede al difetto è la scelta del dispositivo. inadeguato per accogliere una guaina delle dimensioni necessarie. ● Anatomia in cui le dimensioni richieste del dispositivo PFO 08 ● Operazioni procedurali ♦ Si raccomanda di iniziare un trattamento con aspirina (3-5 mg/kg/ interferirebbero con altre strutture intracardiache o intravascolari, come giorno) (o un antiagglomerante piastrinico/anticoagulante alternative valvole o vene polmonari. se il paziente è intollerante all’aspirina) almeno 24 ore prima della B.V., inclusa questa pubblicazione, sono mirate esclusivamente a fornire l’intera procedura con dosaggi adeguati, in modo da mantenere l’ACT danni diretti, incidentali o indiretti derivanti dall’uso anomalo del prodotto. superiore a 200. ● Dopo la puntura percutanea della vena femorale, fare passare un catetere di diagnosi attraverso il PFO nell’atrio sinistro e introdurre un filo di guida di scambio “J” Nell’atrio sinistro. ● Fare passare il cavo di applicazione attraverso il caricature e avvitare il dispositivo sl cavo di applicazione. ● Una volta che il dispositivo è stato fissato al cavo, immergere il dispositivo e il caricature in una soluzione salina e tirare il dispositivo nel caricatore. ● Rimuovere il catetere lasciando in posizione il filo di guida. 09 ● Anatomía en la que el tamaño del dispositivo PFO le haría entrar en Español/Spanish Oclusor HyperionTM PFO Instrucciones de Uso antiplaquetario/anticoagulante alternativo si el paciente como válvulas o venas pulmonares. presenta intolerancia a la aspirina, al menos 24 horas antes del ● Pacientes que no pueden seguir una terapia antiplaquetaria o anticoagulante. ● Pacientes con estados hipercoagulables conocidos. Lea detenidamente las “Instrucciones de uso” antes del uso; los usuarios ● Pacientes con masa o vegetaciones intracardiacas, trombos o tumores. deberían recibir el tratamiento intervencionista por parte de profesionales o mediante la supervisión de los mismos. 4. Advertencias ● Los pacientes alérgicos al níquel podrían sufrir una reacción alérgica a ADVERTENCIA El contenido se suministra ESTÉRIL tras un proceso de esterilización con óxido de etileno. No utilizar si está dañada la barrera estéril. Si se encuentra algún daño, llame al representante de su empresa. Para un solo uso. No reutilizar, reprocesar ni reesterilizar. La reutilización, ♦ Se recomienda comenzar a tomar aspirina (3-5 mg/kg/día), o un contacto con otras estructuras intracardiacas o intravasculares, tales este dispositivo. ● El oclusor HyperionTM PFO debería ser utilizado por médicos que hayan recibido formación en técnicas de cierre de defectos mediante transcatéter. ● Los médicos deben estar preparados para afrontar situaciones procedimiento. ♦ Se debe realizar una administración periprocedimiento de antibióticos. ♦ Los pacientes deberían estar heparinizados por completo a lo largo ecocardiografía intracardiaca (EIC) como ayuda para la colocación del oclusor PFO. Si se utiliza una ETE, la anatomía esofágica del paciente debe ser adecuada para la manipulación de la sonda ETE. ♦ Durante la colocación del dispositivo se utiliza una guía disponibilidad de un cirujano in situ. ♦ No soltar el oclusor PFO del alambre de colocación si el dispositivo no se ajusta a la configuración original o si la posición del dispositivo generar un riesgo de contaminación del dispositivo y/o provocar una las funciones cardiacas más importantes. Los dispositivos embolizados es inestable. Recuperar el dispositivo y colocarlo de nuevo. Si esto infección cruzada, lo que incluye, pero no se limita a la transmisión de no se deberían retirar a través de estructuras intracardíacas a menos todavía no resulta satisfactorio, recuperar el dispositivo y sustituirlo ● Condicional a RM Una vez utilizado, eliminar el producto y el embalaje de acuerdo con la En ensayos preclínicos se ha demostrado que los dispositivos Hyperion política hospitalaria, administrativa y/o gubernamental local. son condicionales a RM en ciertas condiciones. Un paciente que tenga implantado un dispositivo Hyperion puede someterse a exploraciones la aurícula izquierda. La posición correcta de la vaina de colocación se Una vez colocada en posición satisfactoria, retirar el alambre guía e podría causar lesiones, enfermedades o incluso la muerte del paciente. paciente. de que se introduzca en la aurícula izquierda. ● Hacer avanzar la vaina sobre el alambre guía a través del PFO hasta comprueba mediante una inyección de prueba de medio de contraste. ponderar frente a las potenciales ventajas de esta técnica. que se hayan contraído adecuadamente dentro de la vaina. flujo retrógrado purgue todo el aire del sistema. ● Conectar la válvula de hemostasis e irrigarla con una jeringuilla antes fluoroscópica de rayos X. El riesgo que conlleva el incremento de que provocan compromisos hemodinámicos críticos. Esto incluye la ● No utilizar si la barrera estéril se ha visto afectada de algún modo. mediante el mecanismo de bloqueo. Introducir el conjunto dilatador/ la vena cava inferior, retirar el dilatador para permitir que el sangrado de ♦ Se requiere una ecocardiografía transesofágica (ETE) o una estructural del dispositivo y/o provocar un fallo del mismo, que a su vez dispositivo podría provocar lesiones, enfermedades o incluso la muerte del ● Insertar el dilatador en la vaina de colocación y fijarlo a la misma vaina de colocación. Una vez que la vaina de dilatación haya alcanzado la exposición a rayos X para las pacientes embarazadas se debe enfermedades infecciosas de un paciente a otro. La contaminación del del dispositivo para introducirlo en el cargador ● Retirar el catéter dejando colocado el alambre guía. mantener un ACT mayor de 200. de urgencia que requieran la retirada de dispositivos embolizados ● Los dispositivos embolizados se deben retirar, ya que podrían afectar a seguridad, sumergir el dispositivo y el cargador en solución salina y tirar del procedimiento, utilizando la dosificación adecuada para el reprocesamiento o la reesterilización podrían comprometer la integridad La reutilización, el reprocesamiento o la reesterilización también podrían dispositivo en el alambre. ● Una vez que el dispositivo está acoplado al alambre en condiciones de por otro nuevo. ♦ Se deberá tener cuidado en no atrapar redes de Chiari de aurícula derecha o válvulas de Eustaquio grandes bajo el lado auricular derecho del dispositivo. ● Post implante ♦ Los pacientes deberán realizar una profilaxis anti-endocarditis irrigar la vaina con solución salina. ● Introducir el cargador en la vaina de colocación. Hacer avanzar el dispositivo hacia el interior de la vaina empujando (no girando) el alambre de colocación. ● Mediante guía fluoroscópica y endocardiográfica, desplegar el disco auricular izquierdo tirando firmemente contra el septo auricular, lo que se puede notar y observar a través de la ecocardiografía. ● Con una suave tensión en el cable de colocación, tirar de la vaina hacia atrás para desplegar el disco auricular derecho. Asegurar la posición segura a través del foramen oval patente, que se puede observar mediante ecocardiografía. 1. Descripción del producto sin peligro inmediatamente después de la implantación si se cumplen adecuada durante los seis meses posteriores al implante del El oclusor HyperionTM PFO es un dispositivo de oclusión de malla de nitinol las siguientes condiciones: dispositivo. La decisión de continuar con la profilaxis anti- encuentre cerca del disco auricular derecho y administrar una inyección de disco doble autoexpandible. Los dos discos están conectados por ♦ Campo magnético estático de 3T o inferior endocarditis transcurridos los seis meses corresponderá al médico. de medio de contraste para confirmar la posición correcta. una corta cintura que permite el libre movimiento de cada disco. A fin de ♦ Campo magnético de gradiente espacial de 720G/cm o inferior deberían ser tratados con una terapia antiplaquetaria/anticoagulante 7. Eliminación a base p. ej. de aspirina. La decisión de continuar con la terapia ● Eliminar debidamente todos los materiales de embalaje. ● Manejo antiplaquetaria/anticoagulante transcurridos los seis meses ● Eliminar el oclusor PFO y los accesorios siguiendo procedimientos 2. Indicaciones de uso El oclusor HyperionTM PFO y el sistema de colocación están concebidos El oclusor HyperionTM PFO es un dispositivo de oclusión transcatéter para un solo uso. No reutilizar ni reesterilizar. percutánea concebido para cerrar todo tipo de PFO (es decir, clásicos o con aneurisma del septo) en pacientes con historial de accidente ♦ Durante los seis meses posteriores al implante, los pacientes 5. Precauciones incrementar su capacidad de cierre, los discos contienen una fina tela de poliéster. ● Elección del tamaño del dispositivo ♦ Para medir la distancia entre el defecto y el origen de la aorta en la corresponderá al médico. si el paciente se encuentra en un estado hipercoagulable e iniciar 8. Almacenamiento y fecha de caducidad una terapia anticoagulante agresiva. Se debería considerar una ● Almacenar en un lugar fresco y seco a una temperatura de 0–30 °C. ● La fecha de caducidad del oclusor HyperionTM PFO es de tres años. vista de 30 grados y entre el defecto y el orificio de la vena cava trombolisis y la retirada mediante cirugía si el paciente no responde mediante ecocardiografía con derivación de izquierda a derecha durante la superior en la vista bicava de 90 grados se requiere una a la terapia anticoagulante. maniobra de Valsalva. ecocardiografía transesofágica (ETE) o una ecocardiografía intracardiaca (EIC). ♦ El tamaño del dispositivo ha de ser tal que el radio del disco auricular 9. Restricción de garantía y de recurso legal 6. Instrucciones de uso Las descripciones o las especificaciones del material impreso de Comed ● Los pacientes deberían estar heparinizados por completo a lo largo del B.V., inclusive la presente publicación, están concebidas únicamente para derecho no supere la menor de las dos medidas, salvo en el caso procedimiento, utilizando la dosificación adecuada para mantener un describir de forma general el producto en el momento de su fabricación y documentada de trombos venosos en los vasos a través de los que se de un aneurisma del septo auricular, en el que se debería tener ACT mayor de 200. no constituyen ninguna garantía expresa. Comed B.V. no se responsabiliza accede al defecto. en consideración la colocación de un oclusor de mayor tamaño ● Presencia de trombos en el lugar previsto para el implante, o prueba ● Tras la punción percutánea de la vena femoral, pasar un catéter de ● Endocarditis activa u otras infecciones que produzcan bacteremia. para tratar de cubrir el aneurisma. Consultar la sección 7.3 para la diagnóstico a través del PFO hasta la aurícula izquierda e introducir en ● Pacientes cuya vasculatura a través de la cual se accede al defecto sea elección del dispositivo. esta un nuevo alambre guía en «J». inadecuada para alojar el tamaño de vaina apropiado. 10 estándar de residuos sólidos de riesgo biológico. ♦ Si se identifica un trombo en el lado izquierdo, se deberá evaluar cerebrovascular o ataques isquémicos transitorios (AIT) diagnosticados 3. Contraindicaciones ● Confirmar la colocación correcta. Hacer avanzar la vaina hasta que se ● Procedimiento de ningún daño directo, indirecto o incidental que sea resultado del uso anómalo del producto. ● Pasar el alambre de colocación a través del cargador y enroscar el 11 anatomie patiënt. Nederlands/Dutch TM Hyperion PFO Occluder Handleiding Lees deze “handleiding” vóór gebruik zorgvuldig door. Dit product is uitsluitend bestemd voor toepassing door artsen die beschikken over passende ervaring met interventiebehandelingen of die zich laten bijstaan door specialisten. ♦ Periprocedurele toediening van antibiotica. ● Patiënten met geschiedenis van hypercoagulabiliteit. ♦ Volledige heparinisatie gedurende de gehele procedure met ● Patiënten met intracardiale massa of vegetatie, trombus of tumor. linkeratrium. Verifieer de juiste positionering van de plaatsingskatheter occluder. Bij gebruik van TEE moet de esofagale anatomie van de middels een testinjectie met een contrastmiddel. Verwijder na verificatie patiënt geschikt zijn voor het plaatsen en bewegen van de TEE- van de juiste positie de voerdraad en spoel de katheter door met ontstaan op dit product. ● De HyperionTM PFO Occluder mag alleen worden toegepast door artsen die voldoende geoefend zijn in transkatheter technieken voor het sluiten ● Als arts dient u rekening te houden met mogelijk urgente situaties, In die gevallen moet het product worden verwijderd. Daarom zal er ter gebruikt. Neem in dat geval contact op met uw vertegenwoordiger. Het plekke een chirurg aanwezig moeten zijn. ● Een geëmboliseerde prothese moet worden verwijderd om verstoring sonde. ♦ De plaatsing van de prothese vindt plaats onder doorlichting. Het risico van verhoogde blootstelling aan röntgenstraling voor zwangere patiënten moet worden afgewogen tegen de potentiële voordelen van deze techniek. ♦ De PFO-occluder mag niet worden ontkoppeld als de prothese niet overeenstemt met de oorspronkelijke configuratie of als de positie ervan instabiel is. Haal in dat geval de occluder terug en plaats hersterilisatie is niet toegestaan. De structurele integriteit van het product van vitale hartfuncties te voorkomen. Een geëmboliseerde prothese hem opnieuw. Gebruik een nieuw exemplaar als het resultaat kan dan niet worden gewaarborgd en er kunnen defecten optreden die mag alleen opgevouwen binnen de katheter worden teruggehaald via onvoldoende blijft. van het product en/of (kruis)besmetting van de patiënt, waaronder ook infecties die worden overgedragen van patiënt op patiënt. Contaminatie van de katheter op te voeren tot in het linkeratrium. ● Schuif de katheter over de voerdraad door de PFO en in het echocardiografie (ICE) is nodig bij het plaatsen van de PFO- zoals prothese-embolisatie met kritieke hemodynamische gevolgen. is er bij hergebruik, opwerking of hersterilisatie gevaar voor contaminatie terug te laten vloeien en alle lucht uit de verbinding te laten ontsnappen. ● Sluit de hemostaseklep aan en spoel door met een injectiespuit alvorens ● Bij patiënten die allergisch zijn voor nikkel kan een allergische reactie Bij beschadiging van de steriele barrière mag het product niet worden letsel, ziekte of overlijden van de patiënt tot gevolg kunnen hebben. Voorts plaatsingskatheter in de vena cava inferior de dilatator om het bloed 4. Waarschuwingen De inhoud van de verpakking is GESTERILISEERD met ethyleenoxide. product is voor toepassing bij slechts één patiënt. Hergebruik, opwerking of voldoende dosis om ACT boven 200 te houden. ♦ Transoesofagale echocardiografie (TEE) of intracardiale van defecten. WAARSCHUWING andere anti-aggregantia / -coagulantia worden gebruikt. ● Patiënten met intolerantie voor anti-aggregantia of anticoagulantia. intracardiale structuren. ● Het product mag niet worden gebruikt als de steriele barrière op enigerlei manier is verbroken. ● MRI-veilig onder bepaalde voorwaarden ♦ Let op dat een Chiari-netwerk of prominente klep van Eustachius in het rechteratrium niet beklemd raakt onder de proximale schijf van in de katheter door de plaatsingsdraad te duwen (niet draaien). ● Ontvouw onder doorlichting en met TEE de distale schijf door deze stevig tegen het atriale septum aan te trekken. Dit is voelbaar en op het TEE zichtbaar. ● Houd de plaatsingsdraad strak en trek de katheter terug om de proximale schijf te ontvouwen. Controleer op het TEE of de prothese de PFO volledig afsluit. ● Bevestig correcte plaatsing. Schuif de katheter op tot dichtbij de proximale schijf en controleer met contrastmiddel op correcte positionering. de prothese. ● Post-implantatie ♦ Toediening endocarditisprofylaxe gedurende zes maanden na het product kan letsel, ziekte of overlijden van de patiënt tot gevolg hebben. In niet-klinische tests is aangetoond dat Hyperion-hulpmiddelen Verwijder product en verpakking na gebruik volgens de ziekenhuis- en onder bepaalde voorwaarden MRI-veilig zijn. Een patiënt met een implantatie van de prothese. Voortzetting van endocarditisprofylaxe overheidsvoorschriften en/of plaatselijke regelgeving. geïmplanteerd Hyperion-hulpmiddel kan onmiddellijk na plaatsing na zes maanden naar oordeel van arts. van het hulpmiddel onder de volgende omstandigheden veilig worden zoutoplossing. ● Introduceer de lader in de plaatsingskatheter. Schuif de prothese verder 7. Verwijdering ● Verwijder al het verpakkingsmateriaal op de voorgeschreven wijze. ● PFO-occluder en toebehoren verwijderen overeenkomstig de standaardvoorschriften voor biologisch gevaarlijke vaste afvalstoffen. ● De patiënt dient tot zes maanden na de operatie te worden 1. Productbeschrijving gescand: behandeld met anti-aggregantia / anticoagulantia, zoals 8. Opslag en houdbaarheid De HyperionTM PFO Occluder is een zelfexpanderend product van ♦ Statisch magneetveld van 3 Tesla of minder aspirine. Voortzetting van de behandeling met anti-aggregantia / ● Bewaren op een koele, droge plaats bij 0–30°C. nitinolgaas met twee schijven. Beide schijven zijn met elkaar verbonden via ♦ Ruimtelijke-gradiëntmagneetvelden van 720 Gauss/cm of minder anticoagulantia na zes maanden naar oordeel van arts. ● De houdbaarheidstermijn van HyperionTM PFO Occluder is drie jaar. ♦ Bij vaststelling van een trombus links moet de patiënt worden een korte mantel en kunnen vrij bewegen ten opzichte van elkaar. Voor een betere sluiting bevatten de schijven dun polyester weefsel. 5. Voorzorgsmaatregelen onderzocht op hypercoagulabiliteit en moet een agressieve 9. Afwijzing van garantie en aansprakelijkheid ● Verwerking behandeling met anticoagulantia worden gestart. Indien de De beschrijvingen en specificaties in drukwerk van Comed B.V., zoals deze 2. Indicatie De HyperionTM PFO Occluder en het plaatsingssysteem zijn bestemd behandeling met anticoagulantia geen uitwerking heeft, dienen uitgave, zijn uitsluitend bedoeld als algemene informatie over het product De HyperionTM PFO Occluder is een percutane, transkatheter voor eenmalig gebruik. Hergebruik of hersterilisatie zijn derhalve niet trombolyse en operatieve verwijdering te worden overwogen. op het moment van vervaardiging en houden geen uitdrukkelijke garantie occlusieprothese voor sluiting van alle soorten patente foramen ovale (PFO), toegestaan. zowel klassieke vormen als die met aneurysma van het septum, bij patiënten met een anamnese van beroerte of TIA die middels echocardiografie zijn ● Bepaling van de maat van de prothese ♦ Transoesofageale endocardiografie (TEE) of intracardiale gediagnosticeerd met rechts-links shunt tijdens uitvoering van de Valsalva- echocardiografie (ICE) is nodig voor meting van de afstand van het manoeuvre. defect tot de aortawortel in een 30º beeld, en de afstand van het defect tot de monding van de vena cava superior in een bicavaal 3. Contra-indicaties ● Trombus ter plaatse van de beoogde implantatie of gedocumenteerd 90º beeld. ♦ Kies een zodanige maat dat de radius van de proximale schijf niet bewijs van veneus trombus in de vaten die toegang verlenen tot het groter is dan de kleinste van beide gevonden maten, behalve bij een defect. atriaal septaal aneurysma, in welk geval voor een grotere occluder ● Actieve endocarditis of andere infecties die bacteriëmie veroorzaken. zou kunnen worden gekozen met het oog op het aneurysma. Zie ● Het vaatstelsel dat toegang tot het defect moet verlenen, is niet geschikt onder 7.3 voor occluder-keuze. voor een plaatsingskatheter met de aangewezen diameter. ● Interferentie van PFO-prothese met andere intracardiale of intravasculaire elementen, zoals kleppen of longaders, vanwege 12 ● Procedureel ♦ in. Comed B.V. is niet aansprakelijk voor enige rechtstreekse, incidentele of 6. Procedure gevolgschade die voortkomt uit een onjuist gebruik van het product. ● Volledige heparinisatie gedurende de gehele procedure met voldoende dosis om ACT boven 200 te houden. ● Voer na percutane punctie van de V. femoralis een diagnostische katheter door de PFO in het linkeratrium en breng een “J”-voerdraad in het linkeratrium. ● Haal de plaatsingsdraad door de lader en schroef de occluder vast aan de plaatsingsdraad. ● Dompel de lader samen met de stevig aangeschroefde prothese onder in een zoutoplossing en trek de prothese in de lader. ● Verwijder de katheter en laat de voerdraad op zijn plaats. ● Schuif de dilatator in de plaatsingskatheter en maak hem vast aan de Aanbevolen wordt de patiënt ten minste 24 uur voor de procedure katheter met de vergrendeling. Introduceer de samenstelling van aspirine toe te dienen (3-5 mg/kg/dag); bij intolerantie kunnen dilatator en plaatsingskatheter. Verwijder bij aankomst van de 13 Português/Portuguese Oclusor PFO HyperionTM Instruções de Uso dia) (ou uma alternativa antiplaquetária/anticoagulante se o paciente é com outras estruturas intracardíacas ou intravasculares, tais como intolerante à Aspirina) pelo menos 24 horas antes do procedimento. ● Remova o cateter deixando o fio-guia no lugar. ♦ Os antibióticos devem ser administrados de maneira periprocedimental. ● Insira o dilatador no interior da bainha de entrega e trave-o na bainha ♦ Os pacientes devem ser completamente heparinizados durante com o mecanismo de travamento. Introduza o conjunto dilatador/bainha todo o procedimento utilizando dosagem adequada, de modo a de entrega. Assim que a bainha de entrega alcançar a veia cava inferior, manter o tempo ativo de coagulação acima de 200. remova o dilatador para permitir o retorno do sangramento para purgar válvulas ou veias pulmonares. ● Pacientes impossibilitados de seguir uma terapia antiplaquetária ou anticoagulante. ● Pacientes com estados conhecidos de hipercoagulabilidade. Leia atentamente as "Instruções de uso" antes de usar o produto, os ● Pacientes com massa ou vegetação, trombo ou tumor intracardíacos. ♦ Um ecocardiograma transesofágico (ETE) ou intracardíaco (EIC) é necessário como suporte na implantação do oclusor PFO. Se usuários devem ter recebido treinamento sobre este tipo de procedimento ou receber a orientação de profissionais AVISO Conteúdo ESTERILIZADO através de um processo de esterilização por óxido de etileno. Não usar se a barreira de proteção estéril estiver danificada. Se a embalagem estiver danificada entre em contato com o representante da 4. Avisos for utilizado um ETE, a anatomia esofágica do paciente deve ser ● Pacientes que são alérgicos ao níquel podem ter uma reação alérgica a adequada para o posicionamento e a manipulação da sonda de esta prótese. ● O oclusor PFO HyperionTM só deve ser usado por médicos treinados em ● Os médicos devem estar preparados para lidar com situações de urgência que exijam a remoção de próteses embolizadas que resultem Somente para uso em um único paciente. Não reutilizar, reprocessar ou em comprometimento hemodinâmico crítico. Isto inclui a presença de esterilização podem comprometer a integridade estrutural da prótese e/ou perturbar funções cardíacas críticas. Próteses embolizadas não devem doença ou morte do paciente. A reutilização, o reprocessamento ou uma ser retiradas por meio de estruturas intracardíacas a menos que tenham nova esterilização também podem criar um risco de contaminação da sido adequadamente recolhidas no interior da bainha. restringindo a, transmissão de doença(s) infecciosa(s) de um paciente para outro. A contaminação da prótese pode causar lesão, doença ou morte do ● Condicional para RM situação é ainda insatisfatória, recupere a prótese e substitua-a com uma nova prótese. ♦ Devem ser adotados cuidados especiais para não prender a rede de Chiari no átrio direito ou válvulas de Eustáquio proeminentes sob o lado atrial direito da prótese. ● Pós-implante ♦ de teste do meio de contraste. Assim que ela estiver em posição satisfatória, remova o fio-guia e lave a bainha com solução salina. instável. Recupere a prótese e implemente novamente. Se a dano. posição correta da bainha de entrega é verificada por uma injeção ● Introduza o carregador na bainha de entrega. Avance a prótese na adequa à configuração original ou se a posição da prótese é ● Não usar se a barreira de proteção estéril tiver sofrido qualquer tipo de no átrio esquerdo. ● Avance a bainha sobre o fio-guia através do PFO e no átrio esquerdo. A pacientes que estão grávidas devem ser pesados contra os potenciais benefícios desta técnica. um cirurgião no local da implantação. todo o ar do sistema. ● Conecte a válvula hemostática e lave com uma seringa antes de entrar X fluoroscópicos. O risco de ampla exposição a raios X para ● Não libere o oclusor PFO do cabo de entrega se a prótese não se ● Próteses embolizadas devem ser removidas, uma vez que podem provocar uma falha da prótese que, por sua vez, pode resultar em lesão, prótese e/ou causar infecção ou infecção cruzada, incluindo, mas não se ETE. ♦ Durante a colocação da prótese é utilizada a orientação por raios técnicas de fechamento do defeito com transcateter. empresa. esterilizar novamente. A reutilização, o reprocessamento ou uma nova carregador. ● Anatomia na qual o tamanho necessário da prótese PFO iria interferir Após o implante da prótese os pacientes devem seguir uma profilaxia bainha, empurrando (não girando) o cabo de entrega. ● Sob orientação fluoroscópica e ecocardiográfica, implante o disco do átrio esquerdo, puxando-o firmemente contra o septo atrial, que pode ser sentido e observado através de ecocardiografia. ● Com uma tensão suave no cabo de entrega, puxe a bainha de volta para implantar o disco do átrio direito. Garanta uma posição segura em todo o forame oval patente (FOP), que pode ser observado pela ecocardiografia. ● Confirme o posicionamento correto. Avance a bainha para perto do disco do átrio direito e administre uma injeção de meio de contraste para confirmar a posição correta. paciente. Ao longo de testes não clínicos, os dispositivos Hyperion mostraram Após o uso, descarte os produtos e embalagens segundo as normas ser Condicional para RM. Um doente com um dispositivo Hyperion apropriada para endocardite por seis meses. A decisão de continuar hospitalares, administrativas e governamentais locais. implantado pode ser submetido com segurança a este exame a profilaxia para endocardite por um período superior a 6 meses fica 7. Descarte imediatamente depois da colocação do dispositivo, nas seguintes a critério do médico. ● Descarte todos os materiais de embalagem conforme apropriado. Os pacientes devem ser tratados com terapia antiplaquetária/ ● Descarte o oclusor PFO e os acessórios segundo os procedimentos 1. Descrição do produto condições: O oclusor PFO HyperionTM é uma prótese de oclusão autoexpansível de ♦ Campo magnético estático de 3 Tesla ou menos anticoagulação, tais como com Aspirina, por 6 meses após o implante. malha de nitinol de duplo disco. Os dois discos estão conectados ♦ Campo magnético gradiente espacial de 720 G/cm ou menos A decisão de continuar a terapia antiplaquetária/anticoagulação por um período superior a 6 meses fica a critério do médico. por uma pequena cintura permitindo a movimentação livre de cada disco. Para aumentar sua habilidade de fechamento os discos contêm um tecido 5. Precauções fino de poliéster. ● Manuseio 2. Indicações de uso O oclusor PFO HyperionTM é um transcateter de oclusão percutânea projetado para fechar todos os tipos de PFOs (por ex.: clássicos bem como os com ♦ ● Se for identificado um trombo do lado esquerdo o paciente deve ser avaliado para um estado de hipercoagulabilidade e deve-se padrão de descarte de resíduos de risco biológico. 8. Armazenamento e data de validade ● Armazenar em local fresco e seco, com temperatura entre 0–30°C. ● O prazo de validade do oclusor PFO HyperionTM é de três anos. O oclusor PFO HyperionTM e o sistema de liberação destinam-se iniciar uma terapia anticoagulante agressiva. Trombólise e remoção exclusivamente a uso único. Não reutilizar ou esterilizar novamente. cirúrgica devem ser consideradas se o paciente não reagir à terapia 9. Isenção de responsabilidades da garantia e limitação de reparação anticoagulante. As descrições ou as especificações no material impresso pela Comed B.V., ● Seleção do tamanho da prótese ♦ Um ecocardiograma transesofágico (ETE) ou intracardíaco (ICE) é incluindo esta publicação, são destinadas exclusivamente para descrever aneurisma do septo) em pacientes com história de derrame ou ataque necessário para medir a distância entre o defeito para a raiz da 6. Instruções de uso o produto em geral, no momento da fabricação e não constituem quaisquer vascular cerebral isquêmico transitório (AITs) diagnosticado por ecocardiografia aorta na visualização de 30º e a distância a partir do defeito até o ● Os pacientes devem ser completamente heparinizados durante todo garantias expressas. A Comed B.V. não se responsabiliza por quaisquer com shunt da direita para a esquerda durante a manobra de Valsalva. orifício superior da veia cava na visualização de 90º. ♦ A mensuração da prótese deve ser feita de modo que o raio do 3. Contraindicações disco atrial direito não exceda a menor das duas medições, exceto ● Presença de trombos no local pretendido para implante ou evidência no caso de um aneurisma do septo interatrial, onde se deve levar documentada de trombos venosos nos vasos através dos quais se em consideração a colocação de um oclusor maior, em um esforço obtém o acesso ao defeito. para cobrir o aneurisma. Consulte a seção 7.3 para a seleção da prótese. ● Endocardite ativa ou outras infecções que produzem bacteremia. ● Pacientes cuja vasculatura, através da qual se obtém o acesso ao defeito, é inadequada para acomodar o tamanho apropriado da bainha. 14 ● Procedimentos ♦ Recomenda-se iniciar a administração de Aspirina (3-5 mg/kg/ o procedimento utilizando dosagem adequada, de modo a manter o danos diretos, incidentais ou consequentes resultantes do uso anormal do tempo ativo de coagulação acima de 200. produto. ● Após a punção percutânea da veia femoral, passe um cateter de diagnóstico através do PFO para o átrio esquerdo e introduza um fioguia com ponta em "J". no átrio esquerdo ● Passe o cabo de entrega através do carregador e aparafuse a prótese ao cabo de entrega. ● Assim que a prótese estiver conectada firmemente ao cabo, mergulhe o aparelho e o carregador em solução salina e posicione a prótese no 15 ● Patienter med känt hyperkoagulerade tillstånd. Svenska/Swedish HyperionTM PFO ocklusionsanordning Användningsinstruktioner Läs igenom "Användningsinstruktioner" noggrant före användning. Användaren måste känna till hur interventionell behandling går till eller guidas av sjukvårdspersonal ● Patienter med intrakardiell massa eller vegetation, trombos eller tumör. anordningen. Riskenför ökad röntgenexponering för gravida patienter måste vägas mot de potentiella fördelarna med tekniken. 4. Varningar ♦ Lösgör inte PFO kännas och observeras via ekokardiografi. ● Med lätt spänning på införingskabeln, dra tillbaka hylsan för placering av höger atrial skiva. Säkerställ säker position tvärs över patent foramen ovale, vilket kan observeras via ekokardiografi. ● Patienter med nickelallergi kan reagera allergiskt mot denna anordning. ocklusionsanordningen från införingskabeln om anordningen inte ● Bekräfta korrekt placering. För in hylsan nära höger atrial skiva och ge ● HyperionTM PFO ocklusionsanordning får endast användas av läkare återtagit sin ursprungliga form eller om anordningen sitter ostadigt. en injektion kontrastmedel för att bekräfta korrekt position. med utbildning inom kateterburen slutning av defekter. ● Läkare måste vara beredda att hantera akuta situationer som kräver att emboliserade anordningar avlägsnas. Detta innebär att en kirurg måste finnas tillgänglig på den opererande institutionen. VARNING ♦ Guidning med röntgengenomlysning används under placeringen av ● Emboliserade anordningar måste avlägsnas eftersom de kan störa Innehållet levererat STERILT med etylenoxid steriliseringsprocess. Använd livsviktiga kardiella funktioner. Emboliserade anordningar får inte dras inte om sterilbarriären är skadad. Om en skada upptäckts, ring företagets tillbaka genom intrakardiella strukturer utan att först ha kollaberats representant. ordentligt i hylsan. Får endast användas på en patient. Får inte återanvändas, ombearbetas ● Använd inte om sterilbarriären är eller omsteriliseras. Återanvändning, ombearbetning eller omsterilisering ● MR Conditional Ta ut anordningen och placera den på nytt. Om tillfredsställande resultat fortfarande inte kan uppnås ska anordningen tas ut och 7. Kassering ersättas med en ny. ● Kassera allt förpackningsmaterial på lämpligt sätt. ♦ Kontrollera att höger atrial chiari nätverk eller stora eustachian klaffar inte fångas under höger atrial sida av anordningen. ● Kassera PFO ocklusionsanordning och tillbehör i enlighet med gängse metoder för kassering av avfall med biologisk risk. ● Post implantation ♦ Patienten ska erhålla adekvat endokardioprofylax under 6 månader 8. Förvaring och bästföredatum efter implantation av anordningen. Beslut om fortsatt ● Förvara på en sval, torr plats med en temperatur mellan 0–30°C. endokarditprofylax efter 6 månader fattas av läkaren. ● Bästföredatumet för HyperionTM PFO ocklusionsanordning är tre år. ♦ Patienter bör erhålla behandling med antiplatelet/antikoagulatia, som kan äventyra anordningens strukturella integritet och/eller leda till att Vid icke-klinisk testning har Hyperion-anordningar visats vara MR- aspirin, under 6 månader efter implantationen. Beslut om ev. fortsatt 9. Friskrivningsklausul för garanti och ansvarsbegränsning anordningen slutar fungera, vilket i sin tur kan orsaka skada på patienten, säkra under förutsättning att vissa villkor är uppfyllda. En patient med behandling med antiplatelet/antikoagulatia efter 6 månader fattas av Beskrivningar och specifikationer i trycksaker från Comed B.V., inklusive sjukdom eller dödsfall. Återanvändning, ombearbetning eller omsterilisering en implanterad Hyperion-anordning kan, under följande förhållanden, läkaren. denna publikation, är endast avsedda att ge en allmän beskrivning av kan även medföra risk för att anordningen kontamineras och/eller orsaka skannas utan risk omedelbart efter inplacering av anordningen: patientinfektion eller korsinfektion, inklusive men inte begränsat till ♦ Statiskt magnetfält på högst 3T avseende hyperkoagulerat tillstånd och aggressiv antikoagulant garantier. Comed B.V. påtar sig inget ansvar för direkta skador, indirekta överföring av infektös sjukdom från en patient till en annan. Kontamination ♦ Spatial magnetfältsgradient på högst 720G/cm skadad. behandling bör påbörjas. Trombolys och kirurgiskt avlägsnande bör skador eller följdskador till följd av onormal användning av produkten. Efter användning, kassera produkten och förpackningen i enlighet med 5. Försiktighetsåtgärder sjukhusets, förvaltningens och/eller lokala myndigheters policyn. ● Hantering HyperionTM PFO ocklusionsanordning och införingssystemet är HyperionTM PFO ocklusionsanordning är en självexpanderade ocklusionsanordning med dubbelskiva av nitinolnät. De 2 skivorna förbinds engångsprodukter. Får inte återanvändas eller omsteriliseras. ● Val av storleken på anordningen ♦ Transesophageal ekokardiografi (TEE) eller intrakardiell av en kort midja som gör att varje skiva kan röra sig fritt. För att öka ekokardiografi (ICE) krävs för att mäta avståndet från defekten till slutningsförmågan innehåller skivorna tunn polyesterväv. aortaroten med 30 graders vy, och avståndet från defekten till den övre hålvenens mynning med 90 graders vy. 2. Indikationer för användning ♦ Mät storleken på anordningen så att radien av höger artiell skiva inte 6. Användningsinstruktioner ● Patienter ska vara helt hepariniserade under hela ingreppet med en lämplig dosering för att hålla ACT över 200. ● Efter perkutan punktion av den femorala venen, för en diagnoskateter genom PFO in i vänster atrium och för in en "J"-ledare för byte i vänster atrium. ● För in införingskabeln genom laddaren och skruva fast enheten på införingskabeln. ● När anordningen sitter fast ordentligt på kabeln, sänk ner anordningen HyperionTM PFO ocklusionsanordning är en perkutan, kateterburen överskrider den mindre av de två mätningarna, förutom vid en ocklusionsanordning avsedd att sluta alla typer av PFO (dvs. klassiska atrial septal aneurysm, där man bör överväga att placera en större ● Avlägsna katetern genom att lämna ledaren på plats. liksom de med aneurysm av septum) hos patienter med en historik av ocklusionsanordning för att försöka täcka aneurysmen. Se vidare i ● För in dilatorn i införingshylsan och säkra hylsan med låsmekanismen. stroke eller transitoriska ischemiska attacker (TIA) diagnostiserade av avsnitt 7.3 för val av anordning. ekokardiografi med höger-till-vänstershunt under Valsalva maneuver. ● Förfarande ♦ Vi rekommenderar att aspirin (3-5 mg/kg/dag) (eller alternativt 3. Kontraindikationer ● Förekomst av tromb på implantationsstället eller dokumenterade belägg för venös tromb i de kärl, genom vilka tillträde till defekten erhålls. ● Aktiv endokardit eller andra infektioner som producerar bacteremia. ● Patienter vars kärl, genom vilka tillträde till defekten erhålls, inte rymmer lämplig hylsstorlek. ● Anatomi där den storlek på PFO-anordningen som krävs skulle störa 16 antiplatelet/antikoagulant om patienten inte tål aspirin) påbörjas minst 24 timmar före ingreppet. ♦ Antibiotika ska ges periproceduralt. ♦ Patienter ska vara helt hepariniserade under hela ingreppet med en lämplig dosering för att hålla ACT över 200. ♦ Transesophageal ekokardiografi (TEE) eller intrakardiell ekokardiografi (ICE) krävs som en hjälp vid placering av PFO andra intrakardiella eller intravaskulära strukturer, som klaffar eller ocklusionsanordningen. Om TEE används måste patientens pulmonella vener. matstrupsanatomi vara lämplig för placering och manipulering av ● Patienter som inte klarar av antiplatelet eller antikoagulant behandling. produkten vid tidpunkten för tillverkningen och utgör inte några uttryckliga övervägas om patienten inte reagerar på antikoagulant behandling. av anordningen kan leda till skada, sjukdom eller att patienten dör. 1. Produktbeskrivning ♦ Om trombos identifieras på vänster sida bör patienten bedömas TEE-sonden. och laddaren i saltlösning och dra in anordningen i laddaren. För in dilatorn/införingshylsenheten. När införingshylsan har nått inferior vena cava, avlägsna dilatorn för att tillåta backblodflöde för att tömma systemet på all luft. ● Anslut hemostasventilen och spola med en spruta före införing i vänster atrium. ● För in hylsan över ledaren genom PFO och in i vänster atrium. Införingshylsans korrekta position bekräftas genom att kontrastmedel injiceras på prov. När positionen är tillfredsställande, avlägsna ledaren och spola hylsan med saltlösning. ● För in laddaren i införingshylsan. För in anordningen i hylsan genom att skjuta (inte vrida) införingskabeln. ● Under genomlysning och ekokardiografisk guidning, placera vänster atriala skiva genom att dra ordentligt mot atrial septum, vilket kan 17 COMED B.V. Abe Lenstra Boulevard 36, 8448 JB Heerenveen, The Netherlands Tel.: +31 515-573399 Email: [email protected] Website: www.comedbv.com 18 LS1617-013MUL.03
© Copyright 2026