AE 003107
Instituto Nacional de Ecología
Libros INE
AE 003107
CLASIFICA CION
TOMO
I
1111111 11111
III
111111 11111 11111 11111 11111 11111 1111 1111
AE 003107
t
~~
.o
-. .
SECRETARIA DE SALUBiI~l : ~SkSTENCIA~~
_ . .
e{ ` . .' .
k9
_ __ ~
~.. .~ ..~
-,,/~,;
r
/-'
SUBSECRETARIA DE MEJORAMIENTO DEL AMBIENTE
DIRECCION GENERAL DE INVESTIGACION DE LOS EFECTOS DEL AMBIENTE
EN LA SALUD
SUBDIRECCION DE COORDINACION DE LABORATORIOS
Dr . Mario Calles López Negrete
Secretario de Salubridad y Asistencia
Dr . Y Lic . Manuel López Portillo y Ramos
Subsecretario de Mejoramiento del Ambiente
Dr . Guillermo S . Díaz Mejfa
Director General de Investigación de los Efectos del Ambiente en la
Salud.
Sra . Ma . Elena López Portillo de Roias
Asesora del Laboratorio de la Subsecretaria de Mejoramiento del Ambiente
Dr . T . Alfredo Villacorta Arqáez
Subdirector de Coordinación de
los
Laboratorios
Ing . Sergio Becerra Winckler
Jefe del Departamento de Laboratorio de Agua
Personal Profesional y Técnico del Departamento de Agua del Laboratorio
Central de Análisis de Contaminantes Ambientales.
MANUAL DE PROCEDIMIENTOS TECNICOS.
PROLOGO :
Con la elaboración de este manual de procedimientos técnicos se
satisface la necesidad que existe dentro de la Subsecretaria de Mejoramiento del Ambiente, de establecer gulas que normen las —
metodologfas analfticas en el Laboratorio Central de Análisis de
Contaminantes Ambientales.
El esfuerzo desarrollado por todos los trabajadores del Laboratorio
Central para integrar estos manuales de técnicas en el Departamen
to de Agua, en el Departamento de Aire y en el Departamento de Especímenes Biológicos, es labor creativa quetrancenderá en el -Campd Científico.
Hago votos porque estos documentos sean usados como gulas y consultas en el trabajo diario del profesional y del técnico de nues
tro Laboratorio .
>
Dr . Manuel López Portillo y Ramos
Subsecretario de Mejoramiento del Ambiente .
~ ~ ;~,, ~, . •_~ ._
---=,--,--.=
N
DI
C
.
_
d
-r
.a
lS
L,
_~~_ ...~..cc.._ ~-xT—c•=s=_~~zns.t'_'w:~
E
TECNICAS DE MUESTREO Y EQUIPO PARA AGUA RESIDUAL
.ARSENICO (METODO DEL DIETILDITIOCARBAMATO DE PLATA)
DEMANDA BIOQUIMYCA•DE OXIGENO
DEMANDA QUIMICA DE OXIGENO
1
8
. 15
31
DETERMINACION DE OXIGENO DISUELTO POR EL METODO DE
WINKLER MODIFICADO
40
DETERGENTES (METODO DEL AZUL DE METILENO)
50
FENOLES (METODO DE LA 4-AMINOANTIPIRINA)
59
GRASAS Y ACEITES (METODO DE EXTRACCION SOXHLET)
NITROGENO EN
TODAS
SUS
FORMAS
SOLIDOS
CADMIO (METODO DE LA DITIZONA)
COBRE (METODO DE LA NEOCUPROINA)
CROMO HEXAVALENTE (METODO DE DIFENILCARBAZIDA)
NIQUEL (METODO DE LA DIMETILGLIOXIMA)
144
PLOMO (METODO DE LA DITIZONA)
153
METALES PESADOS (DETERMINACION POR ABSORCION ATOMICA)
166
BIBLIOGRAFIA
184
r .s
+
a>r,
._ r_~
~.~
-77(1—'1
TECNICAS DE MUESTR :1!
41R61iLLAM-&
,
i1
El muestreo de,un agua residual es necesario para obtener datos
concernientes a sus características físicas, químicas y biológi
cas . Las muestras deben ser representativas de las condiciones
que existen en el punto y hora de muestreo y tener el volumen suficiente para efectuar en ellas las determinaciones correspon
dientes.
La clasificación del muestreo se efectua de acuerdo al tipo de
muestra tomada que puede ser ; muestra simple instantánea o mues
tra compuesta.
La muestra simple instantánea consiste en tomar una sola mues-tra, por lo cual representará unicamente la concentración de los
constituyentes del agua en ese momento.
La muestra compuesta es la mezcla de varias muestras simples
instantáneas recolectadas a intervalos de tiempo previamente se
leccionados para un mismo sitio de muestreo, en volumenes iguales o proporcionales al gasto.
Los sitios de colección de las muestras deberán seleccionarsetomando en cuenta las fuentes de contaminación, caudal y veloci
dad de
la
corriente, dilución por corrientes ramificadas, cam-
bios en la topografía y declive del río .
:
at_ s- .l
,:, :' :, :iis,L
s".
„
-
Parâr' i'1” mue'St'146 'de
6
CA
.
se deberé
úsár
recipientes 4e
vid'ri g
d'irferent es profundid —des ' y " ''
pl.istiCo, tomariélc; var''fa:s' slerie's-'
distanCias entre'las 'orilla's . En' ocasiones `el múeitreo $e efec '
tuara'd 'e' acuerdo
'
ccni ' l'a bidrbgr$f'ia dei r ife '
En el caso de lagos y lagunas se sigue una técnica semejante,a,
la anterior sobre todo cuando se encuentran cerca del mar.
MUESTREO EN DESCARGA. INDUSTRIAL
,I .
Para el ' 'MubStreo én unadescafga industrial $e ' debetener ` info
maCitin Previa deliro d dé
la'
ihd6$iria ;
Yi '' qÜé ' 'de
aciierde)
' $u
capacidad y proceso empleado, $é
tras simples 6 compuestas que se deben tomar teniendo en cuenta
gastos Y'l6tTiF'SY turnos
trabajo, , . así cómo ,nGmexó ..de .; em ..
pleados en61 .Lós sitios' de muestreo se fijan con . inspección
anterior para la obtención de las muestras más .representat, ivas . ¡.
El volumen total de la muestra requerida se calcula conociendo
el
ñcimeró de ar gmétro' que sé van 'a: réalizár . "
MUESTREO EN 10MAS ... .' .
'r:,-
..() .!
.
Se deja escurrir un volumen aproximadamente igual a 10 veces e
volumen del agua residual que se va amuestrear y a continuación se llena el recipiente de muestreo ayudándose con un embudo, éste recipiente debe ser de material inerte al contenido de las aguas residuales, por lo que se recomiendan los de
polietileno . Las muestras deben representar lo mejor posible
las características del efluente total que se descarga por el
conducto que se muestrea.
TECNICAS ESP.ECIF.ICAS DE MUESTREO
Generalmente el muestreo se divide segúd la técnica réquerida
para tomar la muestra y el tipo de preparación . previa del recipiente, teniendo:
1
Oxígeno Disuelto
En agua residual es necesario determinar el oxígeno "disuelto,
esta medición es de vital importancia para conocer las condiciones aerobias o anaerobias de la muestra.
Este tipo de muestreo se realiza utilizando un muestreador Win
kler que es un cilindro de acero inoxidable con tapa de rosca
del mismo material y un tubo en el centro para .permitir la entrada del agua al frasco Winkler que se coloca en su interior,
el muestreador es llevado a la profundidad deseada por medio -
•. .
.".•"
4
,':IN
T. :
AL
0E:
v, .i
, .A. .
t
ti
T
-0
de unKcAbIt,P14stico n atados a éste ;-.
el tubo fgs .para-lapdOterminaci6affde oxigeno' .dituelto ,looi 01
muestra restan,teiieo ,co,lecta-len ,rediiien, . 'J!
j tes adeoua;4opatalKel)iemamertIqwe se)d0seeAirialitat. WdStittia6 =
do cOA-10SwreUtiVOS necesarios, para ,el,l,ca5p
2 :'mrl
Esta medici6n también se puede hacer por el método electromé- :
), .1-, ,
- lp
trice, por medio de un instrumento YSI con monitor y electrodo
El monitor se encarga de correlacionar la corriente eléctrica
M
6 potencial generada en el electrodo a sus respectivas concentrat U
de' laXgeno, disud4o . Elcelectrodoi iconsta''de treSlp.al,J
tes -prj.nXPOP
x
-)b
!
Kii q
K!
:o';(tiro
Membrana selectiva a las moléculas de Oxigeno,
un elemento sen.
sor al oxígeno (ánodo y cátodo) yo upTi , s8it46n- ,91ectrolitica en [
donde se lleva a cabo una serie de reacciones electroquímicas
de
0iiab'Ji-edüc-m.-, , lors'ciidle".'cife6A
.tfl .t",.'.:!IT
g t .'ea
f-w
1: . ;tJOICE;
Kt
La Calibracidn de este equipo se lleva a cabo siguiendo las ins
'a'
nierid6'eh
tq ^x
,,,' .
t?é,,-'''
F .)
c
''
''
1.1- ;1cTK .zi
de campo con
,los
Las muestras se etiquetan y se lleng .la ho)a
1t),.; K .0f;'Ll
O',CT!
f:' :7
Kt
.1
l-,,
2
FISICOQUIMICOS
De acuerdo a las condiciones del sitio de muestreo se tomará la
muestra, ya sea sumergiendo el recipiente (de polietileno de 2
litros de capacidad) para tomar la muestra en forma directa'6 utilizando el muestreador NISKIN para llenar posteriormente las
botellas . Se puede utilizar también el agua sobrante del mues-treador de oxígeno disuelto.
El muestreador NISKIN consiste en un cilindro de material resis
tente a la corrosión como lo es el acero inoxidable 6 plástico
con tapón de hule por ambos lados, atado por uno de los extre-mos a un cable resistente en el' cual va insertado una pequeña plomada llamada mensajero, este muestreador se introduce al - cuerpo de agua abierto en ambos lados y una vez que se encuentra a la . profundidad deseada, se impulsa el mensajero con fuerza desde la superficie, el cual al golpear la tapa superior acciona un mecanismo que cierra ambas tapas del muestreador . Este
muestreador sirve para tomar muestras . a profundidad.
Cuando la profundidad del cuerpo de agua es pequeña se recomienda
tomar la muestra directamente con el recipiente dende se vaa al
macenar .
6
ri+J'NAL
:~f4
'~
~•
~
~~
~ .r ~
.._~__
_~ . .-.-Y,~~--,~,'~,
• - ; , - ..; ~
~
3
p
~ ~~ •~~ T'~~ ~ ¡~
~2./ 6 ~
~z .-,~.
GRASAS )t'-
Las muestras deben tomarse directamente en frascos de vidrio de
boca ancha y tapón esmerilado con aforo a 1 litro lavados previa
mente con un solvente y secados al aire.
,Se debe cuidar que el sitio de muestreo sea homogéneo para tomar
la muestra, no debe llenarse el frasco para evitar que al taparlo se derrame la muestra y se pierda el aceite flotante.
4
FOSFATOS
Se emplea el mismo método que para el muestreo de fisicoqu£micos,
solo que el recipiente lleva una preparación previa que consiste
en lavarlo con ácido, clorhídrico diluido caliente y posteriormen
te con agua destilada . Debe .-evitarse el uso de detergentes que contengan fosfatos, en la limpieza del material.
5.
DETERGENTES (SUSTANCIA ACTIVAS AL AZUL DE METILENO)
Los surfactantes tienden a concentrarse en la superficie por lo
que deberán tomarse ciertas precausiones al muestrear . La dificultad para obtener muestras representantivas es manifiesta, por lo
que se debe evitar condiciones espumosas—No se debe usar detergentes en la limpieza del material, porque- puede ocurrir la adsorción del detergente en el equipo de vidrio causando errores
en las determinaciones . Lavar el material con mezcla crómica y -
a
VAZ,
7
t
o..~
A
enjuagarlo con agua acidulada y posteriormente con agua destila
da.
6
METALES PESADOS
Se debe tomar una muestra especial para la determinación de cationes como : aluminio, cadmio, mercurio, arsénico, cobre, cromo,
plomo, plata y cinc ; para éstos la muestra debe ser tomada en botellas perfectamente limpias pudiendo ser de plástico o de vi
drio con tapón del mismo material, acidularla con ácido clorhídrico 6 nítrico concentrado hasta un
pH
aproximado de 2 .0 para
reducir la precipitación y adsorción sobre la . s paredes del
vas
en--
e.
Los cationes hierro y manganeso pueden formar compuestos solu bles reduciéndose 6 insolubles oxidándose, por lo que deberánser colectadas en botella de vidrio enjuagada con ácido y después con agua destilada, . cuando . se presentan casos de fierro
coloidal el problema se agudiza al usar recipientes de plástico.
I1
9
I}}L
!„ ~. ..~
.
i
,
L..
.`f
~~
^ ; ;`l:• L-'
{
~
ARSE - NI
ALA' 1.
CO
GENERALIDADES:
La presencia de arsénico en las aguas naturales se debe a su con
tacto con el suelo que lo contengan y a contaminación por dese-chos de las industrias metalurgicas y descargas agrícolas, el empleo de este elemento en agentes germicidas, insecticidas, fer
tilizantes,'detergentes preservativos de madera, aditivos para alimentos de animales, pinturas y anilinas ha provocado altera-ciones en la calidad natural de los cuerpos de agua y suelos de
muchas zonas.
IMPORTANCIA SANITARIA
El arsénico se encuentra en pequeñas cantidades en los tejidos
del cuerpo, pero si su concentración aumenta excesivamente es altamente tóxico para el hombre . Se ha comprobado que el arsénico es carcinogeno, conociéndose muchos casos de cáncer en la -piel de personas que han consumido aguas contaminadas ; en México
se tienen estudios de la region lagunera que se encuentra en . el
norte del pals .
Los límites que se han fijado en el agua para beber son de una
concentración de 0 .05 mg/1 como máximo tolerable y 0 .01mg/1 como limite tolerable.
Bajas concentraciones de arsénico estimulan
el
crecimiento de
las plantas, pero su presencia excesiva en el agua de irriga-ción reduce notoriamente las cosechas.
METODOLOGIA
Método espectrofotometrico con dietilditiocarbamato de plata para la determinación de arsénico en agua.
Este método es aplicable en aguas naturales, residuales, estuarinas y costeras.
PRINCIPIO
El arsénico se reduce a arsina por el zinc en solución ácida, la
arsina pasada através de un depurador y después a un tubo absorbente que contenga dietilditiocarbamato dé plata para la forma-ción de un complejo rojo soluble cuyo color es proporcional al contenido de arsénico en la muestra .
..J
Las reacciones que-ocurren son las siguientes:
2A5+3Zn+ 6HC1
AsH 3 +AgSCSN(C 2 H 5 ) 2
3Zn C1 2 + 2AsH 3
Complejo Rojo.
EQUIPO:
1.
Espectrofotometro para usarse a 535 nm provisto de un paso de
luz de 1 cm.
2.
Generador Gutzein de arsina y tubo de absorción.
3.
Fibra de vidrio.
4.
Equipo común de laboratorio.
REACTIVOS
Los reáctivos que a continuación se mencionan deben ser grado analítico cuando se hable de agua se debe entender agua destilada o
des ionizada.
1.
Acido clorhidrico concentrado.
2.
Solución de Ioduro de potasio :
Disolver 15 grs . de KI en 100 ml de agua destiladas
(guardar en frasco obscuro .)
3.
Cloruro Estanoso
Disolver 40 gr de SNC1 2
. 2H 2 0 exento de arsénico . en 100
ml de acido clorhidrico conc.
4.
Solución de acetato de plomo.
Disolver 10 grs . de pB (C 2 H 30 2 ) 2 .3H 2 0 en 100 ml de agua destilada.
5.
Dietilditiocarbamato de plata.
Disolver 1 gramo de AgSCSN (C 2 H 5 ) 2 en 200 ml de piridina - (guardar en frasco obscuro)
6.
Zinc : de 20 - 30 mallas exento de arsénico.
7.
Sol . madre de arsénico:
Disolver 1 .320 grs . de trioxido de arsénico (As 2 0 3 ) en 10 ml
de agua destilada que contenga 4 grs de NAOH y diluir•a un litro con agua destilada.
1 ,.00 = 1 .00 mg de As
8.
Solución intermedia de arsénico
Diluir 5 ml de la solución madre de arsénico a 500 ml con agua destilada 1 .00 ml = 0 .01 mg de As .
Solución patrón de arsénico.
Diluir 10 .0 ml de la sol . intermedia a 100 ml . con agua
destilada 1 .00 ml = 0 .001 mg de As.
PROCEDIMIENTO
1 .- Pipetear 35 .0 ml . de muestra en un frasco generador limpio.
Agregar sucesivamente, mezclando cuidadosamente después de
cada adición 5 ml . de Hcl conc . 2 ml . de sol . de KI,y 8 gotas (0 .40 ml) del reactivo de SnC1 2 , dejar reposar 15 min.
para que el arsénico se reduzca al estado trivalente.
2.
Preparación del depurador y del absorbente.
Impregnar con la sol . de Acetato de plomo el pedazo de lana
de vidrio que se encuentra en el depurador, no humedecer demasiado pues el agua puede pasar a la solución del reactivo.
Pipetear 4 .0 ml . del reactivo de dietilditiocarbamato de - plata en el tubo absorbente.
3.
Generación de arsina y su medición.
Agregar 3 grs . de zinc al generador y conectar inmediatamente el montaje depurador absorbente . Debe asegurarse que•to
das las conexiones este hermeticamente unidas :
•
13
~
~f5T2É~L
s .1A
,
S,Dej ar 30
,minuto ,-para°'2'á" pró' 3úccibn completa de arsina
calentar ligeramente el condensador para . estar seguro que toda la arsina se libere . Vertir la solución del absorbente
directamente a una celda de 1 cm . y medir la absorbancia de
'la solución . A 535 nm usando el blanco de reactivos como referencia.
4.
Preparación de la curva patrón.
Llevar a cabó el procedimiento antes mencionado usando como
muestra alicuotas de la solución patrón que contengan 0 .0, 1 .0, 2 .0, 5 .0 y 10 )pg . Graficar absorbancia contra concentr_
ción de arsénico.
5.
Cálculo .
mg/1 de As = J1Igde As .
ml muestra
14
A,= _,A,. .
.'
_t . . . .l . A .,*
._
'." .
t
,
. ' 1 ' .„11A
AA . A
7,
4
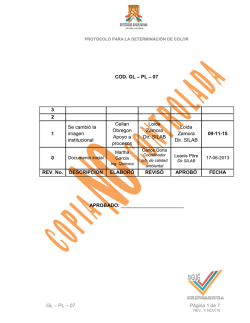
hubo absorbente
Limpiódor
Matraz generador
APARATO GENERADOR DE ARS1NA
DEMANDA BIOQUIMICA DE OXIGENO
DBO
CONSIDERACIONES GENERALES:
La demanda bioquímica de oxígeno (DBO) es usualmente definida
como la cantidad de oxígeno requerido por bacteria en el mo-mento en que se estabiliza la descomposición de la materia or
gánica ' bajo condiciones aeróbicas . El término descompuesto -puede ser interpretado como medida de la materia orgánica que
puede servir como alimento para la bacteria, y liberar ener-gia en ésta oxidación.
La prueba de DBO es muy usada para determinar el grado de con
taminación de desechos domésticos e industriales en términos
del oxigeno que ellos requerirán si son descargados en un agua
natural en el cual existen condiciones aeróbicas . La prueba es
una de las más importantes en las actividades de control de la
contaminación . Por su uso, es posible determinar el grado de contaminación en corrientes a cualquier tiempo . Esta prueba es
de primer importancia en trabajos reguladores y en estudios designados e evaluar la capacidad de purificación de cuerpos de agua receptores .
A
16
-
,, 1
l
~
.
r.Rr'Ne,, `""' ._-
• ~ ~~ L
,,.
. .~
T 'j" 7,,"
,s- l
1
L
e
.
'
La prueba de DBO es esencialmente'un procedimiento de bioensayo involucrando la medida de oxígeno consumido por organismos
vivos (bacterias) en cierto tiempo utilizando la materia orgánica presente en el agua de desecho, bajo condiciones paró asi
milar como sea p osible lo que ocurre en la naturaleza . Para hacer la prueba cuantitativa, las muestras deben ser protegi-dos del aire para prevenir aereación y disminución del nivel
-o
de oxigeno disuelto.
Para ciertos desechos industriales, es conveniente obtener una
curva de oxidación.
La demanda de oxígeno de las aguas residuales y de los efluentes de plantas de tratamiento de aguas residuales domésticas
e
industriales es debido a tres clases diferentes de materiales.
a) Material Orgánicó ca-rbonoso, utilizable como fuente de ali-mento para los organismos aeróbicos.
b) Nitrógeno Oxidable, derivado de nitritos, amoniaco y compues
tos de nitrógeno orgánico que sirven como alimento a bacte-rias específicas (Nitrosomonas y Nitrobacter).
c) Ciertos compuestos químicos reductores (fierro ferroso, ' sulfitos, sulfuros y adehidos ) que reaccionan con el oxígeno
disuelto molecular .
En aguas residuales domésticas, gran parte de la demanda de --
oxigeno se debe a la primer clase de materiales y se determina por la prueba de la Demanda Bioquímica de Oxigeno (5 días)
En efluentes tratados biologicamente, una proporción considerable de la demanda de oxígeno puede deberse a la oxidación de
los compuestos de la segunda clase y también puede determi
narse por la prueba de DBO . Los materiales existentes en la clase C, no pueden ser incluidos en la prueba de la DBO pero
deben tomarse en cuenta.
IMPORTANCIA SANITARIA
La demanda bioquimica del oxigeno requerido para la estabiliza
ción química y biológica de la materia orgánica en un intervalo de tiempo especifico . Entre más grande sea la carga orgánica desechada a un cuerpo de agua, mayor será la necesidad de oxigeno para su descomposición, por lo tanto, habrá una baja en el oxígeno disuelto creando condicionesque van en detrimento
de la vida acuática y otros usos benéficos . En ciertos casos provoca la completa extinción del oxígeno disuelto en las co-rrientes,- dando por resultado la extinción de peces y otras -formas acuáticas . En tales condiciones el aspecto del cuerpo de agua es antiestético.
Un alto valor en la DBO también puede indicar un incremento en
la microflora presente e interferir en el equilibrio de la vi-
18
da acuática, una. cantidad excesiva de algas, además de pruducir olores y sabores desagradables, tapan los filtros de arena utilizados en las plantas de tratamiento.
En las plantas de tratamiento de aguas residuales, tanto domés
ticas como industriales, se emplea mucho el análisis de la DBO
como un parámetro en el control-de la efectividad del trata- ) miénto.
Las principales fuentes de contaminación responsables del aumento en la Demanda Bioquímica de Oxigeno en los cuerpos de -agua son : además de las urbanas, las industrias cerveceras, -textiles, papeleras, empacadoras e ingenios azucareros.
METODOLOGIA
a) PRINCIPIO
La determinación de la Demanda Bioquímica de Oxígeno se basa
en las determinaciones de oxígeno disuelto a diferentes intervalos de tiempo ; consecuentemente la exactitud de los resultados se ve afectada grandemente por el cuidado al efectuar el análisis.
El procedimiento usual recomienda que la temperatura dé incubación debe ser constante (20°C aproximadamente) y en el caso
/
t9
de usar una alícuota,
el agua de dilución debe aerearse pre-
viamente con el fin de que el contenido de gases disueltos sea constante (cercano al punto de saturación) . Se llenan -dos o más botellas para DBO con la muestra, en caso necesa-rio se afiade agua de dilución . Se determina el OD inmediato
a una botella de cada muestra y las otras botellas se incuban
a
20°C durante 5 días . Después de este tiempo se les de-
termina la cantidad de OD remanente ;
la
DBO sera igual a la
cantidad de OD inicial menos el OD al quinto día, dividido entre el % de dilución (en decimales).
EQUIPO
Incubadora
Refrigerador
Estufa
Balanza analítica
Potenciómetro
Compresora de aire
Frascos de 20 litros
Frascos claros y de color ámbar de 2000 ml . (para reactivos)
Frascos de 300 ml . especiales para DBO (mínimo 3 para cada muestra) .
20
- Bureta automática graduada de 50 ml.
-
Pipetas volumétricas de 100 ml . de punta alargada
- Pipetas graduadas de 10 ml . de punta alargada.
-
Matraces aforados de 1000 ml.
- Fcos . gotero de 30 ml.
- Matraces erlenmeyer de 250 mi.
REACCIONES
La prueba de DBO puede ser considerada como un proceso de oxidación húmeda en el cual los organismos vivos sirven como me-dio de oxidación de la materia orgánica o dioxido de carbono y
agua . Existe una relación entre la cantidad de oxigeno reque rido para-convertir una cantidad definida de cualquier compues
to orgánico a Bioxido de Carbono, agua y Amoniaco y puede ser
representativa por la siguiente reacción.
CnH a O b N c + (n + a - b - 3 c)0 2 — n- CO 2 + ( a - 3 c ) H 2 O+CNH 3
4 2 4
En base a la relación anterior, es posible interpretar los datos de DBO en términos de materia orgánica, como la cantidad de oxigeno requerido en la oxidación . Este concepto es fundamental para comprender la velocidad a la cual se desarrolla la
DBO .
21
Las reacciones de oxidación involucradas en la prueba de la
DBO son resultado de la actividad biológica, y la velocidad
a la cual se llevan a cabo las reacciones estan basados en
concentraciones y temperatura . Los efectos de la temperatura
se mantienen constantes llevando a cabo la prueba a 20°C, el
cual es más o menos un valor medio de cuerpos naturales de agua . Los organismos predominantes responsables de la estabi
lizaci6n de la materia orgánica en aguas naturales son formas
nativas del suelo . La velocidad de sus procesos metabólicos
a 20°C y bajo las condiciones de la prueba es tal que la prue
ba se lleva a cabo en varios días . Teoricamente se requiere un tiempo infinito para la oxidación biológica completa de la
materia orgánica, pero para própositos prácticos la reacción
se considera completa en 20 días . Como quiera que sea un perio
do de 20 días es ' demasiado largo para esperar los resultados en la mayoría de las situaciones que se presenten . Se ha encontrado por experiencia que un porcentaje razonable de la -DBO total se desarrolla en 5 días, consecuentemente las prue bas han sido desarrolladas en un periodo básico de 5 días de
incubación . Debe recordarse sin embargo que los valores de la
DBO
El
de
5 días representan solamente una parte de
la
DBO total
porcentaje exacto depende del origen de las aguas y de la
naturaleza de la materia orgánica presente, y pueden determinarse solamente por experimentación . En el caso de aguas de -
:!z
dcsecho domésticos y muchos tipos de industriales, se ha encontrado que el valor de la DBO de 5 días es cercano al 70 u
80% de la DBO total . Este es un porcentaje suficientemente grande de el total para que los valores de 5 días sean usados
para consideraciones importantes.
Es importante mencionar la necesidad de tener un cultivo mixto
de organismos representativos del origen de la muestra para -obtener mediciones adecuadas de la DBO . Tales cultivos, cuando
se derivan de los desechos de suelo o domésticos, contienen un
gran número de bacterias Saprofitas u otros organismos que uti
lizan la materia carbonacea presente en las muestras sujetas ,
-alnáisdeDBO,yusaneloxíg cantidesorpondientes . En suma, dichos desechos contienen normalmente bac
terias Autotroficas, particularmente bacterias nitrificantes,las cuales oxidan materia no carbonacea \para j obtener energía.
4as bacterias nitrificantes están usualmente presentes en cantidádas relativamente pequeñas y afortunadamente, su velocidad
de reproducción a 20°C es tal- que sus concentraciones no son suficientemente grandes para ejercer una apreciable demanda de
oxígeno hasta cerca de 8 a 10 días, tiempo que rebasa la prueba regular de la DBO, Una vez que
los
organismos se han estábi
lizado, oxidan el nitrógeno en la forma de amoniaco a ácidos nitroso y nítrico en cantidades tales que introducen serios -errores en los resultados de la DBO . Esto se ejemplifica de -acuerdo a las siguientes reacciones :
23
2NH 3 + 30-
Formación de Nitrito
Bacteria
2NO + 0 2 + 2H
2NO + 2H + 2H2 0
Formación de Nitrato
Bacteria
2NO3 + 2H +
REACTIVOS
a) AGUA DESTILADA
El agua que se use para la preparación de las soluciones y para
el agua de dilución debe ser de la más alta calidad, destilada
en alambiques de cristal 6 con refrigerantes de estaño ; debe
contener menos de 0 .01 mg/l de Cu y debe estar exenta de cloro,
cloraminas, alcalinidad caústica, sustanicas orgánicas o ácidos.
b)
SOLUCION AMORTIGUADORA DE FOSFATO
Disuelva 8 .5 gr de KH 2 PO 4 , 21 .75 g de K 2 HPO 4 , 33 .4 g de Na 2 HPO 4 .
7H 2 0 y 1 .7 gr de NH 4 C1 en unos 500 ml de agua destilada y diluya a 1 litro . . El pH de esta solución amortiguadora debe ser 7 .2
sin ajuste alguno . No debe presentar ningún tipo de crecimiento
biológico si se conserva en la incubadora .
24
c) SOLUCION DE SULFATO DE MAGNESIO
Disuelva 22
.5 g de MgSO 4
7
H2
0 en agua en agua destilada y diluya a 1 litro.
d) SOLUCION DE CLORURO DE CALCIO
Disuelva 27 .5 g de CaC1 2 anhidro en agua destilada y diluya a
1 litro.
/
e) SOLUCION DE CLORURO FERRICO
Disuelva 0 .25 g de Fe C1 3 . 6H2 0 en agua destilada y diluya a
1 litro.
f) SOLUCIONES DE ACIDOS 0 ÁLCALIS 1 N
Para la neutralización de las muestras de desechos que sean cáusticas o ácidas.
g) SOLUCION DE SULFITO DE SODIO, 0 .025 N.
Disuelva 1 .575 g de Na 2 SO 3 en 1000 ml . de agua destilada . Esta
solución no es estable y debe prepararse"diarian)J ► te.
h) MATERIAL INOCULANTE
El fin del inóculo es introducir a la muestra una población -biológica heterogénea capaz de oxidar la muestra orgánica que
25
contenga . Cuando tales microorganismos ya están presentes como en las aguas residuales domésticas o efluentes no clorados y en aguas superficiales, no es necesario inocular las -muestras.
Cuando hay razón para ceer que la muestra contiene muy pocos
microorganismos, como resultado por ejemplo de la cloración,temperatura elevada o pH extremo, el agua de dilución debe -ser inoculada.
La selección del inóculo apropiado es un factor importante en
la
determinación de DBO . En muchos casos, particularmente en
desechos de procesadoras de alimentos, se puede obtener un -inóculo satisfactorio usando el liquido sobrenadante
de las -
aguas residuales domésticas, el cual ha sido previamente incu
hado a 20°C en un recipiente destapado durante 24-36 horas.
Muchos desechos industriales contienen compuestos orgánicos que no están sujetos a la oxidación por el inóculo de las - aguas residuales domésticas ; en estos casos se puede usar un
inóuclo preparado del suelo aclimatado y desarrollado en el laboratorio ó dal agua receptora colectada abajo del . punto de
descarga del desecho particul ;,_ (d preferencia 3-8 km abajo).
Los dos 5ltimos son probablemente los de mayores posibilidades
El
agua receptora usada como fuente de inóculo indudablemente
dará la mejor estimación del efecto de un desecho en tal agua ;
26
pero debe ser colectada en. un punto en donde se haya formado
una biota capaz de usar como alimento los compuestos orgánicos particulares presentes.
PROCEDIMIENTO
PREPARACION DEL AGUA DE DILUCION
Se ha usado una amplia variedad de aguas en la determinaci6n
de la DBO . Las aguas superficiales naturales parecen ser ideales pero tienen un número de desventajas entre las que se encuentran, DBO variable, población variable de microorganismos
(a menudo incluyen algas y poblaciones significativas de bac-terias nitrificántes) ' y contenido mineral también variable.
Se ha usado el agua corriente, pero sufre de la mayoría de las
limitaciones encontradas . en las aguas superficiales más la posibilidad de toxicidad por cloro residual.
A través de la experiencia se ha visto que un agua de dilución
sintética preparada con agua destilada es mejor para la prueba
de DBO ya que se puede controlar las variables antes citadas.
La calidad del agua destilada, usada para la preparación del auga de dilución es primordial importancia y debe estar libre
de sustancias tóxicas . El cloro o cloraminas y cobre son los más comunes . En muchos casos es necesario declorar el agua que
27
alimenta el alambique para obtener un destilado libre de clo ro . El agua destilada preparada de abastecimientos potables tiene una DBO muy baja por lo que se puede usar para la prepa
ración del agua de dilución manteniéndola en un rango apropia
do de temperatura cercano a ,20°C con un almacenamiento adecua
do.
El agua destilada que se use para este próposito se puede - arear, bien sea agitando un garrafón parcialmente lleno o por
medio de una corriente de aire comprimido . Se pueden encontrar
situaciones en que convenga usar agua fluvial estabilizada, -para comprobar el comportamiento de la corriente con el procedimiento del laboratorio . Viertase el volumen deseado de agua
destilada en un recipiente adecuado y agreguese .l ml .'de cada
uga de las soluciones:
Amortiguadora de fosfatos, sulfato de magnesio, cloruro de cal
cio y cloruro férrico por cada litro de agua.
El pH del agua de dilución puede estar en el rango de 6,5 a
8 .5 sin afectar la acción de la bacteria saprofita . La buffer
es esencial para mantener condiciones de pH favorables en - cualquier tiempo . Las condiciones osmóticas adecuadas se mantienen por los fosfatos de Potasio y de Sodio agregados para proporcionar la capacidad amortiguante . Las sales de calcio y
magnesio se adicionan para contribuir al contenido de sales --
28
totales . El cloruro férrrico, sulfato de magnesio y clorúro
de amonio, suministran los requerimientos de fierro, azufre
y nitrógeno_. La solución amortiguadora de fosfatos proporcio
.
na el fósforo que se necesite . Todas estas sales son necesarias para el crecimiento y elmetábolismo de
los
microorga-
nismos.
El
límite máximo de DBO que se permite en el agua de dilución
es de 0 .2 mg/l '
METODO
DE
PILUCION
_
Este método se basa en el concepto fundamental ae que la velocidad de la degradación bioquímica orgánica es directamente
proporcional a la cantidad de material uso oxidado.
Someta el agua destilada a•aereación hasta que se sature'de
oxigeno . Agregue los nutrientes al agua aereada y continue la'
areación . Estime la dilución necesaria para producir un consumo de oxígeno entre 2 y 6 mg/1 después de 5 días de incubación
Las diluciones recomendables son los siguientes :
29
TIPO DE DESECHO
DB0 5 en mgr/l
PORCIENTO DE
( ESTIMADA )
Desecho industrial
concentrado.
DILUCION
500 - 5000
0 .1
-
1 .0
100 - 500
1 .0 -
5 .0
Aguas residuales
domésticas
Efluentes tratados
20 - 100
Aguas superficiales
5 - 20
5 .0 - 25 .0
25 .0 -100
contaminadas
Utilizando como guía el valor estimado de
la
DBO, se calculan
las diluciones apropiadas para obtener el abatimiento deseado
del contenido de oxígeno y proceder como sigue:
1 . Medir directamente en las frascos especiales para DBO de
capacidad conocida, cantidades adecuadas de la muestra, usando una pipeta volumétrica de punta alargada, el frasco se llena con el agua de dilución justamente para el -tapón pueda colocarse sin dejar burbujas de aire.
2•
Se incuba una serie de muestras con su testigo durante 5
días a 20°C.
30
3 . A la otra serie se le agrega a cada muestra 2 ml de los
siguientes reactivos:
a)
Sulfato manganoso
b)
Álcali-Yoduro
4 . Sedimentar a la mitad
c) H 2 SO4 conc.
5 Agitar
6
Dejar reposar 15 minutos
7
Se toman de esta 100 ml en un matraz erlenmeyer.
d) Se agrega 1 ml . de almidón (indicador)
8
Se titula con tiosulfato de Sodio (Na 2 S 2 O 3 0 .02 N) al - punto de vire a incolora.
. CÁLCULOS
mgr/l DBO =
D1 - D2
P
D1
= OD de la muestra diluida, después de 15 minutos de su
preparación.
D2
= OD de la muestra diluida después de la incubación.
= Fracción decimal del agua de dilución empleada .
31
DEMANDA QUIMICA DE OXIGENO
La demanda química de oxigeno es una determinación que representa una medida del oxígeno equivalente de la fracción de la
materia orgánica que es suceptible de oxidación por un agente
químico fuerte.
La importancia de la-determinación de este . parámetro radica en
que es aplicable para estudios de corrientes y desechos industriales, así como para el control de plantas de tratamiento de
desechos ya que es de medición rápida.
Por otra parte, el resultado de la DQO, puede tomarse como guía para determinar las diluciones en la prueba de la DBO . Es
te criterio se emplea por ejemplo en las plantas de tratamiento de aguas negras para controlar las pérdidas en las tuberías
de desechos y para el control de las diferentes etapas del pro
ceso.
Con respecto a normas, no existen en los reglamentos referen-cias a Demanda Química de Oxígeno, por lo cual este parámetro
es de interés cuando se trata de caracterizar muestras de - corrientes, cuerpos receptores o desechos .
32
M ET 0 D 0 L 0 G I A
a) Principio.
La mayoría de dos, diferentes tipos de materiales orgánicos se
destruyen por ebullición con uná mezcla de ácidos crómico y sulfúrico.
El método se basa en el reflujo de una muestra con cantidades
conocidas de , dicromato de potasio y acido sulfúrico, titulando el exceso de dicromato con sulfato ferroso amoniacal . La -cantidad de materia orgánica oxidable, medida como oxígeno - equivalente es proporcional el dicromato consumido.
b) Interferencias y Limitaciones
Los compuestos alifáticos de cadena recta, hidrocarburos aro-maticos y piridina, no son oxidados en cantidades apreciables
por el método, aunque el dicromato da una oxidación más comple
ta que el permanganato de potasio . Para lograr mejores resulta
dos con los compuestos arriba mencionados se adiciona sulfato
de plata como catalizador . No hay ventaja en ~l uso del cata-. .lizador•para hidroc4rburos aromáticos, pero es esencial para la oxidación de alcoholes de cadena recta y ácidos .
33
La principal interferencia se debe a los cloruros, los cuales
se inhiben para reaccionar en la oxidación por la adición de
sulfato mercúrico a la muestra antes del reflujo, llevándolos
a la forma de complejos solubles de sulfato mercúrico.
El método puede usarse para determinar valores de DQO de 50 -mg/l ó mâs . Usando dicromato diluido se pueden determinar, valores abajo de 10 mg/l, pero usualmente solamente indican un orden de magnitud.
c) Equipo .'
Aparato de Reflujo, que consiste de matraz Erlenmeyer de 250 a
500 ml con cuello \ esmerilado de 24/40 y refrigerante Friedrich,
Liebig, West u otro equivalente de 300 mm y uniones esmerila-,
das de 24/40.
El plato de calentamiento aportará energía sufici .^nte para pro
ducir cuando menos 9 watts por pulgada cuadrada de superficie
de calentamiento.
d) Reactivos.
1) Solución estandar de dicromato de potasio 0 .25 N.
Disolver 12 .259 g de K 2 Cr 2 O 7 , de grado primario estandar, previamente secado a 103°C por 2 horas, en agua destilada y di- luir a 1000 ml .
34
NOTA : El N de Nitrito ejerce una DQO de 1 .14 mg por mg de N
de Nitrito . Para eliminar interferencias apreciables
por nitrito, agregar al matraz de reflujo 10 mg de -ácido sultánico por mg de N de nitrito . Esto se logra
rá agregando 120 mg de ácido sulfánico por litro de solución de dicromato . En esta forma se eliminará la
interferencia de 6 mg/1 de N de nitrito en la muestra
si se usa un volfimen de 20 ml . si se tienen concentraciones más altas de nitritos, se usarán alicuoatas diluidos a 20 ml.
Reactivo de Acido Sulfúrico
Se disuelven 22 .0 g de Sulfato de plata en 9 lbs, de H 2 SO 4 con
centrado. Se requieren de 1 a 2 días para completa disolución.
3) Solución estándar de sulfato ferroso amoniacal, cristales de grado analítico 0 .1 N.
Se disuelven 3 g . de Fe (NH 4 ) 2 (SO 4 ) 2 . 6H 2 0 en agua destilada.
Adicionar 20 ml . de H2 SO 4 concentrado, enfriar y diluir a - 1000 ml . Esta solución debe estandarizarse contra la solución
de dicromato de potasio diariamente.
Estandarización . DilUir 10 .0 ml . de solución de dicromato de -potasio aproximadamente a 100 ml . Adicionar 30 ml . de H 2 SO 4 conc.
y permitir que enfrie . Titular con el sulfato ferroso, usando -
35
2 o 3 gotas (0 .1 - 0 .15 m1.) de indicador de ferroin.
Normalidad = ml de K2Cr207 z 0 .25
ml de Fe (NH
4 ) 2 (SO 4 ) 2
4) Solución de indicador de Ferroín.
Disolver 1 .485 g de 1,10 fenantrolina monohidratada con 695mg
de Fe SO 4 .
7H 2 0 en agua y diluir a 100 ml.
Sulfato de Plata.
Reactivo en polvo . Ver reactivo 2.
6) Sulfato Mercúrico.
Cristales grado analítico.
7) Acidó Sulfámico grado analítico.
PROCEDIMIENTO
a)
Colocar 4 .4 g de Hg SO4 en un matraz de reflujo . Adicionar
20 .0 ml de muestra, ó una alicuota diluida a 20 .0 ml con agua
destilada y mezclar . Agregar 10 .0 ml de solución de dicromato
dé potasio y algunas perlas de vidrio previamente calentadas
36
•
a 600°C por 1 hora.
Conectar
el matraz ar condensador y agregar lentamente 30 ml de
H 2 SO 4 conc . conteniendo Ag 2 SO4 a través de la boca del conden-sador, mezclando vigorosamente mieñtras se agrega el ácido.
Mezclar el contenido del matraz vigorosamente antes de que se aplique el calor ; si no se hace así, ocurrirán calentamientos locales en el fondo del matraz y pueden sucederse proyecciones
por el condensador.
Usar 0 .4 g HgSO 4 , para completar 40 mg de An cloruro, 6 2000 mg/i cuando se usan 20 ml de muestra . Si hay más cloruro presen
te adicionar más HgSO 4 para mantener una relación HgSO 4 : Cl de
10 :1, Si se forma un precipitado ligero no afectará adversamente la determinación.
' b) Reflujár la mezcla por 2 horas o usar un período más ~orto, para . desechos en particular si se ha encontrado que dicho período es adecuado para encontrar DQO máxima . Enfriar y lavar el con
densador con aqua destilada.
c) Diluir la mezcla a cerca de 150 ml con agua destilada, enfriar
a temperatura de cuarto, y titular el exceso de dicrpmato con so- '
luci6n de sulfato ferroso amoniacalestándar, usando•ferroín como
indicador . Usualmente son necesarias 2 6 3 gotas (0 .10 - 0 .15 ml)
como indicador . Tomar como punto final de la titulación el vire de azul verde a café rojizo, aunque el azul - verde puede reapare
I
: 37
cer después de álgunos minutos.
d) Reflujar un blanco de 20 ml de agua"destilada, en
la
misma
forma que las muestras.
NOTA : Para muestras de características especiales usar un . volOmen de muestra entre 10 .0 y 50 .0 ml, con los ' volumenes,
pesos y normalidades ajustados de acuerdo a la tabla ane
xa .
VOLUMEN DE
K 2 Cr 2 O 7
.MUESTRA - (ml)
0 .25 N (ml)
H 2 SO 4 CONC.
. con Ag 2 SO4
HgSO
g
NORMALIDAD DE
Fe (NH4) .2(
VOLUMÉN FINAL DE
)2
LA, TIT[JLACION (ml)"
10 .0
5 .0
15
0 .2
0 .05
20 .0
10 .0
30
0 .4
0 .10
140
30 .0
15 .0
45
0 .6
0 .15
210
40 .0
20 .0
60
0 .8
0 .20
280 .
50 .0
25 .0
75
- 1 .0
0 .25
350
70 ,
39
En el caso de muestras diluidas, usualmente aguas de mar o altamente salinas, usar dicromato de potosio 0 .025 N para la -oxidacibn y sulfato ferroso amoniacal 0 .01 N para la titulación
.CALCULOS
mg/1 DQO =
(a-b)
N
x
8000
ml• de muestra
En donde:
DQO = Demanda química de oxígéno.
a • = ml de Fe (NH 4 ) 2 (SO4) 2
usados para el testigo.
b
usados para la muestra.
= ml de Fe (NH 4 ) 2 (SO 4 ) 2
y
Normalidad de Fe,(NH 4 ) 2 .
(SO 4 ) 2 .
. 40
DETERMINACION DE OXIGENO DISUELTO POR EL METODO DE WINKLER
MODIFICADO
GENERALIDADES:
Todos los organismos son dependientes del oxigeno en una forma
o en otra, para mantener el proceso metabólico que produce - energía para su crecimiento y reproducción . Los procesos Aeróbicos tienen un gran interés debido a su necesidad de oxígeno
libre . En el hombre sé concierne vitalmente con el contenido de oxigeno del aire que respira, ya que una reducción en el -contenido de oxigeno producirá desconfort y posiblemente la -muerte.
La ingeniería sanitaria se interesa en las condiciones atmosféricas en relación al hombre, pero principalmente con las con
diciones atmósfericas que existen en líquidos ; siendo el agua
el líquido más grande en abundancia e importancia ..
Todos los gases de la atmósfera son solubles en agua en algún
grado . Nitrógeno y Oxígeno son clasificados como poco solubles
siendo su solubilidad directamente proporcional a sus presiones parciales.
La ley de Henry se usa para calcular las cantidades presentes
41
a la saturación a cualquier temperatura dada, ya que la solu-
la
bilidad de ambos nitrógeno y oxigeno varia grandemei}te con
temperatura.
En aguas salinas la solubilidad es menor, bajo las condicio-nes de las presiones parciales que existen en la atmósfera ; en el agua se disuelve m£s nitrógeno que oxigeno.
A la saturación se encuentra cerca del 38% de oxigeno disuelto
o el 'doble de oxigeno que en la atmósfera normal.
El rango de solubilidad de oxigeno atmosférico en aguas recien
tes es de• 14 .6 mg/1 a 0°C y de 7 mg/1 a 35°C y 1 atm . de pre-sión . Debido a que este es un gas pobremente soluble su solubi
1
lidad varía directamente con la presión atmosférica y la tempe
ratura . Esta es una consideración importante a altas altitudes,
ya que los valores de la oxidación biológica incrementan con la
temperatura y la demanda de oxigeno también incrementa con las
condiciones de elevación de la temperatura donde el oxigeno disuelto es menos soluble y es lo que m£s concierne a Ingeniería
Sanitaria . Una de las situaciones más críticas en la deficiencia de oxigeno disuelto en Ingeniería Sanitaria ocurre durante
los meses de verano cuando las temperaturas son altas y la solu
bilidad del oxigeno es minima . Por esta razón se piensa en ni-veles de oxígeno disuelto de 8 mg/1, siendo el máximo disponi-• ble bajo condiciones criticas.
42
IMPORTANCIA SANITARIA DE OXIGENO DISUELTO"
En aguas que reciben descargas de desecho el oxigeno disuelto
es el factor que determina el tiempo en que se lleva a cabo los cambios biológicos por organismos Aeróbicos o Anaer6bicos;
la forma de usar'el oxigeno libre por oxidación de materia or
gánica e inorgánica y llegar a productos finales inocuos enel primer caso y en el segundo por reducción de ciertas sales
inorgánicas como sulfatos, siendo los productos finales de
olor desagradable.
Las medidas del oxigeno disuelto son vitales para mantener -las condiciones aeróbicas en aguas naturales que reciben materia contaminante y en procesos de tratamiento aeróbicos destinados a purificar aguas residuales domésticas e industriales.
Las determinaciones de oxigeno disuelto se usan para una amplia
variedad de própositos, esta prueba es una de las más simples e
importantes . En más casos involucra el control dé ríos contaminados, ya que es conveniente mantener condiciones favorables -para el crecimiento y reproducción de una población normal depeces y de otros organismos acuáticos.
Para esta condición se requiere el gasto de los niveles de oxígeno disuelto que soportorá la vida acuática con una condición
salubre deseable todo el tiempo .
43
'Las determinaciones de oxigeno disuelto sirven como base para
la prueba de DBO (Demanda Bioquímica de Oxigeno), siendo asi
la base de la más importante determinación usada para evaluar
la fuerte contaminación de aguas residuales e industriales.
El valor, de
la
oxidación bioquímica puede ser medido por de--
terminaci6n de oxigeno disuelto residual en un sistema a varíos intervalos de tiempo.
Todos
los
procesos para tratamiento aeróbicos depende de
la
--
presencia de oxigeno disuelto . v las pruebas para esto son indispensables como un medio de control de los valores de aeraci6n para asegurar r,ue las cantidades adecuadas sean suficientes para matener las condiciones aer6bicas, así como el uso ex
cesivo del aire.
La prueba de oScígeno disuelto sierve como medida de control .
a) ' MATERIAL Y EQUIPO
Balanza analítica
tureta
Pipetas volumétricas de 100 ml .
Pipetas de Mohr dé 10 ml.
Matraces Erlenmeyer de 250 ml
Frascos Winkler.
Muestreador Winkler con cable.
44
b) RhACTIVOS
1.- Solución de Sulfato Manganoso.
Disolver 480 g . de MnSO 4 4H 2 0, 400 g de Mn ' SO4 2H 2 0 ó
364 g de Mn SO4 H 2 0 en agua destilada, filtrar y diluir a
1 litro.
2.- Reactivo de Alcali-Yoduro-Nitruro.
Disolver 500 g de NaOH 6 (700 g de KOH) y 135 g de NaI ó
(150 g de KI) en agua destilada y diluya a 1 litro . A esta
solución agregue 10 g deNaN 3 disueltos en 40 ml de agua.
Indistintamente se pueden usar sales de sodio 6 de Pota-sic . Este reactivo no debe producir coloración con el almidón cuando se diluya o acidule.
3.- Acido Sulfúrico Concentrado.
4.- Solución de Almidón.
En un vaso de precipitados preparar una solución acuosa adicionando 5 g . de almidón en agua fria ; agregar esta -emulsión en 800 ml de agua en ebullición con agitación, continuar la ebullición por unos minutos, diluir a 1 litro y dejar sedimentar por una noche . Emplear el liquido
claro sobrenadante y preservar con unas gotas de Tolueno
ó 1 .25 g de ácido salicilico por litro .
45
5 .- Solución de Tiosufalto de sodio 0 .025 N
Disolver 6 .205 g de Na 2 S 2 O 3 5H 2 0 en agua recientemente
hervida y enfriada después diluir a 1000 ml . Preservar por adición de 5 ml de cloroformo 6 0 .4 g de NaOH por , -litro, titular con solución de Biyodato o Dicromato.
6.
Solución valorada de Biyodato de Potasio 0 .025 N.
La solución de biyodato equivalente al tiosulfato 0 .025 N . contiene 0 .8124 g/l de KH (I0
3) 2
TITULACION
Disolver 2 g . de yoduro de Potasio (KI), exento de Yodato en
un erlenmeyer con 100-150 ml de agua destilada agregar 10 ml
r
de H 2 SO 4 .1+9 seguido de 20 ml exactamente de
sol .
valorada de
biyodato, diluir a 200 ml, titular el , yodo liberado con la -. sol . de'Tiosulfato agregando el almidón hacia el final de la
titulación, cuando se alcance un color paja pálido . Se deben
necesitar exactamente 20 mi de la solución de tiosulfato de sodio 0 .025 N . cuando las soluciones en comparación son de -igual concentración . Es conveniente que la solución se ajuste
exactamente a 0 .025 N.
7.
Solución valorada de dicromato de Potasio 0 .025 N.
Una solución equivalente a una solución de tiosulfato - 0 .025 N . contiene 1 .226 g/l de K 2 Cr 2 0 7 . El dicromato debe
ser previamente secado a 103°C por 2 horas .
46
Titulación
La misma que con el biyodato, excepto que se usan 20 ml . de la sol . de dicromato . Colocar por 5 minutos en la obscuridad
diluir aproximadamente a 400 ml y titular con la sol . de tiosulfato.
c) MUESTREO
Para el muestreo de oxigeno disuelto, se requiere que la muestra sea representativa del punto, así como exenta de burbujas
de aire.
Para muestreos a profundidad se debe contar con muestreador - winkler, el cual contiene en su interior un frasco especial para esta déterminación . Por medio de este muestreador el agua entra al frasco por un tubo evitando la entrada de burbujas de.
aire obteniendo wi resultado real . Inmediatamente se procede a
la fijación del oxígeno para evitar pérdidas por acción biológica . El transporte de las muestras al laboratorio debe hacerse en hielo, y el análisis en el menor tiempo posible (máximo
8 - horas).
d) PROCEDIMIENTO
La modificación de winkler, se efectué para vencer los efectos
4 .7
de una amplia variedad de interferencias causadas por reducción de substancias incluyendo nitritos . Esto involucra un pretratamiento de la muestra con permanganato de potasio bajo
condiciones ácidas : El permanganato es añadido en exceso y -óxida los reductores presentes . El exceso es destruido por -adición de un agente reductor, oxalato de potasio, y se llevan
a cabo los siguientes pasos:
1.- Adicionar al frasco winkler conteniendo' la muestra, 2 ml.
' de sulfato manganeso teniendo cuidado de que-la pipeta penetre en el .agua . .
.
2.- Adicionar 2 ml de alcalí-yoduro-nitruro, cuando hay oxigeno
en el agua se forma un precipitado café MnO (OH) 2 de lo con
trario, se forma un precipitado blanco (Mn ( .OH)2).
3.- Tapar el frasco y tirar el exceso, agitando vigorosamente para homogenizar la muestra, se deja sedimentar el précip--tado aproximadamente 2 minutos hasta tner más o menos 100 -
ml .
de liquido sobrenadante.
4.- Adicionar 2 ml . de ácido sulfúrico concentrado y agitar has ,
• ta total disolución del precipitado.
Con estos pasos el oxígeno disuelto queda fijado.
5.- Se procede a la titulación ton tiosulfato de sodio (Na 2 S2 O 3 )
0 .025 N, usando una sol : de almidón como indicador .
48
6 .-
Cálculos
mg/1 , de OD =
mi de tiosulfato x N x Eq x 1000
ml 'de muestra
Donde. :
N = Normalidad del tiosulfato
Eq = Peso equivalente del oxigeno.
Corrección por adición de reactivos:
Reactivos agreados = 4 ml en 300 ml de muestra original, si se
toman 100 ml para la titulación.
300
=
300-4
100
x
X = 98 .7 ml.
Sustituyendo y rectificando el volumen de muestra
ppm de OD = ml de tiosulfato,x 0 .025 N x 8 x 1000
98 .7
Factor constante : 0 .025 N x 8 x 1000
98 .7
ppm de OD =ml de tiosulfato x 2 .03
= 2 .03
49
OXIGENO. DISUELTO POR EL METODO DE ELECTRODOS
El uso de electrodos para la determinación de oxígeno disuelto
permite hacer la medida in situ, esto ha incrementado significamente su desarrollo . Los electrodos , pueden ser bajados a
varias profundidas y la concentración de oxígeno disuelto puede ser leido en un micrometro conectado en la superficie, los ,
electrodos pueden ser usados en agua de tratamiento biológico
debido al nivel de monitoreo de oxigeno disuelto en cualquier
punto.
Uno delos aparatos para determinar estas .lecturas es el YSI .
50
D E T E R .G E N T E S
METODO DEL AZUL DE METTLENO '
GENERALIDADES:
Desde 1945 una gran variedad de detergentes sintéticos fueron aceptados como sustitutos del jabón y son en la actualidad los
productos limpiadores más populares, tanto en usos domésticos como industriales . Los componentes básicos de los detergentes son compuestos orgánicos con propiedades tensoactivos en solución acuoasa, por lo que se conocen como tensoactivos o surfactantes, en general, cualquier molécula de um compuesto surfac-tantes presenta una ' cadena polar alifática que es hidrofilica,y una parte aromática que se caracteriza por ser hidro£ebica . A
esta dualidad en la naturaleza de la molécula se deben las p ropiedades humectantes.
IMPORTANCIA SANITARIA
Si bien todos los detergentes se degradan por un ataque biológi
co, el grado de descomposición se relaciona con la estructura química de estos . Asi tenemos que las ramificaciones en el grupo' alkil del tipo ABS, causan un retardo definitivo en su degra
dación, esta resistencia persiste aún después de un tratamiento
51
biológico normal . En los efluentes de las plantas de tratamiento de lodos activados se observa un 50% de degradación del ABS,
y un 90% de LBS,--con relación al influente, lo que da lugar a problemas cuando estas aguas se mezclan con cualquier cuerpo -receptor dado que no han sido completamente degradados dichas sustancias.
Son muchas las dificultades causadas por un alto contenido de detergentes en aguas y agua de desecho . En primer lugar es in-deseable la formación de espuma en ips ríos desde el punto de vista estético y a'su vez
la toxicidad de los surfactantes que
contienen representan un serio peligro a la flora y fauna acuática sin dejar de pensar que estas aguas al ser utilizadas para
irrigación, contaminen los suelos y por lo .consiguiente los cul
tivos.
Otro problema que resulta de la formación de espuma en las co-rrientes, es que esto dificulta la transferencia del oxígeno-atmosférico con el agua lo que también ocurre en las unidades de
aereacíón de planta's de tratamiento.
Además el contenido de los detergentes junto con otros nutrien tes, contribuye a una sobrepoblación de la flora acuática, especialmentealgas, las que
al
morir, por acción degradativa de los
microorganismos, ocasionan una mayor demanda de oxígeno, perju-dicial para los peces y para
el
propio cuerpo de agua ; este fenó
meno se conoce como eutroficaci6n .
-
NORMA
Degradación biológica de detergentes : Varios detergente en sus
comportamientos bioquímicos dependen de su estructura química .Los jabones comunes y alcoholes su!íatados son ampii :3 : :!ente usados como alimentación bacteriana . El campo de la .yndets con ó.
ter o amida son ampliamente hidrolizados . Los ácidos crasos pro
ducidos sirve como fuente de alimentación bacteriana . El otro producto hidrolizado puede o no puede servir como alimento baste
riano dependiendo de su estructura química . La síntesis prepar :3da de poifineros de óxidos de etiloao ac : resistentes al ataque biológico presumiblemente a causa del éter que contienen (C-O-C)
Los derivados del aquil benceno, sulfunatos del propileno son re
sistentes al ataque biológico porque de le estructura de rama en
cadena de los grupos alquilos y porque de les anillos bencónicos
son principalmente atacados por
los
átomos de un carbón tercia--
rio de la rama de cadena . Porque de esta resistencia, ellos persisten después de un tratamiento normal y ha contaminado ambas superficies y suministro de agua de riego con una desagradable propiedad espumosa . Por esta razón el servicio público de la U .S.
estableció un limite de concentración de (ABS) de 0 .5 mg/l . En
sus estandares de agua para consumo humano .
53
METODOLOGIA
Como el surfactante más comunmente usado en la fabricación de
detergentes es el sulfonato de alkil benceno o ABS, es el que
con mayor probabilidad se puede encontrar en las aguas crudas
de los abastecimientos . Por esta razón se ha seleccionado al
ABS, como el compuesto patrón para los métodos de análisis . Las aguas residuales, efluentes de plantas de tratamiento y aguas contaminadas, normalmente contienen gran cantidad de -sustancias que interfieren en la determinación de los surfactantes por lo que es dificil obtener un valor exacto de estos;
pero con los mismos métodos se pueden tener una estimación -aproximado.
Cuando se tiene concentraciones de ABS alrededor de 1 mg/l se
recomienda usar el método de azul de metileno ó el verde de me
tilo, pero en concentraciones mayores es múy importante que se
conozca cuanto representa el bérdádero ABS y cuanto las interferencias, récomendándose entonces la determinación infrarroja.
La principal desventaja de este último método en comparación con los otros es que su procedimiento es bastante complicado y
demanda mucho tiempo ; además el elevado costo del equipo infra
rrojo .
54
PRINCIPIO
Este m€todo depende de la formación de la sal colorida (Azul),
cuando reacciona el azul de metileno con los surfactantes . La
sal es soluble en cloroformo y la intensidad del color es proporcional a su concentración . La intensidad es medida en un es
pectrofot6metro a una longitud de onda de 625 mu.
INTERFERENCIA
Cuando se determina el ABS . en las aguas, los errores positivos
son más comunes que los negativos . Entre las interferencias positivas se tienen los sulfatos orgánicos, sulfonatos, carboxilatos,
fosfatos y fenoles, que forman complejos con el azul de metileno,
lo mismo que los cianatos, cloruros, nitratos y tiocianatos inorgánicos, que forman pares de iones con el azul de metileno, ocasionando interferencias positivos . materiales orgánicos, especial
menteaminas, pueden causar bajos resultados.
EQUIPO
1 .- Espectrofotómetro, para usarse a una longitud de onda de 625
mu .
provisto de un paso de luz de 1 cm . o más .
55
2 .- Embudo de
separación de 500 ml . preferemente con juntas de
teflón.
REACTIVOS
1.- Solución madre de sulfonato de alquil-bencilo (ABS) . Se pesan 1 .00 gramo de ABS . en base del 100% activo . Se disuelven
en agua destilada y se diluyen a 1000 ml:
1 .00 ml = 1 .00 mg de ABS . Se conserva en refrigeración para
evitar su biodegracibn . Es necesario prepararla cada semana.
2.- Solución patrón ABS . Se diluyen 10 .00 ml de solución madre de ABS a 1000 ml . con agua destilada:
1 .00 ml = 0 .010 mg de ABS . se debe preparar diariamente.
3.- Indicador de Fenolftaleina . Se disuelven 5 gr de fenolftalei
na en 500 ml de alcohol etílico o isopropilico al 95% y se
agregan 500 ml de agua destilada . Se agrega NaoH 0 .02 N . a gotas, hasta que aparezca una débil coloración rosa.
4.- Hidróxido de Sodio 1N.
Se disuelven 40 gr . de NaOH en agua destilada y se diluye a ,
un litro.
5.- Acido Sulfúrico 1 N.
Se diluyen cuidadosamente 28 ml de H 2 SO 4 concentrado en un litro de agua destilada .
56
6 .- Cloroformo, calida ACS.
7.- Reactivo de azul de metileno.
Se disuelven 100 mg de azul de metileno (Eostinan No . P 573
6 equivalente) en 100 ml de agua destilada . De esta solución
se pasan 30 ml a un matraz volumétrico de 1000. ml y se agregan 500 ml de agua destilada, 6 .8 ml . de ácido sulfúrico con
centrado y 50 gr . de Ortofosfato monosódico monohidratado (NaH 2 PO 4 . H 20), agitando hasta su completa disolución y se diluye hasta 1000 ml.
8.- Solución de lavado.
En un matraz volumétrico de 1000 ml se agregan 6 .8 ml de
H2SO4 concentrado a 500 ml de agua destilada . Se adiciona a
continuación 50 gr . de NaH 2 PO 4 . H 2 0 y se agita hasta completa disolución . Se diluye hasta el aforo.
PROCEDIMIENTO
1 . Prepare una serie de 10 embudos de separación con 0 .00, 1 .00,
3 .00, 5 .00, 7 .00, 9 .00, 11 .00, 13 .00, 15 .00 y 20 .00 ml, de la solución patrón de ABS . Se agrega agua destilada hasta un
volumen de 100 ml en cada embudo de separación . Se siguen los
pasos que se describen en las secciones 3 y 4, siguientes y se traza una curva de calibráción de mg . de ABS, contra absor
bancia .
.57
2 . Selección del volúmen de la muestra.
El volúmen de la muestra de agua para ser analizada se toma
de acuerdo con la concentración probable de ABS.
CONCENTRACION ESPERADA
DE ABS (mg/1 .)
0 .025
MUESTRA A TOMAR
"
(ml)
0 .080
400
0 .08
-
0 .40
250
0 .40
-
2 .00
100
10 .00
20
100 .00
2
2 .00
10 .00
-
Si el volúmen indicado de la muestra es' menor de 100 ' ml, se diluye con agua destilada hasta 100 ml . o más.
Extracción y desarrollo del color, poner la muestra a embudo de separación . Se alcaliza la solución con hidróxido de
sodio, usando fenolftaleina como indicador . A continuación
se acidula con ácido sulfúrico.
Se agregan 10 ml . de cloroformo y 25 ml . de azul de metileno, se agita vigorosamente por 30 segundos y, se permite que
se separen las fases.
Se extrae la capa de cloroformo ,a un 2o . embudo de separación y se lava el tubo descarga del ter . embudo de separa--
58
ción con una pequeña cantidad de cloroformo.
Se repite la extracción por 3 veces, usando 10 ml . de clorofor
mo en cada ocasión, si se desvanece y desaparece el color azul
de metileno en la fase acuosa, se agregan 25 ml . adicionales de azul de metileno.
Se combinan todos los extractos en el 2o . embudo de separación,
se agregan 50 ml . de solución de lavado y se agita vigorosamente por 30 segundos ; se deja reposar y se extrae la capa de cloroformo através de lana de vidrio a un matraz aforado de 100 ml
se repite el lavado por dos veces, usando 10 .ml . de cloroformo
en cada ocasión, se lava la lana de vidrio y el embudo con cloroformo, se recogen los lavados en el matraz aforado, se diluye
hasta el aforo y se mezcla bien.
Medición : Se determina la absorbancia de la solución a 652 mu,
contra un testigo de cloroformo.
mg/1 de ABS
Total aparente = mg de ABS x 1000
ml de muestra
59
F E N O L E S
GENERALIDADES
El fenol derivado monohidroxilado del benceno ; es ampliamente
usado como desinfectante y en la-sintesis de productos orgáni
cos, particularmente resinas del tipo fenólico . Se presenta como componente natural de las aguas residuales de las industrias del petróleo, gas de alumbrado, plantas de coque y de procesos que comprenden el uso del fenol como .materia prima.
El 'término "fenoles" incluye una mezcla de derivados de fenol,
como : fenoles orto, meta y para 'substituidos por halógenos 6
por un grupo alquilíco, aldehido, acrílico, nitro, bencilo, nitroso y del ácido sulfónico.
En un abastecimiento de agua, que contenga fénol propiamente
dicho` , usualmente estarán asociados otros compuestos fenóli-cos cuya sensibilidad a los reactivos usados en los métodos
de determinación no sean necesariamente los mismos . Como regla general, la introducción de grupos substituyentes en el
60
\.
núcleo del benceno baja la sensibilidad del compuesto
lar
particu-
para desarrollar color con el indicador.
El porcentaje de la composición de los diversos compuestos fenólicos presentes en una muestra dada es imposible . Por tanto
,es obvio que un estándard que contenga una mezcla de fenoles
no puede ser aplicable a todas las muestras . Por esta razón ; el
fenol propiamente dicho ha sido seleccionado como estándard
y cualquier color producido por la reacción de otros compues-tos fenólicos se reporta como fenol.
.a) IMPORTANCIA SANITARIA
Los fenoles son indeseables en abastecimientos de agua para -las .industrias alimenticias y de bebidas, debido a los problemas de sabor y olor resultantes.
Concentraciones muy bajas imparten un sabor tan desagradable que no es probable que cantidades perjudiciales puedan ser con
sumidas sin darse cuenta . Los limites de determinación reporta
dos están entre 10 y 100/g/l.
La remoción de olores fenólicos de un abastecimiento de agua
es un problema serio
'en
las plantas de tratamiento,para resol-
verlo, se usan varios procesos como : Super cloración, trata- miento con dióxido de cloro 6 cloro amoniaco, ozonización y -absorción con carbón activado .
61
En concentraciones bajas, las bacterias usan los fenoles =
como alimento . Las concentraciones letales para los peces
están relacionados, en parte con las especies, tiempo de contacto, temperatura y otras condiciones . Con base a ciertos dátos, 5 .0 ppm . pudieran ser tóxicos a la mayoría de -los peces, no así 1 .0 ppm . o menos.
b) NORMA
Ninguna substancia tóxica sola o en combinación con otras estará presente en concentraciones tales que conviertan el
agua del cuerpo receptor en inadecuada para
el
uso específi-
co a que se destine.
Abastecimiento de agua potable con tratamiento convencional
(coagulación, sedimentación, filtración y desinfección industrial).
El valor máximo permisible del fenol como substancia tóxica
en cuerpos receptores . El límite máximo en miligramos por litro, según la norma nacional vigente es de , 0 .001 mg/l.
METODOLOGIA
Los métodos analíticos para determinar fenoles incluyen técni
cas turbidimétricas, colorimétricas de infrarojos, ultraviole-
62
ta y cromatográficas . De estas técnicas, Ios métodos colorimétricos son los más ampliamente usados debido a su versatilidad
y relativo bajo costo .
-
El método de la 4-aminoantipirina con extracción es el más sen
sible, ya que-es capaz de detectar un microgramo por litro de
fenol como tal.
Determinación de fenoles por el método de la aminoantipirina
con extracción con cloroformo.
a) Principio
El método de la 4-aminoantipirina, determina fenol, fenoles -orto y meta substituidos y en condiciones adecuadas de pH aque
líos fenoles para substituidos. en los
que la substitución es
un carboxilo, halógeno .metóxido o grupo del. . ácido sulfónico .El
reactivo de . la 4-aminoantipirina reacciona con los fenoles en
presencia de un agente oxidante para formar un compuesto colorido sensible aunas cuantas partes por billón (ppb) . Con to-dos los fenoles simples el producto de la reacción del mismo color (rojo) aunque la , respuesta varia con diferentes fenoles
É1 fenol (C 6 H 5 OH) es más sensible y todos los resultados se re
portan por costumbre, en términos de fenol.
La reacción 'que se efectuó es la siguiente ;
63
CH3Ñ ~
=0
CN3 C ~ C— NNy,
its \
CN3 N
C- 0
043— C = C -N
it
0
Esta reacción se lleva a cabo a un pH de 10 para reducir la interferencia de la anilina y de otras aminas aromáticas . El tiempo para el desarrollo del color no es una variable, puesto
que la reacción se decolora lentamente, siendo notable su efec
to después de varias horas.
b) INTERFERENCIAS
Las aguas residuales,domésticas e industriales, pueden contener interferencias, como bacterias, que descomponen los feno-les,substancias oxidantes y reductoras y valores alcalinos de
pH . La degradación biológica es inhibida por la adición de sul
fato de cobre a la muestra . La acidulación con ácido fosfórico
asegura la presencia de condiciones alcalinas fuertes . Algunos
de los procedimientos de tratamiento usados antes del análisis
pueden requerir técnicas especializadas para la eliminación de
64
interferencias y para la recuperación cuantitativa de los compuestos fénólicos.
Algunas de las principales interferenciás pueden ser elimina-das como sigue:
1 .- Los agentes oxidantes como cloro y los detectados por liberación de yodo al acidular en presencia de yoduro de potasio, son removidos inmediatamente después del muestreo por la adi- =
. Si --cióndeuxso lfaterosdanitsóco
los agentes oxidante no son removidos los compuestos fen6licos
serán oxidados parcialmente y los resultados serán bajos.
c) EQUIPO
Aparato de destilación •todo de vidrio, que consta de un matraz
de destilación Pyrex, de un litro, con un condesandor GRAHAM.
Potenciómetro.
d) REACTIVOS
Todos los reactivos deben preparse con agua destilada exenta
de fenoles y cloro.
Solución de sulfato de cobre:
Disuelva 100 g de Cu SO 4 .5H 2 0 en agua destilada y diluya a un
litro .
65
Solución de ácido fósforico 1+9:
Diluya 10 ml de H 3 PO 4 al 85% con agua , destilada.
Indicador de anaranjado de metilo : Disuelva 0 .5 g de anaranjado de metilo en un litro de agua destilada.
Reactivos especiales para destilados turbios:
1) Acido sulfúrico 1N
2) Cloroformo o eter etílico
3) Cloruro de sodio.
4) Hidróxido de sodio 2 .5 N:
Diluya 41 .7 ml de NaOH 6N •a 100 ml o disuelva 10 g de NaOH en
100 ml de agua destilada.
e) PROCEDIMIENTO
Mida 500 ml de muestra en un vaso, baje el pH a 4 .0 aproximadamente con la solución de H 3 PO 4 1+9, usando el indicador de
anaranjado de metilo o un potenciómetro, agregue 5 ml de solu
ción de sulfato , de cobre y pase al aparato de destilación . -Use una probeta graduada de 500 ml . como receptáculo.
Las adiciones de ácido fosfórico y de sulfato cúprico pueden
omitirse si la muestra se preserba como se describió anteriormente.
f) Destile 450 ml . de la muestra, suspenda 1 á destilación-y---
66
cuando la ebullición cese, agregue 50 ml de agua destilada al
matraz de destilación . Continue la destilación hasta'que se haya colectado un total de 500 ml.
/
g) Una destilación debe sér suficiente para la purificación de
la muestra . Ocasionalmente, sin embargo, si el destilado es -turbio . En este caso, acidule el destilado turbio con H 3 PO 4 1+
9, agregue 5 ml . de la solución dé sulfato cúprico y destile como se describió en el párrafo anterior.
h) Tratamiento cuando el segundo ` destilado es turbio.
i) Extraiga una porción de muestra de 500 ml . como sigue:
j) Agregue 4 gotas del indicador, de anaranjado de metilo y suficiente ácido sulfúrico 1N para hacer Acida la solución . Pase
un embudo de separación y agregue 150 g . de cloruro de sodio . Agite con cinco adiciones de cióroformo, usando 40 ml . en la ; , rimera adición y 25 ml . en cada una de las adiciones siguien-. tes . Coloque la capa de cloroformo en un segundo embudo de sepa
ración y agite con tres adiciones sucesivas dé solución 2 .5. N de NaOH, usando 4 .0 ml en la primera adición y 3 .0 ml . en cada
una de las adiciones siguientes . Coloque la capa de cloroformo
en un segundo embudo de separación y agite .
67
c) EQUIPO
Espectrofotómetro o tómetro de filtro, para usarse a 460 mu, equipado con celdas de absorción de 1-10 cm dependiendo de las'
características individuales del fotómetro ; en general si las
lecturas de absorbancia son mayores de 1 .0 con un tamaño determinado de celda, use el tamaño pequeño siguiente:
Embudos del tipo Buchner con disco como de 15 ml # 36060 ó - equivalente.
Papel filtro un papel filtro adecuado, de 11 cm puede ser usado
para filtrar los extractos de cloroformo en lugar de los emb u dos Buchner y sulfato de sodio anhfdro.
POTENCIOMETRO
Embudos de separación de 1,000 ml forma squibb con tapón esmerilado y llave con tefl6n . Por lo menos se requieren 8 . Tubbs Ness
ler, pareados, de 50 ml de forma alta.
d) REACTIVOS
Deben prepararse con agua destilada exenta de fenoles y cloro.
Solución patrón de fenol.
Disuelva 1 .00 g de fenol, grado analítico, un agua destilada, recientemente hervida, enfriada y diluya a 1,000 mi . Ordinaria
mente, ésta pesada directa del fenol, constituye una solución va-
68
lorada . Sin embargo, si se requiere extrema exactitud, valorice como en el párrafo (4) posterior.
Solución intermedia de fenol:
Diluya 10 .0 ml de la solución patrón a 1,000 ml con agua recaen
temente destilada : 1 ml =10 .0/Lg de fenol :Prepare la solución
el día que se vaya a usar.
Solución estándar de fenol:
Dilüya 50 .0 ml de la solución intermedia de fenol a 500 ml con
agua destilada recientemente hervida y enfriada : 1 ml = 1 .0,&ig.
de fenol . Prepare esta solución dentro de las 2 horas de uso.
Solución de bromato de bromuro 0 .1N : Disuelva 2 .784 g de bromato' de potasio anhídro, K BrO 3 , en agua destilada agregue 10 g
de bromuro de potasio (KBr en cristales) . disuelva y diluya a
1,000 ml.
Acido clorhídrico concentrado.
Tiosulfato de sodio 0 .025 N:
Preparación : Disuelva 6 .205 g Na 2 S 2 O3 . 5H 2 0 en agua destilada
recientemente hervida y enfriada, después diluya a un litro.
Preserve por la adición de 5 ml . de cloroformo ó 0 .4 g de hi-dróxido de sodio, por litro.
Valoración : Disuelva 1 .226 g de dicromato de potasio, K 2 Cr 2 O 7 , '
q)reviamente secado a 103°'C durante 2 horas) en agua destilada
y diluya a un litro.
Disuelva 2 g . aproximadamente de yoduro de potasio, KI,exento de
69
yodato, en un matraz erlenmeyer con 100-150 ml . de agua destilada ; agregue 10 ml- de ácido sulfúrico H 2 SO 4 1+9 g . exactamente 20 ml . de la solución de dicromato de potasio . Deje en la oscuridad por 5 minutos diluya a 400 ml aproximadamente y valore -con la solución 0 .025 N de tiosulfato de sodio.
Normalidad =
20 x 0 .025
ml de tiosulfato
Solución de almidón : Agregue una supensión fría de 5 g de almidón soluble o de arrurruz a 800 ml . aproximadamente de agua en
ebullición con agitación.
Diluya a un litro, deje ebullir unos cuantos minutos y deje reposar todo la noche . Use el líquido sobrenadante . Preserve con
1 .25 g de Acido salicílico por litro ó unas cuantas gotas de tolueno.
Solución de cloruro de amonio:
Disuelva 50 g de NH4 C1 en agua destilada y diluya a 1,000 ml.
Solución de aminoantipirina:
Disuelva 2 .0 g de 4-aminoantipirina en agua destilada y diluya
a 100 ml . Esta solución debe prepararse el día que se use.
Solución de ferricianuro de potasio.
Disuelva 8 .0 g de K 3 Fe (CN) 6 en agua destilada y diluya a 100 ml
filtre si es necesario . Preparese cada semana .
70
CLOROFORMO
Sulfato de Sodio anhidro, granular.
Yoduro de potasio, cristales.
Valoración de la solución de fenol
A 100 ml . de agua destilada, en un matraz de 500 m . . con tapón
esmerilado, agregue 50 ml . de la solución patrón de fenol y 10
ml . de la solución bromato bromuro
0 .1N .
Inmediatamente agregue
5 ml . de ácido clorhídrico concentrado y agite suavemente el
ma
traz tapado . Si el color café del bromo libre no persiste, agre
iue porciones de 10 ml . de :solución de bromato de bromuro hasta
que el color persista . Guarde el matraz tapado y deje reposar .10
minutos ; luego agregue 1 g . aproximadamente de yoduro de po-
tasio . Usualmente 4 porciones de 10 ml . de solución de bromato
de bromuro se requieren, si
la
solución patrón de fenol contie-
ne 1,000 mg/l de fenol.
Prepare un blanco exactamente de la misma manera, usando agua destilada y 10 ml . de la solución 0 .01 N de bromato de bromuro.
Valore el blanco y la muestra con la solución 0 .025 N de tiosul
fato de sodio, usando solución dealmidón como indicador.
Calcule la concentración de la solución de fenol como sigue:
mg/l de fenol = 7 .842 ( RB-C )
Donde R = ml de tiosulfato para
el
blanco .
71
B = ml de la solución de bromato bromuro usados para la muestra
divididos entre 10 y C = ml . de tiosulfato usados para la muestra.
PROCEDIMIENTO
Coloque 500 ml del destilado o una alícuota adecuada diluida a
500 ml . en un vaso de 1 litro . Si se usar. 500 ml . del destilado,
no debe contener más de 50µg (0 .1 mg/1 de fenol).
Si la concentración aproximada de fenol de la muestra original no es conocida, determinese por un chequeo preliminar la alícuota
adecuada del destilado y del cloroformo para usarse en la determinación final . Esto puede hacerse sin extracción con cloroformo
efectuando la reacción en tubos de Nessler de 50 ml . comparándolas con los estándares adecuados de fenol.
Prepare un blanco de 500 ml de agua destilada y una serie de estándares de fenol de 500 ml . que contengan 5, 10, 20, 30, 40, 50 ,
pg de fenol.
Trate la muestra, blanco y estándares como sigue : Agregue 10 ml
de la solución de cloruro de amonio y ajuste el pH a 10,0 ± 0 .2
con hidróxido de amonio concentrado . Pase a embudos de separa- ci6n de un litro, agregue 3 .0 ml de la solución de antipirina, mezcle bien, agregue 3 .0 ml . de la solución ferricianuro de po--.
tasio, mezcle bien de nuevo y deje que el color se desarrolle en
72
3 minutos . La solución debe estar clara y ligeramente amarilla.
Extraiga inmediatamente con cloroformo : usando 25 ml . para celdas
de 1-5 cm y 50 ml . para celdas de 10 cm . Agite el embudo de se-paración por lo menos 10 veces, deje que el cloroformo se separe,
mezcle de nuevo 10 veces y deje que el cloroformo se vuelva a - separar . 4
Filtre cada uno de los extractos de cloroformo através de papel filtro o através de embudos de vidrio, filtrado que contenga una
capa de 5 g de sulfato de sodio anhídro . Colecte los extractos -secos en celdas limpias para las medidas de absorbancia no agre-gue más cloroformo .
-
Lea la absorbancia de la muestra y de los estandares contra el .•-blanco a una longitud de onda de 460 mu.
Grafique absorbancia contra g de los estándares de fenol para la
curva de calibración . Una curva de calibración debe ser construídi para cada fotómetro y debe checarse periódicamente para asegurar su reproducibilidad.
Cálculo µg/i de fenol =RR x 1,000
Donde R = (ig/l de fenol en la muestra, de la curva-de calibraci6n y
B
= 1 ml de la original.
Procedimiento alternativo
Si no se hacen análisis frecuentes de fenol, se debe preparar s6lo un estándar de fenol en lugar de una serie de soluciones y una
73
curva de calibración.
En este caso ; prepare un estándar de fenol de 600 ml . aproximadamente igual al contenido fenólico de la porción de muestra original usada para el análisis final . También prepare un blanco de 500 ml . de agua destilada.
Prosiga como se describió en los párrafos anteriores.
El cálculo del contenido de fenol de la muestra original es:
lig/1 de fenol = CD x 1,000
E
B
Donde C = ,)Mg de la solución estándar de fenol,
D = lectura de absorbancia de la muestra,'
, E = Absorbancia de la solución estándar de fenol y
B = ml de la muestra original .
74
GRASAS
Y
ACE I T L S
METODO DE EXTRACCION SO y:HLET
GENERALIDADES
En la determinación de grasas y aceites una cantidad de substancia especifica no es medida . Algunos grupos de substancias con características físicas similares se determinan cuantitativamente sobre la base de su solubilidad común en freón . Las grasas y .
aceites pueden así pues decirse que incluyen hidrocarburos, ácidos grasos, jabones, sebos, ceras, aceites, y cualquier otro material que se extrae por el solvente de una muestra acidificada
y que no se volatiliza durante las manipulaciones de la prueba.
Es importante que su limitación sea ampliamente entendiia . A diferencia de algunos constituyentes que representan distintos ele
mentos químicos, iones, compuestos o grupos de compuestos . Las grasas y aceites están definidos por el método usado para su determinación.
Los métodos presentes a que estan disponibles para lípidos bioló
gicos e hidrocarburos minerales en aguas de desecho y aguas de desecho domésticas . Ellos también estan disponibles para la ma-yor parte de aguas de desecho industrial, aunque ciertos dese- -
75
chos pueden dar bajos resultados porque de la presencia de cualquier concentración exctsiva :de grasas naturales o sintét .cas o
compuestos modificados que no son bien recuperados por el procedimiento estándard.
La industria moderna usa un número de grandes cadenas de compues
tos carbonados como lubricantes y emulsificante, tan buenos para
esos y otros propósitos . A menudo la composición de estos materiales difieren de la naturalezade las grasas y aceites, y pue-den ser más solubles en agua o más facilmente emulsificados
quo
los productos naturales . Como resultado ellos se comportan como
grasas y aceites en tratamiento de aguas y aguas receptoras, pero los problemas que ellos causan pueden acentuarse por sus propiedades especiales . El procedimiento descrito aquí puede .fracasar para-dar una completa recuperación de tales productos.
IMPORTANCIA SANITARIA
e
Las grasas y aceites son particularmente resistentes a la digestión anaeróbica, y cuando estan presentes en lodos causan acumulación de espuma en . los digestóres, tapan los poros de los fil- ,.
tros e impiden el uso de los lodos como fertilizantes.
Cuando estas substancias se descargan en aguas residuales o - -efluentes tratados, algunos de ellos causan películas superficia
les y depósitos de lineas de buques costeros .
76
El conocer las cantidades de grasas y aceites presentes en un
agua residual es útil para vencer dificultades en plantas de
operación, en la determinación de la eficiencia de las plantas
y en el control de las descargas subsecuentes de estos materia
les a las corrientes . Un conocimiento de la cantidad de grasa
presente en el lodo puede ayudar en el diagn6stico de la diges
tión y problemas del agua e indicar la disponibilidad de un lo
do particular para su uso como fertilizante.
NORMA
Para cuerpos de aguas receptoras, la norma nacional vigente
para la determinación de grasas y aceites es hasta una concentración de 650 mg/1.
METODOLOGIA
Para muestras líquidos existen tres métodos : Método A, partí-ción gravimétrica, Método B, Partición infrarroja y el método
C, de extracción Soxhiet.
El método B, es designado para muestras de hidrocarburos altamente volátiles através de una supuesta pérdida en la remoción
de la operación en el procedimiento gravimétrico . Método C, es
el método de selección cuando es relativamente polar o cuando
las fracciones de petróleo están presentes, o cuando los nive-
Ti ‘
les de grasas no volátiles pueden cambiar el límite desolubilidad del solvente'fre6n, para bajos niveles de grasas y acei-tes(menóres dé 10 ing/1), el método B es el de selección por-que
los
métodos" .gravimétricos no proporcionan la precisión ne-
césaiia para la'exactitud del trabajo.
El método,D es una modificación del método Soxhlet y está dis-
ponible para materiales lodosos , y similares . El método E, re-.
suelve problemas dq hidrocarburos de las grasas y aceites tota
les sobre las bases de la naturaleza de los compuestos polares
y no polares presentes y determinan los hidrocarburos separada
. ..
mente.
. PRINCIPIO
Los jabones metálicos solubles se hidrolizan por acidulación .Las grasas sólidas o viscosas que se absorben en el auxi li o
filtración, se separan por filtración de las muestras liquido.
A continuación se extrae la grasa en un aparato sóxhlet, usando hexano como disolvente y el residuo remanente después de
la .
evaporación del hexano, se pesa para determinar el contenido de grasa de . la muestra . Cuando se seca elfiltrq se pierden -
los compuestos que se volatilizan a 103°C ::o-menos . .
78
NTERFERENCIAS
El método es enteramente empírico y solo se pueden obtener resultados duplicados si se siguen estrictamente todos los detalles . Por definición cualquier material que se recupere se con
sidera como grasas y cualquier substancia filtrable, soluble en hexano, como es el caso del azufre elemental y de ciertos colorantes orgánicos, se extrae como grasas . Por las distintas
solubilidades de las diferentes grasas en el hexano, se deben
seguir con toda exactitud las indicaciones sobre la velocidad
y tiempo de extracci6n, además no se puede variar el tiempo -estipulado para el secado y enfriamiento de la grasa extraída,
pues se puede presentar un aumento gradual del peso, posible-mente debido a la absorci6n del oxigeno o bien una perdida gra
dual del peso debido a la volatización.
EQUIPO
I
Aparato de extracci6n, Soxhlet:
II
Bomba de vacío u otro sistema.
III
Embudo Buchner de 12 cm.
REACTIVOS
I
Acido clorhídrico, conc .
79
II N-Hexano comercial con punto de ebullición de 65°C-67°C
III Papel filtro Whatman número de 40 de 11 cm.
IV Discos de tela de muselina, de 11 cm.
V
Suspensión de auxiliar de filtración de silica de diato-meas . 10 gr por litro de agua destilada.
PROCEDIMIENTO
Se toma un volumen de aguas negras en un frasco . de boca ancha,
previamente aforado a 1 litro . Se acidula a pH 1 .00 ; por lo general son suficientes 3 ml . de ácido clorhídrico conc.
Se prepara un filtro que se forma con un disco de tela de muselina al que se sobrepone un disco papel de filtro . Se humedece
el papel y la muselina y se prensan bien en las orillas . Con la
aplicación de vacío, se pasan através del filtro 100 ml . de la
suspensión de auxiliar de filtración y se lava con un litro de
agua destilada, se sigue aplicando el vacío-hasta que no escu-rra más agua del filtro.
Se filtra la muestra acidulada através del filtro preparado . Se
sigue aplicando el vacío hasta que no escurra más agua del filtro.
Por medio de unas pinzas se pasa el papel filtro a un vidrio de
reloj y se le agrega el material que se adiera en las orillas
delá'tela"de ` mb ei'irin .`Se iimpfdn lbs lodds yel fbn'db del envase de muestra, 'lo ` ñ1ismo 'que ' él' ' âgit£dbr y ei`émbúdóBucl 'i '
`filtro `'émpnpados eñ r hezanb, temen'-ner,copdazseâl
do cuidado de rémuvér. ` Lbdá pél4cula ' qúe sédgba "á la grasa y
de recoger todos
los ' materiales
sólidos` ' Lospedaiós'de papel
filtro se agregan dl papel filtro del vidrio de reloj.
Se enrolla el papel filtro, con pedazos de papel .filtra-,usa ;,,,
dos en la limpieza, hasta que se puedan introducir en un cartucho de papel para , extraccibn,al que se vierten todos las
partículas que hayan quedado en el , vidrio de„reloj.
Se seca ei-cartucho cen''e1 : "papélfiltroen-estufa`a, .103'Cipor ::
30 minutos, se llena el cartucho con perlas pequeñas de vi- drio,se pesa el matraz de extracción, y empleando hexano como
disolvente, se extrae la grasa en un aparato soxhlet, a una
velocidad de 20 ciclos . por hora, durante-4 horas a partir del
primer ciclo.
Se destila
el
disolvente del matrni' :del'extractor ; , por calen-,z:
tamiento en baño maría a 85°C (si se redestila, se puede volver a usar el hexano) . Se seca el matraz en baño de vapor y se
hace circular aire por el matraz, por la inducción de un vacío
que se aplica durante 15 minutos.
Se enfría en desecador por 30 minutos y se pesa .
81
CALCULUS
mg/l de grasa total = mg de aumento de peso del matraz x 1000
ml de muestra
(
)
82
N I T R 0 G E N 0
Los diferentes tipos de nitrógeno son 'de gran interés debido 4
1:
l
la importancia que tienen en los procesos de la vida de plantas
y animales.
El nitrógeno tiene varios cambios de valencia inducidos por organismos vivos . Así pues las bacterias efectúan cambios de va-lenciapositivos o negativos dependiendo de . las condiciones pre
vias (aerobias o anaerobias).
Los desechos ' humanos y animales transportados por las aguas residuales contienen nitrógeno en'forma orgánica : En condiciones
aer6bicas las bacterias aut6trofas nitrificantes (el grupo de las nitrosomonas) convierte el amoniaco a nitritos aprovechando
la energía generada en tal oxidación.
En condiciones anaerobias los nitratos y nitritos se reducen me
diante el proceso llamado desnitrificac}6n . Posiblemente los ni
tratos se reducen a nitritos y a continuación se efectúa la reducción de los nitritos . Son pocas las bacterias que reducen los
nitritos a amoniaco ; la mayoria'de ellas, lo reducen a nitrógeno
gaseoso el cual escapa a la atmósfera .
, 83
IMPORTANCIA SANITARIA
Durante mucho tiempo el análisis de nitrógeno ha sido una base
de juicio para determinarla calidad sanitaria .. del
agua-.
A medida que pasa ' el tiempo el nitrógeno orgánico se convierte
en nitrógeno amoniacal y posteriormente, si se encuentra en -condiciones anaerobias se oxida a nitritos y nitratos . Por ejem
plo las aguas que contienen principalmente materia orgánica y amoniaco se considera que fueron recientemente contaminadas y por tanto de peligro potencial . Las aguas en las que el nitrógé
,no se encuentra en forma de nitratos se considera que fueron --
contaminadas mucho tiempo antes ypor tanto son menos dañinas a
la salud pública . Desde el punto de vista de la ingeniería sani
tária interesan únicamente cuatro tipos de nitrógenos : N-Amonia
cal, N-Orgánico, N-de Nitritos yN-Nitratos .
. ::
N- Amoniacal
La selección del método . se basa principalmente en la concentración presente . El método de Nesslerización es sensible a bajas
concentraciones de nitrógeno amoniacal de (20 ug/l hasta 5 mg/ .1)
A concentraciones superiores de / 5 mg/l es preferible usar el mé
todo de destilación .
84
Como las aguas naturales presentan valores variables del pH
y diferentes propiedades amortiguadoras, se agrega una solución amortiguadora de fosfato, para que la muestra se manten
ga a un pH constante durante el proceso de destilación.
MATERIAL Y EQUIPO
1.
Aparato de Digestión
Matraz Kjeldahl con capacidad de 800 ml.
Los mejores resultados se obtienen en matraces Kjeldahl de 800
ml . Estos matraces se llevan a un aparato de calentamiento que
alcancen una temperatura de 344-371°C que es la deseada para una digestión efectiva.
2.
Aparato de Destilación.
Consta de un matraz Kjeldahl, una trampa eficiente y un condensador vertical.
Las conexiones entre estas unidades pueden-hacerse con tubos de
hule . Todo el aparato debe limpiarse con vapor de agua antes de
usarse ; esto se logra destilando 500 ml . de agua exenta de amoniaco .
85 -
REACTIVOS '
1.
Agua Libre de Amoniaco.
Se puede preparar por intercambio iónico o por el método de destilación ; para el segundo caso se eliminan las trazas de amonio en el agua destilada normal adicionando a un litro de
agua destilada, 0 .1 ml . de H 2 SO4 concentrado y se redestila.
2.
Solución Amortiguadora de Fosfatos de pH 7 .4 '
Disuelva 14 .3 g de fosfato monopotásico y 68 .8 g de fosfato
dipatásico y diluya a 1 litro con agua exenta de amoniaco.
3.
Hidróxido de Sodio 1N
Disuelva \
g
de NaOH en agua exenta de amoniaco
y
diluya a
1 litro.
4.
Acido Sulfúrico 1N.
Agregue cuidadosamente 28,mlde H 2 SO 4 concentrado a 500 ml . de agua exenta de amoniaco y diluya a .1 litro .,
5.
Solución Indicadora de Acido Bórico:
Se .describe en la lista de reactivos para nitrógeno orgánico
86
PROCEDIMÍENTO
Coloque una determinada cantidad de muestra en un matraz Kjeldahl
El
volumen de la muestra varia según la procedencia del agua . Si
es necesario neutralice la muestra a pH = 7 aproximadamente con ácido a base diluidos usando potenciómetro, adicione 25 ml . de so
lución Buffer Ajustando a pH = 7 .4
Destilación
Para disminuir la contaminación, haga pasar vapor por el aparato
antes de que empiece la destilación-de la muestra . Vacié el matraz de destilación teniendo cuidado de dejar las perlas de vidrio . Vierta la muestra neutralizada y amortiguada .. Reciba el -destilado en un matraz erlenmeyer de 500 ml . que contenga 50 ml.
de absorbente de Acido bórico, procurando-que el tubo de salida
quede sumergido en el absorbente . Colecte por lo menos 300 ml . de
destilado, este volumen de destilado se titula con ácido sul-
fúrico 6 .02.
mg/1 =
H 2 SO 4 0 .02 N x 0 .28 x 100
N- Amoniacal
ml muestra .
87
NITROGENO ORGÁNICO (METODO KJELDAHL)
El nitrógeno orgánico incluye el nitrógeno de los aminoácidos,
minas, amidas, imidas y nitroderivados . En las aguas residua
les domésticas está en forma de proteínas o dé sus productos de degradación : polipéptidos y aminoácidos . La mayoría de los
cofipuestos orgánico's que contienen nitrógeno producen amoniaco
al ser oxidados . El método Kjeldahl emplea ácido sulfúrico como agente oxidante, y el amoniaco liberado se 'cuantifica por
los métodos de titulación o nesslerización . Para determinar ex
clusivamente el nitrógeno orgánico, se lleva a cabo una remo-ción previa del nitrógeno amoniacal presente.
Durante la digestión de la muestra con ácido sulfúrico se afta-den sulfatos de mercurio y potasio para aumentar la temperatura
de ebullición de la mezcla y asegurar así que todo el nitrógeno
orgánico sea liberado en forma de amoniaco.
MATERIAL Y EQUIPO
Aparato de digestión . Es el mismo que esta descrito en el material y equipo de nitrógeno amoniacal.
Aparato de destilación : Consta de un matraz kjeldahl, una trampa eficiente y un condensador vertical .
Las conexiones entre estas unidadelyue4en j hac?rsecoátOós4e
hule . Todo el aparato debe limpiarse con vapor de agua antes de
,
-
:''',::
usarse ; esto se logra destilando 500 ml de agua exenta de amo-.
:
'
, t rto ,
í;
5z
; ;
-'>
niaco .
.ol,El'.., :oM
REACTIVOS
. ;
51-
5
niJ5m
5L (:(a-,
,
.Ji.
. nt
.A
50'.;
.
5,il
. .''i!
Agua bidestilada exenta de amoniaco se indica en la preparación
o !ro t? lf., 5JIfi 15 II,F, U
de reactivos de nitrógeno amoniacal . ,
,:ob z,.,E
1 . Reactivo de Digestión .
Disolver 134
5bi :)A
alob .;Jsb ril nbiouf
de sulfato de potasio, en 650 ml . de agua des:3 .,
.--.o
c' I ; 5b o
tilada exenta de amoniaco y 200 ml deácido sulfúrico concenol3l .
-LIbLDL .,n, 5L .;m C' 5uo7gb
trado . Agregue, con agitación, una solución preparada por di-
- 5 :;1' . .''Yf[E.
z .a5r.5
5aoT
lución de 2 g . óxido mercúrico rojo, en 25 ml . de ácido sul-.' 'DtibIlue obi-DA
ffirico 6N .
,o'
-Gila,er,de esta- solución
r
-a ~iiá` (6emli6irtatilija
cr
'aff--ibraT 116= -Tll,e-C cti4r-ra- ¡eV-it
hbrItIz5b sure
2 ., :Lnilicadmr :de.
'/, f . r)
.011.9.1 ttritIE1W .aLl-JZ
-i s t abi z i6n.
n6L .DuloP
15
'o
))
.,
': .,tnCq9'f(T
c?
'fl'
'13LF3 :I i' ''':) .O
, Puede usarse ya sea la soluci6n acuosa o alcoholica.
10I
.) ' O'-f
o11z :: .,, 2
o TL ;i :'-t_
e
1. c -Disuelva p
5 rg) .
-
texe.nta, ide amoniacp
y
, dil_uY.4
disó.di
,-tul
t rP
,',,
c~gIn
'í,
c'
.
,s t ilácia, -de
sodio 0 .02 N gota a gota hasta que aparezca un color rosa tenue .
89
3. Hidróxido de Sodio-Tiosulfato de Sodio
Disuelva 500 g de NaOH y 25 de N ; S 2 0 3 . 5H 2 0, en agua destilada exenta de amoniaco y diluya a 1 litro.
4. Indicador Mezclado.
Disuelva 200 mg de rojo de metilo en 100 ml . de alcohol etilico al 958 o isopropilico . Disuelva 100 mg de metileno en 50 ml, de alcohol etilico al 95% o isopropilico y combine -las dos soluciones . Prepárese mensualmente.
5. Solución Indicadora de Acido Bórico
Disuelva 20 g de H 3BO 3 en agua destilada exenta de amoniaco agregue 10 ml de indicador mezclado y diluya a 1 litro prepárese mensualmente.
'6 . Acido Sulfúrico 0 .02 N.
Prepare una solución patrón aproximadamente 0 .1 N . diluyendo
2 . 8 ml de ácido sulfúrico concentrando a 1 litro . Diluya - 200 ml . de esta solución 0 .1 N a 1 litro con agua destilada exenta de CO 2 . Valorice el ácido con una solución de carbona-,
to de sodio 0 .02 N la cual ha sido preparada por disolución
de 1 .06 g de Na 2 CO 3 anhidro previamente secado a 140°C y dilu
yendo a un litro con agua destilada exenta de CO 2 . Para mayor
exactitud, incorpore el carbonato de sodio en la solución in-
90
dicadora
gin
iónb de G la muestra s l Una . soluciónb ex3,ctaTent~e J Q . 92 j.Nnge o ,~ci4o
.sul
-s<
ñ ór g i3,ei7ó quivayJ ntg qs
~80
.c~~ :,añ(
é?i pg ~i~3tQ~Qz m lc'i ,uc
PROCEDIMIENTO
(a -
.~~'.._~ x
A)
: . 1 `,gin
. ~ tfisg~:o
El residuo que ha qué Tadéáespü g Té _habe r einado
lim
el nitróge-
s
no amonical, enfríe el matraz y agregue cuidadosamente 50 ml . -del reactivo de digestión . Si se tienen presentes grandes cantidades de materia orgánica exenta de nitrógeno se agrega un volumen adicional de 50 ml de la solución acido por cada gramo de ma
tenia sólida en la muestra.
c7 iaeacn s .t loq 2obi S a ,02Otin
Se digiere la mezcla por ebullicion durante Z0 f. 30-•minutos, despues de que se haya clarifiéáde l ld o 4o€e&fárl ag el,@fifi'íe b elt7residuo
y se agregan 300 ml de agua exenta de amoniaco . Se alcaliniza con
50 ml de la solución hidróxido de Sodio-Tiosulfato de Sodio, usan
do fenolftaletia como indicador . Se`destila en-50 ml dé'solu ion
indicadora de ácido bórico, hasta que se Wá Riita léét£dó*+-róximadamente 200 ml . El volumen destilado se titula con acido sulf6rico 0 .02 N.
La solución de ácido bórico contiene el indicador de ácido bórico
mezclado y la titulación se suspende cuándo el color vire a viole
ta pálido.
El ácido consumido en esta titulación es equivalente al amoniaco
91
detenido y al contenido en nitr6geno de la muestra
Lleve un testigo a través de todos los pasos del procedimiento
al que fue sometida la muestra y aplique la corrección necesaria a los resultados.
mg / 1 N
orgânico _ ( A -
B)
x 280
ml muestra
Donde:
A = ml de H 2 SO 4 gastados por la muestra
B = mi de H 2 SO4 gastados por testigo.
El nitr6geno total se considera la suma de nitrógeno amoniacal
y nitrógeno orgânico .
92
NITROGENO DE NITRITOS
Los nitritos pueden estar en el agua como resultado de la descomposición biológica de los materiales proteicos . La concentra
ción de nitritos esta determinada a través de la formación de un color rojizo-violeta producido a pH de 2 .0 a 2 .5 por el comnleio de diazonio ácido sulfúrico con N-(1-Naftil) etilendiamino de hidrocloruro.
El tricloruro de nitrógeno imparte un color rojo falso, al adicionar los reactivos este efecto se reduce al adicionar el clor
hidrato de naftilamina y luego el ácido sulfanflico un color na
ranja puede resultar aún cuando esté presente una concentración
considerable de tricloruro de nitrógeno . Una revisión de cloro
libre y tricloruro de nitrógeno residual es recomendable en tal
caso.
Numerosos iones como : férrico, plomo, mercuroso, cloroplatinato
y metavanadato etc . interfieren por precipitación y otros por,
sus sales coloridas . El ión cúprico puede ocasionar resultados
baios al catalizar la descomnosición de la sal de diazonio .
,93
APARATOS Y EQUIPO
• Un espectrofot6metro
Material de cristalería (matraces erlenmeyer,pipetas volumétricas y graduadas, embudos, tubos Nessler, papel filtro
Whatman etc .)
REACTIVOS
1.
Agua libre de nitritos (especificaciones, Standars Methods)
2.
Solución de EDTA.
Disuelva 0 .5 g de etilendiamino-tetra-acetato dis6dico en
agua exenta de nitritos y diluya a 100 ml.
3.
Reactivo sulfonilamida : Disolver 5 g sulfanilamida en una
mezcla de 50 ml con HC1 y aproximadamente 300 ml de agua des
tilada, diluir a 500 ml con la misma agua.
4.
Solución dihidrocloruro etilendiamina.
Disolver 500 mg de dihidrocloruro en 500 ml . de agua destilada . Guarde en refrigerador para prolongar la vida útil del
reactivo, se recomienda además renovar la solución aproximadamente cada mes .
94
5.
Solución amortiguadora de acetato de sodio 2 M.
Disuelva 16 .4 g de Na C 2 H 3 0 2
6 27 .2 g de Na C 2H 30 2 . 3H 2 0
en agua destilada, exenta de nitritos, diluya a 100 mi . Filtre si la solución no es clara.
6.
Acido Clorhídrico 1+3.
7.
Solución madre de nitrito
Disuelva 1 .232 g de NaNO 2 agua destilada exenta de nitritos
y diluya a 1,000 ml.
1 .0 ml = 250 ug de N . Preserve con 1 ml de cloroformo.
NORMALlZACION DE LA .SOLUCION MADRE .
Se lleva a cabo con una solución de permanganato de potasio previamente valorada.
Preparación de la solución de permanganato de potasio 0 .05 N.
Disuelva 1 .6 g de KMnO 4 en un litro de agua destilada . Guarde en .
un frasco ámbar con un tapón esmerilado y déjelo reposar por lo
menos una semana . Esta solución requiere normalización frecuente
(una solución de KMnO 4
0 .05 N es equivalente a 1 .002 mg de Ca -
por cada 1 .00 ml).
Normalización de la solución de KMnO 4 0 .05 N.
Pese varias muestras de oxalato de sodio entre 100 y 150 mg, -agregue 100 ml de agua destilada y agite para disolver, agregue
(
95
10 ml de H 2 SO4 1 a 1 y caliente rapidamente__a 90-95°C, titule
rapidamente en la solución de permanganato de potasio agitando
constantemente hasta que de un color rosa débil persista per lo menos un minuto .'No deje que la . temperatura baje de 85°C, si es necesario caliente el contenido del vaso durante la titu
lación . 100 mg de oxalate de sodio consumirán aproximadamente 30 ml de solución de permanganato . Corra un testigo con agua -destilada y ácido sulfúrico.
gNormalidad
Na
KMnO 4
2 C2O 4
( .4-B) x 0 .06701
A = ml gastados por la muestra
B = ml gastados por el testigo
Promedie el resultado de varias titulaciones.
Pipetee 500. ml de KMnO4 0 .05 N,5 ml de H 2 SO4 concentrado y 50 ml de la solución madre de Na NO 2 en un matraz o frasco con
tapón esmerilado . Al colocar la solución madre de NaNO 2 sumerja .
la punta de la pipeta de nitrito abajo de•la superficie de la -.
solución ácida de permanganato.
Agite suavemente el matraz tapado . Caliente el contenido del ma
traz a 70-80°C en una parrilla cubierta . Remueva el color del permanganato agregando suficiente oxal'ate de . sodio 0 .05 N . - --
y6
(3 .35 g de Na 2 C2 O 4 grado primario por 1,000 ml . de solución) . Titule el exceso de oxalato de sodio con KMnO 4 0 .05 N hasta color rosa . Lleve un testigo de agua exenta de nitritos . A través
de todo el procedimiento y haga las correcciones necesarias enel cálculo final . Calcule el cóntenido de N de NO2 de la solución madre por la ecuación siguiente:
A =
( B x C ) - ( D x E ) x .7
F
A = mg/ml de N - nitritos de la solución ' madre de NaNO 2
B - ml totales de KMnO 4 usados.
C = Normalidad del KMnO 4
D = ml totales de reductor agregado.
' E = Normalidad del reductor
F = ml de la solución madre de NaNO2 tomados para la titulación.
Cada 1 .0 ml de KMn 0 4 0 .05 N consumido por dos nitritos corresponde a 1 .725 mg de Na NO 2
PROCEDIMIENTO
Eliminación de turbiedad y color.
Si la muestra contiene sólidos suspendidos y color agregue 2 ml.
de la suspensión de hidróxido de aluminio a '100 ml de la muestra
agite bien, deje sedimentar por unos minutos y filtre, desechando
las primeras porciones del filtrado .
97
f
DESARROLLO DE COLOR
a 50 ml . de muestra clara que ha sido neutralizada a un pH de '
7 6 una alícuota diluida a 50 ml, agregue 1 .0 mlsulfanilamida,
1 .0 ' ml de E .D .T .A . Dejar que reaccione aproximadamente de 3 a
8 minutos é inmediatamente agregue 1 .0 ml de naftil-etilendiami
na y mezclar inmediatamente . Espere entre 10 y 30 minutos a manera que se desarrolle un color púrpura rojo y" después midase el color a 543
um,
corra un testigo de reactivo y compare
-frecuentemente- con patrones conocidos de nitritos .
98'
NITROGENO DE NITRATOS
El nitrógeno de nitratos se encuentra en pequeñas cantidades
de aguas residuales domésticas recientes.
INTERFERENCIAS
La determinación de nitrógeno de nitratos enaguas residuales
industriales y domésticas se hace más dificil que en aguas natu
rales debido a las diferentes sustancias que interfieren como . son :
cloruros, nitritos, color y materia orgânica.
Los nitratos reaccionan con el ácido fenoidisulfónico para pro-.
ducir un nitroderivado, que en solución alcalina se reestructura para formar un compuesto amarillo (sal de diazonid)
EQUIPO
-
Espectrofotómetro
-
Un baño maría (ó estufa para evaporar)
Matraces volumétricos,
Tubos de Nessler
Cápsulas de porcelanas
Pipetas .
Erlenmeyer
99
-
Probetas graduadas
Embudo 6 .5 cm de diámetro
Papel filtro Whatman.
REACTIVOS
1
Reactivo de ácido fenildisulf6nico:
Se disuelven 25 g de fenol blanco puro en 150 ml . de H 2 SO4
fumante ( 15% de SO 3 libre ; se agita y se calienta por dos
horas en baño maría.
2.
Hidróxido de amonio concentrado o soluci6n de hidróxido de
potasio 12 N,
Disuelva 673 g de KOH en agua destilada, diluyendo a 1'it.
3.
Solución EDTA : Se trituran 50 g . de etilendiamino tetraacetato dis6dico dihidratado con 20 ml de agua destilada . Se agregan 60 ml . de NH 4 OH concentrado y se mezcla bien.
4. \ Solución patrón de sulfato de plata : Se disuelven 4 .40 g de
Ag 2 SO 4 , exento de nitrato, en agua destilada yse diluye a
1 litro ; 1 .0 ml equivale 1 .0 mg de Cl.
5.
Solución madre de nitrato : Se disuelve 0 .7218g . de KNO 3 anhi
dro y se diluye
de N .
a
1000 ml . Esta solución contiene 100 mg/l
100
6.
Solución patrón de Nitrato : Se evaporan a sequedad, sobre
baño maria, 50 ml de la solución madre de nitrato ; se disuelve este residuo con 2 .0 ml . del reactivo de ácido fenildisulfónico y se diluye a 500 ml con aguó destilada ; 1 .0 ml . igual 0 .01 mg de N = 0 .0443 mg de NO3
7.
Reactivos para el tratamiento de interferencias no usuales.
Hidróxido de aluminio : Se disuelven 125 g de alumbre de potasio o de amoni .o, K 2 Al 2 (SO4 ) . 24 H 2 O ó A1NH4
(SO 4 ) 2
-
12 H 2 0 en 1 litro de agua destilada . Se calienta a 60°C y se agregan 55 ml de NH 4 OH concentrado, lentamrntey con agi
tación . Se deja que la mezcla repose por una hora y se pasa
a un recipietite de mayor capacidad para lavar el precipitado
por adiciones (con mezclado adecuado y decantaciones sucesivas.
Solución de ácido sulfúrico, 1N . Con todo cuidado se diluye 28 ml de . H 2 SO 4 concentrado a 1 litro con agua destilada.
Permanganato de Potasio, 0 .1N . Se disuelven- 0 .316 g de K Mr, 0 4
en agua destilada y se diluye a 100 ml.
Solución diluida de peróxido de hidrógeno : Se diluyen 10 ml de
0
101
peróxido de hidrógeno al 30 por 100 ( de bajo contenido de =
nitrato), a 100 ml con agua destilada.
Solución hidróxido de , Sodio, 1N . Se disuelven 40 g de Na OH y se diluye a 1 litro con agua destilada.
PROCEDIMIENTO
1. ' Eliminación del color : Si la muestra p resenta un color ma-
yor
de 10 unidades, se decolora por la adición de 3 ml . de
de s1spensión de hidróxido de aluminió a 150 ml de muestra
Se agita perfectamente, se deja reposar por unos minutos y
se filtra, desechando la primera porción del filtrado.
2.
Conversión del nitrito : A 100 ml . de muestra se agrega 1 ml de H 2 SO 4 y se agita . Gota a gota y agitando se agrega la
solución de KMnO4 ó H 2 O 2 . Se deja reposar la muestra trata
da por 15 minutos, para completar la conversión del nitrito a nitrato.
Eliminación de clouros : Se tratan 100 ml de la muestra con
una cantidad equivalente de solución valorada de sulfato de plata . Se elimina el precipitado de cloruro, bien sea -
por centrifugación, coagulando por calentamiento
ro de plata .
el
cloru-
102
.4 . Evaporación y desarrollo de color : Se neutraliza la muestra
clasificada a un pH aproximadamente de . 7, se pasa a una cápsula y se evapora a sequedad en baño maría . Se mezcla el residuo perfectamente con 2 .0 ml de âcidofenildisulfónico - para asegurar la disolución de todos, los sólidos . Se diluye
con 20 ml de agua destilada y se agregan, con agitación umos
6 o 7 de NH 4 OH ó unos 5 a 6 ml . de KOH, hasta que se desarro
lle el color máximo . Se elimina cualquier hidróxido floculen
to. resultante filtrando con papel filtro o crisol 6 crisol de filtración, o agregando EDTA, a gotas y con agitación has
ta que se redisuelva el precipitado.
Transferir el filtrado a matraces volumetricos o tubos Ness'
ler de 50 o 100 ml y diluir a la marca y mezclar.
Hacer las lecturas fotométricas.
\i
103
S O L I D O S
Los sólidos se definen como la materia que permanece como residuo después de evaporar y secar a 103-105°C una muestra de
agua.
La importancia sanitaria en la determinación de sólidos con respecto a-aguas residuales, radica en el aspecto que puedan
impartir al . cuerpo receptor, principalmente cuando las aguas
de dicho cuerpo receptor tendrán un uso recreativo 6 para con
servación de flora y fauna . Asimismo son de gran importancia
en los costos de tratamiento impartidos a aguas residuales, en virtud de que aquellos son función directa de la cantidad
de sólidos que se vayan a aliminar en tratamiento como : coagu
lación, sedimentación, filtración, lodos activados . etc.
En cuanto a normas aplicables a aguas residuales se encuentra
unicamente la contenida en el Reglamento para la Prevención y
Control de la Contaminación de Aguas y que marca un máximo de
2000 mg/i de sólidos disueltos en cuerpos receptores cuya agua
tendrá uso recreativo, conservación de flora y fauna y usos in
dustriales .
104
b) Estufa de secado
c) Mufla
d) Desecador
e) Bomba de Vacio
f) Balanza Analítica
g) Discos de fibra de vidrio.
P R O t E D I M I E N T O
a) Colocar el disco de fibra de vidrio en el fondo de un crisol
Gooch y aplicando vacío lavar el disco con 3 porciones sucesivas de agua destilada . Trasladar el criso Gooch a la estufa de
secado a 103 - 105°C, por 1 hora . Colocar en desecador el tiem
por necesario para enfriar, pesar inmediatamente y volver a co
locar en el desecador hasta que se use.
b) Tomar un volumen de muestra que no_ contenga más de 200 mg de sólidos suspendidos, La muestra deberá estar bien mezclada) y
filtrar bajo vacío en el, crisol Gooch ya preparado . Trasladar
el crisol a la estufa de secado a 103-105°C por 30 min . cuando
menos, enfriar en desecador y pesar . Repetir el ciclo de secado hasta obtener peso constante .
105
mg/1 de sólidos disueltos
= mg/1 de s6lidos — mg/1 de s6lidos
totales
suspendidos.
SOLIDOS TOTALES FIJOS Y VOLÁTILES
El principal objetivo para efectuar estas determinaciones es --
obtener una medida de la materia orgánica presente . Esta prueba
consiste, en un procedimiento de combustión en mufla, durante la
cual la materia orgánica se convierte en CO 2 y H 2 O
PROCEDIMIENTO Y CALCULO
a) Llevar a ignición el residuo obtenido en el procedimiento de
s6lidos totales, a una temperatura de 550°C en mufla eléctrica, hasta peso constante.
b) Enfrie, coldque en desecador y pese .
106
DETERMINACION DE SOLIDOS TOTALES
Los sólidos totales, representan la totalidad del material sus-pendido y disuelto que contiene el agua, y se determina evaporan
do y secando una muestra a una temperatura definida.
E Q U I P O
a) Cápsula de porcelana de 100 ml.
b) Estufa de secado (180 ± 2°C)
c) Baño Maria o estufa de secado.
'd) Desecador
e) Balanza analítica
f) Mufla .
PROCEDIMIENTO
a) Se lleva a ignición la cápsula de porcelana a 550 ± 50 0 C por 1
hora en mufla.
b) Enfríe, deseque, pese y coloque en desecador hasta que se
use .
107
c) Transferir el volumen de muestra adecuado a la cápsula ya pesada y . evaporar a sequedad en baño Maria o estufa de seca
do . El volumen de agua debe contener entre 25 y 250 mg . de
sólidos . Auxiliese con el valor de conductividad . Si se eva
pora en estufa de secado la temperatura debe ser menor a la
temperatura de ebullición para prevenir pérdidas por proyec
ciones.
d) Secar la muestra evaporada 1 hora a 103-105°C.
e) Enfriar en desecador y pesar.
f) Repetir el ciclo de secado a 103-105°C, desecado y pesado hasta obtener peso constante.
C A L C U L O
mg/1 de sólidos totales
= (A-B) x 1000
ml .de muestra
En donde:
A = Peso del residuo + Peso de la cápsula.
B = Peso de la cápsula .
108
INTERFERENCIAS
Se deben excluir partículas de gran tamafio•flotantes y materiales
no homogéneos de la muestra . Dispersar perfectamente en toda mues
tra partículas de aceite y grasa
NORMA NACIONAL
La Norma Nacional marca un rango entre 500 y 1000 mg/1 de Sólidos
Totales en aguas potables.
SOLIDOS SUSPENDIDOS TOTALES
Los S6lidos Suspendidos son aquellos materiales que pueden ser retenidos en discos de fibra de vidrio después de la filtraci6n y se
determinan secando dichos s6lidos a 103-105°C.
Su importancia radica fundamentalmente en la 'determinación de la
eficiencia de plantas de tratamiento ya que tienen una correlación
directa con la Turbiedad.
E Q U I P O
a) Crisol Gooch de 50 ml de porcelana .
109
C A L C U L O
mg/1 de Sólidos Suspendidos Totales
_ (
A-B ) x 1000
ml de muestra
En donde:
A= Peso de Sólidos Suspendidos
+ Peso de Crisol.
B= Peso de Crisol.
SOLIDOS DISUELTOS
En aguas potables la mayoría de la materia está en forma disuel
ta y consiste principalmente en : sales inorgánicas, pequeñas cal
tidades de materia orgánica y gases disueltos.
Los sólidos disueltos se pueden determinar a partir de la condu<
tividad eléctrica, por el uso de un factor empírico, en-,una
for-
ma aproximada 6 bien por diferencia entre los resultados . obteni-
dos en las determinaciones de sólidos totales y sólidos suspen-•
didos de acuerdo a la siguiente fórmula :
110
CAL C U L O
El residuo obtenido en la cápsula después de pesar, representa
los sólidos fijos totales, por lo tanto se calculan de acuerdo
a la siguiente fórmula:
mg/1 de sólidos fijos totales
=
(C-B)'x 1000
ml de muestra.
en donde:
C = Peso del residuo después de la ignición + peso de la cápsula.
B = Peso de la câpula.
Y finalmente los sólidos volátiles totales se calculan por diferencia:
mg/l de sólidos volátiles totales
= mg/1 de sólidos totales - mg/1 de sólidos fijos totales .
111
SOLIDOS SUSPENDIDOS FIJOS Y VOLATILES
En esta determinación se volatiliza por ignición a 550°C la materia orgánica (sólidos volátiles) contenida en los sólidos sus
pendidos retenidos . en el disco de fibra de vidrio en la determi
nación de sólidos suspendidos totales.
PROCEDIMIENTC Y CALCULO
a) Llevar a ignición el residuo obtenido en el procedimiento de
sólidos suspendidos totales, a una temperatura de 550°C en mufla eléctrica, por 15 minutos.
b) Enfríe, coloque en desecador y pese.
CALCULO
El
.residuo obtenido en el crisol después de pesar, representa
los sólidos suspendidos fijos, y se calculan de acuerdo a la . siguiente-fórmula:
mg/1 de sólidos suspendidos fijos =
(C-B) x 1000
1000 de muestra
112
En donde:
= Residuo obtenido después de la ignición + peso del crisol.
B + Peso del
crisol.
Los'sblidos suspendidos volátiles se calculan por diferencia:
mg/l de sólidos suspendidos volátiles
= mg/1 de sólidos suspendidos totales
mg/1 de sólidos suspendidos fijos .
113
CADMIO ,
El cadmio es altamente tóxico y ha sido implicado en algunos
casos de envenenamiento por alimentos . Pequefias cantidades de cadmio, se sospecha que sean las responsables de cambios
adversos en arterias de riñones humanos . Una concentraci6n de cadmio de 200 ug/1 es tóxico para ciertos peces . De otra
manera, hay una indicación de que el cadmio puede ser importante en la dieta alimenticia . La concentración de cadmio en
agua potable en E .U ., Se ha informado que varia entre 0 .4 y
60 ug/1, con un promedio de 8 .2 ug/1 . El cadmio se puede introducir al agua como el resultado de descargas industriales
6 el deterioro de tubo galvanizado.
PRINCIPIO
El método se basa en la reacción del cadmio presente en el -
agua con la ditizona para dar un complejo de ditizonato de cadmio de color rojo .el cual se extrae con cloroformo y se cuantifica colorimetricamente a una longitud de onda de 515
mU . Este método es aplicable en aguas naturales residuales
para un limite de detecci6n de 0 .01 mg/1 .
114.
REACTIVOS
Los reactivos que a . continuación se mencionan, deben ser grado analítico y deben almacenarse en recipientes de polietileno o de vidrio libre de cadmio, cuando se hable de agua debe
entenderse agua bidestilada, desionizada y exenta de cadmio.
1.-
Acido clorhidrico (HC1) concentrado.
2.-
Acido Nítrico (HNO 3 ) 1 :1
3.-
Acido perclórico (HC10 4 ), al 70%
4.-
Acido Sulfúrico (H 2 O 4 ) concentrado
5.-
Alcohol etílico (C 2 H 5 OH), al 95%
.6 .7 .-
C1,oroformo (CH C1 3 )
Hidróxido de amonio (NH 4 OH) concentrado
8 .- . Peróxido de hidrógeno (H 2 0 2 ), al 30%
9.-
Tetracloruro de carbono (C C1 4 ) '
10.-
Solución de hidróxido de amonio (NH 4 OH), 1 :99
11.-
Soluci6n de hidróxido de sodio (NaOH), IN.
Disolver 10 gde hidróxido de sodio en 250 ml de agua.
12.
Solución de hidróxido de sodio 6 N.
Disolver 240 g de hidróxido en agua y aforar a un litro.
13.
Solución de dimetilglioxima (C4 H 8 N 2 0 2 )
Disolver 1 g de dimetilglioxima en 100 .ml de alcohol etílico al 95% .
115
14
Solución concentrada de ditizona I, ( C
H N S )
13 12 4
a) Disolver 250 . mg de cristales de ditizona en 50 ml . de cloroformo, almacenar en botella ámbar y refrige-
ración.
b) Filtrar a través de papel filtro y lavar con 2 o 3
porciones de 15'ml de cloroformo.
c) Transferir el filtrado a un embudo de separación de
250 ml . de capacidad y extraer con porciones sucesivas de hidróxido de amonio 1 :99, hasta que desaperezca el color verde de la capa de cloroformo.
d) Desechar la capa de cloroformo y lavar los extractos
combinados con cuatro porciones de 15 ml de cloroformo . Desechar los extractos de cloroformo.
e) Precipitar la ditizona por adición de 2 ml de ácido
clorhídrico concentrado, y agitar vigorosamente para neutralizar totalmente el amoniaco.
f) Extraer la ditizona precipitada con dos o tres porciones sucesivas de 25 ml de cloroformo y finalmente di-luir a 250 ml . con cloroformo los extractos combinados
Conservar en refrigeración.
15
Solución concentrada de ditizona II
a) Disolver 125 mg de cristales de ditizona en 50 ml de
116
cloroformo.
b) Filtrar a través de papel filtro y lavar con dos o tres porciones sucesivas de 15 ml de cloroformo.
16 .
Solución diluida de ditizona II
a) Diluir 40 ml de la solución concentrada de ditizona
I a 100 ml con tetracloruro de carbono . Preparar cada vez que vaya a usar.
17 .- Solución de Tartrato de sodio y potasio (KNaC 4 H 4 O 6 .4H 2 0)
a) Disolver 50 g de tartrato de sodio y potasio en 250 ml
de agua.
b) Transferir a un embudo de separación de
S00
ml, agi-
tar con dos o tres porciones de 50 ml de solución de
ditizona II en tetracloruro de carbono para eliminar
las impurezas de metales presentes en el reactivo.
c) Remover la ditizona II y su producto de oxidación de
color amarillo por extracciones sucesivas con porcio
nes de 50 ml de cloroformo hasta que los extractos permanezcan incoloros.
d) Remover el cloroformo con extracciones sucesivas dos
a tres porciones de 50 ml de tetracloruro de carbono
(esta solución debe prepararse cada vez que se vaya
a emplear .)
117
18 . .- Solución Patrón de Cadmio.
a) Solución patrón concentrada de cadmio (100 ug/ml)
Disolver 100 .0 mg de cadmio metálico puro en 20 ml de agua y 5 ml de ácido clorhídrico concentrado, aforar a
1000 ml con agua, 1 ml de esta solución equivale a - -100 ug de cadmio.
'b) Solución patrón dilufda de cadmio (2 .5 ug/ml)
I. Transferir 5 .0 ml . de la solución patrón toncen trada de cadmio a un matraz Erlenmeyer de 250 ml.
II. Agregar 2 ml de Acido clorhídrico concentrado y diluir a 200 ml con agua . 1 ml . de esta solución
equivale
a
2 .50 ug de cadmio (esta solución debe
prepararse cada vez que se vaya a usar).
MATERIAL Y EQUIPO
1.
Material común de laboratorio.
2.
Equipo colorimetrico ; se necesita uno de los siguientes:
a) Espectrofotómetro para usarse a un longitud de onda de 515 mu provisto de un paso de luz de 1 cm con celdas de 1 cm.
b) Fotocolorimetro de filtro equipado con filtro verde para usarse a una longitud de onda de 515 mu, provis-
lls
to de un paso de luz de 1 cm . Equipado con sus cel-
das correspondientes.
3.
Potenciómetro y/o papel indicador de pH
MUESTREO Y CONSERVACION DE MUESTRAS
La muestra se debe colectar de acuerdo a lo indicado en norma
de muestreo, en frascos' de poliétileno y preservarse añadiendo
ácido nítrico concentrado por litro de muestra.
INTJiRFERENCIA
La mayor interferencia resulta cuando se tienen cantidades elevadas de zinc (relación zinc-cadmio mayor de 500 :1) que reducen
la posibilidad de extraer los trazos de cadmio y general resul tados bajos.
De otra manera se puede determinar cantidades de cadmio de 2 .5
a 25 ug en presencia de 0 .25 mg de cada uno de los siguien-
tes iones : cobre, cobalto y zinc y de 2 .5 mg de acetato, aluminio, antimonio, arsénico, bismuto, cromo, cianuro, hierro, plomo, manganeso, mercurio, níquel, fosfato, plata, sulfito, tar-trato, tiocianato, tiosulfato, estaño y otros iones comunes .
119
PROCEDIMIENTO
Preparación de,la curva de calibración
a) Colocar en una serie de embudos de separación de
125 ml . (color ámbar), los volumenes de solución
patrón diluida de cadmio indicados en la tabla 1.
e
TABLA No . 1
VOLUMENES PARA LA CURVA DE CALIBRACION
SOLUCION PATRON DILUIDA DE CADMIO
DE,
CONTENIDO DE CADMIO
2 .5 ug /ml
tR
( ml )
0 .0
1 .0
2 .0
4 .0
6 .0
8 .0
10 .0
( mg )
0 .0000
0 .0025
0
0
0
0
.0050
.0100
.0150
.0200
0 .0250
120
b) Diluir entre 15 a 20 ml . con agua, agregar 10 ml, de
solución de tartrato de sodio y potasio y 4 .2 ml
de hidróxido
de
.sodio 6N . Continuar con el método
normal para determinación de cadmio en la muestra.
c) Transferir una porción adecuada de cada solución
nal
fi-
a una celda de absorción de 1 cm . y medir su - -
,absorbancia a 515 . Usar como referencia tetracloruro
de carbono o un blanco preparado con 20 cm de agua y
proseguir según el inciso b.
NOTA : Si el tetracloruro de carbono se usa como referencia,
corregir las lecturas de absorbancia de los patrones
restando la absorbancia del blanco.
d) Trazar la gráfica de los valores de absorbancia corre
gidos contra los ug de cadmio.
2.
Tratamiento de la muestra
a) Tomar un volumen de muestra según el contenido de - cadmio esperado de acuerdo a la tabla No . 2 .
TABLA No . 2
MUESTRA PARA ANÁLISIS
CONTENIDO DE CADMIO
VOLUMEN DE MUESTRA
ESPERADO
RECOMENDABLE
( mg/1 )
( ml )
1000
1
1000,
1 - 10
lo .-
100
100 - 1000
100
10
1
NOTA : Cuando se tienen contenidos bajos de cadmio (< 1 mg/1 )
es recomendable concentrar la muestra evaporando en un mismo vaso ; porciones de 250 ml, hasta obtener un volumen final de 15 a 20 ml.
b) Digestión con ácido nítrico -•ácido sulfúrico (para
muestras 'con materia orgánica fácil de oxidar).
I Acidificar al anaranjado de metilo a un pH menor de 4 .2 con ácido sulfúrico concentrado, agregar 5 ml de
ácido nítrico concentrado y 2 ml de peróxido de hidra
geno al 30% .
122
II Evaporar un bafio maría o en placa de calentamiento hasta tener un volumen aproximado de 15 a 20 ml, cubrir el recipiente con un vidrio de reloj.
III
Transferir completamente el contendio del reci- piente a un matraz erlenmeyer de 125 ml, enjuagar
con 5 ml . de ácido nítrico concentrado.
IV Agregar al matraz unas perlas de vidrio y 10 ml de ácido sulfúrico concentrado.
V . Evaporar en una parrilla ó placa de calentamiento,
bajo campana de extracción, hasta que aparezcan humos densos blancos de anhídrido sulfúrico en el
matraz, y no 2alentar más allá de este punto . Si
no se ha clarificado la solución, agregar 10 ml.
más de ácido nítrico y repetir la evaporación a humos blancos de anhídrido sulfúrico ( Se debe te
ner la seguridad de la eliminación total de ácido
nítrico, identificado por la claridad de la solución y por la ausencia de humos rojizos en el matraz.
VI Enfriar la solución a temperatura ambiental y diluir con agua cuidadosamente hasta tener un volumen cercano a 50 ml .
123
VII Calentar en una placa de calentamiento casi a ebullición paró disolver las sales solubles y filtrar a través de un crisol Gooch provisto de
un disco de fibra de vidrio 6 en un crisol de vidrio de fondo poroso.
VIII Transferir el filtrado a un matraz volumétrico
de 100 ml enjuagar el filtro con 2 porciones de
5 ml de agua y aforar . Continuar a partir de (3)
c) Digestión con ácido nítrico-âcido perclórico (para muestras con materia orgánica dificil de oxidar)
I , Acidificar al anaranjado de metilo a un pH menor
de 4 .2 con ácido nítrico y agregar un exceso de 5•ml . procediendo como (b-II a b-V).
II
Enfriar y adicionar 5 ml de ácido nítrico, 1 :1, -10 ml de ácido pdrel6rico al 70%, unas perlas de
vidrio y evaporar en bafio maría hasta desprendi- miento de humos.
Continuar como se indica en (b-VI a b-VIII).
NOTA : Evitar llevar a sequedad debido al peligro de explosión .
124
3.
Determinaci6n de cadmio en la muestra.
a) Tomar una alícuota de la muestra digerida, que con
tenga de 25 a 200 ug de cadmio y colocarla en un vaso de precipitado de 150 ml.
b) Agregar 0 .2 ml de ácido clorhídrico concentrado para precipitar la plata presente en la muestra, agitar y dejar reposar por 2 minutos.
c) Filtrar si es necesario y lavar con agua . Al filtrado . y los lavados agregar 5 ml de la solución de tartrato de sodio y potasio y ajustar a un pH de con
H Cl conc . 6 NH4 0H conc.
d) Transferir 14 solución a un embudo de separación de
125 ml, y efectuar tres extracciones con porciones de 5 ml . de solución de ditizona I en cloroformo has
ta que la capa de ditizona permanezca verde . Agitar
vigorosamente en cada extracción y desechar los ex-tractos.
e) Lavar con porciones de 10 ml de cloroformo hasta que
la capa orgánica permanezca incolora, desechar los -lavados . Finalmente lavar con una porciinde 5 ml . de
tetracloruro de carbono y desechar los lavados .
125
f) Transferir la solución acuosa a un vaso de precipitados de 150 ml y afiadir 5 ml , de solución de tartra
to de sodio y potasio.
g) Ajustar el pH de la solución a 8 .5 - 9 .0, adicionan
do hidróxido de amonio concentrado.
h) Agregar 5 ml de la solución de dimetil-glioxima y ajustar vigorosamente durante 30 segundos.
í) Extraer con tres o más porciones de 10 ml de cloroformo hasta la desaparición de cualquier precipitado blanco de dimetil en exceso .' Desechar los extrac.
tos.
j') Lavar la capa acuosa con 5 ml de tetracloruro de --carbono y desechar el lavado.
k) Agregar 4 .2 ml de NaOH6N al embudo de separación y mezclar . En seguida adicionar 5 ml de solución de
tizona II en tetracloruro de carbono y agitar oigo-rosamente.
1)'Transferir la capa de tetracloruro de carbono a un
embudo de separación limpio de color ámbar.
m) Extraer la capa Acuosa con una segunda porción de 5
ml de solución de ditizona II en tetracloruro de -carbonoy combinar las capas orgánicas .
126
n) Continuar extrayendo con porciones de 3 ml de solución de ditizona II en tetracloruro de carbono hasta que los extractos orgánicos permanezcan incolo-ros o ligeramente amarillos y agregar estos extractos a los anteriores.
ñ) Lavar 2 veces los extractos orgánicos combinados con porciones de 10 ml . de hidróxido de sodio 1N y
. 10 ml . de agua, y finalmente con 20 ml de agua . Desechar la capa acuosa en cada paso.
o) Filtrar la solución roja del complejo de ditizonato
de cadmio a través del papel filtro Whatman No . 5 6
similar y colocar el filtrado en un matraz volume-trico de 25 ml.
p) Lavar el papel filtro con una porción de tetracloru
ro de carbono.
q) Aforar con tetracloruro de carbono y mezclar bien.
NOTA : Es recomendable que el material que se maneje sea de color ámbar, se pueden proteger los embudos de separa-
ción y el matraz volumétrico cubriéndolos con papel -aluminio, evitando la exposición del extracto a
luz .
la
--
127
r) Transferir una porción adecuada de la solución de
tetracloruro de carbono a una celda de absorción de 1 cm.
s) Leer la absorbancia de esta solución dentro de los
primeros 15 minutos siguientes •a la extracción, a una longitud de onda de 515 mu usando tetracloruro
de carbono puro como liquido de referencia.
, CALCULUS
1 .- Las concentraciones' de cadmio se calculan por medio de siguiente fórmula :'
a) Cálculo directo mg/i de Cd = A/B x 1000
b) Cálculo por dilución mg/l de Cd = (A/B x 1000) xlOO/c
Donde :
A = Contenido de cadmio leido en la curva de calibración
en mg.
B'= Volumen de muestra, . en ml
C) = Volumen de la alícuota, en ml.
1000
= Factor de conversión.
100/c
= Factor de dilución .
128
Norma de Cadmio en agua para uso recreativo, conservación de
flora, fauna y usos industriales es de 0 .01 mg/l .
129
C
El
O B R E
cobre puede encontrarse en aguas naturales o desechos indus-
triales como de precipitados o sales solubles de cobre . Para un
metabolisomo normal del cuerpo se requieren trazas de este elemento y su ausencia provoca anemia en los niños.
Las sales de cobre se .dosifican en estanques para el control de
vida de plantas acuáticas, se ha demostrado que es tóxico a los
peces.
Más de 1 mg/l de cobre imparte sabor amargo al agua.
METODO COLORIMETRICO
DE
LA
NEOCUPROINA
Este método es aplicable para aguas naturales y residuales, con
un limite mínimo de detenccidn de 0 .003 mg de cobre para un paso de luz de 1 cm .
PRINCIPIO
En soluciones neutras o ligeramente ácidas los iones cuprosos reaccionan con la neocuproina de color amarillo, el cual se extrae con cloroformo y se cuantifica espectrdfotometricamente a
una longitud de onda de 457 nm .
1
1
-130
REACTIVOS
Los reactivos que a continuación se mencionan deben ser grado analitico a menos que se indique otra cosa y cuando se hable de
agua, se debe entender agua bidestilada o desionizada y exenta,
de cobre . Las soluciones preparadas para este análisis, deben almacenarse en recipientes de Tolietileno o de vidrio libre de
cobre.
1 Cloroformo (CHC1 3 )
2 Alcohol metilico (CH 3 OH)
3 Acido Nítrico (HNO 3 ), concentrado.
4 Acido Nítrico (H%10 3 ) 1 :1
5 Acido Sulfúrico (H 2 SO 4 ), concentrado.
6 Hidroxido de amonio (NH 4 OH) concentrado.
7 Hidroxido de amonio (NH 4 OH), 5 N.
' Aforar 330 m 3 de hidróxido de amonio concentrado a litro de agua.
Reactivo de neocuproina.
Disolver 0 .10 g de 2,9 dimetil-1,10 fenantrolina semihi-dratada on 100 cm 3 de alcohol metflico .
131
NOTA 1 : En las condiciones de almacenamiento esta solución es
estable por un mes.
9
Solución de clorhidrato de hidroxilamina (NH 2 OH . HC1)
Disolver 50 g de clorhidrato de hidroxilamina en
450
cm 3
de agua.
10
Solución de citrato de sodio (Na 3 C 6 H 5 O 7 . 2H 2 0)
Disolver 150 g de citrato de sodio en 400 cm 3 de agua, agregar 5 cm 3 de reactivo de clorhidrato de hidroxilamina
y 10 cm 3 de reactivo de neocuproina ; extraer con 50 cm 3 de cloroformo la impureza de cobre de la solución y dese-
char la capa de cloroformo.
11
Solución patrón concentrada de cobre:
11 .1 Pesar 0 .200 g de cobre electrolítico pulido y pasarlo a
un matraz Erlenmeyer de 250 cm 3 .
11 .2 Agregar 10 cm 3 de agua y 5 cm 3 de ácido nítrico concentrado y después es estabiliza la reacción, calentar suavemente para completar la disolución del cobre y hervir hasta el total desprendimiento de los óxidos de nitrógeno, se -
debe realizar en campana de extracción.
11 .3 Enfriar la solución y agregar 50 cm 3 de agua.
11 .4 Transferir el contenido a un matraz volumétrico de un li--
r
132
tro y aforar con agua 1 .00 cm 3 de esta solución equivale
a 0 .200 mg de cobre.
Solución patrón diluida de cobre.
Transferir 50 cm 3 de la solución patrón concentrada de cobre a un matraz volumétrico de 500 cm 3 y aforar con agua;
1 .00 cm 3 de esta solución equivale a 0 .020 mg de cobre.
MATERIAL Y EQUIPO
1
Material común de laboratorio
NOTA 2 : Todo el material de vidrio o polietileno empleado en este método debe enjuagarse con HNO 3 1 :1 y enseguida con
agua.
2
Equipo colorimétrico se necesita uno de los siguientes:
2 .1 Espectrofotómetro para usarse a una longitud de onda de
457 nm, provisto de un paso de luz de 1 cm con sus celdas
correspondientes.
2 .2
Fotómetro de, filtro provisto de un paso de luz de 1 cm o
mayor equipado con un filtro violeta de banda restringida,
que tenga una transmitancia máxima en el ámbito de 450 a
460 nm, con sus celdas correspondientes .
133
0
MUESTREO Y CONSERVACION DE LA MUESTRA
Las muestras se deben colectar en frascos de polietileno, preservarse añadiendo 5 cm 3 de ácido nítrico concentrado por ún litro de muestra colectada y refrigerándose a 4 6 5°C.
INTERFERENCIAS
1
La determinación del cobre por el procedimiento que se recomienda, se encuentra virtualmente libre de interferen-cias por otros iones metálicos.
2
La interferencia del cromo se puede evitar por la adición
del ácido sulfuroso para reducir los cromatos y el ión crómico complejo.
3 En presencia de estaño y de cantidades excesivas de otros
ionesoxidantes se debe emplear un volumen adicional de -clorhidrato de hidroxilamina no mayor de 20 cm 3 .
4
Las interferencias producidas por el cianuro y el sulfuró
se eliminan durante el proceso de digestión .
134
PROCEDIMIENTO
Preparación de la curva'de calibración.
1 .1 Preparar un blanco de referencia, colocando 50 cm 3 de agua, 1 cm 3 de ácido sulfúrico concentrado en un embudo
de separación de 125 cm 3 y proceder como se indica en 1 .B
1 .2 Colocar en una serie de embudos de separación de 125 cm 3
los volumenes de solución patrón diluida de cobre indicados en la Tabla No . 1
VOLUMENES PARA LA CURVA DE CALIBRACION
Solución Patrón
Diluida de Cobre
Contenido de
(cm3)
( m g)
0 .5
1 .0
2 .0
4 .0
0 .010
0 .020
0 .040
0 .080
6 .0
8 .0
0 .120
0 .160
10 :0
0 .200
Cobre.
11 .3 Diluir a 50 cm 3 con agua, agregando 1 cm 3 de ácido sulfúri
co concentrado y proceder corl'se indica del i'nciso 1 .B a
135
1 .4 Graficar las lecturas de absorbancia obtenidas contra los
mg de cobre.
1
Tratamiento de la muestra.
1 .1 Digestión de ácido nítrico-ácido sulfúrico, (para muestras
con materia orgánica facilmente oxidable).
1 .2 Transferir 100 cm 3 de muestra a un vaso de precipitado de
250 cm 3 agregar 1 cm 3 de ácido sulfúrico concentrado y 5 cm 3 de ácido nítrico concentrado.
1 .3 Evaporar en una ' parrilla o placa . de calentamiento hasta que aparezcan humos blancos densos de anhidro sulfúrico en
el vaso de precipitados y no calentar más alfa de este
punto en campana de extracción.
1 .4 Si la solución permanece colorida, enfriar y agregar
5 cm 3
de ácido nítrico concentrado y repetir la evaporación hasta la aparición de humos blancos de anhidro sulfúrico hasta la ausencia de humos ' rojizos, si fuera necesario repetir esta operación hasta que la solución se presente incolora.
1 .5 Enfriar
la
solución a temperatura ambiente y diluir con --
agua cuidadosamente hasta tener un volumen de 80 cm 3 '
1 .6 Calentar en placa de calentamiento a ebullición para disol
ver las sales solubles y enfriar .
136
1 .7 Filtrar con crisol de vidrio poroso y transferir el filtrado a un matraz volúmetrico de 100 cm 3 , enjuagar
rar
con
y
afo-
agua.
1 .8 Proceder a la determinación de cobre como se indica en el
punto siguiente:
1
Determinación de la Muestra
1 .A Tomar exactamente 50 .0 cm 3 o una porción-adecuada de la muestra digerida que contenga de 0 .004 a 0 .2 mg de cobre
y transferirla a un embudo de-separación de 125 cm 3 . Si ha
sido usado un volumen pequeño, diluir a 50 cm 3 con agua.
1 .B Agregar 5 cm 3 de solución de clorhidrato de hidroxilamina
f
y 10 cm 3 de solución de citrato de sodio y mezclar bien.
I
1 .0 Ajustar el
pH
de la muestra aproximadamente a 4, adicionan
do incrementos de 1 cm 3 de hidróxido de amonio 5 N, Si se
ha efectuado la digestión un ácido sulfúrico, se necesitan
5 cm3 de NH4 OH 5 N por cada 10'cm 3 de muestra.
1 .CH Agregar 10
cm 3
del reactivo de neocuproina y 10 cm 3 de clo
ro£ormo y agitar vigorosamente durante 30 segundo para extraer el complejo cobre-neocuproina en el cloroformo.
1 .D Dejar que la mezclase separe en 'dos capas .
/
Transferir la capa de cloroformo a un matraz volumétrico -
137
de 25 cm 3 .
1 .E Repetir la extracción de la capa acuosa con una porción adicional de 10 cm 3 de cloroformo y agregar este extracto
al anterior.
1 .F Diluir los extractos combinados con alcohol metílico y -aforar a 25 cm3 . Tapar y mezclar cuidadosamente.
1 .G Transferir una porción apropiada de la solución orgánica
final a la celda dé absorción.
1 .H Leer en el espectrofotometro la absorbancia de esta solu-ción a una longitud de onda de 457 nm usando el blanco como líquido de referencia.
CALCULOS
La concentración de cobre se calcula por las siguientes -fórmulas:
1.
Cálculo Directo.
mg/l de cobre = A x 1000
B
2.
Cálculo por Dilución.
mg/1 de cobre = A x 1000
100
X
138
Donde:
A Y Contenido de cobre leido en la curva de calibrac :ibn, en mg.
B = Volumen de muestra original en cm.
C r Volumen de
la-alícuota en cm .
139 .
C R O M O
1
H E X A V A L E N T E
GENERALIDADES
1 .1 El Cromo Hexavalente reacciona con la difenilcarbazida para
producir una coloración violeta rojiza, en soluciones ligeramente ácidas.
1 .2 Interferencias : En el paso del desarrollo de color se pueden
tener las siguientes interferencias . Los iones mercurosos y
mercúricos producen coloraciones azul a azul violeta, aunque
la reacción no es sencible con la acidez que se emplea . El hierro en concentraciones mayores de 1 mg/l interfiere produ
cidiendo una coloración amarilla con el reactivo . El vanadio
interfiere en la misma forma, pero con mayor intensidad ; el
color que produce el 'vanadio se desvanece con bastante rapidez y es despreciable después de 10 minutos de la adición de
la difenilcarbazida.
1 .3 Concentración minima identificable : Por comparación visual en tubos de nessler de 50 ml, se puede identificar una con-
centración de 0 .003 mg/l de cromo . El límite es de 0 :005 mg/i.
cuando se usa un trayecto de luz de 5 cm en mediciones foto-métricas .
140
Reactivo de difenilcarbazida:
Se disuelve 0 .2 g de 1 .5 difenilcarbahidrazidaen 100 ml . de
alcohol etílico o isopropilico al 95% ; se agrega con agitación, una solución ácida que se prepare con 40 ml de H 2 SO 4 conc .
y 360 ml . de agua destilada . Si se conserva 'refrigera-
da la solución es estable aproximadamente por un mes . Su co- .
lor cambia del incoloro al amarillento, sin afectar suutili
dad.
Solución madre de Cromo : se disuelve 0 .1414 g de bicromato de potasio, K 2 Cr 2 O 7 , en agua destilada y se diluye a 1000 ml
Está solución contiene 50 mg/1 de Cr.
Solución Patrón de Cromo:
Se diluyen 20 mi de la' solución madre de cromo a 1000 ml . -Esta solución contiene 0 .01 mg de cromo hexavalente por 1 .00
ml . Se prepara diariamente.
d) Procedimiento
Se usa una muestra de 50 .0 ml . o una porción alicuota diluída a 50 ml . con . agua destilada exenta de cromo . Si es necesario se clarifica por centrifugaciób . Se agregan 2 .5 ml del -reactivo de difenilcarbazida y se mezcla bien, se compara vi=
sualmente con,-patrones que contengan de 0 .003 a 0 .20 mg/1 de
Cr.
Se prepara una curva de calibración en el ámbito de cromo de
0 .005 a 0 .40 mg/1, si se va . apiicar la medición fotom6trica
141
a) Importancia sanitaria.
Las sales de cromo se usan ampliamente en los procesos in-dustriales y también como inividores de la corrosión, por lo que pueden llegar las aguas pothbles por las descargas de desechos industriales.
Para el control de la corrosión se agregan frecuentemente
compuestos de cromatos a las aguas . El Cromo se puede presentar en las aguas, tanto en forma hexavalente como en la
trivalente, aunque la forma trivalente rara vez se presenta
en las aguas potables.
b) Norma
El
valor máximo permisible,del cromo hexavalente como subs-
tancia tóxica en los cuerpos receptores . El límite máximo en
miligramos por litro según la norma Nacional vigente es de 0 .05 mg/l, abastecimiento para sistemas de agua potable e in
dustrias alimenticia con desinfección unicamente.
2
METODOLOGIA
a) Principio
Selección del método : El método A es aplicable para la deter
minación del Cromo Hexavalente presenta en aguas naturales o
tratadas, que se'destinan para usos potables . El método del
142
Permanganato nitruro (B) se recomienda para la' determinación
del cromo total en muestras .que contengan materia orgánica y
es el'método de selección para la determinación del cromos.to
tal en muestras desconocidas . El método del hipobrgmito alca
lino . (C) Es útil como método de control para el cromo total
en aguas tratadas, aunque no se puede considerar adecuado pa
ra muestras que contengan una cantidad apreciable de materia
orgánica.
b) Equipo Colorimétrico.
Se necesita uno de los siguientes:
Espectrofotbmetro, para usarse en 540 mu, con un trayecto de,
luz de 1 cm ó mayor.
Fotómetro de filtro, con un trayecto de luz de 1 cm o mayor
y equipado con un filtro verde que tenga su transmitancia máxima en '540 mu.
Tubos de Nessler de 50 ml . pareados de forma alta.
c) Reactivos
Agua exenta de cromo : se redestila, si es necesario, en un
aparato íntegro de cristal'Pyrex, se puede obtener un agua
satisfactoria pasando agua destilada a traves de un lecho -mixto de resinas de presentación fónica .
143
a 540 mu, con un trayecto de luz de 5 cm . Las comparaciones
o lecturas se verifican entre los 5 y 15 minutos después de
la adición del reactivo.
Muestreo y Almacenamiento
Como los iones cromato tienen la tendencia de absorberse en
las paredes de los recipientes y como también se puede-reducir por varios agentes, se deben observar precauciones para
la recolección y almacenamiento de la muestra.
Para la recolecci6n de las muestras deben usar frascos nue vos, en vez de recipientes viejos y rayados . La muestra se debe examinar el mismo día de su recolecci6n y no se reco--mienda su almacenamiento por más de 2 o 3 días.
Cálculo
mg/1 de Cr hexavalente =
mg de Cr hexavalente' x 1000
ml de muestra
144
NI QUE L
El níquel raramente se encuentra en aguas naturales pero frecuen-
temente se presenta en desechos industriales por baños de níque-lado . ,
DETERMINACION
o
Método de la dimetilglioxima.
Se puede .aplicar en aguas naturales y residuales, en un ámbito de 50 a 250 ug de Ni . El método por espectrofotometria de absor -
ción atómica es más adecuado para el análisis de este elemento, solo en el caso de que no se cuenten con el equipo necesario, se
recomienda usar el método colorimétrico:
INTERFERENCIAS
Turbiedad y color en las muestras causadas principalmente por materia orgánica sobre todo, en aguas residuales, impiden el desarro
110 y medición del color . En este caso es necesario hacer una di-
gestión con ácido nítrico-ácido sulfúrico antes del desarrollo
del método
'145
Hierro y Cobre interfieren por lo que es necesario una separación preliminar de estos elementos y en Níquel (ver tratamiento para separar Hierro y Cobre)
RESUMEN
DEL
MET0D0
Para la determinación del Níquel, la muestra es sometida a una
digestión preliminar con una mezcla ácida para eliminación de
interferencias . Posteriormente el cobre y el hierro son separados mediante extracciones con . una solucción de cupferrato,el
níquel se separa entonces de otros iones por . extracción de un complejo de dimetil-glioxima con cloroformo, se extrae nuevamen
te a una fase acuosa ácida y se hace reaccionar nuevamente'con
la solución de dimetil- .glioxima, pala el desarrollo del color y
se mide ' su absorbancia fotometricamente .
c
REACTIVOS
Los reactivos que a continuación se mencionan deben ser grado
analítico y el'agua debe ser destilada.
-SOLUCION INDICADORA DE ANARANJADO DE METILO .
Disolver 50 .0 mg del indicador en polvo enagua y diluir a - 100
cní3 con agua .
146
ACIDO SULFURICO, H 2 SO 4 , concentrado
ACIDO NITRICO, .HNO 3 , concentrado.
PEROXIDO'DE HIDROGENO, H 2 O 2 , 30%
SOLUCION PATRON DE SULFATO DÉ NIQUEL
. Disolver 447 . 9 mg de sulfato de níquel NiSO 4 .6H 2 0 en agua llevar a 1000 ml . en matraz volumetrico 1 ml . = 100 ug de Ni.
SOLUCION ESTÁNDAR DE SULFATO DE NIQUEL
Toma 100 cc de solución patrbd y llevar a 1000 cc en matraz•volum6trico 1 cc = 10 ug de Ni.
SOL . DE ACIDO CLORHIDRICO, HC1, IN.
AGUA BROMADA
Saturar agua destilada con bromo
HIDROXIDO DE AMONIO, NH 4 OH, concentrado
REACTIVO DE AMONIO . NH 4 OH, concentrado
REACTIVO DE DIMETILGLIOXIMA
Disolver 1 g de C 4 H 8 N 2 O 2 en 100 cc de agua (C 4 H $ N 2 O 2 dimetil glioxima)
ALCOHOL ETILICO al 95%
SOLUCION DE TARTRATO DE SODIO, Na 2 C 4 H 4 O6 .2H 2 O.
Disolver 10 g de Na 2 C 4 H 4 O 6 . 2H 2 0 en 90 cm 3 de agua.
SOLUCION DE HIDROXIDO DE SODIO, NaOH, 6N.
ACIDO ACETICO, HC 2 H 3 O 2 , concentrado
SOLUCION CUPFERRON (C 6 HgN 3 O 2 )
147'
' Disolver 1 g . de cupterron en 100 cm 3 de agua . Preparar cada -
vez que se use.
CLOROFORMO CHC1 3
SOLUCION DE CLORHIDRATO DE HIDRÓXILAMINA,NH 2 OH .CH1.
Disolver
10
g de NH 2 OH .HC1 en 90 cm 3 de agua . Preparar diaria-
mente.
APARATOS
i
Espectofot6metro para usarse a 44Snm provisto de un paso de luz de un cm.
Baño 'de vapor o parrilla de calentamiento con control de temperatura.
Las muestras se colectan en recipientes de plástico, en caso de
no efectuarse de inmediato el análisis, preservarlas añadiendo
5 cm 3 de HNO 3 concentrado por un litro de muestra.
PROCEDIMIENTO
Para agua potable no se efectua la siguiente digestión.
Digestión con Acidos Nítrico y Sulfúrico.
De acuerdo a la concentración esperada del metal tomar un volumen
de muestra perfectamente homogénea de acuerdo a la siguiente tabla :
148
CONCENTRACION
ESPERADA mg/1 .
<1
VOLUMEN DE
MUESTRA (cm 3 )
1000
1-10
100
10-l0Ó
10
100-1000
1
Colocar en una cápsula de evaporación y acidificar al anaranjado de metilo con ácido sulfúrico concentrado.
Agregar 5 cm 3 de ácido nítrico concentrado y 2 mi . de peróxido
de hidrógeno al 30%.
Evaporar a 15 6 20 ml en un baño de vapor o parrilla de calentamiento, evitando proyecciones.
Transferir
la
solución evaporada junto con cualquier sólido nue-
vamente a un matraz erlenmeyer de 125cm 3 .
' Lavar la cápsula con 5 cm 3 de HNO 3 y 10 cm 3 de H 2 SO 4 concentrados y agregar al matraz.
Agregar una perlas de vidrio y evaporar hasta desprendimiento de humos densos, blancos de SO 3 . Suspender el calentamiento.
Si la solución no está clara, agregar 10 cm 3 de HNO 3 concentrado y repetir la evaporación hasta desprendimiento de humos de SO 3 .
NOTA : En este punto, todo el HNO 3 debe haber sido removido, esto indica por la claridad de la solución y la ausencia de
humos cafés en el matraz .
149
Enfriar a temperatura ambiente y diluir con agua aproximadamente 50 cm 3 .
Calentar hasta cerca del punto de ebullición para disolver to-das las sales solubles'.
Filtrar a través de un filtro de fibra de vidrio.
Lavar el matraz y el filtro con dos porciones de 5 cm3 de agua.
Transferir cuantitativamente el filtrado con los lavados a un
matraz volumétrico de 100 cm 3 .
-
Llevar 'a la marca con agua y mezclar vigorosamente y de esta solución tomar porciones para el análisis.
PREPARACION DE LA CURVA DE CALIBRACION
Transferir con pipeta cantidades de solucioó estándar
en matraces volumétricos de 100 cm 3 .
cm 3 de solución
ug de Ni
estandar
0.
o
.5
50
10
100
15
150 -
20
200
25
250
•
y , colocar
\ 150
Agregar 25 cm 3 de solución de HC1 IN y 5 cm de agua bromada.
Enfriar con una corriente de agua fría, agregar 1 cm de
t.
NH 4 0H .concentrado
.
Agregar 20 cm 3 de la sol . de dimetilgiioxima sal dis6dica Y
3,
.e(a,. .ar
20 cm 3 de alcohol etílico . Aforar con agua destilada y méz,f, L
ciar . Dejar reposar por 10 minutos.
Medir la lectura de absorbancia de los estándares'á 445•üm
Trazar , +lacurva de calibración .graficándo, las, lecturas de , T
las absorbancias contra sus••r,espectiyas concentraciones.
TRATAMIENTO. PARA SEPARAR, IIERI{O Y COBRE-1•,'•
r, = +,.
Tomar una porción de la muestra tratada po' , d,igestidn , cón HNO 3 -HZSO 4 , conteniendo entre ,50 .•y ,50_ ug de i Nk . Cólocar en, un
embudo de separación.
Agregar' 1 .0cm3 de, solución, de tártratu ; de ,so; dio , ,y ; 2 , gótas
(0 .1 . cm 3 ) del indicador de anarajado de meti.l,o . ., , n,
Agregar gota' a• gota solución de Hidr6xido. de sodio. 6N hasta el
.
vire del 'indicador dé
Agregar 1 cm 3 de ácido acético y énffiar colocando
en •Una corriente dé'agü"a' fríár ' ''
-• ,,?
Agregar 4 cm 3 del reactivo de cupferron recien .pre.parado . MezcFat:
Agregar 10 cm 3 de cloroformo y mezclar bien.
Dejar reposar para :separar,: la$, fases y, continuar agregando pequeñas cantidades de cupferron hasta que seforne i un precipita
do blanco.
151
Mezclar agitando el embudo, permitir que se separen las fases y .desechár la capa de cloroformo.
Lavar con 10 cm 3 de cloroformo y . desecharlo.
Agregar 1 cm 3 de , solución de clorhidrato de hidroxilamina,
mezclar y dejar reposar unos minutos-y proceder a la separación del níquel.
SEPARACION DEL NIQUEL
la
Agregar a ' la solución del embudo 10 cm 3 de
tilglioxima sal disódica y mezclar .
Agregar 15 cm
que separen
Pasar
sol . de dime--
'
de CHC1 3 y mezclar bien . Dejar reposar para -
las'
la r capa de'
fases.
CHC1 3 'a un segundo embudo de separación y -
repetir esta operación con dos porciones más de 10 cm 3 de -CHC13, y adicionar ' al'CHC1 3 de la primera extracción .Dese-char la capa acuosa.
Agregar al embudo que contiene el cloroformo el CHC1 3 , 15 cm 3
de solución de Acido clorhidrico de HC1 1 ON . ' Mezclar bien y
dejar reposar para separar las fases.
Regresar la capa-de cloroformo al primer embudo v lavar con 10 cm 3 de solución de HCi1 .ON.
Agregar 15 cm 3 de HC1 concentrado y desechar la capa de cloro
formo.
Transferir todas las porciones de ácido clorhidrico a un'ma--traz volumétrico de 100 cm 3 .
152
Continuar con el procedimiento exactamente en la misma forma
que para la curva de calibración.
C A L C U L 0 S
Determinar la concentración de Ni en las muestras leyendo en
la curva de calibración la concentración correspondiente a las lecturas de sus absorbancias y aplicando la siguiente fórmula .
mg de Ni = A x .
.
B
L
100
C
Donde:
A = Concentración de Ni leida en la curva de calibración en ug.
B = Volumen de muestra tomado para el análisis en cm 3 .
C = Volumen de la porción tomada para el análisis (después de
la digestión con H 2 SO 4 -HC1) en cm 3
153
PLOMO ,
El plomo es un elemento, que no se encuentra naturalmente en el
cuerpo humano . Es acumulativo y tóxico y la ingestión de agua
que lo contenga en pequefias cantidades puede dar lugar a sinto
mas de envenenamiento con plomo (conocido como saturnismo).
PRINCIPIO
El método se basa en el hecho de que los elementos que interfieren con la extracción del plomo a un pH de 8 á 9, en un medio dé cianuro, se pueden eliminar por una extracción preliminar a pH de 2 a 3.
Después de la eliminación de los elementos interferentes, se agrega tartrato para evitar la formación de hidróxido y se lle
va la solución a pH de 8 a 9 con hidróxido de amonio y cianuro
de sodio . A continuación, el plomo se extrae con una solución
diluida de ditizona . Como se usa un exceso de ditizona, el color rosa del ditizonato de plomo se enmascara por el intenso color verde del exceso de ditizona, este exceso se elimina de
la capa de tetracloruro de carbono con una solución alcalina "de cianuro que .deja al ditizonato de 'plomo en el disolvente or
154
gánico . La solución de ditizonato de plomo,se diluye a un volumen dado y se determina su intensidad del color con un colorí-metro o espectrofotometro, o por comparación con patrones.
INTERFERENCIA
Los elementos que interfieren con la extracción del plomo en el
medio de cianuro a pH de 8 a 9 son estafio estannoso, talio y -bismuto . El talio se encuentra tan rara vez que su interferencia apenas se puede tomar en consideración ; por otro lado, el bismuto y particularmente el estaño, se presentan con cierta -frecuencia, por lo que se les debe prestar atención.
La muestra se llena primera a humos con ácidos percl6rico y nítrico ; para eliminar los compuestos orgánicos y a continuación
se trata con acetato de hidrazina para reducir el estado de - oxidación de aquellos elementos y compuestos que son capaces de
oxidar a la ditizona . Con la reducción se . logra que el' estaño y
el hierro se encuentren en estados de valencias inferiores .A pH
de 2 a 3, la ditizona forma complejos con cobre, bismuto, estaño
mercurio y plata, y tanto estaño como bismuto se eliminan en -esta forma, para que no puedan causar interferencia con la extrac
ción del plomo a pH de 8 a 9 . Como se pueden existir cantidades
155
relativamente grandes de bismuto, estaño o cobre, se usa una solución concentrada de ditizona en cloroformo, para que se puedan eliminar estos elementos.
Aplicación : El método se ha desarrollado para que se puedan cuantificar 0-0 .075 mg de Pb en presencia de 0 .10 mg de cada uno de los siguientes iones : Ag+, Hg++, Be", Cu ++ , Cd++ , - As +++ , Sb+++, Sn++++ Fe+++ Al +++ Cr+++ Ni++, Co++ Mn ++' Zn ++ , Ca++ , Sr ++ , Ba++, Mg++, Na+ , K+ , y NH 4 + ,
APARATOS
' 1 . Equipo colorimétrico : Se necesita uno de los siguientes:
a) Espectrofotómetro, que se pueda usar a 520 mu y que permita un trayecto de luz de 1 cm, o mayor.
b) Fotómetro de filtro, que permita un trayecto de luz de 1 cm,
o mayor, y que se encuentre equipado con un filtro verde que
tenga su transmitancia máxima en la vecindad de 520 mu.
c) Medidor de pH.
d) Embuso de separación, de 125 mi, forma Squibb, con tapones de cristal esmerilado .
156
REACTIVOS
. Agua redestilada ; Se redestila agua destila en un alambi-'
que integro de cristal.
2.
Solución Patrón de Plomo : Se disuelven 100 mg de plomo meta
lico puro en una'mezcla de 2 ml . de HNO 3 conc . y 2 ml . de
agua destilada . Se calienta suavemente, si es necesario ; y
se diluye a 1000 ml . con agua destilada . Se conserva en - frasco de plástico, 100 ml . = 0 .100 mg de Pb.
3.
Solución Indicadora de Fenolftaleína . Se disuelven 5 g de fenoiftaleina en 500 ml . de alcohol etílica o isopropilico
y se agregan 500 ml de agua destilada . Se agrega a continua
ción NaOH 0 .02 N, a gotas, hasta la aparición de un ligera
color rosa.
4.
Hidróxido de Amonio, conc . : Se vierten 600 ml . de agua re-, destilada en un frasco de poliétileno de 1 litro y se yen- fria por inmersión en baño de hielo . A través de una trampa
de lana de vidrio se 'pasa amoniaco gaseoso, de un cilindro
al frasco enfriado, hasta que el volumen de líquido haya au
mentado a 900 ml . del reactivo de hidróxido de amonio en un
matraz de destilación de 1500 ml y se destila recibiendo en
un frasco enfriado de poliétileno de 1 litro que inicialmen
te contenga 250 ml . de agua redestilada, hasta que el volumen del líquido en el frasco se aumenta a 900 ml, mantenien
157
do la descarga del refrigerante abajo de la superficie del
liquido.
5. Hidróxido de amonio 1+1
6. Solución de acetato de hidrazina : Se mezclan 15 ml de hi-drato de hidrazina (de 64% de hidrazina), exenta de plomo,con 50 ml . de ácido gacial y se diluye a 100 ml con agua.
7. Solución de tartrato ' de sodio : Se disuelve 10 g de Na 2 C 4 H 4 O 6 . 2H 2 0 en 100 ml de agua destilada . Para purifi-carla, se agita con solución de ditizona en tetracloruro de
carbono, hasta que la capa de disolvente orgánico tenga un
color verde puro . Se lavan las huellas de ditizona en la so
lución, por extracción con CH C1 3 puro, hasta que la solu-ción sea incolora . A continuación se extrae dos veces con CC1 4 .
B . Solución de ácido tartârico : Se disuelven 50 g de
H 2 C 4 H 4 0 6 . en 100 ml de agua destilada.
9 . Solución de ditizona (I) para eliminarla principal impureza
la difiniltiocarbodiazona, se procede en la forma siguiente
La purificación depende de la insolubridad de la difeniltio
carbodiazona en soluciones básicas acuosas . Se disuelven -250 mg de cristales de ditizona en 50 ml de CH C1 3 , se filtra a través de un pequefio papel filtro y se lava el filtro
158
con varias pequeñas porciones de CH C13 . Se pasa el filtrado a un embudo de separación y se . extrae con porciones
de NH 4 OH 1+99, hasta que la capa de CH C1 3 se encuentre
casi desprovista del color verde . Se descarta la capa de
CH C1 3 y se lavan los extractos combinados con cuatro -porciones de 15 ml . de CH C13 . Se desechan los extractos
de CH Ci a . Se precipita la ditizona por adición,de 2 ml.
de HC1 conc . y se agita para neutralizar complementamente el amoniaco . Se extrae la ditizona precipitada con -porciones de 25 ml de CH C1 3 y, finalmnete, se diluyen los extractos combinados con CH C1 3 puro, a un volumen de cerca de 250 ml.
' . La solución se conserva bien en el frío y es preferible
mantenerla en refrigerador o en agua fria corriente ..
En lugar ele mantener la solución se puede preparar cuando
se necesite . La, descomposición de esta solución se pone
en evidencia por una disminución gradual del color verde.
O .Solución de ditizona (II) : Se disuelven 125 mg . de ditizo
r
na én 50 ml . de CH C1 3 , se filtra a'través de un pequeño
papel filtro, que se lava con pequeñas porciones de CH C1 3
y se combina el lavado con el filtrado . Se extraen los - filtrados con NH 4 OH 1+99, hasta que la capa de CH C1 3 se
encuentra casi desprovista del color verde . Se lava la capa ácuosa con CC1 4 puro para eliminar las huellas de CH C1 3
159
y defeniltiocarbodiazona . Se desechan los extractos de
CC1 4 . Se neutraliza el NH4 OH agitando bien con 2 ml . de
HC1 conc . y se extrae la ditizona precipitada con CC1 4 ,
. diluyéndose los extractos con CC1 4 puro a 500 ml . Esta
solución se debe conservar siempre fría en refrigerador
o lo que es menos recomendable, en agua corriente.
11.
Cloroformo : Todo el cloroformo, y en especial el disol° vente recuperado, se deben tratar en la forma siguiente:
Se le purga de toda el agua . Se lava con H 2 SO4 conc . hasta que el disolvente y la capa ácida se mantengan in
coloras y claras ; se usan de 50 a 100 ml . de ácido por
litro de disolvente . Se agita el disolvente con una solución diluida de bicarbonato de sodio, y a continuación
se lava cuidadosamente . Se le agrega óxido de calcio para secar el disolvente, se le separa el CaO y se agrega
un 2% de su volumen de alcohol metilico absoluto puro .Se destila lentamente . el disolvente, conservando una lenteja de CaO en el alambique . Se desechan los prime-ros 50 a 100 ml y no se lleva la destilación a sequedad
12.
Tetracloruro de Carbono, grado ACs . Si no se dispone de
esta clase se puede usar el disolvente comercial o re-• cuperado, tratándolo-en la forma siguiente : Se agitan 1000 ml del disolvente con 50 ml de una solución de KOH
160
al 50%, repitiendo varias veces la extracción . A continuación se lava el CC1 4 varias veces con porciones de
25-50 ml . de H 2 SO 4 , conc . cuidando que el lavado final
con ácido no presente decoloraciones . \ Se trata el CC1 4
con una solución diluida de bicarbonato de sodio y se - '
lava repetidamente con agua hasta que los lavados sean
perfectamente neutros al papel tornasol . Se seca durante la noche con la Ca C1 2 y se destila ; en lugar de secarlo durante la noche se puede desechar el 10% del des
tilado inicial, y a continuación se recoge el destila-do puro . Después de recogerla porción principal se dejan sin destilar los últimos 50 á . 100 ml.
13 . ,
Solución indicadora de zul de timol : Se disuelven 0 .4 g
del indicador en 100 ml . de agua' destilada.
14 . Solución de Cianuro de Potasio : Se disuelven 10 g de -KCN en 100• ml . de agua destilada (precaución tóxico se
debe evitar su ingestión).
15 .- Solución alcalina de cianuro de potasio : a 175 ml de -NH 4 OH conc . puro se . agregan 15 ml de solución de KCN -(punto'14) y 7 .5 ml . de solución de sulfito, de sodio (10 g en 100 ml de agua) . exenta de plomo ; finalmente,
se diluye a 500 ml . con agua 'destilada (para eliminar
el plomo del sulfito de sodio se disuelven 10 g de - --
161
Na 2 SO 3 en 100 ml de agua destilada y se extrae con solu
ción de ditizona (I) hasta que se mantenga verde el color del disolvente orgánico . Se eliminan las huellas de
CH C1 3 por 4-5 extracciones con CC1 4 puro).
16 . Acido clorhídrico, conc . Si es necesario se destila en
un alambique pyrex . El destilado ha de contener aproximadamente 22% por HC1.
PROCEDIMIENTO
1.
Para la determinación de plomo se prefiere la digestión
con HNO 3 y percl6rico . Si se usa la digestión con HNO 3 H 2 SO 4 en el tratamiento preliminar, son necesarios dos
determinaciones de plomo, una de la solución resultante
de la digestion con HNO 3 -H 2 SO4 y la otra del extracto de acetato de amonio del residuo, que se describe en el
tratamiento preliminar de la muestra.
2.
En un vaso de 125 ml . se pipetea una porción alicuota
de la muestra digerida que contenga 10-100 ug de Pb . Se
lleva simultaneamente un testigo con agua destilada - exenta de plomo.
3.
Se traza una curva de calibración usando 1-10 ml de una
solución patrón de plomo, que se prepara diluyendo 10 ml
162
de la solución, patrón a 100 ml ; 1 ml = 10 ug de Pb . Se
somete a los patrones al mismo procedimiento que la -,
muestra.
4 . Se diluye la muestra como en el punto 2 con 10 ml de agua destila . Se agregan 10-15 gotas de indicador de fenolftaleina y casi se neutraliza con hidróxido de-amonio 1+1 . Se agregan 20 ml de solución de acetato de
hidrazina y se calienta a 90°95°C en baño maría, por no menos de 10 minutos se enfría.
NOTA :
Ene ausencia de estaño y bismuto se pueden omitir las secciones 5-8, con lo que se abrevia el procedimiento . '
,5 .
Se agregan 20 ml de solución de tartrato de-sodio . Se ajusta el pH de la solución aproximadamente, a 2 .5, usan
do el medidor de pH, por la adición de
NH 4 OH
o , de ácido
tartárico . Se . pasa a un embudo de separación.
6.
Se extrae la solución en el embudo con porciones de 3 ml
de la solución de ditizona (I) hasta que la capa or`gánica tenga tin color verde puro . Se agita bien en cada ocasión y se separa la capa de cloroformo, que se descarta.
7.
Se extrae la solución con dos porciones de 5 ml de cloro
formo puro, con lo que se elimina
la
ditizona retenida.
Se desechan las porciones de cloroformo .
{
163
Se elimina
8.
el cloroformo remanente por extracción con
una porción de 5 ml de CC1 4 . Se desecha la capa de - -CC1 4 .
9.
Se agregan 10 ml de solución de tartrato de sodio y 5
gotas del indicador de azul de timol . Si es necesario se agrega NH 4 OH para hacer que el indicador vire al azul.
10.
Se agregan 10 ml de solución de KCN (reactivos 14) Se ajusta el pH a 8 .5, por la adición de solución de ácido
tartarico o de hidróxido de amonio, hasta que el indicador vire al verde.
11.
Se extrae con una porción de S ml de solución de ditizona (II) en CC1 4 . Se agita bien y se pasa cuidadosamente
la capa de disolvente a otro embudo de separación . No se
debe permitir que la porción acuosa pase con el extracto
de CC1 4 .
12.
Se extrae sucesivamente la fase acuosa con porciones de
2 ml de solución de ditizona (II) hasta que el color ver
de de la ditizona persista por dos extracciones, cuando
menos.
Se combinan todos los extractos con el primeramente obte
nido . Cuando se estén analizando muestras múltiples, lo
mismo que en la preparación de la curva de calibraci .6n,
164 , ,
se debe tener cuidado de usar la misma cantidad de ditizona para todos las extracciones . Aumenta algo el color
del testigo al aumentar el número de extracciones.
13 .• Se extrae la fase acuosa con una porción de 5 ml . de -CC1 4 puro y se agrega a los otros extractos .
N
14 . A los extractos combinados , de CC1 4 se agregan 20 ml de
la solución alcalina de KCN (reactivos 15) y se . agita bien . La coloración verde de la ditizona,cambiard a la
coloración rosa del ditizonato de plomo ; la solución al
calina acuosa se tornará amarillenta, por la formación
de la sal de ' ditizona.
15
Se pasa,la'capa de CC1 4 a un matraz aforado de 25 6 50
ml . Se extrae la fase acuosa con 2 porciones de 2 ml . de
CC1 4 puro . Se combinan todos los extractos y se .desecha la capa acuosa.
16 Se diluyen los extractos hasta el aforo del matraz afo
rado con CC1 4 puro y se agita bien.
17 . Se filtra la solución de CC1 4 a través de un papel peque
ño y seco, para eliminar las gotillas suspendidas de - agua . Se lee la absorbancia de esta solución, con CC} 4 puro como liquido de referencia, en un fotómetro de filtro o en un espectrofotometro a 520 mu . Las correcciones
del testigo se verifican deduciendo la absorbancia del -
165
testigo de las lecturas de las muestras.
CALCULO
mg/1 de Pb = lectura de mg de Pb x 1000
x
100
ml de muestra ml de alicuota
Norma de Plomo en agua para uso recreativa, conservación de flora
fauna y usos industriales es de 0 .1 mg/1 .
166
METALES PESADOS
DETERMINACION POR ABSORCION ATOMICA
)
167
METALES PESADOS
PLOMO, CADMIO, NIQUEL, MERCURIO, COBRE, CROMO.
Para análisis de metales pesados al igual que para cualquier
análisis de otro parámetro la muestra debe ser representativa
del cuerpo de agua en estudio y ya sea muestra simple o com-puesta los frascos que los contengan deben estar debidamente
lavados y enjuados con HNO Z
1 :1 y agua destilada exenta de -
metales .
IDENTIFICACION DE MUESTRAS
Cada frasco de muestra debe ser debidamente etiquetado
y con
la respectiva hoja de campo. Deberán especificarse los siguien
tes datos:
En la etiqueta:
a) Sitio de muestreo
b) Localidad
c) Estado
d) Hora y fecha
e) Observaciones
-~-•-~-=~~t.~-`"_' ~
A-168
En la hoja de datos de campo, además de los anteriores:
a)
pH
b)
Temperatura del agua
c)
Temperatura ambiente
d)
Oxigeno disuelto
e)
Método de muestreo
f)
Nombre responsable del muestreo
g)
Tipo de análisis que se requiere:
Metales disueltos
Metales suspendidos
Metales totales 8
Extractables.
h)
Observaciones
TRANSPORTE Y CONSERVACION DE LAS MUESTRAS
Las muestras ya preservadas deben estar debidamente tapadas para
evitar pérdidas.
RECEPCION DE LA MUESTRA EN EL LABORATORIO
Ya en el laboratorio la muestra es registrada con datos de etiqueta y hoja de campo, procediéndose al análisis.
1
169
PREPARACION DE LAS MUESTRAS PARA ANÁLISIS
Material a usar en el laboratorio:
Membrana filtro de 0 .45 mu
Pipeta volumétrica de 50 6,100 ml.
Matraz aforado de 50
Matraz erlenmeyer de
m
Pipetas graduados de
Vidrios de reloj de 5
Pizeta
Equipo para filtro de membrana Millipore o similar
Jeringa o bomba de succión
Potenci6metro
Parrilla
REATIVOS :
Acido Nítrico concentrado 6
Acido Clorhídrico conc.
Cadmio metálico
Nitra,to de plomo Pb (NO 3 )
Perclorato de Magnesio (Mg C10 4 )
Cloruro Mercúrico (Hg C1 2 )
Permanganato de Potasio (KMN0 4 )
Persulfato de Potasio (K 2 S 208)
Cloruro de Sodio (NaCl)
Sulfato de hidroxilamina (NH 2 OH) 2 H 2 SO 4
Cloruro Estanoso (Sn C1 2 )
Acido SOlfurico (H 2 SO 4 ) conc.
En la determinación de metales por'espectro£otometría de absor
ción atómica hay variación de acuerdo con el metal y/o la con centración esperada, por lo que se divide en siete secciones
como sigue:
1.
Petratamiento de la muestra
2.
Determinación de cadmio, calcio, cromo, cobalto, cobre, hie
rro, plomo, magnesio, manganeso, níquel, plata y_zinc por aspiración directa en una flama de aire acetileno.
3.
Determinación de, bajas concentraciones de cadmio, cromo, y
plomo por secuestro con ditiocarbamato pirrolidina de amo-nio, extracción con metil isobutil cetona y aspiración en una flama de aire acetileno.
4.
Determinación de aluminio, bario, berilio, silicio,'y vanadio por aspiración directa en una flama óxido nitroso-aceti
leno .
--
171
5.
{
~s
L
4~
,
~
i~ .
~•Z~~~
Determinaci6n de bajas concentraciones de aluminio por
secuestro con 8 hidroxiquinoleina,,extraccion con metil
isobutil tetona y aspiración en una flama óxido nitroso
acetileno.
6.
Determinación de mercurio por absorción atómica con vapor
frío (sin flama)
7- Determinación de arsénico
selenio por conversión a sus -
hidruros y aspiración en una flama ' argón-hidrógeno.
ANALISIS
Antes de colectar la muestra, decida el tipo de datos que (le-sean determinar . Metales disueltos, suspendidos, totales o extractables . Esta decisión determinará si la muestra será acidi
ficada con 6 sin filtración y la clase de digestión requerida.
Si solamente se van a determinar metales disueltos, la muestra
se filtra a través de una membrana de 0 .45 um, antes de la aci
dificación en campo se reporta en este caso los resultados como metales disueltos.
La filtración no es necesaria cuando se requieren concentración
de metales totales o extractables.
Para agua potable y libre de partículas es suficiente 1 .5 ml .,
de ácido nítrico concentrado por litro de muestra para tener
un pH 2 .0 menos.
Las aguas crudas y de desecho generalmente contienen materiales en suspensión, para estas se requiere de un tratamiento previo al análisis que puede incluir la adición de ácido para
preservar la muestra, además una etapa de digestión para destruir la materia orgánica y mantener'todos los metales en solución.
Para el,análisis de metales totales se transfiere una porción
representativa de una muestra bien mezclada (SO a 100 ml, ó alicuota llevada a estos volumenes) a un matraz y agregar 5 -
mi,
de ácido nítrico (HNO 3 ) concentrado". Coloque el matraz en
una parrilla y evapore a cerca de sequedad, procurando que la
muestra no hierva . Enfrie el matraz y agregue otros 5 ml de ácido, tape el matraz con un vidrio de reloj y regreselo a la
parrilla hasta qué se presente
un
reflujo . Continue calentan
do agregando ácido tanto como sea necesario hasta completar la digestión ; esta es indicada por un residue colorido . Agregar de 1 a 2
ml .
de HNO 3 concentrado y calentar el matraz le-
vemente para diluir el residuo, enjuage las paredes del ma- traz y el vidrio de reloj con agua destilada desmineralizada
y exenta de metales y filtre, la muestra para remover silica -
tos y otros materiales insolubles que pudieran tapar
fiador .
el
atomi
173 .
Ajuste el volumen de 50 a 100 ml . 6 algún otro volumen predeterminado con base a la concentración esperada del metal.
La muestra esta lista para su análisisa" `
Se requiere de una digestión especial para mercurio, arsénico
y selenio ;, algunas, aguas contaminadas pueden requerir adicio-nalmente el Uso de ácido sulfúrico y/o ácido percl6rico y un
condensado de reflujo para su completa digestión.
Para el análisis de metales sttpendidos,•se utiliza el mismo
procedimiento de digestión después de filtrar la muestra, a-través de un filtro de membrana de 0 .45 mu . , Enseguida digiera
el filtro
asi
como el material que contiene y lleve un blanco
de filtro para, permitir una corrección testigo . Reportar los
metales suspendidos expresándose en microgramos o mg/litro, o
pese el residuo y reporte como ug 6 mg/g .•
Los metales extractables incluyen metales en solución más meta
les ligeramente adsorbidos , en el material suspendido . Los re-sultados obtenidos en el análisis de metales extractables esta
ran influenciados por la clase de ácido o ácidos utilizados en
la digestión la concentración de ácidos y el tiempo de calense controlen cuidadosa-tamiento . A menos que las condiciones
,
mente los,resultados no serán •reproducibles y no tendrán senti
do .
.
--
,
,, 'AL
El procedimiento siguiente determina metales solubles en -
ácido clorhídrico (HCl)- Acido Nítrico (HNO 3 ) caliente . Al
momento del muestreo acidifique la muestra con 5 ml . de HNO 3 conc/litro de muestra . En el momento del análisis mezcle la muestra, transfiera una porción de 100 ml . a un ma-traz y agregue 5 ml . de HC1 1 + 1 redestilado . Caliente 15
minutos en un baño de vapor filtre y ajuste el volumen a
100 ml . La muestra ya esta lista para su análisis.
Las concentraciones del metal encontrado especialmente en muestras con sedimento deben ser considerablemente más altas
que los resultados obtenidos de la fracción soluble solamente . Reportar como metales extractables.
Para el uso del aparato, es conveniente que el aire este lim
pio y seco a través de un filtro adecuado para remover aceite
agua y otras sustancias extrañas . La fuente puede ser un compresor o gas envasado comercialmente.
Acetileno, grado estandar comercial . Debido a que la acetona
siempre esta presente como impureza en los cilindros de aceti
leno, se puede prevenir su entrada y daño a la cabeza del que
mador, reemplanzando el cilindro cuando su presión baje hasta
7 Kg/cm 2 ( 100 psig .) de acetileno.
175
METALES
LONGITUD DE ONDA
NM
SENSIBILIDAD PARA
1%
ABSORCION .UG/1.
Manganeso
279 .5
50
Níquel
232 .0
100
Plata
328 .1
60
Zinc
213 .9
15
Coloque
2.
el ancho de la ' abertura de acuerdo a las intrúccio
nes del aparato para el elemento que se va a determinar.
3.
Encienda el instrumento y aplique la cantidad de corriente
sugerida por el fabricante para la lampara de cátodo hueco.
4.
Deje calentar el aparato hasta que la fuente de energía se
estabilice, este proceso usualmente requiere de 15 a 20 min.
reajuste la corriente si es necesario despu6s de calentarse.
5.
Instale la cabeza del quemador.
6.
Abra la• .11ave del aire y ajuste el flujo Al requerido por el aparato para obtener la máxima sensibilidad en la deter'minacidn.
~
~
,
7.
.
r°
.
_~
.
.
176
~
Abra la llave del acetileno ajuste el flujo al requerido
y encienda la flama.
8.
Atomice agua destilada desionizada, acidificada con 1 .5 ml .
de HNO 3 concentrado por litro y cheque la velocidad -
de
aspiración despuós de un minuto ; ajuste si es necesario
a una velocidad entre 3 y 5 ml . por minuto y cero el ins-trumento.
Atomice un estandar apropiado (generalmente de 0 .5 mg/1) y
ajustar el quemador hacia arriba, hacia abajo y hacia los
lados hasta que obtenga una respuesta máxima.
10 . El instrumento esta lista ahora para la operación.
Cuando se terminen los análisis extinga la flama cerrando
primero el acetileno y después el aire.
ESTANDARIZACION
1
Seleccione por lo menos tres concentraciones de cada solución estandar metálica conteniendo de 5 a 1000 ug/1 por dilución apropiada de las siguientes soluciones patrón de meles con agua destilada desmineralizada que contenga 1 .5 ml.
de HNO 3
conc .
por litro para confirmar la concentración de
177
PROCEDIMIENTO
a) Operación del Instrumento : A causa de las diferentes marcas y modelos de espectrofotómetros de absorción atómica,
no es posible formular instructivos aplicables a todos los
instrumentos . En general proceda de acuerdo a los siguien
tes pasos :
i
1 . Instale en el instrumento una lámpara de cátodo hueco del
metal deseado, fije la longitud de onda en la caráctula de
de acuerdo a la tablaw siguiente y alinie la lámpara de - con las siguientes instrucciones del fabricante.
Longitud de Onda y Sensibilidades para análisis de Metales.
METALES
LONGITUD DE ONDA
NM
SENSIBILIDAD PARA
1%
ABSORCION UG/1.
Calcio
422 .7
70
Cadmio
228 .8
25
Cromo
357 .9
100
Cobalto
240 .7
150
Cobre
324 .7
100
Hierro
248 .3
100
Plomo
283 .3
500
Magnesio
285 .2
7
. .
.
.
._
~
J
A
i. .
.~ .~.7 _s .
. -a~-~
.. .
.
.
.
~.~..~
t .. . 7 , •,y ¡A~
~
~
-
.í
11.
~i
.
metal esperada en la muestra . Aspire cada estandar en la flama
que registre la absorbancia.
Siempre que se utilice agua en el procedimiento debe entenderse
agua destilada y desmineralizada.
Cadmio .- Disuelva 1 .000 g de cadmio metálico en un volumen mínimo de HC1 1+1 Diluya a 1000 ml . con agua 1 .00 ml = 1 .00 mg.
Níquel .- Disuelva 4 .953 g de nitrato niqueloso hexahidratado Ni (NO 3 ) 2 . 6 H 2 0 2n 200 ml de agua, agregue 1 .5 ml de HNO 3 conc.
y afore a 1000 ml . 1 ml = 1 mg de Ni.
Plomo .-
Disuelva 1 .598 g•de Nitrato de Plomo ., Pb (NO 3 ) 2 , en
200 ml . de agua, agregue 1 .5 ml . de ácido nítrico concentrado, y
diluya a 1000 ml . con agua 1 .00 ml = 1 .00 mg de Pb.
Prepare una curva calibración graficando la absorbancia de los estandares contra su . concentración.
Cheque la curva de calibración con un estandar después del análi
sis de muestras:
1 . Enjuague el atomizador aspirando el agua que contenga 1 .5 ml.
de HNO3 concentrado por litro y espere a que el instrumento
marque cero.
2.
Atomice la muestra y determine su absorbancia.
o
179
CALCULOS ,
1 . Calcule la concentración de cada ion metálico en ug/l por referencia a la curva de calibración apropiada.
DETERMINACION DE MERCURIO POR ABSORCION ATOMICA SIN FLAMA
Celdas de absorción un tubo de vidrio o de plástico de aproximadamente 2 .5 cm . (1 pulgada) de diámetro y de largo como
el instrumento lo permita . Un tubo largo de 11 .4 cm . ( .4 .5 pulg .) de longitud que haya sido encontrado satisfactorio, pero se prefiere un tubo de 15 cm de longitud (6 pulgadas).
i
Oprima las terminales del tubo perpendicular al eje longitudinal
y unalos con cemento de cuarzo transparente en este -
lugar, pegue la entrada y salida del gas (6 .4 mm .
de diáme--
tro) 1' .3 cm (0 .5 pulgadas) de cada lado.
b)
Celda soporte . Sujete la celda al ras del borde superior del quemador de óxido nitroso u otro soporte recomendable--
y alinie el rayo de luz para obtener la máxima transmitan-cia.
c)
Bomba de Aire .- Cualquier bomba peristâltica con control -electrónico de velocidad, capaz de producir 2 litros de aire por minuto no obstante cualquier otro compresor de aire
podrán ser usados .
180
"'A
1+ .
d)
VkL, .s.-Ek.
Medidor de Flujo .- Capaz de medir un flujo de aire de 2 litros por minuto.
e)
Tubo de Aereaci6n .- Un tubo de vidrio recto con filtro poroso de cuarzo para usarse en la reacción en el matraz.
f)
Matraz de reacción . En un matraz erlenmeyer de 250 ml . con
tapón de hule perforado para el tubo de aereación.
g)
Tubo de Secado . Un tubo de 150 mm de longitud por el 18 mm.
de diámetro conteniendo 29 g de perclorato magnesio (Mg Cl 0 4 )
h)
Lámpara de lectura .- De 60 watts 'colocada sobre la celda de
absorción para mantener la temperatura del aire en la celda
10°C abajo de la temperatura ambiente y evitar la condensa- ción de la mezcla.
i)
Tubo de plástico .- Use plastico vinil transparente como Ty-gon para pasar el vapor de mercurio al matraz de reacción a la celda de absorción y conectar todos los ' demás accesorios.
2
REACTIVOS
Agua destilada desmineralizada . Use agua destilada desmineralizada para la preparación de todos los reactivos estandares yagua de dilución.
b) Solución Patrón de Mercurio . Disuelva 1 .3540 g de cloruro mercúrico Hg C1 2 en 700 ml . de agua, agregue 1 .5'ml . de HNO 3
conc, y diluya a 1000 ml . con agua, 1 .00 ml . = 1 .00 de mercu
rio .
c)
Solución estandard de Mercurio .- Prepare una serie de soluciones estandar de mercurio conteniendo de 0 a 5 . ug/1
por dilúci6n adecuada de la solución patrón de mercurio con agua conteniendo 1 .5 ml de HÑ0 3 conc . por litro . Prepare diariamente los estandares.
d)
Acido nítrico concentrado.
e)
Solución de Permanganato de Potasio . Disuelva 50 g . de permanganato KMnO 4 en agua y diluya a un litro con agua -
f)
Solución de Persulfato de Potasio . Disuelva 50 g . de - K 2 S 204 en agua y diluya a un litro con agua.
g)
Solución de Cloruro de Sodio . Sulfato de Hidroxilamina Disuelva 120 g de Na Cl y 120 g de (NH 2OH) 2 H 2 SO 4 en agua
y diluya a un litro con agua.
h)
Solución de Cloruro Estanoso . Disuelva 100 g de Sn C1 2 en agua destilada desionizada conteniendo 12 .5 ml de H Cl
concentrado y diluya a 1 litro con agua . Con el tiempo esta solución se descompone . Si se forma una suspensión agite el reactivo continuamente durante su uso.
i)
Acido Sulfúrico (H 2 SO 4 ) concentrado .
PROCEDIMIENTO
iC
.
)¡P
Operación de los instrumentos . Seguir los pasos como se
indico anteriormente.
Estandarización.
1 . Transfiera 100 ml de cada una de las soluciones estandares
L de mercurio conteniendo 1 .0,,2 .0 y . 5 .0 ug/1,
y,100
m1 . de
agua, en un matraz erlenmgyer . de 250 m1 . , .
m1 de H2SO4 ;Fónc . ,y•, 2 .5 ml . ; de ; HNO 3 conc . ,
;,Agregue
a
cad
matraz.
3.
Agregue 15 ml de solución de KMN0 4 a cada matraz y dejelo
reposar por 15 min.
4. ,Agregue
8 ..
ml de Sol :. de persulfato .,de potasio á•cada matraz
y-caliente por 2 horas en bafio de agua a 95°C ..
5. =
Enfrie a•temperatura ambiente y agregue 6 ml . de la solu
ción
de
Na Cl (NH 2 OH) 2 H 2 SO4 para reducir`el excéso'de pé'r-
manganato.
6 . Trate cada matraz particularmente y agregue 5 ml . de solución - de'cloruro'éstanoso e inmediatamente cohecteel matraz
•al
aparato dé aéreáción .
.
.,
-sr
•[
183
7.
Como el mercurio es . volatilizado y conducido a la celda
de-la absorción, la absorbancia deberá incrementarse a un
máximo en pocos segundos.
8.
Así como el registro se regresa aproximadamente a'la línea de base, quite el tapón del matraz de reacción y reem
.placela con un matraz conteniendó agua destilada desionizada.
9.
Limpie el sistema con el agua unos segundos Y corra el siguiente estandar en la misma forma.
10. Construya una curva 'estandar graficando las . lecturas máximas contra ug dé . mercurio.
ANÁLISIS DE MUESTRAS
Transfiera 100 ml . de muestra 6 una porción diluida a 100 ml . conteniendo no más . de 5 microgramos por litro a un matraz de -reacción y tráteloscomo •gn el paso anterior (estandarización del punto 2 al 8 )
CALCULUS
Determine la máxima lectura de la muestra de la hoja de registros y lea el valor del mercurio de la curva estandar de acuer
do al punto 10 del paso anterior (estandarización)
3
`
.
;~
~
' á n. 'v . . 1. ~
-
,
_
BIBLIOGRAFIA
STANDAR METHODS FOR THE EXAMINATION OF WATER AND WASTE
WATER . 14 th . ED APRA - AWWA -WPCF 1976.
METHODS FOR CHEMICAL ANALISYS OF WATER AND WASTE NATIONAL ENVIROMENTAL RESEARCH CENTER USE PA.
POB EPA 625/74 - 003 1974.
CHEMISTRY FOR SANITARY ENGINEERS . SAWYER F, McCARTY, SECOND EDITION . McGraw-Hill .
~..
© Copyright 2026