Descargar PDF
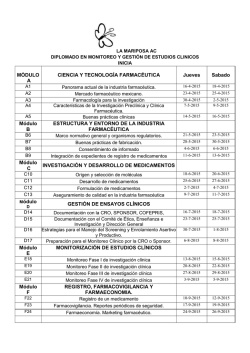
2do CONGRESO Módulo Internacional PRODUCTOS BIOLÓGICOS & BUENAS PRACTICAS DE FARMACOVIGILANCIA Viernes 20 de Noviembre 2015 OBJETIVOS Dar a conocer la experiencia de registros de productos biológicos en Brasil Conocer las tendencias en las Regulaciones Internacionales FDA, EMA PIC en el registros de productos Biológicos & Biotecnológicos Discutir en el Work Shops la implementación de las Buenas Prácticas de Farmacovigilancia en el Perú con participación de expertos de expertos de Brasil y Perú. BENEFICIOS Participación libre a la Expo Farma&Cosmetica 2015 Descuento del 30% a un segundo módulo de elección y a curso pre congreso: Buenas Practicas de Farmacovigilancia. Participación libre a las charlas técnicas y visita a los empresas proveedoras de diferentes países como Alemania. Bélgica, Canadá, EEUU, México, Brasil , Argentina y Perú. Participación a la Conferencia Internacional: Retos y O portunidades en el Registro de Productos Biosimilares “ Experiencia en el registro del primer Biosimilar aprobado por FDA”. 2do Módulo: Productos Biológicos & Buenas Practicas de Farmacovigilancia CONGRESO PROGRAMACIÓN TEMA HORA 2:00pm - 2:15pm Registro de Asistencia. 2:15pm - 2:30pm Palabras de Bienvenida 2:30pm - 3:30pm Registro Sanitario de Productos Biológicos “Experiencia en ANVISA BRASIL” Docentes Dra. Rosanna Mastelaro, Gerente de Asuntos Regulatorios Sindusfarma - BRASIL 3:30pm - 4:30pm Registro de Productos Biológicos & Biotecnológicos “Tendencias en Regulaciones Internacionales FDA, EMA, PIC Ph.D Antonio Moreira Vice-rector de la University of Maryland, Baltimore County - EEUU Dra. Rosana Mastelano, Gerente de Asuntos Regulatorios Sindusfarma - BRASIL WORK SHOP INTERNACIONAL 4:45pm - 6:45pm Desafíos en la Implementación de las Buenas Prácticas de Farmacovigilancia en el Perú “Experiencia Internacional” Dra María Vargas GSK - PERÚ Representante deI INSTITUTO NACIONAL DE SALUD – PERÚ (*) Representante de la Dirección General de Medicamentos, Insumos y Drogas DIGEMID - PERÚ (*) (*) Por confirmar INCLUYE CONFERENCIA MAGISTRAL Viernes 20 de Noviembre del 2015 7:30pm a 9:00pm Retos y Oportunidades en el Registros de Productos Biosimilares “Experiencia en el registros del primer Biosimilar aprobado por FDA” Ph.D Antonio Moreira , Vice-rector University of Maryland, Baltimore County - USA 2do Módulo: Productos Biológicos & Buenas Practicas de Farmacovigilancia CONGRESO INTERNACIONALES PLANA DOCENTE Dra. Rosanna Mastelaro - Brasil Farmacéutica Industrial, egresada de la Facultad de Farmacia de Oswaldo Cruz, con más de 17 años de experiencia en diferentes segmentos de la industria farmacéutica. Actualmente es gerente de legislación farmacéutica en Sindusfarma, en Sao Paulo-Brasil, es responsable de la difusión y orientación a los miembros del sindicato sobre las normas sanitarias aplicables a los registros de medicamentos y la coordinación de grupos de trabajo para la discusión de consultas públicas y preparación de propuestas para ANVISA. Es consultora y conferencista en temas sobre reglamentación sanitaria y farmacovigilancia. Ph.D Antonio Moreira UMAC - USA, (University of Maryland, Baltimore County USA ). Vice-rector de Asuntos Académicos y Professor de Química, Bioquímica de la UMBC (University of Maryland, Baltimore County USA ). Ocupó el cargo de gerente senior en la Industria farmacéutica / biotecnológica.. Es autor o coautor de más de 200 publicaciones y exposiciones. Supervisó más de US $ 12 millones en contratos y subvenciones y es consultor en varias empresas farmacéuticas y biotecnológicas. Ha sido presidente fundador del Capítulo- Chesapeake Bay Area de la ISPE, presidente del Consejo de centros de biotecnologia para la Organización de la Industria – BIO, y apoya en los consejos de consulta científica de varias organizaciones. 2do Módulo: Productos Biológicos & Buenas Practicas de Farmacovigilancia CONGRESO NACIONALES PLANA DOCENTE Dra María Vargas H. GSK - PERÚ Profesional Farmacéutico con más de 12 años de experiencia en el sector farmacéutico. Posgrado en Epidemiología Clínica - Universidad Peruana Cayetano Heredia, Miembro del Grupo de Trabajo Buenas Prácticas Clínicas de la RED PARFM. Ha participado en entrenamiento y reuniones en temas de Seguridad de medicamentos, vacunas, productos biológicos y Farmacovigilancia en países como Argentina, Colombia, Brasil, Korea, EEUU y workshop en instituciones como Food and Drug Administration (FDA). Actualmente Evaluador de Perfil de Seguridad de productos en investigación para Ensayos Clínicos en el país. Representante deI Instituto Nacional de Salud(*) INS - PERÚ Representante de la Dirección General de Medicamentos Insumos y Drogas (*) DIGEMID - PERÚ (*) Por confirmar 2do Módulo: Productos Biológicos & Buenas Practicas de Farmacovigilancia CONGRESO LUGAR Y FECHA CERTIFICACIÓN FECHA Y HORA: El Módulo se desarrollará el día Viernes 20 de Noviembre de 2:00pm a 6:45 pm Los participantes que cumplan satisfactoriamente con los requisitos y normas del módulo, reciben un certificado a nombre de la Empresa Latinoamericana en Asesoría y Consultoría Farmacéutica - LATFAR S.A.C. LUGAR: Sheraton Lima Hotel & Convention Center (Av. Paseo de la República Nº 170 Lima 1 Perú) HOTELS & RESORTS INVERSIÓN Hasta 30 de Octubre 2015 Hasta 20 de Noviembre 2015 USD 120* USD 130* INFORMES E INSCRIPCIONES Dirección: Av. 2 de Mayo 1545- Of. 216 - San Isidro Telf.: 4214373 988883886 RPC: 994698632 (*) El precio no incluye IGV Movistar Descuentos Corporativos De 2 a 4 asistentes : 5% De 5 a más asistentes: 10% Descuentos personales: 5% (Por asistencia a cursos organizados por LATFAR) Email: [email protected] [email protected] www.latfar.com 2do Módulo: Productos Biológicos & Buenas Practicas de Farmacovigilancia CONGRESO 2da FERIA INTERNACIONAL EN INDUSTRIA FARMACÉUTICA Y COSMÉTICA 2015 Eventos paralelos 2do CONGRESO 2015 Organiza 2do Módulo: Productos Biológicos & Buenas Practicas de Farmacovigilancia CONGRESO
© Copyright 2026