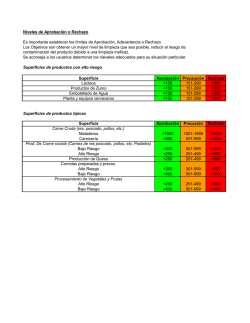
CRITERIOS DE AC RECHAZO DE LAS APLICABLES AL
SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO CONTROL CLINICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA ELABORADO POR: REVISADO POR: APROBADO POR: QBP. GUADALUPE GARCIA CEBILLA QBP. VELIA DEL CARMEN TORRES A QUÍMICAS ANALISTAS QBP. REYNA CORONA CERECERO JEFE DE LABORATORIO M.SP. MARIO A. ALARCÓN ROMERO JEFE DE DEPARTAMENTO CLAVE:HE-P-002 REVISIÓN N° 1 SUSTITUYE A REVISIÓN N° 0 EMISIÓN:20-03-15 EXPIRACIÓN:20-03-17 PÁGINA 1 DE 8 CRITERIOS DE ACEPTACIÓN Y RECHAZO DE LAS MUESTRAS APLICABLES AL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA DRA. ELIZABETH GODOY GALEANA DIRECTORA ACAPULCO, GRO. MARZO DEL 2015 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 1.- REVISIÓN N°1 EMISION: 18-03-15 18 OBJETIVO Establecer los requisitos que deben cumplir las muestras clínicas para ser aceptadas y analizadas en el laboratorio de Química Clínica y Hematología. 2.- ALCANCE Este procedimiento aplica al personal encargado del área de la toma de muestras en el laboratorio estatal, statal, de la red estatal de laboratorios clínicos y de las diferentes jurisdicciones sanitarias y hospitales. 3.- DEFINICIÓNES Criterios de aceptación: características que debe cumplir una muestra biológica desde la toma, manejo, conservación y transporte para obtener resultados confiables. Criterios de rechazo: cconjunto onjunto de características inadecuadas de una muestra desde la toma, manejo, conservación y transporte que pueden proveer información equivocada lo cual puede llevar a un mal diagnóstico. Prueba a de confirmación diagnóstica: a acualquier cualquier método o técnica, que ayudan a corroborar un diagnóstico específico. Lipemia: a: turbidez del suero o plasma visib visible le a simple vista causadas por concentraciones de lipoproteínas. Hemólisis: ruptura de los glóbul glóbulos rojos, por causas químicas o mecánicas con liberación de su contenido intracelular. Se detecta por el rojo del suero o p plasma. lasma. Muestra coagulada: m muestra que evidencia encia visualmente el inicio del proceso de coagulación, en presencia de agentes anticoagulantes. 4.- DOCUMENTOS APLICABLES Norma Oficial Mexicana NOM NOM-039-SSA2-2002, 2002, para la prevención y control de las infecciones de transmisión sexual. Norma Mexicana NMX NMX-EC-15189-IMNC-2008. Laboratorios clínicos-requisitos requisitos particulares para la calidad y la competencia. Procedimiento para la toma, manejo, conservación, transporte y envío de muestras biológicas CC-P-001 001 Lineamientos para la vigilancia de las infecciones de transmisión sexual por laboratorio.SS-DGE DGE-InDRE-RNLSP.2015. Lineamiento Técnico Tamiz Neonatal Detección, diagnóstico, tratamiento y seguimiento de los errores innatos del metabolismo. Centro nacion nacional al de Equidad de Género y Salud Reproductiva. México ,D.F. 2010. SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 2 DE 8 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 5.- REVISIÓN N°1 EMISION: 18-03-15 18 RESPONSABILIDADES Coordinador de Recepción de Muestras Aplicar los criterios de aceptación y rechazo de las muestras que se reciban. Generar el formato de rechazo definitivo de las muestras que no cumplieron con los criterios de aceptación Difundir a los usuarios externos los criterios de aceptación y rechazo, así como notificar los cambios que se generen en los mismos. Capacitar en coordinación con los jefes de laboratorio a los us usuarios uarios externos, en la aplicación de los criterios de aceptación y rechazo rechazo. Solicitar las actualizaciones tres meses antes a la expiración de los criterios de aceptación y rechazo, a la unidad de gestión de la calidad. Jefe de Departamento Revisar los criterios terios de aceptación y rechazo de las muestras aplicables en el laboratorio. Jefe de laboratorio: Supervisar la correcta aplicación de los criterios de aceptación o rechazo de muestras. Realizar las observaciones sobre las muestras especiales en el info informe rme de resultados Revisar y actualizar los criterios de aceptación y rechazo de las muestras, cuando así se requiera. Notificar por escrito a las áreas involucradas, los cambios que se realicen al procedimiento. Generar el formato de rechazo definiti definitivo vo de las muestras que no cumplieron con los criterios de aceptación. Difundir los criterios de aceptación y rechazo de muestras a los usuarios internos del Laboratorio Estatal de Salud Pública. Capacitar al personal encargado de la recepción de muestras para garantizar el cumplimiento de los criterios Químicos analistas: Aplicar los criterios de aceptación y rechazo de las muestras recibidas para su diagnóstico. Rechazar las muestras que no cumplan con los criterios establecidos. 6.- DESCRIPCIÓN DE LA ACTIVIDAD 6.1 Estudios serológicos de: factor reumat reumatoide, proteína C reactiva, USR, TPHA, prueba de embarazo, reacciones febriles y perfil tiroideo tiroideo. CRITERIOS DE ACEPTACIÓN: a) Tipo de muestra y cantidad mínima: suero 1.5 ml se deberá de enviar en viales, criotubos o en tubos de ensayo de plástico con tapón de rosca (usuarios foráneos). foráneos).Temperatura ra para su recepción: 4 – 8°C. b) Para usuarios locales la muestra podrá ser tomada en tubo-jeringa ringa de 12X75 o 13X100 con gel o sin gel cantidad mínima 4.0 ml. SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 3 DE 8 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 c) REVISIÓN N°1 EMISION: 18-03-15 18 La muestra debe estar bien identificada, la etiqueta deb debe contener los siguientes datos: Número de registro Nombre completo del pacient paciente Edad y sexo Los estudios a realizarse La etiqueta debe colocarse en el tubo tubo- jeringa de tal manera que deje observar el aspecto de la muestra (cubrir la etiqueta del mismo tubo). Los usuarios locales deberán traer solicitud por escrito en papel membretado, con domicilio, nombre del médico solicit solicitante ante y el tipo de estudio requerido especificado en forma clara. Para las muestras foráneas deberán de traer solicitud del servicio dirigida al Director del LESP. d) e) CRITERIOS DE RECHAZO a) b) c) d) e) f) Muestrashemolizadas Muestras contaminadas Volumen insuficiente de muestra. Muestras no identificadas correctamente. Discrepancia de datos. Muestras no transportadas en cadena fría 6.2.- Estudios de: grupo sanguíneo y Rh, velocidad de sedimentación globular ( VSG ), recuento de reticulocitos, eosinófilos en moco nasal. Estos estudio solo se realizan a usuarios locales. CRITERIOS DE ACEPTACIÓN: a) Tipo de muestra y cantidad mínima: sangre total con anticoagulante ( EDTA )2.7 ) ml tomada en tubo de 12 x 75 mm. b) La muestra debe estar bien identificada, la etiqueta de debe be contener lossiguientes datos: Número de registro Nombre completo del paciente Edad y sexo Los estudios a realizarse La etiqueta debe colocarse en el tubo tubo- jeringa de tal manera que deje observar en aspecto de la muestra (cubrir la etiqueta del mismo tubo). c) Para eosinófilos en moco nasal se requiere una muestra por duplicado de secreción nasal (moco). d)) Los usuarios locales deberán traer solicitud por escrito en papel membretado, con domicilio, nombre del médico solicitante y el tipo de estudio requerido especificado en forma clara. CRITERIOS DE RECHAZO. a) b) c) d) Muestras hemolizadas Muestras contaminadas Muestras coaguladas Volumen insuficiente de muestra SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 4 DE 8 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 REVISIÓN N°1 EMISION: 18-03-15 18 a) Muestras no identificadas correctamente. b) Discrepancia de datos. 6.3.- Estudios de: examen general de orina (E (EGO) GO) y prueba de embarazo. Estosestudios Esto sólo se realizan a usuarios locales. CRITERIOS DE ACEPTACIÓN: a) Orina b) Contenida en recipiente de plástico tap tapa roja o azul de 60 a 100 ml de capacidad (especial para toma de muestra para orina). c) La cantidad de muestra de 30 a 50 ml aproximadamente. d) En caso de pacientes pediátricos el volumen mínimo deberá ser de 10 ml (EGO) de igual forma se considerara erara a pacientes con problemas especiales, speciales, para lo cual recepción de muestras deberáinformar al personal de laboratorio de química clínica y hematología a la entrega de las muestras. e) La muestra debe estar bien identificada, la etiqueta debe contener los siguientes datos: Número de registro Nombre completo del paciente Edad y sexo Los estudios a realizarse La etiqueta debe colocarse en el recipiente de tal manera que deje observar el aspecto de la muestra. e) Los usuarios locales deberán traer solicitud por escrito en papel membretado, con domicilio nombre del médico solicitante y el tipo de estudio requerido especificado el forma clara. CRITERIOS DE RECHAZO: a) b) c) d) e) f) Muestras no identificadas correctamente. Discrepancia de datos Muestras contaminadas Volumen inadecuado de muestra Muestras en recipientes no adecuados como frascos tipo gerber, o que hayan contenido algún tipo de alimento, producto de belleza o medicamentos. Muestra derramada. 6.4 Las muestras deberán ser entregadas al laboratorio inmediatamente después del tiempo de toma de muestra establecido (7:30- 9:00 am.) con un máximo de 15 minutos posterior a ésta. Para horarios extemporáneos se deberá justificar la toma de muestra previa autorización del jefe de laboratorio. 6.5 Para estudios de confirmación (referencia) de sífilis, diagnóstico de sífilis, USR, provenientes de las Jurisdicciones Sanitarias, de la Red de Laboratorios o de otros laboratorios institucionales. SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 5 DE 8 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 REVISIÓN N°1 EMISION: 18-03-15 18 CRITERIOS DE ACEPTACIÓN: a) Tipo de muestra y cantidad mínima: suero 0.5 ml se deberá enviar en viales,criotubos criotubos o en tubos de ensayo de plástico con tapón de rosca. La muestra debe estar correctamente identificada con los datos: nombre, edad, sexo, estudio solicitado b) La etiqueta debe colocarse en el tubo de ensaye o vial de tal manera que permita observar o el aspecto de la muestra. c) Temperatura para su recepción: red fría 4 – 8°C. d) Tiempo límite para la recepción de la muestra muestra: 7 días después de la toma de muestra, si es conservada a temperatura de 4 – 8°C. Sí la muestra no se envía al laboratorio orio en ese tiempo deberá congelarse a -20°C. f) Documento necesario: estudio o notificación e epidemiológica del caso llenado correctamente conletra legiblelegible. CRITERIOS DE RECHAZO: a) Muestras no identificadas correctamente. b) Discrepancia de datos c) Muestras contaminadas, lipémicas, hemolizadas d) Volumen inadecuado de muestra e) Muestras no transportadas en cadena fría. f) Muestras que no cumplan con las condiciones de tiempo. g) Muestras sin estudio o notificación epidemiológica NOTA 1: Las muestras se recibirán en la Coordinación de Recepción de Muestras y Atención al Público del Laboratorio Estatal tal en los horarios siguientes: de lunes a jueves de 07:00 a 18:30 y los viernes de 07:00 a 13:00. 6.6 Para control de calidad de sífilis p provenientes de las jurisdicciones o de los Laboratorios de la Red CRITERIOS DE ACEPTACIÓN: a) Tipo de muestra y cantidad mínima: suero 0.5 ml se deberá enviar en viales,criotubos o en tubosde de ensayo de plástico con tapón de rosca. La muestra debe estar correctamente identificada con el nombre, N° de registro, edad, sexo, estudio solicitado. b) La etiqueta debe colocarse en el tubo de ensaye o vial de tal manera que permita observar el aspecto de la muestra. d) Las muestras uestras deberán congelarse a hasta su envío. e) Temperatura para su recepción: red fría 4 – 8°C ó congeladas. f) Tiempo límite para ra la recepción de la muestra: 7 días después al corte delinforme mensual. g) Documento necesario: oficio y formato para el control de calidad de sífilis y brucelosis brucel HE-F-017 llenado con los datos solicitados y con la relación del 10% de las muestras negativas y el 100% de las muestras positivas. SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 6 DE 8 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 REVISIÓN N°1 EMISION: 18-03-15 18 CRITERIOS DE RECHAZO: a) Muestras no identificadas correctamente. b) Discrepancia de datos c)) Muestras contaminadas, lipémicas, hemolizadas d) Volumen inadecuado de muestra e) Muestras no transportadas en cadena fría. f) Muestras sin formato g)Muestras que no cumplan con las condiciones de tiempo NOTA 2: Las muestras se recibirán en la Coordi Coordinación nación de Recepción de Muestras y Atención al Público del Laboratorio Estatal en los horarios siguientes: de lunes a jueves de 07:00 am a 18:30 pm y los viernes de 07:00 am a 13:00 pm. 6.7 Para estudio de perfil tiroideo del Programa de Tamiz Neonatal de las Jurisdicciones Sanitarias, de la Red de Laboratorios o de otros laboratorios institucionales. CRITERIOS DE ACEPTACIÓN: a) Tipo de muestra y cantidad mí mínima: suero 1 ml se deberá enviar en viales, criotubos o en tubos de ensayo de plástico con tapón de rosca. La muestra debe estar correctamente identificada con nombre, N° de registro, edad, sexo y estudio solicitado. b) La etiqueta debe colocarse en el tubo de ensaye o vial de tal manera que permita observar el aspecto y volumen de la muestra. c) Temperatura para su recepción: red fría 4 4-8°C. d) Tiempo límite para la recepci recepción de la muestra: 7 días después de la toma de muestra si es conservada a temperatura de 4 4-8°C. 8°C. Si la muestra no se envía en ese tiempo deberá congelarse a -10°C. e) Documento necesario: oficio y solicitud para estudio de perfil tiroideo del Programa de Tamiz Neonatal HE-F-015 015 llenada correctamente con letra legib legible. CRITERIOS DE RECHAZO: a) Muestras no identificadas correctamente. b) Discrepancia de datos c) Muestras no transportadas en cadena fría. d) Muestras sin solicitud NOTA 3: EL ÁREA ANALÍTICA CA SERÁ QUIEN ELABORE EL RECHAZO SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 7 DE 8 SECRETARIA DE SALUD LABORATORIO ESTATAL DE SALUD PUBLICA “DR. GALO SOBERON Y PARRA“ DEPARTAMENTO DE CONTROL CLÍNICO Y AMBIENTAL LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGIA CRITERIOS DEACEPTACIÓN ACEPTACIÓN Y REC RECHAZO DE LAS MUESTRAS APLICABLES ALLABORATORIO LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA CLAVE: HE-P-002 7.- REVISIÓN N°1 EMISION: 18-03-15 18 DIAGRAMA DE FLUJO O ALGORITMO COORDINACIÓN DE RECEPCIÓN DE MUESTRAS Recepción de muestras y aplicación de los criterios de Aceptación y rechazo aplicables al laboratorio de Química Clínica y Hematología. CUMPLE CRITERIOS NO CUMPLE CRITERIOS LABORATORIO DE QUÍMICA CLÍNICA Y HEMATOLOGÍA Verificar cumplimiento de criterios de Aceptación y Rechazo Aplicables icables al Labora Laboratorio de Química Clínica y Hematología. CUMPLE CRITERIOS INICIAR PROCESO GENERAR FORMATO DE RECHAZO NO CUMPLE CRITERIOS GENERAR RECHAZO 8.- ANEXOS 8.1 8.2 8.3 GC-F-038 038 CONTROL DE CAMBIOS RM-F-001 001 INFORME DE RECHAZO DEFINITIVO HE-F-015 015 SOLICITUD PARA ESTUDIO DE PERFIL TIROIDEO PROGRAMA TAMIZ NEONATAL. HE-F-017 017 ENVIO PARA EL CONTROL DE CALIDAD DE SÍFILIS Y BRUCELOSIS. 8.4 SUSTITUYE A REVISIÓN N°. 0 EXPIRACIÓN: 18-03-17 PÁGINA 8 DE 8
© Copyright 2026