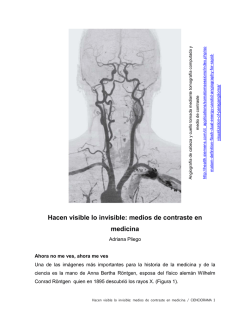
Contraindicaciones El iopamidol está estrictamente contraindicado
Contraindicaciones El iopamidol está estrictamente contraindicado en pacientes con hipertiroidismo declarado. Hipersensibilidad, probada o sospechada, al principio activo yodo o a cualquiera de los excipientes. Advertencias y precauciones especiales de empleo Como en el caso de todos los demás medios de contraste, este producto puede provocar anafilaxia u otros síntomas de alergia, con náuseas, vómitos, disnea, eritema, urticaria e hipotensión. Los antecedentes de alergia, asma o reacción adversa durante investigaciones similares previas indican la necesidad de observar precauciones especiales; el beneficio debe compensar claramente el riesgo en tales pacientes. Debe estar inmediatamente disponible el equipo adecuado de reanimación. Los pacientes deben estar suficientemente hidratados antes de la realización de procedimientos radiográficos. Los pacientes con trastornos funcionales graves del hígado o del miocardio, mielomatosis, diabetes, poliuria u oliguria, hiperuricemia, niños, pacientes ancianos y pacientes con enfermedad sistémica grave no deben exponerse a deshidratación. Las anomalías del equilibrio hidroelectrolítico deben corregirse antes de la administración. En pacientes con trastornos de la función renal debe evitarse la administración de fármacos potencialmente nefrotóxicos hasta que se elimine completamente el medio de contraste. Debe posponerse la administración subsiguiente de medios de contraste hasta que la función renal haya alcanzado su nivel previo. Dado que la experiencia ha demostrado que los medios de contraste calentados se toleran mejor, debe calentarse el medio de contraste hasta la temperatura corporal antes de su administración. Las reacciones adversas más frecuentes observadas con iopamidol han sido náuseas, vómitos, rubefacción, escalofríos, dolor y disgeusia. Se ha descrito la aparición de reacciones alérgicas tardías, habitualmente prurito y urticaria, hasta varios días después de la administración. Puede desarrollarse una reacción adversa independientemente de la cantidad de medio de contraste y de la vía de administración, y una reacción adversa leve puede ser un primer signo del desarrollo de un choque anafiláctico. También se han observado reacciones más graves. Pueden aparecer por separado o combinadas, y pueden incluir trastornos cutáneos, respiratorios, neurosenso-riales, digestivos y cardiovasculares, llegando a veces al colapso circulatorio, excepcionalmente con choque anafiláctico y/o parada circulatoria. Las reacciones de hipersensibilidad son más frecuentes en pacientes con predisposición alérgica o que han presentado reacciones de hipersensibilidad durante una exploración previa con un agente de contraste yodado. Existe un riesgo de reacciones graves en pacientes con cardiopatía grave, especialmente en aquéllos con insuficiencia cardíaca o arteriopatía coronaria. La inyección con medio de contraste intravascular puede provocar edema pulmonar en pacientes con insuficiencia cardíaca declarada, mientras que la administración de medio de contraste en pacientes con hipertensión pulmonar y cardiopatías valvulares puede traducirse en profundos cambios hemodinámicos. Los cambios isquémicos en el ECG y las arritmias intensas son muy habituales en pacientes ancianos y en aquéllos con cardiopatía preexistente. Las reacciones de mayor gravedad que afecten al sistema cardiovascular pueden requerir tratamiento de urgencia, por lo que debe estar inmediatamente disponible el equipo apropiado de reanimación. El iopamidol puede provocar insuficiencia renal transitoria, excepcionalmente con insuficiencia renal aguda. Se han descrito pocos casos de trombocitopenia. Los pacientes con insuficiencia hepatorrenal grave no deben ser sometidos a exploración, a no ser que esté absolutamente indicado. La reexploración debe retrasarse 5-7 días. Deben extremarse las precauciones cuando se inyecta este producto en el hemicardio derecho o en la arteria pulmonar de pacientes con hipertensión pulmonar. La angiografía del hemicardio derecho debe realizarse solamente cuando esté absolutamente indicada. Durante la arteriografía intracardíaca y/o coronaria pueden tener lugar, de forma infrecuente, arritmias ventriculares. Debe mantenerse la medicación de los pacientes que son epilépticos declarados o que tienen antecedentes de epilepsia. En algunos casos, el tratamiento con anticonvulsivos debe aumentarse durante 48 horas antes de la exploración. El uso de este producto puede interferir con las pruebas de la función tiroidea. El iopamidol inyectable debe utilizarse con precaución en pacientes con hipertiroidismo. Pueden darse recidivas de hipertiroidismo en pacientes con tratamiento previo contra la enfermedad de Graves. Los medios de contraste no iónicos presentan menor actividad anticoagulante in vitro que los medios iónicos. Por consiguiente, debe prestarse una atención cuidadosa a la técnica angiográfica. No debe permitirse que los medios no iónicos permanezcan en contacto con la sangre en la jeringa, y los catéteres intravasculares deben enjuagarse frecuentemente, para reducir al mínimo el riesgo de coagulación, que, en raras ocasiones, ha provocado complicaciones tromboembólicas graves tras los procedimientos. Los pacientes con feocromocitoma pueden desarrollar crisis hipertensivas graves tras la administración intravascular de iopamidol. Se recomienda la medicación previa con bloqueantes del receptor alfa. En pacientes con gammapatía monoclonal (mielomatosis, macroglobulinemia de Waldenström), la administración intravascular de medios de contraste es potencialmente peligrosa. En tales pacientes, puede disminuirse el riesgo de deterioro de la función renal si se hidrata bien al paciente antes de la administración. Para evitar crisis en pacientes con anemia falciforme, debe asegurarse su hidratación adecuada y debe utilizarse un volumen mínimo de baja concentración. Puede aparecer irritación del tejido local en el caso de infiltración perivascular de los medios de contraste. Como en el caso de todos los agentes de contraste yodados, el iopamidol puede provocar reacciones de intolerancia graves o mortales. Durante la exploración, se requiere una vía intravenosa para el tratamiento de urgencia en caso de que se declare una reacción. Deben estar disponibles fármacos y el equipo necesario para la reanimación de urgencia. Los pacientes con insuficiencia cardíaca congestiva deben ser sometidos a observación durante varias horas tras la realización del procedimiento, para detectar trastornos hemodinámicos tardíos, que pueden estar asociados a un aumento transitorio en la carga osmótica circulante. Todos los demás pacientes deben ser sometidos a observación durante por lo menos una hora después del procedimiento, ya que la mayoría de los acontecimientos adversos suceden durante este período. El paciente debe ser informado del posible desarrollo de reacciones alérgicas hasta varios días después del procedimiento; en cuyo caso debe acudirse inmediatamente al médico. En los recién nacidos, y especialmente en los recién nacidos prematuros, se recomienda la realización de pruebas de la función tiroidea (típicamente TSH y T4) 7-10 días y 1 mes después de la administración de medios de contraste yodados, debido al riesgo de hipotiroidismo provocado por sobrecarga de yodo.En los procedimientos angiográficos debe tenerse en cuenta la posibilidad de desplazamiento de placas o lesión o perforación de la pared vascular durante la manipulación del catéter y la inyección de medio de contraste. Se recomiendan inyecciones de prueba para asegurar la colocación adecuada del catéter.Siempre que sea posible, debe evitarse la angiografía en pacientes con homocistinuria, debido a un aumento del riesgo de trombosis y embolia. En pacientes sometidos a angiografía periférica debe haber pulsación en la arteria en la que se va a inyectar el medio de contraste radiográfico. En pacientes con tromboangitis obliterante o infecciones ascendentes junto con isquemia grave, la angiografía debe realizarse con especial precaución, o no realizarse. En pacientes sometidos a venografía deben extremarse las precauciones cuando se trate de pacientes con posible flebitis, isquemia grave, infecciones locales u oclusión venosa completa. La administración de medios de contraste yodados puede agravar los síntomas de la miastenia grave. Sobredosificación Los agentes de contraste pueden eliminarse por diálisis. Interacciones con otros medicamentos y otras formas de interacción Datos farmacéuticos Tras la administración de iopamidol se reduce la capacidad de captación de yodo del tejido tiroideo durante 2–6 semanas. Se ha descrito trombosis arterial cuando se administra iopamidol después de papaverina. Relación de excipientes Trometamol, ácido clorhídrico, edetato de calcio y sodio, agua para inyecciones. La administración de vasopresores potencia considerablemente los efectos neurológicos de los medios de contraste intraarterial. Se ha descrito toxicidad renal en pacientes con trastornos hepáticos que recibieron por vía oral agentes de contraste para colecistografía, seguidos por agentes de contraste intravascular. Por consiguiente, la administración de agentes de contraste intravascular debe posponerse en pacientes que hayan recibido recientemente un agente de contraste para colecistografía. Los medios de contraste pueden interferir con las pruebas analíticas de bilirrubina, proteínas o sustancias inorgánicas (por ejemplo, hierro, cobre, calcio, fosfato). Estas sustancias no deben analizarse durante el día posterior a la administración de medios de contraste. En pacientes con nefropatía diabética preexistente, la administración de iopamidol puede provocar acidosis láctica si los pacientes reciben simultáneamente una biguanida. El tratamiento con la biguanida debe interrumpirse 48 horas antes de la administración de iopamidol y puede reanudarse cuando la función renal haya alcanzado el nivel anterior a la exploración. En pacientes que reciben betabloqueantes hay un riesgo elevado de reacciones agravadas de tipo anafiláctico. Tras la administración de iopamidol se han descrito reacciones adversas atípicas, por ejemplo, eritema, fiebre y síntomas de gripe en pacientes tratados con interleucina-2. Incompatibilidades Muchos agentes de contraste radiopacos son incompatibles in vitro con algunos antihistamínicos y con muchos otros fármacos; por consiguiente, no deben mezclarse otros medicamentos con los agentes de contraste. Existe un riesgo elevado de convulsiones en pacientes con epilepsia o lesiones cerebrales focales tratadas con fármacos psicotrópicos específicos, por ejemplo, fármacos antipsicóticos y analépticos, antidepresivos tricíclicos e inhibidores de la monoaminooxidasa. Debe interrumpirse el tratamiento con dichos agentes, si es posible, 48 horas antes de la administración de iopamidol y reanudarse 24 horas después. Uso durante el embarazo y lactancia No se ha comprobado la seguridad del iopamidol inyectable durante el embarazo. En cualquier caso, dado que debe evitarse la exposición a radiaciones durante el embarazo, independientemente de si se usa un agente de contraste o no, el beneficio de un examen con rayos X debe ser considerado cuidadosamente. Aparte de la exposición del feto a radiaciones, la evaluación de la relación beneficio-riesgo de los agentes de contraste que contienen yodo debe tener en cuenta también la sensibilidad del tiroides fetal al yodo. Los agentes de contraste radiográficos que contienen yodo se excretan en la leche materna en pequeñas cantidades. Efectos sobre la capacidad para conducir y utilizar máquinas No se conocen efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, dado el riesgo reacciones tempranas, no se recomienda la conducción ni la utilización de máquinas hasta una hora después de la última inyección. Reacciones adversas El iopamidol puede causar reacciones adversas que son generalmente leves o moderadas y transitorias. A menudo se trata de reacciones tempranas, a veces tardías, que incluyen calor, frío, dolor localizado en el lado de la inyección, o en la región lumbar, abdominal o torácica, dolor general, disgeusia, rubefacción, reacciones dérmicas en forma de diversos exantemas, urticaria, cefalea, náuseas, vómitos, escalofríos, fiebre, temblor, mareo, rinitis, edema, disnea, hipotensión o hipertensión, taquicardia, angina de pecho, asma, broncoespasmo, confusión y convulsiones. Propiedades farmacológicas y Propiedades farmacodinámicas El iopamidol es un medio de contraste radiográfico no iónico de segunda generación, que es estable en solución. Dado su naturaleza no iónica, no posee partículas cargadas y presenta una menor osmolalidad que los agentes iónicos de concentración de yodo equivalente. Los resultados de los estudios clínicos y con animales indican que el iopamidol provoca menos trastornos de la función cardíaca que los agentes de contraste iónicos. No hay pruebas de efectos teratogénicos en ratas o en conejos, ni tampoco pruebas de mutagenicidad en el ensayo de micronúcleos. Sin embargo, hay pruebas de que, al igual que otros agentes de contraste yodados, el iopamidol inyectable es capaz de producir citotoxicidad sinérgica en presencia de rayos X. Se han descrito lesiones cromosómicas en linfocitos humanos in vitro e in vivo. No está clara la importancia clínica de estas observaciones. El iopamidol inyectable no presenta una farmacología clínica convencional, ya que su cometido es servir de agente pasivo para aumentar la absorción de los rayos X en los tejidos. Sin embargo, presenta diversos efectos accidentales fisiológicos, bioquímicos y hematológicos. Propiedades farmacocinéticas El iopamidol se absorbe rápidamente en el torrente sanguíneo a partir del líquido cefalorraquídeo (LCR); tras la administración intratecal, el iopamidol aparece en el plasma en el plazo de una hora y prácticamente la totalidad del fármaco alcanza la circulación sistémica en el plazo de 24 horas. El iopamidol inyectable se distribuye en todo el líquido extracelular, pero no penetra en las células. El volumen de distribución es 0,28 l/kg y su semivida plasmática es 121 minutos, y más prolongada en la insuficiencia renal. El iopamidol se elimina principalmente por los riñones tras la administración intratecal, y el fármaco es esencialmente indetectable en el plasma 48 horas después. En ausencia de trastornos renales, la eliminación urinaria acumulada del iopamidol, expresada como porcentaje de la dosis intravenosa administrada, es aproximadamente 35 a 40 por ciento a los 60 minutos, 80 a 90 por ciento a las 8 horas, y 90 por ciento o más en el período de 72 a 96 horas tras la administración. En individuos normales, aproximadamente el 1 por ciento o menos de la dosis administrada aparece en las muestras de heces acumuladas a las 72 a 96 horas. El iopamidol presenta una escasa tendencia a unirse a proteínas séricas o plasmáticas. No se han encontrado pruebas de activación del complemento in vivo en individuos normales. Los estudios con animales indican que el iopamidol prácticamente no cruza la barrera hematoencefálica tras la administración intravascular. Datos preclínicos sobre seguridad Se ha comprobado que los valores de DL50 intravenosa en varias especies animales son 15-35 veces la dosis clínica máxima. El iopamidol no mostró capacidad teratogénica. En ratas, las dosis de yodo superiores a 1,5 g/kg tuvieron un efecto embriotóxico y disminuyeron el número de fetos vivos, así como el peso fetal. En conejos, se redujo el peso de los fetos a una dosis de yodo de 2,0 g/kg. El iopamidol no alteró la fertilidad de ratas ni el desarrollo perinatal y posnatal de las crías. Sin embargo, se ha observado una alteración reversible de la espermatogénesis en ratones tras la administración de una dosis única de iopamidol. Tolerabilidad local: La tolerabilidad farmacéutica local del iopamidol, 370 mg de yodo/ml, se estudió en ratas tras la inyección intramuscular en la aorta. En comparación con los agentes de contraste iónicos, la tolerabilidad farmacéutica del iopamidol fue equivalente o mejor. La inyección paravariceal accidental puede provocar hinchazón local, dolor y eritema. Normalmente, estas reacciones remiten sin complicaciones. El mantenimiento de la extremidad afectada en posición elevada y el tratamiento con compresas frías son medidas adecuadas. Período de validez 3 años. Tras abrirse por primera vez, el producto debe usarse inmediatamente. Precauciones especiales de conservación Proteger la solución de la luz y de los rayos X. No conservar por encima de 25° C. Conservar en el envase original. Scanlux® solución inyectable está indicado exclusivamente para uso único, y debe desecharse cualquier porción no utilizada. Desechar la solución si no está exenta de partículas. Los medios de contraste yodados pueden reaccionar con las superficies metálicas que contienen cobre (por ejemplo, latón); por consiguiente, debe evitarse el uso de equipo en el que el iopamidol se ponga en contacto con dichas superficies. Naturaleza y contenido del envase Scanlux® 300, 340 y 370 mg/ml soluciones inyectables están disponibles en frascos de vidrio transparente de 50 ml, 75 ml, 100 ml y 200 ml (Vidrio de tipo II) embalados en cajas. Instrucciones de uso y manipulación No aplicable. Se ha descrito toxicidad renal en pacientes con trastornos hepáticos que recibieron por vía oral agentes de contraste para colecistografía, seguidos por agentes de contraste intravascular. Por consiguiente, la administración de agentes de contraste intravascular debe posponerse en pacientes que hayan recibido reciente-mente un agente de contraste para colecistografía. Los medios de contraste pueden interferir con las pruebas analíticas de bilirrubina, proteínas o sustancias inorgánicas (por ejemplo, hierro, cobre, calcio, fosfato). Estas sustancias no deben analizarse durante el día posterior a la administración de medios de contraste. En pacientes con nefropatía diabética preexistente, la administración de iopamidol puede provocar acidosis láctica si los pacientes reciben simultáneamente una biguanida. El tratamiento con la biguanida debe interrumpirse 48 horas antes de la administración de iopamidol y puede reanudarse cuando la función renal haya alcanzado el nivel anterior a la exploración. En pacientes que reciben betabloqueantes hay un riesgo elevado de reacciones agravadas de tipo anafiláctico.
© Copyright 2026