ACIDOS Y BASES2k14 - Departamento de Química Orgánica
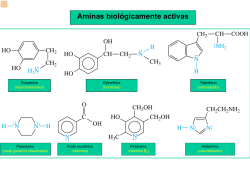
ACIDOS Y BASES QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014 Ácidos y Bases • Los términos “acido” y “base” pueden tener diferente significado, dependiendo del contexto. • La definición de Arrhenius nos dice que, en disolución acuosa, los ácidos forman cationes H+ mientras que las bases forman aniones –OH • La reacción ácido-base según Arrhenius es H+ (aq) + OH− (aq) H2O Ácidos y Bases • La teoría de Brønsted–Lowry define ácidos y bases según su papel en reacciones en las que se transfieren H+ entre donadores y aceptores, entonces, • Un ácido es aquella sustancia que puede donar un H+ y una base es aquella que puede aceptar un H+ • Esta definición extiende el concepto de Arrhenius a sistemas en donde no hay agua involucrada. • La reacción +acido-base según Brønsted–Lowry es AH + B → BH+ + A− Ácidos y Bases Fuerza ácida • La constante de equilibrio (Keq ) para la reacción entre un ácido HA y agua, es una medida relacionada con la fuerza del ácido: Fuerza ácida • La concentración del agua como disolvente (≈55.4 M a 25°C) no cambia significativamente cuando se ve protonada, por lo que pKa y la escala de fuerza ácida • • • • pKa = -log Ka Recordar que en el equilibrio, ΔG = -RT log Keq Un valor pequeño de pKa indica que se trata de un ácido fuerte, y es proporcional a la diferencia de energía entre productos y reactivos. Los valores de pKa serán útiles para predecir si una reacción se llevará a cabo o no. Predicción de reacciones ácido base a partir de los valores de pKa • La diferencia entre dos valores de pKa es el log de la razón entre dos constantes de equilibrio y puede indicar el grado de transferencia de H+ (la base más fuerte se une más al protón) Ácidos y bases orgánicos • Se caracterizan por la presencia de un átomo de hidrógeno polarizado positivamente: Ácidos orgánicos • Tendremos aquellos que pierden un H+ de un grupo O-H : El anión está estabilizado al tener una carga negativa sobre un átomo muy electronegativo El anión está estabilizado tanto por tener una carga negativa sobre un átomo muy electronegativo como por resonancia Ácidos orgánicos • Puede ser también que se trate de un H unido a un carbono: El anión está estabilizado tanto por resonancia como por tener una carga sobre un átomo muy electronegativo. Bases orgánicas • Presentan un átomo con un par de electrones sin compartir, que puede enlazarse a un H+ • Las bases orgánicas más comunes contienen nitrógeno similar al del NH3 • Los compuestos oxigenados pueden actuar como bases en presencia de ácidos fuertes, o como ácidos en presencia de bases fuertes. Ácidos y Bases: la definición de Lewis • Según esta definición, un ácido es un aceptor de pares de electrones y una base, un donador de pares de electrones, dando como resultado la formación de un enlace covalente. • La definición de Lewis es más general que las anteriores y puede aplicarse a muchas reacciones, pero no presentará una escala de fuerza ácida o básica, como en la definición de pKa en el concepto de Brønsted–Lowry. Acidos y bases: la definición de Lewis • Bajo el concepto de Lewis, los ácidos de Brønsted–Lowry (con excepción del H+ propiamente dicho) no son ácidos porque no pueden aceptar un par de electrones directamente. Ácidos y bases: la definición de Lewis • La definición de ácido de Lewis incluye a cationes como el Mg+2 porque aceptan electrones cuando forman un enlace con una base. • Compuestos de elementos del grupo 3A como AlCl3 o BF3 son ácidos de Lewis porque tienen un orbital vacío y pueden aceptar un par de electrones de un donador. Ácidos y bases: la definición de Lewis • Compuestos de metales de transición, como TiCl4, FeCl3, ZnCl2, y SnCl4, son ácidos de Lewis. • Compuestos orgánicos que sufren reacciones con donadores de electrones (bases de Lewis) son ácidos de Lewis, denominados electrófilos • La combinación entre un ácido de Lewis y una base de Lewis puede mostrarse mediante el uso de una flecha curva que se dirige de la base hacia el ácido. Ácidos y bases: la definición de Lewis • Las bases de Lewis pueden aceptar protones además de ácidos de Lewis, por lo que la definición comprende a las bases de Brønsted– Lowry. • La mayoría de compuestos orgánicos oxigenados y nitrogenados serán bases de Lewis, dado que N y O presentan electrones sin compartir. (Nucleófilos) • Algunos compuestos pueden actuar como ácidos o como bases, dependiendo de las condiciones de reacción. Acidez de alcoholes y fenoles • Tanto alcoholes como fenoles se consideran análogos del agua: Acidez de alcoholes • La acidez relativa de los alcoholes varía: metanol > alcohol 1º > alcohol 2º > alcohol 3º • Los factores que influyen en la acidez de alcoholes son: efectos estéricos (solvatación del ion formado), y electrónicos (deslocalización de la carga en el ion alcóxido) Efecto estérico • Influye en la disponibilidad o accesibilidad del oxígeno negativo de la sal para poder ser solvatada por el disolvente y así, estabilizar la carga negativa. Los efectos inductivos ATRACTORES de electrones, incrementan la acidez, al estabilizar la base formada (ion alcóxido). Los grupos alquilo, al ser donadores de electrones, disminuyen la acidez y por ello, los alcoholes 3s son menos ácidos que los 2s y éstos, menos ácidos que los 1s. Los grupos atractores de electrones estabilizan el alcóxido y disminuyen el pKa Acidez de alcoholes • Con excepción del metanol, los alcoholes simples son ácidos más débiles que el agua. • Requieren de bases muy fuertes para reaccionar formando la sal (ion alcóxido), generalmente se usa una reacción redox con un metal alcalino. Acidez de alcoholes Acidez de fenoles • Son más ácidos que los alcoholes porque la base conjugada puede ser estabilizada por resonancia: :O: O: O: : O: : .. Acidez de fenoles • Puesto que su pKa ~10, a diferencia de los alcoholes, los fenoles sí pueden reaccionar con NaOH acuoso: Efecto de los sustituyentes en el anillo sobre la acidez de los fenoles -NO2, -SO3H, -COOH, -COOR, -CONH2 -CHO, -COR, -CN, -X Incrementan la acidez del fenol -OH, -NH2, -OR, -NHCOR, -OCOR, -R, -Ar Disminuyen la acidez del fenol Aminas: análogos del amoniaco Basicidad de las aminas • El par de electrones sin compartir del nitrógeno hace que las aminas sean bases de Lewis (y también de Brønsted–Lowry.) Basicidad de las aminas ÁCIDO CONJUGADO BASE ÁCIDO BASE CONJUGADA Basicidad de aminas alifáticas Amine Ammonia Primary Amines methylamine ethylamine cyclohexylamine Secondary Amines dimethylamine diethylamine Tertiary Amines trimethylamine triethylamine Structure pKb pKa NH 3 4.74 9.26 CH 3 NH2 CH 3 CH2 NH2 C 6 H11 NH2 3.36 3.19 3.34 10.64 10.81 10.66 (CH 3 ) 2 NH (CH 3 CH 2 ) 2 NH 3.27 3.02 10.73 10.98 (CH 3 ) 3 N (CH 3 CH 2 ) 3 N 4.19 3.25 9.81 10.75 Basicidad de aminas alifáticas • Los grupos alquilo, al ser donadores de electrones, incrementarán la densidad electrónica sobre el nitrógeno y colaborarán en la dispersión de la carga positiva del ion amonio. • Si solamente se tomara en cuenta ese factor, las aminas terciarias resultarían ser más básicas que las primarias, pero • Las sales de las aminas primarias se solvatan con más facilidad que las de las aminas secundarias y terciarias y al tomar en cuenta este factor, resulta que no hay diferencia significativa entre la basicidad de las aminas alifáticas 1s. , 2s. Y 3s. Basicidad de aminas aromáticas • El par de electrones libres del nitrógeno en las anilinas está comprometido parcialmente con el anillo aromático y por lo mismo, no estará disponible tan fácilmente como en las aminas alifáticas. Basicidad de aminas aromáticas Basicidad de aminas aromáticas: efectos del sustituyente Sustituyentes Electrón-dadores (-OH; CH3, NH2, OCH3) incrementan la basicidad de la arilamina correspondiente. Sustituyentes Electrón-atractores (-COO Cl, NO2, CN) disminuyen la basicidad de la arilamina. Basicidad de aminas heterocíclicas Basicidad de aminas heterocíclicas Basicidad de aminas heterocíclicas Basicidad de aminas heterocíclicas Basicidad de aminas: formación de sales • Todas las aminas, solubles o insolubles en agua, reaccionan cuantitativamente con ácidos minerales para formas sus sales, que pueden considerarse análogos del ion amonio. • Estas sales, al ser compuestos iónicos, serán sólidos cristalinos de alto punto de fusión, solubles en agua. • Esta propiedad puede aprovecharse para separación o purificación de mezclas. Referencias McMurry. Química Orgánica.(2008) 7ª. Edición. Cengage Learning. Wade. (2012) Química Orgánica. 7ª. Edición. Morrison y Boyd. (1990) Química Orgánica. 5ª. Edición.
© Copyright 2026