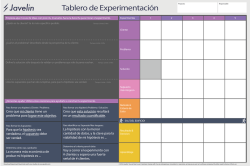
programa profesional de ingeniería industrial manual de prácticas
PROGRAMA PROFESIONAL DE INGENIERÍA INDUSTRIAL MANUAL DE PRÁCTICAS QUÍMICA II AREQUIPA – PERÚ 2013 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ INTRODUCIÓN Presentación para el estudiante Instrucciones para el trabajo en el laboratorio Operaciones peligrosas En caso de accidentes Normas para el uso del laboratorio Primeros auxilios Pág. Práctica Nº 1: Hibridaciones de los átomos de la Química Orgánica y sus formas geométricas 09 Práctica Nº 2: Análisis Inmediato 17 Práctica Nº 3: Hidrocarburos alifáticos 22 Práctica Nº 4: Halogenuros de Alquilo 29 Práctica Nº 5: Alcoholes 34 Práctica Nº 6: Aldehídos y Cetonas 41 Práctica Nº 7: Ácidos Carboxílicos 48 Práctica Nº 8: Ácidos Carboxílicos y Derivados 53 Práctica Nº 9: Aminas 55 Práctica Nº 10: Amidas 59 Práctica Nº 11: Carbohidratos: Monosacáridos, Disacáridos y Polisacáridos 62 Práctica Nº 12: Aminoácidos y Proteínas 67 Práctica Nº 13: Polímeros 71 BIBLIOGRAFÍA 76 CONTROLES 78 2 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ INTRODUCCIÓN En el presente Manual del laboratorio ha sido diseñado para verificar, comprobar y reforzar conocimientos teóricos. Se han considerado una serie de experimentos ordenados de acuerdo a capítulos introduciendo síntesis y aplicación en la elaboración de productos de acuerdo a la especialidad. Este manual esencialmente está dirigido a estudiantes de las áreas de Ciencias e ingenierías y para todos los profesionales dedicados a la enseñanza – aprendizaje experimental de esta ciencia. Se han desarrollado 13 secciones de laboratorio con un orden secuencial en unidades temáticas respectivas. Para cada unidad se han diseñado los experimentos y sus ecuaciones fundamentales, separando las funciones más importantes a efectos de que el estudiante pueda observar, sugerir y crear, así como de poder formular resultados óptimos. Es nuestro deseo, que el presente manual les ayude a una mejor compresión, tanto teórica y experimental y se utilice como una obra de referencia y les ayude a resolver inquietudes planteadas. Responsable del Curso de Química II 3 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRESENTACIÓN PARA EL ESTUDIANTE Las reglas y normas que a continuación se indican deberán de ser cumplirlas irrestrictamente ya que de ello depende su formación integral y evaluación en el curso de Química. 1. La asistencia a las prácticas es obligatoria, el contar con 30% de inasistencias se le considera como ABANDONO 2. El alumno deberá de respetar el horario y el grupo asignado. La puntualidad a la práctica es fundamental. El alumno no podrá ingresar al laboratorio pasada la hora de inicio y esto será considerado inasistencia. 3. Al inicio del curso se le entregara el silabus del curso, donde encontrara el programa del curso, fechas de evaluación actividades que se ejecutaran y peso de las diferentes en su aprendizaje, así como, la forma de obtener el promedio final. 4. Las evaluaciones se efectuaran en el proceso y/o al final del curso tanto en la parte teórica como experimental. 5. Cuando Ud. ingrese al laboratorio debe previamente haber leído con suficiente anticipación el MANUAL DE QUÍMICA II, así como el haber comprendido los conceptos básicos y otros que los Docentes le han impartido en sus clases teóricas. 6. Tener siempre consigo su cuaderno datos y de notas de laboratorio, anotar los medidas directamente en el. Es un pésimo hábito anotar importantes datos en un pedazo de papel. 7. Consultar con el Docente cuando no se entiende una operación o reacción química. 8. Hacer uso del mandil, lentes de seguridad en forma obligatoria en los ambientes de trabajo. 9. La ruptura o daño de los materiales y aparatos, es responsabilidad de los estudiantes que se encuentren operando. Todo accidente por mínimo que parezca o ante cualquier indicio de intoxicación (cansancio, sueño, dolor de cabeza o nauseas, etc.) deberá de ser comunicado inmediatamente al profesor encargado tratando de evitar el pánico para tomar las medidas necesarias de acuerdo al caso. 4 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ INSTRUCCIONES PARA EL TRABAJO EN EL LABORATORIO DE QUIMICA II 1. Recuerde que el laboratorio es un lugar serio de trabajo. Debe conocer su ubicación permanente en la mesa y mantenerla el orden. 2. Lea cuidadosamente el MANUAL DE PRACTICAS DE QUÍMICA II preparando un bosquejo de informe. Al realizar las prácticas, solo efectúe las señaladas y a medida que las realice, complete su informe correspondiente. 3. Deje sus mochilas, chaquetas y cualquier otro implemento, que no necesite en el laboratorio, en los casilleros dispuestos para tal fin. 4. No juegue con las llaves de agua, gas, etc. que se encuentran en las mesas. 5. Si deja caer las sustancias químicas sobre la mesa, limpiar inmediatamente. 6. No toque directamente con las manos las sustancias químicas desconocidas. 7. Si desea conocer el olor de una sustancia, no acerque a la cara directamente, abanique un poco de vapor a las fosas nasales, moviendo la mano sobre la sustancia o el recipiente que contiene la sustancia 8. Compruebe cuidadosamente los rótulos de los frascos de reactivos antes de usar su contenido. 9. No devolver los sobrantes de compuestos usados a los frascos originales, no introducir objeto alguno dentro de ellos, no cambiarles de tapa por ningún motivo. 10. Los frascos goteros no se debe destapar para usarlos, consulte su uso con el profesor. 11. Antes y después del experimento, asegúrese de la limpieza de las mesas y aparatos usados, deje todo en su sitio. 12. Todo material roto o extraviado durante la práctica será de responsabilidad de todos los integrantes del grupo. 13. Al momento de encender el mechero, verifique que las llaves y manguera correspondan al respectivo mechero. 14. Antes y después del experimento, asegúrese de la limpieza de las mesas de trabajo y aparatos usados, deje todo en su sitio. FINALMENTE, LAVARSE BIEN LAS MANOS, CON AGUA Y JABÓN, DESPUÉS DE HACER UN EXPERIMENTO Y ANTES DE SALIR DEL LABORATORIO. 5 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ OPERACIONES PELIGROSAS Las prácticas de Laboratorio requieren de mucho más cuidado del que hasta ahora se ha expuesto en estos puntos se exige al alumno EL USO DE LOS LENTES DE SEGURIDAD. Hay pequeños detalles que se deben tener en cuenta para realizar ciertas operaciones, evitando consecuencias desagradables: 1. Nunca calentar un tubo de prueba, dirigiendo éste hacia sí o hacia algún compañero, las sustancias que se calientan, generalmente líquidas, pueden proyectarse violentamente hacia afuera, provocando un accidente. 2. Nunca prenda un mechero, abriendo totalmente la llave de gas y manteniendo la cara sobre el mismo; la presión del gas produce una llama bastante larga que podría causarle quemaduras. 3. Tener mucho cuidado al introducir un tubo o un Termómetro a través de un tapón de corcho o de jebe. La presión deberá ejercerse sobre el tubo en un punto próximo al tapón; si se presiona desde el extremo opuesto, se tendrá mayor facilidad, pero puede producirse una palanca que fácilmente lo rompa, es aconsejable cubrirse la mano con un trapo y humedecer en agua, aceite o álcali el tubo o termómetro. 4. Emplear siempre la pinza para coger los tubos, especialmente cuanto está efectuando calentamiento (recuerde que el tubo se pone rojo cuando está lo suficientemente caliente, como para producir dolorosas quemaduras. 5. Mantener lejos de la cara, extendiendo bien los brazos toda clase de reactivos cuando por primera vez se ha de verificar alguna reacción química. Muchas veces ésta desprende gran cantidad de calor, que puede proyectar violentamente los reactantes fuera del tubo. ¡¡¡¡TODO LO QUE NO SEA AGUA ES DAÑINO PARA EL OJO!!!! ¡¡¡¡LOS LENTES DE SEGURIDAD SOLO AYUDAN, SI LOS LLEVA PUESTOS!!!! 6 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ NORMAS PARA EL USO DEL LABORATORIO DE QUÍMICA II Las clases prácticas de laboratorio son herramientas indispensables para el desarrollo integral del Curso de Química II, por eso es necesario cumplir en su cabalidad las normas de seguridad siguientes: En caso de padecimiento de alguna enfermedad o condición alguna, tiene que ser informado al Docente responsable del curso. 1. Recuerde que el laboratorio es un lugar de trabajo riesgoso, en virtud de los equipos, aparatos, sustancias y elementos que se utilizan al realizar un experimento. adicionalmente Ud. debe conocer su ubicación permanente en el mesón de trabajo y tiene que mantenerlo en orden. 2. Se debe trabajar sin prisas, pensando en cada momento lo que estás haciendo y debe mantener los materiales y reactivos ordenados. 3. EN EL LABORATORIO ESTÁ PROHIBIDO hacer bromas, correr, jugar, comer, etc. Un comportamiento irresponsable es motivo de EXPULSIÓN INMEDIATA DEL LABORATORIO Y DE SANCIÓN ACADÉMICA. 4. Debe dejar sus mochilas, chaquetas y/o cualquier otro implemento, que no necesite en el laboratorio, en los casilleros dispuestos para tal fin. 5. Será nombrado en forma relativa un coordinador de grupo quién será el responsable del material o equipo recibido y apoyar ante cualquier Incidente. 6. Lea cuidadosamente el MANUAL DE PRACTICAS DE QUÍMICA II preparando un bosquejo de informe. Al realizar las prácticas, solo efectúe las señaladas y a medida que las realice, complete su informe correspondiente. 7. ES OBLIGATORIO usar vestimenta adecuada: MANDIL CON MANGA LARGA que cubra la ropa que llevan, preferentemente de algodón (que no será utilizado fuera del laboratorio), zapatos cerrados y tener el pelo recogido. 8. Es obligatorio el uso de LENTES DE SEGURIDAD durante la realización de los Trabajos Prácticos. Los ojos son órganos muy vascularizados que pueden absorber rápidamente algunos compuestos químicos. Por otra parte, aunque no estemos trabajando directamente estamos expuestos a posibles aerosoles y vapores, y éstos nos sirven de protección. Lentes de contacto no son recomendados en el laboratorio. Las lentes de seguridad evitan la salpicadura de reactivos hacia los ojos, sin embargo, ellas no evitan el 7 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ contacto con algunos gases, que pueden secar los lentes de contacto e incluso ser absorbidos por estos. 9. Los lentes son de uso personal y no pueden ser intercambiadas entre los alumnos. 10. Finalmente, lavarse bien las manos, con agua y jabón, después de hacer un experimento y antes de salir del laboratorio. 8 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 1 HIBRIDACIONES DE LOS ÁTOMOS DE LA QUÍMICA ORGÁNICA Y SUS FORMAS GEOMÉTRICAS 1.1- OBJETIVOS • Conocer y comprender los conceptos más importantes relacionados con la estructura molecular de los compuestos del carbono y las propiedades que se derivan de tales estructuras. • Visualizar, con la ayuda de modelos, las formas tridimensionales de los diferentes tipos de enlaces que se forman alrededor del átomo de carbono y graficarlos de diversas maneras. 1.2.- FUNDAMENTO TEÓRICO La Química orgánica es el estudio de los compuestos del carbono. La mayoría de moléculas están constituidos por enlaces covalente; para una mejor compresión es necesario establecer la configuración electrónica, la fórmula molecular, forma bidimensional y espacial de las moléculas orgánicas. La isomería es una de las mayores "complicaciones" de la química orgánica que desconcertó durante muchos años a los químicos y que no se resolvió hasta mediados del siglo XIX. Si consideramos que los átomos de carbono se unen entre sí con diferentes tipos de enlaces formando cadenas y anillos, con ramificaciones o sin ellas, hasta llegar a límites inalcanzables para los otros elementos; es posible entender la existencia del gran número de moléculas orgánicas. Desde las moléculas pequeñas hasta las macromoléculas que contienen miles de átomos, el problema principal, es el complicado ordenamiento de los átomos. Además, hay muchas formas en que estos compuestos pueden romperse o reordenarse, agregar átomos nuevos o sustituir algunos átomos de sus estructuras para generar nuevas moléculas, lo que complica más su estudio. La base para conocer a los miles de compuestos que contienen carbono, ordenándolos de manera sistemática, es la Teoría Estructural, un marco de ideas sobre la manera en que se unen los átomos para formar las moléculas. Se refiere al orden en que se juntan tales átomos y como los electrones los mantienen unidos, a las propiedades que derivan de sus estructuras, con la clase de reactivos que reaccionarán y al tipo de productos que se pueden obtener. Se podría saber mucho acerca de un compuesto desconocido solamente a partir de su fórmula estructural. . 9 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ La teoría del Enlace valencia (TEV), derivada de la mecánica cuántica, proporciona un buen modelo para explicar la naturaleza y variedades de enlace covalente en base a Hibridaciones de orbitales, que son combinaciones o mezclas de orbitales atómicos puros de similar energía. El átomo de carbono que es el central en los compuestos orgánicos, por su gran versatilidad para formar cadenas puede hibridarse de tres formas distintas, tales como sp3, sp2 y sp. I. Hibridación sp3: Se produce en los átomos de carbono que presentan únicamente enlaces simples o sigma y consiste en la unión del orbital 2s con los tres orbitales 2p, lo que da lugar a la formación de cuatro orbitales atómicos híbridos desapareados, llamados sp3: 2px 2py 2pz 2sp3 2sp3 2sp3 2sp3 Energía 2s2 1s2 ESTADO BASAL ESTADO REAL El diagrama de energía muestra al átomo de carbono primero en su estado basal, es decir en su estado ideal sin ninguna influencia externa, donde está su configuración electrónica. Para poderse combinar es necesario un cambio, ya que se requieren cuatro orbitales iguales y de la misma energía para formar cuatro enlaces covalentes idénticos con otros átomos de carbono o átomos diferentes, generalmente H, O y N. Al igualar la energía se produce el salto de un electrón “2s” hasta el orbital vacío “2pz”, lo que implica la mezcla de los cuatro orbitales. La forma geométrica de este tipo de hibridación es la de un tetraedro regular con ángulos de separación de 109,5º. Esta hibridación es característica de los hidrocarburos alcanos y tiene gran estabilidad. 10 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ Metano (CH4) II. Hibridación sp2: Se presenta en átomos de carbono que forman un doble enlace, como es el caso de los hidrocarburos alquenos. Aquí sólo se mezclan tres orbitales: un orbital “2s” y dos orbitales “2p”, dando lugar a tres orbitales híbridos llamados 2sp2 que se dirigen a los vértices de un triángulo equilátero con un ángulo de separación de 120º. La diferencia con el caso anterior está en que el orbital 2pz no interviene en la mezcla, se mantiene puro y se utiliza en la formación del enlace doble o pi (π). ( = 2px 2py 2pz 2sp22sp22sp22pz Energía 2s2 1s2 ESTADO BASAL ESTADO REAL 11 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Diagrama de energía de la hibridación sp2, nótese el salto del electrón de 2s al orbital vacío 2py formando así los tres orbitales híbridos. Forma trigonal plana del carbono en la hibridación sp2. Etileno (C2H4) Es necesario mencionar que el enlace simple o sigma (σ) es el principal, muy fuerte y difícil de romper porque deriva de la interacción frontal de los orbitales atómicos por lo que los electrones compartidos se ubican en el eje internuclear y por lo tanto, están muy cerca de los dos núcleos de los átomos que forman el enlace. En cambio, los electrones de los enlaces pi (π) resultan de una interacción lateral de los orbitales “p” puros, no pueden ingresar al eje internuclear por la repulsión electrónica con el primer par de electrones, y deben ubicarse en la periferia, están más lejos de los núcleos atómicos y se pueden romper con facilidad. II. Hibridación sp: Propia de carbonos con un enlace triple (hidrocarburos alquinos), que consta de un enlace sigma y dos enlaces pi. Es la combinación del orbital 2s con solamente un orbital 2p, cambio que 12 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ permite la formación de dos orbitales híbridos tipo 2sp que se separan con un ángulo de 180º con una estructura lineal. Los orbitales puros 2py y 2pz no forman parte de la mezcla y se utilizan en la formación de los dos enlaces pi, que de hecho son bastante inestables. = 2px 2py 2pz 2sp 2sp 2py 2pz Energía 2s2 1s2 ESTADO BASAL ESTADO REAL Diagrama de energía que muestra la hibridación sp, el salto del electrón de “s” es hasta el primer orbital vacío de 2p. Aquí el electrón promovido de 2s sólo llega hasta el orbital 2px. Etino (C2H2) QUIRALIDAD Y ENANTIÓMEROS: Los dos objetos representados en la figura 1.1 parecen idénticos a todos los efectos. A cada arista, cara o ángulo en uno de ellos, le corresponde su arista, cara o ángulo en el otro. Con todo, los dos objetos no son superponibles entre sí y, por tanto, son objetos diferentes; se 13 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ relacionan entre sí como un objeto cualquiera se relaciona con su imagen en un espejo. Otro par de objetos familiares que se relacionan de esta forma son la mano izquierda y la mano derecha. En una primera aproximación, parecen idénticas i bajo casi todos los puntos de vista; no obstante, la mano derecha se ajusta perfectamente a un guante para la mano derecha pero no a un guante para la mano izquierda, por ende las manos no son idénticas. La propiedad general que define esa relación ón se denomina Quiralidad.. Cualquier objeto que no es superponible con su imagen especular es quiral.. Por otra parte, si un objeto y su imagen especular pueden hacerse coincidir en el espacio, se dice que son aquirales. REGLAS DE SECUENCIA PARA ESPECIFICAR AR LA CONFIGURACIÓN: Aunque los dibujos constituyan una representación de la estereoquímica, es difícil traducirlos en palabras. Así, también es necesario un método verbal para explicar el arreglo tridimensional de los átomos (la (la configuración) configuración en un centro o estereogénico. En el método acostumbrado se emplean las mismas reglas de secuencia (Z Z o E). ). Revisemos brevemente las reglas de Cahn-IngoldCahn Prelog a fin de ver cómo pueden servir para especificar la configuración de un centro estereogénico (carbono asimétrico). 1. Se observan los cuatro átomos unidos directamente al centro estereogénico y se asignan prioridades en orden decreciente de número atómico. El grupo con mayor número atómico tiene la máxima prioridad; el grupo con el menor número atómico tiene la mínima prioridad. 2. Si no es posible decidir la prioridad aplicando la regla 1, se comparan los números atómicos de los átomos unidos en segundo lugar en cada sustituyente; si es necesario se continúa hasta los terceros, cuartos o más átomos, tomos, hasta que se encuentre una diferencia. 3. Los átomos con enlaces múltiples se consideran como un número equivalente de átomos con enlaces simples. Por ejemplo: Una vez asignadas las prioridades de los cuatro grupos unidos a un carbono quiral, se describe la configuración estereoquímica alrededor del carbono 14 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ quiral orientando mentalmente la molécula de modo que el grupo de menor prioridad (cuatro) apunte directamente directamente hacia atrás, lo más alejado posible del observador. Después se analizan los tres sustituyentes restantes, que se dirigen en forma radial hacia el observador. Si una flecha curva dibujada desde el sustituyente con mayor prioridad hacia el de segunda prioridad pri y de ahí hacia el de tercera (1® 2® 3) tiene el sentido del reloj, se dice que el centro estereogénico tiene la configuración R (latín rectus,, “derecho”). Si por el contrario definen una curva en el sentido contrario de un reloj, se dice que el centro ro esterogénico tiene la configuración S (latín sinister,, “izquierdo”). Consideremos el ácido láctico como un ejemplo de la forma en que se asigna la configuración. 1. El primer paso es asignar prioridades. 2. Orientar la molécula, de tal manera que el grupo grupo de menor prioridad esté dirigido hacia atrás. Prioridades: 4 -H (baja) 3 -CH3 2 -COOH Ácido láctico. DIASTERÓMEROS: Moléculas 1 -OH como las del (alta) ácido láctico, alanina y gliceraldehído son relativamente fáciles de estudiar, puesto que cada una tiene sólo un centro estereogénico y sólo puede existir en dos configuraciones 15 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ enantioméricas. Sin embargo, la situación se torna más compleja en el caso de moléculas que tienen más de un centro estereogénico. Consideremos por ejemplo el aminoácido esencial treonina (ácido 2-amino-3hidroxibutanoico). Dado que la treonina tiene dos centros estereogénicos C2 y C3, existen cuatro estereoisómeros posibles, como analizaremos a continuación: (Se sugiere al alumno que verifique por sí mismo que la configuración R, S es correcta. ASIGNACIÓN DE CONFIGURACIONES R, S A PROYECCIONES DE FISCHER: Es posible asignar las configuraciones estereoquímicas R, S a las proyecciones de Fischer siguiendo los tres pasos que se indican a continuación: 1. Se asignan prioridades a los cuatro sustituyentes de modo usual. 2. Se realiza uno de los dos movimientos permitidos para colocar el grupo de menor prioridad (cuarta) en la parte de arriba de la proyección de Fischer. 3. Se determina el sentido de la rotación al pasar de la prioridad 1 a la 2 y a la 3, y se asigna la configuración R o S como determina la regla. (R en el sentido del reloj y S en el sentido contrario del reloj). 1.3. PARTE EXPERIMENTAL Experimento Nº 1.Guiados por el profesor, los alumnos deberán observar y estudiar los modelos que muestren las diversas formas de hibridación del átomo de carbono. Experimento N º 2. 1. Haga los estéreos isómeros del ácido tartárico, e indique los enantiómeros y diasteroisómeros. 2.- Haga los Confórmeros del Cloroetano y del ciclohexano en forma alternada y eclipsada 1.4. REPORTE DE RESULTADOS 1. Graficar detalladamente dichos modelos. 2. Establecer las diferencias entre las hibridaciones del átomo de carbono y sus formas geométricas, relacionándolas con las propiedades y estabilidad de sus compuestos. 3. Revisen la información y construyan las estructuras del etano, eteno y etino. Construidas y después de obtener el visto bueno, dibújenlas con sus enlaces sigma y pi según corresponde 16 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 2 ANÀLISIS INMEDIATO 2.1. OBJETIVOS • Conocer y aplicar las operaciones del laboratorio necesarias para efectuar análisis preliminares de reconocimiento de muestras diferentes. • Efectuar diversas operaciones químicas para obtener algunas sustancias orgánicas con buen grado de pureza. 2.2. FUNDAMENTO TEÓRICO Para iniciar primeramente el estudio de las propiedades e identificación de los diferentes compuestos químicos, es requisito que la muestra no presente impurezas, para ello es necesario realizar diferentes operaciones conocido como “análisis Inmediato” Se entiende por proceso químico al conjunto de operaciones físicas o químicas utilizadas en la transformación de las materias iníciales en productos finales diferentes. En un proceso algunos pasos son meramente físicos y otros implican variadas reacciones químicas. En el proceso químico cada de las operaciones es unitaria dentro del proceso global. Las operaciones del laboratorio químico se clasifican en: 1.2.1 OPERACIONES DE DIVISION: Que tienen por objeto reducir el tamaño de las sustancias hasta un grado de división que permita la descomposición o transformación ulterior. Aquí se ubican: Pulverización, porfirización, tamización, martilleo, etc. 2.2.2. OPERACIONES DE DISOLUCION: Entre las que se encuentran: • Solución simple. Que consiste en disgregar uniformemente un sólido, líquido o gas en otro líquido, que para las sustancias orgánicas puede ser éter, cloroformo, alcohol, acetona, etc. • Maceración. Es el ablandamiento de una sustancia sólida golpeándola o sumergiéndola en un líquido. Es un proceso de extracción sólido – líquido, en el que la materia prima sólida contiene una serie de compuestos solubles en el líquido extractante que se pretenden disolver. Se usa mucho en herboristería, es decir, el arte de utilizar las plantas medicinales y hierbas para curar o preparar diversos productos. La maceración se puede efectuar en frío o en caliente. • Digestión. Que es una forma especial de maceración en caliente. Generalmente se aplica este término a la descomposición de los alimentos en los sistemas digestivos. 17 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 2.2.3. OPERACIONES DE SEPARACION: Como lo dice su nombre dividen un sistema homogéneo o heterogéneo para tener a sus componentes en forma aislada o eliminar impurezas, logrando así productos puros. Entre estas operaciones podemos citar: • Decantación. Permite separar un sólido de un líquido o dos líquidos inmiscibles entre sí. Consiste en dejar en reposo la fracción insoluble de un sistema y luego escurrir con cuidado el líquido sobrenadante. • Filtración. Emplea medios porosos, como el papel filtro, que permiten el paso sólo de los líquidos separándolos de porciones insolubles no deseadas que contengan. Los líquidos filtrados son soluciones limpias libres de residuos sólidos. • Evaporación. Es el paso espontáneo de un líquido al estado de vapor, a temperatura y presión del medio ambiente. Si se eleva la temperatura hasta el punto de ebullición el vapor se formará más rápido, en este caso el proceso se denomina vaporización. • Desecación. Utilizando desecadores o estufas se eliminan los líquidos, principalmente agua, incorporados a los sólidos. • Deshidratación. Operación empleada para eliminar agua de otras sustancias líquidas para lo cual se agita el líquido acuoso con sustancias deshidratantes, tales como: CuSO4 anhidro, CaCl2, Na2SO4 anhidro, sílica gel, etc. • Destilación. Es una de las operaciones más comunes del laboratorio, consiste en separar dos o más líquidos miscibles por calentamiento y posterior enfriamiento con un condensador o refrigerante. El proceso se basa en las diferentes temperaturas de ebullición de los líquidos componentes de la mezcla. • Precipitación. Es un tipo de reacción química, casi siempre de metátesis, en la que se obtiene una sustancia insoluble que por su mayor densidad se va al fondo del recipiente. • Calcinación. Se someten las sustancias a la acción de altas temperaturas para originar cambios en su composición química. • Cristalización. Es un buen método para obtener sólidos puros cristalizados. Se puede lograr por sublimación o por evaporación de soluciones saturadas o sobresaturadas. 18 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 2.2.4. OPERACIONES DE MEDICION: Que utilizan la balanza analítica para medir sólidos y diversos recipiente volumétricos de vidrio (fiolas, probetas, pipetas, etc.) para medir líquidos. Las etapas del análisis orgánico son: Análisis Inmediato: Es el conjunto de ensayos separar y purificar sustancias orgánicas, que se realizan para mediante procedimientos mecánicos, físicos y químicos. Análisis Elemental Cualitativo: Para determinar el tipo de átomos que forman la molécula del compuesto. Así, la presencia de C e H se detecta por combustión, calentando la sustancia con CuO, que convierte al carbono en CO2 y al hidrógeno en H2O. Los elementos N, S y halógenos enlazados covalentemente primero deben convertirse en iones para luego ser detectados por métodos bastante conocidos. Esta conversión en iones se puede efectuar por dos caminos: Por medio de la fusión con sodio o por la oxidación de Schöringer con oxígeno gaseoso. Para el oxígeno no hay ningún ensayo químico simple, su presencia o ausencia se demuestra por un análisis cuantitativo. Análisis Elemental Cuantitativo: Determina el número relativo de los distintos tipos de átomos presentes en la molécula, o sea que sirve para hallar la fórmula empírica. Análisis Funcional: Para determinar el grupo o grupos funcionales que se encuentran presentes en un compuesto orgánico, como por ejemplo. –OH, – CHO, –COOH, –NH2, etc. 2.3. PARTE EXPERIMENTAL Experimento Nº 1.- Densidad método del Picnómetro Un picnómetro es un pequeño frasco de vidrio de volumen exacto y conocido (Vp). Se pesa vacío (wp), luego se llena completamente (incluido el capilar) con el líquido cuya densidad se desea determinar y finalmente se pesa (wpl). Con estos datos se puede calcular la densidad del líquido: 19 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Se usará el picnómetro para medir la densidad de cada líquido. Enjuague primero el picnómetro con un poco del líquido de interés antes de llenarlo. La densidad se calcula por medio de la ecuación Temperatura del líquido (T): __________ ºC Peso del picnómetro vacío (wp): __________ g Volumen del picnómetro (Vp): __________ mL Experimento Nº 2.- Análisis Cualitativo del oxígeno • Colocar en 2 tubos de ensayo unos cristalitos de yodo • A uno de ellos añadir una muestra liquida orgánica que contenga oxigeno (Etanol, butanol, etc.) Y al otro tubo una muestra orgánica que no tenga oxigeno (Heptano, cloroformo, etc.) • Si aparece una coloración parda rojiza esto nos indicara la presencia de oxígeno en la muestra, si se torna color violeta indicara la ausencia de oxígeno. Experiencia Nº 3.- Sublimación del yodo • Coger un tubo de ensayo limpio y agregarle unos cristales de yodo molecular. • Calentar suavemente el tubo y su contenido, utilizando un mechero de alcohol. • Observar y registrar los cambios que se producen en el yodo sólido que se sublima con facilidad y cristaliza en la parte superior del tubo. 20 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 2.3. REPORTE DE RESULTADOS. a) Datos obtenidos con el picnómetro Método del picnómetro Muestra wpl (g) wpl- wp (g) Agua b) Señale cinco diferencias entre compuestos inorgánicos o minerales y compuestos orgánicos. c) Formule cinco ejemplos de cambios físicos y cinco de cambios químicos. 21 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 3 HIDROCARBUROS ALIFATICOS 3.1. OBJETIVOS • Verificar las propiedades físicas y químicas más importantes de los hidrocarburos alifáticos saturados e insaturados 3.2. FUNDAMENTO TEÓRICO Hidrocarburos son aquellos compuestos orgánicos que en su composición tienen átomos de carbono e hidrógeno. Se clasifican en dos grupos: Según su estructura: a) Hidrocarburos alifáticos: Formados por cadenas de átomos de carbono con enlaces directos entre sí, en forma de cadena lineal o ramificada. b) Hidrocarburos Alicíclicos: Llamados Carbocíclicos cuyas moléculas incluyen cadenas de carbono en forma de anillos. c) Hidrocarburos Heterocíclicos: Son los que contienen sistemas de anillos además de carbono e hidrógeno otros elementos. Según la naturaleza los hidrocarburos pueden ser: a) Hidrocarburos saturados: Cuando los átomos de carbono están enlazados por un enlace simple. b) Hidrocarburos no saturados: Cuando los átomos de carbono están unidos por un doble enlace (Eteno o metileno) o triple enlace (Etino o acetileno). c) Hidrocarburos aromáticos: Todas las series del benceno y derivados. Los alcanos son hidrocarburos en los cuales todos los enlaces carbonocarbono son enlaces simples fórmula molecular es CnH2n+2 Los puntos de ebullición de los alcanos no ramificados aumentan al aumentar el número de átomos de Carbono. Para los isómeros, el que tenga la cadena más ramificada, tendrá un punto de ebullición menor. Solubilidad. Los alcanos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Los alcanos líquidos son miscibles entre sí y generalmente se disuelven en disolventes de baja polaridad Los buenos disolventes para los alcanos son el benceno, tetracloruro de carbono, cloroformo y otros alcanos 22 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ METODOS DE OBTENCIÓN El principal método para la obtención de alcanos es la hidrogenación de alquenos. PROPIEDADES QUÍMICAS: Los hidrocarburos saturados presentan baja reactividad frente a reactivos como: bases fuertes, ácidos fuertes, agentes oxidantes poderosos como el KMnO4, agentes reductores fuertes. Su baja reactividad es debida a sus enlaces que se encuentran saturados. Pero en condiciones energéticas dan lugar a REACCIONES DE SUSTITUCIÓN tal como la halogenación. Los hidrocarburos alifáticos no saturados tienen uno o más enlaces múltiples (dobles o triples) entre carbono – carbono en sus moléculas. Poseen por lo tanto menor cantidad de hidrógenos de la máxima como En los alcanos (hidrocarburos saturados), es esta la razón por el que se les llama insaturados. El doble o triple enlace les da ciertas características a estos compuestos por eso estos compuestos dan REACCIONES DE ADICIÓN REACCIONES: Las reacciones más importantes de los alcanos son la pirolisis, la combustión y la halogenación. • Pirolisis. Se produce cuando se calientan alcanos a altas temperaturas en ausencia de Oxígeno. Se rompen enlaces C-C y C-H, formando radicales, que se combinan entre sí formando otros alcanos de mayor número de C. 23 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ • Combustión. La combustión de los alcanos es una de las reacciones orgánicas más importantes si se tiene en cuenta la masa de material que utiliza este proceso. La combustión de gas natural, gasolina y fuel implica en su mayor parte la combustión de alcanos. Sin embargo, esta combustión deja de ser una reacción orgánica típica porque en primer lugar los reactivos de la reacción son en realidad mezclas de alcanos y en segundo lugar porque el producto pr deseado de la reacción es el calor que desprende y no los productos obtenidos en ella. De hecho, los productos generados en el proceso de combustión de los alcanos son, por lo general, compuestos sin interés y su eliminación, debido a su volumen, constituye nstituye un importante problema. 24 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ • Halogenación. El Br es muy selectivo y con las condiciones adecuadas, prácticamente, se obtiene un sólo producto, que será aquel que resulte de la adición del Br al Carbono más sustituido. El flúor es muy poco selectivo y puede reaccionar violentamente, incluso explosionar, por lo que apenas se utiliza para la halogenación de alcanos. La halogenación de alcanos mediante el Yodo no se lleva a cabo. FUENTE DE LOS ALCANOS: PETRÓLEO Muchos alcanos existen de manera natural en plantas y animales. Por ejemplo, la cubierta cerosa de las hojas de la col contiene nonacosanos (nC29H60), y el aceite de algunos pinos contiene heptano. La cera de abejas contiene, entre otras cosas, eneitriacontano (n-C31H64). Las principales fuentes de alcanos son, los depósitos mundiales de gas natural y petróleo, derivados de la descomposición de materia orgánica marina sepultada hace años. El gas natural consiste principalmente en metano, aunque también contiene etano, propano, butano e isobutano. Estos hidrocarburos simples se usan en grandes cantidades para calentar casas habitación, para cocinar alimentos y como combustible en las industrias. El petróleo es una mezcla compleja de hidrocarburos, la cual es necesario refinar para obtener diferentes fracciones antes de que pueda usarse. 25 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ Productos de la refinación del petróleo PROPIEDADES DE LOS ALCANOS: A Los alcanos también se llaman a veces parafinas, un nombre derivado del latín parumaffinis (que significa “de poca afinidad”). Este término define muy bien su comportamiento, ya que los alcanos tienen poca afinidad química hacia otras moléculas, y son químicamente inertes frente a la mayoría de los reactivos de uso común en química orgánica. Sin Sin embargo, en condiciones apropiadas loa alcanos reaccionan con oxígeno, cloro y algunas otras sustancias. Los alcanos presentan un incremento regular en el punto de ebullición como en el de fusión conforme aumenta el peso molecular, una regularidad que también t se refleja en otras propiedades. Los parámetros promedio del enlace carbonocarbono carbono son casi los mismos en todos los alcanos, con longitudes de enlace de 1.54 ± 0.01 Aº y energías de enlace de 85 ± 3 Kcal/mol. Las moléculas no polares, como las de los alcanos, se atraen débilmente entre sí por efecto de fuerzas intermoleculares de van der Waals. Waals Estas fuerzas, que actúan sólo a distancias muy cortas, resultan de la polarización inducida de las nubes electrónicas en las moléculas. Aunque la distribución distribu electrónica en una molécula es uniforme en promedio durante un periodo, la distribución en un instante dado cualquiera no es uniforme. Un lado de la molécula puede por casualidad, tener un ligero exceso de electrones en relación con el lado 26 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ opuesto. Cuando esto ocurre, la molécula posee un momento dipolar temporal y puede provocar que otra molécula cercana adopte temporalmente un dipolo opuesto, lo cual como resultado induce una ligera atracción entre las dos moléculas. Como podría esperarse, las fuerzas de van der Waals aumentan con el tamaño de la molécula. Si bien participan otros factores, al menos parte del incremento en el punto de ebullición observado al aumentar el número de carbonos en la serie de los alcanos se debe al incremento en las fuerzas de van der Waals. El efecto de la ramificación en los puntos de ebullición también puede explicarse recurriendo a las fuerzas de van der Waals. Los alcanos ramificados tienen una forma más esférica que los alcanos de cadena lineal; como resultado, tienen menor área superficial, menos fuerzas de van der Waals, y consecuentemente puntos de ebullición más bajos. ALQUENOS: Son hidrocarburos con un doble enlace carbono-carbono. El doble enlace es un enlace más fuerte que el enlace sencillo, sin embargo, paradójicamente el doble enlace carbono-carbono es mucho más reactivo. A diferencia de los alcanos, que generalmente muestran reacciones más bien no específicas, el doble enlace es un grupo funcional en el que tienen lugar muchas reacciones con marcado carácter específico. Históricamente, los hidrocarburos con un doble enlace se conocían con el nombre de olefinas. Este nombre, más bien raro, proviene del latín oleum, aceite surgió porque los derivados de tales compuestos tenían, a menudo, apariencia oleaginosa. La estructura geométrica del etileno, el alqueno más sencillo, es ampliamente conocida gracias a los experimentos espectroscópicos y de difracción. La molécula es plana y de acuerdo con la estructura de Lewis del etileno, el doble enlace de caracteriza por ser una región con dos pares de electrones. PROPIEDADES FÍSICAS. Las propiedades físicas de los alquenos son similares a las de los alcanos correspondientes. Los alquenos más pequeños son gases a temperatura ambiente. Comenzando por los compuestos C5, los alquenos son líquidos volátiles. Los alquenos isómeros tienen puntos de ebullición parecidos y las mezclas sólo pueden ser separadas mediante una destilación fraccionada realizada con mucho cuidado y con columnas de gran eficacia. Los momentos dipolares son pequeños en el caso de los hidrocarburos, pero permite una distinción entre los isómeros cis y trans. Por 27 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ ejemplo, el cis-2-buteno tiene un momento dipolar pequeño mientras que el trans-2-buteno tiene un momento. 3.3. PARTE EXPERIMENTAL PRIMERA PARTE: HIDROCARBUROS ALIFATICOS Experimento Nº 1.- Determinación de propiedades físicas Con la muestra proporcionada realice una búsqueda bibliográfica deberá consignar las siguientes propiedades físicas: Olor, Color y Estado físico. Solubilidad en Cloroformo • Obtener un tubo de ensayo y añadir 0,5 mL de muestra • Añadir en el tubo 0,5 mL de Cloroformo • Agitar las muestras • En la tabla proporcionada, registrar si la muestra es soluble en Cloroformo Solubilidad en Agua • Obtener un tubo de ensayo y añadir 0.5 mL de muestra • Añadir en el tubo 0.5 mL de agua • Agitar las muestras • En la tabla proporcionada, registrar si la muestra es soluble en Agua Experimento Nº 2.- Combustión • Obtener una capsula de porcelana y colocar 0.5 ml de muestra. • Acercar la llama de un cerillo con cuidado • Registrar tus observaciones Experimento Nº 3.- Prueba con el H2SO4 • A cada uno de los tubos de ensayo coloque 5 gotas del hidrocarburo y de alcohol. • Cuidadosamente y con agitación suave agregar 5 gotas de H2SO4 concentrado. • Observe si se desprende calor y si el compuesto reacción • Registra tus observaciones: 28 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 3.4. REPORTE DE RESULTADOS Experimento Nº 1. - Determinación de propiedades físicas MUESTRA Problema OLOR COLOR ESTADO FÍSICO SOLUBILIDAD EN CLOROFORMO SOLUBILIDAD EN AGUA Experimento Nº 2.- Combustión Registre sus observaciones Realice Ud. la ecuación de combustión Indique Ud. si deja algún residuo Experimento Nº 3.- Prueba con el H2SO4 Observar la reacción y anotar los resultados ¿Qué ha sucedido con las muestras? 29 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 4 HALOGENUROS DE ALQUILO 4.1. OBJETIVOS • Obtener algunos halogenuros de alquilo y evaluar sus propiedades físicas y químicas. 4.2. FUNDAMENTO TEÓRICO Los Halogenuros de alquilo son compuestos que contienen halógeno unido a un átomo de carbono saturado con hibridación sp3. El enlace C-X es polar, y por tanto los halogenuros de alquilo pueden comportarse como electrófilos. Los halogenuros de alquilo pueden obtenerse mediante halogenación por radicales de alcanos, pero este método es de poca utilidad general dado que siempre resultan mezclas de productos. El orden de reactividad de los alcanos hacia la cloración es idéntico al orden de estabilidad de los radicales: terciario > secundario > primario. Conforme al postulado de Hammond, el radical intermedio más estable se forma más rápido, debido a que el estado de transición que conduce a él es más estable. Los halogenuros de alquilo también pueden formarse a partir de alquenos. Estos últimos se unen a HX, y reaccionan con NBS para formar el producto de bromaciónalílica. La bromación de alquenos con NBS es un proceso complejo por radicales que ocurre a través de un radical alilo. Los radicales alilos son estabilizados por resonancia y pueden representarse de dos maneras, ninguna de las cuales es correcta por sí misma. La verdadera estructura del radical alilo se describe mejor como una mezcla o híbrido de resonancia de las dos formas resonantes individuales. Las longitudes y las energías de enlace de los diferentes haluros que se dan a continuación: 30 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ ESTRUCTURA DE LOS HALOGENUROS HA DE ALQUILO: El enlace carbono-halógeno halógeno en los halogenuros de alquilo resulta de la superposición de un orbital de carbono con hibridación sp3 y un orbital de halógeno. Así, los átomos de carbono de los halogenuros de alquilo tienen configuración geométrica aproximadamente aproximadamente tetraédrica, con ángulos de enlace H-C-X cercanos a 109º. Los halógenos aumentan de tamaño al descender en l la tabla periódica, incremento que se refleja en las longitudes de enlaces en la serie de los halometanos. Como los halógenos son más electronegativos que el carbono, el enlace resultante entre ambos resulta polarizado, el átomo de carbono tiene una ligera carga positiva, mientras que el átomo de halógeno tiene una ligera carga negativa. Dado que el átomo de carbono de los halogenuros de alquilo está polarizado positivamente, estos compuestos son buenos electrófilos. Se verá que gran parte de la química de los halogenuros de alquilo está determinada por su carácter electrófilo. NOMENCLATURA: Los haluros de alquilo se nombran como derivados halogenados de los hidrocarburos: PROPIEDADES FÍSICAS La mayoría de los compuestos orgánicos halogenados son líquidos insolubles a igual que los hidrocarburos de peso molecular comparable. Sin embargo, los átomos de halógeno representan una fracción muy importante del peso molecular que tiene influencia en las propiedades físicas, por ejemplo en el caso del yodo metano CH3I es un líquido comparado con el metano que es gas. Con la a excepción de los hidrocarburos mono clorados,, la mayoría de los compuestos orgánicos halogenados son más densos que el agua 31 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Los halogenuros de alquilo se forman por reacciones de sustitución de los alcanos y adición en los alquenos; los derivados clorados no son inflamables, son utilizados en los extintores contra incendios y lavado en seco de la ropa, son insolubles en agua y cuando el halogenuro ésta presente en más del 70% de su composición, son más densos que el agua. Algunos de ellos son utilizados como anestésicos y refrigerantes. 4.3. PARTE EXPERIMENTAL Experimento Nº 1.- Determinación de propiedades físicas La muestra a trabajar es el Cloroformo, con una búsqueda bibliográfica usted deberá consignar las siguientes propiedades físicas: Olor, Color y Estado físico. Solubilidad en Hexano • En un tubo de ensayo y añadir 0.5 mL de Cloroformo • Añadir en el tubo 0.5 mL de Hexano • Agitar las muestras • En la tabla proporcionada, registre si la muestra es soluble en Cloroformo Solubilidad en Agua • Obtener un tubo de ensayo y añadir 0,5 mL de Cloroformo • Añadir en el tubo 0,5 mL de agua • Agitar las muestras • En la tabla proporcionada, registrar si la muestra es soluble en Agua. Experimento Nº 2.- Obtención del CHI3 (yodoformo) • Añadir en un tubo de ensayo 1 mL de Etanol o propanona • Añadir al mismo tubo de ensayo 0,5 mL de yoduro de potasio al 10 % • Adicionar gota a gota solución de hipoclorito de sodio • Proceda a la agitación • Se formara un precipitado amarillo olor a hospital. • Observar la reacción y anotar los resultados en el apartado de observaciones. CH3 – CH2 – OH + KI + NaClO → CHI3 + HCOOK+ NaCl + KOH + H2O CH3 – CO – CH3 + KI + NaClO → CHI3 + CH3COOK + NaCl + KOH 32 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 4.4. REPORTE DE RESULTADOS Experimento Nº 1.- Determinación de propiedades físicas MUESTRA CLOROFORMO OLOR COLOR ESTADO FÍSICO SOLUBILIDAD EN AGUA Experimento Nº 2.- Obtención del CHI3 (yodoformo) Observar la reacción y anotar los resultados ¿Qué ha sucedido con la solución una vez una vez que se ha adicionado el hipoclorito de sodio? Realice Ud. el balanceo de la Obtención del CHI3 (yodoformo) 33 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRACTICA Nº 5 ALCOHOLES 5.1. OBJETIVOS • Comprobar experimentalmente las principales propiedades físicas y químicas de los alcoholes. • Mediante reacciones químicas diferenciar los alcoholes primarios, secundarios y terciarios 5.2. FUNDAMENTO TEÓRICO. Estructura. La estructura de un alcohol se asemeja a la del agua puesto que un alcohol procede de la sustitución formal de uno de los hidrógenos del agua por un grupo alquilo. Los alcoholes presentan el grupo funcional . En el metanol el ángulo del enlace C-O-H es de 108.9º. Este ángulo es mayor que en el agua debido a la presencia del grupo metilo, mucho más voluminoso que el átomo de hidrógeno, que contrarresta el efecto de compresión del ángulo de enlace que provocan los dos pares de electrones no enlazantes. Las longitudes de enlace O-H son aproximadamente las mismas en el agua que en los alcoholes, pero la distancia de enlace C-O es bastante mayor (1.4 Å) debido al mayor radio covalente del carbono en comparación con el del hidrógeno. En el siguiente diagrama de interacción orbitálica se representa la formación del enlace C-O en los alcoholes y las energías de enlace en el metanol: 34 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ NOMENCLATURA Para nombrar a los alcoholes se elige la cadena más larga que contenga el grupo hidroxilo (OH) y se numera dando al grupo hidroxilo el localizador más bajo posible. El nombre de la cadena principal se obtiene cambiando la terminación –o del alcano por –ol. Una manera de organizar la familia de los alcoholes es clasificar a los alcoholes en primarios, secundarios o terciarios de acuerdo con el tipo de átomos de carbono enlazados al grupo OH. En la siguiente tabla se indican las estructuras de los alcoholes según su grado de sustitución: 35 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PROPIEDADES FISICAS Los alcoholes pueden formar enlaces mediante puentes de hidrógeno, lo que causa que estos compuestos tengan puntos de ebullición más altos que los correspondientes halo alcanos. REACCIONES Las reacciones de los alcoholes son esencialmente de tres tipos: • Ruptura del enlace C - O Deshidratación de alquenos Síntesis de haluros orgánicos partir de alcoholes • Ruptura del enlace O - H Síntesis de éteres Esta reacción no conduce necesariamente al éter como producto mayoritario, puesto que existe competencia con la eliminación. 36 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ • Oxidación Alcohol primario Se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones Alcohol secundario Alcohol terciario No se oxida. FENOLES • Reacciones Las reacciones de los fenoles son de sustitución electrofílica aromática teniendo en cuenta que ya existe el sustituyente -OH 5.3. PARTE EXPERIMENTAL Experimento Nº 1.- Propiedades físicas Anotar las propiedades físicas que se detallan a continuación de alcoholes primarios, secundarios, terciarios: Estado físico, color, olor Anote sus observaciones. Experimento Nº 2.- Ensayo para diferenciar monoles de polioles • En dos tubos de ensayo colocar 0.5 ml de solución de sulfato de cobre y 0.5 ml de solución de hidróxido de sodio concentrado • Observar la formación de un precipitado, agitar • Al primer tubo agregar 0.5 ml de etanol y observar 37 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ • Al segundo tubo agregar unas gotas de glicerina, agitar • Anotar tus resultados Experimento Nº 3.- Acidez de los alcoholes • Colocar en tres tubos de ensayo por separado 0,5 ml de alcohol primario, secundario y terciario respectivamente. • Añadir una lenteja de sodio metálico previamente secado con papel. • Observar el gas desprendido • Compare el tiempo que demora en reaccionar en cada caso Experimento Nº 4.- Reacción de oxidación • Colocar en tres tubos de ensayo por separado 0,5 ml de alcohol primario, secundario y terciario respectivamente, • luego adicionar 0,5 ml de solución de dicromato de potasio al 10 % a cada tubo de ensayo y unas gotas de ácido sulfúrico diluido • Caliente ligeramente la mezcla si fuera necesario • Observe los cambios producidos. 6.4. REPORTE DE RESULTADOS Experimento Nº1: Anote sus observaciones. Experimento Nº 2: Ecuaciones de las reacciones Función que cumple el sulfato cúprico y Na(OH), con Monoles y polioles. 38 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº 3: Ecuaciones de las reacciones. ¿Qué gas se forma? Explicar Experimento Nº 4 ¿Qué función cumple el Dicromato de potasio? Complete las ecuaciones de las reacciones de los alcoholes 39 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 6 ALDEHIDOS Y CETONAS 6.1. OBJETIVO • Conocer algunos métodos sencillos para la obtención de compuestos orgánicos carbonílicos. • Comprobar experimentalmente las propiedades físicas de los compuestos carbonílicos • Comprobar experimentalmente las propiedades químicas: reacciones de oxidación, diferenciación, adición, coloración, etc. 6.2. FUNDAMENTO TEÓRICO El grupo funcional característico de los aldehídos y cetonas es el grupo carbonilo. Para los aldehídos, el carbono carbonilo siempre es un carbono terminal y se encuentra enlazado a un hidrógeno, mientras que en las cetonas nunca será un carbono terminal ya que debe estar enlazado a otros dos átomos de carbono La fórmula general condensada para un aldehído se abrevia como R – CHO y la de una cetona como R – CO – R’. Para nombrar los aldehídos, la “o” final del nombre del alcano respectivo se sustituye por el sufijo “al”. Para los miembros inferiores de la familia predomina el empleo de los nombres comunes como por ejemplo, Metanal o formaldehido, HCHO; etanal o acetaldehído, CH3 – CHO; propanal o propionaldehido, CH3 – CH2 – CHO; butanal o butiraldehido, CH3 – CH2 – CH2 – CHO; valeraldehido, CH3 – CH2 – CH2 – CH2 - CHO y benzaldehído, C6H5 – CHO Para nombrar las cetonas, la “o” final del nombre del alcano respectivo se sustituye por el sufijo “ona”. La acetona es la misma la propanona o 40 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ dimetilcetona, CH3 – CO – CH3; y la butanona es denominada también metiletilcetona, CH3 – CO – CH2 - CH3. La 2- Pentanona, CH3 – CO – CH2 – CH2 - CH3 y la 3-pentanona, CH3 – CH2 – CO – CH2 - CH3 son isómeros de posición. La metilfenilcetona o acetofenona y la difenilcetona o benzofenona son cetonas aromáticas porque alguno de los radicales hidrocarbonados enlazados al grupo carbonilo son grupos arilos. PROPIEDADES FISICAS DE ALDEHIDOS Y CETONAS Salvo el formaldehido que es un gas, casi todos los aldehídos son líquidos. Los miembros inferiores son de olor agradable, muchos otros se emplean en la fabricación de perfumes y sabores artificiales. El formaldehido y el acetaldehído son infinitamente solubles en agua, los homólogos superiores no son hidrosolubles. Los aldehídos son menos densos que el agua e incoloros. Las cetonas tienen propiedades casi idénticas a los aldehídos y se diferencian de estos por su suave olor PROPIEDADES QUIMICAS DE LOS ALDEHIDOS Y CETONAS Las reacciones químicas de los aldehídos y cetonas son función del grupo carbonilo. Por su mayor electronegatividad, el oxígeno atrae el par electrónico más hacia él alejándolo del carbono. En consecuencia, la distribución electrónica del enlace no resulta simétrica; el oxígeno es ligeramente negativo y el carbono ligeramente positivo. El grupo carbonilo puede representarse como dos formas resonantes, una neutra y otra con doble carga de la siguiente manera Al examinar los productos que se forman cuando los reactivos se adicionan al doble enlace carbono – oxígeno, el fragmento positivo del reactivo siempre se adiciona al oxígeno y el fragmento negativo se une al carbono OXIDACIÓN DE ALDEHIDOS Y CETONAS Los aldehídos oxidan fácilmente y se convierten en el ácido carboxílico respectivo, en contraste con las cetonas que son difíciles de oxidar, en presencia de los agentes oxidantes habituales de gran poder como el permanganato de potasio, dicromato de potasio y otros. 41 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ La reacción global de oxidación de un aldehído es la siguiente: Al añadirle la mezcla oxidante a una cetona se comprueba que no hay oxidación por no cambiar el color. Esta propiedad permite diferenciar un aldehído de una cetona, mediante la utilización de oxidantes relativamente débiles, como soluciones alcalinas de compuestos Cúpricos o argentosos que reciben el nombre de reactivos de Fehling, Benedict y Tollens. Reactivo de Fehling El reactivo de Fehling permite determinar la presencia de aldehídos en una muestra desconocida. Se prepara de tal manera que es una mezcla de color azul que al añadirla a una muestra desconocida oxida a los grupos aldehídos y como resultado positivo de la prueba se observa un precipitado de color rojo ladrillo de óxido cuproso. El reactivo de Fehling consta de dos soluciones A y B que se mezclan en partes iguales en el momento de usarse. La solución “A” es sulfato cúprico pentahidratado, mientras que la solución B es de tartrato sodio y potasio e hidróxido de sodio en agua. Cuando se mezclan las dos soluciones, se obtiene un complejo cúprico tartárico en medio alcalino, de color azul, de la siguiente manera: El color azul de la solución cúprica del Fehling desaparece con la presencia de un precipitado de color rojo ladrillo (el cobre se reduce de +2 a +1) y la oxidación del aldehído al correspondiente ácido carboxílico 42 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ Reactivo de Benedict La Prueba de Benedict tiene el mismo fundamento de la de Fehling y permite, por lo tanto, la determinación de aldehídos en una muestra desconocida. En este reactivo se emplea el citrato de sodio en reemplazo del tartrato sódico potásico y el complejo que se forma es de citrato sódico cúprico en un medio alcalino. La reacción de oxidación es la siguiente: Aldehídos y Cetonas Reactivo de Tollens Este reactivo contiene un ión complejo de plata amoniacal, que se reduce a plata metálica en presencia de aldehídos que son fácilmente oxidados. La plata se deposita y se observa como un espejo sobre las paredes del recipiente donde se realice la prueba. La reacción general es: 43 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Reactivo de Schiff El reactivo de Schiff es clorhidrato de p-rosa anilina que se decolora con ácido sulfuroso y reacciona con los aldehídos produciendo una coloración púrpura. Permite diferenciar aldehídos y cetonas Reacción del Haloformo El carácter ácido de los hidrógenos alfas se utiliza en la reacción del haloformo que es producida por las metilcetonas. Cuando tales compuestos se tratan con halógeno y base fuerte, se obtiene un compuesto trihalometano. Usando yodo como halógeno, el trihalometano formado es un precipitado amarillo de olor característico llamado yodoformo. Se conocen el cloroformo, bromoformo y yodoformo, de aquí el nombre de haloformo. Aldehídos y Cetonas importantes El formaldehido es un gas incoloro y de olor extremadamente irritante. Se disuelve en agua en soluciones del 37 al 40 % (Formol). Es germicida, astringente, antiséptico y fungicida. La conservación de cadáveres con formaldehido depende más de efecto antimicrobiano que el endurecimiento de los tejidos (se conjuga con las proteínas) El acetaldehído es un líquido incoloro, extremadamente volátil e importante en síntesis orgánica. El cloral es el tricloroacetaldehído, aceite inestable y desagradable por lo cual se introdujo en medicina en forma de hidrato de cloral, CCl3 – CH (OH)2. Se utiliza en la síntesis del DDT y es el más antiguo de los hipnóticos. Es muy irritante a la piel y a la mucosa El paraldehído es un compuesto cíclico que se forma por la adición nucleofílica de tres moléculas de acetaldehído. Es un líquido incoloro, de aroma fuerte y sabor urente desagradable. Es un hipnótico de acción rápida. Es eficaz en convulsiones experimentales y se ha empleado en el tratamiento urgente del tétano, eclampsia, epilepsia y envenenamiento por medicamentos Convulsionantes se ha empleado en el tratamiento urgente del tétano, eclampsia, 44 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ 6.3. .3. PARTE EXPERIMENTAL Experimento Nº 1.- Propiedades físicas Anotar las propiedades físicas indicadas a continuación de los aldehídos y cetonas en estudio: Estado físico, color y olor. Experimento Nº 2.- Obtención del etanal • Calentar un espiral de cobre hasta el rojo, luego introducirlo en un vaso que contiene etanol, percibir el olor que se desprende. • Hacer la reacción • Repetir la operación peración varias veces. • Guardar la solución para hacer su reconocimiento. Experimento Nº 3.- Propiedades Químicas Reacciones de Óxido – Reducción a) Reacción con el reactivo de Fehling: En un tubo de ensayo 0.25 0. ml de solución de Fehling A y 0.25 0. 5 ml de solución de Fehling B, homogenizar: añadir 0.5 ml de aldehído en estudio. Calentar suavemente en baño maría. Repetir el ensayo con una cetona. Anotar sus observaciones. 6.4. .4. REPORTE DE RESULTADOS Experimento Nº1: Anote sus observaciones. 45 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº 2: Escriba la reacción Experimento Nº 3: Anote las ecuaciones de la reacción con el reactivo de Fehling 46 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 7 ACIDOS CARBOXILICOS 7.1. OBJETIVOS • Estudio de las propiedades físicas y químicas de los ácidos carboxílicos • En base a este estudio el alumno estará capacitado para poder diferenciar un ácido carboxílico de los demás compuestos oxigenados 7.2. FUNDAMENTO TEÓRICO Ácidos carboxílicos y derivados. A los compuestos que contienen el grupo carboxilo (abreviado -COOH o CO2H) se les denomina ácidos carboxílicos. El grupo carboxilo es el origen de una serie de compuestos orgánicos entre los que se encuentran los haluros de ácido (RCOCl), los anhídridos de ácido (RCOOCOR), los ésteres (RCOOR´), y las amidas (RCONH2). 47 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ ESTRUCTURA Y NOMENCLATURA. El grupo carboxilo, -COOH, es formalmente una combinación de un grupo carbonilo y de un hidroxilo. Algunos ácidos alifáticos se conocen desde hace cientos de años y sus nombres comunes reflejan sus orígenes históricos. El ácido carboxílico más simple, el ácido fórmico, es el causante de la irritación causada por la picadura de las hormigas (del latín formica, hormiga). El ácido acético se aisló del vinagre, cuyo nombre en latín es acetum (agrio). El ácido propiónico se consideró como el primer ácido graso, y su nombre deriva del griego protos pion (primera grasa). El ácido butírico se obtiene por oxidación del butiraldehído, que se encuentra en la mantequilla (en latín butyrum). Los ácidos caproico, caprílico y cáprico se encuentran en las secreciones cutáneas de las cabras (caprien latín). En la tabla que se da a continuación aparecen los nombres comunes y los nombres UPAC de los ácidos carboxílicos simples 48 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ • Sales. Se sustituye la terminación - ico del ácido por la terminación -ato. En caso de que se haya utilizado el sufijo -carboxílico carboxílico para nombrar el ácido se sustituye por - carboxilato.. A continuación el nombre del metal correspondiente. PROPIEDADES Los compuestos carboxílicos que tengan enlaces O-H ó N-H H (pueden formar enlaces mediante puentes de H) tendrán un punto de ebullición más elevado que aquellos que no posean esos enlaces. La principal característica de los ácidos carboxílicos, como su propio nombre indica, es la acidez acidez. Por lo que forman sales con gran facilidad. facilidad 7.3. .3. PARTE EXPERIMENTAL Experimento Nº 1.- Propiedades Físicas Nombre Estado Color Físico Olor Solubilidad Solubilidad en agua en CHCl3 Experimento Nº 2.- Determinación del pH Humedecer la punta de la varilla de vidrio con el jugo de limón y colocar la muestra en el centro del papel pH. Humedecer el otro extremo de la varilla en el vinagre y colocarla en el centro de la otra sección del papel pH. 49 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Colocar la tableta de aspirina en el mortero y pulverizar con el pistilo. Utilizar una espátula para pasar una pequeña cantidad de polvo a un vidrio de reloj. Agregar unas gotas de agua destilada mezclar bien y determinar el pH. Experimento Nº 3.- Formación de sales y reconocimiento • En tres tubos de ensayo coloque, en el primero 15 gotas de ácido acético, al segundo adicionar acido oxálico y al tercer tubo ácido benzoico. • A los tres tubos agregar 2 mL de agua y observar. • A la muestra que sea insoluble pruebe de nuevo su solubilidad en 2 mL de Na(OH) al 10 %, homogenizar y observar lo que sucede. Experimento Nº 4.- Reacción del complejo Férrico • Colocar aproximadamente 20 mg (3 a 5 cristales) de la sustancia a analizar (ácido salicílico y aspirina) en un tubo de ensayo y disolverla en 2 mL de etanol. • Adicionar unas 2 gotas de solución acuosa de cloruro férrico al 3%, agitar vigorosamente. • Comparar el color de la solución con un tubo testigo al que solo se le debe agregar etanol y el cloruro férrico. • Anotar sus observaciones. Experimento Nº 5.- Saponificación • Colocar en un tubo de ensayo 1 mL de aceite vegetal y 3 mL de hidróxido de sodio al 20%. • Agitar enérgicamente y colocar el tubo al baño maría de 20 a 30 minutos. • Transcurrido este tiempo se puede observar en el tubo 3 capas: la inferior clara, que contiene la solución de sosa sobrante junto con la glicerina formada; la superior amarilla de aceite no utilizado, la intermedia de aspecto grumoso. Que es el jabón formado. 7.4. REPORTE DE RESULTADOS Experimento Nº 1.- Propiedades Físicas Nombre Estado Físico Color Olor Solubilidad Solubilidad en agua en CHCl3 50 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº2: Anote sus observaciones. MUESTRA pH Limón Vinagre Experimento Nº 3: Complete las ecuaciones de las reacciones Experimento Nº 4.- Reacción del complejo Férrico Para la prueba del complejo férrico indicar cuales compuestos dieron prueba positiva Experimento Nº 5.- Saponificación Explique 51 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 8 ACIDOS CARBOXILICOS: DERIVADOS DE ÁCIDOS 8.1. OBJETIVOS • Estudio de las propiedades físicas y químicas de los derivados de los ácidos carboxílicos • En base a este estudio el alumno estará capacitado para poder diferenciarlos derivados de ácido carboxílico de los demás compuestos oxigenados 8.2. FUNDAMENTO TEÓRICO Ácidos carboxílicos y derivados. A los compuestos que contienen el grupo carboxilo (abreviado -COOH o CO2H) se les denomina ácidos carboxílicos. El grupo carboxilo es el origen de una serie de compuestos orgánicos entre los que se encuentran los haluros de ácido (RCOCl), los anhídridos de ácido (RCOOCOR), los esteres (RCOOR’), y las amidas (RCONH2). Los esteres son compuestos orgánicos derivados de la reacción de ácidos orgánicos con un alcohol, o sus derivados como los cloruros de ácido con alcoholes o fenoles. Una de las reacciones más importantes de esteres es la hidrolisis alcalina o saponificación. Los anhídridos de ácido y los cloruros de ácido son derivados de los ácidos carboxílicos, algunas propiedades físico – químicas son similares a los ácidos carboxílicos y los esteres. Los ácidos carboxílicos y los derivados de ácidos carboxílicos son una clase de compuestos que se denominan en general Derivados de Acilo, R-CO-Y, donde el grupo acilo está unido a un sustituyente electronegativo -Y, que puede actuar como grupo saliente en diversas reacciones de sustitución. 52 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ Ácido carboxílico Halogenuro de ácido Anhídrido de ( X = F,Cl, Br, I) ácido Amida Nitrilo Éster Todos ellos pueden ser obtenidos de los respectivos ácidos carboxílicos, los cloruros de ácidos a su vez se pueden transformar en cualquier otro derivado de ácido y así con cada uno de ellos tal como se muestra a continuación en forma de esquema incluidos los nitrilos. Sus respectivas reacciones se mostraran en forma de resumen con un ejemplo, siguiendo la metodología expuesta para los otros grupos funcionales ya estudiados. 8.3. .3. PARTE EXPERIMENTAL Experimento Nº 1.- Reconocimiento de Esteres Solicite a los alumnos varios empaques que golosinas, gelatinas, etc. para procederá a identificar la presencia de los esteres y los usos correspondientes Experimento Nº 2.- Obtención de esteres alifáticos a) Salicilato de Etilo tilo:: En un tubo de ensayo colocar unos mg de ácido salicílico cílico y agregar o.5 ml de etanol, etanol, dos gotas de ácido sulfúrico concentrado, calentar suavemente añadir agua destilada y percibir el olor que se desprende. b) Acetato de Etilo:: En un tubo de ensayo colocar 0,5 mL de etanol y 0,5 mL de ácido etanoico, luego agregar dos gotas de ácido sulfúrico concentrado, agitar la muestra y calentar suavemente, añadir agua destilada y percibir el olor que se desprende. 53 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 8.4. REPORTE DE RESULTADOS Experimento Nº 1: Anote sus observaciones y conclusiones Experimento Nº 2: Complete las ecuaciones de las reacciones 54 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ PRÁCTICA Nº 9 AMINAS 9.1. OBJETIVOS • Conocer la función amina, estudiando sus características físicas más importantes. • Estudiar las propiedades físicas y químicas de las aminas relacionándolas con su estructura. • Realizar reacciones de diferenciación entre aminas primarias, secundarias y terciarias. .2. FUNDAMENTO TEÓRICO 9.2. Las aminas pueden considerarse como derivados del Amoníaco. Amoníaco NOMENCLATURA El método más extendido para nombrar las aminas es el radico funcional que consiste que consiste en tomar como base el radical más complejo y añadirle el sufijo -amina .Los otros radicales se nombran como sustituyentes sobre el nitrógeno. PROPIEDADES FISICAS Las aminas primarias y secundarias (pueden formar puentes de Hidrógeno) tienen puntos de ebullición más altos que las terciarias de igual peso molecular. Las aminas son compuestos eminentemente básicos. Las aminas son altamente polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno intramoleculares en el estado líquido y 55 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ por tanto tienen puntos de ebullición mayores que los alcanos de peso molecular equivalente. Una característica de las aminas de bajo peso molecular es su olor a pescado, que en cierta medida es distintivo. Metilamina, formando puentes de hidrógeno en el estado líquido BASICIDAD DE LAS AMINAS: AMI La basicidad y la nucleofilicidad de las aminas está dominada por el par de electrones no compartido del nitrógeno, debido a este par, las aminas son compuestos que se comportan como bases y nucleófilos, reaccionan con ácido para formar sales ácido/base, y reaccionan con electrófilos en muchas de las reacciones polares que se han estudiado anteriormente (Ej. Sustituciones Nucleófilicas). Sales de aminas: (sales de amonio) La basicidad de las aminas permite su protonación o alquilación, lo que da lugar a las sales de amonio. Dependiendo del número de sustituyentes que tenga el nitrógeno, las sales pueden ser primarias, secundarias o cuaternarias. La diferencia en el comportamiento de las aminas aminas y sus sales, en cuanto a solubilidad, puede utilizarse tanto para detectar aminas, como para 56 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ separarlas de sustancias no básicas. Un compuesto orgánico insoluble en agua que se disuelve en ácido clorhídrico acuoso, diluido, debe ser apreciablemente básico, lo que significa que, de seguro, se trata de una amina. Esta puede separarse de compuestos no básicos por su solubilidad en ácidos; una vez separada, puede regenerarse alcalinizando la solución acuosa. 9.3. PARTE EXPERIMENTAL Experimento Nº 1.- Determinación de propiedades físicas Determinar las siguientes propiedades físicas de una amina primaria, secundaria y terciaria: Estado físico, color y olor. Determinación de propiedades Químicas Experimento Nº 2.- Reacción con el FeCl3 • En un tubo de ensayo añadir 0,5 mL de solución de cloruro férrico • Posteriormente añadir la amina problema hasta que aparezca un precipitado. 9.4. REPORTE DE RESULTADOS Experimento Nº 1: Anote sus observaciones Experimento Nº 2: Complete la ecuación de la muestra asignada 57 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ PRÁCTICA Nº 10 AMIDAS 10.1. OBJETIVOS: • Conocer la síntesis de amidas simples • Estudiar experimentalmente las propiedades físicas y químicas de las amidas 10.2. .2. FUNDAMENTO TEÓRICO Las amidas con un grupo -NH2 no sustituido se denominan eliminando la palabra ácido y reemplazando la terminación –ico por -amida amida o la terminación carboxílico por carboxamida. REACCIONES DE LAS AMIDAS: AM Las amidas son mucho menos reactivas que cloruros de ácido, anhídridos de ácido o esteres.. Por tanto, el enlace amida sirve rve como la unidad básica a partir de la cual se forman todas las proteínas. Las amidas sufren hidrólisis para formar ácidos carboxílicos más aminas cuando se calientan con ácidos o bases en solución acuosa. Las condiciones que se requieren para la hidrólisis hidrólisis de amidas son más drásticas que para la hidrólisis de cloruros de ácido o ésteres, pero los mecanismos son similares. Ejemplos: (a) Hidrólisis ácida 58 Manual de Prácticas de Química II Ingeni Ingeniería Industrial _________________________________________________________________________ ____________________________________________________________________________________ (b) Hidrólisis básica 10.3. PROCEDIMIENTO EXPERIMENTAL Experimento Nº 1.- Determinación de propiedades físicas Determinar las propiedades físicas de las amidas continuación se detallan: Estado físico, color y olor (con cuidado) Experimento Nº 2.- Hidrólisis alcalina • En un tubo de ensayo coloque 1 punta de espátula de amida (si es sólida) o 10 gotas tas (si es líquido). • Agregue 3 ml de Na((OH) al 10% • Coloque en la boca del tubo una tira de papel filtro humedecido con HCl 3,0 M. • Caliente a baño maría por 3 minutos. • El desprendimiento de humos blancos, alrededor del papel, indicará la presencia de amidas Experimento Nº 3.- Hidrólisis acida • En un tubo de ensayo coloque 0,1g de la amida (si es sólida) o 10 gotas (si es líquido). • Agregue 1 mL de H2SO4 al 10% volumen • Calentar a baño maría por 3 minutos. • Luego percibir el olor y agregarle 1 mL de etanol y calentarlo con mechero de por espacio de medio minuto • Al producto final agregarlo a una capsula de porcelana o una luna de reloj que contenga NaHCO3 al 20 % peso; este reaccionara con el exceso de ácido y percibiremos el olor característico de un éster, muy fragante 59 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº 4.- Formación del oxalato de urea • En un tubo de ensayo disolver 0.5 g de urea en 2 ml de agua destilada y adicionar 0.6 g de ácido oxálico en 7 ml de agua destilada. • Agitar enérgicamente y observar los cristales formados. Experimento Nº 5.-Ensayo de amidas y enlaces peptídicos Reactivo de Biuret: Este reactivo está constituido por dos disoluciones: una de sulfato de cobre 0.01M y otra de Na(OH) al 40%. • En un tubo de ensayo se pone una pequeña cantidad de urea sólida y se calienta suavemente en una placa de calefacción hasta fundirla. De esta forma se habrá formado el compuesto llamado biuret (H2NCONHCONH2) derivado de la pérdida de amoniaco de dos moléculas de urea. • A continuación, adicionar 1 mL de agua hasta lograr su disolución y después 2mL de disolución de Na(OH) y unas gotas de la disolución de sulfato de cobre. • Se mezcla bien debiendo aparecer una coloración rojo-violeta indicativa de la presencia del complejo de Cu (II) correspondiente. Este ensayo lo dan también positivo los péptidos y proteínas, compuestos que contienen el enlace peptídico. 10.4. REPORTE DE RESULTADOS Experimento Nº1: Anote sus observaciones y conclusiones Experimento Nº 2: Complete las ecuaciones de las reacciones 60 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº 3: Complete las ecuaciones de las reacciones Experimento Nº 4: Anote sus observaciones y conclusiones Experimento Nº 5: Anote sus observaciones y conclusiones 61 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 11 CARBOHIDRATOS; MONOSACÁRIDOS, DISACÁRIDOS Y POLISACARIDOS 11.1. OBJETIVOS: • Estudio experimental de las principales reacciones de caracterización de los representantes más conocidos de los glúcidos. • Dada una muestra de glúcido, el alumno será capaz de determinar si se trata de aldosa o una cetosa, si el glúcido es un reductor o no, de un monosacárido, disacárido o polisacárido. 11.2. FUNDAMENTO TEÓRICO Se denomina carbohidratos o glúcidos a los derivados aldehídicos o cetónicos polihidroxilados o sus productos de condensación. Según la cantidad de azúcares que se obtienen por hidrólisis, los carbohidratos se pueden clasificar en: Polisacáridos (celulosa, almidón); trisacáridos (rafinosa), disacáridos (sacarosa, maltosa, lactosa) y monosacáridos estos últimos pueden ser aldosas o cetosas. Según el número de átomos de carbono estos pueden ser: aldohexosas (glucosa, galactosa, manosa); cetohexosas (fructuosa); pentosas (arabinosa, xilosa. Ribosa, desoxirribosa, xilosa); tetrosas (treosas, eritrosa); triosa (gliceraldehído). Cuando el almidón se hidroliza por acción enzimática o por ácidos se rompe en una serie de compuestos intermedios. Una reacción característica del almidón es la formación de un color azulado con yodo Debido a la estructura helicoidal de la amilosa, esta prueba se utiliza muchas veces para vigilar la hidrólisis del almidón, pues el color cambia de azul a rojo y luego desaparece a medida que va disminuyendo la masa molecular (formando azúcares reductores). Etapas de hidrólisis del almidón: PROPIEDADES FÍSICAS Los carbohidratos son solubles en el agua debido a la presencia numerosa del grupo OH que le permite formar enlaces puente de hidrógenos. Presentan actividad óptica debido 62 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ a la presencia de carbonos asimétricos es decir que desvía el plano de la luz polarizada, pueden ser dextro rotatorio o levo rotatorios. Los carbohidratos en estado sólidos presentan estructura abierta o de Fisher, en solución acuosa presentan estructuras cerradas de Haworth. Se tiene una secuencia que permite hacer el reconocimiento y diferenciación de carbohidratos Ensayo de Molisch: Este ensayo es un ensayo para reconocimiento general de carbohidratos en el que los polisacáridos y disacáridos se hidrolizan con ácido sulfúrico concentrado hasta monosacáridos y se convierten en derivados del furfural o 5-hidroximetilfurfural los cuales reaccionan con á-naftol formando un color púrpura violeta. Ensayo de Benedict: El ensayo de Benedict permite el reconocimiento de carbohidratos reductores, al igual que el reactivo de Fehling, el de Benedict contiene Ion cúprico en medio alcalino que se reduce hasta óxido cuproso en presencia de azúcares con el hidroxilo hemiacetálico libre. Ensayo de Barfoed: Esta prueba permite diferenciar entre monosacáridos y disacáridos reductores, también contiene ión cúprico óxido cuproso más que se reduce hasta rápidamente con los monosacáridos que con los disacáridos. Ensayo con Lugol: El reactivo de Lugol que contiene una mezcla de yodo y yoduro, permite reconocer polisacáridos, particularmente el almidón por la formación de una coloración azul violeta intensa y el glicógeno y las dextrinas por formación de coloración roja. 63 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Ensayo de Seliwanoff: Este ensayo es específico para cetosas y se basa en la conversión de la cetosa en 5-hidro-metil-furfural y su posterior condensación con resorcinol formando así complejos coloreados. Ensayo de Bial: El reactivo de Bial contiene orcinol en ácido clorhídrico, el cual forma complejos de coloración sólo con las pentosas. De otro lado carbohidratos, particularmente una propiedad y Determinar importante el grado que de permite pureza de identificar los los mismos, monosacáridos es la rotación óptica ocasionada por la presencia de centros asimétricos o quirales en la estructura molecular, los cuales desvían el plano de luz polarizada. Esta propiedad no es exclusiva de los carbohidratos pues la presentan todas aquellas sustancias denominadas óptimamente activas, por tener en su estructura centros quirales. Para la medición de la rotación óptica los factores importantes a tener en cuenta son: La longitud de onda de luz polarizada, la cantidad de material óptimamente activo, y la naturaleza del Solvente cuando se usa. Los cambios en la temperatura ocasionan solo pequeñas variaciones en las medidas de la rotación. 11.3. PARTE EXPERIMENTAL Experimento Nº 1.- Reacción específica. Glúcidos reductores Muestras: glucosa y fructuosa a) Reacción con el Reactivo de Fehling Esta prueba se utiliza para el reconocimiento de azúcares reductores. El poder reductor que pueden presentar los azúcares proviene de su grupo carbonilo, que puede ser oxidado a grupo Carboxilo con agentes oxidantes suaves. Si el grupo carbonilo se encuentra combinado no puede presentar este poder reductor. Los azúcares reductores, en medio alcalino, son capaces de reducir el ión Cu2+ de color azul a Cu+ de color rojo. Para ello el grupo carbonilo del azúcar se oxida a grupo carboxilo. En medio fuertemente básico como en nuestro caso el Na(OH) el ión Cu2+ formaría Cu (OH)2 insoluble por eso añadimos tartrato sódico Potásico que actúa como estabilizador al formar un complejo con el Cu2+. 64 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ POLISACARIDOS Experimento Nº 2.- Acción del yodo Colocar unos 0.5 ml de solución de almidón en un tubo de ensayo, luego adicionar unas dos gotas del reactivo de lugol (I2 en KI). Observar el Cambio de coloración y luego calentar el tubo de ensayo hasta que se ponga incoloro. Enfrié el tubo sumergiéndolo en agua fría. Observe y Anote sus resultados. Experimento Nº 3: • Coloque un poco de algodón en tres tubos de ensayo y añada 3 mL de agua al primero, 3 mL de acetona al segundo y 3 mL de hexano al tercero • Observe y explique sus resultados Experimento Nº 4.- Hidrólisis de la sacarosa • Tres tubos de ensayo conteniendo cada uno 5 mL de solución de sacarosa al 5 % se colocan en un vaso de precipitados de 100 mL con agua caliente. • Seguidamente se le añade 5 mL de agua al primer tubo, 5 mL de ácido clorhídrico al 10 % al segundo tubo y 5 mL de solución de hidróxido de sodio al 10 % al tercer tubo de ensayo. • Se proceden a calentar los tres tubos durante cinco minutos después se ensaya una porción de 1 mL de cada uno de ellos con el reactivo de Fehling. • Observe y explique sus resultados. 11.4. REPORTE DE RESULTADOS Experimento Nº1: Complete las ecuaciones de las reacciones 65 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº 2: Anote sus observaciones y conclusiones ESTRUCTURA HELICOIDAL DE LA AMILOSA ETAPA Observación de: ESTRUCTURA HELICOIDAL Color/ incoloro presente /ausente 1 mL de Almidón + 4 gotas de lugol Después de calentar Después de enfriar Experimento Nº 3: Observe y explique sus resultados. Experimento Nº 4: Observe y explique sus resultados. Explique por qué después de la hidrólisis de la sacarosa con HCl da positiva la prueba de Fehling. 66 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 12 AMINOÁCIDOS Y PROTEINAS 12.1. OBJETIVOS: • Identifique los aminoácidos mediante el ensayo de Ninhidrina y colorimétricas. • Precipite las proteínas mediante diversos procedimientos fisicoquímicos. • Identifique cualitativamente la presencia de proteínas mediante la reacción del Biuret. 12.2. FUNDAMENTO TEÓRICO El término aminoácido puede aplicarse a cualquier sustancia en cuya estructura molecular existan al menos un grupo amino y un grupo carboxílico. Las reacciones de los aminoácidos son las que en general corresponden a compuestos que presenta grupo amino y carboxilo. Además todo grupo adicional que pudiera estar presente dará su propio conjunto de reacciones. Las proteínas son biopolímeros formados por combinación de los alfa aminoácidos, también se les conoce como polipéptidos. Un péptido es una amida formada por dos o más aminoácidos. El enlace de amida entre un grupo amino de un aminoácido y el grupo carboxilo de otro aminoácido se llama enlace peptídico. Las proteínas son sustancias anfóteras, combinándose tanto con ácidos como bases, dando sales ionizables. Algunas son coaguladas por el calor, etanol y ácidos. Las proteínas son uno de los componentes más importantes de los seres vivos, y cumplen numerosas funciones: estructurales, enzimáticas, transportadoras, reguladoras. Cuando la sangre se coagula, la trama de fibrina atrapa las células y se retrae; si centrifugamos, obtenemos un sobrenadante al que llamamos suero (Igual al plasma salvo en que no contiene factores de coagulación ni fibrinógeno). total de proteínas en suero varía de una especie a La concentración otra, e incluso en un mismo individuo en caso de enfermedad. Por Ejemplo: en las hemorragias, la concentración de proteínas plasmáticas está disminuida, sin embargo, en quemaduras y diversas enfermedades del tracto gastrointestinal, podemos encontrar una elevación de la concentración, al igual que en la deshidratación severa o en la diabetes insípida. Otro ejemplo lo constituye la elevación de la concentración de inmunoglobulinas en el mieloma, cirrosis, lupus erimatoso sistémico etc. 67 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Una de las pruebas de reconocimiento de proteínas es la reacción de Biuret. Las proteínas en presencia de Cu2+ dan complejos coloreados azul-violáceos. El color depende del número de enlaces peptídico de la molécula proteica. Si no existen enlaces peptídicos (por ejemplo, una disolución de aminoácidos) la reacción no produce una solución coloreada 12.3. PARTE EXPERIMENTAL Experimento Nº 1.- Propiedades físicas Anotar las propiedades físicas indicadas a continuación de los aminoácidos en estudio: Estado físico, color y olor. Propiedades Químicas Experimento Nº 2.- Naturaleza anfótera de las proteínas • Preparar cuatro tubos de prueba con lo siguiente: • Primer tubo: Una gota de HCl 0,1M + 1 gota de anaranjado de metilo + 2ml de agua. • Segundo tubo: Una gota de HCl 0,1M + 1 gota de anaranjado de metilo + 2ml de agua. • Tercer tubo: Una gota de Na(OH) 0,1M + 1 gota de fenolftaleína + 2ml de agua. • Cuarto tubo: Una gota de Na(OH) 0,1M + 1 gota de fenolftaleína + 2ml de agua. • Añadimos al primer y al tercer tubo 3 ml de albúmina, agitar y observar. • Al segundo y cuarto tubo adicionar 3 ml de agua, agitar y observar • Explicar los resultados observados Experimento Nº 3.- Reacción con la Ninhidrina • Colocar en un tubo de ensayo 0.5 ml de solución de aminoácido • Agregar 2 gotas de Ninhidrina • Calentar, observar la coloración del producto formado Experimento Nº 4.- Reacciones de precipitación y coagulación • Tome cinco tubos de ensayo y márquelos con las letras A, B, C , D y E cada una de ellas ponga 1 ml de albúmina y se añade 200 mg de NaCl • A cada uno de los tubos agregue a) 5 ml agua fría b) 5 ml de solución de Na(OH) al 25% 68 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ c) 3 ml Etanol d) 3 ml de solución de Pb(NO3)2. e) 2 mL acetona Los tubos se agitan y se dejan en reposo en un baño de hielo-agua. Hacer las observaciones pertinentes después de 5 min. En los tubos donde aparezca un precipitado, decantar y dejar la proteína en el tubo, añadir 2 mL de agua destilada, agitar y observar si la proteína se re disuelve o no. Experimento Nº 5.- Reacciones para aminoácidos con azufre. • En dos tubos de ensayo se vierten 2 mL de las disoluciones de glicina, y clara de huevo. • A cada uno de los tubos se le añaden 0.5 mL de la disolución saturada de Na(OH), se calienta a ebullición. • Después se enfría y se agrega 2 gotas de la disolución de Pb(NO3)2. • Observe la aparición o no de PbS (precipitado negro). 12.4. REPORTE DE RESULTADOS Experimento Nº 1: Anote sus observaciones y conclusiones Experimento N° 2: Anote sus observaciones 69 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Experimento Nº 3: Anote sus observaciones y conclusiones Experimento Nº 4: Anote sus observaciones y conclusiones Experimento Nº 5: Anote sus observaciones y conclusiones 70 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 13 POLÍMEROS 13.1. OBJETIVOS: • Identificar las seis clases más importantes de polímeros termoplásticos por medio de la medición de sus propiedades físicas y químicas. • Entender la importancia de la identificación de materiales plásticos para su utilización a nivel industrial y reciclado. • Conocer las propiedades físicas y químicas de los termoplásticos utilizados en la práctica, así como los métodos de identificación. 13.2 .FUNDAMENTO TEÓRICO La definición más simple de un polímero es la repetición de muchas unidades pequeñas, generalmente hidrocarburos; un polímero es como una cadena en la que cada unión es una unidad básica, hecha de carbono, hidrógeno, oxígeno, y/o silicio. Algunos polímeros son sustancias naturales de origen vegetal y animal. Esto incluye cuernos de animales, carey de tortuga, secreciones de un insecto asiático, la colofonia de la savia de árboles del pino, ámbar que es la resina fosilizada de árboles y alquitrán obtenido de la destilación de materiales orgánicos como madera. Pero debido a su difícil recolección, recuperación y purificación, la búsqueda de polímeros sintéticos era el paso natural a seguir. En el siglo XIX ocurrió el primer desarrollo, al procesar polímeros naturales o combinarlos con químicos para hacer sustancias útiles. Estos polímeros se llamaron “Polímeros naturales modificados" o "Polímeros semi-sintéticos”. El primero y más famoso de éstos es el caucho vulcanizado. En 1839, Charles Goodyear descubrió, después de años de experimentación, que la savia del árbol del hevea (látex) podría calentarse con el azufre para alterar las propiedades físicas del látex permanentemente, evitando sus limitaciones naturales, pues este era quebradizo en el frío y se fundía a altas temperaturas. Identificación de plásticos Los materiales termoplásticos pueden ser reutilizados mediante diferentes procesos de reciclaje, para los cuales, el paso más importante lo constituye la clasificación de los materiales. Las pruebas de laboratorio pueden servir para determinar los componentes de un material desconocido. Algunos métodos de pruebas muy sencillas se muestran a continuación con el fin de dar las 71 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ pautas necesarias para identificar fácilmente los tipos básicos de polímeros termoplásticos. Las resinas de polímeros pueden identificarse por las siguientes pruebas fundamentales: • Marca normalizada • Aspecto físico • Efectos de calor • Prueba Belstein • Solubilidad • Densidad relativa Marca normalizada: La Sociedad de la Industria de Plástico s (SPI) introdujo el código para la identificación de las resinas en 1988 en el afán de reciclar y dejar de contribuir a la contaminación y así establecer un sistema uniforme para todo Estados Unidos. Este código, identifica los termoplásticos del 1 al 7 dentro de un triángulo de flechas, como se muestra en la Tabla No 3, refiriéndose a cada plástico con propiedades y aplicaciones específicas. Los códigos son moldeados o impresos sobre el fondo de la mayoría de contenedores plásticos, sin embargo, para la clasificación a gran escala, la identificación visual no es lo suficientemente práctica. Aspecto físico: El aspecto físico o visual puede dar una pista para identificar los materiales plásticos. Es más difícil identificar los plásticos como materia prima sin mezclar, o en pellets, que los productos acabados. Los termoplásticos se producen generalmente en forma de pellets, granulados. Los materiales termoestables se suelen obtener como polvos o resinas. De las resinas termoplásticas más comunes, el polietileno tereftalato (PET) y polipropileno (PP) tienen una textura translúcida, cerosa. Los métodos de fabricación y aplicación del producto también describen un plástico. Habitualmente, los materiales termoplásticos se extruyen o se someten a conformado por inyección, calandrado, moldeo por soplado y moldeo al vacío. El polietileno, el poliestireno y los celulósicos se suelen emplear en la industria de recipientes y envasados. Las sustancias como polietileno, politetrafluoretileno, poliacetales y poliamidas tienen un tacto ceroso característico. Los plásticos termo endurecibles se suelen moldear por compresión (por trasferencia). 72 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ Efectos del calor: Cuando se calientan muestras de plástico en tubos de ensayo, se pueden identificar los olores característicos de determinados plásticos. La manera particular de quemarse puede dar una pista al respecto. El PET se quema rápidamente, y expide olores a parafina y cuando se extingue la llama, produce un humo blanco. El polietileno se consume con una llama azul trasparente y gotea al fundirse. El cloruro de Polivinilo (PVC) puede encenderse pero él mismo se extinguirá en cuanto la fuente de fuego esté alejada. El PVC tiene un olor muy agrio al quemar porque el cloruro de hidrógeno es un derivado ardiente. El PP, por otro lado, se consume más lentamente, los gases alimentan la llama. El Poliestireno (PS) y sus copolímeros desprenden humo negro (carbono), se quema rápidamente, tiene un olor de gas fuerte, y produce grandes cantidades de hollín. El punto de fusión real es otro elemento identificador. Los materiales termo estables no se funden. Algunos termoplásticos en cambio, funden a menos de 195ºC. También se puede presionar sobre la superficie de un plástico con un soplete de soldadura eléctrico. Si el material se ablanda y la punta caliente se hunde, será un termoplástico. Si sigue duro y se carboniza simplemente se tratara de un termoestable. Prueba de beilstein: La prueba de Beilstein es un método simple para determinar la presencia de un halógeno (cloro, flúor, bromo y yodo). Para esta prueba hay que calentar un alambre de cobre limpio en una llama de Bunsen hasta que se ponga incandescente. Después se pone en contacto rápidamente el alambre caliente con la muestra de ensayo y se retorna el alambre a la llama. Una llama verde demuestra la presencia de halógeno. Los plásticos que contienen cloro como ya se había dicho anteriormente son policlorotrifluoretileno, PVC, policloruro de vinilideno y otros, que dan positivo en el ensayo de halógeno. Si la prueba es negativa, es posible que el polímero esté compuesto solamente de carbono, hidrógeno, oxigeno o silicio. Solubilidad: Las pruebas para determinar la solubilidad o insolubilidad de los plásticos son métodos sencillos de identificación. Con la excepción de las poliolefinas, los acetales, las poliamidas y los fluorplásticos, se puede considerar que todos los materiales termoplásticos son solubles a temperatura ambiente, el PET por ejemplo es impenetrable a los solventes 73 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ químicos mientras el PP se disuelve en tolueno caliente. Los termoestables por su parte, son resistentes a los disolventes. Densidad relativa: La clasificación por densidad con un sistema de flotación se realiza comparando las densidades del material plástico y sustancias líquidas de densidad conocida. Si un plástico flota en una solución con una densidad de 0,94 g/cm³, puede ser un plástico de polietileno de densidad media o baja. Si la muestra flota en una solución de 0,92 g/cm³, puede tratarse de un polietileno de baja densidad o polipropileno. Si se hunde en todas las soluciones por debajo de una densidad de 2,00 g/cm³, la muestra será un plástico de fluorcarbono. La presencia de cargas u otros aditivos y el grado de polimerización pueden dificultar la identificación de los plásticos por la densidad relativa, pues pueden hacer que cambie bastante la densidad de un plástico. Poliolefinas, iónomeros y poliestirenos de baja densidad flotarán en el agua (que tiene una densidad de 1,00 g/cm³) 13.3. PARTE EXPERIMENTAL Traer diferentes polímeros. Cuatro recipientes. Cuatro tipos de soluciones líquidas: Agua destilada Alcohol isopropil 70%, Aceite Vegetal y Glicerina Experimento Nº1: • Realizar una observación visual a cada uno de los pedazos de los seis diferentes tipos de termoplástico, determinando características como transparencia u opacidad, color, forma del grano, etc. y registrar dichas observaciones en la Tabla. • Seleccionar y preparar los líquidos que se utilizarán en la prueba y los polímeros necesarios, identificarlos mediante letras (A, B, C, D, etc.). • Verter los líquidos en cada uno de los cuatro recipientes (un líquido por cada recipiente) y depositar los pedazos de polímeros. Disponiendo de todos los elementos de seguridad personal establecidos. • Observar el comportamiento de las muestras en cada uno de los líquidos, es decir, si flota o no en las sustancias donde ha sido sumergido. • Registrar en la Tabla, especificando si cada muestra flota o no en cada una de las sustancias. 74 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ 13.4. REPORTE DE RESULTADOS Anote sus observaciones y conclusiones Observaciones Flota O No flota Físicas. Tipo de (Transparencia, polímero opacidad, Nombre Agua Alcohol Aceite vegetal Glicerina del polímero color, etc.) A B C D E F 13.5. CUESTIONARIO 1. Su bote está hundiéndose a 2 Km de la playa y usted no es un buen nadador. Se da cuenta que hay seis bloques grandes de plástico marcados con los números 1, 2, 3, 4,5, 6 (los mismos utilizados en la práctica). ¿Cuál de éstos agarraría? ¿Por qué? 2. Se desea fabricar una manija plástica para un sartén de cocina. ¿Qué plástico se debería evitar? 3. Usted decide cambiar el envase de vidrio del removedor de uñas por uno más económico de plástico. Al siguiente día de haber realizado el cambio, toma la botella y se encuentra que esta se desintegro parcialmente. ¿Qué plástico fue usado en esta botella? ¿Cuál es el ingrediente reactivo del removedor de uñas? 4. Algunas veces los contenedores plásticos son hechos al mezclar dos polímeros y no solo uno. ¿Qué ocurriría con la prueba de densidad del agua si se mezclan LDPE/PEBD y PP? ¿Y si PET y HDPE/PEAD se mezclan? 75 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ BIBLIOGRAFÍA 1. Morrison r. y Boyd r.Química Orgánica Fondo Educativo Interamericano. S.A. Quinta Edición, 1990 2. Wade L. G. Química Orgánica Editorial Prentice Hall 3. Fessenden r. and Fessenden J. Techniques and experiment for Organic Chemistry. Willard Press, Boston, 1983 4. Domínguez x. y.Domínguez S. X. Química Orgânica Experimental. Editorial Limusa. México, 1982 5. Gibaja Oviedo s. Guía para El análisis de los Compuestos Del Carbono. Editorial UNMSM. Lima, 1977 6. Holum, John, fundamentos de química general, orgánica y bioquímica. 1era. Ed. 2000, Limusa Wiley. 7. Baum, S. introducción a la química orgánica y biológica. 2a. Ed. México, CECSA. 1989. 76 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PROGRAMA PROFESIONAL DE INGENIERÍA INDUSTRIAL MANUAL DE PRÁCTICAS QUÍMICA II CONTROLES 77 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 1 HIBRIDACIONES DE LOS ÁTOMOS DE LA QUÍMICA ORGÁNICA Y SUS FORMAS GEOMÉTRICAS 1. ¿En qué consiste la teoría del Vitalismo? ¿Qué es densidad electrónica? 2. Dibuje una representación tridimensional de cada uno de los compuestos siguientes, que ilustre la estabilización hiperconjugativa del doble enlace: a)1- buteno b) trans – 2 – buteno c) 2,3 – dimetil – 2 - buteno 3. Explique la regla de Hückel 4. ¿Qué son configuraciones R y S? Ejemplos. 5. Explique las hibridaciones sp3, sp2 y sp del átomo de carbono graficando cada caso con ejemplos. 6. ¿Cuál es la hibridación del átomo de oxígeno en el agua? Represente su estructura tridimensional y explique por qué el ángulo de enlace es de 104,5°. 7. Prediga la hibridación, la geometría y los ángulos de enlace del carbono en el eteno CH2=CH2. 8. ¿Qué diferencias existen entre enlaces sigma y enlaces pi? 9. Definir: Carbono quiral, Luz polarizada, Rotación específica, configuración y conformación. 10. Use la representación del caballete para dibujar la disposición tridimensional en la cual se alcanza la estabilización óptima por hiperconjugación para cada compuesto: a) Propeno b) 2 – metil – 1 – buteno c) 1 - penteno 78 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 2 ANÀLISIS INMEDIATO 1. ¿Qué se entiende por proceso químico? ¿Cómo se clasifican los procesos químicos? 2. ¿Cuál es el fundamento de la determinación cualitativa del fósforo? 3. ¿Qué es punto de ebullición normal? ¿Qué métodos se emplean para su determinación? 4. Por análisis elemental cuantitativo de un compuesto desconocido, se encontró que contenía 40,0% de C; 6,67% de H y 53,33% de O. Calcular su fórmula empírica y su fórmula molecular, si se sabe que su peso molecular es de 60 uma. 5. ¿Cuál es el fundamento de la determinación cualitativa de los halógenos? 6. Explique: ¿Cómo podría separar una mezcla de azúcar-etanol-ácido acético? 7. ¿Qué es cromatografía? ¿Qué tipos de métodos cromatográficos se conocen? 8. Grafique la estructura de la fructosa señalando sus carbonos quirales. 79 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 3 HIDROCARBUROS ALIFATICOS 1. Hacer un resumen presentando los métodos de obtención de alcanos, alquenos y alquinos (industriales y de laboratorio). 2. Describir los procesos de polimerización de alquenos y dienos conjugados, proporcionando los productos que se originan y su relación con los polímeros naturales semejantes. 3. Grafique todos los isómeros posibles monoyodados derivados del heptano. 4. ¿Qué son conformómeros? ¿Cómo se obtienen? 5. Grafique los conformómeros del butano. 6. Explique: ¿Qué son reacciones de sustitución electrofílica? 7. ¿Qué producto se obtiene en la cloración del but-1-ino? 8. Efectúe la reacción de formación del acetiluro de cubre (II). 9. ¿Cuántas moles de oxígeno se requieren para la combustión completa de 5 moles de 1-penteno? 80 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 4 HALOGENUROS DE ALQUILO 1. Explique claramente las propiedades físicas y químicas de los halogenuros de alquilo. 2. Explique claramente la técnica de la obtención de un halogenuro de alquilo a partir de un alcano y cloro gaseoso con su reacción química. 3. Explique claramente la técnica de la obtención de cloruro de etilo a partir del alcohol etílico y HCl con su reacción química. 4. Explique claramente los usos de los halogenuros de alquilo. 5. Explique qué es freón 12 y para que se utiliza. 6. Cuál es el componente refrigerante de la heladera 7. Explique cómo se identifica la presencia de un halogenuro de alquilo 8. ¿Cuáles son los haluros de alquilo en el cuerpo humano? 81 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRACTICA Nº 5 ALCOHOLES 1. ¿Cuál es el uso del alcohol metílico? 2. ¿Cuál es el uso del alcohol etílico? 3. ¿Por qué se les llama alcoholes primarios? 4. ¿Cuáles son las características de los alcoholes secundarios? 5. ¿Qué características tienen los alcoholes terciarios? 6. ¿Se puede usar el etanol como combustible en los vehículos? Justifique su respuesta 7. Explique Ud. En qué consiste el Dosaje Etílico 8. Explique brevemente la fermentación alcohólica y acética 9. ¿Qué efectos nocivos produce el metanol en la salud? 82 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 6 ALDEHIDOS Y CETONAS 1. Que reacciones de las realizadas en el laboratorio nos permiten diferenciar aldehídos de las cetonas. 2. Mediante que reacción a nivel de laboratorio se puede detectar en un ser humano acetona en la orina. 3. ¿Cuáles de las moléculas siguientes dan una prueba de yodoformo positiva? a) 3 – pentanona b) 2 – pentanona c) Pentanal d) Acetofenona e) Acido acético 4. ¿Por qué cree que la acetona (propanona) vuelve amarillentas y quebradizas las uñas y como podría evitarse? 5. Escriba la estructura que corresponda a cada uno de los nombres IUPAC siguientes: a) (S) – 2 – metilciclohexanona b) 4 – nitrobenzaldehido c) (R) – 2 - metilpentanal 6. Haga la reacción de oxidación con KMn04 en medio ácido de: a) La pentanal b) La pent-2-ona 83 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 7 ACIDOS CARBOXILICOS 1. Que son ácidos carboxílicos y diga el nombre del grupo funcional de los ácidos carboxílicos 2. ¿Cuáles son los ácidos carboxílicos que usted encuentra en la vida diaria? 3. ¿Qué ácido está presente en el vinagre y en qué porcentaje? 4. Haga la reacción química de formación del ácido benzoico 5. ¿Cuál es el ácido presente en la cebolla es decir el que produce lagrimeo? 6. ¿Qué es un ácido graso? 7. Calcule los valores de pKa de los ácidos cuyos equilibrios de disociación son los siguientes: K = 4 x 10-6 K = 1250 K=5 K=1 8. Sugiera una secuencia de reactivos capaces de convertir el 1 – pentanol en acido pentanoico. 84 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 8 ACIDOS CARBOXILICOS: DERIVADOS DE ÁCIDOS 1. ¿Qué son esteres? 2. ¿Cuales esteres estarían presentes en los siguientes sabores y olores. a) Naranja_________________ b) Pera____________________ c) Melocotón_______________ d) Menta__________________ e) Banana_________________ 3. Escriba la ecuación química para la formación del acetato de metilo. 4. Defina que es una reacción de esterificación. 5. ¿En qué consiste la reacción de saponificación? 6. Escriba la reacción de saponificación de un éster 85 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 9 AMINAS 1. Dé una explicación (con base en la estructura) al hecho de que las aminas sean de carácter básico. 2. Dibuje como líneas punteadas los puentes de hidrógeno que se describen: b) Hidrógeno de amoniaco unido a otra molécula de amoniaco c) Hidrogeno de amoniaco unido a metilamina d) Hidrogeno de metilamina unido a otra molécula de metilamina e) Hidrogeno de amoniaco unido a trimetilamina 3. En cada uno de los pares siguientes, elija el compuesto más saludable en agua. Explique su razonamiento: a) Amoniaco o trietilamina b) Metilamina o n–octilamina c) Trimetilamina o n-propilamina 4. Diferencie una amina alifática y una aromática. Explique estructuralmente esas diferencias. 5. Cuál o cuáles son los tensos activos que contengan en su composición el grupo amino, indicar su fórmula y su uso. 6. ¿Qué son los alcaloides? 7. ¿Cómo podría diferenciar una amina del amoniaco? 8. La etilamina y el alcohol etílico poseen masas molares semejantes, sin embargo el alcohol etílico posee un punto de ebullición más elevado. Explique. 86 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 10 AMIDAS 1. El orden de reactividad de los derivados de los ácidos carboxílicos es: Haluros de acilo > Esteres >Amidas Dé razones estructurales que explique este hecho 2. Plantee la diferencias físicas y químicas entre un ácido, haluro de ácido, éster y una amida 3. Formule y nombre que satisfagan las siguientes descripciones: a) Tres cloruros de ácido diferentes con formula C6H9ClO b) Tres amidas diferentes con formula C7H11NO c) Tres nitrilos diferentes con formula C5H7N 4. Indicar el método de obtención de la urea que sea la más utilizada actualmente. 5. Al observar el pH de las amidas, a que se debe que sean neutras o menos básicas que las aminas 6. ¿Por qué mamá insiste en que comamos brócoli? 87 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 11 CARBOHIDRATOS; MONOSACÁRIDOS, DISACÁRIDOS Y POLISACARIDOS 1. Dibuje todas las estructuras de la familia de las triosas. 2. Cuantos centros quirales presenta cada uno de los siguientes monosacáridos: 3. a) Eritrulosa b) Glucosamina c) fructosa d) seudoephtulosa e) 2-Desoxiribosa De los siguientes carbohidratos cuales darían la prueba positiva del reactivo de Fehling. a) glucosa b) Trihalosa c) Lactosa d) Sacarosa e) Maltosa 4. ¿Cuál es la estructura de los óxidos cíclicos furano y pirano? 5. De la estructura de dos monosacáridos, disacáridos y polisacáridos 6. Haga la representación de las estructuras cíclicas y de cadena de la α–D– glucosa 7. Establezca diferencias entre un enantiómero y un diastereómero 88 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA Nº 12 AMINOÁCIDOS Y PROTEINAS 1. Un aminoácido se define como: 2. Indique como los aminoácidos se clasifican de acuerdo a su cadena lateral 3. ¿Cuántos aminoácidos de la naturaleza forman parte de las proteínas humanas 4. Indique tres aminoácidos que tengan más de un centro asimétrico y tres que tengan un solo centro asimétrico 5. Designe con sus fórmulas correspondientes de cuatro aminoácidos básicos y cuatro ácidos. 6. Discuta como serán las propiedades de los aminoácidos 7. ¿Cuál es la función principal de los aminoácidos en el organismo humano? 8. ¿Qué es una proteína? ¿Cómo son sus estructuras? 89 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ PRÁCTICA N° 13 POLIMEROS 1. ¿Qué es un polímero? 2. Examine los polímeros desde el punto de vista de la estereoquímica. ¿Cuáles se pueden formar con estereoquímica atáctica, isotáctica o sindiotáctica? 3. ¿Cómo se componen los polímeros? 4. Ejemplos de polímeros naturales. 5. ¿Qué son los polímetros sintéticos? 6. ¿Qué es la polimerización? 7. ¿Cuál es el polímero más barato? 8. ¿Qué propiedades poseen los polímeros? 9. ¿Qué son los disolventes? 90 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 1 Hibridaciones de los átomos de la Química Orgánica y sus formas geométricas APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 91 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 2 Análisis inmediato APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 92 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 3 Hidrocarburos alifáticos APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 93 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 4 Halogenuros de Alquilo APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 94 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 5 Alcoholes APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ___________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 95 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 6 Aldehídos y Cetonas APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 96 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 7 Ácidos Carboxílicos APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 97 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 8 Ácidos Carboxílicos y Derivados APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ___________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 98 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 9 Aminas APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 99 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 10 Amidas APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 100 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 11 Carbohidratos: Monosacáridos, Disacáridos y Polisacáridos APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:________________FECHA : ______________CASILLERO:_________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 101 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 12 Aminoácidos y Proteínas APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:__________________________FECHA: __________________________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 102 Manual de Prácticas de Química II Ingeniería Industrial ____________________________________________________________________________________ CONTROL DE PRÁCTICAS DE QUIMICA II PRACTICA Nº 13 Polímeros APELLIDOS Y NOMBRES ___________________________________________________ GRUPO:__________________________FECHA: __________________________________ ____________________________________________________________________________ Coloque en los casilleros solamente el número de la pregunta que se le asignado 103
© Copyright 2026