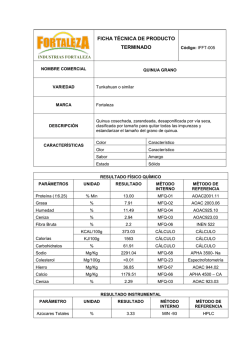
Ácidos Oxácidos u oxoácidos: ternarios (no metal, oxígeno e
Ácidos Son compuestos que se originan por combinación del agua con un óxido ácido o bien por disolución de ciertos hidruros no metálicos en agua. En el primer caso se denominan oxácidos u oxoácidos y en el segundo hidrácidos. Óxido ácido + agua oxácido u oxoácido Ej: SO2 + H2O H2SO3 Hidruro en solución acuosa (disuelto) hidrácido Ej: Cl2 + H2 2 HCl ácido clorhídrico Cl- H+ Ácido es toda sustancia que en solución acuosa se ioniza disociándose, liberando iones hidrógeno H+ (protones). Al disociarse en solución acuosa los oxoácidos quedan conformando oxoaniones ( no metal unido al O con cargas negativas , tantas como H+ se liberaron) y cationes, H+ Ej: H2CO3 en solución acuosa → CO3-2 2 H+ Oxácidos u oxoácidos: ternarios (no metal, oxígeno e hidrógeno) Óxido ácido + agua oxácido u oxoácido Para escribir correctamente las fórmulas desarrolladas de los oxácidos hay que tener en cuenta que: • El no metal que forma el ácido conserva siempre el estado de oxidación que tenía en el óxido ácido. • Cada átomo de hidrógeno se une directamente a un átomo de oxígeno (OH) qué va a estar unido al no metal. • El oxígeno puede estar unido directamente al no metal a través de: - o compartido una con el no metal y con el hidrógeno: X—O—H Ej: - uniones covalentes dobles: - covalentes dativas: X═ O │ OH O←X—OH HBrO Ej: H2CO3 Ej: H2SO3 Br—O—H OH │ C═O │ OH O←S —OH │ OH ¿Cómo conocer el estado de oxidación del no metal? Para conocer el estado de oxidación con el que actúa el no metal el ácido debemos tener en cuenta que: - la suma de las cargas es 0 (signos de las cargas de los estados de oxidación) - el oxígeno siempre actúa con estado de oxidación -2 (se suman todas las de los O participantes) - el hidrógeno con carga 1 (se suman todas las de los H participantes) Entonces: las cagas de los H + las cargas del no metal + las cargas del O = 0 Ej: H2CO3 2 + X + (-6) = 0 X=-2+6 X=4 » CIV Denominación: - La tendencia actual (IUPAC) es denominarlos por numerales de Stock de la siguiente manera: el nombre del no metal terminado con el sufijo ato y entre paréntesis la valencia del no metal y seguido de hidrógeno. Ej: HClO3 clorato (V) de hidrógeno; HNO2 nitrato (III) de hidrógeno. Otras formas de denominarlos: - Prefijo: se los denomina agregando la palabra oxo precedida por el prefijo correspondiente a la cantidad de oxígenos, seguido del nombre del no metal terminado en ato, seguido de la palabra de hidrógeno, hidrógeno si fuera necesario acompañado del prefijo que indique la cantidad de ellos en la fórmula. Ej: HNO2 dioxonitrato de hidrógeno ; H2CO3 trioxonitrato de dihidrógeno; H3PO4 tetraoxofosfato de trihidrógeno - Tradicional: Si al compuesto que le dio origen se lo denominó como óxido ácido de la forma tradicional, se sustituye la palabra óxido por la de ácido y se coloca el prefijo y/o el sufijo correspondiente según la valencia del no metal Ej: Cl2O HClO ácido hipocloroso; Cl2O3 HClO2 ácido cloroso; Cl2O5 HClO3 ácido clórico; Cl2O7 HClO4 ácido perclórico. - Si el óxido ácido solo tenía dos variantes según las valencias del no metal se lo denomina como ácido seguido del nombre del no metal acompañado del sufijo oso o ico. Ej: En el caso del ácido derivado del SO2 (óxido sulfuroso), en el que el S actúa con valencia IV el ácido termina en oso. SIV SO2 + H2O H2SO3 ácido sulfuroso ó sulfato (IV) de hidrogeno En el caso del ácido derivado del SO3, óxido sulfúrico, en el que el S actúa con valencia VI el ácido termina en ico. SVI SO3 + H2O H2SO4 ácido sulfúrico ó sulfato (VI) de hidrogeno Otro Ej sería: N2O3 + H2O HNO2 ácido nitroso ó nitrato (III) de hidrógeno N2O5 + H2O HNO3 ácido nítrico ó nitrato (V) de hidrógeno Otros ejemplos: SO2 + H2O H2SO3 trióxosulfato de dihidrógeno ó ácido sulfuroso ó sulfato (IV) de hidrogeno SO3 + H2O H2SO4 tetraoxosulfato de dihidrógeno ácido sulfúrico ó sulfato (VI) de hidrogeno N2O3 + H2O 2 HNO2 dióxonitrato de hidrógeno ácido nitroso ó nitrato (III) de hidrógeno N2O5 + H2O 2 HNO3 trióxonitrato de hidrógeno ácido nítrico ó nitrato (V) de hidrógeno Algunos óxidos como el fosfórico (P2O5), al reaccionar con el agua pueden dar lugar a la formación de tres oxácidos distintos, ya que el óxido puede reaccionar con una, dos o tres moléculas de agua, respectivamente P2O5 + H2O 2 HPO3 ácido metafosfórico P2O5 + 2 H2O H4P2 O7 ácido pirofosfórico P2O5 + 3 H2O 2 H3PO4 ácido ortofosfórico Lo mismo ocurre con el óxido bórico (B2O3) que forma dos oxácidos según reaccione con una o dos moléculas de agua B2O3 + H2O 2 HBO2 ácido metabórico B2O3 + 3 H2O 2 H3BO3 ácido ortobórico Hidrácidos: binarios (no metal e hidrógeno) Hidruro en solución acuosa (disuelto) hidrácido Provienen de la combinación de algunos no metales (solo los siguientes: fluor, cloro, bromo, yodo y azufre) con hidrógeno (H2) constituyendo gases denominados hidruros o haluros de hidrógeno y que luego al colocarlos en una solución acuosa (disolverlos en agua) forman los hidrácidos correspondientes. En los hidrácidos el no metal siempre actúa con la menor valencia, es decir, cada no metal (fluor, cloro, bromo, yodo, azufre) va a formar un solo hidrácido. Denominación: - Se los denomina colocando el término ácido seguido del nombre del no metal terminado con el sufijo hídrico. Ej: Cl2 + H2 2 HCl ácido clorhídrico Br2 + H2 2 HBr ácido bromhídrico S2 +2 H2 2 H2S ácido sulfhídrico I2 + H2 2 HI ácido yodhídrico F2 + H2 2 HF ácido fluorhídrico
© Copyright 2026