FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
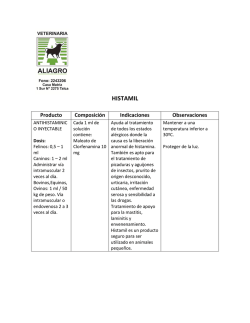
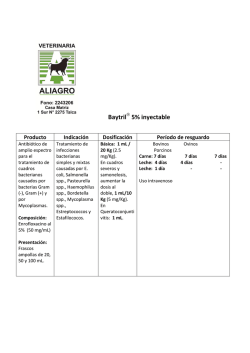
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CEFUROXIMA CHIESI 250 mg, Polvo y Disolvente para Solución Inyectable, EFG CEFUROXIMA CHIESI 750 mg, Polvo y Disolvente para Solución Inyectable, EFG CEFUROXIMA CHIESI 1500 mg, Polvo para Solución Inyectable, EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene: CEFUROXIMA CHIESI 250 mg 250 mg de Cefuroxima (equivalente a 263 mg de Cefuroxima sódica) CEFUROXIMA CHIESI 750 mg 750 mg de Cefuroxima (equivalente a 789 mg de Cefuroxima sódica) CEFUROXIMA CHIESI 1500 mg 1500 mg de Cefuroxima (equivalente a 1578 mg de Cefuroxima sódica) Excipientes ver apartado 6.1. 3. FORMA FARMACÉUTICA CEFUROXIMA CHIESI 250 mg y 750 mg: Polvo y disolvente para solución inyectable CEFUROXIMA CHIESI 1500 mg: Polvo para solución inyectable. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Cefuroxima está indicada en el tratamiento de las siguientes infecciones causadas por gérmenes sensibles (ver apartado 5.1): - Infecciones del aparato respiratorio, tales como bronquitis aguda y crónica, bronquiectasia infectada, neumonía bacteriana, absceso pulmonar e infecciones postoperatorias del tórax. - Infecciones en O.R.L, tales como faringitis, amigdalitis, sinusitis y otitis media. - Infecciones del tracto urinario, tales como pielonefritis aguda y crónica, cistitis y bacteriuria asintomática. - Infecciones de la piel y tejidos blandos, tales como celulitis, erisipela y heridas infectadas. - Septicemias. - Meningitis - Enfermedad gonocócica no complicada e infecciones gonocócicas diseminadas. - Infecciones óseas y articulares, tales como osteomielitis y artritis séptica. - Infecciones en obstetricia y ginecología. Cefuroxima puede utilizarse en asociación con un aminoglucósido (ver apartado 6.2 Incompatibilidades) o con metronidazol en caso de septicemia sospechada o demostrada, o en caso de infección grave cuando el germen patógeno todavía no se ha identificado. 4.2 Posología y forma de administración Debe tenerse en cuenta las directrices oficiales referentes a resistencia bacteriana y al uso y prescripción adecuado de antibióticos. Las dosis recomendadas del antibiótico se administran en función de la gravedad de la infección y de las condiciones del paciente. Adultos: www.agemed.es Documento informativo sometido a adecuación para la navegación telemática. No Válido a afectos jurídicos La posología habitual en el adulto es de 750 mg cada 8 horas, generalmente durante 7 a 10 días. En caso de infecciones graves o complicadas, se recomienda una dosis de 1500 mg cada 8 horas. Si fuera necesario podría aumentarse a 1500 mg cada 6 horas. En caso de infecciones óseas y articulares, se recomienda una dosis de 1500 mg cada 8 horas. En caso de infección gonocócica no complicada, se administrará una dosis única de 1500 mg (2 viales de 750 mg), por vía intramuscular repartida en dos puntos distintos de inyección, junto con la toma de 1 g de probenecid por vía oral. Lactantes y niños (desde un mes hasta 14 años): En niños, la administración de 50 a 100 mg/kg/día en dosis fraccionadas cada 6 a 8 horas ha demostrado ser eficaz en el tratamiento de infecciones de microorganismos sensibles. Dosis de 100 mg/kg/día (no sobrepasar la dosis máxima para los adultos) está indicada para el tratamiento de infecciones graves. Neonatos (durante el primer mes): Dosis de 30 a 100 mg/kg/día, administradas en 2 ó 3 veces. Insuficiencia renal: En caso de alteración de la función renal debe adaptarse la posología de acuerdo con las siguientes directrices. Aclaramiento de creatinina (ml/min.) > 20 10 - 20 < 10 En hemodiálisis* Dosis Frecuencia 750 mg -1,5 g 750 mg 750 mg 750 mg Cada 8 horas Cada 12 horas Cada 24 horas Al final de cada sesión * Como la cefuroxima es dializable, los pacientes en hemodiálisis recibirán una dosis suplementaria al término de la diálisis. Además de su utilización parenteral, cefuroxima puede incorporarse al fluido de diálisis peritoneal (normalmente 250 mg para cada 2 litros de fluido de diálisis). Para pacientes con fallo renal sometidos a hemodiálisis arteriovenosa continua o a hemofiltración de alto flujo en unidades de vigilancia intensiva, la dosis adecuada es de 750 mg dos veces al día. Para hemofiltración de bajo flujo, seguir la dosificación recomendada para disfunción renal. Cuando sólo se dispone de la creatinina sérica, puede utilizarse la fórmula siguiente (basada en el sexo, el peso y la edad del paciente) para convertir este valor en aclaramiento de la creatinina. La creatinina sérica debería ser representativa de un estado estable de la función renal. Aclaramiento de creatinina (Hombres) = Peso (kg) × (140 − edad ) 72 × creatinina sérica (mg/100 ml) Aclaramiento de creatinina (Mujeres) = 0,9 × valor Aclaramiento creatinina (Hombres) En niños con insuficiencia renal, la frecuencia de la dosis debe ser modificada de tal forma que sea coherente con las recomendaciones para adultos. Meningitis Adultos: dosis de 3 gramos por vía intravenosa, administradas cada 8 horas MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios Lactantes y niños: dosis de 200 a 240 mg/kg/día por vía intravenosa, en 3 ó 4 veces. Neonatos: la dosis debe ser de 100 mg/kg/día por vía intravenosa, en 2 ó 3 veces. Duración del tratamiento. Al igual que con todos los antibióticos, el tratamiento debería proseguirse al menos durante 48 a 72 horas después de que hayan desaparecido los síntomas en el paciente o se haya obtenido la erradicación de los patógenos. En caso de infección con Streptococcus pyogenes el tratamiento se prolongará durante un mínimo de 10 días para prevenir el riesgo de complicaciones tardías. Forma de administración: Cefuroxima Chiesi 250 mg y 750 mg se administran por vía intramuscular o intravenosa. Cefuroxima Chiesi 1500 mg se administra por vía intravenosa. Administración intramuscular Agitar suavemente la suspensión resultante y administrar por inyección profunda en una masa muscular importante como el glúteo o la parte lateral del muslo. Previamente, aspirar ligeramente con la jeringa para asegurar que la aguja no está en un vaso sanguíneo. Administración intravenosa La administración intravenosa directa en la vena o a través de un sistema de administración intravenosa, se realizará durante un periodo de tiempo no inferior a 3-5 minutos. 4.3 Contraindicaciones Cefuroxima está contraindicado en caso de hipersensibilidad a cefalosporinas. 4.4 Advertencias y precauciones especiales de empleo Antes de empezar el tratamiento con Cefuroxima se debe tratar en lo posible, de determinar si el paciente ha experimentado anteriormente reacciones de hipersensibilidad a cefuroxima, cefalosporinas, penicilinas u otros medicamentos. Este producto debe ser administrado con cautela a los pacientes alérgicos a la penicilina ya que está documentada la hipersensibilidad cruzada. Si se produce una reacción alérgica a cefuroxima sódica, se deberá suspender la administración del medicamento. Las reacciones de hipersensibilidad agudas serias, pueden requerir el uso de epinefrina y otras medidas de urgencia. Se han descrito casos de colitis pseudomembranosa con casi todos los antibióticos de amplio espectro, incluyendo los macrólidos, las penicilinas semisintéticas y las cefalosporinas. Por lo tanto, es importante tener en cuenta este diagnóstico en los pacientes que desarrollan una diarrea durante o después del tratamiento con antibióticos. Este tipo de colitis pueden ser benignas pero también pueden amenazar la vida del paciente. Se prescribirán con prudencia antibióticos de amplio espectro a los pacientes que tengan antecedentes de enfermedad gastrointestinal, especialmente colitis. Los casos de gravedad moderada se resuelven generalmente interrumpiendo el tratamiento. En los demás casos deberán tomarse las medidas apropiadas. Es recomendable efectuar una evaluación regular de la función renal, especialmente en los pacientes gravemente enfermos y sometidos a dosis altas o en los que reciben diuréticos de asa. Durante el tratamiento de infecciones urinarias crónicas, es necesario efectuar frecuentes evaluaciones clínicas y bacteriológicas. Dichas evaluaciones pueden ser necesarias durante varios meses después de la interrupción del tratamiento. Se han descrito casos de nefrotoxicidad durante la administración concomitante de cefalosporinas y aminoglucósidos, por tanto es conveniente vigilar la función renal en estas circunstancias. MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios Al igual que con los demás antibióticos, la utilización prolongada de cefuroxima sódica puede ocasionar una proliferación de microorganismos no sensibles, especialmente levaduras. Es esencial la vigilancia atenta del paciente. Si se produjera una sobreinfección durante el tratamiento, se deberán tomar las medidas apropiadas. Ocasionalmente se observó, al igual que con otras terapias antibióticas, un retraso en la esterilización del líquido cefalorraquídeo en los niños que padecían meningitis tratados con Cefuroxima. En algunos niños se ha producido una alteración de moderada a grave de la función auditiva, como complicación de la meningitis. Cada gramo de cefuroxima contiene aproximadamente 54,2 mg (2,4 mEq.) de sodio, lo que debe tenerse en cuenta en pacientes con dietas hiposódicas. 4.5 Interacción con otros medicamentos y otras formas de interacción La administración concomitante de probenecid disminuye la secreción tubular, con lo que se reduce el aclaramiento renal en un 40%, aumenta el pico sérico en un 30% y alarga la semivida sérica en un 30%. Cuando se administra Cefuroxima y otros agentes potencialmente nefrotóxicos, como aminoglucósidos o diuréticos de asa, tal como furosemida, se puede potenciar la acción nefrotóxica de éstos. Interacción con pruebas de laboratorio: En la determinación de glucosa en orina con métodos reductores de cobre (tales como la solución de Benedict o de Fheling y comprimidos Clinitest) puede darse una respuesta falsamente positiva bajo tratamiento con Cefuroxima, no así con los métodos enzimáticos. Puede producirse una reacción falsa negativa al efectuar la prueba con ferricianuro para la determinación de glucosa en sangre. Se han descrito resultados falsos positivos en el test de Coombs en algunos pacientes tratados con cefuroxima, lo que puede interferir con estudios hematológicos o con pruebas sanguíneas cruzadas. 4.6 Embarazo y lactancia Embarazo Los estudios de reproducción efectuados en animales no han evidenciado ninguna alteración en la fertilidad ni teratogenicidad. No se ha llevado a cabo ningún estudio adecuado y bien controlado en mujeres embarazadas, por lo cual se debe tener precaución cuando se prescriba cefuroxima a una mujer embarazada. Cefuroxima sólo debe utilizarse en el embarazo si es realmente necesario. Lactancia Dado que cefuroxima se excreta en la leche humana, se debe tener precaución cuando se administre a mujeres en periodo de lactancia. 4.7 Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria No se han observado efectos en la capacidad para conducir y utilizar maquinaria. 4.8 Reacciones adversas Las reacciones adversas más frecuentes consisten en reacciones locales después de administración intravenosa. Las demás reacciones adversas sólo se observan en raras ocasiones. MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios - Reacciones locales: ocasionalmente tromboflebitis después de administración intravenosa. Pueden experimentarse dolores transitorios en el lugar de la inyección intramuscular, siendo más probables que ocurra con dosis elevadas. No obstante, normalmente no es causa suficiente para suspender el tratamiento. - Alteraciones gastrointestinales: se han observado en menos del 1% de los pacientes tratados con cefuroxima. Incluyen náuseas y diarrea. Pueden aparecer síntomas de colitis pseudomembranosa durante el tratamiento o después de éste, aunque en raras ocasiones. También se han comunicado casos de vómitos. - Reacciones de hipersensibilidad: se han observado reacciones de hipersensibilidad en menos del 1% de los pacientes tratados con cefuroxima. Se han descrito casos de rash, prurito, urticaria y test de Coombs positivo. Al igual que con otras cefalosporinas se han producido reacciones anafilácticas en algunas ocasiones. Se han observado algunos casos de eritema multiforme y de síndrome de Stevens-Johnson. Se han observado casos de fiebre medicamentosa. - Alteraciones hematológicas: se ha observado una disminución de la hemoglobina y del hematócrito, así como eosinofilia transitoria en aproximadamente el 10% de los pacientes. En algunos casos también se ha descrito una neutropenia transitoria y leucopenia (<1% igual que con las demás cefalosporinas). También se ha observado hemólisis, anemia aplásica, agranulocitosis, pancitopenia, prolongación del tiempo de protrombina y trombocitopenia. - Alteraciones hepatobiliares: aunque se han descrito aumentos transitorios de las GPT y GOT, fosfatasa alcalina, LDH y bilirrubina, particularmente en pacientes con enfermedad hepática preexistente, no hay evidencia de daño hepático. - Alteraciones renales: se han observado casos de elevación de creatinina sérica y/o del nitrógeno ureico sanguíneo, sin que haya podido establecerse un vínculo de causalidad con el tratamiento. 4.9 Sobredosificación Signos y síntomas: La experiencia de sobredosificación en el hombre es limitada. La administración de dosis elevadas e inadecuadas de antibióticos β-lactámicos inyectables, particularmente al paciente con insuficiencia renal, pueden provocar la aparición de convulsiones. Tratamiento: El tratamiento general puede consistir en terapia de soporte. En caso de convulsiones, se interrumpirá el tratamiento y, si fuera necesario, se iniciará una terapia anticonvulsiva. Los niveles séricos de cefuroxima pueden reducirse por diálisis peritoneal. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades famacodinámicas Grupo farmacoterapéutico Clasificación: J01D Mecanismo de acción Cefuroxima es un antibiótico semisintético del grupo de los β-lactámicos, perteneciente al grupo de cefalosporinas de segunda generación. Su acción bactericida es resultado de la inhibición de la síntesis y reparación de la pared celular bacteriana mediante la unión a proteínas diana esenciales. Posee una gran estabilidad a las β-lactamasas producidas por ciertas bacterias gramnegativas. Microbiología: Cefuroxima es habitualmente activo in vitro frente a gran número de cepas grampositivas y gramnegativas. MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios Criterios de sensibilidad Los valores MIC obtenidos de cultivos bacterianos diferentes de Haemophilus spp. y Neisseria gonorrhoea deben interpretarse según el siguiente criterio: Sensible: ≤ 8 mcg/ml; Intermedio: 16 mcg/ml; Resistente: ≥ 32 mcg/ml Los valores MIC obtenidos para Haemophilus spp. deben interpretarse según el siguiente criterio: Sensible: ≤ 4 mcg/ml; Intermedio: 8 mcg/ml; Resistente: ≥ 16 mcg/ml Los valores MIC obtenidos para Neisseria gonorrhoeae deben interpretarse según el siguiente criterio: Sensible: ≤ 1 mcg/ml; Intermedio: 2 mcg/ml; Resistente: ≥ 4 mcg/ml En la siguiente tabla se detallan los microorganismos según su susceptibilidad a cefuroxima: Sensible o Intermedio Aerobios gram-positivos Staphylococcus aureus y Staphylococcus epidermidis (incluyendo cepas productoras de penicilinasa, pero excluyendo cepas resistentes a meticilina) Streptococcus pneumoniae Streptococcus pyogenes (y otros estreptococos β-hemolíticos) Streptococcus Grupo B (Streptococcus agalactiae) Streptococcus mitis (grupo viridians) Bordetella pertussis. Aerobios gram-negativos Citrobacter spp. Enterobacter spp. Escherichia coli Haemophylus influenzae (incluidas cepas resistentes a ampicilina) Haemophylus parainfluenzae Klebsiella spp. (incluida Klebsiella pneumoniae) Moraxella (Branhamella) catarrhalis (incluidas las cepas resistentes a ampicilina y cefalotina) Morganella morganii (antes Proteus morganii) Neisseria gonorrhoeae (incluyendo cepas productoras y no productoras de penicilinasas) Neisseria meningitidis Proteus mirabilis Providencia rettgeri (antes Proteus rettgeri) Salmonella spp. Shigella spp. Anaerobios Cocos gram-positivos y gram-negativos (incluidos Peptococcus y Peptostreptococcus spp.) Bacilos gram-positivos (incluido Clostridium spp.) Bacilos gram-negativos (incluido Bacteroides y Fusobacterium spp.). Propionibacterium spp. Otros microorganismos Borrelia burgdorferi. Resistente Aerobios gram-positivos Algunas cepas de enterococos, p.e. Enterococcus faecalis (antes MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios Streptococcus faecalis) Estafilococos resistentes a meticilina Listeria monocytogenes Aerobios gram-negativos Algunas cepas de Morganella morganii, Enterobacter cloacae,Citrobacter spp. Pseudomonas y Campilobacter spp., Acinetobacter calcoaceticus, y la mayoría de cepas de Serratia spp. y Proteus vulgaris. Legionella spp. Anaerobios Clostridium difficile y la mayoría de cepas de Bacteroides fragilis. In vitro las actividades de cefuroxima y de los antibióticos aminoglucósidos en combinación han mostrado ser al menos aditivas, con evidencia ocasional de sinergismo. Mecanismo de la resistencia La resistencia de las bacterias a cefalosporinas puede ser natural o adquirida. Generalmente, la resistencia se debe a la producción de β-lactamasas. La prevalencia de la resistencia puede variar geográficamente y con el tiempo. Se puede obtener información local de las resistencias sobre especies seleccionadas, especialmente cuando se traten infecciones graves. Esta información sólo da una idea aproximada de la probabilidad que el microorganismo sea susceptible a cefuroxima. 5.2 Propiedades farmacocinéticas Después de una inyección intramuscular de una dosis de 750 mg de cefuroxima a voluntarios sanos, el pico sérico medio es de 27 µg/ml. Este pico se observa aproximadamente al cabo de 45 minutos (entre 15 y 60 minutos). Después de la administración intravenosa de 750 mg y de 1500 mg, las concentraciones séricas son de aproximadamente 50 µg/ml y de 100 µg/ml, respectivamente, después de 15 minutos. Las concentraciones terapéuticas (superiores o iguales a 2 µg/ml) se mantienen durante 5,3 y 8 horas, respectivamente. El porcentaje de unión de Cefuroxima a proteínas plamáticas es aproximadamente de un 50%. Se obtienen concentraciones terapéuticas de cefuroxima en el líquido pleural, líquido sinovial, bilis, esputo, hueso y en el humor acuoso. En los pacientes con meningitis, también se producen concentraciones terapéuticas en el líquido cefalorraquídeo, cuando se administra el producto por vía intravenosa. Después de la administración de una dosis de 1500 mg cada ocho horas a voluntarios sanos aparentemente no se produce acumulación de cefuroxima en el suero. La semivida plasmática, después de inyección intramuscular o intravenosa, es de unos 80 minutos. Aproximadamente un 89% de la dosis administrada se elimina por vía renal en forma inalterada (50% por filtración glomerular y 50% por secreción tubular) en un periodo de ocho horas, dando lugar a elevadas concentraciones urinarias. Después de la administración intramuscular de una dosis única de 750 mg, las concentraciones urinarias medias son de 1300 µg/ml durante las primeras ocho horas. Las dosis intravenosas de 750 mg y 1500 mg producen concentraciones urinarias medias de 1150 µg/ml y 2500 µg/ml, respectivamente durante las primeras ocho horas. MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios La administración concomitante de probenecid disminuye la secreción tubular, con lo que se reduce el aclaramiento renal en un 40%, aumenta el pico sérico en un 30% y alarga la semivida sérica en un 30%. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes El vial con el polvo para inyectable no contiene excipientes. Las ampollas de disolvente, que acompañan las especialidades Cefuroxima Chiesi 250 mg y 750 mg IM/IV, contienen 2 y 6 ml respectivamente de agua para inyección. 6.2 Incompatibilidades Cefuroxima Chiesi es física y químicamente incompatible con soluciones que contengan un aminoglucósido. Si fuera necesario el tratamiento concomitante, cada uno de los antibióticos se administrará por separado. 6.3 Periodo de validez 36 meses. 6.4 Precauciones especiales de conservación Conservar a una temperatura no superior a 25°C. Conservar protegido de la luz. Las soluciones reconstituidas de cefuroxima sódica deben preferentemente utilizarse de inmediato. No obstante, las preparaciones inyectables de Cefuroxima sódica para administración intramuscular o intravenosa, pueden conservarse 8 horas a una temperatura no superior a 25°C ó 24 horas en refrigeración (2-8°C). Después de los periodos mencionados cualquier suspensión o solución no utilizada debe descartarse. 6.5 Naturaleza y contenido del recipiente Cefuroxima Chiesi 250 mg y 750 mg IM/IV se presentan en un vial de vidrio tipo III, transparente e incoloro de 12,6 ml de capacidad, cerrado con un tapón de caucho y una cápsula de aluminio tipo Flip-off. Ambas dosificaciones de acompañan de una ampolla de disolvente conteniendo 2 ml y 6 ml respectivamente de agua para inyección. Cefuroxima Chiesi 1500 mg IV se presenta en un vial de vidrio tipo III, transparente e incoloro de 26 ml de capacidad, cerrado con un tapón de caucho y una cápsula de aluminio tipo Flip-off. 6.6 Instrucciones de uso / manipulación Administración intramuscular La inyección intramuscular se prepara añadiendo 1 ml de agua para inyección al vial de Cefuroxima Chiesi 250 mg o 3 ml al vial de Cefuroxima Chiesi 750 mg. Administración intravenosa directa MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios La solución para inyección intravenosa directa se obtiene añadiendo al menos 2 ml de agua para inyección al vial de Cefuroxima Chiesi 250 mg, al menos 6 ml al vial de 750 mg, o 15 ml al vial de 1500 mg. Infusión intravenosa Para la infusión intravenosa breve (hasta 30 min), se recomienda utilizar soluciones de concentración entre 7,5 y 15 mg/ml de cefuroxima en agua para inyección, dextrosa al 5%, cloruro sódico 0,9%, u otro de los siguientes líquidos de infusión compatibles: Dextrosa 10% en agua, Dextrosa 5% en cloruro sódico al 0,2%, 0,45% o 0,9%, Solución de Ringer, Solución de Ringer lactato, Azúcar invertido 10%, y Lactato sódico 1/6M. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN CHIESI ESPAÑA, S.A. Berlín 38-48, 7ª planta 08029 Barcelona (España) 8. NÚMERO DE REGISTRO DE LOS MEDICAMENTOS Cefuroxima Chiesi 250 mg, Polvo y disolvente para solución inyectable, EFG Nº registro: 63.688 Cefuroxima Chiesi 750 mg, Polvo y disolvente para solución inyectable, EFG Nº registro: 63.687 Cefuroxima Chiesi 1500 mg, Polvo para solución inyectable, EFG Nº registro: 63.686 9. FECHA DE LA AUTORIZACIÓN PRIMERA AUTORZACIÓN Ó RENOVACIÓN DE LA Cefuroxima Chiesi 250 mg, Polvo y disolvente para solución inyectable, EFG Febrero 2001 (Autorización) Cefuroxima Chiesi 750 mg, Polvo y disolvente para solución inyectable, EFG Febrero 2001 (Autorización) Cefuroxima Chiesi 1500 mg, Polvo para solución inyectable, EFG Febrero 2001 (Autorización) 10. FECHA DE LA REVISIÓN DEL TEXTO Abril 2002 FT03_01 MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios MINISTERIO DE SANIDAD Y CONSUMO Agencia Española de Medicamentos y Productos Sanitarios
© Copyright 2026