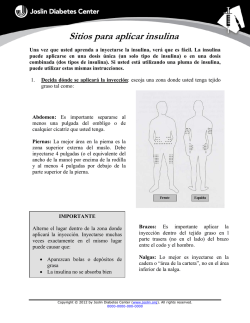
0315-00025983-1 LEV PI 3-6
PUNTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para usar LEVEMIR® de manera segura y eficaz. Consulte la información completa de prescripción de LEVEMIR® . LEVEMIR® (insulin detemir [rDNA origin] injection) solución para inyección subcutánea Aprobación inicial en EE. UU.: 2005 ——— CAMBIOS IMPORTANTES RECIENTES ——— •Advertencias y precauciones (5.1)02/2015 ——— INDICACIONES Y USO ——— LEVEMIR® es un análogo de insulina humana de acción prolongada que se indica para mejorar el control glucémico en adultos y niños con diabetes mellitus. (1) Limitaciones importantes para el uso: •Levemir® no se recomienda para el tratamiento de la cetoacidosis diabética. Para esta afección es preferible el tratamiento con insulina de acción rápida por vía intravenosa. ——— POSOLOGÍA Y ADMINISTRACIÓN ——— •La dosis inicial debe individualizarse basándose en el tipo de diabetes y en si el paciente nunca ha recibido insulina antes (2.1, 2.2, 2.3). •Se debe administrar por vía subcutánea una vez al día o en dosis divididas dos veces al día. La administración una vez al día debe hacerse con la comida de la noche o a la hora de acostarse (2.1). •Se debe rotar el lugar de la inyección dentro de la zona de inyección (abdomen, muslo o músculo deltoides) para reducir el riesgo de lipodistrofia (2.1). INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO* INDICACIONES Y USO 1 2 POSOLOGÍA Y ADMINISTRACIÓN 2.1 Administración de la dosis 2.2 Inicio del tratamiento con LEVEMIR® 2.3Conversión de otros tratamientos insulínicos a LEVEMIR® 3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES 4CONTRAINDICACIONES 5 ADVERTENCIAS Y PRECAUCIONES 5.1Nunca se debe compartir un inyector LEVEMIR® FlexTouch® entre pacientes 5.2 Ajuste de dosis y control 5.3Administración 5.4Hipoglucemia 5.5 Hipersensibilidad y reacciones alérgicas 5.6 Insuficiencia renal 5.7 Insuficiencia hepática 5.8 Interacciones con otros medicamentos 5.9Retención de líquidos e insuficiencia cardíaca debido al uso concomitante de agonistas de PPAR-gamma 6 REACCIONES ADVERSAS 6.1 Experiencia en ensayos clínicos 6.2 Experiencia posterior a la comercialización 7 INTERACCIONES CON OTROS MEDICAMENTOS 8 USO EN POBLACIONES ESPECÍFICAS 8.1Embarazo 8.3 Madres en período de lactancia 8.4 Uso pediátrico 8.5 Uso geriátrico •Si se pasa de un tipo de insulina a otro (conversión) puede ser necesario ajustar el momento de administración y la dosis de LEVEMIR®. La glucosa debe controlarse cuidadosamente al pasar de otra insulina a LEVEMIR® y durante las primeras semanas (2.3). FORMAS FARMACÉUTICAS Y CONCENTRACIONES ——— Solución para inyección: 100 unidades/ml (U-100) en: •LEVEMIR® FlexTouch® de 3 ml •Vial de 10 ml (3) ——— ——— CONTRAINDICACIONES ——— •No la use en pacientes con hipersensibilidad a LEVEMIR® o a cualquiera de sus excipientes (4). ——— ADVERTENCIAS Y PRECAUCIONES ——— •Nunca se debe compartir un inyector LEVEMIR® FlexTouch® entre pacientes, aunque se cambie la aguja (5.1). •Ajuste de dosis y control: controle el nivel de glucemia de todos los pacientes tratados con insulina. Los regímenes de insulina deben modificarse cuidadosamente y solo bajo supervisión médica (5.2). •Administración: no diluya ni mezcle con ningún otro tipo de insulina o solución. No administre por vía subcutánea con bomba de insulina. Tampoco administre por vía intramuscular ni intravenosa ya que puede presentarse hipoglucemia grave (5.3). •La hipoglucemia es la reacción adversa más común del tratamiento insulínico y podría poner en peligro la vida del paciente (5.4, 6.1). •Reacciones alérgicas: pueden presentarse casos graves de alergia generalizada, entre ellos la anafilaxia, que pueden poner en peligro la vida del paciente (5.5). 10SOBREDOSIS 11DESCRIPCIÓN 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción 12.2Farmacodinámica 12.3Farmacocinética 13 TOXICOLOGÍA PRECLÍNICA 13.1 Carcinogenia, mutagenia, deterioro de la fertilidad 14 ESTUDIOS CLÍNICOS 16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN 16.1Presentación 16.2Almacenamiento 16.3 Preparación y manipulación 17 INFORMACIÓN PARA ASESORAR AL PACIENTE 17.1Nunca comparta LEVEMIR® FlexTouch® con otros pacientes 17.2Instrucciones para los pacientes *Las secciones y subsecciones que se han omitido de la información completa de prescripción no se han incluido. 1 •Insuficiencia renal o hepática: puede ser necesario ajustar las dosis de LEVEMIR® (5.6, 5.7). •Puede haber retención de líquidos e insuficiencia cardíaca con el uso concomitante de tiazolidindionas (TZD), que son agonistas de PPAR-gamma y la insulina, incluida la de LEVEMIR® (5.9). ——— REACCIONES ADVERSAS ——— Entre las reacciones adversas asociadas con LEVEMIR® se incluyen la hipoglucemia, las reacciones alérgicas, reacciones en el lugar de la inyección, lipodistrofia, sarpullido y prurito (6). Para notificar de PRESUNTAS REACCIONES ADVERSAS, llame a Novo Nordisk Inc. al 1-800-727-6500 o a la FDA al 1-800-FDA-1088, o bien visite www.fda.gov/ medwatch. ——— INTERACCIONES CON ——— OTROS MEDICAMENTOS •Algunos medicamentos pueden afectar el metabolismo de la glucosa y hacer que sea necesario ajustar la dosis de insulina y controlar cuidadosamente los niveles de glucosa (7). •Los signos de hipoglucemia pueden reducirse o estar ausentes en pacientes que toman medicamentos antiadrenérgicos (p. ej., betabloqueantes, clonidina, guanetidina y reserpina) (7). ——— USO EN POBLACIONES ESPECÍFICAS ——— Pediátrica: No se ha estudiado en niños con diabetes tipo 2 ni en niños menores de 2 años con diabetes tipo 1 (8.4). Consulte la sección 17 INFORMACIÓN PARA ASESORAR AL PACIENTE y la documentación sobre el producto autorizada por la FDA para el paciente. Revisado: 02/2015 LEVEMIR® (insulin detemir [rDNA origin] injection) INFORMACIÓN COMPLETA DE PRESCRIPCIÓN ADVERTENCIAS Y PRECAUCIONES 5 5.1 Nunca se debe compartir el LEVEMIR® FlexTouch® INDICACIONES Y USO 1 entre pacientes LEVEMIR® está indicada para mejorar el control glucémico en El LEVEMIR® FlexTouch® no debe compartirse con otros adultos y niños con diabetes mellitus. pacientes, aunque se cambie la aguja. Al hacerlo se corre el Limitaciones importantes para el uso: riesgo de trasmisión de patógenos sanguíneos. •LEVEMIR® no se recomienda para el tratamiento de la 5.2 Ajuste de dosis y control cetoacidosis diabética. Para esta afección es preferible el Es esencial que todos los pacientes que reciban tratamiento tratamiento con insulina de acción rápida por vía intravenosa. insulínico se revisen la glucosa. Los regímenes de insulina deben modificarse cuidadosamente y solo bajo supervisión médica. POSOLOGÍA Y ADMINISTRACIÓN 2 2.1 Administración de la dosis Los cambios en la potencia, fabricación, tipo o método de LEVEMIR® es un análogo de la insulina humana recombinante para administración de la insulina pueden dar lugar a la necesidad de la administración subcutánea una o dos veces al día. un cambio en la dosis de insulina o a un ajuste del tratamiento Los pacientes tratados con LEVEMIR® una vez al día deben antidiabético concomitante. administrarse la dosis con la comida de la noche o a la hora de Como con cualquier preparado de insulina, el tiempo que tarda acostarse. en hacer efecto LEVEMIR® pueden variar de un paciente a otro y Los pacientes que requieren administrársela dos veces al día pueden de un momento a otro en un mismo paciente, y depende de varias administrarse la dosis de la noche con la comida de la noche, a la condiciones, entre ellas el suministro local de sangre, la temperatura local y la actividad física. hora de acostarse o 12 horas después de la dosis de la mañana. La dosis de LEVEMIR® debe individualizarse según la respuesta 5.3Administración clínica. Es esencial que todos los pacientes que reciban tratamiento LEVEMIR® solamente se debe administrar por vía subcutánea. insulínico se revisen la glucemia. No administre LEVEMIR® por vía intravenosa ni intramuscular. La Los pacientes que deban ajustar la cantidad o el momento en que se duración prevista de la actividad de LEVEMIR® depende de que administran LEVEMIR® deben hacerlo solo bajo supervisión médica se inyecte en el tejido subcutáneo. La administración intravenosa con un control adecuado de la glucosa [consulte Advertencias y o intramuscular de la dosis subcutánea habitual podría causar hipoglucemia grave [consulte Advertencias y precauciones (5.4)]. precauciones (5.2)]. ® Los pacientes con diabetes tipo 1 deben usar LEVEMIR® en un No use LEVEMIR en bombas de infusión de insulina. régimen que incluya una insulina de acción rápida o de acción breve. No diluya ni mezcle LEVEMIR® con ningún otro tipo de insulina ® Como con todas las insulinas, se debe rotar el lugar de la inyección o solución. Si se diluye o se mezcla LEVEMIR , el perfil farmacocinético o farmacodinámico (es decir, el inicio de la acción, dentro de la misma zona (abdomen, muslo o músculo deltoides) ® donde se aplicó la inyección anterior para reducir el riesgo de el tiempo que tarda en hacer el máximo efecto) de LEVEMIR y la insulina mezclada pueden alterarse de manera impredecible. lipodistrofia [consulte Reacciones adversas (6.1)]. LEVEMIR® puede inyectarse por vía subcutánea en el muslo, la 5.4Hipoglucemia más común del tratamiento pared abdominal o la parte superior del brazo. Como con todas las La hipoglucemia es la reacción adversa ® insulinas, la velocidad de absorción y, como consecuencia, el inicio insulínico, incluso con LEVEMIR . El riesgo de hipoglucemia y la duración de la acción, pueden verse afectados por el ejercicio y aumenta si el control glucémico es intensivo. otras variables, como estrés, enfermedades intercurrentes o cambios Cuando se usa un agonista del receptor GLP-1 en combinación con en los medicamentos concomitantes o los patrones de las comidas. LEVEMIR®, puede ser necesario reducir o ajustar de manera más ® Cuando se use LEVEMIR® con un agonista del péptido similar al conservadora la dosis de LEVEMIR para minimizar el riesgo de hipoglucemia [consulte Reacciones adversas (6.1)]. glucacón (GLP-1), este se debe administrar en una inyección aparte. Jamás deben mezclarse. Es aceptable inyectar LEVEMIR® y un Se debe enseñar a los pacientes a reconocer y tratar la hipoglucemia. agonista del receptor GLP-1 en la misma parte del cuerpo, pero las La hipoglucemia grave puede causar pérdida del conocimiento o convulsiones y tener como resultado un deterioro temporal o inyecciones no deben ser adyacentes. permanente del funcionamiento cerebral o la muerte. En ensayos ® 2.2 Inicio del tratamiento con LEVEMIR clínicos con insulina, incluso en ensayos con LEVEMIR®, se ha ® La dosis inicial recomendada para LEVEMIR en los pacientes con observado hipoglucemia grave que requirió la ayuda de otra persona, diabetes tipo 1 debe ser aproximadamente un tercio del requisito la infusión parenteral de glucosa o la administración de glucagón. diario total de insulina. Se debe usar una insulina preprandial de acción rápida o de acción breve para satisfacer el resto de las El momento en que ocurre la hipoglucemia suele reflejar el perfil de acción-tiempo de las formulaciones de insulina administradas. Otros necesidades diarias de insulina. factores, tales como cambios en la ingesta de alimentos (es decir, la ® La dosis inicial recomendada de LEVEMIR en pacientes con diabetes cantidad de alimentos o la hora de las comidas), el ejercicio y los tipo 2 inadecuadamente controlada que toman antidiabéticos orales medicamentos concomitantes también pueden alterar el riesgo de es de 10 unidades (o de 0.1 a 0.2 unidades/kg) administradas una hipoglucemia [consulte Interacciones con otros medicamentos (7)]. vez al día por la noche o divididas en un régimen de dos veces al día. El efecto prolongado de LEVEMIR® administrada por vía subcutánea La dosis inicial recomendada de LEVEMIR® en pacientes con puede retrasar la recuperación de la hipoglucemia. diabetes tipo 2 inadecuadamente controlada que reciben un agonista Como con cualquier insulina, se debe tener cautela con los pacientes del receptor GLP-1 es de 10 unidades administradas una vez al día que se sabe que presentan hipoglucemia y en aquellos que puedan por la noche. tener predisposición a la hipoglucemia (p. ej., la población Las dosis de LEVEMIR®, por consiguiente, deben ajustarse según pediátrica y pacientes que ayunan o comen de manera errática). los valores de glucosa en sangre. Las dosis de LEVEMIR® deben La hipoglucemia puede afectar la capacidad de concentración y individualizarse bajo la supervisión de un profesional de la salud. reacción del paciente. Esto puede resultar riesgoso en situaciones en las que estas capacidades son especialmente importantes, como 2.3 Conversión de otros tratamientos insulínicos a al conducir u operar maquinaria. LEVEMIR® Si se está pasando de insulina glargina a LEVEMIR®, el cambio se Las advertencias iniciales de la hipoglucemia pueden ser diferentes o menos pronunciadas en ciertas circunstancias, como cuando puede hacer unidad por unidad. Si se está pasando de insulina NPH, el cambio se puede hacer el paciente tiene diabetes desde hace muchos años o padece de unidad por unidad. Sin embargo, algunos pacientes con diabetes neuropatía diabética, cuando se usan medicamentos, como los tipo 2 pueden necesitar más LEVEMIR® que insulina NPH, según se betabloqueantes, o cuando se intensifica el control glucémico [consulte Interacciones con otros medicamentos (7)]. Estas observó en un ensayo [consulte Estudios Clínicos (14)]. situaciones pueden derivar en hipoglucemia grave (y, posiblemente, Como con todas las insulinas, se recomienda revisar la glucosa pérdida del conocimiento) antes de que el paciente se dé cuenta de durante la transición y durante las primeras semanas siguientes. que tiene hipoglucemia. Puede ser necesario ajustar las dosis y los momentos de administración de insulinas de acción rápida o acción breve u otros 5.5 Hipersensibilidad y reacciones alérgicas Con los productos de insulina como LEVEMIR® pueden presentarse tratamientos antidiabéticos concomitantes. casos graves de alergia generalizada, entre ellos la anafilaxia, que 3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES pueden poner en peligro la vida del paciente. La solución para inyección LEVEMIR® en 100 unidades por ml viene en: 5.6 Insuficiencia renal •LEVEMIR® FlexTouch® de 3 ml No se observó diferencia en la farmacocinética de la insulina detemir en individuos no diabéticos con insuficiencia renal ni en •Vial de 10 ml voluntarios sanos. Sin embargo, algunos estudios con insulina 4CONTRAINDICACIONES humana han mostrado un aumento de las concentraciones de ® LEVEMIR está contraindicada en pacientes con hipersensibilidad insulina en pacientes con insuficiencia renal. Puede ser necesario ® al LEVEMIR o a cualquiera de sus excipientes. Las reacciones han revisar cuidadosamente la glucosa y ajustar la dosis de insulina, incluido anafilaxia [consulte Advertencias y precauciones (5.5) y incluida LEVEMIR®, en pacientes con insuficiencia renal [consulte Reacciones adversas (6.1)]. Farmacología clínica (12.3)]. 2 5.7 Insuficiencia hepática Se observó que individuos no diabéticos con insuficiencia hepática grave tenían exposiciones sistémicas menores a la insulina detemir que los voluntarios sanos. Sin embargo, algunos estudios con insulina humana han mostrado un aumento de las concentraciones de insulina circulante en pacientes con insuficiencia hepática. Puede ser necesario revisar cuidadosamente la glucosa y ajustar la dosis de insulina, incluida LEVEMIR®, en pacientes con insuficiencia hepática [consulte Farmacología clínica (12.3)]. 5.8 Interacciones con otros medicamentos Algunos medicamentos pueden alterar los requisitos de insulina y consecuentemente aumentar el riesgo de hipoglucemia o hiperglucemia [consulte Interacciones con otros medicamentos (7)]. 5.9 Retención de líquido e insuficiencia cardíaca debido al uso concomitante de agonistas de PPAR-gamma Las tiazolidinedionas (TZD), que son agonistas de receptores activados por proliferadores peroxisómicos (PPAR) gamma, pueden causar retención de líquido relacionada con la dosis, particularmente cuando se usan en combinación con insulina. La retención de líquido puede causar o exacerbar la insuficiencia cardíaca. Se debe supervisar a los pacientes tratados con insulina, incluida LEVEMIR®, y un agonista de PPAR-gamma para ver si presentan signos y síntomas de insuficiencia cardíaca. Si enferman de insuficiencia cardíaca, esta debe tratarse siguiendo el tratamiento habitual vigente y se debe considerar suspender o reducir la dosis del agonista de PPAR-gamma. 6 REACCIONES ADVERSAS En otros partes de este documento se explican las siguientes reacciones adversas: •Hipoglucemia [consulte Advertencias y precauciones (5.4)]. •Reacciones alérgicas y de hipersensibilidad [consulte Advertencias y precauciones (5.4)]. 6.1 Experiencia en ensayos clínicos Debido a que los ensayos clínicos se llevan a cabo según una gran variedad de diseños, a veces es difícil comparar las incidencias de reacciones adversas registradas en un ensayo clínico con las incidencias registradas en otro ensayo clínico, y podrían no reflejar las incidencias que de hecho se observan en la práctica clínica. En las tablas 1 a 4 a continuación pueden verse las frecuencias de reacciones adversas (excepto hipoglucemia) registradas en los ensayos clínicos de LEVEMIR® en pacientes con diabetes mellitus tipo 1 y tipo 2. En las tablas 5 y 6 se muestran los resultados en cuanto a hipoglucemia. En el ensayo de LEVEMIR® agregado a liraglutida + metformina, todos los pacientes recibieron 1.8 mg de liraglutida + metformina durante un período inicial de 12 semanas. Durante dicho período inicial, 167 pacientes (17 % del total inscrito) abandonaron el estudio: 76 (46 % de los abandonos) lo hicieron debido a reacciones adversas gastrointestinales y 15 (9 % de los abandonos) lo hizo debido a otros eventos adversos. Solo aquellos pacientes que finalizaron el período inicial con un control glucémico inadecuado fueron asignados de forma aleatoria al tratamiento complementario con LEVEMIR® durante 26 semanas o bien a continuar con el mismo tratamiento de 1.8 mg de liraglutida + metformina sin cambios. Durante este período aleatorizado de 26 semanas, la única reacción adversa informada fue diarrea, en ≥5 % de los pacientes tratados con 1.8 mg de liraglutida + metformina (11.7 %) y fue mayor que en los pacientes tratados con 1.8 mg de liraglutida y metformina solamente (6.9 %). En dos ensayos agrupados, un total de 1155 adultos con diabetes tipo 1 fueron expuestos a dosis individualizadas de LEVEMIR® (n=767) o NPH (n=388). La duración media de la exposición a LEVEMIR® fue de 153 días, y la exposición total a LEVEMIR® fue de 321 años-paciente. Las reacciones adversas más frecuentes se resumen en la tabla 1. Tabla 1: Reacciones adversas (excepto hipoglucemia) en dos ensayos clínicos agrupados de 16 y 24 semanas de duración en adultos con diabetes tipo 1 (reacciones adversas con una incidencia de ≥5 %) LEVEMIR®, % NPH, % (n = 388) (n = 767) Infección de las vías respiratorias altas 26.1 21.4 Dolor de cabeza 22.6 22.7 Faringitis 9.5 8.0 Síndrome gripal 7.8 7.0 Dolor abdominal 6.0 2.6 Un total de 320 adultos con diabetes tipo 1 fueron expuestos a dosis individualizadas de LEVEMIR® (n=161) o NPH (n=159). La duración media de la exposición a LEVEMIR® fue de 176 días, y la exposición total a LEVEMIR® fue de 78 años-paciente. Las reacciones adversas más frecuentes se resumen en la tabla 2. LEVEMIR® (insulin detemir [rDNA origin] injection) Tabla 2: Reacciones adversas (excepto hipoglucemia) en un ensayo de 26 semanas de comparación de insulina aspart + LEVEMIR® con insulina aspart + insulina glargina en adultos con diabetes tipo 1 (reacciones adversas con una incidencia ≥5 %) LEVEMIR®, % Glargina, % (n = 161) (n = 159) Infección de las vías respiratorias altas 26.7 32.1 Dolor de cabeza 14.3 19.5 Dolor de espalda 8.1 6.3 Síndrome gripal 6.2 8.2 Gastroenteritis 5.6 4.4 Bronquitis 5.0 1.9 En dos ensayos agrupados, un total de 869 adultos con diabetes tipo 2 fueron expuestos a dosis individualizadas de LEVEMIR® (n=432) o NPH (n=437). La duración media de la exposición a LEVEMIR® fue de 157 días, y la exposición total a LEVEMIR® fue de 186 años-paciente. Las reacciones adversas más frecuentes se resumen en la tabla 3. Tabla 3: Reacciones adversas (excepto hipoglucemia) en dos ensayos clínicos agrupados de 22 y 24 semanas de duración en adultos con diabetes tipo 2 (reacciones adversas con una incidencia de ≥5 %) LEVEMIR®, % NPH, % (n = 437) (n = 432) Infección de las vías respiratorias altas 12.5 11.2 Dolor de cabeza 6.5 5.3 Un total de 347 niños y adolescentes (de 6 a 17 años) con diabetes tipo 1 fueron expuestos a dosis individualizadas de LEVEMIR® (n=232) o NPH (n=115). La duración media de la exposición a LEVEMIR® fue de 180 días, y la exposición total a LEVEMIR® fue de 114 años-paciente. Las reacciones adversas más frecuentes se resumen en la tabla 4. Tabla 4: Reacciones adversas (excepto hipoglucemia) en un ensayo clínico de 26 semanas de duración en niños y adolescentes con diabetes tipo 1 (reacciones adversas con una incidencia de ≥5 %) LEVEMIR®, % NPH, % (n = 115) (n = 232) Infección de las vías respiratorias altas 35.8 42.6 Dolor de cabeza 31.0 32.2 Faringitis 17.2 20.9 Gastroenteritis 16.8 11.3 Síndrome gripal 13.8 20.9 Dolor abdominal 13.4 13.0 Fiebre 10.3 6.1 Tos 8.2 4.3 Infección viral 7.3 7.8 Náuseas 6.5 7.0 Rinitis 6.5 3.5 Vómitos 6.5 10.4 Embarazo Se realizó un ensayo clínico aleatorizado, abierto, controlado, en mujeres embarazadas con diabetes tipo 1 [consulte Uso en poblaciones específicas (8.1)]. •Hipoglucemia La hipoglucemia es la reacción adversa que se observa con más frecuencia en los pacientes que usan insulina, incluida LEVEMIR® [consulte Advertencias y precauciones (5.4)]. Las tablas 5 y 6 resumen la incidencia de hipoglucemia grave y no grave en los ensayos clínicos con LEVEMIR®. En los ensayos con adultos y en uno de los ensayos pediátricos (Estudio D), se definió la hipoglucemia como un evento con síntomas indicativos de hipoglucemia que requirieron asistencia de otra persona y estuvieron asociados con un valor de glucosa plasmática inferior a 56 mg/dl (glucemia por debajo de 50 mg/dl) o una recuperación rápida tras la administración de un carbohidrato oral, glucosa intravenosa o glucagón. En el otro ensayo pediátrico (Estudio I), se definió la hipoglucemia grave como un evento con semiconsciencia, inconsciencia, coma y/o convulsiones en un paciente que no podía asistir en el tratamiento y que puede haber requerido glucagón o glucosa intravenosa. En los ensayos de adultos y pediátrico (Estudio D), la hipoglucemia no grave se definió como una glucosa plasmática asintomática o sintomática <56 mg/dl (o una glucemia equivalente <50 mg/dl según se usó en lo estudios A y C) que se trató el paciente mismo. En el Estudio I pediátrico, la hipoglucemia no grave incluyó eventos asintomáticos con una glucosa plasmática <65 mg/dl, así como eventos sintomáticos que pudo tratarse el paciente mismo tomando un tratamiento oral proporcionado por el cuidador. Las incidencias de hipoglucemia en los ensayos clínicos con LEVEMIR® (consulte en la sección 14 la descripción de los diseños de los estudios) fueron similares entre los pacientes tratados con LEVEMIR® y los pacientes no tratados con LEVEMIR® (consulte las tablas 5 y 6). 3 Tabla 5: Hipoglucemia en pacientes con diabetes tipo 1 Hipoglucemia grave Porcentaje de pacientes con al menos 1 Evento/paciente/año evento (n/total N) Estudio A LEVEMIR® dos veces 8.7 0.52 Diabetes tipo 1 al día (24/276) Adultos 10.6 16 semanas NPH dos veces al día 0.43 (14/132) En combinación con insulina aspart ® Estudio B LEVEMIR dos veces 5.0 0.13 Diabetes tipo 1 al día (8/161) Adultos 10.1 26 semanas Glargina una vez al día 0.31 (16/159) En combinación con insulina aspart Estudio C LEVEMIR® una vez 7.5 0.35 Diabetes tipo 1 al día (37/491) Adultos 10.2 24 semanas NPH una vez al día 0.32 (26/256) En combinación con insulina regular Estudio D LEVEMIR® una o dos 15.9 0.91 Diabetes tipo 1 veces al día (37/232) Pediátricos NPH una o dos veces 20.0 26 semanas 0.99 al día (23/115) En combinación con insulina aspart ® Estudio I LEVEMIR una o dos 1.7 0.02 Diabetes tipo 1 veces al día (3/177) Pediátricos NPH una o dos veces 7.1 52 semanas 0.09 al día (12/170) En combinación con insulina aspart Hipoglucemia no grave Porcentaje de pacientes Evento/paciente/año (n/total N) 88.0 26.4 (243/276) 89.4 (118/132) 37.5 82.0 (132/161) 20.2 77.4 (123/159) 21.8 88.4 (434/491) 31.1 87.9 (225/256) 33.4 93.1 (216/232) 31.6 95.7 (110/115) 37.0 94.9 (168/177) 56.1 97.6 (166/170) 70.7 Tabla 6: Hipoglucemia en pacientes con diabetes tipo 2 Estudio E Diabetes tipo 2 Estudio F Estudio H Adultos Diabetes tipo 2 Diabetes tipo 2 24 semanas Adultos Adultos En combinación con fármacos 22 semanas 26 semanas orales En combinación con insulina aspart En combinación con liraglutida y metformina LEVEMIR® dos NPH dos veces LEVEMIR® una o NPH una o dos LEVEMIR® una vez al día + Liraglutida + veces al día al día dos veces al día veces al día liraglutida + metformina metformina Hipoglucemia grave Porcentaje de pacientes con al 0.4 2.5 1.5 4.0 0 0 menos 1 evento (n/total N) (1/237) (6/238) (3/195) (8/199) Evento/paciente/año 0.01 0.08 0.04 0.13 0 0 Hipoglucemia no grave Porcentaje de pacientes (n/ 40.5 64.3 32.3 32.2 9.2 1.3 total N) (96/237) (153/238) (63/195) (64/199) (15/163) (2/158*) Evento/paciente/año 3.5 6.9 1.6 2.0 0.29 0.03 *Un sujeto fue un caso atípico y fue excluido debido a 25 episodios de hipoglucemia que el paciente mismo pudo tratarse. Este paciente tenía antecedentes de hipoglucemias frecuentes antes del estudio. •Inicio del tratamiento con insulina e intensificación del control de la glucosa La intensificación o la mejora rápida del control de la glucosa han sido asociadas con un trastorno de refracción ocular reversible y pasajero, agravamiento de la retinopatía diabética y neuropatía periférica dolorosa aguda. No obstante, el control glucémico a largo plazo disminuye el riesgo de retinopatía y neuropatía diabéticas. •Lipodistrofia El uso a largo plazo de insulina, incluida LEVEMIR®, puede causar lipodistrofia en el lugar donde se inyecta repetidamente la insulina. La lipodistrofia incluye lipohipertrofia (engrosamiento del tejido adiposo) y lipoatrofia (adelgazamiento del tejido adiposo), y puede afectar la absorción de insulina. Se deben rotar los lugares de inyección dentro de la misma región para reducir el riesgo de lipodistrofia [consulte Posología y administración (2.1)]. •Aumento de peso Puede ocurrir aumento de peso con el tratamiento con insulina, incluida LEVEMIR®, y este se ha atribuido a los efectos anabólicos de la insulina y la disminución de la glucosuria [consulte Estudios clínicos (14)]. •Edema periférico La insulina, incluida LEVEMIR®, puede causar retención de sodio y edema, particularmente si un control metabólico deficiente anterior mejora al intensificar el tratamiento insulínico. •Reacciones alérgicas Alergia localizada Como con cualquier tratamiento con insulina, los pacientes que usan LEVEMIR® pueden tener reacciones localizadas en el lugar de la inyección, como eritema, dolor, prurito, urticaria, edema e inflamación. En estudios clínicos con adultos, tres pacientes tratados con LEVEMIR® dijeron tener dolor en el lugar de la inyección (0.25 %) en comparación con un paciente tratado con insulina NPH (0.12 %). Los informes de dolor en el lugar de la inyección no hicieron que se suspenda el tratamiento. La rotación del lugar de inyección dentro de una zona dada entre cada inyección y la siguiente puede contribuir a reducir o evitar estas reacciones. En algunos casos, estas reacciones pueden estar relacionadas con otros factores y no con la insulina, como irritantes contenidos en un limpiador para la piel o una técnica de inyección deficiente. La mayoría de las reacciones menores a la insulina suele resolverse en unos pocos días o semanas. Alergia sistémica Puede ocurrir alergia generalizada potencialmente mortal, incluida anafilaxia, así como reacciones cutáneas generalizadas, angioedema, broncoespasmo, hipotensión y shock con cualquier insulina, incluida LEVEMIR®, y pueden hacer peligrar la vida del paciente [consulte Advertencias y precauciones (5.5)]. •Producción de anticuerpos Todos los productos de insulina pueden generar la producción de anticuerpos contra la insulina. Estos anticuerpos antinsulínicos pueden aumentar o disminuir la eficacia de la insulina y pueden requerir que se ajuste la dosis de insulina. En 3 ensayos clínicos de fase III de LEVEMIR® se observó el desarrollo de anticuerpos sin efecto aparente en el control glucémico. 6.2 Experiencia posterior a la comercialización Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de LEVEMIR®. Debido a que estas reacciones fueron informadas voluntariamente por una población de tamaño incierto, no siempre es posible calcular con seguridad su frecuencia o establecer una relación causal con la exposición al fármaco. Se ha informado de errores en la medicación durante el uso posterior a la aprobación de LEVEMIR®, en los cuales otras insulinas, particularmente insulinas de acción rápida o acción breve, se administraron por error en vez de LEVEMIR® [consulte Información para asesorar al paciente (17)]. Para evitar errores en la medicación entre LEVEMIR® y otras insulinas, se debe indicar a los pacientes que siempre deben verificar la etiqueta de la insulina antes de inyectársela. LEVEMIR® (insulin detemir [rDNA origin] injection) INTERACCIONES CON OTROS MEDICAMENTOS 7 Hay varios medicamentos que afectan el metabolismo de la glucosa y pueden requerir ajustar la dosis de insulina y, particularmente, un control cuidadoso. Los siguientes son ejemplos de medicamentos que pueden aumentar el efecto reductor de la glucemia de las insulinas, incluida LEVEMIR® y, por lo tanto, aumentar la vulnerabilidad a la hipoglucemia: antidiabéticos orales, acetato de pramlintida, inhibidores de la enzima conversora de la angiotensina (IECA), disopiramida, fibratos, fluoxetina, inhibidores de la monoamina oxidasa (IMAO), propoxifeno, pentoxifilina, salicilatos, análogos de la somatostasina y antibióticos sulfonamídicos. Los siguientes son ejemplos de medicamentos que pueden disminuir el efecto reductor de la glucemia de las insulinas, incluida LEVEMIR®: corticoesteroides, niacina, danazol, diuréticos, simpatomiméticos (p. ej., epinefrina, albuterol, terbutalina), glucagón, isoniazida, derivados de la fenotiazida, somatropina, hormonas tiroideas, estrógenos, progestágenos (p. ej., en los anticonceptivos orales), inhibidores de la proteasa y antipsicóticos atípicos (p. ej., olanzapina y clozapina). Los betabloqueantes, la clonidina, las sales de litio y el alcohol pueden incrementar o disminuir el efecto reductor de la glucemia de la insulina. La pentamidina puede causar hipoglucemia, a la que a veces puede seguir hiperglucemia. Los signos de hipoglucemia pueden reducirse o estar ausentes en pacientes que toman medicamentos antiadrenérgicos, como betabloqueantes, clonidina, guanetidina y reserpina. 8 USO EN POBLACIONES ESPECÍFICAS 8.1Embarazo Categoría B para embarazo Resumen de riesgos El riesgo básico de defectos congénitos, aborto espontáneo u otros eventos adversos que existe con todos los embarazos es mayor en los embarazos complicados por hiperglucemia. Se debe informar a las pacientes mujeres que le digan al médico si tienen planes de quedar embarazadas, o si de hecho quedan embarazadas mientras usan LEVEMIR®. Un ensayo clínico aleatorizado controlado de mujeres embarazadas con diabetes tipo 1 que usaban LEVEMIR® durante el embarazo no mostró un aumento en el riesgo de anomalías fetales. Estudios de toxicología reproductiva realizados en ratas y conejos sin diabetes que incluyeron grupos simultáneos de control con insulina humana indicaron que la insulina detemir y la insulina humana tuvieron efectos similares en cuanto a embriotoxicidad y teratogenia que fueron atribuidos a la hipoglucemia materna. Consideraciones clínicas El mayor riesgo de eventos adversos en embarazos complicados por hiperglucemia puede reducirse con un buen control de la glucosa antes de la concepción y durante el embarazo. Debido a que los requisitos de insulina varían durante el embarazo y el puerperio es esencial realizar un control cuidadoso de la glucosa en las mujeres embarazadas. Datos de seres humanos En un estudio clínico abierto, mujeres con diabetes tipo 1 embarazadas (entre 8 y 12 semanas de gestación) o con planes de quedar embarazadas se asignaron de forma aleatoria 1:1 para recibir LEVEMIR® (una o dos veces al día) o insulina NPH (una, dos o tres veces al día). Se administró insulina aspart antes de cada comida. Un total de 152 mujeres en el grupo de LEVEMIR® y 158 en el grupo de NPH estaban o quedaron embarazadas durante el estudio (total de embarazadas = 310). Aproximadamente la mitad de las participantes del estudio en cada grupo fueron aleatorizadas como embarazadas y expuestas a NPH u otras insulinas antes de la concepción y en las primeras 8 semanas de gestación. En las 310 embarazadas, la hemoglobina glucosilada media (HbA1c) fue <7 % a las 10, 12 y 24 semanas de gestación en ambos grupos. En la población con intención de tratar, la HbA1c media (error estándar) en la semana 36 de gestación fue de 6.27 % (0.053) en las pacientes tratadas con LEVEMIR® (n=138) y de 6.33 % (0.052) en las pacientes tratadas con NPH (n=145); la diferencia no fue clínicamente significativa. Las reacciones adversas que ocurrieron en las pacientes embarazadas con una incidencia de ≥5 % se muestran en la tabla 7. Las dos reacciones adversas más frecuentes fueron nasofaringitis y dolor de cabeza. Estas coinciden con los resultados obtenidos en otros ensayos sobre la diabetes (consulte la tabla 1 en la sección 6.1) y no se repiten en la tabla 7. La incidencia de reacciones adversas de preeclampsia fue de 10.5 % (16 casos) y 7.0 % (11 casos) en los grupos de LEVEMIR® e insulina NPH, respectivamente. Del número total de casos de preeclampsia, ocho (8) casos en el grupo de LEVEMIR® y 1 caso en el grupo de insulina NPH requirieron hospitalización. Las incidencias de preeclampsia observadas en el estudio se encuentran dentro de las tasas previstas para embarazos complicados por la diabetes. La preeclampsia es un síndrome definido por síntomas, hipertensión y proteinuria; la definición de preeclampsia no se estandarizó en el ensayo, lo que hizo difícil establecer una conexión entre un tratamiento dado y un mayor riesgo de preeclampsia. Todos los eventos se consideraron improbablemente relacionados con el tratamiento del ensayo. En los nueve (9) casos que requirieron hospitalización las mujeres tuvieron niños sanos. Se registraron eventos de hipertensión, proteinuria y edema con menos frecuencia en el grupo de LEVEMIR® que en el grupo de insulina NPH en total. No hubo diferencia entre los grupos de tratamiento en cuanto a la presión arterial media durante el embarazo y no hubo ninguna indicación de un aumento general en la presión arterial. En el grupo de insulina NPH, hubo 6 reacciones adversas graves en cuatro madres con los siguientes trastornos de la placenta: placenta previa, hemorragia por placenta previa y desprendimiento prematuro de placenta, y una reacción adversa grave de hemorragia prenatal. No ocurrió ninguna en el grupo de LEVEMIR®. La incidencia de muerte fetal (aborto) fue similar en las pacientes tratadas con LEVEMIR® y con NPH; 6.6 % y 5.1 % respectivamente. Los abortos se informaron con los siguientes términos: aborto espontáneo, aborto retenido, aborto espontáneo en el primer trimestre, insuficiencia cervicouterina y aborto incompleto. Tabla 7: Reacciones adversas durante el embarazo en un ensayo de comparación de insulina aspart + LEVEMIR® con insulina aspart + insulina NPH en embarazadas con diabetes tipo 1 (reacciones adversas con una incidencia ≥5 %)* LEVEMIR®, % (n = 152) NPH, % (n = 158) Anemia 13.2 Diarrea 11.8 10.8 5.1 Preeclampsia 10.5 7.0 Infección urinaria 9.9 5.7 Gastroenteritis 8.6 5.1 Dolor abdominal alto 5.9 3.8 Vómitos 5.3 4.4 Aborto espontáneo 5.3 2.5 Dolor abdominal 5.3 6.3 Dolor orofaríngeo 5.3 6.3 4 con el fármaco y con la dosis en la incidencia de fetos con anomalías vesiculares como vesículas biliares pequeñas, bilobuladas, bifurcadas y ausentes con una dosis de 900 nmol/kg/día. Los estudios de desarrollo embriofetal en ratas y conejos que incluyeron grupos simultáneos de control con insulina humana indicaron que la insulina detemir y la insulina humana tuvieron efectos similares en cuanto a embriotoxicidad y teratogenia, lo que sugiere que los efectos observados fueron el resultado de hipoglucemia resultante de la exposición a insulina en animales normales. 8.3 Madres en período de lactancia Se desconoce si LEVEMIR® se excreta en la leche materna. Debido a que muchos fármacos, incluida la insulina humana, se excretan en la leche materna, se debe tener precaución al administrar LEVEMIR® a una mujer que amamanta. Las mujeres diabéticas que estén amamantando pueden requerir ajustes en sus dosis de insulina. 8.4 Uso pediátrico Se han establecido la farmacocinética, la seguridad y la eficacia de inyecciones subcutáneas de LEVEMIR® en pacientes pediátricos (de 2 a 17 años) con diabetes tipo 1 [consulte Farmacología clínica (12.3) y Estudios clínicos (14)]. LEVEMIR® no se ha estudiado en pacientes pediátricos menores de 2 años de edad con diabetes tipo 1. LEVEMIR® no se ha estudiado en pacientes pediátricos con diabetes tipo 2. La recomendación en cuanto a la dosis al pasar de otro tratamiento a LEVEMIR® es la misma que se describió para adultos [consulte Posología y administración (2) y Estudios clínicos (14)]. Como en los adultos, la dosis de LEVEMIR® debe individualizarse en los pacientes pediátricos basándose en las necesidades metabólicas y en un control frecuente de la glucemia. 8.5 Uso geriátrico En ensayos clínicos controlados de comparación de LEVEMIR® con insulina NPH o insulina glargina, 64 de 1624 pacientes (3.9 %) en los ensayos de diabetes tipo 1, y 309 de 1082 pacientes (28.6 %) en los ensayos de diabetes tipo 2 tenían una edad ≥65 años. Un total de 52 pacientes (7 con tipo 1 y 45 con tipo 2) (1.9 %) tenía una edad ≥75 años. No se observaron diferencias generales en cuanto a seguridad o eficacia entre estos pacientes y pacientes más jóvenes, pero las muestras pequeñas de pacientes, particularmente los pacientes con una edad ≥65 años en los ensayos de diabetes tipo 1 y los pacientes con una edad ≥75 años en todos los ensayos limitan las conclusiones. No se puede descartar una mayor sensibilidad en algunos individuos. En los pacientes adultos mayores con diabetes, la dosis inicial, los incrementos en la dosis y las dosis de mantenimiento deben ser conservadores para evitar la hipoglucemia. La hipoglucemia puede ser difícil de reconocer en los adultos mayores. *Debido a que los ensayos clínicos se llevan a cabo según una gran variedad de diseños, a veces es difícil comparar las incidencias de reacciones adversas registradas en un ensayo clínico con las incidencias registradas en otro ensayo clínico, y podrían no reflejar las incidencias que de hecho se observan en la práctica clínica. La proporción de pacientes que tuvieron hipoglucemia grave fue de 16.4 % y 20.9 % en las pacientes tratadas con LEVEMIR® y NPH, respectivamente. La incidencia de hipoglucemia grave fue de 1.1 y 1.2 eventos por año-paciente en las pacientes tratadas con LEVEMIR® y NPH, respectivamente. La proporción y las incidencias de episodios no graves de hipoglucemia fueron similares en ambos 10SOBREDOSIS Un exceso de insulina en relación con la ingesta de alimentos, el grupos de tratamiento (tabla 8). gasto de energía o ambas cosas puede derivar en hipoglucemia Tabla 8: Hipoglucemia en embarazadas con diabetes tipo 1 grave y a veces prolongada y potencialmente mortal. Los episodios Estudio G leves de hipoglucemia generalmente se pueden tratar con glucosa Diabetes tipo 1 oral. Puede ser necesario realizar ajustes en la dosificación del Embarazo medicamento, los patrones de comidas o el ejercicio. En combinación con insulina aspart Los episodios más graves con coma, convulsiones o deterioro neurológico pueden tratarse con glucagón intramuscular/subcutáneo NPH LEVEMIR® o glucosa intravenosa concentrada. Tras una aparente recuperación Porcentaje de de una hipoglucemia, puede necesitarse continuar la observación y pacientes con al 16.4 20.9 una ingesta adicional de carbohidratos para evitar la recurrencia de menos 1 evento (n/ (25/152) (33/158) Hipoglucemia hipoglucemia [consulte Advertencias y precauciones (5.4)]. total N) grave* 11DESCRIPCIÓN Eventos/paciente/ 1.1 1.2 LEVEMIR® (insulin detemir [rDNA origin] injection) es una solución año estéril de insulina detemir para usar como inyección subcutánea. La Porcentaje de insulina detemir es un análogo de insulina humana recombinante 94.7 92.4 pacientes con al de acción prolongada (duración de la acción de hasta 24 horas). (144/152) (146/158) LEVEMIR® se produce mediante un proceso que incluye la expresión Hipoglucemia no menos 1 evento (n/ total N) de ADN recombinante en Saccharomyces cerevisiae seguida de una grave* modificación química. Eventos/paciente/ 114.2 108.4 año La insulina detemir difiere de la insulina humana en que la posición B30 del aminoácido treonina se ha omitido, y la cadena de ácido *Para ver una definición de hipoglucemia grave y no grave consulte la sección 6, graso C14 se ha fijado al aminoácido B29. La fórmula molecular de Hipoglucemia. la insulina detemir es C267H402O76N64S6 y su peso molecular es En aproximadamente un cuarto de los neonatos, se detectó 5916.9. Tiene la siguiente estructura: ® LEVEMIR en la sangre de cordón umbilical a niveles superiores al Figura 1: Fórmula estructural de la insulina detemir nivel de cuantificación (<25 pmol/l). No se observaron diferencias en los desenlaces de los embarazos ni en la salud fetal ni neonatal con el uso de LEVEMIR®. Datos de animales En un estudio de fertilidad y desarrollo embrionario, se administró insulina detemir a ratas hembras antes de la copulación, durante la copulación y a lo largo de la preñez en dosis de hasta 300 nmol/kg/ día (3 veces la dosis humana de 0.5 unidades/kg/día, basada en la LEVEMIR® es una solución acuosa incolora, transparente, neutra relación del área bajo la curva de concentración plasmática y tiempo y estéril. Cada milímetro de LEVEMIR® contiene 100 unidades [ABC]). Dosis de 150 y 300 nmol/kg/día produjeron números de (14.2 mg/ml) de insulina detemir, 65.4 mcg de zinc, 2.06 mg de camadas con anomalías viscerales. Se administraron dosis de hasta m-cresol, 16.0 mg de glicerol, 1.80 mg de fenol, 0.89 mg de fosfato 900 nmol/kg/día (aproximadamente 135 veces la dosis humana sódico dihidrato, 1.17 mg de cloruro de sodio y agua para inyección. de 0.5 unidades/kg/día basada en la relación ABC) a las conejas Puede agregarse ácido clorhídrico y/o hidróxido de sodio para durante la organogénesis. Se observaron aumentos relacionados ajustar el pH. LEVEMIR® tiene un pH de aproximadamente 7.4. LEVEMIR® (insulin detemir [rDNA origin] injection) 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción La principal actividad de la insulina detemir es regular el metabolismo de la glucosa. Las insulinas, incluida la insulina detemir, ejercen su acción específica fijándose a los receptores de insulina. La insulina fijada a los receptores disminuye la glucosa que hay en la sangre al facilitar la captación celular de glucosa en el músculo esquelético y el tejido adiposo y al inhibir la producción de glucosa en el hígado. La insulina inhibe la lipólisis en el adipocito, inhibe la proteólisis e intensifica la síntesis de proteínas. 12.2Farmacodinámica La insulina detemir es un análogo de insulina basal humana soluble de acción prolongada con una duración de la acción de hasta 24 horas. El perfil farmacodinámico de LEVEMIR® es relativamente constante, sin un pico pronunciado. La duración de la acción de LEVEMIR® es mediada por una absorción sistémica retardada de las moléculas de insulina detemir desde el lugar de la inyección debido a la autoasociación de las moléculas del fármaco. Además, la distribución de insulina detemir a los tejidos diana periféricos se enlentece debido a su fijación a la albúmina. La figura 2 muestra los resultados de un estudio en pacientes con diabetes tipo 1 realizado durante un máximo de 24 horas después de la inyección subcutánea de LEVEMIR® o insulina NPH. El tiempo medio entre la inyección y el final del efecto farmacológico de la insulina detemir varió de 7.6 horas a >24 horas (24 horas fue el final del período de observación). Velocidad de infusión de la glucosa (mg/kg/min) Figura 2: Perfiles de actividad en pacientes con diabetes tipo 1 en un estudio de pinzamiento normoglucémico durante 24 horas 6.0 Parámetros farmacodinámicos de LEVEMIR® y NPH LEVEMIR® NPH 0.2 U/kg 0.4 U/kg 0.3 IU/kg 4.0 ABCVIG (mg/kg) 419 1184 743 VIGmáx (mg/kg/min) 1.1 1.7 1.6 2.0 0.0 0 4 8 12 16 20 24 Tiempo desde la inyección de insulina (horas) LEVEMIR® 0.4 unidades/kg LEVEMIR® 0.2 unidades/kg NPH 0.3 unidades internacionales/kg ABCVIG: área bajo la curva para la velocidad de infusión de la glucosa VIGmáx: velocidad de infusión de la glucosa máxima Con las dosis en el intervalo de 0.2 a 0.4 unidades/kg, la insulina detemir ejerce más del 50 % de su efecto máximo desde entre 3 y 4 horas hasta aproximadamente 14 horas después de la administración de la dosis. La figura 3 muestra los resultados en cuanto a la velocidad de infusión de la glucosa de un estudio de pinzamiento normoglucémico de 16 horas en pacientes con diabetes tipo 2. El estudio de pinzamiento terminó al cabo de 16 horas de conformidad con el protocolo. Velocidad de infusión de la glucosa (mg/kg/min) Figura 3: Perfiles de actividad en pacientes con diabetes tipo 2 en un estudio de pinzamiento normoglucémico durante 16 horas 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 Parámetros farmacodinámicos de LEVEMIR® y NPH LEVEMIR® NPH 0.6 U/kg 1.2 U/kg 0.6 IU/kg 1.2 IU/kg ABCVIG (mg/kg) 1359 2333 1900 3220 VIGmáx (mg/kg/min) 2.3 3.7 3.2 4.8 0 2 4 6 8 10 12 14 16 Tiempo desde la inyección de insulina (horas) LEVEMIR® 0.6 unidades/kg LEVEMIR® 1.2 unidades/kg NPH 1.2 unidades NPH 0.6 unidades internacionales/kg internacionales/kg ABCVIG: área bajo la curva para la velocidad de infusión de la glucosa VIGmáx: velocidad de infusión de la glucosa máxima 12.3Farmacocinética Absorción y biodisponibilidad Tras la inyección subcutánea de LEVEMIR® en sujetos sanos y pacientes con diabetes, las concentraciones séricas de insulina detemir tuvieron un perfil de concentración/tiempo relativamente constante a lo largo de 24 horas, alcanzándose la máxima concentración sérica (Cmáx) entre 6 y 8 horas después de la administración de la dosis. La insulina detemir fue absorbida más lentamente tras la administración subcutánea en el muslo, siendo la ABC0-5 h entre 30 y 40 % menor y la ABC0-inf 10 % menor que las ABC correspondientes a inyecciones subcutáneas en las regiones deltoide y abdominal. La biodisponibilidad absoluta de la insulina detemir es de aproximadamente el 60 %. Distribución y eliminación Más del 98 % de la insulina detemir en el torrente sanguíneo se fija a la albúmina. Los resultados de estudios de fijación de proteínas tanto in vitro como in vivo demuestran que no hubo interacción clínicamente relevante entre la insulina detemir y los ácidos grasos u otros fármacos fijados a proteínas. La insulina detemir tiene un volumen de distribución aparente de aproximadamente 0.1 l/kg. Tras la administración subcutánea en pacientes con diabetes tipo 1, la insulina detemir tiene una semivida terminal de 5 a 7 horas dependiendo de la dosis. Poblaciones específicas Niños y adolescentes: las propiedades farmacocinéticas de LEVEMIR® se investigaron en niños (de 6 a 12 años), adolescentes (de 13 a 17 años) y adultos con diabetes tipo 1. En los niños, el área bajo la curva de concentración plasmática y tiempo (ABC) y la Cmáx aumentaron en 10 % y 24 %, respectivamente, en comparación con los adultos. No hubo diferencia en cuanto a la farmacocinética entre adolescentes y adultos. Pacientes geriátricos: en un ensayo clínico en el que se investigaron las diferencias en la farmacocinética de una única dosis subcutánea de LEVEMIR® en sujetos sanos jóvenes (de 20 a 35 años) y adultos mayores (≥68 años), el ABC de la insulina detemir fue más alta en los sujetos adultos mayores debido a una depuración reducida. Al igual que otros preparados de insulina, la dosis de LEVEMIR® siempre debe ajustarse según las necesidades individuales. Sexo: no se observaron diferencias clínicamente significativas en los parámetros farmacocinéticos de LEVEMIR® entre varones y mujeres. Raza: en dos estudios clínicos farmacológicos realizados en sujetos japoneses y caucásicos sanos, no se observaron diferencias clínicamente relevantes en los parámetros farmacocinéticos. La farmacocinética y la farmacodinámica de LEVEMIR® se investigaron en un estudio de pinzamiento en el que se compararon pacientes con diabetes tipo 2 de origen caucásico, afroamericano e hispanoamericano. Las relaciones dosis-respuesta con LEVEMIR® fueron similares entre las tres poblaciones. Insuficiencia renal: se administró una única dosis subcutánea de 0.2 unidades/kg (1.2 nmol/kg de LEVEMIR® a sujetos sanos y sujetos con distintos grados de insuficiencia renal (leve, moderada, grave y dependiente de hemodiálisis). En este estudio, no hubo diferencias en la farmacocinética de LEVEMIR® entre los sujetos sanos y los sujetos con insuficiencia renal. Sin embargo, algunos estudios con insulina humana han mostrado un aumento de las concentraciones circulantes de insulina en pacientes con insuficiencia renal. Puede ser necesario revisar cuidadosamente la glucosa y ajustar la dosis de insulina, incluida LEVEMIR®, en los pacientes con insuficiencia renal [consulte Advertencias y precauciones (5.6)]. Insuficiencia hepática: se administró una única dosis subcutánea de 0.2 unidades/kg (1.2 nmol/kg) de LEVEMIR® a sujetos sanos y sujetos con distintos grados de insuficiencia hepática (leve, moderada y grave). La exposición a LEVEMIR® calculada según el ABC disminuyó de manera inversamente proporcional a la gravedad de la insuficiencia hepática con un aumento correspondiente en la depuración aparente. Sin embargo, algunos estudios con insulina humana han mostrado un aumento de las concentraciones circulantes de insulina en pacientes con insuficiencia hepática. Puede ser necesario revisar cuidadosamente la glucosa y ajustar la dosis de insulina, incluida LEVEMIR®, en los pacientes con insuficiencia hepática [consulte Advertencias y precauciones (5.7)]. Embarazo: no se ha estudiado el efecto del embarazo en la farmacocinética y la farmacodinámica de LEVEMIR® [consulte Uso en poblaciones específicas (8.1)]. Tabaquismo: no se ha estudiado el efecto del tabaquismo en la farmacocinética y la farmacodinámica de LEVEMIR®. 5 Liraglutida: no se observó ninguna interacción farmacocinética entre la liraglutida y LEVEMIR® cuando se administraron inyecciones subcutáneas separadas de LEVEMIR® 0.5 unidades/kg (dosis única) y 1.8 mg de liraglutida (en equilibrio dinámico) a pacientes con diabetes tipo 2. 13 TOXICOLOGÍA PRECLÍNICA 13.1 Carcinogenia, mutagenia, deterioro de la fertilidad No se han realizado estudios estándar de 2 años de carcinogenia en animales. Se obtuvieron resultados negativos en cuanto al potencial genotóxico de la insulina detemir en un estudio de mutación inversa in vitro en bacterias, una prueba de aberración cromosómica en linfocitos de sangre periférica humana y en la prueba de micronúcleos de ratón in vivo. En un estudio de fertilidad y desarrollo embrionario, se administró insulina detemir a ratas hembras antes de la copulación, durante la copulación y a lo largo de la preñez en dosis de hasta 300 nmol/kg/ día (3 veces la dosis humana de 0.5 unidades/kg/día, basada en la relación del área bajo la curva de concentración plasmática y tiempo [ABC]). No se observaron efectos en la fertilidad en ratas. 14 ESTUDIOS CLÍNICOS Se compararon la eficacia y la seguridad de LEVEMIR® administrada una vez al día a la hora de acostarse o dos veces al día (antes del desayuno y a la hora de acostarse, antes del desayuno y con la comida de la noche, o a intervalos de 12 horas) con la administración una vez al día o dos veces al día de insulina NPH en estudios abiertos, aleatorizados, con grupos paralelos, de 1155 adultos con diabetes tipo 1, 347 pacientes pediátricos con diabetes tipo 1 y 869 adultos con diabetes tipo 2. Se compararon la eficacia y la seguridad de LEVEMIR® administrada dos veces al día con insulina glargina en un estudio abierto, aleatorizado, con grupos paralelos de 320 pacientes con diabetes tipo 1. La dosis de la noche de LEVEMIR® se ajustó en todos los ensayos según objetivos predefinidos para la glucemia en ayunas. El valor de glucemia previo a la comida de la noche se usó para ajustar la dosis de la mañana de LEVEMIR® en dichos ensayos, en los que también se administró LEVEMIR® a la mañana. En general, la reducción de la hemoglobina glucosilada (HbA1c) con LEVEMIR® fue similar a la lograda con insulina NPH o insulina glargina. Diabetes tipo 1: pacientes adultos En un estudio clínico abierto de 16 semanas (Estudio A, n=409), se asignó de forma aleatoria a adultos con diabetes tipo 1 a un tratamiento con LEVEMIR® a intervalos de 12 horas, LEVEMIR® administrado a la mañana y a la hora de acostarse, o insulina NPH administrada a la mañana y a la hora de acostarse. También se administró insulina aspart antes de cada comida. Al cabo de 16 semanas de tratamiento, todos los pacientes tratados con LEVEMIR® habían logrado reducciones en la HbA1c y la glucosa plasmática en ayunas (GPA) similares a las de los pacientes tratados con insulina NPH (tabla 9). Las diferencias en cuando al momento de administración de LEVEMIR® no tuvieron efecto en la HbA1c, en la glucosa plasmática en ayunas (GPA) ni en el peso corporal. En un estudio clínico abierto de 26 semanas (Estudio B, n=320), se asignó de forma aleatoria a adultos con diabetes tipo 1 a un tratamiento con LEVEMIR® dos veces al día (administrada a la mañana y a la hora de acostarse) o insulina glargina una vez al día (administrada a la hora de acostarse). Se administró insulina aspart antes de cada comida. Los pacientes tratados con LEVEMIR® lograron una disminución en la HbA1c similar a la de los pacientes tratados con insulina glargina. En un estudio clínico abierto de 24 semanas (Estudio C, n=749), se asignó de forma aleatoria a adultos con diabetes tipo 1 a un tratamiento con LEVEMIR® una vez al día o con insulina NPH administrada una vez al día, ambas administradas a la hora de acostarse y en combinación con insulina humana regular antes de cada comida. LEVEMIR® y la insulina NPH tuvieron un efecto similar en la HbA1c. LEVEMIR® (insulin detemir [rDNA origin] injection) Tabla 9: Diabetes mellitus tipo 1: pacientes adultos Estudio A Duración del tratamiento Tratamiento en combinación con Estudio B 16 semanas 26 semanas 24 semanas NovoLog® (insulina aspart) Insulina humana soluble (insulina regular) NPH dos veces al día LEVEMIR® dos veces al día 276 133 HbA1c al inicio 8.6 Variación media con respecto al valor inicial ajust. -0.8* Número de pacientes tratados *De un modelo ANCOVA ajustado para el valor al inicio, región geográfica, sexo y edad (covariable). **De un modelo ANCOVA ajustado para el valor al inicio, país, estado puberal al inicio y edad (factor de estratificación). Estudio C NovoLog® (insulina aspart) LEVEMIR® dos veces al día Insulina glargina una vez al día LEVEMIR® una vez al día NPH una vez al día 161 159 492 257 8.5 8.9 8.8 8.4 8.3 -0.7* -0.6** -0.5** -0.1* 0.0* HbA1c (%) LEVEMIR® – NPH IC 95 % para la diferencia entre tratamientos -0.2 (-0.3, -0.0) -0.0 (-0.2, 0.2) 6 -0.1 (-0.3, 0.0) Dosis de insulina basal (unidades/día) Valor medio inicial 21 24 27 23 12 24 Variación media con respecto al valor inicial 16 10 10 4 9 2 Valor medio inicial 48 54 56 51 46 57 Variación media con respecto al valor inicial 17 10 9 6 11 3 Valor medio inicial 209 220 153 150 213 206 Variación media con respecto al valor inicial ajust. -44* -9* -38** -41** -30* -9* Dosis total de insulina (unidades/día) Glucemia en ayunas (mg/dl) Peso corporal (kg) Valor medio inicial 74.6 75.5 77.5 75.1 76.5 76.9 Variación media con respecto al valor inicial ajust. 0.2* 0.8* 0.5** 1.0** -0.3* 0.3* *De un modelo ANCOVA ajustado para el valor al inicio y país. **De un modelo ANCOVA ajustado para el valor al inicio y el centro de estudio. Diabetes tipo 1: pacientes pediátricos Se han llevado a cabo dos estudios abiertos, aleatorizados, controlados, en pacientes pediátricos con diabetes tipo 1. Un estudio tuvo una duración de 26 semanas e incluyó pacientes de 6 a 17 años de edad. El otro estudio tuvo una duración de 52 semanas e incluyó pacientes de 2 a 16 años de edad. En ambos estudios, tanto la insulina LEVEMIR® como la NPH se administraron una o dos veces al día. Se administró insulina aspart antes de cada comida. En el estudio de 26 semanas, los pacientes tratados con LEVEMIR® lograron una disminución media en la HbA1c similar a la lograda con la insulina NPH (tabla 10). En el estudio de 52 semanas, la aleatorización se estratificó por edad (2 a 5 años, n=82, y 6 a 16 años, n=265) y la HbA1c media aumentó en ambos grupos de tratamiento, con resultados similares en el grupo de 2 a 5 años de edad (n=80) y en el grupo de 6 a 16 años de edad (n=258) (tabla 10). Tabla 10: Diabetes mellitus tipo 1: pacientes pediátricos Estudio D Estudio I Duración del tratamiento 26 semanas 52 semanas NovoLog® (insulina aspart) Tratamiento en combinación con NovoLog® (insulina aspart) LEVEMIR® una o dos veces al día NPH una o dos veces al día LEVEMIR® una o dos veces al día NPH una o dos veces al día Número de pacientes tratados 232 115 177 170 HbA1c (%) 8.8 8.8 8.4 8.4 HbA1c al inicio Variación media con respecto al -0.7* -0.8* 0.3** 0.2** valor inicial ajust. 0.1 0.1 LEVEMIR® – NPH IC 95 % para la diferencia entre -0.1; 0.4 -0.1; 0.3 tratamientos Dosis de insulina basal (unidades/día) Valor medio inicial 24 26 17 17 8 6 8 7 Variación media con respecto al valor inicial Dosis total de insulina (unidades/día) Valor medio inicial 48 50 35 34 9 7 10 8 Variación media con respecto al valor inicial Glucemia en ayunas (mg/dl) Valor medio inicial 181 181 135 141 Variación media con respecto al -39 -21 -10** 0** valor inicial ajust. Peso corporal (kg) Valor medio inicial 46.3 46.2 37.4 36.5 Variación media con respecto al 1.6* 2.7* 2.7** 3.6** valor inicial ajust. Diabetes tipo 2: pacientes adultos En un estudio clínico abierto, aleatorizado, de 24 semanas (Estudio E, n=476), se comparó LEVEMIR® administrada dos veces al día (antes del desayuno y a la noche) con insulina NPH administrada dos veces al día (antes del desayuno y a la noche) como parte de un régimen de tratamiento en combinación estable con uno o más de los siguientes antidiabéticos: metformina, un secretagogo de insulina o un inhibidor de la alfa-glucosidasa. Ninguno de los pacientes había recibido tratamiento con insulina al momento de la aleatorización. LEVEMIR® y la insulina NPH disminuyeron la HbA1c de manera similar con respecto al valor al inicio (tabla 11). En un estudio clínico abierto, aleatorizado, de 22 semanas (Estudio F, n=395) en adultos con diabetes tipo 2, se administraron LEVEMIR® e insulina NPH una o dos veces al día como parte de un régimen basal-bolo con insulina aspart. Medida por la HbA1c o la GPA, LEVEMIR® tuvo una eficacia similar a la de la insulina NPH. Tabla 11: Diabetes mellitus tipo 2: pacientes adultos Estudio E Estudio F Duración del tratamiento 24 semanas 22 semanas Tratamiento en combinación con antidiabéticos orales insulina aspart LEVEMIR® NPH dos LEVEMIR® NPH una o dos veces veces una o dos dos veces al día al día veces al día al día Número de pacientes tratados 237 239 195 200 HbA1c (%) 8.6 8.5 8.2 8.1 HbA1c al inicio Variación media con respecto al -2.0* -2.1* -0.6** -0.6** valor inicial ajust. LEVEMIR® – NPH -0.1 -0.1 IC 95 % para la diferencia entre (-0.3, 0.0) (-0.2, 0.1) tratamientos Dosis de insulina basal (unidades/día) Valor medio inicial 18 17 22 22 Variación media con respecto al 48 28 26 15 valor inicial Dosis total de insulina1 (unidades/día) 22 22 Valor medio inicial Variación media con respecto al 57 42 valor inicial Glucemia en ayunas2 (mg/dl) Valor medio inicial 179 173 Variación media con respecto al -69* -74* valor inicial ajust. Peso corporal (kg) Valor medio inicial 82.5 82.3 82.0 79.6 Variación media con respecto al 1.2* 2.8* 0.5** 1.2* valor inicial ajust. 1Estudio E: realizado en pacientes sin tratamiento previo con insulina. 2Estudio F: datos de glucemia en ayunas no recopilados. *De un modelo ANCOVA ajustado para valor al inicio, país y categoría de tratamiento antidiabético oral. **De un modelo ANCOVA ajustado para el valor al inicio y país. En combinación con liraglutida y metformina Este ensayo abierto de 26 semanas incluyó 988 pacientes con un control glucémico inadecuado (HbA1c 7-10 %) con metformina (≥1500 mg/día) sola, o un control glucémico inadecuado (HbA1c 7-8.5 %) con metformina (≥1500 mg/día) y una sulfonilurea. Los pacientes que tomaban metformina y una sulfonilurea dejaron de tomar la sulfonilurea y a continuación todos los pacientes ingresaron en un período de 12 semanas en el que recibieron tratamiento adicional con liraglutida a una dosis de 1.8 mg una vez al día. Al final del período inicial, 498 pacientes (50 %) habían alcanzado una HbA1c <7 % con 1.8 mg de liraglutida y metformina y continuaron el tratamiento en un grupo observacional no aleatorizado. Otros 167 pacientes (17 %) se retiraron del ensayo durante el período inicial y aproximadamente la mitad de ellos lo hizo debido a eventos adversos gastrointestinales [consulte Reacciones adversas (6.1)]. Los 323 pacientes restantes con una HbA1c ≥7 % (33 % de los que habían ingresado en el período inicial) fueron aleatorizados a 26 semanas de LEVEMIR® una vez al día administrada por la noche como tratamiento adicional (N=162) o a continuar el tratamiento sin modificar con 1.8 mg de liraglutida y metformina (N=161). La dosis inicial de LEVEMIR® fue de 10 unidades/día y la dosis media al final del período con aleatorización de 26 semanas fue de 39 unidades/ día. Durante el período de tratamiento aleatorizado de 26 semanas, los porcentajes de pacientes que abandonaron debido a que el tratamiento era ineficaz fueron el 11.2 % en el grupo aleatorizado a continuar el tratamiento con 1.8 mg de liraglutida y metformina y el 1.2 % en el grupo asignado al tratamiento adicional con LEVEMIR®. El tratamiento con LEVEMIR® adicional al de 1.8 mg de liraglutida + metformina tuvo como resultado reducciones estadísticamente LEVEMIR® (insulin detemir [rDNA origin] injection) significativas en la HbA1c y la GPA en comparación con la continuación del tratamiento con 1.8 mg de liraglutida + metformina solamente (tabla 12). Desde un peso corporal medio al inicio de 96 kg tras la aleatorización, hubo una reducción de 0.3 kg en los pacientes que recibieron el tratamiento adicional con LEVEMIR® en comparación con una reducción media de 1.1 kg en los pacientes que continuaron con el tratamiento sin modificar de 1.8 mg de liraglutida + metformina solamente. Tabla 12: Resultados de un ensayo abierto de 26 semanas de LEVEMIR® como tratamiento adicional a liraglutida + metformina en comparación con la continuación del tratamiento con liraglutida + metformina solamente en pacientes que no alcanzaron una HbA1c <7 % tras 12 semanas de tratamiento con liraglutida + metformina Estudio H LEVEMIR® una vez al día + Liraglutida + liraglutida + metformina metformina 162 157 Población con intención de tratar (N)a HbA1c (%) (media) Valor al inicio (semana 0) 7.6 7.6 -0.5* 0* Variación media con respecto al valor inicial ajustada -0.5* Diferencia con el grupo de liraglutida + metformina (media de mínimos cuadrados)b Intervalo de confianza 95 % (-0.7, -0.4) 43** 17** Porcentaje de pacientes que alcanzaron una A1c <7 % Glucosa plasmática en ayunas (mg/dl) (media) Valor al inicio (semana 0) 166 159 -38* -7* Variación media con respecto al valor inicial ajustada -31*** Diferencia con el grupo de liraglutida + metformina (media de mínimos b cuadrados) Intervalo de confianza 95 % (-39, -23) aPoblación con intención de tratar usando la última observación en estudio. bMedia de mínimos cuadrados ajustada para el valor al inicio. *De un modelo ANCOVA ajustado para el valor al inicio, país y categoría de tratamiento antidiabético oral previo. **De un modelo de regresión logística ajustado para el valor de HbA1c al inicio. ***Valor de p <0.0001. Embarazo Se realizó un ensayo clínico aleatorizado, abierto, controlado, en mujeres embarazadas con diabetes tipo 1 [consulte Uso en poblaciones específicas (8.1)]. 16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN 16.1Presentación LEVEMIR® se presenta en los siguientes tamaños de envases: cada presentación contiene 100 unidades de insulina detemir por ml (U-100). LEVEMIR® FlexTouch® de 3 ml NDC 0169-6438-10 vial de 10 ml NDC 0169-3687-12 FlexTouch® puede usarse con agujas desechables NovoFine® o NovoTwist®. Cada FlexTouch® es para que use un solo paciente. Nunca se debe compartir LEVEMIR® FlexTouch® con otros pacientes, aunque se cambie la aguja. 16.2Almacenamiento: Los envases sin usar (y sin abrir) de LEVEMIR® deben guardarse en el refrigerador a una temperatura entre 2 °C y 8 °C (de 36 °F a 46 °F). No los guarde en el congelador ni junto al elemento refrigerante del refrigerador. No los congele. No use LEVEMIR® si ha estado congelada. Los envases sin usar (sin abrir) de LEVEMIR® pueden guardarse hasta la fecha de vencimiento impresa en la etiqueta si se guardan en el refrigerador. Guarde los envases sin usar de LEVEMIR® en la caja para que se conserve limpias y protegidos de la luz. Si no es posible refrigerarlos, los envases sin usar (sin abrir) de LEVEMIR® pueden guardarse sin refrigerar a temperatura ambiente, a temperaturas por debajo de 30 °C (86 °F) siempre que se mantengan lo más frescos posible y lejos del calor y la luz directos. Los envases no refrigerados de LEVEMIR® deben desecharse 42 días después de estar fuera del refrigerador, incluso si el inyector FlexTouch® o el vial todavía contiene insulina. Viales: Después del uso inicial, los viales deben guardarse en el refrigerador, nunca en el congelador. Si no es posible refrigerarlo, el vial en uso debe guardarse sin refrigeración a temperatura ambiente, por debajo de 30 °C (86 °F) siempre que se mantenga lo más fresco posible y lejos del calor y la luz directos. Los viales refrigerados de LEVEMIR® deben desecharse 42 días después de su uso inicial. Los viales no refrigerados de LEVEMIR® deben desecharse a los 42 días de estar fuera del refrigerador. LEVEMIR® FlexTouch®: Después de su uso inicial, el LEVEMIR® FlexTouch® NO debe guardarse en el refrigerador y NO debe guardarse con la aguja puesta. Guarde el LEVEMIR® FlexTouch® lejos del calor y la luz directos a temperatura ambiente, por debajo de 30 °C (86 °F). El LEVEMIR® FlexTouch® no refrigerado debe desecharse a los 42 días de estar fuera del refrigerador. Siempre retire la aguja después de cada inyección y guarde el LEVEMIR® FlexTouch® sin la aguja colocada. Esto evita la contaminación y las infecciones, así como la pérdida de insulina, lo que garantiza que la dosis sea exacta. Siempre use una aguja nueva para cada inyección a fin de prevenir la contaminación. Las condiciones de almacenamiento se resumen en la tabla 13. Tabla 13: Condiciones de almacenamiento para LEVEMIR® FlexTouch® y en vial Sin usar Sin usar (sin abrir) En uso (sin abrir) (abierto) A temperatura Refrigerado ambiente (por debajo de 30 °C) 42 días* LEVEMIR® Hasta la fecha de Temperatura ambiente FlexTouch® de 42 días* vencimiento (menos de 30 °C) 3 ml (No refrigerar) 42 días* Hasta la fecha de Refrigerado o a Vial de 10 ml 42 días* vencimiento temperatura ambiente (por debajo de 30 °C) 7 que cuando se inyectan LEVEMIR® deben mantener presionado el botón de inyección hasta que el contador llegue a 0, y luego deben mantener la aguja insertada en la piel mientras cuentan lentamente hasta 6. La dosis completa no se administra cuando el contador regresa a 0 sino 6 segundos después. Si se retira la aguja antes de tiempo, se puede ver un chorro de insulina saliendo de la punta de la aguja. En ese caso, no se habrán administrado la dosis completa (puede que se administren hasta un 20 % menos), y deberán controlarse los niveles de glucosa en sangre con más frecuencia e incluso puede ser necesario que se administren más insulina. •Si no aparece el 0 en el contador de dosis después de mantener presionado el botón de inyección, es posible que el paciente haya usado una aguja obstruida. En ese caso no habrá recibido nada de insulina, aunque el contador de dosis se haya movido de la dosis original que se programó. •Si el paciente usó una aguja obstruida, se le debe indicar que cambie la aguja como se explica en la sección 5 de las instrucciones de uso y que repita todos los pasos indicados en dichas instrucciones comenzando con la sección 1: Cómo preparar el inyector con una aguja nueva. Asegúrese de que el paciente seleccione la dosis completa que necesita. Se debe advertir a las pacientes diabéticas que informen al profesional de la salud si están embarazadas o planean estarlo. Remita a los pacientes a la “Información para el paciente” sobre LEVEMIR® para que vean más información. *El tiempo total que puede permanecer a temperatura ambiente (a menos de 30 °C) es de 42 días, independientemente de si el producto está en uso o sin usar. 16.3 Preparación y manipulación Los productos farmacéuticos parenterales deben inspeccionarse visualmente para ver si presentan partículas o cambios de color antes de su administración, siempre que la solución y el envase lo permitan. LEVEMIR® debe inspeccionarse visualmente antes de su administración y solo debe usarse si la solución se ve clara e incolora. Mezcla y dilución: LEVEMIR® NO debe mezclarse ni diluirse con otra insulina o solución [consulte Advertencias y precauciones (5.3)]. 17 INFORMACIÓN PARA ASESORAR AL PACIENTE Consulte la documentación sobre el producto autorizada por la FDA para el paciente (Información para el paciente e Instrucciones de uso). 17.1 Nunca se debe compartir un inyector LEVEMIR® FlexTouch® con otros pacientes Advierta a los pacientes que nunca deben compartir LEVEMIR® FlexTouch® con otra persona, aunque se cambie la aguja, porque al hacerlo se corre el riesgo de transmitir patógenos sanguíneos. 17.2 Instrucciones para los pacientes Se debe informar a los pacientes que los regímenes de insulina deben modificarse cuidadosamente y solo bajo supervisión médica. Además, se les debe informar sobre los posibles efectos secundarios del tratamiento insulínico, que incluyen hipoglucemia, aumento de peso, lipodistrofia (y la necesidad de rotar los sitios de inyección dentro de la misma región del cuerpo) y reacciones alérgicas. Se debe informar a los pacientes que la hipoglucemia puede afectar la capacidad de concentración y reacción del paciente. Esto puede resultar riesgoso en situaciones en las que estas capacidades son especialmente importantes, como al conducir u operar maquinaria. A los pacientes que tienen hipoglucemia con frecuencia o que tienen síntomas de hipoglucemia que son leves o escasos se les debe advertir que tengan cuidado al conducir u operar maquinaria. Se ha informado de casos en que se ha usado equivocadamente LEVEMIR® en vez de otras insulinas, particularmente las de acción breve, y viceversa. Para evitar errores en la medicación entre LEVEMIR® y otras insulinas, se debe indicar a los pacientes que siempre deben verificar la etiqueta de la insulina antes de inyectársela. LEVEMIR® solo debe usarse si la solución está transparente e incolora, sin partículas visibles. Se debe advertir a los pacientes que LEVEMIR® NO debe diluirse ni mezclarse con ninguna otra insulina o solución. Se debe enseñar a los pacientes los procedimientos de manejo personal de la diabetes, que incluyen controlarse los niveles de glucosa, emplear la técnica de inyección adecuada y tratar la hipoglucemia e hiperglucemia. Es necesario enseñarles a manejar situaciones especiales como afecciones intercurrentes (enfermedades, estrés o alteraciones emocionales), si se administran una dosis inadecuada de insulina u olvidan administrársela, o se administran una dosis mayor de insulina accidentalmente, consumen alimentos inadecuados o se saltean comidas. Los pacientes deben recibir una instrucción adecuada sobre el uso de LEVEMIR® de la manera correcta. Enséñeles a los pacientes Novo Nordisk®, Levemir®, NovoLog®, FlexTouch®, NovoFine® y NovoTwist® son marcas registradas de Novo Nordisk A/S. LEVEMIR® está cubierta por las patentes de EE. UU. n.° 5,750,497, 5,866,538, 6,011,007, 6,869,930 y otras patentes en trámite. FlexTouch® está cubierta por las patentes de EE. UU. n.° 7,686,786, 6,899,699, 8,672,898, 8,684,969 y otras patentes en trámite. Fabricada por: Novo Nordisk A/S DK-2880 Bagsvaerd, Dinamarca Para obtener información sobre LEVEMIR® póngase en contacto con: Novo Nordisk Inc. 800 Scudders Mill Road Plainsboro, New Jersey 08536 1-800-727-6500 www.novonordisk-us.com © 2005-2015 Novo Nordisk 0315-00025983-14/2015 LEVEMIR® (insulin detemir [rDNA origin] injection) 8 Información para el paciente LEVEMIR® (insulin detemir [rDNA origin] injection) No comparta su Levemir® FlexTouch® con otras personas, aunque se haya cambiado la aguja. Puede contagiar una infección grave a otra persona o se la pueden contagiar a usted. ¿Qué es Levemir®? •Levemir® es una insulina artificial que se usa para controlar los niveles elevados de azúcar en sangre en adultos y niños con diabetes mellitus. •Levemir® no se indica para tratar la cetoacidosis diabética. ¿Quiénes no deben usar Levemir®? No use Levemir® si: •tiene alergia al Levemir® o a alguno de sus ingredientes. Antes de usar Levemir®, informe a su proveedor de servicios médicos acerca de todas sus afecciones de salud, incluso: •si está embarazada, tiene pensado quedar embarazada o si está amamantando; •si está tomando algún medicamento nuevo de venta con o sin receta, incluidos suplementos. Antes de usar Levemir®, hable con su proveedor de servicios médicos sobre los niveles bajos de azúcar en sangre y cómo controlarlos. ¿Cómo debo usar Levemir®? •Lea las instrucciones de uso que vienen con su Levemir®. •Use Levemir® exactamente como le haya indicado su proveedor de servicios médicos. •Conozca el tipo y la potencia de la insulina que usa. No cambie de tipo de insulina que usa a menos que su proveedor de servicios médicos se lo indique. Si cambia a otro tipo diferente de insulina podría tener que cambiar la cantidad de insulina y el momento en que se la administra. •Revise sus niveles de azúcar en sangre. Pregúntele a su proveedor de servicios médicos cuáles deben ser sus niveles de azúcar en sangre y cuándo debe revisárselos. •No vuelva a utilizar sus agujas o jeringas ni las comparta con otras personas. Puede contagiar una infección grave a otra persona o se la pueden contagiar a usted. •Nunca se inyecte Levemir® en una vena o un músculo. ¿Qué debo evitar mientras uso Levemir®? Mientras use Levemir®: •No conduzca vehículos ni maneje maquinarias pesadas hasta saber qué efectos tiene en su organismo. •No beba alcohol ni utilice medicamentos que contengan alcohol. ¿Cuáles son los posibles efectos secundarios de Levemir®? Levemir® puede producir efectos secundarios graves que pueden causar la muerte, incluso: Bajo nivel de azúcar en sangre (hipoglucemia). Los signos y síntomas de un nivel bajo de azúcar en sangre incluyen: •mareos o vahídos •visión borrosa •ansiedad, irritabilidad o cambios de humor •sudoración •habla arrastrada •hambre •confusión •temblores •dolor de cabeza •frecuencia cardíaca acelerada Puede ser necesario que deba modificar la dosis de insulina que usa debido a: •un cambio en el nivel de actividad física, aumento o pérdida de peso, aumento del estrés, enfermedad o cambios en la dieta •cambio en la dieta •aumento del estrés •aumento o pérdida de peso •enfermedad Otros efectos secundarios frecuentes de Levemir® pueden ser: •reacciones en el lugar de la inyección, picazón, sarpullido, reacciones alérgicas graves (reacciones en todo el cuerpo), engrosamiento de la piel o depresiones de la piel en el lugar de la inyección (lipodistrofia), aumento de peso e hinchazón de las manos y los pies. Obtenga asistencia médica de emergencia si tiene: •dificultad para respirar, falta de aliento, frecuencia cardíaca acelerada, hinchazón en la cara, la lengua o la garganta, sudoración, somnolencia extrema, mareos o confusión. Estos no son todos los posibles efectos secundarios de Levemir®. Llame a su médico para obtener asesoramiento sobre los efectos secundarios. Puede informar efectos secundarios a la FDA llamando al 1-800-FDA-1088. Información general sobre el uso seguro y eficaz de Levemir®. Los medicamentos a veces se recetan para otros fines que no son los mencionados en el folleto de información para el paciente. Puede pedir al farmacéutico o proveedor de servicios médicos información sobre Levemir® que está escrita para profesionales de la salud. No use Levemir® para una afección para la cual no fue recetado. No les dé Levemir® a otras personas, aunque tengan los mismos síntomas que usted. Puede causarles daño. ¿Qué ingredientes contiene Levemir®? Ingrediente activo: insulina detemir (origen ADNr) Excipientes: zinc, m-cresol, glicerol, fenol, fosfato sódico dihidrato, cloruro de sodio y agua para inyección. Puede agregarse ácido clorhídrico y/o hidróxido de sodio para ajustar el pH. Fabricado por: Novo Nordisk A/S DK-2880 Bagsvaerd, Dinamarca Para obtener más información, visite www.novonordisk-us.com o llame 1-800-727-6500. Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU. Revisado: 02/2015 FlexTouch® y Levemir® son marcas registradas de Novo Nordisk A/S. © 2005-2015 Novo Nordisk 0315-00025983-1 4/2015 LEVEMIR® (insulin detemir [rDNA origin] injection) Instrucciones de uso para el paciente LEVEMIR® vial de 10 ml Lea cuidadosamente las siguientes instrucciones de uso antes de usar un vial de 10 ml de LEVEMIR® y cada vez que renueve la receta. Debe leer las instrucciones incluidas en este manual aunque haya usado viales de insulina de 10 ml antes. ¿Cómo debo usar el vial de 10 ml de LEVEMIR®? Uso del vial de 10 ml: 1. Asegúrese de tener el tipo correcto de insulina. Esto es especialmente importante si usa distintos tipos de insulina. 2. Observe el vial y la insulina. La insulina LEVEMIR® debe ser transparente e incolora. La tapa a prueba de adulteración debe estar intacta antes de usar el vial por primera vez. Si antes de usar el vial por primera vez, nota que se ha quitado la tapa o que la insulina está turbia o tiene algún color, no use la insulina y devuélvala a la farmacia. 3. Lávese las manos con agua y jabón. 4. Si está usando un vial nuevo, quite la tapa a prueba de adulteración. Antes de cada uso, limpie el tapón de goma con un pañito con alcohol. 4A 4B 10.Si hay burbujas de aire, golpetee levemente la jeringa con un dedo para que las burbujas de aire suban a la parte superior de la aguja. Presione lentamente el émbolo hasta la marca de la unidad correcta para su dosis. 9 10 11.Verifique que tenga la dosis correcta de LEVEMIR® en la jeringa. 12.Retire la jeringa del vial. 13.Inyecte LEVEMIR® de inmediato como le haya indicado su proveedor de servicios médicos. ¿Cómo debo inyectarme LEVEMIR® con una jeringa? Si limpia el sitio de inyección con un pañito con alcohol, permita que el sitio de la inyección se seque antes de inyectar. Pregunte al proveedor de servicios médicos cómo rotar los sitios de inyección y cómo administrar las inyecciones. 1. Tome un pellizco de piel 1 entre dos dedos, inserte la aguja en el pliegue de piel con un movimiento de lanzar un dardo y presione el émbolo para inyectar insulina bajo la piel. La aguja penetrará en línea recta. 2. Mantenga la aguja insertada en la piel durante al menos 6 segundos para asegurarse de haber inyectado toda la insulina. Una vez que haya retirado la aguja de la piel, es posible que haya una gota de LEVEMIR® en la punta de la aguja. Esto es normal y no afecta la dosis que acaba de aplicar. 5. No remueva ni agite el vial. Si se agita el vial justo antes de extraer la dosis con la jeringa se pueden formar burbujas o espuma. Esto podría hacer que se extraiga una dosis de insulina equivocada. La insulina debe usarse solamente si está transparente e incolora. 6. Jale del émbolo de la jeringa hasta que la punta negra llegue a la marca del número de unidades que se inyectará. 7. Inserte la aguja en el tapón de goma del vial. 8. Empuje el émbolo hasta el fondo. Esto hace que entre aire en el vial. 6 3. Si aparece sangre después de que retira la aguja de la piel, presione levemente sobre el sitio de inyección con un pañito con alcohol. No frote la zona. 4. Después de la inyección, retire la aguja, no la vuelva a tapar y deséchela en un recipiente a prueba de pinchazos. Las jeringas, agujas y lancetas deben colocarse en un envase para instrumentos afilados (como los recipientes rojos para elementos biopeligrosos), un envase de plástico duro (como una botella de detergente) o un recipiente de metal (como una lata de café vacía). Dichos envases deben sellarse y desecharse de la manera adecuada. 7 8 Revisado: marzo de 2013 Novo Nordisk® y LEVEMIR® son marcas registradas de Novo Nordisk A/S. LEVEMIR® está cubierto por las patentes de EE. UU. n.° 5,750,497, 5,866,538, 6,011,007, 6,869,930 y otras patentes en trámite. 9. Voltee el vial y la jeringa y jale lentamente del émbolo hasta unas pocas unidades más de la dosis correcta que necesita. 9 Fabricado por: Novo Nordisk A/S DK-2880 Bagsvaerd, Dinamarca Para obtener información sobre LEVEMIR® póngase en contacto con: Novo Nordisk Inc. 800 Scudders Mill Road Plainsboro, New Jersey 08536 © 2005-2015 Novo Nordisk 0315-00025983-1 4/2015 LEVEMIR® (insulin detemir [rDNA origin] injection) 250 NovoFine® NovoFine® Plus 150 Paso 4: •Inserte la aguja tapada dentro del inyector y enrosque la aguja hasta que quede firme (vea la figura E). 250 (Figura D) 200 NovoTwist® 50 NovoFine® NovoFine® Plus Paso 9: •Sostenga el inyector con la aguja apuntando hacia arriba. Mantenga presionado el botón Z hasta que el contador de dosis muestre el "0". El "0" debe estar alineado con el indicador de dosis. •Se debe ver una gota de insulina en la punta de la aguja (vea la figura J). Si no ve una gota de insulina, repita los pasos 7 a 9, no más de 6 veces. Si aún así no ve una gota de insulina, cambie la aguja y repita los pasos 7 a 9. 100 Paso 3: •Seleccione una aguja nueva. •Desprenda la aleta de papel de la tapa exterior de la aguja (vea la figura D). (Figura C) NovoTwist® (Figura J) Seleccione la dosis: (Figura E) Paso 5: •Retire la tapa exterior de la aguja. No la deseche (vea la figura F). NovoFine® NovoFine® Plus NovoTwist® (Figura F) Paso 6: •Retire la tapa interior de la aguja y deséchela (vea la figura G). NovoFine® NovoFine® Plus NovoTwist® Paso 10: •Gire el selector de dosis para seleccionar el número de unidades que necesita inyectar. El indicador de dosis debe estar alineado con su dosis (vea la figura K). Si selecciona la dosis incorrecta, puede girar el selector de dosis hacia adelante o hacia atrás hasta la dosis correcta. En el dial se muestran los números pares. Los números impares se muestran en forma de líneas. 0 2 Ejemplos 3 4 6 5 unidades seleccionadas 22 24 26 24 unidades seleccionadas (Figura K) Tapa al inyector (Figura G) (Figura A) 0 2 Indicador de dosis Botón de inyección 0 2 0 2 4 Ejemplo: quedan unas 200 unidades 250 injection Paso 7: •Gire el selector de dosis hasta seleccionar 2 unidades (vea la figura H). 2 unidades seleccionadas (Figura H) 200 250 150 200 50 100 Levemir® ® FlexTouch insulin detemir (rDNA origin) Cebado del inyector Levemir® FlexTouch®: 150 Contador Selector de dosis de dosis 100 Visualizador de insulina •El medidor de insulina del inyector Levemir® FlexTouch® muestra cuánta insulina queda en el inyector (vea la figura L). 50 Medidor de insulina 150 (Figura I) Paso 2: •Observe el líquido en el inyector (vea la figura C). Levemir® debe estar transparente e incolora. No la use si está turbia o tiene algún color. Aleta Aguja de papel NovoTwist ® Tapa exterior Tapa interior Aleta de la aguja de la aguja Aguja de papel 200 NovoFine® Plus Tapa exterior Tapa interior de la aguja de la aguja (Figura B) 0 2 •No comparta su inyector Levemir® FlexTouch® con otras personas, aunque se haya cambiado la aguja. Puede contagiar una infección grave a otra persona o se la pueden contagiar a usted. •El inyector Levemir® FlexTouch® es un dispositivo precargado en forma de pluma que contiene 300 unidades de Levemir ® (100/ml) (insulin detemir [rDNA origin] injection). Puede inyectar de 1 a 80 unidades en una sola inyección. •No se recomienda que use el inyector una persona ciega o con problemas de la vista sin la ayuda de una persona que haya aprendido a usar el producto de la manera correcta. Implementos que necesitará para administrar la inyección de Levemir®: •el inyector Levemir® FlexTouch® •una aguja nueva NovoFine®, NovoFine® Plus o NovoTwist® •un pañito con alcohol •un envase para instrumentos afilados para desechar los inyectores y agujas usados. Vea “Cómo desechar los inyectores y agujas de Levemir® FlexTouch®” al final de estas instrucciones. Preparación del inyector Levemir® FlexTouch®: •Lávese las manos con agua y jabón. •Antes de comenzar a preparar la inyección, verifique la etiqueta del inyector Levemir® FlexTouch® para asegurarse de estar usando el tipo correcto de insulina. Esto es especialmente importante si usa más de 1 tipo de insulina. •Levemir® debe estar transparente e incolora. No use Levemir® si está espesa o turbia o si tiene algún color. •No use Levemir® pasada la fecha de vencimiento impresa en la etiqueta o 42 días después de haber comenzado a usar el inyector. •Siempre use una aguja nueva para cada inyección para garantizar la esterilidad y evitar obstrucciones. No vuelva a utilizar las agujas ni las comparta con otras personas. Puede contagiar una infección grave a otra persona o se la pueden contagiar a usted. NovoFine® Tapa exterior Tapa interior Aleta de de la aguja de la aguja Aguja papel Paso 8: •Sostenga el inyector con la aguja apuntando hacia arriba. Golpetee la parte superior del inyector varias veces para que las burbujas de aire suban (vea la figura I). 50 Paso 1: •Quite la tapa al inyector (vea la figura B). 100 Lea esto antes de usar por primera vez Instrucciones de uso Inyector Levemir® FlexTouch® (insulin detemir [rDNA origin] injection) 10 (Figura L) LEVEMIR® (insulin detemir [rDNA origin] injection) 4 6 8 50 NovoFine® NovoFine® Plus NovoTwist® (Figura R) (Figura S) Paso 16: •Vuelva a tapar el inyector empujando la tapa en línea recta (vea la figura T). 0 2 (Figura N) (Figura T) 250 0 2 200 150 100 50 (Figura O) Cuente lentamente: 1-2-3-4-5-6 0 2 Paso 13: •Mantenga presionado el botón hasta que el contador de dosis muestre el "0" (vea la Figura O). El "0" debe estar alineado con el indicador de dosis. Es posible que oiga o sienta un clic. •Mantenga la aguja insertada en la piel hasta que el contador haya regresado a "0" y lentamente cuente hasta 6 (vea la figura P). Cuando el contador de dosis regrese a “0”, no obtendrá la dosis completa hasta 6 segundos después. Si se retira la aguja antes contar hasta 6, se puede ver un chorro de insulina saliendo de la punta de la aguja. Paso 15: •Retire la aguja del inyector cuidadosamente y deséchela (vea la figura R). No vuelva a tapar la aguja. Si vuelve a tapar la aguja podría lastimarse. •Si no tiene un envase para instrumentos afilados, deslice la aguja con cuidado dentro de la tapa externa de la aguja (vea la figura S). Retire cuidadosamente la aguja del inyector y deséchela cuanto antes. No guarde el inyector con la aguja puesta. Al guardar el inyector sin la aguja puesta contribuirá a evitar que pierda, que se obstruya la aguja y que penetre aire en el inyector. 150 150 100 (Figura Q) 150 250 200 50 50 Paso 12: •Inserte la aguja en la piel (vea la figura N). Asegúrese de ver bien el contador de dosis. No lo tape con los dedos, ya que esto podría impedir que aplique la inyección. 100 50 (Figura M) 200 150 100 Paso 11: •Elija el lugar para inyectar y limpie la piel con un pañito con alcohol. Deje que se seque antes de inyectar la dosis (vea la figura M). •Guarde los inyectores Levemir® FlexTouch® sin usar en el refrigerador a una temperatura de 36 °F a 46 °F (2 °C a 8 °C). •Guarde el inyector que está usando actualmente fuera del refrigerador a menos de 86 °F. •No congele Levemir®. No use Levemir® si ha estado congelada. •Mantenga Levemir® lejos del calor y la luz. •Los inyectores sin usar pueden guardarse hasta la fecha de vencimiento impresa en la etiqueta si se guardan en el refrigerador. •El inyector Levemir® FlexTouch® que está usando debe desecharse después de 42 días, incluso si todavía contiene insulina. Información general sobre el uso seguro y eficaz de Levemir®. •Guarde los inyectores Levemir® FlexTouch® y las agujas fuera del alcance de los niños. •Siempre use una aguja nueva para cada inyección. •No comparta su inyector Levemir® FlexTouch® ni las agujas con otras personas. Puede contagiar una infección grave a otra persona o se la pueden contagiar a usted. 250 50 Aplicación de la inyección: •Inyecte Levemir® exactamente como le haya mostrado el proveedor de servicios de salud. Su proveedor de servicios de salud le dirá si necesita pellizcar la piel antes de inyectar. •Levemir® puede inyectarse bajo la piel (vía subcutánea) de la zona del abdomen, la parte superior de las piernas (muslos) o la parte superior de los brazos. •Al aplicar cada inyección cambie (rote) el lugar donde inyecta dentro de la zona de piel que use. No use el mismo lugar para cada inyección. Paso 14: •Retire la aguja de la piel (vea la figura Q). Si aparece sangre después de que retira la aguja de la piel, presione levemente sobre el sitio de inyección con un pañito con alcohol. No frote la zona. 100 •Para ver cuánta insulina queda en su inyector Levemir® FlexTouch®: Gire el selector hasta que se detenga. El contador de dosis se alineará con el número de unidades de insulina que quedan en el inyector. Si el contador indica 80, quiere decir que quedan al menos 80 unidades en el inyector. Si el medidor de dosis indica menos de 80, el número que aparece en el contador de dosis es el número de unidades que quedan en el inyector. 11 250 200 150 100 50 (Figura P) Si ve un chorro de insulina saliendo de la punta de la aguja, es que no se administró la dosis completa. Si eso sucede, debe controlarse los niveles de azúcar en la sangre con más frecuencia porque puede necesitar más insulina. Después de la inyección: •Inmediatamente después de usarlos, puede colocar el inyector Levemir® FlexTouch® y las agujas en un envase para instrumentos afilados aprobado por la FDA. No deseche (bote) agujas sueltas ni inyectores en la basura común. •Si no tiene un envase para instrumentos afilados aprobado por la FDA, puede usar un recipiente que: esté fabricado de plástico resistente; se pueda cerrar con una tapa que cierre firmemente y sea resistente a los pinchazos, de modo que los objetos filosos no puedan salir; se mantenga vertical y estable durante el uso; no pierda; esté debidamente etiquetado para advertir de residuos peligrosos dentro del recipiente. •Cuando el envase para instrumentos afilados esté casi lleno, deberá seguir las normas de su comunidad para desechar correctamente el envase para instrumentos afilados. Podría haber leyes estatales o locales que indiquen cómo desechar agujas y jeringas. No vuelva a utilizar las agujas o jeringas ni las comparta con otras personas. Para obtener más información sobre cómo desechar objetos afilados, y para obtener información específica sobre cómo desecharlos en el estado en que vive, visite el sitio web de la FDA http://www.fda.gov/ safesharpsdisposal. •No deseche el envase para instrumentos afilados en la basura común a menos que las normas de su comunidad lo permitan. No recicle el envase para instrumentos afilados. ¿Cómo debo guardar mi inyector Levemir® FlexTouch®? Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU. Fabricado por: Novo Nordisk A/S DK-2880 Bagsvaerd, Dinamarca Revisado: 02/2015 Para obtener más información visite www.novotraining.com/levemirflextouch/us02 © 2005-2015 Novo Nordisk 0315-00025983-1 4/2015
© Copyright 2026