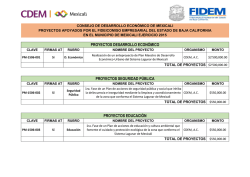
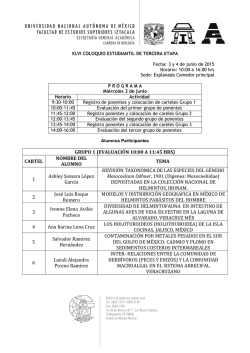
INSTITUTO POLITÉCNICO NACIONAL
SIP-14 BIS INSTITUTO POLITÉCNICO NACIONAL SECRETARIA DE INVESTIGACIÓN Y POSGRADO ACTA DE REVISIÓN DE TESIS La Paz, B.C.S., 12:00 En la Ciudad de siendo las horas del día 25 del mes de Octubre del 2011 se reunieron los miembros de la Comisión Revisora de Tesis designada por el Colegio de Profesores de Estudios de Posgrado e Investigación de CICIMAR para examinar la tesis titulada: "FAUNA HELMÍNTICA EN QUETOGNATOS DEL NORTE DE QUINTANA ROO, MÉXICO (2004 Y 2005)" Presentada por el alumno: LOZANO Apellido paterno COBO HORACIO materno nombre(s) Con registro: B 9 1 1 3 j 7 Aspirante de: MAESTRIA EN CIENCIAS EN MANEJO DE RECURSOS MARINOS Después de intercambiar opiniones los miembros de la Comisión manifestaron APROBAR LA DEFENSA DE LA TESIS, en virtud de que satisface los requisitos señalados por las disposiciones reglamentarias vigentes. LA COMISION REVISORA Directores de Tesis — DRA. LAURA SA CHEZ VELASCO Directora de Tesis Ik/1 MC. MARIA DEL CARMEN GÓMEZ DEL PRADO ROSAS 'rectora de Tesis MC. GUS AVO DE LA CRUZ AGÜERO DR. JAIME GOMEiGUTJR . JUAN CARLOS PÉREZ URBIOLA CU Itto PRESIDENTE DEL C EGIO DE PROFESOR 'O 11. DRA. MARÍA M • GARIT . CAS S VALDEZ ‘4,113V 4"I":',7C0 IPN CICIMAR DIRECCION INSTITUTO POLITÉCNICO NACIONAL SECRETARÍA DE INVESTIGACIÓN Y POSGRADO CARTA CESIÓN DE DERECHOS En la Ciudad de La Paz, B.C.S., el día 24 del mes el (la) que suscribe Programa de Noviembre BM. HORACIO LOZANO COBO del año 2011 alumno(a) del MAESTRÍA EN CIENCIAS EN MANEJO DE RECURSOS MARINOS con número de registro B091373 adscrito al CENTRO INTERDISCIPLINARIO DE CIENCIAS MARINAS manifiesta que es autor (a) intelectual del presente trabajo de tesis, bajo la dirección de: DRA. LAURA SÁNCHEZ VELASCO y MC. MARÍA DEL CARMEN GÓMEZ DEL PRADO ROSAS y cede los derechos del trabajo titulado: "FAUNA HELMÍNTICA EN QUTOGNATOS DEL NORTE DE QUINTANA ROO, MÉXICO (2004 Y 2005)" al Instituto Politécnico Nacional, para su difusión con fines académicos y de investigación. Los usuarios de la información no deben reproducir el contenido textual, gráficas o datos del trabajo sin el permiso expreso del autor y/o director del trabajo. Éste, puede ser obtenido escribiendo a la — [email protected] -....... [email protected] Si el permiso se otorga, el usuario deberá dar el agradecimiento correspondiente y citar la fuente del mismo. siguiente dirección: [email protected] BM. HORACIO LOZANO COBO nombre y firma INSTITUTO POLITECNICO NACIONAL CENTRO INTERDISCIPLINARIO DE CIENCIAS MARINAS FAUNA HELMÍNTICA EN QUETOGNATOS DEL NORTE DE QUINTANA ROO, MÉXICO (2004 Y 2005) TESIS QUE PARA OBTENER EL GRADO DE MAESTRO EN CIENCIAS EN RECURSOS MARINOS PRESENTA HORACIO LOZANO COBO LA PAZ, B.C.S., DICIEMBRE DE 2011 CONTENIDO Página NOMENCLATURA DE LAS FIGURAS …………………………………………. I LISTA DE FIGURAS ……………………………………………………………… III LISTA DE TABLAS ……………………………………………………………… VI RESUMEN ………………………………………………………………………… VIII ABSTRACT ……………………………………………………………………….. X 1.- INTRODUCCIÓN ..……………………………………………………………. 1 2.- ANTECEDENTES ..……………………………………………………………. 3 2.1.- A nivel mundial ………………………………………………………….. 3 2.2.- En México ……………………………………………………………….. 5 3.- ÁREA DE ESTUDIO …………………………………………………………… 5 3.1.- Ubicación geográfica …………………………………………………… 5 4.- PLANTEAMIENTO DEL PROBLEMA E HIPOTESIS ….…………………… 6 5.- OBJETIVOS .…………………………………………………………………….. 7 5.1.- General …………………………………………………………………….. 7 5.2.- Particulares …..…………………………………………………………….. 8 6.- MATERIAL Y MÉTODOS …………………………………………………… 8 6.1.- Descripción de las estaciones de muestreo …………………………… 8 6.2.1.- Trabajo de campo ……………………………………………………. 10 6.2.2- Revisión e identificación de los quetognatos ……………………… 11 6.3.- Parámetros ecológicos de parasitismo ………………………………….. 12 6.4.1.- Técnica parasitológica basada en Salgado-Maldonado, 1979 .….. 12 6.4.2.- Identificación helmíntica .……………….…………………………….. 13 6.4.3.- Descripción helmíntica .………………………………………………. 13 6.5.1.- Análisis multivariados entre variables biológicas y físicas ..……... 13 6.5.2.- Grupos de especies de quetognatos y parásitos ...………………..… 14 6.5.3.- Procedimiento de Permutación de Multi-Respuesta (PPMR) ………. 15 6.5.4.- Relaciones entre los grupos de quetognatos y parásitos definidos con las variables ambientales …………………………………………. 7.- RESULTADOS ………………………………………………………………… 15 16 7.1.1.- Composición taxonómica de los quetognatos ...……………………. 16 7.1.2.- Captura y abundancia de los quetognatos ...………………………. 16 7.1.3.- Prevalencia de parasitismo de los quetognatos …………………… 17 7.2.1.- Distribución espacial de los quetognatos capturados y parasitados …………………………………………………………………….. 17 7.2.2.- Distribución temporal de los quetognatos capturados y parasitados …………………………………………………………………….. 7.2.3.- Prevalencia de parasitismo espacial y temporal (2004 y 2005) …. 18 19 7.3.- Parámetros ecológicos: abundancia, prevalencia e intensidad media de parasitismo de cada especie de quetognato …………...… 29 7.4.- Descripción de las características morfológicas y anatómicas de los parásitos encontrados en ambos años ………………………… 44 7.4.1.- Phylum Platyhelminthes ………………………………………………. 44 7.4.1.1.- Clase Monogenea ………………………………………………….. 44 Larva de Monopisthocotylea …………………………………………… 44 Descripción ……………………………………………………... 44 Revisión taxonómica y parámetros ecológicos de parasitismo …. 7.4.1.2.- Clase Trematoda …………………………………………………… Distoma tipo A …………………………………………………………… Descripción …………………………………………………………. Distoma tipo B …………………………………………………………… Descripción …………………………………………………………. 45 46 46 46 47 47 Distoma tipo C …………………………………………………………... 48 Descripción ………………………………………………………….. 48 Distoma tipo D …………………………………………………………… 49 Descripción ………………………………………………………… Distoma tipo E ……………………………………………………………. Descripción …………………………………………………………. 49 50 50 Distoma tipo F ……………………………………………………………. 51 Descripción ………………………………………………………….. 51 Distoma tipo G …………………………………………………………… 52 Descripción ………………..………………………………………… 52 Esporocisto ……………………………………………………………… 53 Descripción ………………………………………………………….. 53 Cercaria owreae ……………………………………………………….. 54 Descripción …………………………………………………………... 54 Revisión taxonómica y parámetros ecológicos de parasitismo ... 55 Larva tipo Monilicaecum ……..……………………………………….. 57 Descripción …………………………………………………………... 57 Revisión taxonómica y parámetros ecológicos de parasitismo ... 58 Familia Hemiuridae .………………………………………………….. 59 Descripción …………………………………………………………... 60 Revisión taxonómica y parámetros ecológicos de parasitismo ... 60 Hemiurus sp. …..……………………………………………………….. 62 Descripción …………………………………………………………... 62 Revisión taxonómica y parámetros ecológicos de parasitismo ... 63 Parahemiurus sp. .....………………………………………………….. 65 Descripción …………………………………………………………... 65 Revisión taxonómica y parámetros ecológicos de parasitismo ... 66 Lecithochirium sp. ……..……………………………………………….. 68 Descripción …………………………………………………………... 68 Revisión taxonómica y parámetros ecológicos de parasitismo ... 69 Brachyphallus sp. …..………………………………………………….. 71 Descripción …………………………………………………………... 71 Revisión taxonómica y parámetros ecológicos de parasitismo ... 72 Paralecithochirium sp. …………………………………………………. 74 Descripción …………………………………………………………... 74 Revisión taxonómica y parámetros ecológicos de parasitismo ... 75 Opisthadena sp. ………..………………………………………………. 76 Descripción …………………………………………………………... 76 Revisión taxonómica y parámetros ecológicos de parasitismo ... 77 Adinosoma sp. ……..………………………………………………….. 79 Descripción …………………………………………………………... 79 Revisión taxonómica y parámetros ecológicos de parasitismo ... 80 Opechona pyriforme ………………………………………………….. 82 Descripción …………………………………………………………... 82 Revisión taxonómica y parámetros ecológicos de parasitismo ... 83 Tergestia sp. …………………………………………………………… 85 Descripción …………………………………………………………... 85 Revisión taxonómica y parámetros ecológicos de parasitismo ... 86 7.4.1.3.- Clase Cestoda ………………………….……………………………… 87 Metacéstodo tipo Plerocercoide A ..………………………………… 87 Descripción …………………………………………………………. 87 Metacéstodo tipo Plerocercoide B ………………………………….. 88 Descripción …………………………………………………………. 88 Metacéstodo tipo Plerocercoide C ………………………………….. 89 Descripción ………………………………………………………….. 89 Metacéstodo tipo Plerocercoide D ………………………………….. 90 Descripción …………………………………………………………. 90 Metacéstodo tipo Plerocercoide E ………………………………….. 91 Descripción …………………………………………………………. 91 Revisión taxonómica y parámetros ecológicos de parasitismo en los metacéstodos tipo A, B, C, D y E …..…………………….. 92 Platelminto tipo A ……………………………………………………... 93 Descripción …………………………………………………………. 93 Platelminto tipo B ……………………………………………………... 94 Descripción …………………………………………………………. 94 Platelminto tipo C ……………………………………………………. 95 Descripción ………………………………………………………… 95 7.4.2.- Phyllum Nematoda ...………………………………………………….. 95 Larva de nemátodo ………………………………………………… 95 Descripción …………………………………………………………. 96 Procamallanus (Spirocamallanus) sp. ……………………………… 96 Descripción ………………………………………………………….. 96 Revisión taxonómica y parámetros ecológicos de parasitismo …. 97 7.4.3.- Quiste ……………………………………………………………………... 101 Descripción ……………………………………………………………. 101 7.4.4.- Modificaciones de la pared corporal del hospedero por la posible presencia de parásitos ………………………………………………. 102 Descripción ……………………………………………………………. 102 7.5.1.- Definición de grupos de quetognatos parasitados y parásitos …….. 128 7.5.2.- Procedimiento de Permutación de Multi-Respuesta (PPMR) ………. 131 7.5.3.- Relaciones entre el parasitismo de quetognatos y el ambiente ……. 131 8.- DISCUSIÓN ………………….………………………………………………… 141 8.1.- Distribución y abundancia de quetognatos ………………..…………… 141 8.2.- Prevalencia y parasitismo de quetognatos …………………………….. 142 8.3.- Habitat planctónicos indicados por quetognatos parasitados .……… 145 9.- CONCLUSIONES ……………………...……………………………………… 149 10.- LITERATURA CITADA …….…..…………………………………………… 151 11.- ANEXO I ……………………………………………………………………… 154 NOMENCLATURA DE LAS FIGURAS A= Acetábulo. hh= Hospederos de helmíntos. An= Anillo nervioso. hp= Hospederos parasitados. Ap= Apéndices. In= Intestino. B= Botridio. mc= Modificación corporal. Bc= Bifurcación cecal. Mo= Monogéneos. Be= Banda esclerótizada. Mq= Membrana quística. C1= Plerocercoide A. n1= Nemátoda. C2= Plerocercoide B. n2= Procamallanus (Spirocamallanus) sp. C3= Plerocercoide C. Ne= Nemátodos. C4= Plerocercoide D. Ov= Ovario. C5= Plerocercoide E. Pa= Parásitos. C6= Pleroceircoide F. Pd= Pterosagitta draco. Cai= Cámara intestinal. Pe= Poro excretor. Ce= Céstodos. Pg= Poro genital. Cb= Cápsula bucal. Pig= Pigmentación. Ci= Ciego intestinal. Pit= Cavidad preacetabular. Eg= Esófago glandular. Pp= Pars prostática. Em= Esófago muscular. q= Quiste. E= Estómago. rp= Ríqueza de parásitos. Ecs= Ecsoma. Ss= Serratosagitta serratodentata. Es= Escólex. Ssp= Sagitta sp. Est= Estróbilo. t1= Distoma A. F= Faringe. t2= Distoma B. Fe= Flaccisagitta enflata. t3= Distoma C. Fh= Ferosagitta hispida. t4= Distoma D. Gr= Glándula rectal. t5= Distoma E. Gv= Glándula vitelógena. t6= Distoma F. hc= Hospederos capturados. t7= Distoma G. I t8= Esporocisto. t9= Cercaria owreae. t10= Larva tipo Monilicaecum. t11= Hemiuridae. t12= Hemiurus sp. t13= Parahemiurus sp. t14= Lecithochirium sp. t15= Brachyphallus sp. t16= Paralecitochirium sp. t17= Opisthadena sp. t18= Dinosoma sp. t19= Opechona pyriforme. t20= Tergestia sp. T= Testículo. Tr= Tremátodos. Tu1= Platelminto A. Tu2= Platelminto B. Tu3= Platelminto C. Ve= Vesícula excretora. Vo= Ventosa oral. Vs= Vesícula seminal. Zb= Zona basal. II LISTADO DE FIGURAS Figura 1.- Página Ubicación geográfica de las estaciones de muestreo y de las tres zonas ambientales consideradas en el norte del estado de Quintana Roo, México ……………….………………………………………………………… 2.- Esquema de la larva de Monopisthocotylea encontrado en penetración de F. enflata del ambiente arrecifal nerítico (en vista lateral) …………… 3.- 53 Esquema de Cercaria owreae encontrado en el saco celómico de F. enflata de los ambientes arrecifal nerítico y lagunar arrecifal ………… 12.- 52 Fotografía de la fase esporocisto de tremátodo encontrado en el saco celómico e intestino de F. hispida en el ambiente lagunar costero .…….. 11.- 51 Fotografía del Distoma tipo G encontrado en el saco celómico e intestino de F. enflata, F. hispida y P. draco de los tres ambientes ……………… 10.- 50 Esquema del Distoma tipo F encontrado en el saco celómico de F. hispida del ambiente lagunar costero ………………………………………………. 9.- 49 Esquema del Distoma tipo E encontrado en el saco celómico de F. hispida del ambiente lagunar costero ………………………………………………. 8.- 48 Esquema del Distoma tipo D encontrado en el saco celómico de F. hispida del ambiente lagunar costero ………………………………………………. 7.- 47 Esquema del Distoma tipo C encontrado en el saco celómico de F. hispida del ambiente lagunar costero ………………………………………………. 6.- 46 Esquema del Distoma tipo B encontrado en el saco celómico de F. enflata del ambiente lagunar arrecifal ………………………………………………. 5.- 44 Esquema del Distoma tipo A encontrado en el intestino de F. enflata del ambiente arrecifal nerítico ……………………………………………………. 4.- 11 54 Esquema de la larva tipo Monilicaecum encontrado en el saco celómico, intestino y septo caudal de F. hispida, F. enflata, P. draco, S. serratodentata y Sagitta sp. de los tres ambientes estudiados ………. 13.- 57 Esquema de Hemiúridos a nivel familia encontrados en el saco celómico de F. hispida, F. enflata, P. draco y S. serratodentata en los tres ambientes estudiados ………………………………………………….. 59 III 14.- Esquema de Hemiurus sp. encontrado en el saco celómico de F. hispida S. serratodentata de los ambientes lagunar costero y lagunar arrecifal .. 15.- Esquema de Parahemiurus sp. encontrado en el saco celómico de F. hispida del ambiente lagunar costero………………………………….... 16.- 65 Esquema de Lecithochirium sp. encontrado en el saco celómico e intestino de F. hispida del ambiente lagunar costero ..…………………… 17.- 62 68 Esquema de Brachyphallus sp. encontrado en el saco celómico e intestino de F. hispida, F. enflata, S. serratodentata y Sagittasp. de los tres ambientes estudiados ..…………………………………………….. 18.- Esquema de Paralecithochirium sp. encontrado en el saco celómico de F. hispida del ambiente arrecifal nerítico ………………………………….. 19.- 79 Esquema de Opechona pyriforme encontrado en el saco celómico e intestino de F. hispida y F. enflata de los tres ambientes estudiados …. 22.- 76 Esquema de Adinosoma sp. encontrado en el saco celómico de F. hispida, F. enflata y Sagitta sp. de los tres ambientes estudiados .……………… 21.- 74 Esquema de Opisthadena sp. encontrado en el saco celómico de F. hispida y F. enflata de ambientes lagunar arrecifal y lagunar costero ... 20.- 71 82 Esquema de Tergestia sp. encontrado en el saco celómico e intestino de F. hispida, F. enflata y Sagitta sp. de los ambientes lagunar costero y lagunar arrecifal …………………………………………………………….. 23.- Metacéstodo tipo plerocercoide A encontrado en el saco celómico de F. hispida en el ambiente lagunar costero …………………………………. 24.- 90 Metacéstodo tipo plerocercoide E encontrado en el saco celómico de F. hispida y S. serratodentata en el ambiente lagunar costero …………. 28.- 89 Escólex de metacéstodo tipo plerocercoide D encontrado en el saco celómico de F. enflata en el ambiente lagunar arrecifal .…………………. 27.- 88 Metacéstodo tipo plerocercoide C encontrado en el saco celómico de F. enflata en el ambiente arrecifal nerítico …………………………………. 26.- 87 Metacéstodo tipo plerocercoide B encontrado en el saco celómico de F. hispida y S. serratodentata en el ambiente lagunar costero …………. 25.- 85 91 Fotografía de Platelminto tipo A encontrado en el saco celómico de IV F. hispida en el ambiente lagunar costero …………………………………. 29.- Esquema de Platelminto tipo B encontrado en el saco celómico de F. hispida, F. enflata y S. serratodentata en el ambiente lagunar costero … 30.- 94 Fotografía de Platelminto tipo C encontrado en el septo caudal de F. hispida en el ambiente lagunar costero …………………………………. 31.- 93 95 Fotografía de una larva de nemátodo encontrado en el saco celómico de F. hispida y F. enflata en los ambientes lagunar costero y lagunar arrecifal ………………………………………………………………………… 32.- Esquemas de Procamallanus (Spirocamallanus) sp. encontrado en el saco celómico de F. hispida en el ambiente lagunar arrecifal …………… 33.- 95 96 Fotografía de quistes encontrados en el inestino y saco celómico de F. hispida, F. enflata, P. draco, S. serratodentata y Sagitta sp. de todos los ambientes estudiados ………………………………………………….. 34.- Fotografía de la modificación de la pared corporal encontrada en F. hispida en todos los ambientes estudiados ……………………………………….. 35.- 101 102 Grupos de quetognatos parasitados y parásitos obtenido mediante el dendrograma de similitud a partir de un análisis de agrupamiento de las estaciones de muestre del 2004 y 2005 ……………………………………. 36.- 133 Grupos de quetognatos parasitados y parásitos y su relación con las variables ambientales mediante el ACC …………………………………… 135 V LISTADO DE TABLAS Tabla 1.- Página Quetognatos capturados en el norte de Quintana Roo durante el 2004 …………………………………………………………………… 2.- Quetognatos capturados en el norte de Quintana Roo durante el 2005 ……...………………………………………………………………. 3.- 23 Quetognatos parasitados en el norte de Quintana Roo durante el 2005 ……...………………………………………………………………. 5a.- 22 Quetognatos parasitados en el norte de Quintana Roo durante el 2004 ……...………………………………………………………………. 4.- 21 24 Prevalencia de parasitismo espacial y temporal en el norte de Quintana Roo durante el 2004 …………………………………………. 25 5b.- Continuación …………………………………………………………….. 26 6a.- Prevalencia de parasitismo espacial y temporal en el norte de Quintana Roo durante el 2005 …………………………………………. 27 6b.- Continuación …………………………………………………………….. 28 7.- Prevalencia e intensidad media de parasitismo anual ..……………… 29 8.- Fauna parasitaria y parámetros ecológicos en F. hispida (2004 y 2005) …………………………………………………………………….. 9.- Fauna parasitaria y parámetros ecológicos en F. enflata (2004 y 2005) …………………………………………………………………….. 10.- 42 Fauna parasitaria y parámetros ecológicos en P. draco (2004 y 2005) …………………………………………………………………….. 12.- 38 Fauna parasitaria y parámetros ecológicos en S. serratodentata (2004 y 2005) ……..…………………………………………………….. 11.- 32 43 Fauna parasitaria y parámetros ecológicos en Sagitta sp. (2004 y 2005) …………………………………………………………………….. 43 13.- Registros de Cercaria owreae en quetognatos ……………………… 103 14.- Registros de la larva tipo Monilicaecum …………………………….. 104 15a, b.- Registros de metacercarias y adultos de Hemiurus sp. …………… 106 16.- Registros de metacercarias y adultos de Parahemiurus sp. ……… 111 VI 17.- Registros de metacercarias de Lecithochirium sp. ………………… 113 18a-c.- Registros de adultos de Lecithochirium sp. ………………………… 114 19.- Registros de metacercarias y adultos de Brachyphallus sp. ……… 120 20.- Registros de adultos de Opisthadena sp. …………………………… 121 21.- Registros de adultos de Adinosoma sp. ………………………………. 123 22.- Registros de metacercarias y adultos de Opechona sp. ………….. 123 23.- Registros de metacercarias y adultos de Tergestia sp. …………… 125 24.- Registros de metacéstodos tipo Plerocercoide en quetognatos y peces ……………………………………………………………………. 25.- Grupo de Flaccisagitta enflata en el ambiente lagunar arrecifal del 2005 (Grupo 1), formado por el análisis de agrupamiento ………….. 26.- 138 Grupo de Ferosagitta hispida en el ambiente lagunar costero del 2005 (Grupo 3), formado por el análisis de agrupamiento ………….. 28.- 137 Grupo de Flaccisagitta enflata en el ambiente lagunar arrecifal del 2004 (Grupo 2), formado por el análisis de agrupamiento ………….. 27.- 126 139 Grupo de Ferosagitta hispida de los tres ambientes del 2005 (Grupo 4), formado por el análisis de agrupamiento ………………… 140 VII RESUMEN En el Caribe Mexicano no se ha abordado suficientemente la relación entre los quetognatos, sus parásitos y los parámetros ambientales en los que viven. Los quetognatos son el segundo grupo en abundancia en el zooplancton ya que constituyen un eslabón en la transferencia de energía hacia niveles tróficos superiores, pero además pueden actuar como hospederos intermediarios o paraténicos de helmintos. Por tal, el objetivo de este trabajo fue conocer la fauna helmíntica que parasita a los quetognatos en el Sistema Lagunar Nichupté y zonas adyacentes del norte de Quintana Roo y su relación con las condiciones ambientales durante los dos años 2004 y 2005. Las muestras de zooplancton fueron recolectadas mensualmente siguiendo la metodología de captura para ellas en 12 estaciones, distribuidas desde Cancún hasta Puerto Morelos y cubriendo tres ambientes: arrecifal nerítico, lagunar costero que incluye al Sistema Lagunar Nichupté (SLN) y lagunar arrecifal. Los quetognatos parasitados se tiñeron con Tricrómica de Gomori, se aclararon con salicilato de metilo y se montaron con resina sintética en preparaciones permanentes. Se recolectaron 67200 quetognatos de los cuales 4,020 se encontraron parasitados pertenecientes a: Ferosagitta hispida, Flaccisagitta enflata Pterosagitta draco y Serratosagitta serratodentata. La prevalencia de parasitismo fue de 5.98% e intensidad media de infección de 2.45. Se obtuvieron 9860 parásitos, siendo posible la identificación de 1169 helmintos en 33 formas diferentes que incluyeron larvas de monogéneos, larvas de digéneos: cercarias y metacercarias, larvas de nematodos en fase 3 y también larvas de platelmintos y distomidos. Para cada uno de los parásitos identificados se obtuvo su abundancia, prevalencia e intensidad promedio de infección. Las especies más abundantes fueron F. hispida y F. enflata ambas mostraron dominancia por un grupo de estaciones en particular, F. hispida en las estaciones que se encuentran en el ambiente lagunar costero y que incluye al SLN y F. enflata que se registro dominante en los otros dos ambientes, arrecifal nerítico y lagunar arrecifal. El mayor número de parásitos encontrados fue en estas dos especies de mayor abundancia. Los trematodos digéneos mostraron una mayor distribución en las estaciones de muestreo y una menor especificidad VIII hospedatoria al encontrarse en todas las especies de quetognatos parasitados, en cambio los céstodos mayor especificidad al encontrarse en dos especies de quetognatos y en el caso de los nematodos solo fueron encontrados en F. hispida. En este trabajo se registran nuevas localidades y hospederos para los helmintos de las costas mexicanas. IX ABSTRACT In the Mexican Caribbean has not been sufficiently addressed the relationship between chaetognahts, their parasites and environmental parameters in which they live. The chaetognaths are the second largest group in zooplankton abundance as they are a link in the energy transfer to higher trophic levels, but also can act as intermediate hosts of helminthes or paratenic. For this, the objective of this study was to helminth fauna parasitizing the chaetognaths in the Nichupte Lagoon System and adjacent areas of northern Quintana Roo and its relation to environmental conditions during the two years 2004 and 2005. Zooplankton samples were collected monthly using the methodology capture them at 12 stations distributed from Cancun to Puerto Morelos and covering three environments: neritic reef, coastal lagoon wich includes the Nichupte Lagoon System (SLN) and reef lagoon. The parasitized chaetognaths were stained with Gomori Trichrome, rinsed with methyl salicylate and mounted synthetic resin in permanent preparations. Chaetognaths were collected of wich 67200 were parasitized 4020 were parasitized pertaining to: Ferosagitta hispida, Flaccisagitta enflata Pterosagitta draco and Serratosagitta serratodentata. The prevalence of parasitism was 5.98% and mean intensity of infection of 2.45. 9860 parasites were obtained, being possible the identification of helminthes in 1169 involving 33 different ways monogeneans larvae, larval digenea: cercariae and metacercariae; nematode larvae stage 3 and larvae of flatworms and distoms. For each of the identified parasites obtained their abundance, prevalence and mean intensity of infection. The most abundant species were F. hispida and F. enflata both showed dominance by a particular group of stations. F. hispida in the stations located in the coastal lagoon environment and that includes the SLN and F. enflata that key log in the other two environments, neritic reef lagoon. The largest number of parasites found in these two species was most abundant. Digeneans showed a greater distribution in the sampling stations and a lower specificity hospedator to be found in all species of chaetognaths parasitized, however the greater specificity in cestodes found in two species of chaetognaths in the case of nematodes wrere found only in F. X hispida. In this paper we reported new locations and hosts for helminths of the Mexican coast. XI 1.- INTRODUCCIÓN Quintana Roo es una de las regiones con mayor desarrollo turístico en el país, lo que contrasta con el conocimiento que se tiene de su flora y fauna marina. A la fecha se han registrado importantes modificaciones en la calidad de los ecosistemas marinos, lo cual debe afectar el ciclo de vida de muchas especies (Álvarez-Cadena et al., 2007b), particularmente de organismos del zooplancton que son los más sensibles a los cambios ambientales (Youngbluth, 1980). Dentro de los grupos abundantes del zooplancton, se encuentran los quetognatos que son organismos hermafroditas, carnívoros, depredadores no visuales que identifican a sus presas por la perturbación que producen en el medio acuático debido a su movimiento. Se alimentan principalmente de copépodos y larvas de peces (Feigenbaum & Maris, 1984). Son reconocidos como una de las principales vías en la transferencia de energía en la cadena trófica entre los primeros eslabones y los depredadores mayores, donde se incluyen a especies de peces, tiburones y calamares de importancia comercial (Reeve, 1970; Nagasawa & Marumo, 1979a). Los quetognatos son organismos que tienen una migración activa y constante a lo largo de la columna de agua por lo que tienen un alto riesgo de ser seleccionados como hospederos intermediarios o paraténicos por parásitos que serían transferidos hacia niveles tróficos superiores en consecuencia de las altas abundancias de este hospedero dentro de la comunidad del zooplancton (Medina, 1979; Daponte et al., 2008). El conocimiento que se ha adquirido de los parásitos que albergan los quetognatos ha sido de manera esporádica. Los estudios han sido más frecuentes en los últimos 30 años, en donde se empezó a analizar la posible relación del ciclo de vida de los parásitos con la biología de los quetognatos (Pearre, 1974; 1979). Como resultado de esta interacción se han observado daños corporales e inflamatorios del sitio de penetración de los parásitos (Nagasawa, 1991), lo cual podría generar un cambio en el comportamiento de los quetognatos, haciendo que estos vivan más cerca de la superficie lo cual conlleva a una mayor vulnerabilidad a ser depredados por peces planctívoros como lo mencionaron Pearre (1979) y Nagasawa (1991). Esto puede ser interpretado como una influencia del parásito sobre su hospedero para 1 que le permita llegar hacia su siguiente hospedero o al definitivo. Otros daños observados son el gigantismo que es la adquisición de mayor talla de los organismos (Nagasawa, 1991), cambios en la coloración del cuerpo (Nagasawa & Nemoto, 1984; Santhakumari, 1992) y disminución en el desarrollo de las gónadas femeninas, ocasionando desde una inhibición ovárica hasta su completa desaparición afectando indudablemente su fecundidad (Pearre, 1979). Entre los parásitos que causan los efectos antes mencionados se encuentran: Tremátodos.- Presentan diferentes fases larvales, iniciando con el miracidio (primera fase) el cual es un organismo nadador libre, que penetra siempre a un molusco (primer hospedero intermediario). Una vez en el interior del molusco se transforma por reproducción asexual en esporocisto (segunda fase) y dentro de éste se desarrollan las redias (tercera fase) y en cada redia se forman las cercarias (cuarta fase) también por reproducción asexual. Esta cuarta larva sale del molusco y penetran a un crustáceo o larva de pez (segundo hospedero intermediario) en donde se convierten en metacercarias (quinta fase). Por último al ser ingerido este segundo hospedero intermediario por un hospedero definitivo permite que la larva se convierta en adulto (Lamothe-Argumedo, 1983). Céstodos.- De ciclo indirecto por lo que requieren de uno o dos hospederos intermediarios. Los huevos embrionados de estos organismos alcanzan el agua después de ser eliminados por el hospedero definitivo con las heces, así eclosionan y se forman los coracidios (primera larva). Posteriormente estas larvas son consumidas por un artrópodo (primer hospedero intermediario) y migran al hemocele donde experimentan una metamorfosis de alargamiento y reorganización del cuerpo, formándose en larva procercoide (segunda larva). Este primer hospedero es consumido por un pez (segundo hospedero intermediario), la larva perfora el intestino de éste dando paso a una metamorfosis gradual para transformarse en larva plerocercoide (tercera larva) en la cual desaparecen los ganchos embrionarios y desarrollan rudimentos del órgano de fijación característica del adulto. Al final el pez es ingerido por elasmobranquios, los hospederos definitivos (Stunkard, 1977; Schmidt & Roberts, 1983). 2 Nemátodos.- Presentan ciclo de vida indirecto todas las especies. La primera fase larval es formada en el útero de la hembra adulta, la cual es expuesta al medio acuático por las heces fecales del hospedero definitivo y eclosiona como segunda fase larval. Posteriormente los crustáceos ingieren esta larva y fungen como primer hospedero intermediario. La larva se desplaza en el hemocele y se desarrolla el tercer estadio larval. Los crustáceos serán ingeridos por organismos planctívoros (segundo hospedero intermediario o paraténico) en donde la larva persistirá en el intestino o se enquistará en su serosa y será transportada en la cadena alimenticia a los hospederos definitivos piscívoros (Anderson, 2000). Como se ha descrito en cada uno de los ciclos de vida, estos helmintos presentan una fase larvaria que parasita organismos bentónicos o planctónicos (Reeve, 1970; Nagasawa & Marumo, 1979a) y en el caso de los quetognatos, considerados el segundo grupo de abundancia en el plancton marino particularmente en las costas de Quintana Roo (Ramírez-Ávila, 1997), la presencia de parásitos no puede ser casual. Por lo que el incremento en los estudios del parasitismo en quetognatos permitirá conocer los efectos posibles en sus poblaciones, además de ampliar la información sobre los ciclos de vida de los helmintos, tipos de transmisión y su contribución en una de las causas de mortalidad de los quetognatos en las costas de Quintana Roo. 2.- ANTECEDENTES 2.1.- A nivel mundial La mayor parte del conocimiento de los helmintos en quetognatos se debe principalmente a los primeros registros en el océano Atlántico, sin embargo, también existen registros en los demás océanos. Las fases larvales de los digéneos de diferentes áreas geográficas son las de mejor conocimiento hasta el momento. Océano Atlántico.- se han registrado metacercarias progéneticas de Parahemiurus merus en el quetognato Parasagitta friderici en la Bahia de Paraguana, Brasil (Almeida et al., 2009); Cercaria owreae en Flaccisagitta lyra en el Caribe Cubano (Suárez-Caabro, 1955); Dawes (1958 & 1959); en el Gran Banco Meteor 3 (Jarling & Kapp, 1985); Brachyphallus sp. en Sagitta elegans (Linton, 1927), Hemiurus sp. en Sagitta elegans (Myers, 1956); Lecithochirium sp. en Sagitta cephaloptera (Dollfus, 1960); Hemiurus sp. en Sagitta minima, Sagitta friderici, Sagitta enflata (Pearre, 1976 & 1979); Monilicaecum en Serratosagitta serratodentata, Sagitta minima, Sagitta hexaptera, Sagitta enflata, Pterosagitta draco y Spadella sp. (Reimer et al., 1975); Derogenes sp. en Sagitta euxina (Elian, 1960); Opechona sp. en Sagitta elegans (Reimer et al., 1971); Derogenes varicus en quetognatos no identificados (Rolbiecki & Waskusz, 2005); Derogenes sp., Ectenurus sp., Monascus filiformis y una metacercaria de Lepocreadiidae fueron encontradas por Daponte et al. (2006); fases larvales de céstodos en Sagitta enflata (Dollfus et al., 1954); en Sagitta tenuis (Dawes, 1958); en Sagitta elegans (Reimer et al., 1971 y Kulachkova, 1972); en Sagitta setosa (Oresland, 1986); en Sagitta friderici y Pterosagitta draco (Pierrot-Bults, 1990); el nemátodo Contracaecum sp. en Sagitta euxina (Elian, 1960). Golfo de México.- Se encontraron a Cercaria owreae en Flaccisagitta enflata y Flaccisagitta hexaptera de Florida (Hutton, 1952 & 1954); Parahemiurus sp. en Ferosagitta hispida (Overstreet, 1969). Océano Pacífico.- Nagasawa & Nemoto (1984) y Santhakumari (1992) observaron modificaciones en el tegumento de Sagitta crassa y Sagitta sp. en Japón. Posteriormente Shimazu (1978) y Nagasawa & Marumo (1979a, b) encontraron metacercarias de la familia Hemiuridae: Derogenes sp., Ectenurus virgulus, Parahemiurus merus y Daponte et al. (2008) registraron una metacercaria de la familia Lepocreadiidae: Monascus filiformis en S. friderici. Shimazu (1978) registro larvas de céstodos en los quetognatos: S. enflata, Sagitta ferox, Sagitta nagae, Sagitta neglecta, Sagitta regularis, Sagitta pacifica, Pterosagitta draco y Eukrohnia hamata. Nagasawa & Marumo (1979a) observaron céstodos en Eukrohnia hamata, Pterosagitta draco y Sagitta enflata. Mazzoni (1986) encontró una larva de nemátodo sin identificar en Flaccisagitta enflata. Océano Índico.- Oresland & Bray (2005) encontraron en el quetognato Flaccisagitta enflata a las metacercarias: Monilicaecum, Aphanurus sp., 4 Parahemiurus sp., larvas de céstodos y a un nemátodo en fase larval y en el quetognato Sagitta elegans a la metacercaria de Opechona sp. 2.2.- En México Los estudios de parasitismo en quetognatos en las costas Mexicanas se han enfocado únicamente a taxonomía de helmintos en la zona del Caribe Mexicano (Gómez del Prado-Rosas et al., 1999a, b, 2000a, 2002, 2005 y 2007b). Ellos, mencionaron a Cercaria owreae infectando Flaccisagitta enflata, Serratosagitta serratodentata, Ferosagitta hispida, Sagitta helenae. También describieron a las metacercarias tipo Torticaecum sp. infectando a Serratosagitta serratodentata, Metacercaria quintanarroensis a Flaccisagitta enflata, y una metacercaria accacoelidae en F. enflata. A los hemiúridos Brachyphallus sp. en S. serratodentata, Ectenurus sp. en Parasagitta friderici, Lecithochirium sp. en F. enflata, S. serratodentata, S. bipunctata y S. helenae. Finalmente a la metacercaria tipo Monilicaecum en F. enflata y S. serratodentata. Sin embargo, el presente trabajo es el primer estudio de carcter taxonómico y ecológico para comprender las asociaciones de la estructura de la comunidad de hospederos y parásitos en una serie mensual en dos años (variación mensual e interanual) en relación con las condiciones ambientales de temperatura, salinidad, pH y concentración de oxígeno disuelto. 3.- ÁREA DE ESTUDIO Se encuentra ubicada entre los paralelos 20º55` a 21º05` N y 86º40` a 86º50` W en la región nor-oriental de la península de Yucatán (estado de Quintana Roo). La zona de muestreo presenta una extensión aproximada de 50 km desde Puerto Morelos hasta Cancún, incluido el Sistema Lagunar Nichupté (Fig. 1). De acuerdo con Jordan (1993) el área de estudio presenta principalmente una vegetación de tipo manglar como Rhizophora mangle Linneo, 1753 y Avicenia laguncularia (L.), la selva es baja tropical perennifolia con pastizales halófitos. Las costas de Quintana Roo y la Península de Yucatán, se caracterizan por ser de escaso relieve, ausencia de aporte de ríos y la naturaleza cárstica de su suelo propia de la región. La plataforma continental es muy extensa frente a las costas 5 septentrional y occidental de Yucatán (Banco de Campeche). Sin embargo, desde Cancún hacia el sur prácticamente desaparece, lo que permite que sus aguas sean de fuerte carácter oceánico con condiciones oligotróficas (bajos niveles de nutrientes), elevada estabilidad vertical y transparencia (Merino & Otero, 1991). En escala oceánica, la principal característica es la presencia de la corriente de Yucatán que fluye de sur a norte a lo largo de costa sobre la plataforma continental de la costa de Quintana Roo (Merino, 1986). En esta región, las principales corrientes marinas tienen una dirección norte-noreste que fluyen a lo largo de la línea de costa, con velocidades promedio de 10 cm/s-1, aunque se pueden registrar velocidades de hasta 50 cm/s-1 (Merino & Otero, 1991). En la zona de estudio también se han registrado corrientes con dirección sur-sureste cerca de la costa de menor intensidad. Las mareas son mixtas y semidiurnas con un rango de mareas de 0.24 m (Ruíz-Rentería et al., 1998). El clima del lugar de acuerdo con la clasificación de Koppen (Modificada por García, 1964) es del tipo Aw1 (x`) (y`)g, esto es, cálido subhúmedo con temperatura media anual > 22º C y el mes más frío es típicamente >18º C. Para el área de estudio se registran tres regímenes climáticos a lo largo del año: a) el régimen de secas (marzo a junio) que se caracteriza por una escasa precipitación pluvial; b) el régimen de lluvias (julio a octubre) con vientos alisios en dirección sur-sureste y c) el de nortes (noviembre a febrero) caracterizado por fuertes vientos provenientes del norte y con constante precipitación aunque no torrencial (Gasca et al., 1996). 4.- PLANTEAMIENTO DEL PROBLEMA E HIPOTESIS La zona norte de Quintana Roo, se ha consolidado como una de las principales regiones de importancia económica para el país, particularmente en el Sistema Lagunar Nichupté (SLN), el cual está rodeado por el gran desarrollo turístico de Cancún. Esta zona es considerada como área de crianza y reproducción de organismos marinos. Sin embargo, el SLN se encuentra bajo un proceso de eutrofización lo que ha provocado que las condiciones sean favorables para el desarrollo de parásitos en los organismos marinos, incluyendo al grupo de los quetognatos. 6 El factor más importante que determina la presencia o ausencia de una especie de parásito en una cierta localidad, es la presencia de un hospedero con una densidad de población alta (Moravec et al., 1995c), como se puede considerar a los quetognatos en esta zona de Quintana Roo. Por su parte, Álvarez-Cadena et al. (2007a) y Youngbluth (1980) consideran que las condiciones ambientales costeras asociadas con la precipitación pluvial favorecen la productividad en los sistemas acuáticos, lo cual permite el incremento poblacional de diversos grupos del zooplancton, incluido el de los quetognatos. En este contexto, se sabe que en esta zona del Caribe Mexicano han sido caracterizados tres regímenes climáticos los cuales varían conforme se presente un aumento o disminución de la precipitación pluvial en el año. Así mismo Álvarez-Cadena et al. (2007a), diferenciaron en el área de estudio tres zonas ambientales de acuerdo con su ubicación, condiciones ambientales, flora y fauna, las cuales en este trabajo son mencionadas como: arrecifal nerítico, lagunar costero y lagunar arrecifal. Ahora bien, considerando tanto la precipitación pluvial, como la diferenciación ambiental se plantea la siguiente hipótesis: la mayor densidad de organismos y el mayor número de quetognatos parasitados se encontrará en el ambiente lagunar costero durante la época de lluvias en donde Ferosagitta hispida será la especie con mayor presencia de parásitos, mientras que la menor densidad de quetognatos y el menor número de quetognatos parasitados ocurrirá en el ambiente arrecifal nerítico durante el régimen de secas en donde se presentará Flaccisagitta enflata principalmente. 5.- OBJETIVOS 5.1.- General Conocer la fauna helmíntica que parasita a los quetognatos en el Sistema Lagunar Nichupté y zonas adyacentes del norte de Quintana Roo y su relación con las condiciones ambientales durante los años 2004 y 2005. 5.2.- Particulares 5.2.1.- Determinar la composición, abundancia y prevalencia de parasitismo general 7 de los quetognatos. 5.2.2.- Determinar la distribución espacial y temporal de los quetognatos capturados y parasitados. 5.2.3.- Determinar los parámetros ecológicos de parasitismo: abundancia, prevalencia e intensidad media de infección para cada especie de quetognato parasitado. 5.2.4.- Describir las características morfológicas y anatómicas de los parásitos encontrados. 5.2.5.- Determinar la influencia de las condiciones ambientales en las que se observó la presencia de parásitos. 6.- MATERIAL Y MÉTODOS 6.1.- Descripción de las estaciones de muestreo Las muestras de zooplancton se obtuvieron mensualmente durante el 2004 y 2005 en 12 estaciones a lo largo de las costas del norte de Quintana Roo, desde Cancún hasta Puerto Morelos. Con el objeto de simplificar la información, las 12 estaciones de muestreo del norte de Quintana Roo fueron agrupadas en diferentes áreas geográficas de acuerdo con la ubicación, tipo de condiciones ambientales, flora y fauna. Las estaciones 1 y 2 pertenecen al ambiente arrecifal nerítico (Fig. 1, azul) la cual presenta oleaje y fuertes corrientes por lo que se le considera con gran dinámica debido en parte a la profundidad del lugar (10-15 m) y cuyo fondo está caracterizado por la presencia de blanquizales de arena. Merino (1986) mencionó que la dinámica de esta zona se debe a que se acentúa la fuerza de la corriente en dirección norte. Los grupos de zooplancton que se han registrado son principalmente de origen oceánico como algunas especies de sifonóforos, salpas, medusas, quetognatos y larvas de peces. Las estaciones 3 a 6 se ubican dentro del Sistema Lagunar Nichupté (SLN) en el ambiente lagunar costero (Fig. 1, rojo). El SLN se encuentra separado del mar por una barrera de arena y rodeado por edificios destinados a la actividad turística (zona hotelera que es de importancia comercial para el estado). En el SLN se localizan tres 8 cuencas interconectadas entre sí, la cuenca norte (Est. 3), la cuenca centro (Est. 5) y la sur (Est. 6), además de otras de menor tamaño que están conectadas con los cuerpos lagunares antes mencionados. La profundidad máxima del SLN es de 5 m y la mínima de 0.5 m, siendo la profundidad media de 2.2 m (Merino et al., 1990). González-López (1989) mencionó que el tiempo de residencia del agua en el SLN es aproximadamente de 1.9 años, es decir es el tiempo necesario para que ocurra el recambio total de sus aguas. Al norte del SLN se ubica la Laguna Bojórquez (Est. 4), la cual tiene una circulación limitada debido a que no tiene comunicación directa con el mar. Se conecta con la cuenca norte del SLN por medio de dos canales dragados y estrechos (20–40 m de ancho y 3.5 m de profundidad aproximadamente). González-López (1989) calculó el tiempo de residencia del agua para esta laguna mencionando que es de 2.7 años aproximadamente. Finalmente, Merino et al. (1990) mencionó que el SLN está considerado como un sistema de baja energía con limitados intercambios de agua con el mar abierto, debido a la ausencia de descargas de ríos y a pequeños intervalos de marea. Las estaciones 7 a 12 se encuentran en el ambiente lagunar arrecifal del norte de Quintana Roo (Fig. 1, verde) definido así por la presencia de arrecifes coralinos (principal característica del lugar), los cuales son visibles en varias partes de la barrera arrecifal ya que sobresale del agua. Hacia la estación 7 dirección norte, se observan bancos arrecifales aislados y en dirección sur se hacen más continuos hasta formar una barrera. El cuerpo de agua comprendido entre la línea de costa y la barrera arrecifal se conoce como Laguna arrecifal de Puerto Morelos. Es una barrera que alcanza una anchura que varía entre los 350 m y 1600 m con una profundidad promedio de 3m. Merino & Otero (1991) mencionan que la barrera arrecifal tiende a desaparecer por completo en dirección sur (Est. 12). En esta área predomina el fondo arenoso aunque también se pueden observar grandes parches de pastos marinos como Thalassia testudinium y Syringodium sp. así como corales blandos de distintos géneros (González-López, 1989). Es una zona de importancia para la reproducción, crianza y alimentación de diversas especies de peces y crustáceos. 6.2.1.- Trabajo de campo 9 Los muestreos se realizaron siguiendo una trayectoria circular durante 5 minutos a una distancia aproximada de 200 m de la costa con excepción de las estaciones que se encuentran dentro del SLN. Para ello se utilizó una red cónica de plancton de 0.42 m de diámetro, 1.20 m de longitud y una luz de malla de 330 micras, además tenía un medidor de flujo para las estimaciones de densidad de organismos. La embarcación estuvo impulsada por un motor fuera de borda de 60 Hp a una velocidad aproximada de 1.5 a 2 nudos. Los organismos recolectados fueron fijados en el momento de la captura con formaldehído neutralizado con carbonato de litio agregando agua de mar hasta obtener una concentración de 4% aproximadamente. Durante la captura de las muestras de zooplancton, se hicieron mediciones in situ de la temperatura, salinidad, pH y oxígeno disuelto con un multianalizador YSI. Además, se obtuvieron los valores promedio de la precipitación mensual registrados para el año 2004 y 2005 en Quintana Roo (Comisión Nacional del Agua, 2004; 2005). 10 Figura 1.- Ubicación geográfica de las estaciones de muestreo y de las tres zonas ambientales consideradas en el norte del estado de Quintana Roo, México. 6.2.2.- Revisión e identificación de los quetognatos De la muestra obtenida se procedió a separar a la totalidad de quetognatos en el laboratorio de Plancton de la Unidad Académica de Puerto Morelos, del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México con un microscopio estereoscopio. A cada frasco se le adicionó una etiqueta con los datos de captura. Los quetognatos fueron transportados al laboratorio de Docencia 2 11 del Centro Interdisciplinario de Ciencias Marinas. A los quetognatos que se les encontró la presencia de parásitos fueron separados del total para su revisión posterior. La identificación de los quetognatos se realizó a nivel específico con la ayuda de las claves de McLelland (1989). Los quetognatos obtenidos fueron estandarizados mediante el método de estimación aproximada del volumen filtrado considerando el diámetro de la red de plancton (0.42m), la velocidad en la que se realizó el arrastre (1.5 a 2 nudos) y el tiempo de duración en cada arrastre (5 minutos). Obteniendo el valor de 21.2 m3. 6.3.- Parámetros ecológicos de parasitismo Para la determinación de la abundancia de los quetognatos, prevalencia, intensidad media y abundancia relativa de parasitismo se consideraron los criterios de Bush et al. (1997) quienes definieron: Abundancia = Número de parásitos Total de hospederos revisados Prevalencia = Número de hospederos parasitados X 100 Número de hospederos revisados Intensidad media de parasitismo = Número de parásitos de una especie Número de hospederos parasitados Abundancia relativa = Número total de individuos de un parásito Número total de hospederos 6.4.1.- Técnica Parasitológica basada en Salgado-Maldonado, 1979 A los quetognatos parasitados se les aplicó una deshidratación en alcoholes graduales de 70 a 100% en el laboratorio de Parasitología de la Universidad Autónoma de Baja California Sur. Posteriormente fueron teñidos con Tricrómica de Gomori, transparentados con salicilato de metilo y montados con resina sintética con 12 la finalidad de obtener preparaciones permanentes para su observación en el microscopio compuesto. 6.4.2.- Identificación helmíntica Fueron identificados con base en la sinopsis de Tremátodos de Yamagutí (1971), Gibson et al. (2002), Jones et al. (2005) y Bray et al. (2008). Para los céstodos se utilizaron los trabajos de Yamagutí (1959) y Khalil et al. (1994) y para los Nemátodos fueron con base en las características mencionadas por Yamagutí (1961) y Chabaud (1975). Los ejemplares obtenidos se encontrán depositados en la Colección Parasitológica del Museo de Historia Natural de la Universidad Autónoma de Baja California Sur (CPMHN-UABCS). 6.4.3.- Descripción helmíntica Se realizaron esquemas con la ayuda de un microscopio Zeiss compuesto con cámara clara. Se proporcionaron las medidas mínimo, máximo y promedio (entre paréntesis) de los organismos en milímetros (mm). Además, se tomaron microfotografías de los parásitos directamente al microscopio compuesto Leica modelo DMLB con la ayuda de una cámara fotográfica digital Samsung Digimax V700 señalando el aumento al que fue tomada. 6.5.1.- Análisis multivariados entre variables biológicas y físicas Para obtener relaciones entre el parasitismo en quetognatos y las variables ambientales se utilizó un análisis de agrupamiento, un análisis de correspondencia canónica (CCA) y un análisis de de procedimiento permutacional de multi-respuesta (PPMR). Estas técnicas se realizaron con la finalidad de observar tendencias de acuerdo a las abundancias de las especies de quetognatos y de los parásitos identificados. Los datos hidrológicos en conjunto con las épocas climáticas y las zonas ambientales fueron procesados con el programa PC-ORD versión 4.25 por medio de técnicas multivariadas (McCune & Mefford, 1999). Se realizaron dos matrices de datos: 13 La primera matriz nombrada “especies”, estuvo conformada por 123 filas y 40 columnas. En total se consideraron cinco especies de quetognatos, las cuales se presentaron cuatro en el 2004 Ferosagitta hispida (Fh), Flaccisagitta enflata (Fe), Pterosagitta draco (Pd) y Serratosagitta serratodentata (Ss), y cinco en el 2005, Fh, Fe, Pd, Ss y Sagitta sp. (Ssp.). Se consideraron 34 parásitos diferentes entre los dos años: Distoma A (t1), Distoma B (t2), Distoma C (t3), Distoma D (t4), Distoma E (t5), Distoma F (t6), Distoma G (t7), Esporocisto (t8), Cercaria owreae (t9), larva tipo Monilicaecum (t10), hemiuridae (t11), Hemiurus sp. (t12), Parahemiurus sp. (t13), Lecithochirium sp. (t14), Brachyphallus sp. (t15), Paralecithochirium sp. (t16), Opisthadena sp. (t17), Dinosoma sp. (t18), Opechona pyriforme (t19), Tergestia sp. (t20), Plerocercoide A (c1), Plerocercoide B (c2), Plerocercoide C (c3), Plerocercoide D (c4), Plerocercoide E (c5), Plerocercoide F (c6), Monogenea larva (mo), platelminto tipo A (tu1), platelminto tipo B (tu2), platelminto tipo C (tu3), nematodo larva (n1), Procamallanus (Spirocamallanus) sp. (n2), quiste (q) y modificación corporal (mc). De los que corresponden al 2004 fueron 22 y del 2005 fueron 24, finalmente de los 34 parásitos, 12 se presentaron en ambos años. En la segunda matriz nombrada “ambiental” se colocaron los valores de las siete variables cuantitativas: prevalencia (P), temperatura (T), salinidad (S), oxígeno disuelto (O2), potencial hídrico (PH), precipitación pluvial promedio (PP) y de las cinco variables categóricas: época climática (1= Norte; 2= Seca; 3= Lluvia), zona ambiental (1= Arrecifal nerítico; 2= Lagunar costero; 3= Lagunar arrecifal), arrecifal nerítico (an), lagunar costero (lc), lagunar arrecifal (la). Las 12 variables se colocaron en las columnas y en las filas se colocaron las 123 estaciones de muestreo. Con la finalidad de disminuir la variabilidad entre las especies de quetognatos parasitados y las especies de parásitos en la matriz de especies, fueron transformadas a log (x+1) y con el mismo propósito de disminuir la magnitud de variabilidad en la matriz ambiental fue relativizada por columnas. 6.5.2.- Grupos de especies de quetognatos y parásitos Se realizó un análisis de agrupamiento de dos vías para obtener dendrogramas mediante el índice de Sorensen que permite medir el grado de 14 similitud entre las estaciones con base en las abundancias de los quetognatos parasitados y de los parásitos. Este índice es robusto ya que incorpora el coeficiente presencia/ausencia de las especies, junto con sus respectivas abundancias (Field et al., 1982). A partir de este índice se obtuvo un dendrograma (mediante el método de unión flexible,β -.25) que es un diagrama en forma de árbol realizado con los resultados del análisis de agrupamiento que indican cómo se relacionan dichas variables. 6.5.3.- Procedimiento de Permutación de Multi-Respuesta (PPMR) Posterior al análisis de agrupamiento se empleo un análisis de Procedimiento Permutacional de Multi-Respuesta (PPMR) (McCune & Mefford, 1999; McCune et al., 2002) para probar estadísticamente si existen diferencias significativas en las abundancias de los quetognatos parasitados y parásitos de los distintos grupos conformados. Debido a que esta es una prueba no-paramétrica, no fue necesario asumir que los datos biológicos tienen una distribución normal. 6.5.4.- Relaciones entre los grupos de quetognatos y parásitos definidos con las variables ambientales Con la finalidad de relacionar las variables ambientales con la abundancia de los quetognatos parasitados y los parásitos se aplicó un análisis de correspondencia canónica (ACC), el cual involucra la ordenación de una matríz (especies) mediante regresiones múltiples con una segunda matríz (ambiental). El resultado de este análisis se muestra en un diagrama de ordenación con las estaciones y especies de quetognatos y parásitos representadas por puntos y las variables representadas por flechas. Las especies y estaciones de muestreo conjuntamente representan los patrones dominantes en la distribución de la comunidad, la medida en que estos pueden ser explicados por las variables ambientales y los puntos de especies, y las flechas de las variables ambientales conjuntamente reflejan la distribución de las especies a lo largo de cada variable ambiental (Ter Braak, 1986). 15 7.- RESULTADOS 7.1.1.- Composición taxonómica de los quetognatos De los dos años de estudio se encontraron 12 especies de quetognatos las cuales han sido ubicadas dentro de cuatro familias. Krohnitta pacifica (Aida, 1897) fue asignada a la familia Krohnittidae Tokioka, 1965, Pterosagitta draco (Krohn, 1853) en la familia Pterosagittidae Tokioka, 1965. Eukrohnia hamata (Mobius, 1875) pertenece a la familia Eukrohniidae Tokioka, 1965 y finalmente de la familia Sagittidae Claus and Grobben, 1905 se encontró el mayor número de especies: Ferosagitta hispida (Conant, 1895), Flaccisagitta enflata (Grassi, 1881), Flaccisagitta hexaptera (d´Orbigny, 1843), Mesosagitta minima (Grassi, 1881), Sagitta bipunctata Quoy and Gaimard, 1827, Sagitta helenae Ritter-Zahony, 1910, S. friderici RitterZahony, 1911, S. tenuis Conant, 1896, y Serratosagitta serratodentata (Krohn, 1853). De las 12 especies identificadas solamente dos no fueron observadas en ambos años. Flaccisagitta hexaptera fue capturada solamente en el 2004, mientras que Eukrohnia hamata fue exclusiva del 2005. Las otras diez especies se presentaron en ambos años. 7.1.2.- Captura y abundancia de los quetognatos En el 2004, se capturaron 17,825 individuos y de las 12 especies identificadas F. hispida fue la especie que presentó la mayor abundancia (n= 13,189; A= 622.12) y le siguieron F. enflata (n= 2,477; A= 116.84), K. pacifica (n= 505; A= 23.82), S. serratodentata (n= 419; A= 19.76), S. tenuis (n= 189; A= 8.92), P. draco (n= 126; A= 5.94), F. hexaptera (n= 44; A= 2.08), S. friderici (n= 7; A= 0.33), S. helenae (n= 7; A= 0.33), M. minima (n= 2; A= 0.09), S. bipunctata (n= 1; A= 0.05) y finalmente Sagitta sp. (n= 859; A= 40.52). En la Tabla 1 se muestra el número de organismos capturados en las estaciones a lo largo del año. En el 2005, el número de organismos capturados fue de 49,375 y nuevamente F. hispida fue la especie más abundante a lo largo del año (n= 45697; A= 2155.52), posteriormente se ubicaron las especies F. enflata (n= 1935; A= 91.27), K. pacifica (n= 497; A= 23.44), S. serratodentata (n= 184; A= 8.68), M. minima (n= 86; A= 4.06), S. bipunctata (n=75; A= 3.54), S. tenuis (n= 54; A= 2.55), P. draco (n= 44; A= 2.08), 16 S. helenae (n= 28; A= 1.32), S. friderici (n= 16; A= 0.75), E. hamata (n= 3; A= 0.14) y Sagitta sp. (n= 756; A= 35.66). El número de organismos obtenidos de cada estación muestreada a lo largo del año se puede observar en la Tabla 2. 7.1.3.- Prevalencia de parasitismo de los quetognatos En el 2004 de los 17,825 organismos capturados se encontraron parasitados 1,153 quetognatos lo que significó una prevalencia de parasitismo anual del 6.47%. La especie F. hispida fue la de mayor prevalencia de parasitismo 7.75% (Hr= 13,189; Hp= 1,022). En segundo grado de parasitismo se presentó F. enflata con un 5.01% (Hr= 2,477; Hp= 124), posteriormente siguió P. draco con un 4.76% de prevalencia (Hr= 126; Hp= 6) y por último se determinó a S. serratodentata con un 0.24% (Hr= 419; Hp= 1). En el ciclo del 2005, de los 49,375 quetognatos capturados resultaron 2,867 individuos parasitados lo que representó una prevalencia de parasitismo anual del 5.79%. En este año F. enflata fue la especie de mayor prevalencia de parasitismo con 8.99% (Hr= 1,935; Hp= 174) a pesar de no haber sido en la que se encontró el mayor número de quetognatos parasitados. De la especie S. serratodentata se obtuvo una prevalencia del 5.98% (Hr= 184; Hp= 11). Posteriormente en menor grado de parasitismo se observo a F. hispida con una prevalencia de 5.85% (Hr= 45,697; Hp= 2,672). Por último se obtuvo una prevalencia de 1.32% de aquellos individuos que fueron considerados como Sagitta sp. (Hr= 756; Hp= 10). 7.2.1.- Distribución espacial de los quetognatos capturados y parasitados En el 2004 (Tabla 1), de las estaciones tres (n= 5,390), cuatro (4,230) y cinco (n= 2,505) se extrajeron la mayor cantidad de quetognatos. Estas estaciones son ubicadas dentro del ambiente lagunar costero del cual se obtuvo un total de 13,281 individuos. Del ambiente arrecifal nerítico se obtuvieron 1,891 organismos en su mayoría de la estación dos (n= 1,260). En el caso del ambiente lagunar arrecifal fueron encontrados 2,653 quetognatos, siendo principalmente de la estación doce (n= 958). 17 En el 2005 (Tabla 2), la captura de quetognatos fue coincidente con lo que respecta al 2004 en su variación espacial, esto es, de las estaciones tres (n= 17,248), cuatro (n= 15,140) y cinco (n= 8,708) se obtuvo el mayor número de organismos de todas las estaciones y por tal, predominó el ambiente lagunar costero (n= 44,313) con respecto a los demás ambientes. En el caso del ambiente lagunar arrecifal se obtuvieron 3,597 quetognatos de los cuales en su mayoría estuvieron distribuidos en la estaciones nueve (n= 1,014) y once (n= 891). Finalmente, del ambiente arrecifal nerítico se obtuvieron 1,465 ejemplares, siendo en principalmente de la estación uno (n= 1,362). En lo que respecta al parasitismo, en el 2004 se encontraron 1,153 organismos parasitados (Tabla 3), los cuales fueron extraídos principalmente de la estación cuatro (n= 626) y en segunda instancia de la estación tres (n= 257), ambas estaciones se ubican dentro del sistema lagunar costero del cual se obtuvieron 987 individuos parasitados. Del ambiente lagunar arrecifal se obtuvieron 85 quetognatos parasitados principalmente de las estaciones once (n= 22) y doce (n= 24). Por último del ambiente arrecifal nerítico se obtuvieron los 81 organismos parasitados restantes que correspondieron a las estaciones uno (n= 56) y dos (n= 25). La situación en el 2005 fue diferente respecto al 2004, se obtuvo un total de 2,867 organismos parasitados (Tabla 4). Las estaciones que mostraron mayor número de quetognatos parasitados fueron la tres (n= 944), cuatro (n= 1,001) y cinco (n= 652), estaciones que pertenecen a la zona lagunar costera (n= 2,619). De las estaciones siete a la doce de la zona lagunar arrecifal se obtuvieron 145 organismos parasitados destacando en este ambiente la estación once como la que más organismos parasitados hubo y por último de las estaciones uno y dos en conjunto se observaron 103 quetognatos parasitados aunque la estación uno fue la más parasitada (n= 101). 7.2.2.- Distribución temporal de los quetognatos capturados y parasitados En la Tabla 1 que corresponde a la captura de quetognatos del 2004, se puede observar el número de organismos obtenidos en cada uno de los meses en cada una de las estaciones. Se observa que el mayor número de organismos 18 capturados fue en la primera mitad del año, siendo enero (n= 3,432), febrero (n= 3,634), marzo (n= 2,338), mayo (n= 2,062), junio (n= 1,279) y julio (n= 1,068) los más numerosos a diferencia de los meses restantes en donde incluso del mes de agosto solo se obtuvieron 281 individuos. En los quetognatos parasitados del 2004 (Tabla 3), se presenta el mismo patrón de captura, esto es, en su mayoría correspondieron a la primera mitad del año. Siendo junio (n= 430) y enero (n= 200) los de mayor cantidad de quetognatos parasitados. El mes de de menor organismos parasitados fue agosto con un organismo parasitado. En el 2005, la captura de quetognatos fue muy diferente con respecto al 2004 (Tabla 2), en este año no se observó un patrón. Los meses de mayor número de individuos fueron marzo (n= 10,999), septiembre (n= 7,867), abril (n= 6,816) y mayo (n= 5,560) por lo que se puede notar que la captura estuvo más distribuida a lo largo del año. Noviembre fue el periodo en el que menos organismos se encontraron con solo 703, aunque este número es mayor al mínimo registrado en agosto del 2004. El parasitismo en el 2005 (Tabla 4) estuvo dominado por los meses de marzo (n= 1,024) y septiembre (n= 337), sin embargo, hubo gran diferencia entre estos dos. De este año, octubre fue el de menor parasitismo (n= 28). 7.2.3.- Prevalencia de parasitismo espacial y temporal (2004 y 2005) En lo que respecta a la variación espacial de la prevalencia de parasitismo, en el 2004 (Tabla 5) hubo una mayor prevalencia en la estación cuatro (P= 14.80%) con respecto a todas las demás estaciones. A ésta, le continuaron las estaciones uno (P= 8.87%) y ocho (P= 8.62%), y en último caso la estación seis con solo el 1.30%. De los tres ambientes la mayor prevalencia fue en el ambiente lagunar costero (P= 7.43%) posteriormente fue el ambiente arrecifal nerítico (P= 4.28%) y por último el lagunar arrecifal (P= 3.20%). Por su parte, en lo que se refiere a la variación temporal de este mismo año (Tabla 5), junio fue el de mayor prevalencia de parasitismo (P= 33.62%) a diferencia de las demás estaciones. Abril fue el segundo mes (P= 12.71%) y le siguieron enero (P= 5.83%), marzo (P= 5.26%) y mayo (P= 5.24%). Por último, agosto tuvo la menor prevalencia de este año siendo tan solo de 0.36% (Tabla 5). 19 En el caso del 2005, la prevalencia de parasitismo en la variación espacial fue diferente con respecto al 2004 (Tabla 6). La estación de la cual se obtuvo la prevalencia más alta fue la cinco (P= 7.49%) y de esta le siguieron, la uno (P= 7.42%) y cuatro (P= 6.61%), y por último la estación seis tuvo tan solo el 0.68%. Ahora bien, de los tres ambientes, el arrecifal nerítico tuvo una prevalencia mayor con respecto a los otros dos ambientes (P= 7.03%). En el lagunar costero fue de 5.89% y en el lagunar arrecifal fue de 4.03%. La variación en la prevalencia de parasitismo temporal en este mismo año fue de la siguiente manera: junio como el de de mayor valor (P= 9.60%), seguida de marzo (P= 9.31%), febrero (P= 6.92%) y noviembre (P= 6.54%), y por último octubre, con tan solo el 1.84%. 20 Tabla 1.- Quetognatos capturados en el norte de Quintana Roo durante el 2004 (E= enero; F= febrero; M= marzo; A= abril; Ma= mayo; J= junio; Jul= julio; Ag= Agosto; S= septiembre; O= octubre; N= noviembre; D= diciembre). Arrecifal nerítico Lagunar costero Lagunar arrecifal Mes E F M A Estación 1 125 104 80 11 2 50 1 1077 12 3 275 372 1030 130 4 1840 944 116 214 5 283 1359 0 311 6 2 154 1 3 7 0 32 6 4 8 0 12 4 0 9 266 41 17 1 10 75 36 4 94 11 318 62 2 16 12 198 517 1 54 Total Ma J Jul Ag S O N D Total 67 30 687 70 112 943 95 2 0 8 30 18 8 1 745 438 22 5 17 15 0 22 3 3 7 76 365 488 7 1 31 4 12 63 6 8 29 69 36 18 77 5 2 1 4 1 127 618 533 179 329 77 26 0 6 11 20 26 27 317 21 0 3 22 1 21 1 6 10 0 4 2 11 6 0 2 3 8 103 21 0 8 1 14 67 13 4 58 4 32 19 5 129 19 0 6 631 1260 5390 4230 2505 1156 206 58 472 405 554 958 3432 3634 2338 850 2062 1279 1068 281 957 775 645 504 17825 1891 13281 2653 21 Tabla 2.- Quetognatos capturados en el norte de Quintana Roo durante el 2005. Mes E F M A Ma J Jul Ag S O N D Total Estación Arrecifal 1 0 313 196 12 4 0 12 1 48 86 389 301 1362 nerítico 2 0 8 3 5 0 4 9 23 1 12 12 26 103 3 393 1306 5140 1559 3616 809 1871 382 1584 0 3 585 17248 44313 Lagunar 4 51 1524 3577 3040 207 271 285 360 4254 350 83 1138 15140 costero 5 26 1267 1892 1548 1378 996 7 678 720 43 0 153 8708 6 1832 43 187 643 295 0 23 7 185 2 0 0 3217 7 15 3 3 3 37 1 6 32 11 5 68 16 200 Lagunar 8 1 0 0 4 7 0 0 1 59 25 6 2 105 arrecifal 9 62 9 0 1 9 35 0 1 337 493 0 67 1014 10 21 41 1 0 2 24 36 17 32 308 44 123 649 11 72 20 0 1 0 77 6 1 531 25 58 100 891 12 251 9 0 0 5 95 29 3 105 175 40 26 738 Total 2724 4543 10999 6816 5560 2312 2284 1506 7867 1524 703 2537 1465 3597 49375 22 Tabla 3.- Quetognatos parasitados en el norte de Quintana Roo durante el 2004. Mes E F M A MA J JU AG S O N D Total Estación Arrecifal 1 7 12 11 0 1 0 1 0 7 11 3 3 56 nerítico 2 2 0 21 0 1 0 1 0 0 0 0 0 25 3 7 41 71 14 53 55 3 0 0 0 5 8 257 Lagunar 4 129 21 20 66 7 375 8 0 0 0 0 0 626 costero 5 20 15 0 24 28 0 0 0 0 1 1 0 89 6 0 0 0 0 15 0 0 0 0 0 0 0 15 7 0 4 0 0 0 0 0 0 0 0 0 0 4 Lagunar 8 0 4 0 0 1 0 0 0 0 0 0 0 5 arrecifal 9 6 5 0 0 0 0 0 1 0 1 3 0 16 10 2 3 0 3 1 0 0 0 1 1 3 0 14 11 21 1 0 0 0 0 0 0 0 0 0 0 22 12 6 15 0 1 1 0 0 0 0 0 1 0 24 200 121 123 108 108 430 13 1 8 14 16 11 Total 81 987 85 1153 23 Tabla 4.- Quetognatos parasitados en el norte de Quintana Roo durante el 2005. Mes E F M A May J Jul Ag S O N D Total Estación Arrecifal 1 0 40 9 1 1 0 0 0 1 6 19 24 101 nerírtico 2 0 0 0 0 0 0 0 0 0 0 1 1 2 3 12 103 275 77 218 81 87 5 50 0 0 36 944 Lagunar 4 0 20 599 145 11 2 6 0 150 6 2 60 1001 costero 5 0 136 139 36 74 133 0 23 101 0 0 10 652 6 15 1 2 3 1 0 0 0 0 0 0 0 22 7 1 0 0 0 0 0 0 2 0 0 9 1 13 Lagunar 8 1 0 0 0 0 0 0 0 0 1 0 0 2 arrecifal 9 12 2 0 0 0 0 0 0 12 9 0 0 35 10 3 3 0 0 0 0 1 1 0 4 0 10 22 11 0 6 0 0 0 4 0 0 20 2 16 6 54 12 9 3 0 0 0 2 1 0 3 0 0 1 19 Total 53 305 222 95 31 337 28 47 149 2867 314 1024 262 103 2619 145 24 Tabla 5a.- Prevalencia de parasitismo espacial y temporal en el norte de Quintana Roo durante el 2004. Mes E F M A Ma J Estación Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) 1 7/125 (5.6) 12/104 (11.54) 11/80 (13.75) 0 1/67 (1.49) 0 2 2/50 (4.0) 0 21/1077 (1.95) 0 1/30 (3.33) 0 3 7/275 (2.55) 41/372 (11.02) 71/1030 (6.89) 14/130 (10.77) 53/687 (7.71) 55/745 (7.38) 4 129/1840 (7.01) 21/944 (2.22) 20/116 (17.24) 66/214 (30.84) 7/70 (10.0) 375/438 (85.62) 5 20/283 (7.07) 15/1359 (1.10) 0 24/214 (7.72) 28/112 (25.0) 0 6 0 0 0 0 15/943 (1.59) 0 7 0 4/32 (12.50) 0 0 0 0 8 0 4/12 (33.33) 0 0 1/2 (50.0) 0 9 6/266 (2.26) 5/41 (12.20) 0 0 0 0 10 2/75 (2.67) 3/36 (8.33) 0 3/94 (3.19) 1/8 (12.50) 0 11 21/318 (6.60) 1/62 (1.61) 0 0 0 0 12 6/198 (3.03) 15/517 (2.90) 0 1/54 (1.85) 1/18 (5.56) 0 Total 200/3432 (5.83) 121/3634 (3.33) 123/2338 (5.26) 108/850 (12.71) 108/2062 (5.24) 430/1279 (33.62) 25 Tabla 5b.- Continuación. Jul Ag S O N D Total Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) 1/7 (14.29) 0 7/69 (10.14) 11/36 (30.56) 3/18 (16.67) 3/77 (3.90) 56/631 (8.87) 1/76 (1.32) 0 0 0 0 0 25/1260 (1.98) 3/365 (0.82) 0 0 0 5/179 (2.79) 8/329 (2.43) 257/5390 (4.77) 8/488 (1.64) 0 0 0 0 0 626/4230 (14.80) 0 0 0 1/27 (3.70) 1/317 (0.32) 0 89/2505 (3.55) 0 0 0 0 0 0 15/1156 (1.30) 0 0 0 0 0 0 4/206 (1.94) 0 0 0 0 0 0 5/58 (8.62) 0 1/3 (33.33) 0 1/103 (0.97) 3/21 (14.29) 0 16/472 (3.39) 0 0 1/1 (100.0) 1/14 (7.14) 3/67 (4.48) 0 14/405 (3.46) 0 0 0 0 0 0 22/554 (3.97) 0 0 0 0 0 0 24/958 (2.51) 13/1068 (1.22) 1/281 (0.36) 8/957 (0.84) 14/775 (1.81) 16/645 (2.48) 11/504 (2.18) 1153/17825 (6.47) 26 Tabla 6a.- Prevalencia de parasitismo espacial y temporal en el norte de Quintana Roo durante el 2005. Mes E F M A Ma J Est. Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) 1 0 40/313 (12.78) 9/196 (4.60) 1/12 (8.33) 1/4 (25) 2 0 0 0 0 3 12/393 (3.05) 103/1306 (7.89) 275/5140 (5.35) 77/1559 (4.94) 218/3616 (6.03) 81/809 (10.01) 4 0 20/1524 (1.31) 599/3577 (16.75) 145/3040 (4.77) 11/207 (5.31) 2/271 (0.74) 5 0 136/1267 (10.73) 139/1892 (7.35) 36/1548 (2.33) 74/1378 (5.37) 133/996 (13.35) 6 15/1832 (0.82) 1/43 (2.33) 2/187 (1.07) 3/643 (0.47) 1/295 (0.34) 7 1/15 (6.67) 0 0 0 0 8 1/1 (100.0) 0 0 0 0 9 12/62 (19.35) 2/9 (22.22) 0 0 0 0 10 3/21 (14.29) 3/41 (7.32) 0 0 0 0 11 0 6/20 (30) 0 0 12 9/251 (3.59) 3/9 (33.33) 0 0 0 2/95 (2.10) Total 53/2724 (1.95) 314/4543 (6.92) 1024/10999 (9.31) 262/6816 (3.84) 295/5560 (5.31) 222/2312 (9.60) 0 0 4/77 (5.19) 27 Tabla 6b.- Continuación. Jul Ag S O N D Total Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) Hp/Hr (P%) 0 0 1/48 (2.08) 6/86 (6.98) 19/389 (4.88) 24/301 (7.97) 101/ 1362 (7.42) 0 0 0 0 1/12 (8.33) 1/26 (3.85) 2/103 (1.94) 87/1871 (4.65) 5/382 (1.31) 50/1584 (3.16) 0 36/585 (6.15) 934/17248 (5.41) 6/285 (2.10) 0 150/4254 (3.53) 6/350 (1.71) 2/83 (2.41) 60/1138 (5.27) 1001/15140 (6.61) 0 23/678 (3.39) 101/720 (14.03) 0 10/153 (6.54) 652/8708 (7.49) 0 0 0 0 0 2/32 (6.25) 0 0 9/68 (13.23) 1/16 (6.25) 13/200 (6.5) 0 0 1/25 (4) 0 0 2/105 (1.90) 0 12/337 (3.56) 9/493 (1.83) 0 35/1014 (3.45) 1/36 (2.78) 1/17 (5.88) 0 4/308 (1.30) 0 10/123 (8.13) 22/649 (3.39) 0 0 20/531 (3.77) 2/25 (8) 15/58 (25.86) 7/100 (7) 54/891 (6.06) 1/29 (3.45) 0 3/105 (2.86) 0 0 1/26 (3.85) 19/738 (2.57) 95/2284 (4.16) 31/1506 (2.06) 337/7867 (4.28) 28/1524 (1.84) 46/703 (6.54) 150/2537 (5.91) 2857/49375 (5.79) 22/3217 (0.68) 28 7.3.- Parámetros ecológicos: abundancia, prevalencia e intensidad media de parasitismo para de cada especie de quetognato Debido al poco desarrollo de las características de importancia taxonómica que presentaron algunos parásitos no fue posible identificarlos a nivel genérico o específico por lo que se mantienen como quistes. En el Anexo I se muestra el listado taxonómico que corresponde a los helmintos identificados y en la Tabla 7, se detalla la prevalencia de parasitismo e intensidad media de infección en cada año (2004 y 2005) diferenciando los valores obtenidos de los helmintos y de los quistes. Tabla 7. Prevalencia (P%) e intensidad media de parasitismo anual (I) (C= céstodos; Hr= hospederos revisados; Hp= hospederos parasitados; N= nemátodos; T= tremátodos; Tu= platelmintos). Ciclo 2004 Helmíntos Hr Quistes Modificación corporal Total P (%) Parásitos I T C M Tu N 17825 343 17825 4 17826 1 17826 0 17825 2 17825 348 17825 1146 17825 78 17825 1153 1.92 0.02 0.01 0.00 0.01 1.95 6.43 0.44 6.47 648 6 1 0 2 657 3480 78 4215 1.89 1.50 1.00 0.00 1.00 1.89 3.04 1.00 3.66 T C M Tu N 49375 438 49375 7 49375 0 49375 13 49375 1 49375 459 49375 2789 49375 0 49375 2867 0.89 0.01 0.00 0.03 0.00 0.93 5.65 0.00 5.81 491 7 0 13 1 512 5133 0 5645 1.12 1.00 0.00 0.00 1.00 1.12 1.84 0.00 1.97 Quistes Modificación corporal Total 2005 Helmíntos Hp 29 En lo que respecta al parasitismo del 2004; 1,153 fueron los quetognatos parasitados presentándose 4,215 parásitos en diferentes fases larvales y sitios de infección; uno en la cabeza (ca), 426 en el intestino (i), 3,772 correspondieron al saco celómico (sc) y 16 en el septo caudal (sep). De éstos, solamente 657 se pudieron ubicar dentro de dos phylum de helmintos. 1.- Phylum Platyhelminthes fueron 655 que corresponden a tres clases: a) De la clase Trematoda (n= 648) se identificaron en fase esporocisto (n= 6), en fase cercaria a Cercaria owreae (n= 2), en fase metacercaria a los didimozoides tipo Monilicaecum (n= 93), las metacercarias de hemiúridos a nivel familia (n= 17) y a género Parahemiurus sp. (n= 5), Lecithochirium sp. (n= 22), Brachyphallus sp. (n= 8), Paralecithochirium sp. (n= 1) y Opisthadena sp. (n= 1). Además de las metacercarias Opechona pyriforme (n= 6) de la familia Lepocreadiidae. Hubo individuos que solamente fueron diferenciados como dístoma tipo F (n= 1) y G (n= 486) por presentar las dos ventosas características de esta clase. b) De la clase Cestoidea (n= 6) se encontraron larvas en fase metacéstodo tipo Plerocercoide A (n= 1), B (n= 1), C (n= 1), D (n= 1) y E (n= 2). c) De la clase Monogenea se obtuvó un organismo. 2.- Phylum Nematoda fueron dos. Uno en fase larval 3 identificado como Procamallanus (Spirocamallanus) sp. y un segundo en posible fase larval 2 que debido a su pequeño tamaño no permitió la visión de las características taxonómicas por tal se mantiene a nivel de phylum. Por otra parte en el 2005, se presentaron 5,645 parásitos en los 2,867 quetognatos parasitados y fueron encontrados ubicados en diferentes sitios de infección: 10 en la cabeza, 21 en el intestino (i), 5,603 en el saco celómico (sc) y 12 en el septo caudal (sep). Sin embargo, solamente se pudieron ubicar 512 dentro de algún phylum de helmintos. 1.- Del Phylum Platyhelmintes fueron 511, de estos 13 se mantienen a nivel de phylum (un platelminto tipo A, once platelmintos tipo B y un platelminto tipo C) y los 498 restantes corresponden a dos clases: a) De la clase Trematoda (n= 491) se identificaron en fase cercaria a Cercaria owreae (n= 4) y en fase metacercaria a los s didimozoides tipo Monilicaecum (n= 30 153), 167 metacercarias a nivel familia Hemiuridae y a nivel genérico están Hemiurus sp. (n= 16), Parahemiurus sp. (n= 8), Brachyphallus sp. (n= 47), Opisthadena sp. (n= 1) y Adinosoma sp. (n= 19). Además de las metacercarias Opechona pyriforme (n= 6) de la familia Lepocreadiidae y Tergestia sp. (n= 12) de la familia Fellodistomidae. Por la presencia de las dos ventosas: oral y ventral de algunos organismos se les pudo ubicar dentro de esta clase sin embargo, son considerados como Distoma tipo A (n= 1), tipo B (n= 1), tipo C (n= 1), tipo D (n= 1), tipo E (n= 1), tipo F (n= 1) y tipo G (n= 52). b) De la clase Cestoidea (n= 7) se encontraron individuos en metacéstodo Plerocercoide tipo B (n= 6) y tipo E (n= 1). 2.- Del Phylum Nematoda, se encontró una larva la cual no pudo ser identificada por su tamaño pequeño. Los parámetros ecológicos de cada parásito en cada hospedero se mencionan en forma de tabla. En F. hispida (Tabla 8), en F. enflata (Tabla 9), en S. serratodentata (Tabla 10), en P. draco (Tabla 11) y en Sagitta sp. (Tabla 12). En cada tabla se indica la prevalencia de parasitismo (P%) e intensidad media de infección (I) por hospedero, se incluye la estación (Est.), mes y año en el cual se registra cada helminto y se menciona el sitio de infección (SI) en el que fue encontrado cada parásito: cabeza (ca), intestino (i), saco celómico (sc) y septo caudal (sep). Finalmente se agrega el número designado en la Colección Parasitológica (CPMHN-UABCS). 31 Tabla 8.- Fauna parasitaria y parámetros ecológicos en F. hispida (2004 y 2005). F. hispida 2004 Distoma tipo C Distoma tipo D Distoma tipo E Distoma tipo F Distoma tipo G n 1 1 1 1 486 SI sc sc sc sc sc, i Hr/Hp P (%) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 13189/168 (1.27) Helmin (I) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 459 (2.73) Esporocisto 6 sc, i 13189/6 (0.04) 6 (1.00) Monilicaecum 93 13189/2 (0.02) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/2 (0.02) 13189/1 (0.01) 2 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 6 (3.00) 1 (1.00) Mes M A M Jul E F M A Ma J Ag Ma J E F F F M A Jul S O N Est 4 5 4 3 4, 5, 11 1, 3, 9 3 4 3, 6 3, 4 9 5 4 11 1 3 12 2 4 2 1 1 1 CPMHN-UABCS 336, 337, 338 339, 340, 341 342 343 344,345 346, 347 348 359 360 32 Hemiuridae sin identificar 17 Parahemiurus sp. 5 Lecithochirium sp. 22 Brachyphallus sp. 8 Paralecithochirium sp. Opechona pyriforme Plerocercoide A Plerocercoide B 1 6 1 1 13189/1 (0.01) 13189/1 (0.01) 13189/3 (0.02) 13189/3 (0.02) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/3 (0.02) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/1 (0.01) 13189/2 (0.015) 13189/2 (0.015) 13189/1 (0.008) 13189/1 (0.008) 13189/2 (0.015) 13189/2 (0.015) 13189/2 (0.015) 13189/2 (0.015) 13189/3 (0.023) 13189/4 (0.030) 13189/2 (0.015) 13189/5 (0.038) 13189/1 (0.01) 13189/1 (0.008) 13189/1 (0.008) 13189/1 (0.008) 1 (1.00) 1 (1.00) 3 (1.00) 3 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 3 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 2 (1.00) 2 (1.00) 3 (1.00) 5 (1.25) 2 (1.00) 5 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) N D M A Ma J J N D E F A Ma J E F M A Ma J J Jul N D E J S M E M 12 1 3 4 3 3 4 3 3 4 3 4 6 4 3 3 3 4 3 3 4 3 3 3 5 4 1 2 4 3 33 Nematoda P. (Spirocamallanus.) sp. Quiste 1 1 Modificación Corporal 78 2005 Distoma G n sc, i SI 13189/1 (0.01) 13189/1 (0.01) 13189/773 (5.86) 1 (1.00) 1 (1.00) 3238 (4.19) 13189/76 (0.58) 76 (1.00) Hr/Hp P (%) 45697/13 (0.03) Helmin (I) 18 (1.38) Ma E E F M A Ma J Jul S O N D E M A Ma J S O N 3 11 1, 3, 4, 5 1, 3, 4, 7, 8, 10, 12 2, 3, 4 3, 4, 5, 10 3, 4, 5, 6 3, 4 3, 4 1 10 1, 5 3 4 1, 2, 3 4, 10 6 3, 4 1 9 3 Mes F M A Ma Ag S Est 4 3 6 3, 4 7 3 362-365 366-372 373, 374, 375 376-379 380-383 384, 385 386, 387 388 389 390, 391 392 414 415, 416, 417 418, 419 420 421, 422 423 424 425 CPMHN-UABCS 34 Monilicaecum Hemiuridae sin identificar Hemiurus sp. 16 45697/1 (0.002) 45697/2 (0.004) 45697/1 (0.002) 45697/2 (0.004) 45697/3 (0.006) 45697/15 (0.033) 45697/1 (0.002) 45697/29 (0.063) 45697/3 (0.006) 45697/3 (0.006) 45697/4 (0.008) 45697/3 (0.006) 45697/5 (0.011) 45697/52 (0.113) 45697/17 (0.037) 45697/3 (0.006) 45697/1 (0.002) 45697/2 (0.004) 45697/5 (0.011) 45697/1 (0.002) 45697/2 (0.004) 45697/2 (0.004) 45697/2 (0.004) 45697/1 (0.002) 45697/2 (0.004) 45697/2 (0.004) 45697/1 (0.002) 1 (1.00) 2 (1.00) 1 (1.00) 2 (1.00) 3 (1.00) 15 (1.00) 1 (1.00) 29 (1.00) 3 (1.00) 3 (1.00) 4 (1.00) 3 (1.00) 5 (1.00) 52 (1.00) 17 (1.00) 3 (1.00) 1 (1.00) 2 (1.00) 5 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 2 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 1 (1.00) O N 4 11 O O N D E F F M M M A A A Ma J Jul Jul A S S S S O O D F F 8 9 11 10 3 3 4 3 4 5 3 4 5 3 3 3 10 5 3 4 9 11 9 10 5 4 5 35 Parahemiurus sp. 8 Brachyphallus sp. 46 Opisthadena sp. Adinosoma sp. 19 45697/7 (0.015) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/2 (0.004) 45697/1 (0.002) 45697/1 (0.002) 45697/2 (0.004) 45697/2 (0.004) 45697/3 (0.007) 45697/2 (0.004) 45697/4 (0.009) 45697/1 (0.002) 45697/2 (0.004) 45697/3 (0.007) 45697/3 (0.007) 45697/1 (0.002) 45697/4 (0.009) 45697/9 (0.020) 45697/6 (0.013) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/2 (0.004) 45697/4 (0.008) 45697/1 (0.002) 7 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 3 (1.00) 2 (1.00) 4 (1.00) 1 (1.00) 2 (1.00) 3 (1.00) 3 (1.00) 1 (1.00) 5 (1.25) 9 (1.00) 6 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 4 (1.00) 1 (1.00) M Ma J Ag S S M M M A Ma A E F F M M M A S S S S O O E E M A A 4 3 5 5 4 11 3 4 5 4 3 5 3 3 4 3 4 5 4 4 5 9 11 9 11 6 3 4 3 4 36 Opechona pyriforme Tergestia sp. Plerocercoide B Plerocercoide E Platelminto A Platelminto B Platelminto C Quiste 1 sc, i 45697/1 (0.002) 45697/1 (0.002) 45697/2 (0.004) 45697/2 (0.004) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/7 (0.015) 45697/1 (0.002) 45697/3 (0.007) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (0.002) 45697/1 (.002) 45697/1 (.002) 45697/1 (.002) 45697/1 (.002) 45697/1 (.002) 45697/1 (.002) 45697/2 (0.004) 45697/2 (0.004) 45697/1 (.002) 45697/2751 (6.01) 1 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 3 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 2 (1.00) 1 (1.00) 5062 (1.84) Ma Jul S O O N F Ma S S D F M F M M E F M M A Ma D M E F M A Ma J 5 3 9 10 11 1 12 5 3 11 10 3 3 3 3 5 6 3 3 4 3 5 4 4 3, 6 3, 4, 5, 6 3, 4, 5, 6 1, 3, 4, 5, 6 3, 4, 5, 6 3, 4, 5 37 Jul Ag S O N D 3, 4 3, 5, 7 3, 4, 5 3 1, 11 1, 3, 4, 5 Tabla 9.- Fauna parasitaria y parámetros ecológicos en F. enflata (2004 y 2005). F. enflata 2004 Larva Monogéneo Distoma tipo G n 1 22 sc, i Cercaria owreae 2 sc Monilicaecum SI Hr/Hp P (%) 2477/1 (0.04) 2477/18 (0.73) Helmin (I) 1(1.00) 22 (1.22) 2477/1 (0.04) 2477/1 (0.04) 2477/3 (0.12) 2477/1 (0.04) 2477/3 (0.12) 2477/1 (0.04) 2477/14 (0.57) 2477/3 (0.12) 1 (1.00) 1 (1.00) 3 (1.00) 1 (1.00) 3 (1.00) 1 (1.00) 11 (1.14) 3 (1.00) Mes M E F M Jul S O Jul O E E E E E E Est 1 9, 11 1, 9, 12 2 1 1 1 1 1 1 2 9 10 11 12 CPMHN-UABCS 349, 350 351, 352, 353 354 355 356 357 265 266 38 Hemiuridae sin identificar Brachyphallus sp. Opisthadena sp. Opechona pyriforme Plerocercoide C Plerocercoide D Quiste 1 1 sc, i 2477/10 (0.40) 2477/1 (0.04) 2477/1 (0.04) 2477/5 (0.20) 2477/8 (0.32) 2477/14 (0.57) 2477/1 (0.04) 2477/1 (0.04) 2477/3 (0.12) 2477/1 (0.04) 2477/2 (0.08) 2477/1 (0.04) 2477/2 (0.08) 2477/1 (0.040) 2477/1(0.04) 2477/2 (0.081) 2477/1 (0.040) 2477/1 (0.040) 2477/1 (0.04) 2477/1 (0.04) 2477/73 (2.95) 10 (1.00) 1 (1.00) 1 (1.00) 5 (1.00) 8 (1.00) 14 (1.00) 1 (1.00) 1 (1.00) 3 (1.00) 1 (1.00) 2 (1.00) 1 (1.00) 2 (1.00) 1 (1.00) 1 (1.00) 3 (1.5) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 148 (2.03) F F F F M M Ma Ma O N N F S S F F F M O N E F M A Ma S O N D 1 7 11 12 1 2 2 12 1 1 9 12 1 1 10 7 9 2 1 10 2, 9, 10, 11, 12 7, 8, 9, 12 1, 2 12 1 1 1 9, 10 1 393-397 398-401 402, 403 404 405 406 407 408, 409 410 39 2005 Distoma tipo A Distoma tipo B Distoma tipo G n 1 1 34 Cercaria owreae 4 Monilicaecum SI i sc Hr/Hp P (%) 1395/1 (0.07) 1395/1 (0.07) 1935/27 (0.87) Helmin (I) 1 (1.00) 1 (1.00) 34 (1.26) 1935/2 (0.10) 1935/1 (0.05) 1935/1 (0.05) 1935/1 (0.52) 1935/1 (0.52) 1935/11 (0.57) 1935/4 (0.207) 1935/8 (0.41) 1935/35 (1.81) 1935/1 (0.05) 1935/1 (0.05) 1935/6 (0.31) 1935/1 (0.52) 1935/6 (0.31) 1935/1 (0.05) 1935/2 (0.10) 1935/1 (0.05) 1935/5 (0.26) 1935/6 (0.31) 1935/1 (0.05) 1935/1 (0.05) 1935/2 (0.10) 1935/11 (0.57) 1935/9 (0.46) 2 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 11 (1.00) 5 (1.25) 9 (1.125) 38 (1.09) 1 (1.00) 1 (1.00) 7 (1.17) 1 (1.00) 8 (1.33) 1 (1.00) 2 (1.00) 1 (1.00) 5 (1.00) 6 (1.00) 1 (1.00) 1 (1.00) 3 (1.5) 12 (1.09) 9 (1.00) Mes F F M N D M N D E E E E E F F F F F M Ma J J O N N N N N D Est 1 10 1 1, 4, 7, 11 1 1 11 12 7 8 9 10 12 1 9 10 11 12 1 1 11 12 1 1 2 4 7 11 1 CPMHN-UABCS 40 Hemiuridae sin identificar Adinosoma sp. Opechona pyriforme Tergestia sp. Platelminto B Nematoda Quiste sc, i 1935/1 (0.05) 1935/1 (0.05) 1935/4 (0.21) 1935/4 (0.21) 1935/1 (0.052) 1 (1.00) 1 (1.00) 7 (1.75) 4 (1.00) 1 (1.00) D D D D F 3 7 10 11 1 1935/1 (0.052) 1935/1 (0.052) 1935/1 (0.052) 1935/2 (0.103) 1935/1 (0.052) 1935/2 (0.103) 1935/1 (0.052) 1395/1 (0.07) 1935/20 (1.03) 1 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 1 (1.00) 2 (1.00) 1 (1.00) 1 (1.00) 42 (2.10) O D F F J D N E F M J S N D 10 1 9 10 12 10 4 10 1, 11 1 11 1, 12 1, 7, 11 1, 2, 11 41 Tabla 10.- Fauna parasitaria y parámetros ecológicos en S. serratodentata (2004 y 2005). S. serrratodentata 2004 Quiste n SI sc Hr/Hp P (%) 419/1 (0.24) Helmin (I) 1 (1.00) Mes F Est 12 184/1 (0.54) 184/1 (0.54) 184/1 (0.54) 184/1 (0.54) 184/1 (0.54) 184/2 (1.09) 184/1 (0.54) 184/1 (0.54) 184/1 (0.54) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 2 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) E E F F N D D D S 9 12 11 12 1 1 3 11 1 184/1 (0.54) 184/1 (0.54) 184/1 (0.54) 184/1 (0.54) 184/1 (0.0543) 184/15 (8.15) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 12 (0.8) S F Ma F F F M N D 11 3 3 3 3 1 5 1, 11 1 CPMHN-UABCS 413 2005 Hemiuridae sin identificar Brachyphallus sp. Plerocercoide B Plerocercoide E Platelminto B Quiste sc, i 42 Tabla 11.- Fauna parasitaria y parámetros ecológicos en P. draco (2004 y 2005). P. draco 2004 Distoma tipo G Monilicaecum Quiste n 5 Habitat sc, i sep sc, i Hr/Hp P (%) 126/2 (1.59) 126/1 (0.79) 126/23 (18.25) Helmin (I) 5 (2.50) 1 (1.00) 82 (3.57) Mes E F F N Est 11 9 8 1 CPMHN-UABCS 358 411 412 Tabla 12.- Fauna parasitaria y parámetros ecológicos en Sagitta sp (2004 y 2005). Sagitta sp. 2005 Monilicaecum Hemiurus sp. Brachyphallus sp. Adinosoma sp. Tergestia sp. Quiste N SI sc, i Hr/Hp P (%) 756/1 (0.12) 184/1 (0.54) 756/2 (0.26) 756/1 (0.13) 756/1 (0.132) 756/1 (0.132) 756/3 (0.40) Helmin (I) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 1 (1.00) 14 (4.66) Mes S S S S S S Ag S N Est 12 11 9 12 9 12 10 9 11 CPMHN-UABCS 43 7.4.- Descripción de las características morfológicas y anatómicas de los parásitos encontrados en ambos años Las descripciones y medidas de cada helmínto se basaron en un número de 10 ejemplares, exceptuando aquellos parásitos que se encontraron en menor cantidad. 7.4.1.- Phylum Platyhelminthes 7.4.1.1- Clase Monogenea Larva de Monopisthocotylea Figura 2. Esquema de la larva de Monopisthocotylea encontrado en penetración de F. enflata del ambiente arrecifal nerítico (en vista lateral). Descripción: El extremo posterior del cuerpo de esta larva se observó dentro del quetognato hasta el celoma pero sin alcanzar a llegar al intestino. Mide 0.22 mm de longitud total y 0.059 mm de de ancho. En la parte anterior del cuerpo se encuentra 44 el prohaptor de probable apariencia muscular, mide 0.08 mm de longitud y 0.06 mm de ancho. Posterior a esta estructura se encuentra una faringe muscular, mide 0.03 de largo y 0.03 mm de ancho. Debido a que el monogéneo se encontró en posición lateral no se pudo distinguir si presenta uno o dos ciegos intestinales. En la parte posterior está el opistohaptor, mide 0.2 mm de longitud y 0.08 mm de ancho. Se observaron cuatro ganchos en la parte posterior del opistohaptor que debido a su morfología es posible considerarse a esta larva dentro de la familia Gyrodactylidae. Los ganchos son de tres diferentes formas: a) en forma filiforme delgado y siendo el más grande de los tres tipos; b) en forma de garfío delgado y c) en forma sigmoideo, ancho en la parte basal y finalizando en una punta. No se pudo diferenciar los órganos reproductores debido a la posición en la que se encontró esta larva en el quetognato. Revisión taxonómica y parámetros ecológicos de parasitismo: Esta larva fue considerada dentro de la familia Gyrodactylidae por la presencia de ganchos en la parte posterior del opisthoaptor que se asemejan con los ganchos de los monogéneos adultos de Gyrodactylus sp., sin embargo, el ejemplar de este trabajo se encontró en posición lateral, lo cuál dificultó la observación detallada de la morfología de cada gancho, la cuál es de importancia taxonómica a nivel específico. En general, los monogéneos tienen un ciclo de vida directo, lo que significa que no utilizan hospederos intermediarios a diferencia de otros platelmintos como los digéneos que utilizan uno o más hospederos intermediarios (Huyse et al., 2003). Sin embargo, a pesar que su ciclo de vida es directo, presentan una fase larval, la cuál presenta en la parte posterior del opistohaptor varios pares de ganchos, que varían en número y forma en cada familia. 45 7.4.1.2.- Clase Trematoda Distoma tipo A Figura 3. Esquema del Distoma tipo A encontrado en el intestino de F. enflata del ambiente arrecifal nerítico. Descripción: Este organismo tiene una morfología semirectangular u oval. El extremo anterior es más angosto que el posterior. Mide 0.093 mm de largo total por 0.06 mm de ancho máximo correspondiente a la parte posterior. Presenta dos ventosas de diferente tamaño lo cual nos permite considerarla como distoma. La primera ventosa (ventosa oral) está ubicada en la parte anterior del cuerpo y la segunda que es de mayor tamaño (acetábulo) y es post ecuatorial. En la parte posterior de la ventosa oral se encuentra la faringe, muscular y casi tan grande como la ventosa oral. Posterior a la faringe se observan dos ramas cecales laterales al acetábulo hasta el extremo posterior del cuerpo. Debido al tamaño pequeño del organismo no se observaron más estructuras, ni tampoco fue posible obtener las medidas de la ventosa oral, el acetábulo ni la faringe. 46 Distoma tipo B Figura 4. Esquema del Distoma tipo B encontrado en el saco celómico de F. enflata del ambiente lagunar arrecifal. Descripción: Este individuo tiene una morfología circular. Mide de longitud total 0.064 mm y de ancho 0.07 mm. Es posible distinguir la presencia de dos ventosas musculares en la parte central del círculo, sin embargo, no fue posible distinguir si las dos son ventosas o si la de menor tamaño sería la faringe debido a que se encontraron una encima de la otra. Debido al tamaño pequeño de este helminto, solo se observan los ciegos intestinales en forma de varios pliegues y no fue posible obtener las medidas. En este parásito se observa una membrana quística cubriendo todo el organismo. 47 Distoma tipo C Figura 5. Esquema del Distoma tipo C encontrado en el saco celómico de F. hispida del ambiente lagunar costero. Descripción: La forma del cuerpo es oval. Este individuo se encontró doblado, encimándose la parte anterior con la posterior, lo que dificultó su identificación. Midió de 0.623 mm de largo total y 0.12 mm de ancho. Se observo la ventosa oral en la parte anterior del cuerpo y mide 0.054 mm de largo por 0.06 mm de ancho. No se distingue una faringe. El acetábulo se observa en el segundo tercio del cuerpo en posición ecuatorial, mide 0.06 mm de longitud por 0.08 mm de ancho. La relación de la ventosa oral y el acetábulo es 1:1.11. Debido a que se encontró doblado ventralmente dentro del quetognato no se pudo diferenciar las estructuras del sistema reproductor. 48 Distoma tipo D Figura 6. Esquema del Distoma tipo D encontrado en el saco celómico de F. hispida del ambiente lagunar costero. Descripción: Este organismo presenta una morfología oval. Mide 0.092 mm de longitud total y 0.05 mm de ancho. Es posible distinguir una ventosa muscular grande en el extremo anterior del cuerpo que mide 0.041 mm de longitud y 0.03 mm de ancho. Cerca del borde posterior a esta ventosa se observa otra estructura de forma circular de menor tamaño, aunque no fue posible obtener sus medidas. Los ciegos intestinales corren paralelos a la longitud del cuerpo sin embargo en la parte posterior del cuerpo no se distingue cómo culminan. No se observaron más estructuras en esta larva. 49 Distoma tipo E Figura 7. Esquema del Distoma tipo E encontrado en el saco celómico de F. hispida del ambiente lagunar costero. Descripción: El cuerpo es en forma ovoide alargado, mide 0.365 mm de longitud total y 0.07 mm de ancho. En la parte anterior se encuentra la ventosa oral, muscular que mide 0.034 mm de largo y 0.04 mm de ancho. Debajo a la parte posterior de la ventosa oral se observa la faringe muscular y mide 0.02 mm de largo por 0.02 mm de ancho. Del extremo posterior de la faringe se desprenden dos ramas cecales laterales al acetábulo y que llegan hasta la parte posterior del cuerpo desembocando en el poro excretor. El acetábulo se encuentra en el primer tercio del cuerpo, mide 0.056 mm de 50 longitud y 0.067 de ancho. La relación de la ventosa oral y ventral es 1:1.64. Debido a la contracción del organismo no se pudo observar las estructuras reproductoras. Distoma tipo F Figura 8. Equema del Distoma tipo F encontrado en el saco celómico de F. hispida del ambiente lagunar costero. Descripción: Estos organismos tienen una forma ovoide aunque fueron vistos en forma lateral. Midieron de 0.09 a 0.134 de longitud total (0.112) y 0.06 mm de ancho. Se lograron diferenciar dos ventosas: la ventosa oral en la parte anterior del cuerpo que midió de 0.019 a 0.025 (0.022) de longitud y 0.02 de ancho y la segunda, el acetábulo se encuentra en la parte media del cuerpo, midió 0.03 de longitud y 0.03 de ancho. La relación de las ventosas es 1:1.36. No se presentaron más estructuras en las larvas debido a su poco desarrollo. 51 Distoma tipo G Figura 9. Esquema del Distoma tipo G encontrado en el saco celómico e intestino de F. enflata, F. hispida y P. draco de los tres ambientes. Descripción: Estos organismos tienen una morfología semicircular u ovoide. Presentan dos ventosas: la primera se encuentra en la parte anterior del cuerpo (ventosa oral) y la segunda de mayor tamaño en la región media del cuerpo (acetábulo). No se observaron más estructuras en las larvas, debido a que son de tamaño pequeño, además, se encontraban envueltas por una membrana quística, la cual dificultó la observación. 52 Esporocisto Figura 10. Fotografía de la fase esporocisto de trematodo encontrado en el saco celómico e intestino de F. hispida en el ambiente lagunar costero. Descripción: En el interior del cuerpo se distinguen diferentes células semicirculares que formaran a cada una de las redias. La morfología de este organismo es semejante a la fase esporocisto de digéneos. 53 Cercaria owreae Figura 11. Esquema de Cercaria owreae encontrado en el saco celómico de Flaccisagitta enflata de los ambientes arrecifal nerítico y lagunar arrecifal. Descripción: La forma del cuerpo es ovoide, estrecha en la parte anterior, mide de 0.029 a 0.032 (0.031) de longitud por 0.016 a 0.020 (0.018) de anchura máxima. Por la contracción de los organismos, el tegumento presenta surcos transversales. Se observan papilas dermales en la región anteroventral y anterodorsal del cuerpo extendiéndose hasta el acetábulo. La ventosa oral es muscular subterminal, mide 0.038 a 0.048 (0.043) de longitud y 0.045 a 0.054 (0.050) de ancho. El acetábulo es muscular preecuatorial, mide 0.061 a 0.064 (0.062) de longitud y 0.054 (0.054) de ancho. La relación del diámetro de las ventosas oral y ventral es 1:1.4. La faringe es muscular, redondeada a oval, mide 0.016 de longitud y 0.022 de anchura. El esófago 54 es muy corto, inmediatamente después se encuentra la bifurcación cecal de la cual parten los ciegos dorsales a la ventosa ventral o acetábulo hasta la parte posterior del cuerpo. Los ciegos intestinales se continúan en un par de apéndices cilíndricos (izquierdo y derecho) que sobresalen del cuerpo los cuales se encuentran contraídos, miden de 0.128 a 0.144 (0.136) de longitud por 0.054 a 0.070 (0.062) de anchura. Los órganos reproductores no están desarrollados y el sistema excretor no es visible. Revisión taxonómica y parámetros ecológicos de parasitismo De acuerdo con sus características esta cercaria se asemeja a los ejemplares descritos por Hutton (1954), quien menciona que Cercaria owreae fue nombrada como Metacercaria owreae por diferir en la morfología de otras larvas o tremátodos adultos debido a que los ciegos intestinales se extienden en un par de apéndices posteriores. Sin embargo, Dawes (1959) consideró que esta fase de desarrollo corresponde a la de cercaria, por lo que el nombre apropiado debería ser Cercaria owreae. Jarling y Kapp (1985) mencionaron el escaso conocimiento que se tiene del adulto de esta larva, sin embargo, Dawes (1959) mencionó, que la longitud de los ciegos dentro de los apéndices posteriores, podría corresponder a terminar en una abertura anal en la pared de la vesícula excretora en el caso del adulto, característica que la presentan varias familias, pero que sólo se observa en siete géneros de la familia Accacoeliidae. Sin embargo, por la presencia de seis divertículos en la región anterior de cada uno de los ciegos intestinales parece más la morfología del género: Accacladocoelium Ödhner, 1928 tal y como lo señalan Dawes (1959) y Gómez del Prado-Rosas et al. (1999b). Dawes (1959) mencionó que este estado larval de tremátodo no podría pertenecer a A. petasiporum Ödhner, 1928 porque esta especie tiene un acetábulo conspicuo, el cual no corresponde con el de la C. owreae. Las otras 3 especies existentes: A. nigroflavum (Rudolphi, 1819), A. macrocotyle (Diesing, 1858) sensu Monticelli, 1893 y A. alveolatum Robinson, 1943, siguen siendo estudiadas. Dawes (1958) menciona que la larva de este tremátodo emerge del primer hospedero intermediario (un molusco bentónico). El parásito presenta apéndices pequeños que probablemente cumplen con la función de órganos de 55 flotación emergentes dentro del plancton donde la larva se mantiene de forma libre y posteriormente podría albergarse en larvas de peces, de aquí que los quetognatos se desempeñen como hospederos intermediarios (Nagasawa y Marumo, 1979a). C. owreae posiblemente parasita al pez Mola mola (Linnaeus, 1758) como lo hacen las tres especies del género Accacladocoelium (Gómez del Prado-Rosas et al., 1999b). Como se ha mencionado, C. owreae presenta señales de estar contraída en la región de los apéndices posteriores, por lo que aparenta ser más pequeña a lo previamente registrado. Las cercarias encontradas por Gómez del Prado-Rosas et al. (1999b) en las costas de Quintana Roo, midieron de 0.166-0.575 y las encontradas por Furnestin y Rebecq (1966) en Mauritania y Liberia, han sido las de mayor tamaño hasta el momento (0.245-2.200). La prevalencia de C. owreae en quetognatos obtenida en este estudio es baja, al igual que los registros de Hutton (1952; 1954), Jarling y Kapp (1985) y Gómez del Prado-Rosas et al. (1999b), tomando en cuenta que Dawes (1958; 1959) y Furnestin y Rebecq (1966) consideran que una prevalencia alta va de 4.1% a 7% respectivamente. Por su parte, la intensidad media de infección obtenida fue igual a lo encontrado por Gómez del Prado-Rosas et al. (1999b) y no fue posible realizar una comparación con los demás autores debido a que no mencionan la intensidad media de infección en sus trabajos. La presencia de metacercarias de C. owreae se compila en la Tabla 13. 56 Larva tipo Monilicaecum Figura 12. Esquema de la larva tipo Monilicaecum encontrado en el saco celómico, intestino y septo caudal de F. hispida, F. enflata, P. draco, S. serratodentata y Sagitta sp. de los tres ambientes estudiados. Descripción: Este parásito fue encontrado como una metacercaria no enquistada. El cuerpo es oval o elongado, mide de 0.099 a 0.256 (0.148) de longitud y 0.040 a 0.081 (0.055) de ancho. El tegumento es delgado, no espinoso, transversalmente estriado. La ventosa oral ligeramente encajada en la parte anterior del cuerpo, es usualmente elipsoidal y algunas veces globular, mide 0.006 a 0.016 (0.012) de longitud y 0.006 a 0.023 (0.011) de ancho. La ventosa ventral o acetábulo es muscular, generalmente redondo, mide 0.016 a 0.023 (0.022) de longitud y 0.020 a 0.034 (0.025) de ancho. La relación de la ventosa oral y ventral es 1:1.70. La boca es subterminal, no se observa la faringe, el esófago no es claramente visible y algunas veces se distingue una estructura pequeña en forma de bolsa inflada, posiblemente la faringe. El estómago es globular u ovoide, laterodorsal al acetábulo, tiene una pared delgada, 57 mide de 0.013 a 0.025 (0.016) de longitud y 0.015 a 0.034 (0.021) de ancho. Los ciegos intestinales ocupan las zonas laterales del cuerpo, son del tipo moniliforme, sinuosos y cada uno está compuesto por una serie de 8 ó 9 cámaras. No se observan las gónadas. La vesícula excretora es sacular y pequeña, se encuentra posterior a los ciegos intestinales hasta el poro excretor. El poro excretor es terminal. Revisión taxonómica y parámetros ecológicos de parasitismo Estas características se asemejan con las descripciones de la larva tipo Monilicaecum de Yamagutí (1970; 1971), nombre asignado debido al uso colectivo de un grupo larval, diferenciado del grupo larval de Torticaecum por la presencia de un estómago y por la forma del ciego intestinal formado por cámaras tubulares en forma tortuosa. El ciclo de vida de los Didymozoidae no ha sido determinado experimentalmente (Koie y Lester, 1985), pero de acuerdo con Cribb et al. (2000) aparentemente son enteramente pelágicos, usando a los moluscos Heteropodos y Pteropodos (Orden Mesogastrea) como primer hospedero intermediario. Por su parte, Cable (1956) y Nikolaeva (1965) mencionaron que el ciclo de vida de los Didymozoidae sigue el patrón de los Hemiuridae. Madhavi (1968) mencionó que la cercaria cistófora tiene un cuerpo con las estructuras de la metacercaria tipo Monilicaecum y de algunos otros Didymozoidae inmaduros encontrados en el aparato digestivo de peces marinos. De acuerdo con los registros previos de los adultos de estos organismos, se conoce que están presentes en los peces carnívoros de arrecifes coralinos (e. g. Lethrinidae, Serranidae) y que son comunes en teleósteos pelágicos especialmente en Scombridae (Cribb et al., 2000). Ahora bien, el tamaño de los ejemplares de este estudio es mayor que el registrado por Nagasawa y Marumo (1979b) (0.171), sin embargo, son de menor tamaño que los encontrados en quetognatos por Shimazu (1978) (0.185-0.383). El tamaño de la larva tipo Monilicaecum también ha sido mencionado en otros hospederos, por ejemplo Madhavi (1968) encontró metacercarias en copépodos de 0.544, Vidal y Haimovici (1999) en cefalópodos de 0.14-0.2, y Yamagutí (1970) registró las larvas de mayor tamaño hasta el momento en peces adultos (3.25). 58 Hasta el momento no ha sido posible realizar una comparación de la prevalencia obtenida en este trabajo para la larva tipo Monilicaecum de quetognatos debido a que los registros previos no mencionan un valor de prevalencia en algún grupo de zooplancton como hospedero intermediario, sin embargo, Vidal y Haimovici (1999) consideraron un alto valor de prevalencia de 72% e intensidad media de infección de 3.5 en el cefalópodo Illex argentinus Castellanos, 1960. Con respecto a la incidencia de parasitismo de la larva tipo Monilicaecum en los quetognatos de este trabajo, fue igual a la mencionada por Shimazu (1978) y Nagasawa y Marumo (1979b) en los quetognatos F. enflata, Sagitta ferox, Sagitta nagae, Sagitta neglecta, Krohnitta pacifica y Sagitta regularis de la Bahía de Suruga, Japón, quienes encontraron un parásito por cada quetognato parasitado. Los registros de la larva tipo Monilicaecum se compilan en la Tabla 14. Familia Hemiuridae Figura 13. Esquema de hemiúridos a nivel familia encontrados en el saco celómico de F. hispida, F. enflata, P. draco y S. Serratodentata en los tres ambientes estudiados. 59 Descripción: Estos hemiúridos tienen cuerpo elongado, fusiforme u oval, con el extremo posterior más angosto. La cutícula no tiene espinas pero está provista de plegamientos transversales. El cuerpo está dividido en soma y ecsoma (o cola) y midió de 0.116 a 0.483 (0.201) de longitud y 0.049 a 0.150 (0.078) de ancho. El ecsoma se encuentra invaginado en la parte posterior del cuerpo. Presenta dos ventosas bien desarrolladas oral y ventral (acetábulo). La ventosa oral es muscular y se encuentra en la parte anterior del cuerpo, mide 0.026 a 0.080 (0.038) de longitud y 0.025 a 0.045 (0.034) de ancho. En el tercio medio del cuerpo se encuentra el acetábulo, el cual alcanza casi en su totalidad el ancho del cuerpo, esta ventosa muscular mide 0.035 a 0.067 (0.049) de longitud y 0.034 a 0.064 (0.050) de ancho. La relación de las ventosas oral y acetábulo es 1:1.28. Boca en la ventosa oral. Posteriormente está una faringe muscular, la cual mide 0.009 a 0.024 (0.016) de longitud y 0.013 a 0.021 (0.017) de ancho. La bifurcación cecal se encuentra anterior al acetábulo, de la cual parten los ciegos intestinales lisos, en forma irregular que se extienden hasta el ecsoma. No se observan las gónadas masculinas y femeninas. No se distingue la vesícula excretora. Poro excretor terminal. Revisión taxonómica y parámetros ecológicos de parasitismo El ciclo de vida de estos hemiúridos incluye una etapa usualmente enquistada e infectiva llamada metacercaria (Baer, 1952; Erasmus, 1972), en esta fase larval, los organismos no se encuentran desarrollados completamente, lo que dficulta la observación de las características de importancia taxonómica que permiten la identificación a nivel género, por tal razón, en algunos casos, los hemiúridos encontrados en este trabajo se mantienen a nivel familia. Montero (1974) mencionó que las metacercarias pueden ser consideradas como metacercarias progenéticas, cuando alcanzan el máximo desarrollo sexual, esto es, cuando hay producción de huevos en esta fase larval, convirtiéndose así en verdaderas formas neoténicas. Sin embargo, en los ejemplares de este trabajo no se pueden considerar progenéticas, deido a que no se bservó la producción de huevos. Las metacercarias de este 60 estudio presentan, entre otras características, un tegumento aserrado marginalmente y plegamientos transversales. Presencia o ausencia de un ecsoma en la parte posterior del cuerpo y de pit preacetabular. Glándulas vitelinas en forma de dos masas compactas, tubulares, masas con un arreglo lobular corto o en forma de túbulos digitiformes y la posición de la vesícula seminal anterior o posterior al acetábulo. Gibson y Bray (1979) y León-Regagnon et al. (1996) comentaron que la familia Hemiuridae es uno de los grupos más diversos de digéneos que se restringen a formas ecsomadas y de acuerdo con Gibson et al. (2002) se conforma de doce subfamilias: Glomericirrinae, Lecithochiriinae, Plerurinae, Pulmoverminae, Lethadeninae, Hemiurinae, Elytrophallinae, Dinurinae, Opisthadeninae, Theletrinae, Bunocotylinae y Aphanurinae. Por otra parte, Gómez del Prado-Rosas et al. (2005), mencionaron que los hemiúridos utilizan a peces teleósteos como hospederos definitivos, particularmente peces planctívoros como son los Clupeidos y los quetognatos sirven como hospederos paraténicos. Los quetognatos comprenden el segundo grupo más abundante en las comunidades del zooplancton y son presas importantes de los peces, particularmente de aquellos planctívoros, aunque también de los estados larvales de las especies de peces (Øresland, 1986). La información sobre el tamaño de las metacercarias, prevalencia e intensidad media de estas formas larvales es escasa e inclusive no es posible realizar una comparación de estos aspectos con los organismos identificados como Hemiuridae en S. elegans (Russell, 1931), S. friderici Ritter-Zahony, 1911, F. enflata y Spadella cephaloptera (Busch, 1851) del noreste del océano Atlántico por Dollfus (1960) y en quetognatos del océano Índico por Øresland y Bray (2005). Con respecto a los valores de prevalencia, son mayores que los registrados por Gómez del Prado-Rosas et al. (2005) en Brachyphallus sp. (0.027%), Ectenurus sp. (0.004%) y Lecithochirium sp. (0.018%), sin embargo, menor a lo obtenido por Overstreet (1969) en P. merus (3.2%) y en el caso del valor de la intensidad media es similar al mencionado por autores anteriores. 61 Hemiurus sp. Figura 14. Esquema de Hemiurus sp. encontrado en el saco celómico de F. hispida y S. serratodentata de los ambientes lagunar costero y lagunar arrecifal. Descripción: El cuerpo es alargado con ecsoma invaginado. Mide de 0.214 a 0.397 (0.293) de longitud y 0.06 a 0.26 (0.12) de ancho en la parte posterior a nivel de las glándulas vitelinas. El ecsoma mide de 0.041 a 0.1 (0.071) de longitud y de 0.038 a 0.11 (0.065) de ancho. El tegumento es plicado extendiéndose desde la parte anterior del cuerpo hasta a nível de la parte anterior del ecsoma. La ventosa oral es terminal, mide de 0.031 a 0.214 (0.052) de longitud y 0.03 a 0.06 (0.04) de ancho. Pit ausente. El acetábulo situado en el tercio anterior del cuerpo, mide 0.036 a 0.069 (0.059) de longitud y 0.05 a 0.07 (0.06) de ancho. La relación de las ventosas oral y el acetábulo es 1:1.13. La faringe es bubosa, de menor tamaño que la ventosa oral, mide 0.02 a 0.04 (0.02) de longitud y 0.01 a 0.05 (0.02) de ancho. El esófago no es visible. La bifurcación cecal se encuentra anterior al acetábulo, de ahí parten los ciegos lisos que se extienden hasta la parte anterior del ecsoma, terminando 62 separadamente. Dos testículos preováricos, situados en posición oblicua. El testículo anterior mide 0.011 a 0.038 (0.019) de longitud y 0.010 a 0.049 (0.03) de ancho; el testículo posterior mide 0.013 a 0.041 (0.02) de longitud y 0.012 a 0.051 (0.03) de ancho. Vesícula seminal bipartita, mide 0.1 a 0.22 (0.14) de longitud y 0.01 a 0.02 (0.02) de ancho. El ovario está situado en el tercio medio del cuerpo, mide 0.02 a 0.03 (0.02) de longitud y 0.03 a 0.06 (0.04) de ancho. Las glándulas vitelógenas son postováricas, constituidas por dos masas compactas dispuestas oblicuamente, la anterior mide 0.02 a 0.03 (0.02) de longitud y 0.022 a 0.054 de ancho. La glándula vitelógena posterior mide 0.015 a 0.039 de longitud y 0.024 a 0.046 de ancho. No se distinguen las demás estructuras. Revisión taxonómica y parómetros ecológicos de parasitismo Las principales características diagnósticas que se consideraron en la identificación de Hemiurus sp. son: una cutícula estriada y la presencia de una vesícula seminal bipartita de acuerdo con Yamaguti (1971). El género Hemiurus es uno de los más pequeños de la familia Hemiuridae, se han descrito alrededor de 16 especies, H. appendiculatus (Rudolphi, 1802) Looss, 1899 (especie tipo), H. arelsici Yamaguti, 1938, H. communis Odhner, 1905, H. levinseni Odhner, 1905, H. luehei Odhner, 1905, H. microporus (Montic, 1889) Looss, 1899, H. monticelli (Linton, 1898) Looss, 1899, H. odhneri Yamaguti, 1934, H. raabei Slusarski, 1958, H. rugosus Looss, 1907, H. sigani Fischthal & Kuntz, 1964, H. sluiteri (Brock, 1886) Looss, 1899, H. ocreatus (Rudolphi, 1802), H. macrouri Gayevskaya, 1975. Koie (1990) mencionó que la diferencia principal entre las especies se debe a la relación entre la ventosa oral y el acetábulo, sin embargo, aun no se define cuantas especies son válidas para este género. Se conoce poco acerca de los hospederos que intervienen en el ciclo de vida de estas especies, sin embargo, Heath & Nicoll (1991) mencionaron que los Hemiurus sp. deben tener un primer hospedero intermediario molusco, el segundo hospedero sería un copépodo y que el hospedero definitivo sería el pez Clupea harengus. Dollfus (1923) sugirió que la cercaria cistofora Cercaria calliostomae que se encontró en el caracol marino Calliostoma ziziphinum en Roscoff, Francia, posiblemente sea el estado larval de las especies de Hemiurus sp. 63 Koie (1995) registro una larva de Hemiurus en el molusco Retusa truncatula de aguas Danesas. El copépodo Acartia clausi ha sido observado con la presencia de metacercarias de Hemiurus sp. (Steur, 1928; Lebour, 1935; Koie, 1995). Incluso Yip (1984), registró metacercarias en el ctenóforo Pleurobrachia pileus. En lo que se refiere a quetognatos, se han registrado Sagitta setosa, S. elegans y Sagitta sp. como hospederos intermediarios (Myers, 1956; Koie, 1990; Koie, 1995). Los adultos de este género han sido registrados en peces marinos pertenecientes a las familias Gadidae, Clupeidae, Cottidae, Salmonidae y Scorpaenidae en los oceános Atlántico, Pacífico y Artico (Nicoll, 1914; Hill, 1974; Koie, 1983, 1984, 1990). La prevalencia de parasitismo y el tamaño de las metacercarias de Hemiurus sp. encontradas en este trabajo, no fueron comparadas con los registros previos debido a que los autores no mencionaron los valores en sus trabajos. Sin embargo a nivel de organismos adultos, Koie (1984) mencionó prevalencias de hasta el 100% de H. communis y H. levinseni en el pez Gadus morhua en aguas Danesas. Por su parte, Gibson & Bray (1986) registraron los adultos de H. appendiculatus de mayor talla 6.70 mm de longitud total en el pez Alosa fallax de las costas Bálticas en Alemania. Las metacercarias de Hemiurus sp. encontradas en este trabajo se agregan a los registros de hemiúridos en quetognatos del norte de Quintana Roo, así como también F. hispida y S. serratodentata se registran por primera ocasión como hospederos de este género de hemiúrido. En la Tabla (15a) se puede observar las localidades en las que se registraron las fases larvales en moluscos, copépodos, ctenóforos y quetognatos de las especies de Hemiurus sp. y en la Tabla (15b) se mencionan las localidades de los peces en los que se encontraron los adultos de Hemiurus sp. 64 Parahemiurus sp. Figura 15. Esquema de Parahemiurus sp. encontrado en el saco celómico de F. hispida del ambiente lagunar costero. Descripción: El cuerpo es alargado con ecsoma. Mide de 0.259 a 0.463 (0.358) de longitud y 0.109 a 0.225 (0.159) de ancho en la parte posterior a nivel de las glándulas vitelinas. El ecsoma se encuentra invaginado, mide 0.038 a 0.120 (0.077) de longitud y 0.038 a 0.081 (0.058) de ancho. El tegumento es plicado (estriado) extendiéndose desde la parte anterior del cuerpo hasta el nivel de las glándulas vitelinas. La ventosa oral terminal, mide 0.020 a 0.044 (0.033) de longitud y 0.024 a 0.038 (0.030) de ancho. Pit ausente. El acetábulo situado en el tercio anterior del cuerpo, mide 0.043 a 0.068 (0.058) de longitud y 0.044 a 0.081 (0.062) de ancho. La relación de las ventosas oral y el acetábulo es 1:1.78. La faringe es bulbosa, de menor tamaño que la ventosa oral, mide 0.018 a 0.031 (0.023) de longitud y 0.015 a 0.025 (0.022) de ancho. El esófago no es visible por la contracción de los ejemplares. La bifurcación cecal se encuentra anterior al acetábulo, de ahí parten los ciegos lisos que se 65 extienden hasta la parte anterior del ecsoma, terminando separadamente. Dos testículos preováricos, situados en hilera en la línea media. El testículo anterior mide 0.010 a 0.025 (0.019) de longitud y 0.010 a 0.069 (0.046) de ancho; el testículo posterior mide 0.015 a 0.026 (0.018) de longitud y 0.014 a 0.080 (0.045) de ancho. Vesícula seminal ovoide, postacetabular, mide 0.036 a 0.070 (0.054) de longitud y 0.036 a 0.051 (0.043) de ancho; pars prostatica alargada, que sobrepasa la parte posterior del acetábulo, mide 0.073 a 0.088 (0.080) de longitud y de ancho mide 0.019 a 0.024 (0.021) en la parte posterior. No se observan todavía el saco del seno (sinus sac), ni el órgano del seno (órgano copulador). Poro genital posteroventral a la apertura bucal, mide 0.013 a 0.015 (0.014) de longitud y 0.009 a 0.011 (0.010) de ancho. El ovario está situado en el tercio medio del cuerpo, mide 0.013 a 0.040 (0.028) de longitud y 0.019 a 0.069 (0.052) de ancho. Las glándulas vitelógenas se encuentran a nivel del ovario, constituidas por dos masas compactas lobuladas dispuestas oblicuamente, miden 0.050 a 0.075 (0.052) de longitud y 0.031 a 0.084 (0.058) de ancho. La vesícula excretora no es visible. Revisión taxonómica y parámetros ecológicos de parasitismo Las principales características diagnósticas que se consideraron en la identificación taxonómica de Parahemiurus sp. son: cutícula estriada y la presencia de una vesícula seminal oval, no bipartita, de acuerdo con Gibson et al. (2002). Bray (1990) después de una revisión detallada del género, determinó en sinonimia a muchas especies de ellas, reconociendo como válidas sólo a siete, P. engraulisi Gupta & Jahan, 1977, P. anchoviae Pereira & Vaz, 1930, P. ecuadori Manter, 1940, P. madrasensis Sahai & Srivastava, 1977, P. clupeae Yamagutí, 1953, P. yanamense Hafeezullah, 1980 y P. merus (Linton, 1910) Manter, 1940 que es la especie tipo. A seis más las consideró como species inquirendae: P. arripidis Lebedev, 1971, P. clupeae de King (1964), P. dogieli Skrjabin y Guschanskaja, 1954, P. pseudosciaenae Shen, 1985, P. trachichthodi Lebedev, 1968 y Parahemiurus spp. (Yamagutí, 1934; Lebedev, 1971; Toman, 1973; Shimazu, 1982). Bray & Cribb (2005) describen a P. xylokopos. Sin embargo, León-Règagnon et al. (1997a) mencionaron que se han descrito alrededor de 22 especies del género Parahemiurus. Señalan también 66 que se conoce poco acerca de los ciclos de vida de estos hemiúridos. Los parásitos, a nivel larvario presentan una especificidad hospedatoria baja, ya que los ciclos de vida de muchas especies se completan en regiones con una fauna de invertebrados (hospederos intermediarios) que difiere de un sitio a otro, en el caso de los adultos presentan cierta preferencia por parasitar a peces de alguna familia en particular (Bray, 1990; León-Règagnon et al., 1997a). La talla de las metacercarias de Parahemiurus sp. de este trabajo, son de menor tamaño que las mencionadas por Overstreet (1969) del celoma de F. hispida (1.23 mm.). En el caso de los adultos, Yamagutí (1938) registró a P. harengulae en el pez Harengula zunasi, siendo este especimen el de mayor tamaño hasta el momento, cabe mencionar que Manter (1940; 1947) consideró a P. harengulae como sinónimo de P. merus. Por otro lado, los valores de prevalencia e intensidad media de infección obtenidos en la metacercaria Parahemiurus sp. de este trabajo, son más bajos que los obtenidos por Overstreet (1969) en la metacercaria de F. hispida (P= 3.2%, I= 1.23), en Florida, E.U.A. Cabe mencionar que Paraguassú et al. (2002) consideraron en organismos adultos un valor de prevalencia alto de 34.4% e intensidad media de 6. En la Tabla 16 se compila la información con respecto al registro de metacercarias del género Parahemiurus y de especies adultas. Debido a lo anterior, Bray (1990) y León-Règagnon et al. (1997a) consideran al género, con amplia distribución, principalmente de aguas templadas y tropicales de todo el mundo. 67 Lecithochirium sp. Figura 16. Esquema de Lecithochirium sp. encontrado en el saco celómico e intestino de F. hispida del ambiente lagunar costero. Descripción: Cuerpo alargado con ecsoma, el extremo posterior más ancho que el anterior, mide 0.110 a 0.291 (0.195) de longitud sin ecsoma y 0.031 a 0.122 (0.079) de ancho en la parte posterior. Ecsoma invaginado, mide 0.013 a 0.063 (0.023) de longitud y 0.018 a 0.068 (0.037) de ancho. El tegumento es liso. La ventosa oral mide 0.021 a 0.050 (0.033) de longitud y 0.023 a 0.045 (0.036) de ancho. El acetábulo se encuentra en el tercio anterior del cuerpo, mide 0.038 a 0.077 (0.056) de longitud y 0.026 a 0.074 (0.051) de ancho. La relación de las ventosas oral y acetabular es 1:1.66. Abertura preacetabular (pit) presente. Faringe bulbosa mide 0.013 a 0.026 (0.020) de longitud y 0.014 a 0.028 (0.020) de ancho. Esófago no visible. La bifurcación cecal se encuentra en la parte anterior del cuerpo entre la faringe y el acetábulo. Los ciegos intestinales se extienden hasta la región posterior del cuerpo, sin penetrar al ecsoma. No se distinguen testículos. La vesícula seminal es alargada 68 sobrepasando la parte posterior del acetábulo, bilobular, que mide 0.038 a 0.069 (0.053) de longitud y 0.008 a 0.009 (0.008) de ancho. No se distingue la pars prostática. No se observan el poro genital ni el ovario. Las glándulas vitelógenas en forma de dos masas lobuladas en el tercio medio del cuerpo, postováricas, miden 0.018 de longitud y 0.031 de ancho. La vesícula excretora es en forma de “Y”, las ramas se unen dorsalmente a la ventosa oral. El poro excretor terminal, mide 0.005 a 0.018 (0.011) de longitud y 0.006 a 0.040 (0.016) de ancho. Revisión taxonómica y parámetros ecológicos de parasitismo El tegumento liso, presencia de un pit preacetabular y glándulas vitelógenas en forma de dos masas lobuladas, permitieron su identificación en el género Lecithochirium. Bray (1991) realizó una revisión del género y mencionó que está considerado como uno de los géneros más grandes de la familia, con alrededor de 100 especies nominales, pero el estatus de la mayoría de las especies está poco entendido. Por su parte, León-Règagnon et al. (1997a) mencionó que la morfología de este grupo es especialmente complicada debido a la presencia de caracteres taxonómicos que están ausentes en otros hemiúridos, como son las modificaciones de la ventosa oral, la presencia o ausencia de una cavidad preacetabular (pit preacetabular) y ciertas modificaciones en el complejo reproductor terminal. En lo que se refiere al ciclo de vida de las especies de Lecithochirium, Vilas et al. (2004) mencionaron que involucra tres o cuatro hospederos dependiendo de la presencia o ausencia de pequeños peces que actúen como hospederos paraténicos y además que la reproducción sexual de estos hemiúridos se lleva a cabo en el hospedero definitivo. Bray (1991) y Timi et al. (1999) agregaron que el cuarto hospedero en el ciclo de vida es aparentemente una característica común de este género con formas ovígeras enquistadas en las vísceras de peces o encapsuladas en la cavidad del cuerpo. Como se mencionó anteriormente, la especificidad hospedatoria en este grupo de helmintos a nivel larvario es baja y posiblemente esto se deba a que las metacercarias de Lecithochirium sean encontradas en diferentes especies de quetognatos, segundo hospedero intermediario, los cuales cumplen con la función de transporte en cada una de las zonas geográficas en que se distribuyen, 69 ya que el hospedero definitivo son los peces. Por otra parte, el tamaño de las metacercarias de Lecithochirium de este trabajo, es el más pequeño que se haya encontrado anteriormente, Dollfus (1960) registró metacercarias que probablemente corresponden al género de Lecithochirium que son mayores a las encontradas en este trabajo (0.369-0.377). En el caso de organismos adultos, Bravo-Hollis & Arroyo (1962) registraron en peces a L. monticelli, el espécimen de mayor tamaño hasta el momento (4.200-5.340). Con respecto al valor de intensidad media de infección obtenido en las metacercarias de Lecithochirium de este trabajo, es similar a lo registrado por Gómez del Prado-Rosas et al. (2005) en quetognatos (I= 1), sin embargo, en lo que se refiere a la prevalencia, fue menor que la obtenida de este trabajo (P= 0.004-0.01%). En el caso de los especímenes adultos de este género Timi et al. (1999) consideró como valores altos de prevalencia e intensidad media de infección de 41.18 a 53.57% y de 5.4 a 7.8 respectivamente. La Tabla 17 muestra información referente a los registros de metacercarias de Lecithochirium y las Tablas 18a - c, hacen referencia a los adultos. 70 Brachyphallus sp. Figura 17. Esquema de Brachyphallus sp. encontrado en el saco celómico e intestino de F. hispida, F. enflata, S. serratodentata y Sagitta sp. de los tres ambientes estudiados. Descripción: El cuerpo es alargado y también muestra ecsoma, extremo posterior más ancho, mide 0.253 a 0.500 (0.373) de longitud sin ecsoma y 0.061 a 0.208 (0.153) de ancho en la parte posterior. Ecsoma invaginado, mide 0.059 a 0.138 (0.095) de longitud y 0.038 a 0.138 (0.093) de ancho. El tegumento es plicado (aserrado), desde la parte anterior hasta la parte final de las glándulas vitelógenas. La ventosa oral en la parte anterior del cuerpo es muscular, mide 0.030 a 0.056 (0.041) de longitud y 0.025 a 0.059 (0.041) de ancho. El acetábulo es muscular, se encuentra en el tercio anterior del cuerpo, mide 0.034 a 0.088 (0.064) de longitud y 0.030 a 0.093 (0.072) de ancho. La relación de las ventosas oral y el acetábulo es 1:1.57. Presencia de una abertura preacetabular (pit) entre la faringe y el acetábulo. La faringe es bulbosa, muscular, mide 0.021 a 0.025 (0.023) de longitud y 0.013 a 0.026 (0.022) de ancho. 71 Esófago no visible. La bifurcación cecal se encuentra entre la faringe y el acetábulo, de ahí parten los ciegos intestinales que se extienden hasta la parte posterior del cuerpo sin penetrar el ecsoma. Dos testículos preováricos arreglados en hilera, el anterior mide 0.013 a 0.019 (0.016) de longitud y 0.063 a 0.081 (0.072) de ancho, el posterior mide 0.011 a 0.019 (0.015) de longitud y 0.056 a 0.070 (0.063) de ancho. No se observa la vesícula seminal. El ovario mide 0.025 de longitud y 0.056 de ancho. Las glándulas vitelógenas están en forma de dos masas con lóbulos largos, en el tercio medio del cuerpo, miden de 0.009 a 0.056 (0.034) de longitud y 0.023 a 0.100 (0.059) de ancho. El poro excretor es terminal, mide 0.025 a 0.031 (0.028) de longitud y 0.041 a 0.044 (0.043) de ancho. Revisión taxonómico y parámetros ecológicos de parasitismo Las características que permitieron identificar el género Brachyphallus son: tegumento con plicaciones cuticulares, presencia de un pit presomático y glándulas vitelógenas en forma de dos masas ovales con lóbulos largos. Yamagutí (1971) reconoce seis especies: Brachyphallus crenatus (Rudolphi, 1802) como especie tipo, B. affinis Lander, 1904, B. amuriensis Babaskin, 1928, B. parvus Manter, 1926, B. brachygobii Reichenbach-Klinke, 1952 y B. nasae Nagaty et Abdul-Aal, 1962, sin embargo, no fue posible determinar la especie a la que pertenecen debido a que los aparatos reproductores no se encuentran desarrollados por completo. Se conoce poco acerca del ciclo de vida de estos parásitos, Reimer et al. (1971) describieron a Cercaria caudofilamentosa en el caracol Rissoa membranacea del mar Báltico y sugirieron la posibilidad de que sea la forma larval de las especies de este género, posteriormente, Koie (1983) agregó que posiblemente otras especies de Rissoa sean los hospederos intermediarios en otras regiones, extendiendo así el rango de estos parásitos. Pierrot-Bults (1990) mencionó que la transmisión de este parásito en los quetognatos es muy similar al de Derogenes varicus, en donde la metacercaria sin enquistar se desarrolla en los copépodos y al ser ingerido por los quetognatos, estos últimos sirven como hospederos paraténicos. Las especies de Brachyphallus utilizan a varias especies de peces marinos como hospederos definitivos como los Clupeidos, que son infestados principalmente por alimentarse de pequeños peces 72 (Koie, 1984; Pierrot-Bults, 1990; Sterud, 2002; Gómez del Prado-Rosas et al., 2005). De acuerdo con Klimpel et al. (2003), el hecho de que Brachyphallus sea encontrado en una gran variedad de hospederos finales o definitivos indica que tiene una baja especificidad hospedatoria en las especies adultas de este género, conclusión que es compartida por Bunkley-Williams & Williams (1994), sin embargo, posiblemente este patrón de especificidad en el caso de los hospederos intermediarios sea diferente. Con respecto al tamaño de las metacercarias de Brachyphallus de este trabajo, no fue posible realizar una comparación con las metacercarias registradas previamente debido a que Linton (1927) y Pierrot-Bults (1990) en sus compilaciones, no mencionan el tamaño de las metacercarias en quetognatos. Gibson y Bray (1986) mencionaron que el género Brachyphallus es uno de los géneros de hemiúridos más pequeños. En lo que se refiere a los adultos, Gibson & Bray (1986) registran a los especimenes de mayor tamaño hasta el momento en peces marinos (3.75). Por otro lado, la prevalencia obtenida en las metacercarias de Brachyphallus en quetognatos de este trabajo fue ligeramente mayor que lo registrado por Gómez del Prado-Rosas et al. (2005) (P= 0.027%), aunque la intensidad media de parasitismo es la misma en ambos trabajos (I= 1). Con respecto a las formas adultas de Brachyphallus, Koie (1984) y Urawa & Kaeriyama (1999) consideraron que un valor alto de prevalencia e intensidad media de parasitismo en peces sería de 50 a 70% y 9.1 a 40 respectivamente. En la Tabla 19 se encuentra información de los registros de metacercarias y adultos del género Brachyphallus sp. 73 Paralecithochirium sp. Figura 18. Esquema de Paralecithochirium sp. encontrado en el saco celómico de Ferosagitta hispida del ambiente arrecifal nerítico. Descripción: Cuerpo alargado con ecsoma, mide 0.269 de longitud y 0.141 de ancho sin ecsoma. Ecsoma invaginado, mide 0.044 de longitud y 0.051 de ancho. El tegumento es liso, organismo con ligera contracción. La ventosa oral mide 0.070 de longitud y 0.064 de ancho. El acetábulo se encuentra en la parte media del cuerpo, mide 0.096 de longitud y 0.112 de ancho. La relación de las ventosas oral y acetabular es 1:1.36. La faringe es bulbosa de menor tamaño que la ventosa oral, mide 0.032 de longitud y 0.042 de ancho. Esófago no observado por la contracción del organismo. La bifurcación cecal se encuentra anterior al acetábulo, de ahí parten los ciegos intestinales que se extienden hasta la parte posterior del cuerpo terminando separadamente, sin penetrar el ecsoma. Dos testículos preováricos, opuestos, miden 0.013 de longitud y 0.025 de ancho el dorsal y 0.018 de longitud y 0.025 de ancho el ventral. No se observa la vesícula seminal ni el poro genital. Ovario situado en el tercio posterior del cuerpo, post-testicular, mide 0.013 de longitud y 0.015 de ancho. 74 Glándulas vitelógenas preováricas, constituidas por dos masas con lóbulos cortos, miden 0.023 de longitud y 0.029 de ancho la dorsal y 0.019 de longitud y 0.028 de ancho la ventral. Ramas de la vesícula excretora unidas dorsalmente en la parte anterior de la ventosa oral. Poro excretor terminal, mide 0.015 de longitud y 0.010 de ancho. Revisión taxonómica y parámetros ecológicos de parasitismo Esta metacercaria presentó la superficie del cuerpo lisa, ausencia de un pit preacetabular y glándulas vitelógenas preováricas constituidas por dos masas lobuladas indistintamente, por lo que se definen semejantes al género Paralecithochirium Zhang, 1994 (Gibson et al., 2002). El género Paralecithochirium comprende una sola especie: P. leptobotiae Zhang, 1994. Se desconoce el ciclo de vida de esta especie, aunque al ser un hemiúrido, probablemente necesite de tres o cuatro hospederos intermediarios como es el caso de los demás géneros, teniendo así como hospedero intermediario a los quetognatos. Por el momento, no se puede realizar una comparación del tamaño, valores de prevalencia e intensidad media de infección en las metacercarias de este trabajo debido a que la especie tipo es un organismo adulto registrada en peces. La metacercaria de Paralecithochirium sp. se menciona por primera vez en organismos marinos, los quetognatos, ya que la especie tipo fue encontrada en peces de agua dulce de China (Gibson et al., 2002). 75 Opisthadena sp. Figura 19. Esquema de Opisthadena sp. encontrado en el saco celómico de Ferosagitta hispida y Flaccisagitta enflata de ambientes lagunar arrecifal y lagunar costero. Descripción: El cuerpo es ovalado, parte anterior más angosta, mide 0.450 de longitud y 0.225 de ancho en la parte posterior. Ecsoma ausente. El tegumento es grueso y liso. Ventosa oral subterminal, semicilíndrica, de 0.096 de longitud y 0.099 de ancho. El acetábulo se localiza en el tercio medio del cuerpo, mide 0.128 de longitud y 0.144 de ancho. La relación de la ventosa oral y el acetábulo es 1:1.33. La boca se abre en medio de la ventosa oral cerca del labio preoral. Faringe musculosa, subglobular, mide 0.064 de longitud y 0.074 de ancho. Esófago no observado. La bifurcación cecal se encuentra anterior al acetábulo, de ahí parten los ciegos intestinales o ramas cecales anchas, se extienden dorsolateralmente y terminan separadamente casi en el extremo posterior del cuerpo. El aparato reproductor masculino está 76 representado por un par de testículos oblicuos localizados en la parte posterior del acetábulo, entre las ramas cecales, son ovalados. El testículo anterior mide 0.013 de longitud y 0.015 de ancho, el testículo posterior mide 0.016 de longitud y 0.025 de ancho. La vesícula seminal es sacular, sinuosa y que se encuentra rodeada por células prostáticas, mide 0.058 de longitud y 0.015 de ancho. El poro genital es posterior a la faringe, mide 0.045 de longitud y 0.058 de ancho. El aparato reproductor femenino (ovario) no se observa. Las glándulas vitelógenas se encuentran posteriores al acetábulo, son dos masas compactas post-testiculares. La del lado derecho mide 0.039 de longitud y 0.050 de ancho, y la del izquierdo mide 0.028 de longitud y 0.038 de ancho. El aparato excretor está representado por una vesícula excretora ancha en forma de “Y”, bulbosa, bifurcándose posterior al acetábulo y uniéndose las ramas anteriores dorsalmente a la ventosa oral. El poro excretor es terminal, mide 0.032 de longitud y 0.038 de ancho. Revisión taxonómica y parámetros ecológicos de parasitismo La metacercaria de este trabajo se asemeja a las características morfológicas que presentan los ejemplares del género Opisthadena Linton (1910), carece de un ecsoma y presenta dos glándulas vitelógenas postováricas en hilera y en forma de masas opuestas. León-Règagnon et al. (1997a) mencionaron que es difícil definir al adulto de esta metacercaria ya que la taxonomía de este género es complicada, debido a que los caracteres que han sido utilizados para distinguir a las diferentes especies muestran una gran variabilidad. El género Opisthadena comprende nueve especies nominales (León-Règagnon et al., 1997b), la especie tipo, O. dimidia fue descrita por Linton (1910). León-Règagnon et al. (1996) mencionaron que las otras especies de este género, O. cheni Martin, 1978, O. kuwaiti Al-Yamani y Nahhas, 1981, O. bodegensis Johnson y Copsey, 1953, O. setipinnae Qiu y Liang, 1995, O. chloroscombri Nahhas y Cable, 1964, O. karachii Skrjabin y Guschanskaja, 1955, O. marina y O. fujianensis, tienen restricción en la distribución geográfica. Por otro lado, los registros de las especies de Opisthadena han sido encontrados en la forma adulta en peces, por lo que no se puede realizar una comparación con el tamaño de 77 estas metacercarias y con los valores obtenidos de prevalencia e intensidad media de parasitismo de este estudio. En el caso de los especímenes adultos del género Opisthadena, Bray y Cribb (2002) registraron los ejemplares de mayor tamaño hasta el momento (4.254-8.623). Por su parte, los valores de prevalencia e intensidad media obtenidos en este trabajo, resultaron ser mayores que los obtenidos en Brachyphallus (0.027%), Lecithochirium (0.018%) y Ectenurus (0.004%), en los quetognatos del mar Caribe Mexicano mencionados por Gómez del Prado-Rosas et al. (2005). Con respecto a las formas adultas de las diferentes especies de este género, Johnson y Copsey (1953), Dyer et al. (1985; 1992) y León-Règagnon et al. (1997a) consideraron que un alto valor de prevalencia e intensidad media de infección sería de 50 a 100% y 6 respectivamente en peces. Opisthadena se distribuye como parásito de peces en los mares templados y tropicales de todo el mundo (León-Règagnon et al., 1997a) y en la Tabla 20 se compila información de los registros de este género. De acuerdo a la distribución observada en las especies del género Opisthadena, están dispersas en los ambientes marinos al igual que otros hemiúridos como Derogenes varicus, el cual tiende a exhibir poca especificidad hospedatoria. En cambio en el caso de la especie tipo O. dimidia, por contraste, habita principalmente miembros del género Kyphosus. Ahora bien, al igual que la metacercaria del género Paralecithochirium, la metacercaria de Opisthadena de este trabajo, se registra por primera ocasión en un grupo de zooplancton marino, los quetognatos, como se mencionó anteriormente, los registros que se tienen hasta el momento han sido de formas adultas en peces. Cabe mencionar que el especímen encontrado en este estudio posiblemente sea la metacercaria de O. dimidia utilizando al quetognato como hospedero intermediario porque es la especie que se ha sido registrada en las costas de Quintana Roo. 78 Adinosoma sp. Figura 20. Esquema de Adinosoma sp. encontrado en el saco celómico de Ferosagitta hispida, Flaccisagitta enflata y Sagitta sp. de los tres ambientes estudiados. Descripción: El cuerpo es alargado con ecsoma. Mide 0.162 a 0.321 (0.239) de longitud y 0.05 a 0.4 (0.11) de ancho en la parte posterior a nivel de las glándulas vitelinas. El ecsoma se encuentra invaginado, mide 0.013 a 0.127 (0.053) de longitud y 0.01 a 0.07 (0.046) de ancho. El tegumento es liso. La ventosa oral terminal, mide 0.023 a 0.158 (0.054) de longitud y 0.03 a 0.07 (0.04) de ancho. Pit presente. El acetábulo está situado en el tercio anterior del cuerpo, mide 0.044 a 0.095 (0.067) de longitud y 0.04 a 0.08 (0.06) de ancho. La relación de las ventosas oral y el acetábulo es 1:1.24. La faringe es bulbosa, de menor tamaño que la ventosa oral, mide 0.01 a 0.04 (0.02) de longitud y 0.01 a 0.04 (0.02) de ancho. El esófago no es visible. La 79 bifurcación cecal se encuentra anterior al acetábulo, de ahí parten los ciegos lisos que se extienden hasta la parte anterior del ecsoma, terminando separadamente. Dos testículos preováricos, oblicuos. El testículo anterior mide 0.004 a 0.024 (0.012) de longitud y 0.011 a 0.029 (0.021) de ancho; el testículo posterior mide 0.007 a 0.019 (0.013) de longitud y 0.013 a 0.029 (0.021) de ancho. La vesícula seminal es sinuosa, postacetabular, mide 0.1 de longitud y 0.04 de ancho. El ovario está situado en el tercio medio del cuerpo, mide 0.020 a 0.020 (0.020) de longitud y 0.030 a 0.030 (0.030) de ancho. Las glándulas vitelógenas se encuentran a nivel del ovario, constituidas por dos masas lobuladas en posición opuesta, la del lado izquierdo mide 0.020 a 0.030 (0.020) de longitud y 0.018 a 0.031 (0.024) de ancho y la del lado izquierdo mide 0.013 a 0.29 (0.021) de longitud y 0.018 a 0.038 (0.028) de ancho. La vesícula excretora no es visible. Revisión taxónomica y parámetros ecológicos Las metacercarias fueron asignadas a este género debido a que presentaban las características particulares del género descrito por Manter (1947), que son: tegumento liso, testículos en posición oblicua y dos glándulas vitelógenas en masas lobuladas. El género Adinosoma Manter, 1947 fue creado para diferenciar los especimenes que habían sido asignados dentro del género Dinosoma y que no presentaban un tegumento con plicaciones cuticulares, ni testículos simetricos en posición de hilera. Yamaguti (1971) mencionó que el género Adinosoma debería ser considerado como sinonimia de Dinosoma, sin embargo, Fernandes & Goulart (1989) consideran que los caracteres usados para separar los dos géneros son específicos y no genéricos por lo que consideran válido el género. El género Adinosoma esta compuesto hasta el momento de dos especies, la especie tipo es A. robustum y la segunda especie es A. hawaiiense (Yamaguti, 1970), esta última originalmente había sido considerada dentro del género Dinosoma, sin embargo, fue excluía debido al tipo de tegumento que presentaba y por la posición de los testículos que no correspondian con la descripción generica (Gibson & Bray, 1979). Por su parte, Bartoli & Gibson (2006) mencionaron que tanto las dos especies de Adinosoma como las 18 especies que se conocen para el 80 género Dinosoma son poco conocidas debido a que en su mayoría solamente han sido registradas una sola vez y que además han sido descritas de pocos especímenes, lo cual resulta en poca informacion en la variación inter e intraespecífica (Gibson & Bray, 1979). Hasta el momento se desconoce el ciclo de vida del género Adinosoma, sin embargo, es posible que siga el mismo patrón de la familia Hemiuridae y en particular por la cercanía taxonómica con el género Dinosoma al compartir los hospederos puede ser que tengan la misma ruta aunque tampoco se ha específicado cual es el ciclo de vida del género Dinosoma. El miracidio es ciliado, las cercarias se desarrollan dentro de la redia, las metacercarias son formas sin enquistar que se presentan en el hemocele de los crustaceos u otros invertebrados planctónicos que se alimentan de copépodos (Gibson & Bray, 1979), como en este caso el quetognato y posteriormente al ser consumido este hospedero intermediario planctónico por otro hospedero definitivo como son los peces, se desarrollan los organismos adultos de este género. Los organismos registrados en este trabajo son los primeros en fase larval de este género tanto en quetognatos como en cualquier otro organismo planctónico por lo que no fue posible hacer una comparación con organismos en fase metacercaria con algún otro trabajo. Sin embargo, en lo que respecta a los adultos Yamaguti (1970) registró organismos de tamaño que va desde los 2.5 a 6.2 mm de longitud total. En la Tabla 21, se puede observar los peces que han sido registrados como hospederos de los adultos de este género. 81 Opechona pyriforme Figura 21. Esquema de Opechona pyriforme encontrado en el saco celómico e intestino de F. hispida y F. enflata de los tres ambientes estudiados. Descripción: Presenta forma piriforme, mide 0.104 a 0.211 (0.166) de longitud y 0.134 a 0.336 (0.171) de ancho en la parte posterior. El tegumento es espinoso. Presenta una pigmentación ocelar difusa entre las dos ventosas (oral y ventral) en lo ancho del cuerpo. La ventosa oral es subterminal, mide 0.025 a 0.074 (0.042) de longitud y 0.035 a 0.070 (0.053) de ancho, es de menor tamaño que el acetábulo. Este último se ubica en la parte media del cuerpo en posición ventral, mide 0.025 a 0.063 (0.046) de longitud y 0.044 a 0.063 (0.050) de ancho. La relación de las ventosas oral y el acetábulo es 1:1.07. La faringe bulbosa es posterior a la ventosa oral, mide 0.031 a 0.043 (0.036) de longitud y 0.034 a 0.044 (0.037) de ancho. Por lo contraído de los organismos no se observan la prefaringe, el seudoesófago, ni el esófago. La bifurcación cecal se da en la región posterior del acetábulo. Los ciegos intestinales 82 se encuentran laterales a la vesícula excretora y terminan de manera independiente. No se observan los órganos reproductores masculino y femenino. La vesícula excretora es de forma globular, se extiende desde la parte posterior del acetábulo hasta desembocar en un poro excretor, mide 0.053 a 0.056 (0.054) de longitud. El poro excretor es terminal y mide 0.009 de longitud y 0.013 de ancho. Revisión taxonómica y parámetros ecológicos de parasitismo La presencia de un tegumento espinoso, una pigmentación ocelar difusa entre ambas ventosas y la presencia de una vesícula excretora en forma globosa, permite considerar a los especímenes de este trabajo con gran semejanza a la morfología de Opechona pyriforme Linton 1900. De acuerdo con Yamaguti (1971) existen 15 especies descritas del género Opechona, sin embargo, en una revisión reciente, Bray y Gibson (1990) mencionan que el género comprende nueve especies válidas, O. bacillaris (Molin, 1859) Dollfus, 1927 que es la especie tipo, O. alaskensis Ward et Fellingham, 1934, O. cablei (Stunkard, 1980), O. chloroscombri Nahhas y Cable, 1964, O. occidentalis Montgomery, 1957, O. parvasoma Ching, 1960 specie inquirendae, O. pharyngodactyla Manter, 1940, O. pyriforme (Linton, 1900) y O. sebastodis (Yamaguti, 1934) Yamaguti, 1953. Se han descrito otras diez especies a las cuales Bray y Gibson (1990) las mantienen como inciertas debido a que consideran que el tamaño de los huevos es insuficiente para diferenciar a las especies. Posteriormente, Øresland y Bray (2005) mencionaron que la intensa acumulación de la pigmentación es una característica distintiva de los miembros de este género. Por su parte, Gómez del Prado-Rosas et al. (2000) comentaron que la metacercaria O. pyriforme está relacionada estrechamente con O. bacillaris y O. cablei, sin embargo, se distingue de estas dos especies por la presencia de espinas de igual longitud en ambos extremos del cuerpo, una ventosa oral que no es infundibular y la vesícula excretora que no se extiende hasta la bifurcación intestinal. Estos autores, agregan por primera vez a la descripción original, la presencia de papilas en la ventosa oral, las papilas sensoriales ciliadas que cubren la superficie ventral y la presencia de espinas en el interior de ambos lados de las ventosas. Hasta el momento, no se ha definido el ciclo de vida de O. pyriforme. Koie (1975) sin 83 embargo, describió el ciclo de O. bacillaris, donde el primer hospedero intermediario es el molusco prosobranquio Nassarius pygmaeus (Lamarck), posteriormente la cercaria, entra en ctenóforos, pequeñas medusas o quetognatos. Las infestaciones experimentales las realizó utilizando a Sagitta elegans, como la cercaria es una nadadora libre es capaz de localizar y entrar al quetognato, desplazándose hacia la parte posterior del celoma, aunque esto no está bien definido. Lebour (1916) encontró metacercarias de Opechona sp. en el canal alimenticio de quetognatos y sugirió que los parásitos son tragados y después se desplazan a las paredes del intestino en el celoma del cuerpo. Por tal, se puede mencionar que la estancia de O. pyriforme en los quetognatos es temporal y que los quetognatos actúan como hospederos intermediarios. El hospedero final más común es la macarela Scomber scombrus (Linneo, 1758), aunque también puede presentarse en peces de la familia Gadidae, Carangidae, Scorpaenidae, Clupeidae y Scombridae (Koie, 1975; Bray y Gibson, 1990; Øresland y Bray, 2005). Por otro lado, el tamaño de las metacercarias de O. pyriforme encontradas en quetognatos de este estudio, es mayor que las metacercarias registradas en las medusas por Gómez del Prado-Rosas et al. (2000). En el caso de especímenes adultos, Yamaguti (1938) registró a O. hynnodi en peces, la cual es la de mayor tamaño encontrada hasta el momento para este género. Con respecto a los valores de prevalencia e intensidad media de infección de la metacercaria O. pyriforme de este trabajo, son más bajos que los obtenidos por Gómez del Prado-Rosas et al. (2000) en las metacercarias de medusas (P= 0.39%, I= 1.5) y con respecto a las formas adultas de O. pyriforme, Dyer et al. (1992) obtuvieron una prevalencia del 100% en peces aunque la mayor intensidad media de infección la registró Abdallah et al. (2002) (I= 89). Las metacercarias y adultos del género Opechona se han registrado en diversos grupos marinos, como se observa en la Tabla 22. Debido a la información proporcionada de Opechona, se puede notar que es encontrada principalmente en el océano Atlántico aunque también se han registrado en los océanos Índico y Pacífico, parasitando medusas, ctenóforos y quetognatos en fase metacercaria y peces en etapa adulta. 84 Tergestia sp. Figura 22. Esquema de Tergestia sp. encontrado en el saco celómico e intestino de F. hispida, F. enflata y Sagitta sp. de los ambientes lagunar costero y lagunar arrecifal. Descripción: La forma del cuerpo es oval. Mide 0.104 a 0.193 (0.143) de longitud total y 0.07 a 0.11 (0.08) de ancho. La ventosa oral mide 0.03 a 0.074 (0.047) de longitud y 0.03 a 0.05 (0.05) de ancho y presenta de 5 a 8 lóbulos cefálicos conformando una corona a nivel de la parte anterior de la ventosa oral. El acetábulo se encuentra en la parte posterior del segundo tercio del cuerpo, es de menor tamaño que la ventosa oral, mide 0.026 a 0.065 (0.044) de longitud y 0.037 a 0.073 (0.051) de ancho. La relación de la ventosa oral y el acetábulo es 1:0.93. La faringe es alargada, muy muscular en posición dorsolateral al acetábulo, mide 0.03 a 0.07 (0.05) de longitud y 0.02 a 0.03 (0.02) de ancho. La bifurcación cecal es anterior al acetábulo, los ciegos intestinales llegan hasta la parte posterior del cuerpo terminando separadamente. No se distinguen las demás estructuras debido al tamaño pequeño del organismo y al poco desarrollo observado de esta larva. La vesícula excretora es en forma de Y. 85 Resumen taxonómico y parámetros ecológicos Aunque el ciclo de vida de los miembros del genero Tergestia no se conoce en su totalidad, Bray (1988) compila la información disponible, señalando que los esporocistos de este parasito han sido encontrados en bivalvos protobranquios y pteriomorfos. Las cercarias fueron registradas en el plancton como formas de vida libre y que pueden convertirse en metacercarias no enquistadas en varios invertebrados como ofiúridos, gasterópodos, ctenoforos y quetognatos. Otra posible via, sin embargo, consiste en que las cercarias también puedan ser ingeriadas por un pez pequeño y convertirse enmetacercarias en su aparato digestivo. Posteriormente, el pez, que será el hospedero definitivo, puede adquirir el parasito a través de la ingestión del hospedero intermediario, o a través de la ingestión directa de la cercaria. Por lo anterior, se considero que las larvas de peces que se registraron en este trabajo, desempeñan el papel de segundo hospedero intermedario o paratenico, que permiten que los parasitos se mantengan vivos antes de alcanzar a su hospedero definitivo (Gómez del Prado-Rosas et al., 2007). En la Tabla 23 se presentan los registros de las metacercarias y adultos de Tergestia sp. 86 7.4.1.3.- Clase Cestoda Metacéstodo tipo Plerocercoide A Figura 23. Metacéstodo tipo Plerocercoide A encontrado en el saco celómico de F. hispida en el ambiente lagunar costero. Descripción: Esta larva nombrada como tipo A, se caracteriza por presentar cuerpo regionalizado en dos partes: la anterior se denomina escólex y la posterior, estróbilo. Mide 0.282 de longitud y 0.051 de ancho en la parte anterior a nivel del escólex y 0.115 en la parte posterior del cuerpo. Se observa evidente contracción de la parte posterior del cuerpo. El escólex mide 0.096 de longitud y 0.115 de ancho. Tiene cuatro botridios pequeños, musculares, de forma semi esférica con una ligera contracción, dos de ellos miden 0.058 de longitud y 0.048 de ancho, los otros dos, miden 0.038 de longitud y 0.054 de ancho. La parte posterior del escólex es angosta a manera de cuello que conecta con el resto del cuerpo. 87 Metacéstodo tipo Plerocercoide B Figura 24. Metacéstodo tipo Plerocercoide B encontrado en el saco celómico de F. hispida y S. serratodentata en el ambiente lagunar costero. Descripción: Esta larva tipo B, es de forma cilíndrica y ligeramente más ancha en la parte posterior, mide 0.056 de longitud y 0.125 de ancho en la parte posterior del cuerpo. El tegumento es liso con principios de segmentación en la parte media del cuerpo, también se observan células pequeñas, elongadas a lo largo y ancho del cuerpo, seguramente parenquimáticas, musculares y subcuticulares. No se observan órganos de fijación (botridios o ventosas), sin embargo, en la parte posterior se observa un desgarramiento del tegumento que permite notar la presencia de un par de ganchos pequeños. Por la ausencia de escólex probablemente se encontraba en proceso de metamorfosis del estadio procercoide al plerocercoide. 88 Metacéstodo tipo Plerocercoide C Figura 25. Metacéstodo tipo Plerocercoide C encontrado en el saco celómico de F. enflata en el ambiente arrecifal nerítico. Descripción: Esta larva tipo C, se encontró envuelta en una membrana quística. El cuerpo, mide 0.150 de longitud y 0.118 de ancho. El tegumento también muestra principios de segmentación. El escólex, mide 0.051 de longitud y 0.112 de ancho. Presenta cuatro botridios a manera de ventosas musculares: dos dorsales y dos ventrales. Los botridios ventrales, miden de 0.028 a 0.046 de longitud y de 0.031 a 0.033 de ancho y los dorsales, miden de 0.035 a 0.043 de longitud y de 0.026 a 0.029 de ancho. 89 Metacéstodo tipo Plerocercoide D Figura 26. Escólex de metacéstodo tipo D encontrado en el saco celómico de F. enflata en el ambiente lagunar arrecifal. Descripción: Se basa en la parte anterior del organismo el escólex, mide 0.256 de longitud y 0.368 de ancho. Presenta cuatro botridios de forma oval, musculares. No se observó el resto del cuerpo. 90 Metacéstodo tipo Plerocercoide E Figura 27. Metacéstodo tipo E encontrado en el saco celómico de F. hispida y S. serratodentata en el ambiente lagunar costero. Descripción: Presenta un cuerpo oval alargado, no se distingue segmentación y la parte final del cuerpo es redondeada. Mide 0.261 a 0.433 (0.369) de longitud total y 0.167 a 0.195 (0.177) de ancho. En el interior del cuerpo se distingue la zona bulbosa que es en forma oval, mide 0.173 a 0.193 (0.18) de longitud y 0.079 a 0.134 (0.113) de ancho. De la zona bulbosa se distinguen cuatro bulbos independientes entre sí que miden 0.0113 a 0.163 (0.141) de longitud y un ancho de 0.019 a 0.035 (0.027). No se distinguen más estructuras. 91 Revisión taxonómica y parámetros ecológicos de parasitismo en los metacéstodos tipo A, B, C, D y E Las larvas de céstodos A, C, y D se identificaron por la presencia de cuatro ventosas que se observan alrededor de la extremidad anterior y en el caso de la larva B, fue identificada por esbozos de ganchos en la parte posterior, además que en tres de estas larvas se observaron principios de segmentación en la parte posterior del cuerpo. Por lo anterior y sobre la base de estas características son similares a las larvas tipo Scolex pleuronectis. Shimazu (1978) y Reimer et al. (1971), consideraron a las larvas de céstodos como Scolex pleuronectis por la presencia de cuatro ventosas en la región anterior, debido a que no es posible identificar las larvas de céstodos a nivel familia si no se observa la morfología del escólex. Dollfus et al. (1954), Øresland (1986), Pierrot-Bults (1990) y Nagasawa (1991) mencionaron que la ingestión de estas larvas en quetognatos, no es común y se da en forma accidental. Por su parte, Khalil et al. (1994) agregó que los adultos de céstodos viven en la válvula espiral de elasmobranquios, los huevos de estas larvas son vertidos al mar por medio de las heces fecales finalizando su desarrollo en una gran variedad de invertebrados marinos. Cribb et al. (2001) y Øresland y Bray (2005) comentaron que el primer hospedero seguramente es una especie obligada, el segundo y los hospederos posteriores son paraténicos, así que los quetognatos son hospederos intermediarios que posiblemente cumplen la función de transporte para estas larvas de céstodos. Con respecto al tamaño de las larvas Plerocercoide de este trabajo, en comparación con los registros previos, igualan en tamaño a las registradas por Nagasawa &Marumo (1979a) (0.1), siendo ambas las más pequeñas hasta el momento. Por su parte Shimazu (1978) registró los organismos de mayor tamaño hasta el momento para quetognatos (1.08-2.99). En cuanto a los registros que hay de estos metacéstodos en peces, Stunkard (1977) encontró larvas de 1.2. No fue posible realizar una comparación de los valores de prevalencia e intensidad media de este trabajo con los registros de Shimazu (1978) y Nagasawa & Marumo (1979a) debido a que no mencionan los valores que obtuvieron, sin embargo, los valores de prevalencia de las larvas tipo Plerocercoide de este trabajo en quetognatos, son 92 menores que las formas larvales registradas por Kulachkova (1972) en S. elegans (0.4). También se han encontrado formas larvales en algunas especies de peces, Klimpel et al. (2003) y Barskaya et al. (2005) consideraron que valores de prevalencia e intensidad media de infección altos serían de 64.3 a 67% y 5.6 respectivamente. Los registros de metacéstodos tipo Plerocercoide de Tetraphyllidea en quetognatos, moluscos y peces se encuentra en la Tabla 24. Platelminto tipo A Figura 28. Fotografía de Platelminto tipo A encontrado en el saco celómico de F. hispida en el ambiente lagunar costero. Descripción: La forma del cuerpo es circular, siendo ligeramente la parte anterior más ancha que la posterior. En la parte anterior presenta dos oscelos en forma oval. Debido al pequeño tamaño no fue posible observar las estructuras internas. 93 Platelminto tipo B Figura 29. Esquema del Platelminto tipo B encontrado en el saco celómico de F. hispida, F. enflata y S. serratodentata en el ambiente lagunar costero. Descripción: A pesar de que se encontraron varios organismos de esta forma de parásito, todas se observan similares, es decir no se le distinguen órganos internos. El tegumento es liso, la forma del cuerpo es oval. Miden de 0.12 a 0.193 mm (0.155) de largo y 0.032 a 0.45 mm (0.04) de ancho. 94 Platelminto tipo C Figura 30. Fotografía de Platelminto tipo C encontrado en el septo caudal de F. hispida en el ambiente lagunar costero. Descripción: La forma del cuerpo es oval y no fue posible obtener las medidas debido a su tamaño. 7.4.2.- Phyllum Nematoda Larva de nemátodo Figura 31. Fotografía de una larva de nemátodo encontrado en el saco celómico de F. hispida y F. enflata en los ambientes lagunar costero y lagunar arrecifal. 95 Descripción: Debido a que las regiones anterior y posterior de estos organismos se encontraron incrustadas en el tegumento del hospedero y al pequeño tamaño que presentaron no fue posible obtener las medidas para cada uno de estos organismos, ni tampoco se distinguen estructuras internas. Género Procamallanus Subgénero (Spirocamallanus) sp. Figura 32. Esquemas de Procamallanus (Spirocamallanus) sp. encontrado en el saco celómico de F. hispida en el ambiente lagunar arrecifal. Descripción: Este ejemplar se encuentra en el tercer estado larval. El cuerpo mide 0.960 de longitud y 0.022 de ancho. Posteriormente termina en forma cónica, con un proceso caudal de dos puntas, una dorsal y la otra ventral. El proceso caudal, mide 0.069 de longitud y 0.014 de ancho. El tegumento es liso. La cápsula bucal es redonda y 96 continua, mide 0.025 de longitud y 0.019 de ancho. No se distingue el anillo basal. El número de bandas esclerotizadas en espiral de la cápsula bucal es 18-20 siendo contadas de derecha a izquierda y viceversa. El esófago se encuentra regionalizado en una zona anterior muscular que mide 0.081 de longitud y 0.013 de ancho y la posterior que es glandular, mide 0.113 de longitud y 0.013 de ancho. El anillo nervioso, mide 0.011 de longitud y 0.014 de ancho, se encuentra a una distancia de 0.105 del extremo anterior. No se observan deiridios y poro excretor. El intestino es recto, mide 0.250 de longitud y 0.013 de ancho. No se observa el primordio genital. Se distingue una glándula rectal circular posterior al intestino, que mide 0.006 de longitud y 0.006 de ancho. No se distinguen fasmidios. Revisión taxonómica y parámetros ecológicos de parasitismo Una de las características de importancia taxonómica para la identificación de las larvas de nemátodos es la coloración. Sin embargo, en este trabajo no se puede mencionar un tipo de coloración de la cutícula del nemátodo debido a que fue teñido dentro del quetognato. Los rasgos distintivos de esta larva se deben a un tegumento liso, una cápsula bucal redonda, continua y con 18 a 20 bandas en espiral, un esófago muscular ligeramente más corto que el glandular, se observó una glándula rectal circular y un proceso caudal cónico en la parte posterior del cuerpo conformado por dos picos terminando en punta. De acuerdo a las características anteriores se considera larva fase 3 o tercer estadio larval (L-3), ya que en las fases L-1 y L-2 no se desarrollan todavía bandas en la cápsula bucal, el esófago no se encuentra diferenciado en muscular y glandular, no se observan glándulas rectales y en la parte posterior no se ha desarrollado el proceso caudal. De ahí que Moravec et al. (1995c) hayan mencionado que exista cierta semejanza con las larvas de los géneros Camallanus, Paracamallanus y Neocamallanus. Sin embargo, las diferencias se presentan a partir del tercer estado larval, particularmente en la estructura de la cápsula bucal (Moravec et al., 1995c). Por las características mencionadas anteriormente se considera a esta larva de nemátodo dentro del subgénero Spirocamallanus Olsen 1952 que fue reubicado dentro del género Procamallanus Baylis, 1923 por Moravec y Amin (1978) y Moravec y Sey (1988). 97 La fase L-3 del nemátodo de este trabajo se diferencia de las demás formas larvales L-3 descritas anteriormente por tener un mayor número de bandas en espiral en comparación con P. (S.) neocaballeroi que tiene ocho bandas en espiral (Moravec y Vargas-Vázquez, 1996), P. (S.) jaliscensis presenta 10 bandas en espiral (Moravec et al., 2000). Moravec et al. (2006) encontraron que a P. (S.) sp. tiene 16 bandas y P. (S.) cricotus de 16 a 19 bandas, además en esta última especie el tamaño del anillo nervioso es mayor. No se observan glándulas rectales y presenta en la parte posterior del cuerpo un proceso caudal con 2 o 3 espinas terminales (Fusco, 1980). De acuerdo con Moravec et al. (1995a, c) la fase L-3 de P. (S.) rebecae no presenta bandas en la cápsula bucal aspecto que difiere con la larva registrada en este trabajo ya que sí presenta bandas en la cápsula bucal. Por su parte, Moravec et al. (1993a) mencionaron solamente que P. (S.) pimelodus tiene numerosas bandas espiraladas sin proporcionar una cantidad aproximada y que esta especie presenta 3 dientes en el fondo de la cápsula bucal, lo cual no se pudo observar en la larva de este trabajo. Las bandas de la fase L-3 obtenida en este estudio son similares con el número de bandas que tienen las larvas de P. (S.) pereirai (12-20) pero se diferencia por carecer del proceso terminal con 3 ó 4 puntas (Santos et al., 1999). A nivel larval diversos autores han mencionado que los nemátodos miembros de la familia Camallanidae utilizan a los copépodos como hospederos intermediarios (Li, 1935; Pereira et al., 1936; Fusco, 1980; Moravec et al., 1995c; Moravec & Vargas-Vázquez, 1996; Moravec et al., 2003) e inclusive se han registrado en camarones (Fusco, 1980; Overstreet, 1973; Santos et al., 1999). En los copépodos, el nemátodo lleva a cabo sus primeras dos mudas originando el desarrollo de las larvas L-1 y L-2, posteriormente los copépodos son consumidos por larvas de peces. Dentro de estos organismos, el nemátodo realiza la tercera muda desarrollando la fase L-3, posteriormente esta larva experimentará la última muda cuando llegue al hospedero definitivo (fase L-4), en este caso peces, donde se convertirá en adulto en el intestino de éste (De & Maity, 1999). Moravec et al. (1995c) mencionaron que es notable, que todas las especies de nemátodos adultos exhiban relativamente un alto grado de especificidad hospedatoria, utilizando como hospederos definitivos los mismos géneros e incluso especies de peces. Sin embargo, debido a las diferentes 98 condiciones ambientales en las áreas geográficas, hay una considerable diferencia en la composición de las especies de la fauna de nemátodos. Por su parte, Moravec (1994) puntualizó que la especificidad de los nemátodos de peces a nivel hospedero intermediario es mucho más amplia que a nivel de hospederos definitivos, los cuales muestran ser particularmente para camalanidos. Moravec et al. (1995c) comentaron que uno de los factores más importantes en la presencia o ausencia de una especie de parásito en una cierta localidad, es la existencia de un hospedero intermediario con una densidad de población alta o suficiente. Posiblemente a esto se deba la presencia de larvas de nemátodos en los quetognatos, los cuales son considerados como el segundo grupo más abundante en el plancton marino después de los copépodos (Øresland, 1990). Una segunda posible vía de infección para el quetognato podría ser el consumo de copépodos infestados con las primeras dos fases larvales (L-1 y L-2) ya que el alimento principal de quetognatos son los copépodos (Nagasawa & Marumo, 1979a). La larva L-3 de este trabajo también se diferencia por el tamaño (0.960), siendo más chica que las larvas L-3 de las especies, P. (S.) cricotus (1.0), P. (S.) rebecae (2.71), P. (S.) pimelodus (2.38), P. (S.) jaliscensis (3.63), P. (S.) pereirai (4.07) y P. (S.) sp. (3.55) (Fusco, 1980; Moravec et al., 1993a, 1995a, b; Santos et al., 1999; Moravec et al., 2000, 2006), aunque es de mayor tamaño que P. (S.) neocaballeroi (0.685) (Moravec y Vargas-Vázquez, 1996). Es importante mencionar que la información que se conoce acerca del tamaño de las larvas L-3 de las diferentes especies, se debe a los trabajos realizados bajo condiciones del laboratorio de los anteriores autores. Con respecto a los organismos adultos, Moravec et al. (2000) mencionaron que el tamaño varía dependiendo del sexo, ya que las hembras grávidas e inclusive no grávidas son de mayor tamaño que los machos. Por otro lado, con respecto a los valores de prevalencia e intensidad media de infección obtenidos en la larva L-3 de este trabajo no pudieron ser comparados con los registros previos debido a que los autores no especifican los valores para la fase L-3. Sin embargo, en los organismos adultos, P. (S.) rebecae de Cichlasoma meeki (Cichlidae) de las costas del sur de Quintana Roo, México (Moravec et al., 1995a), P. (S.) pereirai de Symphurus tesselatus y Menticirrus americanus de Rio de 99 Janeiro, Brasil (Santos et al., 1999) y P. (S.) mexicanus de C. geddesi de Veracruz, México (Moravec et al., 2000) son las especies mencionadas con el valor más alto de prevalencia en peces (P = 100%), mientras que P. (S.) gobiomori de Eleotris picta (Eleotridae) de las costas de Jalisco, México es la especie registrada con el valor más alto de intensidad media de infección en peces (I = 16) (Moravec et al., 2000). Es importante mencionar que este valor de infección se considera alto para especies del subgénero Spirocamallanus, sin embargo, la intensidad registrada para especies del subgénero Procamallanus es incluso mayor, como lo obtenido por Moravec y Van As (2004) de P. (P.) laeviconchus en el pez Synodontis nigromaculatus (Boulenger, 1905) (Mochokidae) de la Rivera de Okavango en Botswana, Africa con una I= 157. Las revisiones realizadas para el género Procamallanus como la de Moravec et al. (2000), quienes se enfocaron principalmente en las especies de agua dulce registradas en la región Neotropical consideran sólo 27 especies válidas pertenecientes a los tres subgéneros: Procamallanus, Spirocamallanus y Denticamallanus. Sin embargo, en una revisión anterior más amplia, Andrade-Salas et al. (1994), mencionaron que existen alrededor de 85 especies de Spirocamallanus tomando en cuenta las sinonimias y teniendo como hospederos a varias especies de peces. En esa revisión, se incluyeron las cuatro especies de adultos registradas para la zona de Norteamérica y México, P. (S.) cricotus y P. (S.) halitrophus por Fusco y Overstreet (1978) en el norte del Golfo de México, P. (S.) neocaballeroi por Caballero-Deloya, 1977 en Veracruz, México y P. (S.) pereirai por Annereaux (1946) y Osorio et al. (1987) de California y de Tabasco, México, respectivamente. Sin embargo, a dicha clasificación se deben agregar las especies registradas para la zona del Pacífico mexicano, P. (S.) gobiomori, P. (S.) jaliscensis y P. (S.) mexicanus (Moravec et al., 2000), y P. (S.) chetumalensis del sur de Quintana Roo, mar Caribe Mexicano (González-Solís et al., 2002). De las ocho especies adultas mencionadas en Norte América y México de acuerdo con la clasificación de Andrade-Salas et al. (1994), sólo tres han sido encontradas en peces marinos, P. (S.) cricotus en Micropogonias undulatus (Sciaenidae), P. (S.) halitrophus en Scyacium papillosum (Bothidae) (Fusco y Overstreet, 1978) y P. (S.) pereirai en Atherinopsis californiensis (Andrade-Salas et al. 1994). 100 7.4.3.- Quiste Figura 33. Fotografía de quistes encontrados en el intestino y saco celómico de F. hispida, F. enflata, P. draco, S. serratodentata y Sagitta sp. de todos los ambientes estudiados. Descripción: Se encontraron 8,610 quistes de forma oval y esféricos. La membrana quística es rugosa y ligeramente fragmentada. Son de tamaño pequeño (>0.01) lo que impidió su manipulación para identificar su contenido. 101 7.4.4.- Modificaciones de la pared corporal del hospedero por la posible presencia de parásitos Figura 34. Fotografía de la modificación corporal encontrada en F. hispida en todos los ambientes estudiados. Descripción: Se observaron 78 quetognatos, los cuales presentaron una alteración o modificación de su pared corporal y fueron exclusivos del 2004. La modificación de la pared corporal radica principalmente en ciertas áreas de la superficie del cuerpo proyectadas hacia el exterior en forma oval o globular sin una ruptura de la pared corporal, lo que aparentemente muestra la posible migración de un parásito, debido a que en algunos casos, se observó esta modificación corporal y la presencia de un parásito. 102 Tabla 13. Registros de C. owreae en quetognatos. HOSPEDERO LOCALIDAD AUTORES F. enflata Florida, E. U. A. Hutton, 1952 y 1954 F. hexaptera Florida, E. U. A. F. lyra Norte de Cuba Suárez-Caabro, 1955 F. lyra Caribe Cubano Dawes, 1958 y 1959 Z. pulchra Norte de Madagascar, Africa S. serratodentata var. atlantica Mauritania S. bipunctata Furnestin y Rebecq, 1966 F. enflata Gabón, Mauritania y Liberia. F. hexaptera Cabo Frío y Mossamedes en Angola F. hexaptera Gran Banco Meteor, Atlántico Jarling y Kapp, 1985 Costas de Quintana Roo, México Gómez del Prado-Rosas et al., 1999b F. enflata S. serratodentata F. hispida S. helenae 103 Tabla 14.- Registros de la larva tipo Monilicaecum. HOSPEDERO LOCALIDAD AUTOR Paracalanus aculeatus Waltair Coast, Bay of Bengal, Madhavi, 1968 (copépodo) Asia-Ocean Indic Vomer setapinnis (pez) Cost Cape, Ghana Fischthal y Thomas, 1968 Parupeneus porphyreus (pez) Hawaii Yamaguti, 1970 Oceano Atlántico Reimer et al., 1975 Suruga Bay, Japan Shimazu, 1978 East of Sea Chine Nagasawa y Marumo, 1979a Sagitta serratodentata Sagitta minima Sagitta hexaptera Sagitta enflata Pterosagitta draco Spadella sp. S. enflata S. ferox S. nagae S. pacifica S. enflata Sagitta enflata Sagitta ferox 104 Sagitta nagae Suruga Bay, Japan Nagasawa y Marumo, 1979b Illex argentinus (Cefalópodo) Brasil Vidal y Haimovici, 1999 Peces de arrecife New Caledonia, Pacifico Cribb et al, 2000 Costas de Quintana Roo, Gómez del Prado-Rosas et al. México (2007) Sagitta neglecta Sagitta regularis F. enflata S. serratodentata 105 Tabla 15a.- Registros de metacercarias y adultos de Hemiurus sp. HOSPEDERO Molusco Retusa truncatula Copépodos Acartia clausi Acartia clausi Calanus sp. Acartia clausi Acartia clausi Acartia Acartia Acartia tonsa Ctenóforos Pleurobrachia pileus LOCALIDAD AUTORES Oresund, aguas Danesas Koie, 1995 Plymouth Sound Costa este de Escocia Lebour, 1923 (Koie, 1995) Marshall, 1925 (Steuer, 1928) Plymouth Sound Norte de Portugal Atlantic, Mediterranean, Black Sea Experimental Oresund, aguas Danesas Lebour, 1935 Candeias, 1957 (Koie, 1995) Stafford, 1905 (Yamaguti, 1971) Koie, 1990 Koie, 1995 Yip, 1984 Quetognatos Sagitta setosa Sagitta elegans Plymouth Sound St. Andrews Sagitta sp. Sagitta sp. Triest Al este de Kattegat, Mar Norte Meek, 1928 (Koie, 1995) Myers, 1956 Timon-David, 1937 (Yamaguti, 1971) Koie, 1990 106 Tabla 15b.- Continuación. HOSPEDERO Adultos Sparus centrodontus Capros aper Lophius piscatorius Trigla pini T. gurnadus Gobius paganellus Lepadogaster govanii Gadus luscus G. merlangus G. minutus G. pollachius Ammodytes lanceolatus Molva molva Zeugopterus punctatus Nerophis aequoreus Trachurus trachurus Scomber scombrus Areliscus purpureomaculatus Melanogrammus aeglefinus Hippoglossus hippoglossus Hippoglossoides plastessoides Limanda ferruginea Pseudopleuronectes americanus Clupea alosa LOCALIDAD AUTORES Canal Ingles Nicoll, 1914 Mar de Ariake, Japón Al norte del oceano Atlántico Magdalena Islands, Gulf of St. Lawrence Miscou Bank, Le Fond George, Magdalena Islands Orphan Bank, Gulf of St. Lawrence Yamaguti, 1938 Linton, 1940 (Hill, 1974) Ronald, 1960 Atlantic, Mediterranean, Black Sea Yamaguti, 1971 107 Salmo Osmerus Gibbus Ammodytes Caspiolosa Luciperca Perca Spicara Anguilla Acanthocottus Hippoglossus Platysomatichthys Mugil Scomber Brevoortia Molva Lophius Gadus Trigla Conger Cottus Ammodytes Sebastodes Liparis Salmo Raniceps Hippoglossus Odontogadus merlangus euxinus Theragra chalcogramma Gadus saida Skandinavia Mar Barents Mar negro Puerto Friday Greenland 108 Theragra Sebastodes Ophiodon Oncorhynchus Urophycis Cyclopterus Lopholatilus Merluccius Pollachius Salvelinus Microgadus Myxocephalus Gymnacanthus Artedicellus Boreogadus Cottus Salmo Eleginus Osmerus Clupea Liparis Blepsias Hippoglossus Limanda Atheresthes Lepidopsetta Pholis Stichaeus Raja Squalus Atlantico 109 Microgadus Clupea harengus C. sprattus Perca fluviatilis Caspialosa pontica Plagyodus ferox Remora remora Theragra chalcogramma Salmo salar Clupea pilchardus C. sardina Rhombus maximus Engraulis encrassicholus Siganus striolatus Diacope metallicus Peces Limanda limanda Gadus morhua Hippoglossoides platessoides Alosa fallax Salmo trutta Boreogadus saida Clupea harengus Gadus morhua morhua Pollachius virens Gadus morhua Sebastes fasciatus Boreogadus saida Hippoglossus stenolepis Oncorhynchus gorbuscha Atlantico Artico, Atlantico, Baltico Danube Mar negro Madeira Woods Hole Bahia de Toyama, Japón Mar Baltico Mediterraneo Filipinas Java este del Atlántico (Nueva Inglaterra) Mar Norte y al norte de Oresund, aguas Danesas Aguas Danesas Noreste del Atlantico Costas Balticas al este de Alemania Kristinberg, costa este de Suiza Franz-Joseph's Fjord, East Greenland Alesund, Noruega Kislaya Inlet, Ura Inlet, the Barent Sea Kislaya Inlet, the Barent Sea este de Noruega Costas de Canada Alaska Timon-David, 1937 (Yamaguti, 1971) Hill, 1974 Koie, 1983 Koie, 1984 Zubchenko, 1985 Gibson & Bray, 1986 Karasev et al., 1996 Karlsbakk et al., 2001 Bakay & Bakay, 2002 Moles, 2007 110 O. kisutch O. nerka O. tshawytscha Theragra chalcogramma Lampetra fluviatilis Costas de Polonia Dawes, 1946 (Sobecka et al., 2009) Tabla 16.- Registros de metacercarias y adultos de Parahemiurus sp. HOSPEDERO LOCALIDAD AUTOR F. hispida Biscayne Bay, Florida Overstreet, 1969 quetognatos sin identificar Japan Shimazu, 1982 F. enflata Indian Ocean Øresland y Bray, 2005 Sea of Ariake, Japan Yamaguti, 1938 Tortugas, Florida Manter, 1947 Biscayne Bay, Florida Overstreet, 1969 Metacercarias Adultos Atherina bleckeri Harengula zunasi Harengula macrophthalmus Anchoa lyolepis Caranx crypos C. hippos Lagodon rhomboides Sardinella anchovia 111 Anchoa halleri Balistes polylepis Haemulon flavigutattum Harengula thrissina Bahía de Chamela, Jalisco Lythrulon flaviguttatum León-Règagnon et al., 1997a Microlepidotus brevipinnis Opisthonema libertate Ortostoechus maculicauda Engraulis anchoita Argentina y Uruguay Timi et al., 1999 Pagrus pagrus Rio de Janeiro, Brasil Paraguassú et al., 2002 Branchiostegus auratus Aguas Taiwanesas Shih et al., 2004 Anchoa tricolor Rio de Janeiro, Brasil Tavares et al., 2005 Acanthopagrus australis New Brighton, New South Wales, Australia Caranx sexfasciatus Dunwich, Stradbroke Island, Queensland, Australia Cephalopholis boenak Heron Island, Queensland, Australia Euthynnus affinis Heron Island, Queensland, Australia Pomatomus saltatrix New Brighton, New South Wales, Australia South Mole, Fremantle, western Australia Priacanthus hamrur New Caledonia, Australia Scorpis lineolata Amity Point, Stradbroke Island, Queensland, Australia Siganus nebulosus Moreton Bay, Queensland, Australia Bray y Cribb, 2005 112 Spratelloides robustus Woodman Point, Western Australia Thunnus tonggol Moreton Bay, Queensland, Australia Trachinotus coppingeri New Brighton, New South Wales, Australia Stradbroke Island, Queensland, Australia Tabla 17.- Registros de metacercarias de Lecithochirium sp. HOSPEDERO LOCALIDAD AUTOR Sagitta cephaloptera Noreste del Atlántico Dollfus, 1960 Sagitta setosa Canal Inglés Øresland, 1986 Costas del Caribe Mexicano Gómez del Prado-Rosas et al., 2005 Metacercarias Flaccisagitta enflata Sagitta bipunctata S. helenae Serratosagitta serratodentata 113 Tabla 18a.- Registros de adultos de Lecithochirium sp. HOSPEDERO LOCALIDAD AUTOR Synodus japonicus Hottuyn, Japan Yamaguti, 1938 Synodus foetens Tortuga, Florida Manter, 1947 Muraenesox coniceps Mazatlán, Sinaloa Bravo-Hollis, 1956 Madagascar Razarihelissoa, 1959 Hawaii Manter y Pritchard, 1960 Gymnothorax dovii Bahía Santa Inés, Baja California, México Arai, 1962 Synodus sp. Puntarenas, Costa Rica Bravo-Hollis y Arroyo, 1962 Lutjanus guttatus Manzanillo, Colima y Lamothe-Argumedo, 1965 Mycteroperca pardalis Zihuatanejo, Guerrero, México Euthynnus alleteratus Bothus pantherinus Bodianus bilunulatus Dactyloptena orientalis Dascyllus albisella Chaetodon auriga C. corallicola C. miliaris Gymnothorax undulatus Hemitaurichthys zoster Katsuwonus pelamis Scomberomorus sierra 114 Archosargus rhomboidalis Bathygobius soporator Caranx crysos Centropomus undecimalis Elops saurus Epinephelus striatus Eucinostomus gula Haemulon flavolineatum Lagodon rhomboides Lutjanus synagris Biscayne Bay, Florida Overstreet, 1969 Mycteroperca bonaci Mycteroperca microlepis Oligoplites saurus Opsanus beta Pomatomus saltatrix Scorpaena grandicornis Selene vomer Synodus foetens 115 Tabla 18b.- Continuación… HOSPEDERO LOCALIDAD AUTOR Adultos Abudefduf abdominalis Acanthurus sandvicensis Albula vulpes Alectis indica Antennarius sp. A. moluccensis Aphareus furcatus Auxis thazard Bothus mancus B. pantherinus Chaetodon fremblii C. miliaris Caranx helvolus C. lugubris Conger sp. Dactyloptena orientalis Decapterus pinnulatus Decapterus maruadsi 116 Euthynnus yaito Fistularia petimba Hawaii Yamaguti, 1970 Gymnothorax flavimarginatus G. undulates Heniochus acuminatus Holocentrus samara Holocentrus spinifer Mulloidichthys auriflamma M. pflueggeri Myripristis argyromus M. berndti Ostichthys japonicas Paracirrhites forsteri Parupeneus bifasciatus P. chryserydros P. multifasciatus P. pleurostigma Priacanthus cruentatus Sarda orientalis Scorpaenopsis cacopsis S. gibbosa Sphyraena halleri 117 Synodus dermatogenys Trachurops crumenophthalmus Upeneus arge Tabla 18c.- Continuación… HOSPEDERO LOCALIDAD AUTOR Gadus morhua Aguas Danesas Koie, 1984 Alectis ciliaris Durban, Natal Blennioclinus brachycephalus Blue Hole, Port Elizabeth, Eastern Cape Province Chrysoblephus anglicus Off St. Lucia, Natal Euthynnus affinis Durban y Sodwana, Natal Gymnapistes marmoratus Rockingham, Western Australia Gymnothorax woodwardi Abrolhos Islands y Dongara, Western Autralia G. javanicus Coral Bay, Western Australia G. flavimarginattus La Mercy, Natal Platycephalus bassensis Adelaide, South Australia Saurida undosquamis Off Richards Bay, Natal Trachichthodes gerrardi Adelaide, South Australia Genypterus capensis Algoa Bay, Slandens River mouth Adultos Bray, 1991 y Cape Town, Cape Province 118 Euthynnus affinis Sargocentron rubrum Heron and Lizard Island, Queensland Bray et al., 1993 Jalisco, México Castillo-Sánchez et al., 1997 Bahía de Chamela, Jalisco, México León-Règagnon et al., 1997a Fistularia commersoni Playa Ocotal, Costa Rica Pérez-Ponce de León et al., 1998 Engraulis anchoita Uruguay y Patagonia, Argentina Timi et al., 1999 Micropogonias furinieri Rio de Janeiro, Brasil Alves y Luque, 2001 Cichlasoma urophthalmus El Cayo, Estero Pargo, Campeche, México Vidal-Martínez et al., 2002 Pterocaesio marri Euthynnus lineatus Anchoa halleri Citula dorsalis Euthynnus lineatus Fistularia petimba Lutjanus colorado Sarda orientalis Trachinotus rhodopus Celestún (laguna), Yucatán, México Pagrus pagrus Rio de Janeiro, Brasil Paraguassú et al., 2002 Conger conger Ría de Arousa, noroeste de España Vilas et al., 2003; 2004 Branchiostegus auratus Euthynnus affinis Megalops cyprinoides 119 Sebastiscus marmoratus Aguas Taiwanesas Shih et al., 2004 Rio de Janeiro, Brasil Da Silva y Luque, 2005a Scomberoides commersonianus Siganus spinus Suggrundus longirostris Trichiurus lepturus Dactylopterus volitans Tabla 19.- Registros de metacecarias y adultos de Brachyphallus sp. HOSPEDERO LOCALIDAD AUTORES Noroeste del océano Atlántico Pierrot-Bults, 1990 (Linton, 1927) Mar Blanco, Europa Pierrot-Bults, 1990 Costas del Caribe Mexicano Gómez del Prado-Rosas et al., 2005 Gadus morhua Aguas Danesas, Ártico Koie, 1984 Varios peces Noreste del Atlántico Gibson y Bray, 1986 Arenque Mar Norte, Europa McKenzie, 1988 Peces dulceacuícolas Puerto Rico, Atlántico Bunkley-Williams y Williams, 1994 Metacercarias Sagitta elegans Serratosagitta serratodentata Adultos 120 Oncorhynchus nerka Rivera Bibi, Hokkaido, Japón Urawa y Kaeriyama, 1999 Arenque Polonia Szostakoska y Sulgostowska, 2001 Dicentrarchus labrax Noruega Sterud, 2002 Agonus cataphractus Mar Norte, Europa Klimpel et al., 2003 Mar Blanco, Europa Barskaya et al., 2005 Rhinonemus cimbrius Oncorhynchus gorhuscha Tabla 20.- Registros del género Opisthadena sp. HOSPEDERO LOCALIDAD AUTORES Kyphosus sectatrix Tortugas, Florida Manter, 1947 Cebidichthys violaceus Playa Dillon, California Johnson y Copsey, 1953 Kyphosus elegans Isla Rasa del Golfo de Cortés, Baja California, México Bravo-Hollis, 1965 Kyphosus sydneyanus Puerto Noarlunga, Adelaide sur de Australia Manter, 1966 Kyphosus sectatrix Biscayne Bay, Florida Overstreet, 1969 Kyphosus cinerascens Hawaii Yamaguti, 1970 Xiphias gladius Noreste del Océano Atlántico Hogans et al., 1983 Kyphosus incisor Isla Mujeres, Quintana Roo Sierra-Romero, 1984 Adultos 121 Kyphosus sectatrix Isla Mario, suroeste de las costas de Puerto Rico Dyer et al., 1985 Kyphosus sectatrix Isla Mona, Puerto Rico Dyer et al., 1992 Kyphosus elegans Baja California y Jalisco, México León-Règagnon et al., 1996 Kyphosus elegans Bahía de Chamela, Jalisco, México León-Règagnon et al., 1997a, b Kyphosus vaigiensis Heron Island, Queensland, Australia K. vaigiensis Lizard Island, Queensland, Australia K. vaigiensis Moorea, French Polynesia K. cinerascens Heron Island, Queensland, Australia K. cinerascens Ningaloo, Australia K. sydneyanus Off Fremantle, Australia K. sydneyanus Ningaloo, Australia K. cornelli Kalbarri, Australia K. bigibbus Ningaloo, Australia Bray y Cribb, 2002 122 Tabla 21.- Registros de adultos de Adinosoma sp. HOSPEDERO Chaunax nuttingi Chlorophthalmus trunculentus Merluccius sp. Paralichthys oblongus Urophycis chesteri U. regius Beryx decadactylus Emmelichthyops sp. Conger sp. Gephyroberyx darwini LOCALIDAD AUTORES Florida, USA Manter, 1934 (Yamaguti, 1971) Hawaii Yamaguti, 1970 Senegal Vassiliades, 1982 Tabla 22.- Registros de metacercarias y adultos de Opechona sp. HOSPEDERO LOCALIDAD AUTORES Plymouth, Atlántico Lebour, 1916 Metacecarias Obelia sp. (medusa) Cosmetira pilosella (medusa) Turris pileata (medusa) Phialidium hemisphaericum (medusa) Pleurobrachia pileus (ctenoforo) Sagitta setosa Canal Inglés 123 Anachis ovara (Gasteropodo) Bougainvillia caroliensis (medusa) Gonionemus vertens (medusa) Woods Hole, USA Stunkard, 1967 y 1969 Sagitta elegans (quetognato) Mar del Norte Reimer et al., 1971 Nemopsis bachei (Anteromedusa) Woods Hole, USA Stunkard, 1974 Norte de Oresund, Europa Koie, 1975 Podocoryne carnea (medusa) Woods Hole, Massachusetts, USA Stunkard, 1980 Pelagia noctiluca (medusa) Woods Hole, Massachusetts, USA Stunkard, 1983 Sagitta sp. (quetognato) Mar del Norte y Kattegat Pierrot-Bults, 1990 Sagitta elegans Canal Inglés Chrysaora quinquecirrha (medusa) Mnemiopsis leidyi (ctenoforo) Pleurobrachia pileus (ctenoforo) Eutonina indicans (medusa) Podocoryne carnea (medusa) Aequorea forskalea (medusa) Phialidium sp. (hidromedusa) Liriope tetraphylla (hidromedusa) Buenos Aires, Argentina Martorelli, 1996 Eirene lactea (medusa) Puerto Morelos, Quintana Roo Gómez del Prado-Rosas et al., 2000 F. enflata (quetognato) Océano índico Øresland y Bray, 2005 Mnemiopsis macradyi (ctenóforo) 124 Adultos Scomber japonicus Japón, Pacífico Yamaguti, 1938 Sardinella anchovia Byscaine Bay, Florida Overstreet, 1969 Gadus morhua Aguas Danesas Koie, 1984 Chloroscombrus chrysurus Bahía Mayagüez, Puerto Rico. Dyer et al., 1985 Mycteroperca tigris (Valenciennes) Isla Mona, Puerto Rico. Dyer et al., 1992 Scomber japonicus Rio de Janeiro, Brasil. Abdallah et al., 2002 Hynnodus atherinoides Tabla 23.- Registros de metacercarias y adultos de Tergestia sp. 125 Tabla 24.- Registros de metacéstodos tipo Plerocercoide en quetognatos y peces. HOSPEDERO LOCALIDAD AUTORES Sagitta inflata Madras, Francia Dollfus et al., 1954 Sagitta tenuis Caribe Dawes, 1958 Sagitta elegans Mar Norte Reimer et al., 1971 Sagitta elegans Mar Blanco Kulachkova, 1972 Eukrohnia hamata Suruga Bay, Japan Shimazu, 1978 Suruga Bay, Japan Nagasawa y Marumo, 1979a Quetognatos Pterosagitta draco Sagitta enflata Sagitta pacifica Pterosagitta draco Eukrohnia hamata 126 Sagitta tasmanica Noreste de África Jarling y Kapp, 1985 Sagitta setosa Canal Inglés Øresland, 1986 Sagitta friderici Isla Sociedad Pierrot-Bults, 1990 Pterosagitta besnardi (P. draco) Sur del Atlántico Flaccisagitta enflata Oceáno índico Øresland y Bray, 2005 Woods Hole, USA Stunkard, 1977 Peces de agua dulce Puerto Rico Bunkley-Williams y Williams, 1994 Thalassoma sp. Nueva Caledonia, Francia Cribb et al., 2000 Micropogonias furnieri Rio de Janeiro, Brasil Alves y Luque, 2001 Macrourus whitsoni Bahía Halley, Mar Wedell Walter et al., 2002 Pagrus pagrus Rio de Janeiro, Brasil Paraguassú et al., 2002 Agonus cataphractus Mar Norte Klimpel et al., 2003 Anchoa tricolor Rio de Janeiro, Brasil Tavares et al., 2005 Onchorhynchus gorhuscha Mar Blanco Barskaya et al., 2005 Molusco Loligo pealeii (Calamar) Peces 127 7.5.1.- Definición de grupos de quetognatos parasitados y parásitos Se aplicó un análisis de agrupamiento que se basa en el índice de Similitud de Sorensen, el cual genero dos dendrogramas con base en las abundancias de los hospederos y de los parásitos en cada una de las estaciones de muestreo (Fig. 35). La escala en la que se presentan los dos dendrogramas es de 0 a 100%, esto significa que la similitud es mayor en aquellas especies y estaciones que estén más cercanas al 100% y serán menos similares conforme se acerquen al 0%. El dendrograma A (Fig. 35), representa la similitud de las estaciones de muestreo en base a las abundancias de los hospederos y parásitos que se presentaron. Se puede observar la conformación de cuatro grupos de estaciones en un nivel de similitud de 30%. Los grupos definidos por el análisis de agrupamiento se revisaron de manera individual con la finalidad de poder identificar las características de cada uno, en total fueron definidos cuatro grupos y son descritos a continuación: Grupo 1 o grupo de F. enflata en el ambiente lagunar arrecifal del 2005 (Tabla 25), nombrado así por la dominancia de esta especie de quetognato y a que el mayor número de estaciones corresponde al año 2004. Fue conformado de 41 estaciones que corresponden a 18 del 2004 y 23 del 2005. En ambos años las estaciones correspondieron a ocho meses; enero, febrero, marzo, mayo, octubre, noviembre y diciembre, aunque septiembre solo fue en el 2004 y junio en el 2005. Predomino el ambiente lagunar arrecifal al que pertenecen 25 estaciones, nueve del 2004 y 16 del 2005. El segundo ambiente fue el arrecifal nerítico con 16 estaciones que fueron nueve del 2004 y siete del 2005. En este grupose incluyeron cinco especies de quetognatos parasitadas que mostraron 20 parásitos diferentes. F. enflata fue la especie de quetognato más abundante (4.269) y frecuente (100%) y la abundancia de los parásitos de este grupo estuvo dominada por la Larva de Monilicaecum (5.610), los quistes (4.024) y los digéneos Distoma tipo G (1.268). En la Tabla 25 también se observan las abundancias promedio y frecuencia relativa de las otras cuatro especies de quetognatos y de los 17 parásitos restantes que se encontraron en este grupo. La prevalencia obtenida para este grupo fue desde 1.61 hasta el 33.3% (10.99% en promedio). La temperatura varióde 24.15 a 29.4º C (26.798º C en promedio). En el caso de la salinidad varió de 27.3 a 37.65 ups (36.08 en promedio). 128 El oxígeno varió de 3.645 a 6.74 mL (5.195 mL en promedio). El pH fue de 7.39 a 8.32 (8.11 en promedio) y la precipitación pluvial varió de 8.6 a 649.2 mm (81.35 mm en promedio). El grupo 2 o Grupo de F. enflata en el ambiente lagunar arrecifal del 2004 (Tabla 26), fue conformado de 19 estaciones que corresponden a 13 estaciones en los meses de enero, febrero, abril, mayo, junio, agosto, septiembre, octubre y noviembre del 2004 y seis estaciones del 2005 en abril, agosto, septiembre y octubre. Predominó el ambiente lagunar arrecifal con nueve estaciones del 2004 y tres del 2005. Del segundo ambiente, arrecifal nerítico, fueron cuatro estaciones del 2004 y tres del 2005. En este grupo se consideraron las cinco especies de quetognatos parasitadas que mostraron siete parásitos diferentes. En este grupo F. enflata fue la especie más abundante (0.799) pero no fue la más frecuente (68.42%) debido a que F. hispida se presento en el 84.21% de las estaciones. En el caso de los parásitos, la mayor abundancia y frecuencia fueron de los quistes (1.421 y 78.95%, respectivamente) y los distómidos tipo G (0.421 y 21.05%, respectivamente). En la Tabla 26 se complementa la lista de especies de quetognatos parasitados y parásitos que se encontraron en este grupo. Se observo que la prevalencia de parasitismo de este grupo varió de 0.00001 a 33.33% (8.51% en promedio). La temperatura varió de 23.95 a 32.2º C (27.94º C en promedio). La salinidad fue de 27.2 a 37.4ups (35.16 ups en promedio). El oxígeno varió de 3.03 a 7.485 (5.34). El pH varió de 7.27 a 8.37 (8.01 en promedio). Por último la precipitación pluvial varió de 8.6 a 208.2 mm (75.33 mm en promedio). El grupo 3 o Grupo de F. hispida en el ambiente lagunar costero del 2005 (Tabla 27), se integró de 45 estaciones exclusivamente del ambiente lagunar costero. 18 son de enero, febrero, marzo, abril, mayo, junio y julio del 2004 y 27 son de enero, febrero, marzo, abril, mayo, junio, julio, agosto, septiembre y diciembre del 2005. En este grupo se incluyeron dos especies de quetognatos que presentaron 24 parásitos. El quetognato dominante fue F. hispida (54.073) el cual tuvo una frecuencia del 100%. De los parásitos encontrados, los quistes fueron los dominantes de este grupo con una abundancia promedio del 186.156 y con una frecuencia relativa del 100%. En la Tabla 27 se presenta el complemento de la abundancia promedio y frecuencia 129 relativa del quetognato F. enflata y del resto de los parásitos encontrados en este grupo. La prevalencia tuvo una variación de 0.74 a 85.6% (10.28% en promedio). La temperatura varió de 22.1 a 32.6º C (27.51º C en promedio). En el caso de la salinidad varió de 20.8 a 36.75 ups (31.11 ups en promedio). Por su parte el oxígeno fue de 3.25 a 7 (5.02 en promedio). El pH varió de 7.58 a 8.51 (8.12 en promedio). La precipitación pluvial de este grupo fue desde los 8.6 hasta los 249.9 mm (79.84 mm en promedio). En el grupo 4 o Grupo de F. hispida de ambientes mixtos del 2005 (Tabla 28), se agruparon 18 estaciones que corresponden a 5 estaciones en los meses de julio, noviembre y diciembre del 2004 y 13 al 2005 de enero, febrero, abril, junio, julio, septiembre, octubre y noviembre. En este grupo domino el ambiente lagunar costero con 10 estaciones (4 del 2004 y 6 del 2005), el lagunar arrecifal presento 7 estaciones exclusivamente del 2005 y se presento una estación del arrecifal nerítico en el 2004. En este grupo se presentaron las cinco especies de quetognatos parasitados, sin embargo, la especie dominante fue F. hispida (10.687) que tuvo una frecuencia del 100%. En este grupo se presentaron 11 parásitos diferentes, siendo los más abundantes, la forma quistes (3.00) y el hemiúrido Brachyphallus sp. (1.444). En la Tabla 28 se detallan las abundancias promedio y frecuencias de cada una de las especies de quetognatos y de los parásitos que conforman al grupo. La prevalencia que se observó en este grupo fue de 0.32 al 8% (2.54% en promedio). La temperatura presentó una variación de 24.7 a 32.6º C (28.72º C en promedio). La salinidad varió de 19.35 a 37.3 ups (33.05 en promedio). El oxígeno varió de 3.985 a 7.035 (5.45 en promedio). El pH fue de 7.21 a 8.29 (7.90 en promedio) y por último la precipitación pluvial varió de 16 a 649.2 mm (217.58 mm en promedio). Por otra parte en el dendrograma B (Fig. 35), se observan las agrupaciones de las especies de quetognatos parasitadas y de los parásitos, particularmente se distinguen dos grandes grupos. El primero dominado por Ferosagitta hispida con una riqueza parasitaria de 11 (Tabla 27 y 28) y el segundo grupo dominado por Flaccisagitta enflata con una riqueza parasitaria de 23 parásitos diferentes (Tabla 25 y 26) y también esta especie se ve asociada con los quetognatos Pterosagitta draco, Serratosagitta serratodentata y Sagitta sp. 130 Como complemento a los dendrogramas en la Figura 35, se observa un rectángulo y en su interior se distinguen cuadros en blanco y negro como símbolo de presencia (negro) y ausencia (blanco) de cada uno de los quetognatos parasitados y de los parásitos, este rectángulo funge de guía para conocer el contenido en cada uno de los grupos de estaciones en base a la presencia o ausencia, información que se desgloso en las tablas de cada grupo. 7.5.2.- Procedimiento de Permutación de Multi-Respuesta (PPMR) Con este análisis se comprobó que sí existen diferencias significativas en la abundancia de los quetognatos parasitados y de los parásitos en cada uno de los grupos definidos por el análisis de cluster. La hipótesis se rechazo fue que no había diferencias significativas entre las estaciones de muestreo. El resultado de la prueba fue un t-estadístico de -48.909785, un valor de A de 0.5061053 y una p= 0.000000000. A= 1 – (delta observada/delta esperada) Amax= 1 cuando todas las especies dentro de los grupos comparados son idénticas (delta= 0) A= 0 cuando la heterogeneidad dentro de los grupos iguala a lo esperado por Aleatoriedad A< 0 cuando más heterogeneidad existe dentro de los grupos que lo esperado por aleatoriedad p= probabilidad de obtener un delta más pequeño o igual. 7.5.3.- Relaciones entre el parasitismo de quetognatos y el ambiente Con la finalidad de observar la relación entre los grupos de quetognatos parasitados y los parásitos con las variables ambientales: temperatura (T), salinidad (S), oxígeno disuelto (O2), potencial de hidrógeno, prevalencia (P) y la precipitación pluvial (PP) se utilizó un análisis de correspondencias canónicas. Este análisis permite observar el resultado de las correlaciones en una gráfica de ordenación en dos ejes y asocia cada una de las variables ambientales a un eje (Fig 36). 131 El resultado de este análisis indicó que no hubo correlación significativa con alguna de las variables ambientales. Los valores de las correlaciones que se obtuvieron fueron: prevalencia de parasitismo (P; r= 0.041) y el pH (PH; r= -0.225) están más correlacionadas con el segundo eje del diagrama del análisis de correspondencia canónica; la temperatura (T; r= 0.289), la salinidad (S; r= -0.143), el oxígeno (O2; r= 0.158) y la precipitación pluvial (PP; r= 0.112) que se encuentran más correlacionados con el primer eje. En la Figura 36 se puede observar que en cuanto a la salinidad (S) se refiere los grupos de F. enflata (1 y 2) son los que están más relacionados con salinidades altas, por el contrario su relación es inversa a temperaturas bajas (T). Caso contrario con los grupos de F. hispida (3 y 4) los cuales están más relacionados con las temperaturas altas y por tal, se encuentran alejados del vector de la salinidad. Los grupos de F. enflata del ambiente lagunar arrecifal del 2005 y F. hispida del ambiente lagunar costero del 2005 (grupos 1 y 3, respectivamente) se encontraron relacionados con los valores altos del pH. También estos dos grupos se encuentran relacionados con valores altos de prevalencia (P). El grupo que estuvo más relacionado al oxígeno (O2) fue el grupo F. hispida del ambiente lagunar costero del 2005 (grupo 3) con los valores bajos de oxígeno. Por último con la precipitación pluvial (PP) se observa relación con el grupo F. hispida del ambiente lagunar costero del 2005 con los valores bajos de esta variable ambiental. 132 133 Figura 35. Dendrogramas de similitud de los quetognatos parasitados, los parásitos y de las estaciones de muestreo del 2004 y 2005. [A= Dendrograma A, B= Dendrograma B, 1= Grupo de F. enflata en el ambiente lagunar arrecifal del 2005, 2= Grupo de F. enflata en el ambiente lagunar arrecifal del 2004, 3= Grupo de F. hispida en el ambiente lagunar costero del 2005, 4= Grupo de F. hispida de ambientes mixtos del 2005, Fh= Ferosagitta hispida, Fe= Flaccisagitta enflata, Pd= Pterosagitta draco, Ss= Serratosagitta serratodentata, Ssp= Sagitta sp., t1= Distoma A, t2= Distoma B, t3= Distoma C, t4= Distoma D, t5= Distoma E, t6= Distoma F, t7= Distoma G, t8= Esporocisto, t9= Cercaria owreae, t10= larva tipo Monilicaecum, t11= hemiuridae, t12= Hemiurus sp., t13= Parahemiurus sp., t14= Lecithochirium sp. t15= Brachyphallus sp., t16= Paralecithochirium sp., t17= Opisthadena sp., t18= Dinosoma sp., t19= Opechona pyriforme, t20= Tergestia sp., c1= Plerocercoide A, c2= Plerocercoide B, c3= Plerocercoide C, c4= Plerocercoide D, c5= Plerocercoide E, c6= Plerocercoide F, mo= Larva Gyrodactylidae, tu1= Platelminto tipo A, tu2= Platelminto tipo B, tu3= Platelminto tipo C, n1= Nemátodo larva, n2= Procamallanus (Spirocamallanus) sp., q= Quiste y mc= Modificación corporal]. 134 135 Figura 36. Relación del parasitismo y de los grupos de estaciones con respecto a las variables ambientales (O2= Oxígeno, P= Prevalencia, PH= Potencial hidríco, PP= Precipitación pluvial, T= Temperatura, S= Salinidad). Los grupos de estaciones de muestreo se representan con los puntos en colores (Grupo 1 en color lila= F. enflata en el ambiente lagunar arrecifal del 2005, Grupo 2 en color verde= F. enflata en el ambiente lagunar arrecifal del 2004, Grupo 3 en color azul= F. hispida en el ambiente lagunar costero del 2005, Grupo 4 en color amarillo= F. hispida de ambientes mixtos del 2005). Las especies de quetognatos parasitados y los parásitos en triángulos oscuros [Fh= Ferosagitta hispida, Fe= Flaccisagitta enflata, Pd= Pterosagitta draco, Ss= Serratosagitta serratodentata, Ssp= Sagitta sp., t1= Distoma A, t2= Distoma B, t3= Distoma C, t4= Distoma D, t5= Distoma E, t6= Distoma F, t7= Distoma G, t8= Esporocisto, t9= Cercaria owreae, t10= larva tipo Monilicaecum, t11= hemiuridae, t12= Hemiurus sp., t13= Parahemiurus sp., t14= Lecithochirium sp. t15= Brachyphallus sp., t16= Paralecithochirium sp., t17= Opisthadena sp., t18= Dinosoma sp., t19= Opechona pyriforme, t20= Tergestia sp., c1= Plerocercoide A, c2= Plerocercoide B, c3= Plerocercoide C, c4= Plerocercoide D, c5= Plerocercoide E, c6= Plerocercoide F, mo= Larva Gyrodactylidae, tu1= Platelminto tipo A, tu2= Platelminto tipo B, tu3= Platelminto tipo C, n1= Nemátodo larva, n2= Procamallanus (Spirocamallanus) sp., q= Quiste y mc= Modificación corporal]. 136 Tabla 25. Grupo de Flaccisagitta enflata en el ambiente lagunar arrecifal del 2005 (Grupo 1), formado por el análisis de agrupamiento. GRUPO 1 Abundancia n= 41 estaciones promedio Frecuencia Frecuencia relativa F. hispida Fh 0.491 35 85.37 F. enflata Fe 4.269 41 100.00 P. draco Pd 0.161 17 41.46 S. serratodentata Ss 0.327 24 58.54 Sagitta sp. Ssp. 0.327 24 58.54 Distoma A t1 0.024 1 2.44 Distoma B t2 0.024 1 2.44 Distoma F t6 0.024 1 2.44 Distoma G t7 1.268 13 31.71 Cercaria owreae t9 0.098 2 4.88 Larva Monilicaecum t10 5.610 41 100.00 Hemiuridae t11 0.122 4 9.76 Brachyaphallus sp. t15 0.024 1 2.44 Paralecithochirium sp. t16 0.024 1 2.44 Dinosoma sp. t18 0.049 2 4.88 Opechona pyriforme t19 0.268 7 17.07 Tergestia sp. t20 0.073 1 2.44 Plerocercoide C c3 0.024 1 2.44 Plerocercoide E c5 0.024 1 2.44 Plerocercoide F c6 0.049 1 2.44 Monogéneo larva mo 0.024 1 2.44 Nemátodo 1 n1 0.024 1 2.44 Procamallanus (S.) sp. n2 0.024 1 2.44 Quiste q 4.024 25 60.98 Modificación corporal mc 0.073 3 7.32 137 Tabla 26. Grupo de Flaccisagitta enflata en el ambiente lagunar arrecifal del 2004 (Grupo 2), formado por el análisis de agrupamiento. GRUPO 2 Abundancia n= 19 estaciones promedio Frecuencia Frecuencia relativa F. hispida Fh 0.151 16 84.21 F. enflata Fe 0.799 13 68.42 P. draco Pd 0.025 6 31.58 S. serratodentata Ss 0.338 11 57.89 Sagitta sp. Ssp 0.338 11 57.89 Distoma G t7 0.421 4 21.05 Cercaria owreae t9 0.105 2 10.53 Larva Monilicaecum t10 0.105 2 10.53 Opisthadena sp. t17 0.053 1 5.26 Plerocercoide D c4 0.053 1 5.26 Quiste q 1.421 15 78.95 Modificación corporal mc 0.105 2 10.53 138 Tabla 27. Grupo de Ferosagitta hispida en el ambiente lagunar costero del 2005 (Grupo 3), formado por el análisis de agrupamiento. GRUPO 3 Abundancia n= 45 estaciones promedio Frecuencia Frecuencia relativa F. hispida Fh 54.073 45 100 F. enflata Fe 0.005 4 8.89 Distoma C t3 0.022 1 2.22 Distoma D t4 0.022 1 2.22 Distoma E t5 0.022 1 2.22 Distoma F t6 0.022 1 2.22 Distoma G t7 10.467 15 33.33 Esporocisto t8 0.133 2 4.44 Larva Monilicaecum t10 0.133 3 6.67 Hemiuridae t11 3.622 20 44.44 Hemiurus sp. t12 0.311 7 15.55 Parahemiurus sp. t13 0.289 11 24.44 Lecithochirium sp. t14 0.267 7 15.55 Brachyphallus sp. t15 0.667 11 24.44 Opisthadena sp. t17 0.022 1 2.22 Dinosoma sp. t18 0.200 5 11.11 Opechona pyriforme t19 0.022 1 2.22 Tergestia sp. t20 0.022 1 2.22 Plerocercoide A c1 0.022 1 2.22 Plerocercoide B c2 0.156 4 8.89 Platelminto A tu1 0.022 1 2.22 Platelminto B tu2 0.222 7 15.55 Platelminto C tu3 0.022 1 2.22 Nemátodo 1 n1 0.022 1 2.22 Quiste q 186.156 45 100 Modificación corporal mc 1.600 6 13.33 139 Tabla 28. Grupo de Ferosagitta hispida de ambientes mixtos del 2005 (Grupo 4), formado por el análisis de agrupamiento GRUPO 4 Abundancia n= 18 estaciones promedio Frecuencia Frecuencia relativa F. hispida Fh 10.687 18 100 F. enflata Fe 0.068 8 44.44 P. draco Pd 0.034 3 16.66 S. serratodentata Ss 0.165 7 38.89 Sagitta sp. Ssp 0.165 7 38.89 Distoma G t7 0.389 3 16.67 Larva Monilicaecum t10 0.278 4 22.22 Hemiuridae t11 0.889 8 44.44 Hemiurus sp. t12 0.111 1 5.55 Lecithochirium sp. t14 0.556 3 16.67 Brachyphallus sp. t15 1.444 6 33.33 Dinosoma sp. t18 0.444 4 22.22 Tergestia sp. t20 0.444 2 11.11 Platelminto B tu2 0.056 1 5.55 Quiste q 3.000 10 55.55 Modificación corporal mc 0.056 1 5.55 140 8.- DISCUSION 8.1.- Distribución y abundancia de quetognatos Del análisis taxonómico de quetognatos de este trabajo se identificaron 12 especies de las 17 que han sido registradas previamente en estudios sobre las comunidades zoopláncticas en el Caribe Mexicano (Suárez-Morales & GascaSerrano, 1990a, b; Gasca-Serrano & Castellanos, 1993; Gasca-Serrano et al., 1994; Suárez-Morales, 1994b), como en los dirigidos exclusivamente a los quetognatos (Suárez-Morales et al., 1990; Gasca et al., 1996; Álvarez-Cadena et al., 1996b; Ramírez-Ávila, 1997; Ramírez-Ávila & Álvarez-Cadena, 1999; Hernández-Flores, 2003). Por su parte, McLelland (1989) registró un total de 24 especies distribuidas tanto en el Mar Caribe como en el Golfo de México. Michel & Foyo (1976) mencionaron que la fauna de quetognatos de las aguas tropicales del Caribe estaban dominadas por un grupo de ciertas especies, en el que se incluían Flaccisagitta enflata, Serratosagitta serratodentata, Krohnitta pacifica, Pterosagitta draco y Flaccisagitta hexaptera, que también fueron encontradas en el presente trabajo en el ambiente lagunar arrecifal. Particularmente en el norte de Quintana Roo, Merino (1986) y Gasca et al. (1996) mencionaron que la estrecha plataforma continental (6 km) y que los patrones de circulación frente a Puerto Morelos permiten el flujo de la corriente hacia la costa, lo cual tiene influencia directa con el transporte de especies oceánicas hacia regiones neríticas o costeras y por tal razón, es que se encuentren especies de distribución oceánica en la zona costera como es el caso de Eukrohnia hamata, P. draco, F. enflata, F. hexaptera, Mesosagitta minima, Sagitta bipunctata y S. serratodentata, inclusive con excepción de F. enflata, las cuales presentaron los valores más bajos de abundancia. Por su parte, las especies K. pacifica, F. hispida, S. helenae, S. friderici y S. tenuis registradas en este trabajo, son consideradas de ambientes neríticos (Alvariño, 1965; McLelland, 1989) y con excepción de F. hispida, también fueron encontradas con valores de abundancia bajos en el ambiente lagunar arrecifal, lo cual ha sido observado previamente en las costas de Quintana Roo (Suárez-Morales et al., 1990; Álvarez-Cadena et al., 1996b; Gasca et al., 1996; 141 Ramírez-Ávila, 1997; Suárez-Morales, 1998; Hernández-Flores, 2003; ÁlvarezCadena et al., 2009). Los resultados de abundancia muestran el dominio de dos especies, F. hispida con el 73.99% y F. enflata con el 13.89%. En el caso de F. hispida, RamírezÁvila & Álvarez-Cadena (1999) la registraron como dominante y teniendo su abundancia más alta en el periodo de lluvías, como ocurrió en el presente trabajo, donde F. hispida fue más abundante durante el perido de mayor precipitación pluvial durante el 2004 tanto en el ambiente lagunar costero como en el lagunar arrecifal. Michel (1984) la consideró como indicadora de aguas neríticas y oceánicas en zonas tropicales y subtropicales en los océanos Atlántico, Indico y Pacífico (Suárez-Caabro, 1955) y debido a que presenta esta distribución se sabe que es constante durante todo el año (Pierce, 1951; Owre, 1960),por tal, se pueden observar gran cantidad de especímenes inmaduros representando múltiples generaciones que coexisten en diferentes estados de desarrollo (Pearre, 1991), ya se ha mencionado que solamente necesitan de 18 a 50 días para completar un ciclo reproductivo (dependiendo de la temperatura), lo cual la hace una especie de rápido desarrollo (Casanova, 1999). Por su parte F. enflata es una especie cosmopolita en todos los mares tropicales y subtropicales entre los 40º latitud N y los 40º S, es considerada tanto oceánica como nerítica (Vega-Rodríguez, 1964), incluso esta especie es considerda como indicadora de aguas oceánicas (Alvariño, 1965; McLelland, 1989). Mostajo (1978) y McLelland (1989) mencionaron que es la especie más abundante, común y fácil de identificar en el Golfo de México. Youngbluth (1979) mencionó que los cambios en la densidad de esta especie pueden deberse a movimientos de masas de agua. Ramírez-Ávila & Álvarez-Cadena (1999) la registran como la segunda especie más abundante y frecuente en la laguna arrecifal de Puerto Morelos después de F. hispida, justo como fue observado en este trabajo. 8.2.- Prevalencia y parasitismo de quetognatos El parasitismo en la comunidad de quetognatos de este estudio fue ubicado exclusivamente en cinco especies, P. draco, F. hispida, F. enflata y S. serratodentata de las 12 especies encontradas, esto posiblemente a que varias de las otras 142 especies se presentaron con abundancias bajas y en poca frecuencia. Los valores de prevalencia e intensidad media de parasitismo fueron mayores a los registrados previamente en quetognatos del Caribe Mexicano (Gómez del Prado-Rosas et al., 1999a, b, 2000a, 2002, 2005 & 2007b) e inclusive que los valores obtenidos en otros zooplancteres como medusas y larvas de peces de esta misma zona (Gómez del Prado- Rosas et al., 2000b, 2007a; Morales-Hernández, 2009; Gutiérrez-Heredia, 2008). Posiblemente esto se deba a que, el presente trabajo fue realizado durante todo el ciclo anual lo que implicó tener un mayor número de muestra y así una revisíon del parasitismo de quetognatos más completa. El presente trabajo es el primero que se realiza durante dos ciclos anuales, lo que permite observar la distribución espacial y temporal de los helmintos en el norte de Quintana Roo. De las cuatro especies parasitadas, P. draco es la única especie que no había sido registrada como hospedero en el norte de Quintana Roo por lo que se considera como un nuevo registro para el Caribe Mexicano. Sin embargo, al igual que las otras tres especies han sido registradas previamente como hospederos de algunas formas de digéneos, céstodos y nemátodos en otras áreas geográficas (Reimer et al., 1975; Shimazu, 1978; Mazzoni, 1986; Pierrot-Bults, 1990). En las costas de Quintana Roo el número de especies que se han encontrado parasitadas es de siete. Las de mayor número de registros son F. enflata en cinco ocasiones (Gómez del Prado-Rosas et al., 1999b, 2000a, 2002, 2005 & 2007b) y S. serratodentata en cuatro ocasiones (Gómez del Prado-Rosas et al., 1999a, b, 2005 & 2007b). También han sido registradas S. bipunctata, S. helenae y Parasagitta friderici (Gómez et al., 1999b; 2005), sin embargo, en el presente trabajo no se presentaron parasitadas posiblemente a su poca ocurrencia durante estos años de estudio. Shimazu (1978) mencionó, que una posible vía de infestación de los quetognatos, se deba a que adquieran las larvas de helmintos al ingerir pequeños copépodos infectados, que son posiblemente el segundo hospedero intermediario. El quetognato infestado de esta manera actúa como hospedero paraténico, transportando a las larvas de parásitos, como se ha mencionado en los Didymozoidae a otro hospedero paraténico o definitivo (Madhavi, 1968; Shimazu, 1978; Pierrot-Bults, 1990). Bunkley-Williams & Williams (1994) y Alves & Luque 143 (2001) mencionaron que las formas larvales de helmintos causan poco daño en su hospedero a menos que se presenten en grandes cantidades y que su ingestión se debe en parte a la dieta, a la distribución regional y a la densidad de los hospederos. Lafferty (1999) y Poulin & Valtonen (2001) sugieren que los parásitos con ciclos de vida similares aumentan la posibilidad de transmisión por la asociación con los hospederos intermediarios o paraténicos. En el caso de los quetognatos de este estudio, rara vez se presentaron dos especies de helmintos en un quetognato ya que en su mayoría se presentó un parásito por hospedero, lo que significa que los valores de prevalencia e intensidad media son bajos. Poulin (2001), considera que los valores de prevalencia de las especies de helmintos en los hospederos intermediarios se consideran bajos (<1%) cuando se comparan con el de los helmintos adultos en los hospederos definitivos. Por su parte, Cezar & Luque (1999) y Paraguassú et al. (2002) mencionaron que la presencia o ausencia de los estados larvales de parásitos tendrá una explicación completa, cuando se tenga la información adicional sobre las características de las poblaciones de los potenciales hospederos intermediarios y definitivos. En este trabajo se mencionaron algunas formas de parásitos que no se pudieron identificar debido a que el tamaño dificultó su manipulación, como ocurrió con las formas distoma y quistes. Además, se observó en algunos quetognatos, una modificación de la pared corporal en forma de abultamiento o proyección, semejante a la descrita por Santhakumari (1992), la cual posiblemente esté originada por parásitos. Nagasawa (1991), hace mención a esto al referirse a que los parásitos se pueden desplazar por el celoma del cuerpo llegando hasta la zona ovárica. Esto significaría que posiblemente la proyección corporal mencionada, es el resultado de la presencia de un parásito que se ha desplazado hacia otra zona del cuerpo. Este mismo autor registró parásitos, en la cabeza, céloma del cuerpo y ovarios de los quetognatos, lo cual coincide con este trabajo, en donde además se encontraron en el septo caudal. Nagasawa y Nemoto (1984), mencionaron que la presencia de parásitos en quetognatos puede provocar alteraciones en varios aspectos. Uno de estos, se refiere a los cambios en el tegumento de los quetognatos, como lo registró Santhakumari (1992), quien hace referencia a tres efectos que son: un cambio en el 144 color del tegumento de F. enflata y Sagitta bedotti (Beraneck, 1895) debido a la presencia de manchas oscuras provocadas por hongos; un cambio en la coloración de la cola de F. enflata, en el que observó, un tono más opaco al normal (transparente) y el último relativo al alargamiento o proyección de la superficie corporal ya mencionado. Una modificación de comportamiento, es el cambio en la conducta de los quetognatos debido a una combinación de efectos del gigantismo provocados por la presencia de helmintos, lo cual induce a que los quetognatos vivan más cerca de la superficie lo cual conlleva a una mayor vulnerabilidad a ser depredados por peces planctívoros como lo mencionaron, Pearre (1979) y Nagasawa (1991). Esto puede ser interpretado como una influencia del parásito sobre su hospedero que le permita llegar más pronto hacia su siguiente hospedero o al definitivo. Nagasawa (1991) también menciona que la inhibición del desarrollo de los ovarios de manera parcial o definitiva es ocasionada por larvas de nemátodos y tremátodos principalmente. 8.3.- Habitat planctónicos indicados por quetognatos parasitados El índice de Sorensen utilizado en la formación de grupos planctónicos con base en la distribución de las especies quetognatos parasitados y parásitos más abundantes definió dos grupos planctónicos principales en base a las especies de quetognatos F. hispida y F. enflata que fueron las de mayor abundancia. El grupo que representa cada una de estas especies fue separado por el ambiente diferenciando así dos hábitat en la distribución de F. hispida y dos en F. enflata, siendo en total cuatro grupos. Los grupos 1 y 2 corresponden a F. enflata, estos grupos son una mezcla de estaciones de los ambientes arrecifal nerítico y lagunar arrecifal, que presentaron las temperaturas más bajas y salinidades más altas, lo cuál coincide con la distribución de F. enflata, debido a que Pierce (1951) y McLelland (1989) la consideradan como poco tolerante a bajas salinidades e incluso Naranjo (2000) la registra en salinidades superiores a los 34.2 ups. También Crelier & Daponte (2004) la registran en salinidades entre 34.5 y 35.5 ups, valores que se encuentran en el intervalo de salinidad obtenidos en este par de grupos. Por su parte, Suárez-Caabro (1955) y 145 Vega-Rodríguez (1964) la mencionan como tolerante a temperaturas que varían entre los 16 y 32º C, intervalo en el que se pueden incluir las temperaturas de los grupos 1 y 2 de este trabajo. Esta especie también es mencionada como tolerante a variaciones de oxígeno, sin embargo, Rivero-Beltran (1975) no menciona los valores en los que se distribuye esta especie. En el análisis de correspondencia canónica se pudo obsevar que la salinidad estuvo correlacionada con los grupos 1 y 2, lo cuál esto quiere decir que se presentaron las especies con características más oceánicas como es F, enflata, S. serratodenta, P. draco y que han sido mencionadas como especies asociadas a aguas tropicales de mayor salinidad (Álvarez-Cadena et al., 1996b; Ramírez-Ávila & Álvarez-Cadena, 1999). En general, en el ambiente arrecifal nerítico en el que se encontró abundante F. enflata, resultó con la menor cantidad de organismos capturados de los tres ambientes estudiados. Longhurst & Pauly (1987) y Álvarez-Cadena et al. (2007b) mencionaron que las aguas oceánicas del Caribe a diferencia de las costeras o lagunares son consideradas como una región de menor fertilidad orgánica (aguas oligotróficas) y que incluso han sido registradas como de bajos valores tanto en producción primaria como secundaria, lo que se vería reflejado en una disminución de quetognatos como ocurrió en este estudio. Álvarez-Cadena et al. (2007b) atribuyen a que la disminución en la producción secundaria y por tal en la abundancia de quetognatos, se puede deber a un menor contenido de oxígeno debido a que en esta zona del norte de Quintana Roo, la barrera arrecifal disminuye considerablemente, el fondo es constituido en su mayoría de blanquizales de arena, se presentan fuertes corrientes y que hay una gran dinámica de oleaje, lo que difculta el asentamiento y formación de praderas de pastos y algas ocasionando que exista un menor contenido de oxígeno. En cambio en el ambiente lagunar arrecifal, aunque se encuentra en constante comunicación con el medio oceánico, se observa la presencia de extensas praderas de pastos marinos que favorcen el contenido de oxígeno disuelto en la columna de agua, aumentando así los niveles de clorofila-a y de biomasa zooplánctica (Álvarez-Cadena et al., 2007b). Probablemente, esta sea la razón por la que se capture una mayor cantidad de quetognatos a diferencia del arrecifal nerítico. 146 Por otro lado, en lo que respecta a los grupos de F. hispida, se observa un dominio exclusvio de estaciones del ambiente lagunar costero en el caso del grupo 3 y en el grupo 4 una mezcla de estaciones del ambiente lagunar costero con el lagunar arrecifal princialmente y dos estaciones del arrecifal nerítico. Esto coincide con la distribución de esta especie la cual es registrada como única en el Sistema Lagunar Nichupté (Álvarez-Cadena et al., 1996b) que es incluida en el ambiente lagunar costero de este trabajo. Boltovskov (1981) mencionó que tiene la capacidad de sobrevivir en salinidades que varían entre los 20 y 45 ups, intervalo en el que se encuentran las salinidades obtenidas en los grupos 3 y 4 de este trabajo. Reeve & Walter (1972) realizaron experimentos de la tasa de crecimiento de F. hispida y encontraron que las especies no sobreviven más de 15 días a temperaturas superiores a los 33.5º C y que las especies pueden desarrollar su madurez en rangos de salinidad de 25 a 40 ups y que por debajo de los 20 ups no alcanzan a madurar. Álvarez-Cadena et al. (1996b) la registra en el SLN (ambiente lagunar costero en este trabajo) en salinidades mayores a los 35 ups. Suárez-Caabro (1955) la registra en temperaturas entre los 21 y 29º C. Por su parte, Liang (2002) la reporta en temperaturas y salinidades mayores a 20º C y 36.0 ups respectivamente. En lo que se refiere a las concentraciones de oxígeno en el que se distribuye esta especie, Rivero-Beltrán (1975) la registra en valores de oxígeno de 5.2 ml/L, sin embargo, en este trabajo se observaron valores de 3.25 a 7.03. En el análisis de correspondencia canónica estos grupos 3 y 4, fueron correlacionados con las temperaturas más altas siendo F. hispida la dominante de estos dos grupos que es mencionada como una especie con alta tolerancia a temperaturas mayores (Álvarez-Cadena et al., 1996b; Ramírez-Ávila & Álvarez-Cadena, 1999). De los tres ambientes estudiados desde Puerto Morelos hasta Cancún, el ambiente lagunar costero fue el de mayor abundancia de quetognatos capturados y parasitados. En este ambiente se ubica al Sistema Lagunar Nichupté (SLN) y de acuerdo con Merino et al. (1990) este sistema se encuentra bajo un proceso de eutrofización (enriquecimiento por nutrientes orgánicos), ocasionado por el vertimiento de aguas residuales de la población en particular a la cuenca de Bojórquez. Álvarez-Cadena et al. (1996b) mencionaron que como resultado de estas 147 condiciones de eutrofización, existe una mayor producción de clorofila a y de biomasa planctónica siendo de hasta dos o tres veces más en el SLN que al norte y sur de este sistema. Ahora bien, en lo que se refiere al parasitismo en los grupos 1 y 2 se obtuvieron las prevalencias de parasitismo más altas y una riqueza de parásitos mayor, lo cuál puede coincidir en que F. enflata sea una de las especies de quetognatos en que más parásitos se hayan observado tanto en Quintana Roo (Gómez del Prado-Rosas et al., 1999b, 2000a, 2002, 2005 & 2007b) como a nivel mundial (Hutton, 1952 & 1954; Dollfus et al., 1954; Furnestin & Rebecq, 1966; Overstreet, 1969; Reimer et al., 1975; Pearre, 1976; Shimazu, 1978; Nagasawa & Marumo, 1979a & b; Santhakumari, 1992; Oresland & Bray, 2005). En estos dos grupos al ser una combinación de estaciones se observaron otras especies de quetognatos con abundancias bajas, las cuales ya habían sido registradas previamente para estos ambientes (Ramírez-Ávila & Álvarez-Cadena, 1999). La prevalencia de parasitismo en los grupos de F. hispida (3 y 4), fue muy diferente, esto se debe a la diferencia en la abundancia que hubo en los parásitos entre los grupos. En el grupo 3 los parásitos fueron dominados ampliamente por la presencia de quistes y en menor abundancia los hemiúridos. F. hispida es una especie que se ha registrado muy poco como hospedero de helmintos, en Quintana Roo solo se encuentra el trabajo de Gómez del Prado-Rosas et al. (1999b) y a nivel mundial, solo se ha registrado en el Golfo de México (Overstreet, 1969), posiblemente esto se deba a que F. hispida sea de tamaño pequeño (8 a 12 mm de longitud en organismos maduros) lo cual dificulta la observación de parásitos en comparación con especies más oceánicas que son de mayor tamaño como es el caso de F. enflata (18 a 25 mm de longitud en organismos maduros) (McLelland, 1989). En este trabajo F. hispida fue la especie que más abundancia de parásitos presento sin embargo, la mayoría fueron en formas de quiste o distomidos que no pudieron ser asignados a una familia de helminto, lo cual límita el conocimiento de esta especie de quetognato como hospedero intermediario. Moravec et al. (1995c), mencionaron que uno de los factores más importantes que determinan la presencia o ausencia de una especie de parásito en una cierta localidad, es la presencia de un 148 hospedero con una densidad de población alta y en el caso de F. hispida ha sido registrada como especie única y dominante en el SLN (Álvarez-Cadena et al., 1996a). En el grupo 4, se observan bajas abundancias de especies F. enflata, P. draco, S. serratodentata, Sagitta sp. y que acompañan a F. hispida, esta asociación ya había sido registrada en la Laguna de Puerto Morelos, (ambiente lagunar arrecifal), en donde Ramírez-Ávila & Álvarez-Cadena (1999) la mencionan como la más abundante seguida de F. enflata, justo como fue observado en este grupo. 9.- CONCLUSIONES 1.- Se encontraron 12 especies de quetognatos en el ciclo del 2004 y 2005, sin embargo, la presencia de Flaccisagitta hexaptera fue exclusiva del 2004 y Eukrohnia hamata solo se observó en el 2005. De todas las especies, solamente se encontraron parásitos en Pterosagitta draco, Ferosagitta hispida, Flaccisagitta enflata, Serratosagitta serratodentata y Sagitta sp. 2.- La abundancia de quetognatos capturados del 2004 y 2005 estuvo dominada por dos especies, Ferosagitta hispida en el ambiente lagunar costero y por Flaccisagitta enflata en los ambientes arrecifal nerítico y lagunar arrecifal. 3.- La prevalencia de parasitismo fue mayor en el 2004 que en el 2005. Ferosagitta hispida fue la especie de mayor prevalencia mientras que Serratosagitta serratodentata fue la de menor prevalencia de parasitismo en el 2004. Mientras que en el 2005, Flaccisagitta enflata fue la especie de mayor prevalencia y Sagitta sp. fue la de menor prevalencia de parasitismo. Por otra parte, la intensidad media de infección fue de un parásito por hospedero en cada una de las especies parasitadas de ambos años. 4.- La estación tres del ambiente lagunar costero fue la de mayor captura de organismos tanto del 2004 como del 2005 y las estación ocho del ambiente lagunar arrecifal fue la de menor captura de organismos en el 2004 y la estación dos del 149 ambiente arrecifal nerítico fue la de menor captura del 2005. Por otra parte, la prevalencia de parasitismo fue mayor en la estación cuatro del ambiente lagunar costero en el 2004 mientras que en el 2005 la mayor prevalencia se registro en la estación cinco también del ambiente lagunar costero. 5.- En el 2004, febrero fue el mes de mayor captura de quetognatos mientras que agosto fue el de menor número y en el 2005 la mayor captura de quetognatos se registró en marzo mientras que la menor fue de noviembre. Por otra parte, la prevalencia de parasitismo fue mayor en el mes de junio y la menor en agosto en el 2004 mientras que en el 2005, la prevalencia fue mayor en junio y la menor en el mes de octubre. 6.- Se encontró mayor número de parásitos en el 2005 que en el 2004, aunque en ambos años fue dominado por la presencia de quistes que no fueron asignados a ningún grupo taxonómico. De los dos años estudiados se presentaron los helmintos digéneos en fase metacercaria como los más diversos y abundantes de todos los grupos de platelmintos que se registraron. 7.- La presencia de monogéneos en fase larval de la familia Gyrodactylidae, así como las metacercarias de la familia Haemiuridae Hemiurus sp., Parahemiurus sp., Paralecithochirium sp., Opisthadena sp., Dinosoma sp., Opechonay pyriforme, las metacercarias de la familia Fellodistomidae Tergestia sp. Además de cinco formas diferentes de metacéstodos tipo Plerocercoide y el nematodo de Procamallanus (Spirocamallanus) sp. se deben considerar como nuevos registros en la fauna parasitaria de los quetognatos de Quintana Roo y Mar Caribe Mexicano. 8.- El análisis de agrupamiento con base en el índice de similitud de Sorensen determinó dos dendrogramas. En el dendrograma A se conformaron cuatro agrupaciones que se diferencian por la abundancia de Flaccisagitta enflata en los ambientes arrecifal nerítico y lagunar arrecifal, y por la abundancia de Ferrosagitta hispida en el ambiente lagunar costero. Por su parte, en el B se conformaron dos 150 grupos que se diferencian por la fauna parasitaria de Ferosagitta hispida y Flaccisagitta enflata. 9.- El análisis de correspondencia canónica (ACC) indicó que no hubo correlación entre las variables ambientales con la abundancia del parasitismo. Sin embargo en la revisión de cada una de las variables ambientales se observó correlación de las salinidades más altas con los grupos de Flaccisagitta enflata. Las temperaturas más altas se correlacionaron con los grupos de Ferosagitta hispida. Con el pH y la Prevalencia de parasitismo, la correlación fue con los grupos de F. enflata del ambiente lagunar arrecifal del 2005 y con F. hispida del ambiente lagunar costero. El oxígeno disuelto y la precipitación pluvial se relacionaron con el grupo de F. hispida en el ambiente lagunar costero del 2005. LITERATURA CITADA Almeida F. C., V. Barquete & J. Pereira Jr. 2009. Progenetic metacercariae of Parahemiurus merus (Platyhelminthes, Digenea, Hemiuridae) infecting Parasagitta friderici (Chaetognatha) from Southern coast Brazil. Atlantica, Rio Grande. 31 (1): 35-38. Álvarez-Cadena, J. N, M. E. Islas-Landeros & E. Suárez-Morales. 1996a. A preliminary zooplancton survey in a Mexican Caribbean eutrophic coastal lagoon. Bulletin of Marine Science. 58 (2): 694-708. Álvarez-Cadena, J. N., E. Suárez-Morales & Jerry A. McLelland. 1996b. Observations on an Isolated population of Sagitta hispida conant (Chaetognatha) in a tropical Lagoon system of Northeast yucatán (Mexico). Gulf Research Reports. 9 (3): 197-204. Álvarez-Cadena, J. N., U. Ordóñez-López., A. R. Almaral-Mendívil., M. Ornelas-Roa & U. A. Sabido. 2007a. Larvas de peces del litoral arrecifal del norte de Quintana Roo, Mar Caribe de México. Hidrobiológica. 17 (2): 139-150. Álvarez-Cadena, J. N., U. Ordóñez-López., D. Valdés-Lozano, A. R. Almaral-Mendívil & A. Ulicab-Sabido. 2007b. Estudio anual del zooplancton: composición, 151 abundancia, biomasa e hidrología del norte de Quintana Roo, mar Caribe de México. Revista Mexicana de Biodiversidad. 78: 421-430. Álvarez-Cadena, J. N., U. Ordóñez-López., A. R. Almaral-Mendivil & A. Uicab-Sabido. 2009. Composition and abundance of zooplankton groups from a coral reef lagoon in Puerto Morelos, Quintana Roo, Mexico, during an annual cycle. Revista de Biología Trópical. 57 (3): 647-658. Alvariño, A. 1964a. Bathymetric distribution of Chaetognaths. Pacific. Science. 18 (1): 64-82. Alvariño, A. 1965. Chaetognaths. In: Harold Barnes (ed.) Oceanography and Marine Biology: an annual review. 3: 115-195. Alves, D. R. & J. L. Luque. 2001. Community Ecology of the Metazoan Parasites of White Croacker, Micropogonias funieri (Osteichthyes: Sciaenidae), from the Coastal Zone of the State of Rio de Janeiro, Brazil. Memorias del Instituto Oswaldo Cruz, Rio de Janeiro. 96 (2): 145-153. Anderson, R. C. 2000. Nematode parasites of vertebrates. Their development and transmission. 2nd. Edition. CABI Publishing. New York, U.S. A. 650 pp. Bieri, R. 1991. Six new genera in the Chaetognath family Sagittidae. Gulf Research Reports. 8 (3): 221-225. Boltovskov, 1981. Bray, R. A., D. I. Gibson & A. Jones. 2008. Keys to the trematoda Volume 3. Cab International and Natural History Museum, London. 521 pp. Bunkley-Williams, L. & E. H. Williams, Jr. 1994. Parasites of Puerto Rican Freshwater Sport Fishes. Sport Fish Restoration. 1-164. Bush, A. O., K. D. Lafferty., J. M. Lotz & A. W. Shostak. 1997. Parasitology meets ecology on its own terms: Margolis et al. Journal of Parasitology. 83 (4): 575583. Casanova, J. P. 1999. Chaetognath. In: Boltovsky, D. (ed.). South Atlantic Zooplankton. Backhuys Publishers, Leiden. 1999. 2: 869-1706. Cezar, A. D. & J. L. Luque. 1999. Metazoan Parasites of the Atlantic Spadelfish Chaetodipterus faber (Teleostei: Ephippidae) from the Coastal Zone of the 152 State of Rio de Janeiro, Brazil. Journal of the Helminthological Society of Washington. 66 (1): 14-20. Chabaud, A. 1975. CIH Keys to the nematode parasites of vertebrates. Commonwealth Agricultural Bureaux. England. 27 pp. Comisión Nacional del Agua. 2004. http://siga.cna.gob.mx/basesdeDatos.aspx Comisión Nacional del Agua. 2005. http://siga.cna.gob.mx/basesdeDatos.aspx Crelier, A. M. & M. C. Daponte. 2004. Chaetognatha of the Brazil-Malvinas (Falkland) confluence: distribution and associations. Iheringia Ser. Zool. , Porto Alegre. 94 (4): 403-412. Daponte, M. C., A. A. Gil de Pertierra., M. A. Palmieri & M. Ostrowski de Nuñez. 2006. Parasites infections (Trematoda, Digenea) of Sagitta friderici (Chaetognatha) from the southwestern Atlantic Ocean: prevalence and distribution. Diseases of Aquatic Organisms. 71: 225-232. Daponte, M. C., A. A. Gil de Pertierra., M. A. Palmieri & M. Ostrowski de Nuñez. 2008. Monthly ocurrence of parasites of the chaetognath Sagitta friderici off Mar del Plata, Argentina. Journal of Plankton Research. 30 (5): 567-576. Dawes, B. 1958. Sagitta as a host of larval trematodes, including a new and unique type of cercaria. Nature. 182: 960-961. Dawes, B. 1959. On Cercaria owreae (Hutton, 1954) from Sagitta hexaptera (d`Orbigny) in the Caribbean Plankton. Journal of Helminthology. 33 (2 y 3): 209-222. Dollfus, R. Ph. 1960. Distomes des Chaetognathes. Bulletin de l`Institut des Pêches Maritimes du Maroc. 1-27. Dollfus, R. Ph., M. Anantaraman & V. Nair. 1954. Metacercaire d´Accacoeliidé chez Sagitta inflata Grassi et larve de Tétraphyllide. Annales de Parasitologie. 29 (5-6): 521-526. Elian, L. 1960. Observations systematiques et biologiques sur les chaetognaths qui se trovent dans les eaux roumaines de la mer noire. Section Hydrobiologique du Centre de Recherche Biologique de l`Académic R. P. R. Feigenbaum, D. L. & R. C. Maris. 1984. Feeding in the Chaetognatha. Oceanographic Marine Biological Annales Revist. 22: 343-392. 153 Field, J. G., K. R. Klarke & R. M. Warwick. 1982. A practical strategy for analysis multispecies distributions patterns. Marine Ecology Progress Series. 8: 37-52. Furnestin, M. L. & J. Rebecq. 1966. Sur l’ubiquité de Cercaria owreae (R. F. Hutton, 1954). Annales de Parasitologie. 41 (1): 61-70. García, E. 1964. Modificaciones al sistema de clasificación climática de Köppen, para adaptarlo a las condiciones particulares de la República Mexicana. Larios, México. 246 pp. Gasca-Serrano, R. & I. Castellanos. 1993. Zooplancton de la Bahía de Chetumal, mar Caribe, México. Revista de Biología Tropical. 41 (3): 619-625. Gasca-Serrano, R., E. Suárez-Morales & L. Vásquez-Yeomans. 1994. Estudio comparativo del zooplancton (biomasa y composición) en dos Bahías del mar Caribe Mexicano. Revista de Biología Tropical. 42 (3): 595-604. Gasca, R., J. N. Álvarez-Cadena & E. Suárez-Morales. 1996. Chaetognath assemblages in the Mexican Caribbean Sea (1991). Caribbean Marine Studies. 5: 41-50. Gibson, D. I., A. Jones & R. A. Bray. 2002. Keys to the trematoda Voume1. Cab International and Natural History Museum, London 521 pp. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena, L. Segura-Puertas & R. Lamothe-Argumedo. 1999a. First record of Torticaecum sp. (Trematoda: Didymozoidae) in the chaetognath Serratosagitta serratodentata (Krohn, 1853) from Caribbean waters. Journal of Plankton Research. 21 (5): 1005-1008. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena, L. Segura-Puertas & R. Lamothe-Argumedo. 1999b. New records, hosts, and SEM observations of Cercaria owreae (Hutton, 1954) from the Mexican Caribbean Sea. Journal of the Helminthological Society of Washington. 66 (2): 194-197. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena & L. Segura-Puertas. 2000a. Metacercaria quintanarrooensis sp. nov. (Trematoda: Accacoeliidae) en Flaccisagitta enflata (Grassi, 1881) del Mar Caribe Mexicano (31-32p). En: Estudios sobre plancton en México y el Caribe. E. Rios-Jara., E. JuárezCarillo., M. Pérez-Peña., E. López-Uriarte., E. G. Robles-Jarero., D. U. 154 Hernández-Becerril & M. Silva-Briano (eds.). Sociedad Mexicana de Planctología y Universidad de Guadalajara. 147 p. Gómez del Prado-Rosas, M. C., L. Segura-Puertas., J. N. Álvarez-Cadena & R. Lamothe-Argumedo. 2000b. Opechona pyriforme metacercaria (Trematoda: Lepocreadidae) in Eirene lactea (Cnidaria: Hydroidomedusae) from a reef lagon in the Mexican Caribbean Sea. Anales del Instituto de Biología. UNAM. Serie de Zoología. 7 (1): 1-6. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena, L. Segura-Puertas & R. Lamothe-Argumedo. 2002. An accacoeliid metacercaria parasitizing the arrow worm Flaccisagitta enflata (Grassi, 1881) from the Mexican Caribbean Sea. Comparative Parasitology. 69 (1): 108-111. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena, L. Segura-Puertas & R. Lamothe-Argumedo. 2005. Hemiurid metacercariae (Trematoda) in chaetognaths from the Mexican Caribbean Sea. Comparative Parasitology. 72 (2): 230-233. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena, R. Lamothe-Argumedo., U. Ordoñez-López & A. R. Almaral-Mendívil. 2007a. Larvas de peces parasitadas por metacercarias de Hemiuridae y Fellodistomidae (Trematoda) en la laguna arrecifal de Puerto Morelos, Quintana Roo, México. Hidrobiológica. 17 (3): 233-239. Gómez del Prado-Rosas, M. C., J. N. Álvarez-Cadena., L. Segura-Puertas & R. Lamothe-Argumedo. 2007b. Didymozoid trematode Monilicaecum type in chaetognaths from the Mexican Caribbean Sea. Revista Mexicana de Biodiversidad. 78: 483-487. González-López, A. 1989. Hidrología y nutrientes de la Laguna de Bojórquez. Tesis de Maestría. Instituto de Ciencias del Mar y Limnología. UNAM. México. 89 pp. Gutiérrez-Heredia, L. 2008. Helmintofauna en larvas de peces de la familia Gobiidae de La Laguna Bojórquez, Cancún, Quintana Roo, México. Tesis de Licenciatura. Universidad Autónoma de Baja California Sur, La Paz, B. C. S. México. 85p. 155 Hernández-Flores, R. M. 2003. Report on collection of chaetognaths from Banco Chinchorro, Mexican Caribbea Sea. Bulletin of Marine Science. 73 (1): 123131. Hutton, R. F. 1952. Schistosome cercariae as the probable cause of seabather`s eruption. Bulletin of Marine Science of the Gulf and Caribbean. 2: 346-359. Hutton, R. F. 1954. Metacercaria owreae n. sp., an unusual trematode larva from Florida current Chaetognaths. Bulletin of Marine Science of the Gulf and Caribbean. 4 (2): 104-109. Jairling, Ch. & H. Kapp. 1985. Infestation of Atlantic chaetognaths with helminth and ciliates. Diseases of aquatic organisms. 1: 23-28. Jones, A., R. A. Bray & D. I. Gibson. 2005. Keys to the Trematoda Volume 2. Cab International and Natural History Museum, London. 745 pp. Jordan, E. D. 1993. Atlas de los Arrecifes Coralinos del Caribe Mexicano. Instituto de Ciencias del Mar y Limnología. UNAM. CIQRO. México. 110 pp. Khalil, L. F., A. Jones & R. A. Bray. 1994. Keys to the cestode parasites of vertebrates. Cab International. 751 pp. King, K. R. 1979. The life history and vertical distribution of the Chaetognath, Sagitta elegans, in Dabbob Bay, Washington. J. Plankton Res., 1 (2): 153-167. Kulachkova, V. G. 1972. Helminths of Sagitta elegans Verrill from the White Sea. Parazitologiya. 6: 297-304. Lafferty, K. D. 1999. The Evolution of Trophic Transmission. Parasitology Today. 15 (3): 111-115. Lamothe-Argumedo, R. 1983. Introducción a la Biología de los Platelmintos. A. G. T. Editor, S. A. México. D.F. 143pp. Liang, T. H. 2002. Chaetognath seasonality and distribution at surface layers off Ubatuba, south Brazil bight coastal waters. Oceánides. 17 (2): 103-111. Longhurst, A. R. & D. Pauly. 1987. Ecology of tropical oceans. Academic Press. New York. 407pp. Lutschinger, S. 1993. The marine fauna of New Zealand: Chaetognatha (Arrow worms). Nat. Inst. W. Atm. Res. LTD. 61p. 156 Madhavi, R. 1968. A Didymozoid Metacercaria from the Copepod, Paracalanus aculeatus Giesbrecht, from Bay of Bengal. The Journal of Parasitology. 54 (3): 629. Mazzoni, H. E. 1986. Chaetognaths infested with larvae of Contracaecum sp. (Nematoda, Anisakidae) in the Argentine sea. Physis Sec A. 8 y 20 pp. McCune, B. & M. J. Mefford. 1999. Multivariate analysis of ecological data. PC-ORD, CD version 4.26 beta. MjM Software. Glanden Beach, Oregon, USA. 300p. McCune, B., J. Grace. & D. Urban. 2002. Analysis of ecological communities. MjM Software designs. Gleneden Beach, OR. McLelland, J. A. 1989. An illustrated key to the chaetognatha of the northern Gulf of Mexico with notes on their distribution. Gulf Research Reports. 8 (2): 145-172. McLelland, J. A. & H. M. Perry. 1989. Records of deep-water chaetognaths from the Northern Gulf of Mexico. Gulf Research Reports. 8 (2): 181-187. Medina R. M. D. 1979. Análisis sobre la distribución Horizontal de Organismos planctónicos en el sur del Golfo de California, con referencia especial al Phylum Chaetognatha. Tesis de Licenciatura. México, B.C.S. 76pp. Merino, I. M. 1986. Aspectos de la circulación costera superficial del Caribe Mexicano con base en observaciones utilizando tarjetas de deriva. Anales del Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México. 13 (2): 31-46. Merino, I. M. & L. Otero. 1991. Atlas ambiental costero de Puerto Morelos, Quintana Roo. Centro de Investigaciones de Quintana Roo (CIQRO), 80 pp. Merino, I. M., Czitrom, S., Jordán, E., Martín, E., Thomé, P. & Moreno, O. 1990. Hydrology and rain flushing of the Nichupte lagoonal system, Cancun, Mexico. Estuarine, Coastal and Shelf Science. 30: 223-227. Michel, H. B. 1984. Chaetognatha of the Caribbean Sea and adjacent areas. NOAA Technical Report NMFS. 15p. Michel, H. B. & M. Foyo. 1976. Caribbean zooplankton. I. Siphonophora, Heteropoda, Copepoda, Euphausiacea, Chaetognatha and Salpidae. Office of Naval Research, Dep. of Navy, U.S.A. 433-461. 157 Mille-Pegaza, S. & J. Carrillo-Laguna. 1999. Los quetognatos (Chaetognatha) del banco de Campeche en Abril-Mayo de 1986. Revista de Biología Trópical. 47: 1-2. Mille-Pegaza, S. & J. Carrillo-Laguna. 2000. Los quetognatos del Golfo de México en Abril-Mayo de 1986. Pp. 23-24. En: Estudios sobre plancton en México y el Caribe. E. Rios-Jara., E. Juárez-Carillo., M. Pérez-Peña., E. López-Uriarte., E. G. Robles-Jarero., D. U. Hernández-Becerril y M. Silva-Briano (eds.). Sociedad Mexicana de Planctología y Universidad de Guadalajara. 174p. Mille-Pegaza, S. & J. Carrillo-Laguna. 2003. Distribución y abundancia de los quetognatos de la Plataforma Tamaulipeca y océano adyacente en Abril de 1987. Hidrobiológica. 13 (3): 223-229. Morales-Hernández, M. Y. 2009. Estructura espacial de los tremátodos parásitos de la hidromedusa Clytia folleata (McCrady, 1859) en la zona costera del norte de Quintana Roo. Tesis de Maestría en Ciencias. Posgrado en Ciencias del Mar y Limnología. UNAM. México. 55p. Moravec, F., E. Mendoza-Franco, J. Vargas-Vázquez & Vivas-Rodríguez. 1995c. Studies on the development of Procamallanus (Spirocamallanus) rebecae (Nematodo: Camallanidae), a parasite of cichlid fishes in Mexico. Folia Parasitologica. 42: 281-292. Mostajo, E. L. 1978. Quetognatos del Mar Caribe y Golfo de México. Phycis. Buenos Aires. 38 (94): 47-57. Myers, B. J. 1956. An adult Hemiurus sp. (Trematoda) from Sagitta elegans Verril. The Canadian Journal of Zoology. 34: 206-207. Nagasawa, S. 1991. 8. Parasitism and Diseases in Chaetognaths. In: Bone Q., H. Kapp. And A. C. Pierrot-Bults. 1991. The Biology of Chaetognaths. Oxford Science Publications. U. S. A. 173pp. Nagasawa, S. & R. Marumo. 1979a. Identification of chaetognaths based on the morphological characteristics of hooks. La Mer (Bulletin de la Société francojapoinaise d´océanographie). 17 (49): 177-188. 158 Nagasawa, S. & R. Marumo. 1979b. Parasites of chaetognaths in Suruga Bay, Japan. La Mer (Bulletin de la Société franco-japonaise d´océanographie). 17 (3): 127136. Nagasawa, S. & T. Nemoto. 1984. X-diseases in the chaetognath Sagitta crassa. Helgolander Meeresuntersuchungen. 37: 139-148. Naranjo, P. C. 2000. Contribución al estudio de los quetognatos alrededor de las Islas Galápagos. Acta oceanográfica del Pacífico. 10 (1): 169-179. Oresland, V. 1986. Parasites of the chaetognath Sagitta setosa in the western English Channel. Marine Biology. 92: 87-91. Oresland, V. 1990. Feeding and Predation impact of the chaetognath Eukrohnia hamata in Gerlache Strait, Antartic Peninsula. Marine Ecology Progress series. 63: 201-209. Oresland, V. & R. A. Bray. 2005. Parasites and headless chaetognaths in the Indian Ocean. Marine Biology. 147: 725-734. Overstreet, R. M. 1969. Digenetic trematodes of marine teleost fishes from Biscayne bay, Florida. Tulane studies in Zoology and Botany. 15 (4): 119-175.Pearre, Jr. S. 1974. Ecological studies of three West-mediterranean Chaetognaths. Investigation Pesqueries. 38 (2): 325-369. Owre, H. B. 1960. Plankton of Florida current VI. The Chaetognath. Bulletin of Marine Science. 10: 255-322. Paraguassú, A. R., J. L. Luque & D. R. Alves. 2002. Comunity ecology of the metazoan parasites of red porgy, Pagrus pagrus (L., 1758) (Osteichthyes, Sparidae) from the caostal zone, state of Río de Janeiro, Brazil. Acta Scientiarum Maringá. 24 (2): 461-467. Pearre, Jr. S. 1974. Ecological studies of three west-mediterranean chaetognaths. Investigation Pesqueries. 38 (2): 325-369. Pearre, Jr. S. 1976. Gigantism and partial parasitism castration of Chaetognatha infected with larval trematodes. Journal of the Biological Association of United Kingdom. 56: 503-513. 159 Pearre, Jr. S. 1979. Niche Modification in Chaetognatha Infected with Larval Trematodes (Digenea). Internationale Revue Der Gesamten Hydrobiologie. 64 (2): 193-206. Pearre, S. Jr. 1991. Growth and reproduction. In: Bone, Q., H. Kapp. and A. C. Pierrot-Bults. 1991. The Biology of Chaetognaths. Oxford Science Publications. U.S.A. 173pp. Pierce, L. E. 1951. The Chaetognatha of the west coast of Florida. The Biological Bulletin. 100 (3): 206-228. Pierrot-Bults, A. C. 1990. Diseases of chaetognatha. 4: 425-437. In: Kinne, O. (ed.). Diseases of marine animals. Vol. III. Biologische Anstalt Helgoland. Germany. 482 pp. Pierrot-Bults, A. C. & V. R. Nair. 1991. Distribution patterns in Chaetognatha. In: Bone Q., H. Kapp. and A. C. Pierrot-Bults. The Biology of Chaetognaths. Oxford Science Publitactions. U. S. A. 173pp. Poulin, R. 2001. Interactions between species and the structure of helminth communities. Parasitology. 122: S3-S11. Poulin, R. & E. T. Valtonen. 2001. Interespecific associations among larval helminths in fish. International Journal for Parasitology. 31: 1589-1596. Ramírez-Ávila, Y. 1997. Contribución al estudio de los quetognatos pláncticos (Chaetognatha) en la laguna arrecifal de Puerto Morelos, Quintana Roo: composición y abundancia. Tesis de Licenciatura. UNAM. México, D.F. 44 pp. Ramírez-Ávila, Y. & J. N. Álvarez-Cadena. 1999. Chaetognath species composition from a coral reef lagoon in the Mexican Caribbean Sea. Revista de Biología Tropical. 47 (Supl. 1). 157-163. Reeve, M. R. 1970. The biology of Chaetognatha. 1. Quantitative aspects of growth and reproduction in Sagitta hispida. In: Steele, JH. (ed.). Marine Food Chains. Oliver and Boyd, Edinburg. 168-192p. http://books.google.com.mx/books?hl=es&lr=&id=Wn2gcNvYNrsC&oi=fnd&pg =PR5&dq=Marine+Food+Chains&ots=vDvLxSXSCl&sig=FRFXJqRqZI9zmxO Cn_8x7woVZ-s#v=twopage&q&f=false 160 Reeve, M. R. & M. A. Walter. 1972. Conditions of culture, food-size selection, and the effects of temperature and salinity on growth rate and generation time in Sagitta hispida Conant. Journal of Experimental Biology and Ecology. 9: 191200. Reimer, L. W., C. Gerger, B. Hener, H. Lainka, I. Rosenthal & L. Scharnweber. 1971. On the distribution of larval helminths in planktonic animals of the North Sea. Parazitologiya (Leningrand). 5: 542-550. Reimer, L. W., S. Hnatiuk & J. Rochner. 1975. Metacercarien in Planktieren des mittleren Atlantik. Hochschule Wissens “Liselotte chaftliche Herrmann” Zeitschrift Gustrow Aus der der Padagogischen Mathematisch - Naturwissenschaftlichen Fakultat. 2 (75): 239-258. Rivero-Beltran, C. 1975. Distribución de los quetognatos en la Bahía de Campeche. Mem. I. Simp. Lat. Ocean. Biol (México). 306-324. Rolbiecki, L. & W. Walkusz. 2005. Derogenes varicus (Muller, 1784) from chaetognaths (Chaetognatha) cauht in Kongsfjorden, west Spitsbergen. Oceanological and Hydrological Studies. 34 (4): 131-134. Ruíz-Rentería F., B. I. Van Tussenbrook & E. Jordan Dahlgren. 1998. Caribbean coral reef, seagrass and mangrove sites, Puerto Morelos, Quintana Roo, México. Productividad Marino Costera del Caribe, UNESCO, París. 57-66. http://www.unesco.org/csi/pub/papers/ruiz.htm Salgado-Maldonado, G. 1979. Procedimientos y técnicas generales empleados en los estudios helmintológicos. Laboratorio de Helmintología. Oficina de Sanidad, Nutrición y Genética. Dirección General de Acuacultura. Departamento de Pesca. México: 17-53. Santhakumari, V. 1992. Diseases of chaetognaths from the Arabian Sea. Journal Marine Biology Association India. 34 (1-2): 279-281. Schmidt, G. D. & L. S. Roberts. 1983. Fundamentos de Parasitología. Continental. México. 655 pp. Shimazu, T. 1978. Some helminth parasites of the chaetognatha from Suruga Bay, central Japan. Bulletin of the National Science Museum Tokyo. Ser. A. (Zoology). 4 (2): 105-116. 161 Stunkard, H. W. 1977. Studies on tetraphyllidean and tetrarhynchidean metacestodes from squids taken on the New England coast. Bulletin of Biology. 153: 387412. Suárez-Caabro, J. A. 1955. Quetognatos de los mares cubanos. Memorias de la Sociedad Cubana de Historia Natural. 22 (2): 125-180. Suárez-Morales, E. 1994a. Copépodos planctónicos de la Bahía de Chetumal, México (1990-1991). Caribb. J. Sci. 30 (3-4): 181-188. Suárez-Morales, E. 1994b. Comunidades zooplancticas en las lagunas costeras mexicanas. Pp247-268. En: De la Lanza-Espino, G. Y Casares (Eds). Lagunas costeras de México. Universidad Autonoma de Baja California Sur, México. Suárez-Morales, E. 1998. Quetognatos. Book 7: 163-167 in J. A. Xacur Maiza, ed. Enciclopedia de Quintana Roo. 1st ed. Edit. Verdehalago. México. 399p. Suárez-Morales, E. & R. Gasca-Serrano. 1990a. Variación dial del zooplancton asociado a praderas de Thalassia testudinium en una laguna arrecifal del Caribe Mexicano. Universidad y Ciencia. 7 (13): 57-64. Suárez-Morales, E. & R. Gasca-Serrano. 1990b. Notas sobre la comunidad zoopláncitca de la Bahía de la Ascensión, Quintana Roo, México. Universidad y Ciencia. 7 (14): 141-146. Suárez-Morales, E., R. M. Hernández & R. Gasca-Serrano. 1990. Quetognatos (Chaetognatha) de la Bahía de la Ascensión, Reserva de la Bahía de Sian Ka’an, Quintana Roo, México. In: D. Navarro & J. G. Robinson (eds.), Diversidad Biológica de la Reserva de la Biosfera de Sian Ka’an, Quintana Roo, México: (CIQRO/PSTC, Univ. Of Florida): 137-146. Ter Braak, Cajo J. F. 1986. Canonical Correspondence Analysis: a new eigenvector technique for multivariate direct gradient analysis. Ecology. 67 (5): 1167-1179. Tokioka, T. 1965. The taxonomic outline of Chaetognatha. Publ. Seto Mar. Biol. Lab. 12 (5): 335-357. Vega-Rodríguez, F. 1964. Sistemática y consideraciones sobre la distribución de Chaetognatha en Veracruz, Ver. México. Tesis Profesional. UNAM. México, D.F. 61p. 162 Yamaguti, S. 1959. Systema Helminthum. The cestodes of vertebrates. Vol. II. Interscience Publishers. New York, 1261 pp. Yamaguti, S. 1961. Systema Helminthum. The nematodes of vertebrates. Vol. III. Part. I. Interscience Publishers. New York, 1261 pp. Yamaguti, S. 1971. Synopsis of digenetic trematodes of vertebrates. Parts I, II. Keigaku Publishing, Tokyo, Japan. 1074 pp. Youngbluth, M. J. 1979. The variety and abundant zooplankton in the coastal waters of Puerto Rico. Northeast Gulf Science. 3 (1): 15-26. Youngbluth, M. J. 1980. Daily, seasonal and annual fluctuations among zooplankton populations in an unpolluted tropical embayment. East Coast of Marine Science. 10: 265-287. 163 11.- ANEXO I Phyllum Plathyhelminthes Gengebaur 1859 Clase Monogenea Familia Gyrodactylidae Clase Trematoda Rudolphi, 1808 Subclase Digenea Carus, 1863 Cercaria owreae Hutton, 1954 Superfamilia Hemiuroidea Loss, 1899 Familia Didymozoidae Poche, 1907 Larva tipo Monilicaecum Yamaguti, 1942 Familia Hemiuridae Looss, 1899 Subfamilia Hemiurinae Looss, 1899 Género Hemiurus Rudolphi, 1809 Género Parahemiurus Vaz et Pereira, 1930 Subfamilia Lecithochiriinae Luhe, 1901 † Género Lecithochirium Luhe, 1901 † Género Brachyphallus Odhner, 1905 Género Paralecithochirium Zhang, 1994 Subfamilia Opisthadeninae Yamagutí, 1970 Género Opisthadena Linton, 1910 Subfamilia Plerurinae Gibson & Bray, 1979 Género Dinosoma Manter, 1934 Familia Lepocreadiidae (Odhner, 1905) Nicoll, 1935 Subfamilia Lepocreadiinae Odhner, 1905 Opechona pyriforme Linton 1900 Familia Fellodistomidae Nicoll, 1909 Género Tergestia 164 Clase Cestoidea Subclase Cestoda Orden Tetraphyllidea Carus, 1863 Metacéstodo tipo Plerocercoide A Metacéstodo tipo Plerocercoide B Metacéstodo tipo Plerocercoide C Metacéstodo tipo Plerocercoide D Metacéstodo tipo Plerocercoide E Phyllum Nematoda Orden Spirurida Superfamilia Camallanoidea Familia Camallanidae Género Procamallanus Baylis, 1923 Subgénero Spirocamallanus Olsen, 1952 165
© Copyright 2026