MGA 0621. OSMOLALIDAD
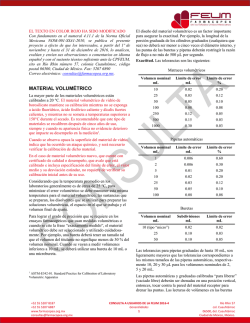
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de noviembre y hasta el 31 de diciembre de 2016, lo analicen, evalúen y envíen sus observaciones o comentarios en idioma español y con el sustento técnico suficiente ante la CPFEUM, sito en Río Rhin número 57, colonia Cuauhtémoc, código postal 06500, Ciudad de México. Fax: 5207 6890 Correo electrónico: [email protected]. 0.310 Osmol/kg (281 a 310 mOsmol/kg); y lo más parecido a esta es la osmolalidad exhibida por una solución al 0.9 % de cloruro de sodio (solución fisiológica) de 308 mOsmol/kg. Cuando se formula una forma farmacéutica para administración endovenosa u oftálmica, es muy importante homologar la osmolalidad de la solución para hacerla isotónica al plasma, y evitar con ello eventos de hemólisis o dolor. MGA 0621. OSMOLALIDAD Las unidades de concentración osmolar generalmente son expresadas en miliosmoles (mOsmol) de soluto por litro de solución. En términos generales, el peso de un Osmol es el peso molecular de una sustancia expresado en gramos, dividido entre el número de iones o especies químicas (n) que se forman en la solución. En las soluciones ideales, por ejemplo, n=1 para la glucosa, n=2 para cloruro de sodio o sulfato de magnesio, n=3 para cloruro de calcio y n=4 para citrato de sodio. La concentración osmótica ideal puede ser calculada empleando la siguiente fórmula: La osmolalidad es una forma de expresar la concentración de una solución, asociada a una de las propiedades coligativas de las soluciones, la presión osmótica. La presión osmótica es la fuerza motriz que tiende a equilibrar los niveles de disolvente entre dos soluciones de diferente concentración separadas por una membrana semipermeable (impermeable a los solutos y únicamente permeable al solvente, en el caso de sistemas biológicos dicho solvente es agua). La osmolaridad es una función de las partículas en solución; por tanto, las moléculas que al momento de disolverse se disocian (iones) contribuyen en mayor forma a la osmolalidad, comparadas con aquellas que no se disocian. Por ejemplo, 1 mol de NaCl al ser disuelto contribuye con 1 mol de Na+ + 1 mol de Cl-, 1 mol de MgCl2 aporta 1 mol de Mg2+ + 2 moles de Cl-, en tanto que un mol de glucosa en solución aporta exacta y únicamente 1 mol de soluto. Al ser la presión osmótica una función directa de los solutos en una solución, esta se puede calcular mediante la siguiente fórmula: Π = (ρRT/1 000)Σ υi mi φmi Donde: Π = Presión osmótica. ρ = Densidad del solvente a la temperatura T. T = Temperatura en escala absoluta. R = Constante universal de los gases. υi = Número de partículas formadas por la disociación de una molécula del i-ésimo soluto. mi = Molalidad del i-ésimo soluto. φmi = Coeficiente molal osmótico del i-ésimo soluto. Y el término que implica la sumatoria de los efectos de los solutos: Σ υi mi φmi es la Osmolalidad (ξ), la cual es expresada en Osmol/kg de solución, o usando una subunidad, los mOsmol/kg. La osmolalidad del plasma sanguíneo, está en función principalmente de la cantidad de cloruro de sodio, glucosa y proteínas (albúmina) disueltas, y oscila entre 0.281 a +52 55 5207 8187 +52 55 5207 6887 www.farmacopea.org.mx [email protected] No se debe confundir a la Osmolalidad, que es el único parámetro experimentalmente determinable, con la Osmolaridad, la cual es un cálculo teórico de la aportación a la presión osmótica de cada una de las especies en solución. Se elimina la siguiente fórmula: Concentración osmolar mOsmol / L Peso de la sustancia g/L Peso molecular g Número de 100 especies < Se adiciona la siguiente fórmula 𝐶𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖ó𝑛 𝑜𝑠𝑚𝑜𝑙𝑎𝑟 (𝑚𝑂𝑠𝑚𝑜𝑙 ⁄𝐿) 𝑃𝑒𝑠𝑜 𝑑𝑒 𝑙𝑎 𝑠𝑢𝑠𝑡𝑎𝑛𝑐𝑖𝑎 (𝑔⁄𝐿 ) 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 = ∑[ ( ) (100)] 𝑒𝑠𝑝𝑒𝑐𝑖𝑒𝑠 𝑃𝑒𝑠𝑜 𝑚𝑜𝑙𝑒𝑐𝑢𝑙𝑎𝑟 (𝑔) Al incrementarse la concentración de soluto, la interacción entre las partículas del mismo se aumenta también y los valores de osmolaridad real disminuyen con respecto a los valores ideales. La desviación de las condiciones ideales no es significativa cuando se trata de soluciones fisiológicas y para soluciones más diluidas aún, para soluciones altamente concentradas, los valores de osmolaridad real pueden ser significativamente más bajos que los valores ideales. Por ejemplo, la osmolaridad ideal de la solución inyectable de cloruro de sodio al 0.9 % es (9/58.4)(2)(1 000) = 308 mOsmol/L. La osmolaridad teórica de una mezcla compleja no puede ser fácilmente calculada. En tales casos, los valores reales de CONSULTA A USUARIOS DE LA FEUM 2016-4 Métodos generales de análisis 1 Río Rhin 57 col. Cuauhtémoc 06500, del. Cuauhtémoc Ciudad de México, México. concentración osmolal son utilizados para cumplir con los requerimientos establecidos en la monografía correspondiente y son determinados calculando la osmolaridal a partir de valores medidos de concentración osmolar y de contenido de agua. Métodos Por cada Osmol de soluto añadido a 1 kg de agua disminuye el punto de congelación (1.86 °C) y disminuye la presión de vapor (0.3 mm de mercurio a 25 °C). Estos cambios físicos pueden ser medidos y con ellos se pueden obtener valores exactos de la concentración osmolal. Marbete. En la monografía donde se requiera establecer el valor de osmolalidad del material, la etiqueta indica la concentración osmolal total en mOsmol/kg de solución. En los casos en los que la etiqueta indique que el producto debe ser diluido antes de usarse, la etiqueta también deberá indicar la concentración osmolal total. Cuando se emplean osmómetros que miden la depresión del punto de congelación, un volumen medido de la solución (generalmente 2 mL), es colocado en un tubo de vidrio y este es sumergido en un baño de temperatura controlada. Luego, un termopar y un vibrador son colocados dentro de la mezcla y la temperatura del baño es bajada hasta que la mezcla es superenfriada. Entonces, se activa el vibrador para inducir la cristalización del agua en la solución de prueba y el calor de fusión liberado eleva la temperatura de la mezcla hasta su punto de congelación. Por medio de un puente de Wheatstone, el punto de congelación registrado se convierte a una medida en términos de miliosmolalidad. Los osmómetros que miden la presión de vapor de las soluciones son empleados con menor frecuencia. Estos requieren un volumen menor de solución de prueba (generalmente 5 µL) pero la precisión y exactitud de las determinaciones de osmolalidad son comparables a las obtenidas con osmómetros que dependen de la medición del punto de congelación de las soluciones. Los instrumentos se calibran empleando dos soluciones de referencia de cloruro de sodio que cubran el rango esperado de osmolalidades. Tabla 0621.1. Soluciones de referencia para la calibración del osmómetro. Masa en gramos de Osmolalidad Osmolalidad Coeficiente Depresión cloruro de real ideal molal crioscópica sodio por (mOsmol/kg) (mOsmol/kg) osmótico (°C) kilogramo de agua 3.087 100 105.67 0.9463 0.186 6.260 200 214.20 0.9337 0.372 9.463 300 323.83 0.9264 0.558 12.684 400 434.07 0.9215 0.744 15.916 500 544.66 0.9180 0.930 19.147 600 655.24 0.9157 1.116 22.380 700 765.86 0.9140 1.302 +52 55 5207 8187 +52 55 5207 6887 www.farmacopea.org.mx [email protected] CONSULTA A USUARIOS DE LA FEUM 2016-4 Métodos generales de análisis 2 Río Rhin 57 col. Cuauhtémoc 06500, del. Cuauhtémoc Ciudad de México, México.
© Copyright 2026