crecimiento - Sobre todo personas con o sin discapacidad
CRECIMIENTO
DEL NIÑO
Fundamentos Fisiopatológicos
CRECIMIENTO
DEL NIÑO
Fundamentos Fisiopatológicos
DR. RAÚL CALZADA LEÓN
Endocrinólogo Pediatra
Jefe del Servicio de Endocrinología, Instituto Nacional de Pediatría
Secretario del Comité de Investigación, Instituto Nacional de Pediatría
Investigador Asociado "C", Institutos Nacionales de Salud
Miembro Titular de la Asociación Mexicana de Pediatría
Socio Titular de la Sociedad Mexicana de Nutrición y Endocrinología
Socio Titular de la Sociedad Latinoamericana de Endocrinología Pediátrica
Socio Titular de la Asociación Latinoamericana de Diabetes
Socio Titular de la International Society for Pediatric and Adolescent Diabetes
Socio Titular del Consejo Mexicano de Endocrinología
Coordinador del Grupo Nacional de Consenso en Endocrinología Pediátrica
Profesor del Curso de Especialización en Endocrinología Pediátrica, UNAM
McGraw-Hill Interamericana
HEALTHCARE GROUP
MÉXICO • AUCKLAND • BOGOTÁ • CARACAS • LISBOA • LONDRES • MADRID
MILÁN • MONTREAL • NUEVA DELHI • NUEVA YORK • SAN FRANCISCO
SAN JUAN • SINGAPUR • SIDNEY • TORONTO
NOTA
La medicina es una ciencia en constante desarrollo. Conforme surjan nuevos
conocimientos, se requerirán cambios de la terapéutica. El (los) autor(es) y los
editores se han esforzado para que los cuadros de dosificación medicamentosa
sean precisos y acordes con lo establecido en la fecha de publicación. Sin
embargo, ante los posibles errores humanos y cambios en la medicina, ni los
editores, ni cualquier otra persona que haya participado en la preparación de
la obra garantizan que la información contenida en ella sea precisa o completa,
tampoco son responsables de errores u omisiones, ni de los resultados que
con dicha información se obtengan. Convendría recurrir a otras fuentes de
datos, por ejemplo, y de manera particular, habrá que consultar la hoja
de información que se adjunta con cada medicamento para tener certeza de
que la información de esta obra es precisa y no se han introducido cambios en
la dosis recomendada o en las contraindicaciones para su administración. Esto
es de particular importancia con respecto a fármacos nuevos o de uso no
frecuente. También deberá consultarse a los laboratorios para información
sobre los valores normales.
CRECIMIENTO DEL NIÑO. FUNDAMENTOS FISIOPATOLOGICOS
Prohibida la reproducción total o parcial de esta obra, por cualquier medio,
sin autorización escrita de McGraw-Hill Interamericana Editores, S.A. de C.V.
DERECHOS RESERVADOS © 1998, respecto de la primera edición en español por
McGRAW-HILL INTERAMERICANA EDITORES, S.A. de C.V.,
una división de The McGraw-Hill Companies, Inc.
Cedro núm. 512, Col. Atlampa,
Delegación Cuauhtémoc, 06450 México, D.F.
Miembro de la Cámara Nacional de la Industria Editorial,
Reg. núm. 736
ISBN 970-10-1847-8
1234567890
Impreso en México
Esta obra se terminó de
imprimir en Agosto de 1998 en
Litográfica Ingramex
Centeno Núm. 162-1
Col. Granjas Esmeralda
Delegación Iztapalapa
09810 México, D.F.
Se tiraron 2,500 ejemplares
9076543218
Printed in México
Contenido
Prefacio.......................................................................................................................... vii
Agradecimientos............................................................................................................ ix
SECCIÓN I. BASES PARA EL ESTUDIO DEL CRECIMIENTO............................ 1
1. El crecimiento como fenómeno social...................................................................... 3
2.
3.
4.
5.
6.
7.
El crecimiento como fenómeno biológico................................................................. 8
Genética del crecimiento ........................................................................................ 12
Bases neuroendocrinas del crecimiento................................................................... 25
Factores que modifican el crecimiento ................................................................... 50
Energética del crecimiento ..................................................................................... 59
Cinemática del crecimiento .................................................................................... 69
SECCIÓN II. CONCEPTO INTEGRAL DEL CRECIMIENTO ............................. 91
8. Crecimiento prenatal............................................................................................... 93
9. Crecimiento posnatal ............................................................................................ 103
10. Estudio del paciente con talla baja ....................................................................... 118
SECCIÓN III. TALLA BAJA POR DIVERSOS TRASTORNOS.......................... 129
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
Retraso de crecimiento intrauterino...................................................................... 131
Displasias óseas .................................................................................................... 143
Talla baja familiar................................................................................................. 155
Retraso constitucional del crecimiento................................................................. 163
Retrasos del crecimiento de origen alimentario ....................................................177
Crecimiento en enfermedades renales................................................................... 191
Crecimiento en síndrome de Turner.......................................................................200
Deficiencia de hormona de crecimiento ................................................................208
Resistencia a la hormona del crecimiento .............................................................219
Detención del crecimiento por agentes terapéuticos ..............................................226
índice alfabético....................................................................................................233
V
Prefacio
El crecimiento es un proceso biológico dinámico,
común a todos los seres vivos, que se expresa de
acuerdo con las características genéticas de la especie y del individuo, y que requiere de una coordinación extraordinariamente compleja de distintas funciones relacionadas entre sí y ubicadas en
cada una de las células de los órganos, aparatos y
sistemas que nos conforman, con la finalidad de
utilizar los materiales plásticos y energéticos para
obtener un funcionamiento y tamaño óptimos.
El estudio de la expresión de este proceso es
indispensable en todos los seres humanos, pero es
particularmente útil en la etapa de la vida que va
desde la concepción, o por lo menos desde el nacimiento, hasta la adquisición plena de las funciones
biológicas y reproductivas, es decir, desde la infancia y niñez hasta el término de la pubertad y debe
de ser, por tanto, inherente a la práctica diaria del
médico general y del pediatra.
Cuando en el Instituto Nacional de Pediatría
se decidió a incorporar al programa de estudio de
la especialidad de pediatría, un módulo expresamente
diseñado para evaluar el crecimiento normal del
niño, así como del estudio de sus anomalías, se hizo
evidente que no existía obra compendiada alguna
en la que fuera posible estudiar de modo fácil y
accesible estos temas. De manera simultanearen
diversos centros hospitalarios y asociaciones médicas de México, a los cuales he sido invitado para
platicar e intercambiar experiencias acerca de diferentes aspectos del crecimiento y de sus alteraciones, se me ha cuestionado en relación con algún
texto en el que se pueda encontrar información
extensa y completa pero sencilla, factible de ser
utilizada tanto por el médico general como por el
especialista en pediatría.
Con base en lo anterior, tomé la decisión de
escribir esta obra, con el propósito de que sea po-
sible valorar un fenómeno que ocurre de manera
universal en todos los niños, y que analizado con
cuidado, permite establecer la existencia de un estado adecuado de salud, o bien de reconocer tempranamente sus alteraciones y estudiar al portador
con la finalidad de resolver un problema que condicionara riesgos para el desarrollo, además de una
talla final baja.
Desde mi punto de vista, un concepto básico
es que muchas enfermedades tienen un periodo
subclínico prolongado, durante el cual, si bien el
paciente se puede encontrar asintomático y asignológico en la revisión por aparatos y sistemas, es
evidente que existen modificaciones en el crecimiento que pueden detectarse con relativa facilidad. Por tal motivo el estudio del crecimiento permite aportar datos de gran utilidad para la evaluación de cualquier individuo, y llevarnos a concluir
que el diagnóstico de salud sólo se puede realizar
en ausencia de signos y síntomas anormales y en
tanto el crecimiento y el desarrollo psicomotriz se
realicen de acuerdo con situaciones referidas como
fisiológicas para su población.
Aun más, es probable que por medio del estudio de este fenómeno biológico podamos atrevernos
a señalar que el crecimiento de una población se
encuentra limitado por sus características sociobiológicas, y que los parámetros habitualmente utilizados para su estudio no señalan las características
óptimas de crecimiento, sino aquellas que aunque
se han expresado durante varias generaciones, representan una limitación biológica necesaria para
facilitar la supervivencia en tales condiciones.
No pretendo señalar en el presente texto la gran
diversidad de aspectos técnicos que conlleva el estudio fino de las alteraciones del crecimiento, sino
poner a la disposición del médico interesado, una
obra que facilite la comprensión de cómo se lleva a
vii
viii
Prefacio
cabo el crecimiento en condiciones fisiológicas, y
de la importancia que tiene su análisis en la práctica diaria de la medicina clínica, tanto para el paciente aparentemente sano, como para aquel que acude
a instituciones de primer nivel por presentar alteraciones que pueden repercutir en el crecimiento.
Cuando uno atiende pacientes que son enviados para determinar la causa de una talla baja, se
torna evidente que el diagnóstico se ha elaborado
por lo general de manera tardía, y que las enfermedades que se presentan incluso desde el nacimiento, no se han diagnosticado de manera oportuna.
Un porcentaje importante de estos niños no han sido
estudiados de forma sistemática y ordenada porque
se tiene el concepto equivocado de que se requiere
de pruebas de laboratorio y de gabinete costosas,
complicadas y de difícil realización, cuando en
realidad se necesita un equipo mínimo y accesible
a todo el personal de salud. Dicho equipo mínimo
consiste en una cinta métrica, gráficas de crecimiento poblacional y deseos de estudiar al niño.
Así entonces, en una primera parte, presento
las características fisiológicas y patológicas que producen o favorecen un crecimiento normal o que son
capaces de modificarlo, de acuerdo con la dinámica (factores determinantes genéticos y neuroendocrinos y factores modificadores), energética y cinemática del fenómeno del crecimiento.
En la segunda parte, se integran estos conceptos para describir las características del crecimiento prenatal y posnatal y, finalmente, se señala una
metodología sencilla y fácil de aplicar para el clínico en su quehacer diario en el estudio del sujeto
que presenta talla baja.
Finalmente, se describen las características de
las enfermedades que más frecuentemente se vinculan con un crecimiento limitado en nuestro medio.
Es importante señalar que aunque en la actualidad se está prestando mucha atención al estudio
de la regulación del crecimiento por la conexión
recíproca de los órganos involucrados en la acción
del sistema de la hormona del crecimiento (hipotálamo, hipófisis, glándulas endocrinas periféricas y
células blanco), la posibilidad de que éstos se encuentren primariamente afectados es pequeña, en
tanto que para la mayoría de los niños, la limitante
más importante para que se puedan expresar de
manera óptima sus características genéticas, es el
aporte deficiente de los materiales necesarios para
el crecimiento (nutrición). Si bien se dedican tres
capítulos a la descripción del control neuroendocrino del crecimiento y sus trastornos, el resto de la
obra señala alteraciones orgánicas frecuentemente
encontradas en los niños de la población de los
países en vías de desarrollo y que originan hipocrecimiento, así como las llamadas variantes fisiológicas del crecimiento.
Hay sin duda numerosas enfermedades que no
son tratadas en el libro, lo cual obedece a dos razones principales:
A. Muchas de tales enfermedades, si bien se vinculan con talla baja, no se diagnostican por esta
alteración, sino por la disfunción orgánica que
producen, y los signos y síntomas generados;
debido a ello sería irrelevante, desde el punto
de vista clínico, tratar de estudiarlas con base
en las alterac iones de crecimiento que causan,
y
B. Otros trastornos que cursan con hipocrecimiento requieren del concurso de especialistas y subespecialistas pediátricos para establecer su
diagnóstico etiológico, y dado que esta obra
está dirigida al médico general y al pediatra,
rebasaría los límites de lo diseñado si preten
diera describir con detalle todas las entidades
que cursan con talla baja
Debo señalar, en justicia, que la decisión de
escribir esta obra, la tomé consciente de mis limitaciones académicas al respecto, ya que no puedo
considerarme como un experto en el campo, y los
conceptos que vierto provienen de la enseñanza de
una gran cantidad de estudiosos e investigadores
con los que he tenido la fortuna de convivir y aprender, así como de la necesidad de poner en práctica
sus enseñanzas en el ejercicio diario de mi vida
profesional, tanto desde el punto de vista pediátrico
como endocrinológico, y si algún mérito tiene la
realización de este libro es sólo el tiempo y la dedicación usados para ello.
RAÚL CALZADA LEÓN
Agradecimientos
Como ya señalé, debo agradecer a una cantidad
innumerable de personas que me han permitido
aprender acerca de los temas que constituyen la
presente obra, así como a las circunstancias que se
dieron en mi persona, tiempo y espacio para emprender la tarea, y aunque es riesgoso olvidar a
alguno de ellos, me es necesario hacer constar mi
agradecimiento a los siguientes:
En primer lugar al doctor Guillermo Dávila
(qepd), quien me enseñó la importancia de estudiar
de manera integral a ese maravilloso ser que llamamos niño, y del que junto con sus padres, somos
responsables de llevarlo en condiciones adecuadas
hasta que logre un crecimiento y un desarrollo completos y lo más cercano a sus óptimos.
Al doctor Carlos Robles Valdés, maestro y aliciente constante en mi devenir por la endocrinología pediátrica, con quien inicié mis estudios sobre
las alteraciones del crecimiento.
A las doctoras Nelly Altamirano Bustamante,
Raffaela Schiavon Ermani, María de la Luz Ruiz
Reyes y al doctor César Jiménez, quienes me han
permitido compartir las actividades académicas,
asistenciales y de investigación que llevamos a cabo
en el Servicio de Endocrinología del Instituto Nacional de Pediatría.
A todos aquellos compañeros del Servicio de
Endocrinología con quienes he continuado el aprendizaje:
Dra. Aurora Ramírez Torres, Dra. Margarita
Barrientos Pérez, Dra. Judith Cornejo Barrera, Dr.
Daniel Llanas Rodríguez, Dr. Guillermo Paras
García, Dr. Armando Dávalos Ibáñez, Dr. Humberto
Franco Betancur, Dr. Ventura Armando Franco
Rodríguez, Dra. Eulalia Garrido Magaña, Dr. Juan
García Cruz, Dra. Maritza García Flores, Dra. María
Pía Martínez Gigena, Dr. Antonio Rafael González
Paz, Lic. en Antropología Alejandro Valderrama, y
Sra. Martha Trejo Santos.
A los estudiosos mexicanos que han descrito
las características y alteraciones del crecimiento
en nuestros niños, principalmente a los doctores
Rafael Ramos Galván, Joaquín Cravioto y Silvestre Frenk, así como a la doctora Johanna Faulhaber, a la Maestra en Ciencias Antropológicas Rosa
María Ramos Rodríguez y al doctor Salvador Villalpando.
A mi familia, Aurora, Pamela y Raúl, mucho
de cuyo tiempo fue utilizado para escribir el texto, y quienes me han permitido estudiar el crecimiento en sus bases genéticas más estrechas y directas.
ix
Capítulo
1
El crecimiento como
fenómeno social
El crecimiento es un proceso dinámico, cuya medición constante por breves intervalos de tiempo refleja el estado de desarrollo individual en los aspectos psicosocial, económico, nutricio, cultural,
ambiental y de homeostasis orgánica.
De ese modo, cuando un organismo crece sin
alguna limitación en sus condiciones intrínsecas y
ambientales, la expresión de su masa se determina
fundamentalmente por sus características genéticas;
en consecuencia, el fenotipo constituye un reflejo
fiel del genotipo. Sin embargo, mientras haya factores directos o indirectos que dañen al organismo
de manera transitoria o permanente, el grado de expresión del fenotipo será menor al esperado en condiciones óptimas de vida.
Así, el crecimiento óptimo es un derecho básico de todo ser humano, que debe vivir bajo condiciones que le permitan expresar toda su capacidad
genética de crecimiento y desarrollo, y por tanto:
Ningún niño cuyo crecimiento se encuentre
alterado, debe considerarse normal
La vigilancia del crecimiento, que permite
aumentar las herramientas clínicas para determinar
la normalidad o anormalidad del fenómeno, se realiza por medio de la somatometría: los resultados
se comparan con las percentilas* asignadas a cada
parámetro, y con base en la gráfica del crecimiento
es posible visualizar objetivamente el proceso dinámico del crecimiento y comprenderlo mejor, así
Nota del editor: el autor prefiere el término "porcentila(s)",
pero por preferencia editorial se utilizó percentila(s) en todo
el texto.
como generar demandas y acciones por parte del
equipo de salud, de la misma comunidad e incluso
de la familia.
Es importante que los prestadores de cuidados
y la población general manejen de manera sistemática los conceptos de crecimiento y desarrollo.
Mientras esto no suceda y el crecimiento no constituya un fenómeno comprensible para la comunidad, habrá limitaciones en su valoración, ya que el
número de solicitantes potenciales excede en demasía la capacidad de atención médica; a esto se
suma el hecho de que en la práctica sólo especialistas en pediatría realizan valoraciones sistemáticas.
En este sentido, la monitorización del crecimiento
por el equipo médico responsable de la salud del
niño, o incluso por sus padres y maestros, es una
estrategia operacional que permite:
1. Visualizar la presencia o ausencia de crecimiento mediante la medición regular y secuencial
de los niños.
2. Facilitar la detección oportuna del problema;
de esa manera se evita que factores modificadores negativos continúen lesionando al paciente y obliga a valorar el entorno en que se desarrolla el niño y su familia.
3. Proporcionar la atención relevante y específica en el momento adecuado a través del equipo de salud.
4. Identificar la necesidad de adecuar servicios
básicos para promover la salud, de acuerdo con
los requerimientos de la patología personal,
familiar o comunitaria que impida el mantenimiento de óptimos en la dirección, velocidad,
ritmo y momento del crecimiento:
3
4
Sección I • Bases para el estudio del crecimiento
La promoción de la salud implica la vigilancia del crecimiento como una de sus estrategias básicas
En México se han realizado pocos estudios
sobre el crecimiento, y como ninguno de ellos valora en conjunto a los pobladores de distintas regiones geográficas o socioeconómicas o ambas, se
carece de modelos nacionales de referencia; además, esas investigaciones requieren de revalidación
o modificación actual ya que se hicieron alrededor
del decenio de 1960. Pese a que esto no excluye la
posibilidad de su uso individual o complementario
por comparación con modelos internacionales de
referencia, es evidente que se necesita conocer las
características de crecimiento de la población, tanto para interpretar o adecuar esos estudios a los niños
nacionales como para analizar las condiciones económicas y geopolíticas presentes.
El estudio prospectivo del crecimiento de una
población no es de fácil realización; por ello, es
importante iniciarlo con un planteamiento correcto, con una hipótesis clara de trabajo, una planeación metodológica acorde con las necesidades y los
recursos existentes y con objetivos bien delimitados, ya que de otra manera existe un gran riesgo de
fracaso. La experiencia de estudios realizados en
otras épocas o en otros países condujo a la definición de las principales causas de falla en los programas para la monitorización y la promoción del
crecimiento. Esas fallas pueden resumirse en los siguientes puntos:
1. Falta de información a la comunidad sobre: las
metas que se persiguen, la importancia de valorar a la población menor de 18 años (e ideal
mente incluso a los adultos), el momento y
forma de realización del estudio y los resultados de éste. Cuando la población no colabora
de manera adecuada, es imposible vigilar el crecimiento de modo adecuado y confiable.
2. En la mayoría de los programas sólo se enfatizan las ventajas de descubrir alteraciones en el
crecimiento; esto da lugar a que en algunas poblaciones del país, con idiosincrasia especial,
se evite la valoración de muchos niños para que
no se les diagnostiquen enfermedades. En esas
regiones, en particular, es necesario crear conciencia sobre los beneficios de reconocer el de
sarrollo normal o anormal de un niño.
3. Muchas veces sólo se estudian algunos grupos
de edad, con frecuencia escolares.
4. Con la creencia de que constituye un indicador del estado nutricio del individuo, se ha enfatizado la importancia de conservar un "peso
5.
6.
7.
8.
9.
ideal para la edad", más que la importancia de
mantener una estatura adecuada para la edad y
un peso apropiado para la estatura. Las repercusiones de la alimentación sobre el peso son
indicadoras, en términos generales, de estados
agudos o subagudos; pero la estatura es un reflejo más fiel de carencias nutricias crónicas.
Existe la idea generalizada de que la ejecución
de esos programas es difícil y complicada, y
aunque en verdad no se puedan llevar a cabo a
corto plazo, estudios como el del doctor Jordán en Cuba prueban lo contrario.
Los estudios de vigilancia del crecimiento se
han utilizado como un instrumento aislado del
Plan Nacional de Salud, y es necesario integrarlos a acciones bien determinadas de promoción de la salud.
Se plantean mal las metas y se esperan resultados "fantásticos". Con seguridad, un estudio
actual demostrará que la población nacional ha
estado sujeta durante varios decenios a condiciones de vida "subóptimas", y aunque este hecho se conoce bastante bien, jamás se ha tratado de objetivar. No es fácil aceptar que la calidad de vida se haya modificado en sentido
negativo durante un régimen determinado.
Nunca se ha intentado que madres, padres y
líderes de la comunidad utilicen los indicadores de crecimiento para valorar a la población
infantil. En ese sentido, los estudios de vigilancia del crecimiento continuarán "inoperan
tes para la comunidad" mientras se piense que
la valoración del crecimiento es un "rito" exclusivo de algunos médicos y no una acción
necesaria en la familia, escuela y comunidad;
lo mismo sucederá mientras la población no
esté preparada para comprender la importancia de vigilar el crecimiento de los niños como
una tarea habitual y sea incapaz de efectuar una
"somatometría básica" (peso y estatura), de determinar la normalidad o no del crecimiento y
de acudir ante un equipo de salud que en presencia de enfermedad la resuelva favorable
mente. Entre tanto la población general no
"exija" valorar el crecimiento, con la conciencia de que éste es un fenómeno importante, se
carecerá de presión necesaria para que las autoridades de salud desarrollen las acciones pertinentes.
En la mayoría de los programas, y aunque se
identifiquen alteraciones del crecimiento, no se
diagnostican necesidades sociales, alimentarias, culturales ni sanitarias de la comunidad,
en muchas ocasiones, para no reconocer la incapacidad de resolverlas a corto plazo o con la
Capítulo 1 • El crecimiento como fenómeno social
idea de que la población no aceptará o colaborará con planes de salud a largo plazo.
10. No existe plan de estudio alguno para el paciente con alteraciones del crecimiento. Ante
la falta de comprensión de este fenómeno,
cuando se detecta una estatura menor a la esperada para la edad, se justifica con "ideas má
gicas" o se proporcionan tratamiento inadecuados, o ambos casos. Para ejemplificar lo anterior se pueden citar las siguientes expresiones:
"El niño es chaparrito porque así es él, y
no hay nada que se pueda hacer para remediarlo"
"Ya crecerá con el tiempo; hay que dejarlo"
"No se le pueden pedir peras al olmo"
(ambos padres tienen estatura baja y sus hijos tienen que ser "chaparros")
"No es fácil determinar la causa de la estatura baja; no malgaste recursos en ello"
"Hay que darle vitaminas para que
crezca"
"Lo único que se puede hacer es ponerlo a
hacer ejercicio y a que duerma más" Es
necesario que la población médica y paramédica conozca la existencia de planes de
análisis para los pacientes con estatura menor
a la esperada, que utilice los recursos a su alcance para determinar la causas de la alteración del crecimiento y, en su caso, remita a los
pacientes a un grado de atención más especializado y valore la conveniencia de "descubrir"
otros casos similares en el área.
11. Ausencia de acciones para modificar las condiciones de vida familiar, comunitaria, estatal
o nacional, por lo que persiste la influencia de
las condiciones supresoras del crecimiento.
12. Falta de retroalimentación que asegure que el
programa sea tanto normativo como operativo. La vigilancia y promoción del crecimiento
se tornan sólo inoperantes y costosas para el
Estado cuando el descubrimiento de una causa
de estatura baja, común a un porcentaje determinado de la población, no conduce al establecimiento de medidas para resolverla, al análisis de la repercusión de esas acciones sobre
el crecimiento y al informe oportuno y adecuado, así como a la generación de nuevos planes para neutralizar al otro factor supresor.
Lo anterior pone en evidencia que un factor
muy importante en la falla de los programas es la
decepción que surge en quienes pretenden diseñar
o realizar el estudio y en quienes son objeto del
estudio; esto se debe al sentimiento de que los re-
5
sultados carecerán de aplicaciones práctica y benéfica, a corto y a largo plazo, y de que en todo caso
sólo una cantidad reducida de "especialistas en crecimiento" se beneficiarán con ellos.
En México ya existen bases legales para poder
cimentar un estudio nacional de crecimiento y ellas
están contenidas en la "Norma técnica para el control de la nutrición, del crecimiento y del desarrollo del niño, en la atención primaria a la salud"
publicada originalmente en el Diario Oficial de la
Federación el 7 de julio de 1986, en las páginas
112 a 129.
La simplicidad y la eficacia de un programa de
promoción y vigilancia del crecimiento dependen
de:
1. La organización.
2. La interacción de médicos entre sí y con la co
munidad.
3. La sensibilización de la población y líderes de
la comunidad.
4. Aspectos prácticos de su realización.
5. Tiempo usado en su ejecución.
Algunas estrategias básicas que deben considerarse para fundamentar un programa de ese tipo
son las siguientes:
1. Analizar la situación actual del crecimiento por
medio de estudios semilongitudinales o en su
defecto transversales, y comparar los resultados con los publicados internacionalmente.
Además, antes debe iniciarse un programa co
munitario de sensibilización.
2. Diseñar planes para aplicación local, regional,
estatal y nacional, que permitan la creación de
programas que a su vez contengan metas bien
planeadas y conduzcan a resultados congruentes con la realidad mexicana.
3. Definir el costo efectivo del programa, sin perder de vista la realidad de sus requerimientos a
corto, mediano y largo plazo.
4. Mediante el programa, identificar alteraciones
y definir no sólo medidas correctivas transitorias, sino estrategias preventivas permanentes,
tanto médicas como políticas y administrativas.
5. Valorar los resultados obtenidos y definir así
los nuevos programas que sea necesario generar.
El crecimiento debe ser un fenómeno entendible para la comunidad
y esto sólo se logrará mediante
6
Sección I • Bases para el estudio del crecimiento
programas de información a la comunidad y
programas deformación de recursos médicos
en escuelas y hospitales
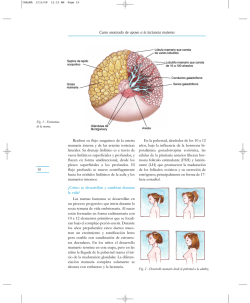
En la población mexicana, aunque la estatura baja se debe en gran medida a limitaciones nutricias por aporte bajo e inadecuado de nutrimentos en relación con las necesidades fisiológicas del
crecimiento, es frecuente observar agravantes relacionados, entre ellos infestaciones entérales que dificultan la digestión y absorción de nutrimentos e
infecciones de repetición que aumentan las demandas energéticas; esto ocurre porque las condiciones
higiénicas individuales son deficientes, lo cual en
buena parte está condicionado por un ámbito cultural bajo, en lo personal y en lo colectivo. Aunado
a lo anterior, es frecuente hallar condiciones afectivas y escolares inadecuadas en las comunidades
de estos individuos, que perpetúan las características desfavorables para el crecimiento y el desarrollo somático, intelectual y emocional de las nuevas
generaciones (fig. 1-1).
Los niños con deprivación nutricia no sólo
poseen estatura menor de la esperada, sino frecuente
modificación de las proporciones corporales y evidencias de una longitud del segmento inferior más
pequeña. Cuando además de la deficiencia de crecimiento existen periodos agudos de desnutrición,
la relación de peso para la estatura se modifica, y si
Fig. 1-1. Características economicoculturales y afectivoculturales que interactúan en las poblaciones.
coexisten infecciones o infestaciones se agregan
otras manifestaciones clínicas.
Es importante señalar que un individuo con
estatura inferior a la óptima debe considerarse deprivado, a pesar de que su talla sea similar a la de
otros individuos de su mismo sexo y edad en la comunidad. Lo anterior resalta el hecho de que en una
comunidad en la que el crecimiento está limitado
por aspectos biológicos y psicosociales, la estatura
baja no debe considerarse variante "fisiológica" del
crecimiento y, por tanto, equivalente a buen estado
de salud; por el contrario, esa población afectada
debe conceptuarse como "enferma crónica" y en
consecuencia sensible de tratamiento. Existen múltiples ejemplos de comunidades, sociedades e incluso poblaciones enteras de una nación que lograron aumentar el promedio de estatura de las
generaciones subsiguientes luego de mejorar los aspectos nutricios, higiénicos, culturales o afectivos; esto se denomina incremento secular del crecimiento. No obstante, también existen ejemplos de
comunidades que durante lapsos variables vieron
restringidas sus características, y cuyos integrantes
alcanzaron una estatura final inferior a la de generaciones previas.
En México es muy frecuente observar que la
estatura de los integrantes de comunidades rurales
tiende a ser menor que la de quienes viven en centros urbanos, o bien que la estatura muestra una
disminución geopolítica progresiva más acentuada
en el sur y sureste del país. Esto debe conducir a la
meditación y cuestionamiento sobre el estado de
salud de la población nacional, y aunque durante
muchas generaciones la comunidad mexicana se
ha caracterizado por falta de crecimiento óptimo
deben intentarse modificaciones en el patrón de
vida que, a corto plazo pero de manera permanente, se reflejen en condiciones más cercanas a las
óptimas.
Es necesario que la educación constituya un
factor de cambio y esto a su vez requiere modificar
el aporte de información. Desde el punto de vista
académico no debe considerarse bien educado al
individuo que sólo haya recibido información sistemática sobre las narraciones históricas de su pueblo, sino que debe fomentarse el análisis crítico de
la historia nacional y la capacitación oportuna para
comprender las necesidades indispensables de salud, entre ellas el diseño de una alimentación adecuada, viable para la región; de igual manera deben impulsarse las opciones relacionadas con el uso
de la tierra, el ambiente, los animales de consumo
y las alternativas de trabajo en cada comunidad con
el fin de desarrollar medidas urgentes de sanidad
ambiental en las áreas rural y suburbana.
Capítulo 1 • El crecimiento como fenómeno social
La declaración de la Organización Mundial de
la Salud, respecto de que el crecimiento óptimo es
un derecho de todos los niños, debe complementarse con otros axiomas que garanticen el crecimiento adecuado, por ejemplo:
1. La nutrición adecuada es un derecho de todos
los niños, ya que sin ella no puede darse un
crecimiento óptimo.
2. La higiene ambiental es una necesidad básica
de todos los niños, ya que sin ella es imposible
garantizar el aprovechamiento de los nutrimen
tos.
3. La educación óptima es una condición indispensable para todos los niños, ya que sólo así
se pueden establecer las medidas que garanti
cen el cambio de las características sociales,
ambientales y nutricias de la comunidad.
4. Todo niño posee el derecho de tener padres con
educación, condiciones ambientales y nutrición
óptimas y que, por tanto, muestren una estatura acorde con sus características genéticas, ya
que los adultos son los responsables de aportar
y mantener las características educativas, ambientales y nutricias de los niños.
LECTURAS RECOMENDADAS
Amigo H, Bustos P. Factores condicionantes de la estatura
en escolares de alta vulnerabilidad social. Santiago:
7
Departamento de Nutrición, Facultad de Medicina,
Universidad de Chile, 1994.
Burrows R, Leiva L, Muzzo S. Peso, talla y perímetro
craneano en escolares de la región metropolitana de
Chile de acuerdo al nivel socioeconómico. Rev Chil
Pediatr 1992;63:321.
Calzada RL. Talla baja nutricional. En: García VM, Pulido
A (eds). Humanismo y medicina, infancia y sociedad.
México: Instituto Nacional de la Nutrición/Academia
Mexicana de Pediatría, 1994:293.
Jordán JR. El crecimiento del niño. Barcelona: Jims, 1988.
MacCarthy D. The effects of emotional disturbances and
deprivation on somatic growth. En: Davis JA, Dobbing
J (eds). Scientific Foundation of Pediatrics. London:
William Heinemann Medical Books, 1974:56.
Muzzo S. Características actuales de la estatura del escolar
chileno. Rev Chil Pediatr 1990;18:69.
Neligan GA, Prudham D. Family factors affecting child
development. Arch Dis Child 1976;51:853.
Ramos RG. Efectos del ambiente sobre el crecimiento y
desarrollo físico. Bol Med Hosp Infant Mex 1970;27:
419.
Ramos RG. La somatometría en el diagnóstico del estado
de nutrición. Gaceta Med Mex 1976;111:321.
Unicef. The state of the world's children. New York: Ox
ford University Press, 1992.
Waterlow JC. Reflections on the stumting. Unicef/OMS,
1991.
Capítulo
2
El crecimiento como
fenómeno biológico
El cuerpo humano se compone de moléculas en
cambio constante, las cuales poseen un patrón característico de organización estructural y funcional cuyo
equilibrio depende de la relación entre la velocidad
de síntesis o producción y la velocidad de destrucción de la materia. En ese sentido, el crecimiento
puede definirse como el movimiento de la materia
viva que se desplaza en el tiempo y en el espacio.
Así, el crecimiento es sólo la manifestación de la
capacidad de síntesis de un organismo y de cada
una de sus células; a este fenómeno puede denominársele vida y, por tanto, es válido señalar que:
Vida = síntesis = crecimiento
Durante cada momento de la existencia, el
equilibrio entre la velocidad de síntesis y la velocidad de destrucción puede manifestarse por aumento, mantenimiento o disminución de la masa que
conforma al organismo en relación con el momento previo; esto se denomina signo del crecimiento,
y puede expresarse como positivo, neutro o negativo (fig. 2-1).
Sin embargo el crecimiento no es sólo un incremento uniforme de masa y volumen; también
contempla el cambio de forma y composición corporales, y puede incluir reemplazo de tejidos (eritropoyesis extramedular), sustitución de tejidos (cartílago por hueso) y alteraciones o modificaciones
de tejidos específicos para adquirir una nueva función (aparato reproductor).
El crecimiento inicial de diversos tejidos se
caracteriza por rápido aumento en el número de
células, con un aumento en la relación ácido desoxirribonucleico/proteínas, y una reducción con8
secuente de la cantidad de citoplasma formado en
cada célula, a lo cual también se le conoce como
hiperplasia.
Cuando el órgano alcanza el tamaño adecuado
para el momento biológico, el crecimiento consta
casi por completo de hipertrofia celular, con cambios mínimos en el número de células, lo cual también se identifica porque se altera (disminuye) la
proporción ácido desoxirribonucleico/proteínas del
tejido debido al aumento de proteína citoplásmica
sin que haya modificaciones en la cantidad de ácido desoxirribonucleico tisular. En la madurez se alcanza un punto de equilibrio y existen cantidades
casi iguales de ácido desoxirribonucleico y proteínas citoplásmicas.
La etapa de hiperplasia celular, con su rápido
aumento en el número de células, constituye un
periodo crítico de crecimiento porque durante ésta
el organismo es más sensible a sufrir daños permanentes, malformaciones o crecimiento anormal. La
duración del periodo de rápida división celular varía
de un tejido a otro y, como consecuencia, el intervalo de vulnerabilidad también cambia. Por ejemplo, a los seis meses de edad posnatal ya se observa
la existencia de la mayoría de las células que constituyen el sistema nervioso central; por ello, el periodo de mayor posibilidad de lesión neuronal por
factores que afecten su crecimiento ocurre en la vida
prenatal. En contraste, las células óseas continúan
su formación hasta los 15 a 20 años de edad, por lo
cual los factores que afectan negativamente su crecimiento pueden ejercer su acción antes del término de la pubertad.
Durante el principio del crecimiento se forman células que son totipotenciales y que poste-
Capítulo 2 · El crecimiento como fenómeno biológico
Fig. 2-1. Signo del crecimiento.
nórmente empiezan a diferenciarse; al mismo tiempo que pierden tal característica, esas células adquieren funciones especializadas que dan lugar a
tejidos funcionalmente distintos, entre ellos muscular, hematopoyético, reproductor, etc. Por lo general, la célula diferenciada posee nuevas funciones y al mismo tiempo pierde otras; pero entre más
se especializa es menos probable que conserve su
capacidad reproductora (neuronas, células neuroendocrinas, etc.).
La diferenciación celular implica por fuerza que
debido a la programación genética se adquiera la
capacidad de reaccionar a estímulos específicos, los
cuáles no afectan a otras células menos diferenciadas del mismo tejido o a células de otros tejidos
con funciones distintas. La respuesta celular a esos
estímulos específicos también es única para cada
tipo celular maduro (p. ej., producción de insulina
por las células beta del páncreas). Asimismo, aunque existe recambio constante de materia viva, el
modo y la velocidad de formación varía de un tipo
celular a otro. En ese sentido, los tejidos pueden
calificarse de manera general como:
1. Aquéllos con gran velocidad de recambio. Se
incluyen los tejidos en que las células se pierden o son removidas al realizar una función
determinada, pero mantienen una masa constante; por ejemplo, la epidermis, el epitelio intestinal, el endometrio, la médula ósea y los
precursores de espermatozoides. En este tipo
de tejidos, existe una reserva de células "madre" (generalmente totipotenciales o casi totipotenciales) que se preserva por medio de mul-
9
tiplicación celular y que, de acuerdo con las
necesidades corporales, produce un tipo de células muy diferenciadas en su función.
2. Tejidos con una velocidad de recambio media.
Este grupo incluye órganos como el hígado, el
riñon y las glándulas endocrinas, en los cuales
no existe una pérdida obligada de tejido durante la actividad funcional. El crecimiento de
este tipo de tejidos se debe a la división de células bien diferenciadas, y el recambio celular
es relativamente lento; pero el incremento, ya
sea por hipertrofia o por hiperplasia puede producirse en presencia de estímulos adecuados,
en especial durante la reparación del daño tisular.
3. Aquéllos en que el recambio prácticamente no
existe. Incluye tejidos muscular y nervioso, los
cuales durante las primeras etapas del crecimiento alcanzan casi por completo la hiperplasia celular y a partir de la adquisición de funciones diferenciadas sólo pueden crecer mediante hipertrofia; por esa razón, el número de
células que los constituyen permanece estable.
No obstante, esos tejidos conservan una baja
capacidad para regenerar partes dañadas o atróficas; el axón de un nervio se regenera cuando
la vaina celular se restaura o permanece intacta, pero una neurona destruida no puede reemplazarse.
De ese modo, el fenómeno del crecimiento
incluye tanto la relación entre síntesis y destrucción como la diferenciación de las distintas partes
del organismo para realizar funciones diversas. Por
ello es válido señalar que:
el análisis del fenómeno de crecimiento debe
considerar su signo y su diferenciación
SIGNO POSITIVO DEL CRECIMIENTO
Cuando la velocidad de síntesis es mayor que la de
destrucción, ya sea por la programación genética
del crecimiento o por el equilibrio entre ésta y el
ambiente, la masa aumenta con respecto al momento
previo.
Este signo es característico de los primeros años
de vida y se le observa desde la concepción hasta el
término de la pubertad bajo una regulación fisiológica controlada por las condiciones genotípicas de
cada individuo; sin embargo, también puede observársele durante la fase de recuperación de estados
patológicos, como la cicatrización y reparación tisulares, y en las mujeres durante la gestación, independientemente del crecimiento del producto intra-
10
Sección I • Bases para el estudio del crecimiento
uterino. Desde el punto de vista histológico, se manifiesta por aumento en el número de células que
componen un tejido (hiperplasia), incremento del
volumen celular secundario ante mayor cantidad de
citoplasma y organelos intracelulares (hipertrofia),
incremento de la cantidad de tejido intercelular
(acreción), o por la combinación de éstos (fig. 2-2).
Para que la velocidad de síntesis sea mayor que
la de destrucción se requiere de aportes calórico y
proteínico suficientes y balanceados, y de eficacia
metabólica adecuada para permitir un estado de
constante anabolismo.
Cuando el organismo se encuentra en fase de
recuperación necesita de ingestión alimentaria superior a la recomendada para otros individuos del
mismo sexo y edad, para así poder incrementar su
velocidad de síntesis y obtener la masa correspondiente a sus características biológicas óptimas.
Si bien es cierto que la mayoría de los estudios
sobre el crecimiento se realiza en niños, no debe
confundirse el crecimiento con su signo positivo
aunque los valores estándar más difundidos para
evaluarlo señalen los incrementos en la masa que
conforma somáticamente a uno o más de los integrantes de una población social, geográfica y política determinada.
SIGNO NEUTRO DEL CRECIMIENTO
Se debe a una velocidad de síntesis similar a la de
destrucción, en cuyo caso la masa corporal mantiene relativa constancia. Este signo es característico
en los adultos, pero puede presentarse de manera
patológica en la etapa pediátrica, como ajuste ante
la disminución del aporte nutricio o aumento en las
demandas energéticas, o ambas cosas. En este caso,
la estatura y el peso se mantienen sin cambios du-
Fig. 2-2. Crecimiento de un tejido o un órgano.
rante un lapso determinado; esto puede identificarse fácilmente como una situación patológica cuando se compara con el incremento esperado de estatura entre dos momentos distintos de observación
para la edad.
Es necesario enfatizar que en este signo no cesa
el crecimiento, ya que la síntesis continúa, y sólo
representa un estado de equilibrio en que se logra
sustituir el tejido que se destruye; por lo general se
preserva la función y se mantiene la homeostasis
orgánica. Sin embargo, a un niño cuyo signo cambia de positivo a neutro, en presencia de estados
patológicos, debe considerársele en situación precaria de equilibrio y con bastantes posibilidades de
pasar a un signo negativo de crecimiento.
SIGNO NEGATIVO DEL CRECIMIENTO
Se presenta cuando la velocidad de síntesis es menor que la de destrucción, ya sea por disminución
de la primera o por aumento de la segunda. En
condiciones fisiológicas, es característico de la senectud; sin embargo, en condiciones patológicas se
puede presentar en niños y adultos, como un ajuste
necesario para preservar la vida, aunque no necesariamente la homeostasis funcional.
Al igual que en el signo neutro, en el negativo
no se suspende la capacidad de sintetizar material
y, en consecuencia, el crecimiento continúa. Pero
la síntesis es insuficiente para reponer el tejido destruido, y por ello la masa corporal disminuye en
relación con el momento previo; esto se puede
manifestar por reducción de los tejidos graso, muscular u óseo, entre otros, a lo cual se suma la disminución o incluso la pérdida de funciones.
El signo negativo de crecimiento, cualquiera
que sea la causa que lo genere, no puede mantenerse por tiempo prolongado, ya que las disfunciones
orgánicas que lo acompañan son incompatibles con
la vida. Incluso durante la senectud, se presentan
episodios alternativos de signo negativo y signo neutro, y cuando hay predominio evidente y prolongado del primero, el individuo muere.
En los capítulos siguientes se expondrán conceptos relacionados con las fuerzas que determinan o modifican la adquisición y mantenimiento del
signo "fisiológico" del crecimiento en las diversas
etapas de la maduración, y se dividirán en:
1. Factores determinantes del crecimiento
A. Genéticos
B. Neuroendocrinos
2. Factores modificadores del crecimiento
A. Socioculturales
B. Orgánicos
Capítulo 2 · El crecimiento como fenómeno biológico
Con el fin de identificar de manera más adecuada y completa las interferencias sobre el crecimiento, y poder desarrollar acciones necesarias para
garantizar que éste se lleve a cabo en forma fisiológica, es necesario que el análisis del crecimiento
individual y comunitario considere la capacidad
óptima del organismo condicionada por los factores determinantes, así como el efecto lesivo, transitorio o permanente que puedan ejercer uno o más
de los factores modificadores.
LECTURAS RECOMENDADAS
Cole TJ. Do growth chart centiles need a face lift? Br Med
J 1994;308:641.
Comas J. Manual de antropología física. México: Instituto
de Investigaciones Históricas, UNAM, 1966.
Dubos R. El hombre en adaptación. México: Fondo de
Cultura Económica, 1975.
Garn SM, Rohmann CG. Interaction of nutrition and ge-
11
netics in the timing of growth and development. Pediatr
ClinNorthAm 1966;13:353.
Genovés TS. El supuesto aumento secular de la estatura a
partir de circa 01800 d.C. Anales de Antropología
1966;3:69.
Gómez F. Desnutrición. Bol Med Hosp Infant Mex 1946;3:
543.
Hill DJ, Han VKM. Cell and tissue growth. En: Gluckman
PD, Heymann MA (eds). Perinatal and pediatric pathophysiology. London: Hodder and Stoughton Limited,
1993:155.
Ramos RG. Homeorrhesis as a phenomenon of adaptation
to calorie protein deficiency. Ginebra: PAG/OMS/FAO/
Unicef, 1966.
Ramos RMR. Crecimiento y proporcionalidad corporal en
adolescentes mexicanas. México: UNAM, 1986.
Tanner JM. The regulation of human growth. Child Development 1963;34:817.
Voss LD, Wilkins TJ, Bailey BJR, Betts PR. The reliability
of height and height velocity in the assessment of growth
(The Wessex Growth Study). Arch Dis Child 1991;66:
833.
Capítulo
3
Genética del crecimiento
La generación de descendientes muy semejantes
entre sí depende de un fenómeno hereditario en
todos sus aspectos básicos. Aunque el ambiente
puede influir y modificar el resultado final del crecimiento, las principales características de éste,
como dirección, ritmo y velocidad, están predeterminadas desde el inicio de la existencia del individuo por los genes transmitidos por los padres. En
especial, la dirección y la velocidad del crecimiento y el desarrollo son representantes fieles del control genético al que está sometido el individuo en
condiciones fisiológicas, y en términos generales
se mantienen características semejantes para todos
los seres humanos como especie biológica.
Aunque las características de ritmo y estatura
final del crecimiento presentan variaciones entre
diversos grupos étnicos, esto parece deberse, en la
mayoría de los casos, a modificaciones del medio
en el que viven, ya que para gemelos univitelinos
el coeficiente de correlación para la estatura final
es de 0.95 (8 cm como máximo, 0 ± 4 cm sobre la
media), siempre y cuando ambos vivan en el mismo estado de salud y nutrición.
En condiciones de vida inadecuadas, ocurren
adaptaciones biológicas para asegurar la supervivencia del organismo, y entonces se modifica el
ritmo, la velocidad y el momento, tanto del crecimiento como del desarrollo, e incluso se afecta la
proporcionalidad y la estatura final del individuo;
este fenómeno se conoce como homeorresis. Esa
capacidad de adaptación puede explicar las diferencias de tamaño y proporcionalidad, así como el
término de la maduración somática en distintos individuos de la misma comunidad y aun de la misma familia.
De esa manera, es posible señalar que los padres heredan a los hijos la capacidad de crecimiento adecuado y de tamaño final (genotipo); asimis12
mo, en condiciones ideales, estas características son
similares en todos los hijos del mismo sexo (fenotipo), pero su expresión final (epigenotipo) depende de las condiciones orgánicas, nutricias y ambientales en que se desarrolla cada individuo en particular. En otras palabras, el hecho de que el ritmo y
la velocidad de crecimiento sean menores a los esperados y que, por tanto, la longitud alcanzada para
la edad sea inferior en comparación con las características familiares, debe alertar sobre la existencia de condiciones patológicas que limitan la expresión fenotípica del genoma (fig. 3-1).
Por otro lado, se debe estar consciente de que
al analizar la tendencia familiar de estatura final, se
considera la estatura epigenotípica final de los
padres, y no su capacidad genotípica de crecimiento; en consecuencia, si los hijos crecen en condiciones mejores que las de los padres es frecuente
encontrar estaturas finales superiores a las esperadas. Esto se denomina incremento secular del crecimiento cuando se manifiesta en una población o
grupo socioeconómico determinado; el fenómeno
contrario se conoce como decremento secular del
crecimiento y se observa cuando las condiciones
en las que crecen los individuos son subóptimas en
relación con las que vivieron sus padres.
Así por ejemplo, en algunas poblaciones, cuyas características ambientales y nutricias han cambiado de manera relativamente rápida, ha sido posible establecer diferencias significativas en la estatura. Este es el caso de los japoneses, que a lo
largo de tres generaciones a partir de la industrialización de Japón han aumentado su estatura en 18
cm; esto también ocurrió en aquellos japoneses que
emigraron a Hawai y a Estados Unidos.
En Polonia, la generación que durante la Segunda Guerra Mundial se hallaba en etapa de crecimiento disminuyó en 22 cm su estatura final con
Capítulo 3 • Genética del crecimiento
13
Para determinar la estatura máxima esperada
en hijos de una misma pareja, siempre y cuando no
cambien las condiciones nutricias y ambientales,
se recomienda utilizar el método descrito por Molinari, que también se basa en el cálculo de la estatura media familiar:
Para hijos varones:
talla media familiar X 0.718 + 57.6 cm
Para hijas mujeres:
talla media familiar X 0.718 + 44.6 cm
A continuación se mencionan dos ejemplos
al respecto en los que se consideran las estaturas
de dos generaciones previas a las del niño en estudio.
Ejemplo 1
Fig. 3-1. Relación entre las características genéticas y la expresión somática final de un organismo.
respecto a la de sus padres; pero en dos generaciones a partir de la posguerra se recuperó la estatura
media poblacional.
Por lo anterior, resulta importante determinar
la estatura final mínima esperada para un niño, y
con base en ésta calcular su estatura a distintas
edades, ya que el cálculo de la talla familiar reduce
en 33% la dispersión de los valores poblacionales,
sobre todo en niños mayores de seis años de edad
cronológica.
Existen diversos métodos matemáticos de complejidad variable para determinar la estatura mínima esperada de un niño, de acuerdo con las estaturas de sus padres; pero, por su sencillez y
aproximación, se recomienda utilizar el método de
Tanner para calcular el potencial genético de crecimiento. Este método se basa en la talla media
familiar (TMF) o promedio de estatura de los padres:
Para hijos varones:
talla media familiar + 6.5 cm
Para hijas mujeres:
talla media familiar — 6.5 cm
En opinión personal, es posible aceptar como
normales las variaciones de hasta ± 4 cm, si bien
otros autores señalan como fisiológicas variaciones de hasta ± 8 a 13 centímetros.
Valoración del crecimiento de un niño de siete años
10 meses de edad, con 120 cm de estatura.
El padre mide 168 cm y la madre 155. En la
rama paterna, el abuelo mide 165 cm; la abuela,
148 cm; los tíos, 172 y 167 cm; y las tías, 160 y
161 cm, respectivamente. En la rama materna, el
abuelo mide 170 cm; la abuela, 158 cm; los tíos,
170 y 172 cm; y las tías, 150 y 161 cm, respectivamente.
De acuerdo con la fórmula de Tanner, la estatura final media esperada para este niño es de 168
cm (164 a 172 cm); esto significa que su estatura
final corresponde a 1 cm por debajo de la percentila 10, por lo que a los siete años con 10 meses de
edad debería medir 119 cm, es decir, su estatura
actual es adecuada para las estaturas de los padres
(fig. 3-2).
Ahora bien, de acuerdo con las estaturas de los
abuelos paternos, el padre y sus hermanos debieron haber alcanzado 163 cm como estatura final, y
las tías 150 cm; pero es evidente que todos fueron
más altos de lo esperado, lo cual pudiera significar
que el incremento secular observado en esta familia se debió a mejor expresión del genotipo, por una
menor acción o menor cantidad de factores modificadores negativos sobre el crecimiento.
La estatura final esperada para la madre y las
tías maternas es 157.5 cm, y para los tíos, 170.5
centímetros. Tanto la madre como sus hermanos
varones y una hermana se situaron en el intervalo
esperado, pero la tía que mide 150 cm está 7.5 cm
por debajo de la media y 3.5 cm por debajo del
límite inferior considerado como fisiológico; esto
podría significar que ella, al contrario de sus hermanos, durante la etapa de crecimiento sí estuvo
14
Sección I • Bases para el estudio del crecimiento
Fig. 3-2. Representación del Ejemplo 1. Diferencias entre la estatura de un paciente y la talla media familiar (x).
expuesta a factores modificadores negativos que limitaron su crecimiento, o bien que su organismo
fue más sensible que el de sus hermanos a condiciones inadecuadas de vida.
A continuación, debe calcularse la estatura final esperada para el niño, tomando en cuenta la
mayor estatura entre la expresada por el padre y la
madre, y la que éstos debieron haber alcanzado. En
el caso del padre, se considera su estatura actual
(ya que los 163 cm de estatura esperada se encuentran por debajo de su estatura real), en tanto que
para la madre debe considerarse 157.5 cm de estatura, que refleja una mejor talla final genética. Así
entonces, se recalcula la estatura final esperada para
este niño con 168 cm del padre y 157.5 cm de la
madre; ello da un resultado final de 169.2 cm que
corresponde a la percentila 10, por lo que a los siete años 10 meses de edad se esperaría una estatura
de 120.5 centímetros.
Entonces es posible concluir que la estatura que
expresa el niño para su edad corresponde a la deseada de acuerdo con las características genotípicas y fenotípicas de ambas ramas familiares, y que,
por tanto, no parece existir alteración en la expresión del crecimiento hasta este momento.
Ejemplo 2
Valoración de una niña de 13 años de edad con
estatura de 149 cm, considerada baja. Si con base
en las gráficas poblacionales sólo se toma en cuenta
la estatura para la edad, se podría concluir que la
niña se encuentra 2 cm por arriba de la percentila
cinco, y que, por tanto, su estatura se sitúa en los
límites habituales de estatura para la población
general (fig. 3-3).
No obstante lo anterior, el análisis familiar al
respecto evidencia que la niña tiene una pérdida
significativa de estatura.
En la rama paterna: el padre mide 192 cm; el
abuelo, 188 cm; la abuela, 181 cm; los tíos 191,
190 y 188 cm; y las tías, 178 y 182 centímetros. La
estatura esperada para el padre y sus hermanos es
de 191 cm, y de las hermanas de 178 centímetros.
En esta familia todos los miembros alcanzaron una
estatura adecuada, y la del padre (192 cm) puede
considerarse óptima.
En la rama materna: la madre mide 178 cm; el
abuelo, 180 cm; la abuela, 170 cm; los tíos, 187 y
190 cm; y las tías 176 y 179 centímetros. Puesto
que la estatura final esperada para los varones es de
Capítulo 3 • Genética del crecimiento
15
Fig. 3-3. Representación del Ejemplo 2. Diferencias entre la estatura de un paciente y la talla media familiar (+).
181.5 cm y para las mujeres de 168.5 cm, es evidente que todos lograron superarla, lo cual indica
que los abuelos no expresaron adecuadamente su
capacidad óptima de crecimiento y, por tanto, para
fines de cálculo se considerarán los 178 cm que
mide la madre.
La estatura final esperada para la niña es de
178.5 cm y corresponde a 4.5 cm arriba de la percentila 97 poblacional, por lo que a los 13 años se
esperaría una estatura de 174.5 cm; ello marca un
déficit de estatura de 29.5 cm, lo cual debe considerarse un crecimiento bastante anormal. Asimismo, la niña debe recibir tratamiento como
portadora de un trastorno grave del crecimiento,
aunque para la distribución percentilar de la estatura poblacional se sitúe dentro de los límites habituales.
REGULACIÓN GENÉTICA
DEL CRECIMIENTO
Un organismo debe mantener un equilibrio entre
sus líneas de producción por una parte, y el abastecimiento y consumo de energías y materias primas
por la otra, es decir, entre el anabolismo y el catabolismo; debe existir un equilibrio entre la replicación del material genético (ácidos nucleicos) y las
proteínas generadas por medio de éste, de acuerdo
con la necesidad de preservar la expresión de sustancias orgánicas que regulen la estructura y la función.
La síntesis de novo de un compuesto funcional
es la meta final de la regulación genética. Esa sustancia incluye: moléculas importantes para mantener la estructura celular (membrana y citosqueleto); enzimas encargadas del metabolismo energético y de la formación de compuestos funcionales
(proteínicos y esteroideos), así como moléculas reguladoras de la homeostasis acidobásica, hidroelectrolítica, osmolar y térmica.
La vida debe mantenerse a través de la formación de macromoléculas, ya que de otra manera
habría un aumento no compensado de la entropía
que determinaría su desaparición. La reproducción
celular garantiza entonces que el ciclo entrópico se
repita de manera constante y regular. Cuando la
generación de energía se altera por falta de abasto
de materia prima, o por uso defectuoso de ésta, los
ciclos reproductivos celulares cesan hasta que se
restablece el equilibrio energético. Se presentan condiciones similares a éstas cuando se produce una
descompensación en la entropía por exceso de destrucción de materia estructural o de regulación del
metabolismo, o ambas cosas.
16
Sección I • Bases para el estudio del crecimiento
Lo anterior explica por qué un individuo que
debería mantener un signo positivo de crecimiento
puede disminuir la intensidad de éste o frenarlo de
manera transitoria para expresar un signo neutro de
crecimiento o incluso un signo negativo, siempre
con la finalidad de poder mantener la función y preservar la vida.
La regulación genética significa entonces la
existencia de sistemas cibernéticos de genes relacionados entre sí, de modo que la generación de
una proteína y la regulación de su producto metabólico mantengan el orden y el equilibrio de cada
una de las reacciones metabólicas.
Una de las principales características del crecimiento es que cada clona celular muestra ritmo y
velocidad de crecimiento determinados, y presenta
etapas precedentes de diferenciación y especialización distintas en esencia a las de otras clonas celulares, por lo que parece obvio que los genes que
controlan el crecimiento, desarrollo y proliferación
poseen expresión temporal y organospecífica. En
otras palabras:
Para cada estadio de crecimiento y diferenciación celular, un número determinado de genes
se encuentra activo en transcripción, y otro número en reposo o inactivo
Si se toma en cuenta que, con excepción de las
células constituyentes del sistema inmunitario, todas las células del organismo contienen la misma
información genética (es decir, que el ácido desoxirribonucleico es exactamente el mismo en ellas,
y que, por tanto, todas son potencialmente capaces
de elaborar cualquier sustancia necesaria para la
vida), resulta evidente que en cada clona celular y
aun en cada célula en particular se expresan de
manera funcional sólo algunas de las características genéticas, ya sea en forma temporal o permanente durante la vida. Por ejemplo, en neuronas,
células endocrinas del páncreas y germinales del
ovario, la expresión de los genes que inducen crecimiento se produce temporalmente durante la etapa temprana del desarrollo, y después se bloquea
durante el resto de la vida de la clona, mientras que
la expresión de los genes que producen diferenciación y especialización se genera en etapas posteriores a las de crecimiento. Con seguridad, los genes que inducen crecimiento celular, y que en ambos sexos parecen integrar, por lo menos de modo
parcial, el brazo corto del cromosoma X, son semejantes en los tres tipos celulares, pero aquellos
que inducen diferenciación son distintos.
Se estima que cada célula somática haploide
contiene alrededor de 100 000 genes idénticos para
todos los tipos celulares, pero de modo funcional
sólo expresa un porcentaje de ellos. Por ejemplo,
los hepatocitos expresan sólo 10 a 30% de su material genético, en tanto que algunas neuronas pueden expresar entre 50 y 75 por ciento.
Si bien existen genes que por lo general se
expresan en todos los tipos celulares (mantenimiento de la membrana y del citosqueleto, producción
de energía y otras funciones celulares básicas para
la supervivencia), otros sólo lo hacen en determinados fenotipos celulares. Entonces, aunque en la
actualidad se desconozcan muchos de los mecanismos intrínsecos de la fisiología genética, es innegable que la especialización tisular es un sistema
complicado de regulación específica, que para cada
célula en particular organiza la expresión temporal
o definitiva de varios de los distintos genes, y que
no sólo varía de un tejido a otro, sino que muestra
diferentes etapas de organización.
Pese a que en este capítulo no se pretende detallar la complejidad en la regulación de la expresión genética celular, vale la pena enfatizar algunos aspectos básicos relacionados con ésta.
El ácido desoxirribonucleico contiene la unidad básica de la información genética y está integrado a proteínas nucleares específicas de características básicas (histonas) y acidas (no histonas),
las cuales recubren longitudes variables del material genético y permiten o no su copia para generar
ácido ribonucleico (RNA), y en consecuencia regulan la capacidad de expresión de este fragmento
para cada tipo celular y para un momento determinado.
En algunos sistemas celulares se ha demostrado que la unión de la hormona con el receptor citoplásmico (en especial para hormonas esteroideas)
depende de que una nucleoproteína acida modifique su unión con el ácido desoxirribonucleico y
permita así la expresión de un segmento específico
de la información genética, con lo cual se genere
un ácido ribonucleico mensajero que induzca las
síntesis de una proteína metabólicamente funcional y de otro receptor citoplásmico.
Entonces se requieren dos tipos de regulación
de la expresión genética:
1. El dependiente de las nucleoproteínas acidas,
que permiten o no que una porción de ácido
desoxirribonucleico sea sensible de expresarse funcionalmente (ácido desoxirribonucleico
descubierto), y que en parte tiene relación con
las características iónicas y acidobásicas que
existen dentro del compartimiento intranuclear,
las cuales pueden modificarse a su vez por receptores de la membrana nuclear.
Capítulo 3 • Genética del crecimiento
2. El dependiente de la activación del genoma,
una vez que las nucleoproteínas aislantes han
sido removidas (transcripción), y cuyo funcionamiento ha tratado de explicarse con base en
la teoría de Jacob y Monod, conocida como
"Teoría del operan" y modificada en 1969 por
Britten y Davidson para explicar la regulación
genética aplicable a organismos superiores con
procesos complejos de regulación enzimática
múltiple.
Generación de ácido desoxirribonucleico
descubierto
Aunque la configuración de doble hélice alfa en que
está contenida la secuencia de bases púricas y pirimídicas constituye el fundamento anatómico del
genoma, la regulación de su expresión depende de
la serie de plegamientos que se llevan a cabo con
las histonas como ejes y que permite la constitución de nucleosomas (fig. 3-4).
1. Nucleosomas. La doble hélice alfa gira alrededor de un centro constituido por cuatro pares de histonas (H-2A, H-2B, H-3 y H-4), de
manera que cada 140 a 160 pares de bases y
las ocho histonas conforman una estructura funcional y anatómica cuya función principal es
reprimir la capacidad de expresión genómica
(figs. 3-4 y 3-5).
Es en el nucleosoma donde los factores de
transcripción se unen para iniciar la activación
de la expresión del genoma y, por tanto, esta
conformación puede considerarse la unidad básica funcional de la expresión genotípica.
Entre un nucleosoma y otro se encuentra
una histona (Hl) unida a 20 a 60 pares de bases con estructura de doble hélice alfa, los
cuales a su vez constituyen la base para un
nuevo plegamiento en espiral que origina al
selenoide.
2. Selenoide. El material genético se "empaqueta" alrededor de una matriz de proteínas no histonas, de modo que cada giro del selenoide está
integrado por seis nucleosomas (960 a 1 320
pares de bases, con una media de 1.2 kilobases, kb; fig. 3-4).
3. Núcleo de interfase. El selenoide a su vez se
pliega de manera irregular para formar "asas"
unidas en intervalos de 10 a 100 kilobases (fig.
3-4); finalmente, la condensación de éstas constituye al cronómero.
4. Cronómero. Es el fundamento de las bandas
cromosómicas que se observan microscópicamente al realizar un cariotipo.
17
Para que los factores de transcripción actúen
sobre el nucleosoma se requiere que las histonas
permitan un "desplegamiento transitorio" de la
doble hélice del ácido desoxirribonucleico, con base
en las características acidobásicas, y eléctricas y osmolares del contenido nuclear. Sin embargo, algunos segmentos del ácido desoxirribonucleico pueden permanecer "permanentemente plegados"; esto
evita la posibilidad de transcripción debido a la existencia de un ácido desoxirribonucleico cubierto.
Se puede concluir entonces que la capacidad
de expresión genética de cada célula o de cada clona celular, parece radicar en la especificidad del
nucleosoma para permitir la unión y función de los
factores iniciadores de la transcripción.
Factores iniciadores de la transcripción
Jacob y Monod proponen que el gen operador con
sus respectivos genes estructurales se activa cuando el gen represor pierde su efecto luego de unirse
a un agente inductor que lo bloquea. Britten y
Davidson sugieren que el agente inductor actúa
cuando se pone en contacto con una porción del
ácido desoxirribonucleico "descubierto o desnudo"
en el que se encuentran genes "sensor-integrados",
los cuales al activarse generan replicación de ácido
desoxirribonucleico y producen un ácido ribonucleico activador; éste actúa a su vez como un gen
inductor sobre otra porción del ácido desoxirribonucleico y hace que se activen uno o varios genes
(denominados "receptores"). Los genes receptores
activados generan una señal mediante cambios iónicos y de pH, para que se exprese una tercera parte
del genoma que contiene los genes productores de
un ácido ribonucleico mensajero específico. Este
último inducirá entonces la síntesis ribosómica de
una o varias proteínas específicas. De ese modo, la
activación o inactivación de la transcripción está a
cargo de las proteínas integradas a la molécula de
ácido desoxirribonucleico, esto es, a través de nucleoproteínas histonas y no histonas.
Este modelo es muy útil para entender los estadios ontogénicos tempranos que se caracterizan
por la producción de una misma proteína reguladora en varias clonas celulares, y así se presupone que
existe homología funcional en la región de reconocimiento de los genes receptores; es decir, un solo
factor inductor de la replicación de ácido desoxirribonucleico actúa sobre varias regiones "descubiertas" del genoma que contiene genes "sensores".
Bajo este tipo de control, el huevo fecundado
inicia su proliferación celular. Aunque en seres
humanos no se ha establecido el origen de este
agente, se sabe que en el huevo no fecundado de
18
Sección I • Bases para el estudio del crecimiento
Fig. 3-4. Plegamientos del material genético.
erizos de mar existe ácido ribonucleico mensajero
citoplásmico "inactivo", y que en el momento de la
fecundación se introducen proteínas paternas que
activan al ácido ribonucleico acumulado, el cual
actúa como agente inductor universal; así se origina la mayor parte de la síntesis de proteínas que
regulan las primeras etapas de proliferación celular del embrión. Si estos datos se extrapolan a la
condición humana, es posible suponer que existe
información citoplásmica almacenada en forma
inactiva (evidentemente de origen materno) en el
huevo no fecundado y que, cuando en éste penetra
la cabeza del espermatozoide, el ácido ribonuclei-
Fig. 3-5. Constitución del nucleosoma. El ácido desoxirribonucleico (DNA) se enreda alrededor de un grupo de ocho
histonas.
co citoplásmico sé activa mediante productos de
origen paterno, con lo cual se genera un agente inductor.
Existen dos posibilidades sobre la formación
del agente inductor:
1. Una proteína de origen paterno activa el ácido
ribonucleico mensajero de origen materno, el
cual se transforma en el agente inductor.
2. Un ácido ribonucleico mensajero de origen paterno se acopla al de origen materno y lo complementa; así se genera un ácido ribonucleico
mensajero "mixto" que podría funcionar como
agente inductor. Este agente es el posible encargado de que los genomas materno y paterno se mezclen y complementen mediante la inducción de divisiones meióticas, y de que al
mismo tiempo se generen porciones de "ácido
desoxirribonucleico descubierto" que, por los
cambios iónicos mostrados en el momento de
la fecundación, ocasionen activación de los genes "sensor-integrados", generación de ácido
ribonucleico activador, activación de los genes
receptores y formación del ácido ribonucleico
mensajero responsable de la síntesis de enzimas que facilita los procesos de crecimiento y
división celular.
Conforme avanza el proceso de diferenciación
celular que acompaña al crecimiento del embrión,
es probable que algunos genes receptores se vuelvan refractarios al estímulo del ácido ribonucleico
"activado" y se inicie el proceso de especificidad.
Esa diferenciación implica que una porción de ácido desoxirribonucleico previamente descubierta por
nucleoproteínas se transforme en ácido desoxirribonucleico "cubierto", y que se genere un nuevo
tipo de ácido ribonucleico "activado" que se reco-
Capítulo 3 • Genética del crecimiento
noce específicamente por una región del genoma
que contiene genes receptores (denominados "secundarios") no activados de manera previa. Estos
genes "receptores secundarios" producen modificaciones en las proteínas nucleares y dejan descubiertas regiones de genes productores antes inactivos que, al contacto con las nuevas condiciones iónicas, generan ácido ribonucleico mensajero para la
síntesis de proteínas, ahora específicas de la clona
celular, y de las cuales depende la expresión de la
diferenciación celular.
Las clonas celulares en que los genes dirigen
la síntesis de proteínas reguladoras parecen poseer
un mismo gen "sensor-integrado" capaz de activar
varios genes productores a la vez e iniciar así la
síntesis de varios ácidos ribonucleicos mensajeros
que den origen cada uno a una de las 10 enzimas
distintas del ciclo de la urea.
Se entiende así que la expresión final de la
activación de un gen "sensor-integrado" es la síntesis de uno o varios polipéptidos sin función específica; mientras que la expresión final de la activación de un gen "productor" es exclusivamente la
síntesis de un polipéptido. En este punto radica la
importancia de la teoría de Britten y Davidson, ya
que es capaz de explicar tanto las funciones comunes a todas las clonas celulares, como las específicas para cada una, esto es, las bases del proceso de
diferenciación celular.
Los polipéptidos sintetizados poseen funciones específicas, entre ellas, ser componentes estructurales de la célula, receptores de mensajeros autocrinos, paracrinos y endocrinos, transportadores y
reguladores de la acción de moléculas orgánicas,
anticuerpos, reguladores de efectos metabólicos,
etc. Sin embargo, debe considerarse la posibilidad
de que el péptido sufra cambios postranscripcionales para generar una acción específica, como
sucede en el caso de la mayoría de las hormonas
polipeptídicas. Por ejemplo, la proopiomelanocortina, que después de sintetizarse como polipéptido
puede dividirse y generar una de las siguientes sustancias: endorfinas y hormonas suprarrenocorticotrópica (ACTH) y estimulante de melanocitos
(MSH).
Las mutaciones en el ámbito de los genes "sensor-integrados", del ácido ribonucleico activador o
de los genes "receptores" pueden ocasionar falta
de producción de uno o varios polipéptidos; en
cambio, las mutaciones en el ámbito de los genes
"productores" pueden originar falta de síntesis de
un solo polipéptido, estructural o funcional, y desembocar en alteraciones de la actividad celular que
a su vez ocasionen manifestaciones clínicas indicadoras de un trastorno específico, como sucede en
19
enfermedades secundarias a falta de generación o
acción anormal de una o varias enzimas, que se denominan "errores innatos del metabolismo".
En la actualidad se conocen varios de los factores iniciadores de la transcripción y su secuencia
funcional, la cual, aunque no es idéntica en todos
los casos, puede explicarse de manera esquemática
de acuerdo con el modelo que se presenta a continuación (fig. 3-6).
1. La "región TATA", denominada así por su alto
contenido de adenina y timina, se encuentra
separada del primer exón por 25 a 30 pares de
bases. En este lugar reside la actividad intrínseca del ácido desoxirribonucleico para iniciar
un proceso de transcripción; por ello, se le considera el sitio "promotor basal o inicial". Parece lógico suponer que, como su funcionalidad
depende de la orientación y posición del material genético, se localice en un sitio de ácido
desoxirribonucleico descubierto, el cual debe
hallarse en los pares de bases situados entre
los nucleosomas.
2. Para iniciar la regulación de la transcripción
del precursor de ácido ribonucleico o ácido ribonucleico heteronuclear, debe formarse un
complejo funcional entre la región TATA y por
lo menos siete factores activadores de la transcripción, conocidos como proteínas fijadoras
de la región TATA (TBP, del inglés TATA binding proteins).
A. En orden cronológico, el primer factor que
interviene es el denominado II-D cuya función es reconocer la región TATA; ésta debe
activarse y servir de enlace entre la polimerasa-II (que regula la velocidad de la
transcripción) y las otras proteínas fijadoras de la región TATA (responsables
de la especificidad del segmento de ácido
desoxirribonucleico descubierto que se
transcribirá para sintetizar finalmente una
proteína determinada y específica; fig.
3-7).
B. Una vez formado el complejo TATA + IID, los factores II-A y II-B se unen para
constituir el complejo DAB. La especificidad de la transcripción génica depende de
la proteína II-B, ya que en este sitio se unen
los "coactivadores de la transcripción"
(hormonas esteroideas o proteínicas, metabolitos, etc.), es decir, los factores reguladores no genéticos que señalan la necesidad de iniciar la síntesis de una o más
proteínas requeridas en la regulación funcional del organismo (fig. 3-7).
20
Sección I • Bases para el estudio del crecimiento
Fig. 3-6. Interacción de los factores iniciadores de la transcripción con fragmento de "DNA desnudo" del material genético.
C. Luego de la formación del complejo DAB,
identificando específicamente la región genómica a transcribir, debe iniciarse la
formación del ácido ribonucleico heteronuclear. Para ello, en el ámbito de la proteína II-D, se une un dímero formado por
la polimerasa-II y la proteína II-F; esto origina un polímero conocido como "complejo DABpdF" o también como proteínas relacionadas con proteínas fijadoras de la
región TATA (TAF, del inglés TATA binding protein associaied proteins) o como
"coactivadores de la transcripción" (fig.
3-7).
D. Finalmente, en el ámbito del dominio carboxilo terminal y en específico en la región
de repetición del heptapéptido (Tyr-SerPro-Thr-Ser-Pro-Ser) de lapolimerasa, ésta
se fosforila después de su asociación con
DAB; así se facilita la elongación de la
transcripción. Sin que se haya dilucidado
por completo su función, es necesaria la
presencia de las proteínas II-E, II-H y II-J
para constituir el complejo basal de transcripción que se encarga de la lectura de un
sitio predeterminado del ácido desoxirribonucleico (fig. 3-7).
3. Activada la región TATA por el complejo basal de transcripción, es necesario descubrir
una región de ácido desoxirribonucleico previamente unida a histonas (nucleosoma), y
para ello se requiere de la activación tanto de
los "elementos promotores proximales" (encargados de la transcripción tisular inespecífica) como de los "elementos incrementadores" o "promotores de realce" (aumento de la
transcripción tisular específica), en muchos
casos debido a la unión de los "coactivadores de la transcripción" o "elementos reguladores hormonales" (estrógenos, progesterona,
glucocorticoides, testosterona, hormonas tiroideas, vitamina D, retinoides, insulina, etc.; fig.
3-6).
4. Bajo la acción de los elementos antes mencionados, la transcripción del ácido desoxirribo
nucleico descubierto origina un ácido ribonucleico heteronuclear o inmaduro, que requiere
de la adición de 7-metil-guanosina en su extremo 5' (para asegurar su estabilidad), de la poliadenilación en el extremo 3' (200 a 500 ade-
Capítulo 3 • Genética del crecimiento
21
Fig. 3-7. Secuencia de interacción de los factores iniciadores de la transcripción para generar ácido ribonucleico (RNA).
ninas en secuencia lineal) y de la remoción de
intrones para dar origen a un ácido ribonucleico maduro (fig. 3-8).
5. La eliminación de intrones y la poliadenilación
posibilitan la generación de distintos ácidos
ribonucleicos mensajeros maduros a partir de
un solo ácido desoxirribonucleico. Así, por
ejemplo, el mismo ácido desoxirribonucleico
puede ocasionar la síntesis de calcitonina en
las células C de las paratiroides, cuando se
transcribe la información contenida en los exones 1 a 4 del gen y se pierde la del exón cinco;
mientras tanto, en las neuronas centrales la remoción del exón cuatro con expresión del exón
cinco dará origen al péptido relacionado con
el gen de la calcitonina.
6. Una vez constituidos, ya sea uno o más ácidos
ribonucleicos mensajeros, se unen a la fracción
40S de los ribosomas, al ácido ribonucleico ribosómico 18S y finalmente a la fracción 60S,
para iniciar la traducción genética o síntesis de
proteínas y producir un péptido inmaduro, pos-
terior a la remoción del péptido señal (20 a 30
aminoácidos hidrofóbicos; fig. 3-8). 7. El
péptido inmaduro se traslada al aparato de Golgi
y ahí, a través de fosforilación, glucosi-lación,
acetilación, sulfatación u otros cambios, dará
origen al péptido maduro, el cual se almacena
para luego ser vertido a la célula o al espacio
extracelular (intersticial o vascular) mediante
secreción.
Todo proceso de diferenciación celular implica un efecto de "compartimentalización"; es decir,
en cada tejido funcionan diferentes genes, según la
etapa de desarrollo ontogénico de la clona celular,
lo cual habla en favor de la existencia de un "momento crítico" para poner en acción a un gen o a un
grupo de genes. En otras palabras, del "momento
crítico" de generación del gen o los genes necesarios, y de la adecuada síntesis de los polipéptidos
requeridos en cada etapa de desarrollo, dependerá
la normalidad de la organización, interrelación y
función de cada célula para poder constituir "siste-
22
Sección I • Bases para el estudio del crecimiento
Fig. 3-8. Formación de una proteína funcional a partir del ácido desoxirribonucleico (DNA).
mas funcionales", ya sea tejidos, órganos, aparatos
y, finalmente, organismos capaces de realizar funciones que posibiliten la homeostasis ante su ambiente y la reproducción.
A todo lo anterior, debe agregarse que el genoma no sólo controla los momentos críticos del crecimiento, sino que también regula su detención.
Aunque en la actualidad no existen estudios que
expliquen cómo se determina el cese del crecimiento
ni cuáles son los factores involucrados en esta regulación, es evidente que el fenómeno del crecimiento se exprés1» como "todo o nada" para cada
célula en particular, y que el control del crecimiento pluricelular se encarga del aumento de volumen
de cada tejido y del organismo en su conjunto.
En condiciones ideales, el crecimiento en el
ámbito celular debe alcanzar un "máximo", pero
en ámbitos organizativos complejos (tejido, órgano, aparato, sistema, organismo) debe adecuarse al
ambiente; por ello, en ausencia de factores limitantes sólo alcanzará un "óptimo", el cual es con mucho inferior al "máximo", y además conforme avanza la edad observa velocidades progresivamente menores (con excepción de la etapa de la pubertad).
Así, por ejemplo, en relación con el tamaño
alcanzado, es posible señalar lo siguiente:
1. Si todas y cada una de las células que se originan a partir del óvulo fecundado crecen a su
capacidad "máxima", al terminar el primer mes
de vida intrauterina el embrión tendrá un volumen alrededor de 8 000 veces superior al del
óvulo inicial; de hecho, esta situación se observa en condiciones fisiológicas.
Capítulo 3 • Genética del crecimiento
2. Sin embargo, si este mismo crecimiento "máximo" se mantuviera hasta alcanzar la edad adulta, el organismo así generado tendría un volumen cuya arista equivaldría a ¡128.35 km elevada a la potencia 1 100 años luz!, por lo que
sus requerimientos energéticos serían imposibles de satisfacer. Compréndase entonces la importancia de limitar el crecimiento fetal de manera que al término de la gestación el producto
posea un peso medio de 3 kg y una longitud
media de 50 cm, y una velocidad máxima, en
términos de incremento de talla, de 107 cm/
año en la semana 20 del embarazo.
3. Aun si se piensa en términos de crecimiento
posnatal, es evidente que la velocidad de crecimiento cada año es menor a la observada en
el periodo previo y que, por tanto, al término
del crecimiento se alcanza una estatura media
de 176 cm para varones y de 164 cm para mujeres, en lugar de 375 cm en mujeres y 450 cm
en varones que se obtendrían si la velocidad
de crecimiento del primer año de la vida (media de 25 cm por año) se mantuviera hasta los
1'5 y 18 años, respectivamente.
Además, debe tomarse en cuenta que a las características genéticas ("máximas" o genotipo) y a
la regulación neuroendocrina ("óptimo" o fenotipo) se agregan condiciones ambientales, nutricias
y orgánicas, que al limitar el crecimiento con intensidad y periodicidad variables producen como
resultado final una estatura real (epigenotipo), la
cual representa exclusivamente el equilibrio alcanzado por cada individuo durante las diferentes fases de adaptación a su medio.
Entre mayor es la cantidad de factores adversos que actúan durante la fase de crecimiento, menor es la estatura alcanzada. Pero las características
genotípica y fenotípica que se transmiten a los descendientes permitirán a éstos obtener una estatura
mayor que la de sus padres en la medida en que
disminuya la frecuencia, intensidad, o adición-potenciación de uno o varios factores limitantes del
crecimiento.
Poblaciones que alcanzan estaturas bajas representan al principio la existencia de individuos que
debieron limitar su crecimiento para mantener la
homeostasis corporal y poder sobrevivir ante situaciones inadecuadas, y cuyo epigenotipo es tan "chaparro" de manera inversamente proporcional a su
estado general de salud, por lo menos durante la
infancia.
La estatura que se observa en la población infantil de México al momento de ingresar a la escuela primaria es un ejemplo de lo anterior. Los
23
porcentajes que se señalan en el cuadro 3-1 representan la cantidad de niños cuya talla muestra más
de dos desviaciones estándar por debajo de la media poblacional.
Si se asume que lo habitual para una población
sana es alcanzar una estatura que no presente más
Cuadro 3-1. Estatura de la población infantil mexicana
durante su ingreso a la escuela primaria en 1993.
El asterisco (*) indica que el número de sujetos
afectados es mayor de 10% de la población infantil
Fuente: Sistema Nacional para el Desarrollo Integral de la
Familia. Primer censo nacional de talla: en niños de primer
grado de primaria. México: Secretaría de Educación Pública,
1994.
24
Sección I • Bases para el estudio del crecimiento
de dos desviaciones estándar por debajo de la media en 97% de los individuos, es evidente, y así se
observa en el cuadro 3-1, que ningún estado de la
República Mexicana permite a sus habitantes condiciones generales adecuadas de salud, y que en
algunos lugares los afectados constituyen más de
10% de la población infantil.
Así entonces, es posible señalar que:
El genoma se expresa en toda su potencia en
la medida en la que el ambiente es favorable
LECTURAS RECOMENDADAS
Berg P. Dissections and reconstructions of genes and chromosomes. Science 1981 ;213:296.
Britten J, Davidson EH. Gene regulation for higher cells. A
theory. Science 1969;165:349.
Conaway RC, Conaway JW. General initiation factors for
RNA polymerase II. Annu Rev Biochem 1993;62:161.
Darnell JR. Variety in the level of gene control in eukaryotic cells. Nature 1982;297:365.
Davidson EH, Britten RF. Regulation of gene expression:
possible role of repetitive sequences. Science 1979;
204:1052.
Dillon N, Grosveld F. Transcriptional regulation of multigene loci: multilevel control. Trends Genet 1993;9:134.
Eisenstein BI. The polymerase chain reaction: a new method
of using molecular genetics for medical diagnosis. N
EnglJMed 1990;322:178.
Felsenfeld G. Chromatin as an essential part of the tran
scriptional mechanism. Nature 1992;355:219.
Greenblatt J, Nodwell JR, Masón SW. Transcriptional
antitermination. Nature 1993;354:401.
Harrison SC. A structural taxonomy of dna-binding domains. Nature 1991;353:715.
Hunter T, Karim M. The regulation of transcription by
phosphorilation. Cell 1992;70:375.
Jacob F, Monod J. Genetic regulatory mechanisms in the
synthesis of proteins. J Molec Biol 1961;3:318.
Maniatis T, Goodbourn S, Fischer JA. Regulation of inducible and tissue-specific gene expresión. Science 1987;
236:1237.
Maniatis T. Mechanisms of alternative pre-mRNA splicing.
Science 1991;251:33.
Mitchell PJ, Tijan R. Transcriptional regulation in mammalian cells by sequence specific DNA binding proteins.
Science 1989;245:371.
Sistema Nacional para el Desarrollo Integral de la Familia.
Primer censo nacional de talla: en niños de primer grado
de primaria. México: Secretaria de Educación Pública,
1994.
Whale E, Keller W. The biochemistry of 3'-end clavage and
polyadenylation of messenger RNA precursors. Annu
Rev Biochem 1992;61:419.
Capítulo
4
Bases neuroendocrinas
del crecimiento
El crecimiento es un proceso multifactorial que
implica:
1.
2.
3.
4.
Replicación
Hipertrofia
Formación y secreción de tejido intercelular
Diferenciación morfológica y funcional (p. ej.,
la formación de capas embrionarias germinales durante la gestación)
5. Migración ordenada de las células a sitios ana
tómicos definidos
6. Condensación celular para formar unidades
anatomofuncionales (tejidos, órganos, etc.)
7. Muerte celular programada
En términos generales, la acción de esos factores se realiza a través de una o más de las siguientes funciones (fig. 4-1):
1. Aumentan la velocidad de división al reducir
la duración del ciclo celular. En aquellas clonas
celulares en que esto se ha cuantificado, se
reduce de 14 días a 8 horas; es decir, la velocidad de citoduplicación se aumenta hasta 67
veces
2. Potencian el efecto de otras hormonas o factores de crecimiento, o ambos, al aumentar la sensibilidad de una o varias clonas celulares, tanto en relación con el crecimiento como en la
diferenciación y adquisición de funciones
Estos procesos requieren de una comunicación
intercelular precisa y activa que está regulada por
las interacciones celulares locales (autocrinas y
paracrinas) y sistémicas (endocrinas) a través de los
factores de crecimiento.
Si bien el crecimiento está determinado principalmente por las características genéticas del individuo, la regulación de su velocidad, ritmo y
momento dependen en esencia de moduladores neuroendocrinos, los cuales requieren condiciones
ambientales adecuadas para su acción, o en otras
palabras:
Los factores de crecimiento estimulan el desarrollo y el crecimiento, y mantienen la viabilidad celular sólo si los medios intracelular y
extracelular son adecuados para la expresión
de las características genéticas y de las funciones metabólicas y energéticas en ese momento celular en particular
Fig. 4-1. Acción de los factores de crecimiento.
25
26
Sección I • Bases para el estudio del crecimiento
3. Inducen la síntesis de factores endocrinos, paracrinos y autocrinos, los cuales regulan viabilidad, funcionamiento y muerte celular.
Los factores de crecimiento fueron identificados por primera vez en 1906 por Carnot y Deflandre,
cuando se describió la existencia y la acción de la
eritropoyetina; sin embargo hasta 1961, cuando Levi
y Montalcini describieron el "factor de crecimiento nervioso", se reconocieron como mediadores de
las características genéticas que regulan el crecimiento celular.
El nombre de cada uno de los más de 50 factores conocidos hasta ahora deriva exclusivamente
del tejido en que se aislaron por primera vez o sobre el que se demostró su efecto; pero, aunque en
la actualidad se respeta esta denominación, se conocen muchas otras funciones y sitios de acción, e
incluso se han podido integrar sistemas que involucran a dos o más mediadores neuroendocrinos.
Las características generales de la mayoría de
los factores de crecimiento son:
1. Constituyen moléculas pequeñas de origen proteínico, cuyo peso molecular varía entre 5 000
y 25 000 kDa.
2. Tienen efectos similares sobre clonas celulares de origen embriológico común; pero pueden tener otras funciones (incluso antagónicas)
en otros tipos celulares.
3. Sus receptores, de origen glucoproteínico, se
localizan en la membrana celular externa, y la
formación del complejo "factor de crecimiento-receptor" determina la especificidad de sus
efectos biológicos (fig. 4-2).
4. El complejo activo se internaliza por endocitosis, y determina la especificidad de sustrato para
receptores localizados en núcleo, ribosomas,
mitocondria y citoplasma.
5. Los efectos sobre la hipertrofia celular, hiperplasia celular, y probablemente otras funcio
nes, se logran con concentraciones de billonésimas de mola(l X 10-12), es decir, tienen una
gran potencia biológica. Según O'Mally y
Schrader: "Si el paladar fuera tan sensible a
los sabores como los receptores a las hormo
nas, seríamos capaces de detectar 1 mg de azú
car disuelta en una piscina de agua".
Debido a que en la práctica es imposible describir los efectos de todos y cada uno de los factores de crecimiento, sólo se exponen algunos de los
mejor caracterizados. A continuación se describe
el sistema de la hormona de crecimiento (GH); luego se menciona el efecto de algunos de los factores
con acción paracrina y autocrina, y posteriormente
se ejemplifica la regulación de un crecimiento tisular específico.
SISTEMA DE LA HORMONA DE
CRECIMIENTO
El sistema de la hormona de crecimiento consiste
en una serie de factores que, por lo menos en parte,
regulan el crecimiento longitudinal armónico del
organismo, y que en la actualidad se sabe que está
constituido por (fig. 4-3):
1. Factores pretalámicos e hipotalámicos que regulan la secreción pulsátil de hormona de crecimiento.
2. Hormona de crecimiento, regulación hipofisaria de su síntesis y secreción, proteínas transportadoras específicas, y receptores periféricos
para ella.
3. Factores de crecimiento tipo insulina, sus proteínas transportadoras y receptores tisulares
para éstas.
Regulación de la secreción
de la hormona de crecimiento
Fig. 4-2. Mecanismos de acción intracelular de los factores
de crecimiento.
La liberación de hormona de crecimiento está influida de manera directa por el equilibrio entre la
hormona liberadora de hormona de crecimiento
(GHRH) hipotalámica y la somatostatina (SS) que
llegan a la hipófisis a través de la circulación portal
hipotalamohipofisaria (fig. 4-4).
La hormona liberadora de hormona de crecimiento, codificada en el cromosoma 20, se sinteti-
Capítulo 4 • Bases neuroendocrinas del crecimiento
27
Fig. 4-3. Eje funcional del factor de crecimiento tipo insulina-1 (IGF-1). GHRH = hormona liberadora de la hormona de crecimiento.
za en los núcleos arqueado y ventromedial del hipotálamo como una preprohormona, a partir de la
cual se genera el péptido activo de 40 aminoácidos
(también se ha descrito una forma de 44 aminoácidos). En el somatotropo se une a un receptor de
membrana de 26 kDa y, a través del aumento de
valores intracelulares de monofosfato de adenosina cíclico (cAMP), facilita la transcripción del gen
de hormona de crecimiento; además produce un
aumento en las concentraciones de calcio, lo cual
facilita su liberación. Estos efectos se deben de
modo predominante a la acción de los primeros 29
aminoácidos de la molécula de hormona liberadora
de hormona de crecimiento.
La somatostatina consiste en un péptido de 14
aminoácidos, sintetizado en el núcleo periventricular, que en el somatotropo hipofisario inhibe la liberación de calcio y así produce hiperpolarización
de la membrana posterior a un aumento de la permeabilidad al potasio, con lo que bloquea la secreción de hormona de crecimiento. También evita incremento en las concentraciones intracelulares hipofisarias de cAMP.
El predominio del efecto de la hormona liberadora de hormona de crecimiento produce un epi-
sodio agudo de liberación de esa hormona y la somatostatina, por el contrario, bloquea por completo esa liberación; de ese modo, un "pulso secretor"
de hormona de crecimiento depende de la existencia concomitante de concentraciones altas de dicha
hormona liberadora y concentraciones bajas de somatostatina.
En condiciones fisiológicas, durante la etapa
de crecimiento con signo positivo se produce una
secreción aguda de hormona de crecimiento cada
tres a cuatro horas y en la vida adulta se origina un
pico cada cuatro a seis horas. Asimismo, existe un
proceso intrincado que regula la secreción de hormona liberadora de hormona de crecimiento y somatostatina; ese proceso aún no está bien determinado, pero sus características principales se muestran a continuación.
La secreción de hormona liberadora de hormona de crecimiento se estimula por concentraciones
hipotalámicas elevadas de serotonina, histamina,
noradrenalina, acetilcolina y dopamina, y se inhibe
por ácido gammaaminobutírico (GABA) y dopamina; por su parte, la secreción de somatostatina se
estimula por ácido gammaaminobutírico, noradrenalina, dopamina y hormona de crecimiento, y se
28
Sección I • Bases para el estudio del crecimiento
2. El sistema colinérgico desempeña una función
importante en la modulación de hormona de
crecimiento. Los bloqueadores muscarínicos
inhiben el efecto de hormona liberadora sobre
la hormona de crecimiento por incrementar la
secreción de somatostatina; por su parte, los
agonistas colinérgicos bloquean la secreción de
somatostatina y aumentan la de hormona de
crecimiento. En la actualidad se piensa que el
sistema colinérgico tiene funciones sólo en el
ámbito de la somatostatina.
3. En años recientes, un gran número de neuropéptidos ha estado implicado en el control de
la secreción de hormona de crecimiento, tanto
en el ámbito del hipotálamo como de la adenohipófisis; la hormona liberadora de hormona
estimulante de la tiroides (TRH), el péptido intestinal vasoactivo (VIP), la gastrina, la neurotensina y la sustancia P desempeñan una función estimuladora, mientras que la calcitonina,
el neuropéptido Y y la hormona liberadora de
hormona suprarrenocorticotrópica (CRH) disminuyen su secreción.
4. La galanina, péptido de 29 aminoácidos que se
encuentra en concentraciones elevadas en el hipotálamo, aumenta la secreción de hormona de
crecimiento y la respuesta hipofisaria a la hormona liberadora de ésta, posiblemente a través
de la disminución del tono de somatostatina.
5. Los glucocorticoides tienen un doble efecto.
Aunque una dosis única de dexametasona puede bloquear por varios días la secreción de hormona de crecimiento producida por la acción
de su hormona liberadora, existe una respuesta
inmediata (casi a las tres horas) en la que aumenta esa secreción.
inhibe por acetilcolina. Estas interacciones son complejas, por lo que se mencionarán algunos aspectos
particulares:
1. La dopamina puede estimular o inhibir la secreción de hormona liberadora de hormona de
crecimiento dependiendo de las condiciones en
que actúe este neurotransmisor, ya que en situaciones de estrés lo hace a través de metabolitos adrenérgicos. El sistema adrenérgico estimula la secreción de esa hormona liberadora a
través de receptores alfa-2; sin embargo, el uso
de clonidina (un adrenérgico alfa) aumenta la
secreción de hormona de crecimiento no por
estimulación de la hormona liberadora sino por
disminución de somatostatina. Los adrenérgicos beta aumentan la secreción de somatostatina y en consecuencia disminuyen la de hormona de crecimiento.
Además de los factores hipotalámicos ya descritos, existen otros mediadores neuroendocrinos
que regulan la secreción hipofisaria de la hormona
de crecimiento:
1. En 1988 se identificó el factor hipofisarío específico de transcripción (PIT-1 o GHF-1),
constituido por 291 aminoácidos, y se demostró que es indispensable en la generación de
las células hipofisarias secretoras (somatotropo, lactotropo y tirotropo), así como en la regulación de los genes de hormona de crecimiento, prolactina y la cadena beta de la hormona
liberadora de tirotropina. La respuesta secretora de hormona de crecimiento inducida por
receptores de hormonas sexuales, receptores de
hormonas tiroideas y glucocorticoides parece
estar mediada por PIT-1, y en algunos pacien-
Capítulo 4 • Bases neuroendocrinas del crecimiento
tes con deficiencia de hormona de crecimiento
(acompañada con frecuencia por deficiencia de
prolactina, hipotiroidismo e hipoplasia hipofisaria) se ha demostrado la existencia de mutaciones en el exón del gen que codifica para PIT1. En la región 5' del gen GH-N se encuentra
el sitio de unión para PIT-1, cuyo efecto parece
ser la sensibilización del gen promotor de la
hormona de crecimiento. El extremo carboxiloterminal se une al ácido desoxirribonucleico, y en el extremo aminoterminal existen 72
aminoácidos que se encargan de activar la transcripción.
2. El péptido hipofisario activador de adenilciclasa (PACAP), miembro de la familia de secretina-glucagon-péptido intestinal vasoactivo,
a través de sus receptores tipo I, aumenta la
concentración de calcio del somatotropo y fa
cilita la liberación de hormona de crecimiento.
3. Las hormonas tiroideas activan al gen promo
tor de la síntesis de hormona de crecimiento.
En condiciones de hipotiroidismo o hipertiroidismo se reduce la secreción de hormona de
crecimiento, probablemente porque se antagoniza el efecto de su hormona liberadora sobre
la adenohipófisis, a pesar de la secreción dis
minuida de somatostatina.
4. Los andrógenos y los estrógenos gonadales,
producidos de manera natural durante la pu
bertad o administrados en dosis farmacológi
cas, aumentan la secreción de hormona de cre
cimiento, tanto espontánea como inducida por
fármacos.
29
5. La hipoglucemia y algunos aminoácidos (arginina, lisina, galanina, etc.) incrementan la secreción de hormona de crecimiento, mientras
que la insulina y los ácidos grasos libres la inhiben. De manera experimental se ha observado que luego de un ayuno de cinco días aumenta la concentración sérica de hormona de
crecimiento, lo cual coincide con disminución
de ácidos grasos e insulina y aumento de aminoácidos circulantes producto de la gluconeogénesis.
6. La secreción de hormona de crecimiento se encuentra profundamente modificada en enfermedades como anorexia nerviosa, obesidad, dia
betes mellitus y desnutrición (fig. 4-5).
La secreción pulsátil de hormona de crecimiento es un acontecimiento universal en los seres humanos; sin embargo, la amplitud y la altitud de los
picos son distintas de un sujeto a otro, de manera
que la cantidad producida durante 24 horas o secreción integrada varía según la edad, el sexo y la
estatura genética del individuo. Así, por ejemplo,
las concentraciones séricas de hormona de crecimiento que se encuentran en la circulación sistémica aumentan de manera significativa desde el inicio de la pubertad, es decir, cuando se observa el
estadio II de maduración de Tanner y Whitehouse,
y hasta que se alcanza una maduración correspondiente al estadio IV, al parecer por el efecto de los
andrógenos. Sin embargo, existen diferencias notables en el patrón de secreción determinado por
andrógenos y estrógenos.
Fig. 4-5. Factores que favorecen y que inhiben la producción y acción de los factores de crecimiento tipo insulina (IGF).
GH = hormona del crecimiento; SS = somatostatina.
30
Sección I • Bases para el estudio del crecimiento
Asimismo, la cantidad de hormona de crecimiento secretada en los estadios 3 y 4 del sueño
profundo es mayor en varones prepúberes que en
mujeres. En varones, los picos tienen mayor altitud
y amplitud, y entre ellos se observan concentraciones básales muy cercanas a 0 ng/dl; en mujeres,
existe menor altitud y amplitud de los picos, pero
éstos son más frecuentes y entre sí mantienen concentraciones básales elevadas de modo constante
(fig. 4-6). Debido a que el patrón pulsátil con picos
altos y amplios es más favorable para el crecimiento esquelético, se piensa que en parte la diferencia
de estatura entre varones y mujeres se debe a este
fenómeno.
La secreción total de hormona de crecimiento
en 24 horas es mayor en individuos cuya estatura
genética se sitúa en las percentilas poblacionales
altas (90 a 97) que en aquéllos cuyo crecimiento
corresponde a las percentilas poblacionales bajas
(3 a 10). Así, la estatura genética u óptima de un
individuo parece deberse a la capacidad de secreción diaria de hormona de crecimiento, y a la respuesta del somatotropo hipofisario ante los factores reguladores de la síntesis hormonal en las distintas etapas de la vida (fig. 4-7).
Por otro lado, el patrón pulsátil se relaciona
con características metabólicas, entre ellas inducción de la síntesis hepática de enzimas como 5-alfareductasa, 5-beta-hidroxilasa y 16-alfa-hidroxilasa,
cuyos valores son más altos en varones, y con dis-
minución de las concentraciones de fosfolípidos circulantes.
Es importante señalar que las pruebas de estimulación de la hormona de crecimiento mediante
el uso de fármacos (hormona liberadora de hormona de crecimiento, clonidina, hipoglucemia inducida por insulina, arginina, propranolol, glucagon,
etc.) originan un estado agudo de reto que proporciona información parcial sobre la capacidad de
respuesta hipotalamohipofisaria del sistema de la
hormona de crecimiento, pero esto no muestra las
condiciones funcionales fisiológicas que constituyen dicho sistema; por tanto, los resultados no bastan para afirmar de manera categórica la suficiencia
o insuficiencia de un individuo para secretar hormona de crecimiento. El uso racional de esas pruebas debe involucrar el análisis de la velocidad de
crecimiento del individuo y de su maduración biológica, además de las concentraciones séricas de la
proteína transportadora de hormona de crecimiento
(GHBP), de los factores de crecimiento tipo insulina y de las proteínas transportadoras de éstos.
Síntesis y efectos directos de la
hormona de crecimiento
El gen para la hormona de crecimiento se localiza
en el cromosoma 17, y codifica la síntesis de una
proteína que consta de 191 aminoácidos y contiene
Capítulo 4 • Bases neuroendocrinas del crecimiento
dos puentes disulfuro intracatenarios, cuyo peso molecular es de 22 kDa, aunque se han descrito formas circulantes de 20 kDa. La síntesis de la hormona de crecimiento depende de cinco genes distintos, cada uno con cinco exones (fig. 4-8).
1. El primer gen codifica para una proteína que
facilita el transporte de la hormona de crecimiento desde el retículo endoplásmico hacia
la membrana.
2. El gen GH-N contiene la información para la
síntesis de dos proteínas parecidas: una de 22
kDa, que constituye 90% de la hormona de crecimiento producida; otra de 20 kDa, que carece de los aminoácidos 32 a 46 respecto de la
forma 22 kDa y que corresponde sólo a 10%
de la hormona de crecimiento circulante.
3. El gen GH-V se encarga de la síntesis de una
proteína similar a la hormona de crecimiento
(proteína que sólo se produce en la placenta y
difiere en 13 aminoácidos de la forma hipofisaria).
La estructura cuaternaria de la molécula de
hormona de crecimiento es un determinante primario en la unión con proteínas transportadoras o con
receptores periféricos: existen tres polipéptidos discontinuos en su molécula que determinan la funcionalidad, y ellos son el asa que se forma entre los
residuos 54 y 74, la porción central de la hélice
cuatro al carboxiloterminal y la región aminoterminal de la hélice uno.
Si bien se cree que la mayoría de las acciones
de hormona de crecimiento son mediadas a través
del factor de crecimiento tipo insulina-1 (IGF-1),
31
estudios recientes demuestran que la hormona per
se puede producir los siguientes efectos:
1. Aumento de la síntesis de proteínas. Esta función se observa en las primeras tres a seis horas, y se caracteriza por aumento de la síntesis
sin disminución de la proteólisis; por su parte,
el efecto del factor de crecimiento tipo insulina-1 se hace evidente después de 6 a 12 horas
de aplicada la hormona de crecimiento, y consiste en disminución del catabolismo de proteínas. Entonces, la acción anabólica neta que
se observa parece deberse a una acción intrínseca de la hormona durante las primeras seis
horas, y a un efecto mixto (hormona de crecimiento + factor de crecimiento tipo insulina-1)
en las siguientes horas, con un equilibrio metabólico neto que depende de las acciones agonistas entre ambas moléculas.
2. En el estado posabsortivo, tiene efectos agonistas con la insulina; aumenta la captación
de glucosa en el ámbito celular y disminuye
la gluconeogénesis y glucogenólisis. Por el
contrario, en el estado posprandial inmediato, aumenta la liberación celular de glucosa por
estimulación de la glucogenólisis y gluconeogénesis, y disminuye la captación celular
de glucosa dependiente de insulina; en tanto
que en las células musculares inhibe la glucogénesis y la oxidación de glucosa y aumenta la
oxidación de grasas, con lo que se disminuye
la necesidad de degradar proteínas y metabolizarlas oxidativamente a través de la gluco
neogénesis. Este último efecto es antagónico
con las acciones del factor de crecimiento tipo
Fig. 4-8. Grupo de genes de la hormona de crecimiento (GH). Para cada gen, los cuadros oscuros representan las regiones
codificantes (exones); los cuadros claros, los intrones. Los cuadros rayados representan las regiones 5' y 3'. GH-N = hormona
de crecimiento normal; GH-V = variante que difiere en 14 aminoácidos de GH-N; LP-A y LP-B = loci duplicados que codifican
para el lactógeno placentario.
32
Sección I • Bases para el estudio del crecimiento
insulina-1, y se controla en parte por aumento
en la producción de proteína transportadora de
factor de crecimiento tipo insulina-3, la cual
sólo permite que menos de 5% de factor de crecimiento tipo insulina-1 se encuentre libre en
la circulación y pueda favorecer la captación
celular de glucosa.
3. Produce un incremento de glicerol y ácidos grasos libres en plasma por medio de aumento de
la lipólisis (a pesar de concentraciones altas de
insulina circulante), y favorece la oxidación
beta. Por otro lado, parece disminuir de manera transitoria el colesterol transportado por las
lipoproteínas de baja densidad (LDL) en 10 a
30% y aumentar el colesterol de lipoproteínas
de alta densidad (HDL). Las acciones antilipolíticas de factor de crecimiento tipo insulina-1
disminuyen al aumentar la concentración de
proteína transportadora de factor de crecimiento tipo insulina-3.
4. Activa el sistema renina-angiotensina-aldosterona y estimula la actividad de la ATPasa en la
bomba de sodio y potasio, con lo que aumenta
la retención de agua, potasio, fósforo y se favorece la excreción renal de calcio que provoca su disminución. Sin embargo, estos efectos
parecen depender más de la acción del factor
de crecimiento tipo insulina-1 que de la hormona misma.
Receptor para la hormona de crecimiento
El receptor para hormona de crecimiento consiste
en una cadena peptídica de 620 aminoácidos, con
dominios extracelular de 246 aminoácidos, transmembrana de 24 aminoácidos e intracelular de 350
aminoácidos. El dominio extracelular tiene cinco
posibles sitios de glucosilación y siete residuos de
cisteína que forman tres puentes disulfuro. La cisteína no sobrante, localizada cerca de la membrana
celular puede estar involucrada en la dimerización
del receptor, esencial para la activación (fig. 4-9).
El dominio extracelular está codificado por los
exones 3 a 7; el dominio transmembrana por el exón
8, y el dominio intracelular por los exones 9 y 10
del gen localizado en el cromosoma 5. En pacientes con síndrome de resistencia a la acción de la
hormona de crecimiento que se estudiaron en Ecuador (poblaciones de Loja y del Loro), se demostró
una alteración en el codón 18 del exón 6 (dominio
extracelular), lo cual produce un cambio en la tripleta de bases. Curiosamente, este cambio no origina sustitución de aminoácidos en la molécula del
receptor para hormona de crecimiento, ya que cuando ésta se sintetiza in vitro resulta idéntica a la producida en condiciones fisiológicas. Sin embargo,
el codón alterado es leído por la célula como una
señal de punto final, por lo que a partir de este sitio
se suspende la lectura y transcripción del exón 6;
esto origina una proteína incompleta y disfuncional que ocasiona una resistencia periférica a la
hormona de crecimiento.
El número de receptores para hormona de crecimiento en hígado, músculo, tejido adiposo y condrocitos depende de la concentración sérica de la
propia hormona de crecimiento. De este modo, las
concentraciones bajas se relacionan con menor
número de receptores expuestos en la membrana celular, mientras que concentraciones altas,
pero dentro de límites fisiológicos, aceleran e incrementan la internalización de los receptores; en
ambas situaciones se produce menor acción hormonal. Los esteroides sexuales aumentan los receptores hepáticos, mientras que la desnutrición los
disminuye.
El complejo hormona de crecimiento-receptor
consiste en una molécula de hormona de crecimiento con dos moléculas de receptores unidas a nivel
del carboxiloterminal. Inicialmente, la hormona de
crecimiento se une a un solo monómero del receptor, a través de 24 aminoácidos localizados en la
hélice uno y de toda la hélice cuatro de la hormona;
esto ocasiona un cambio conformacional o reacomodo molecular que permite la unión de otro monómero del receptor a 13 aminoácidos de la hélice
uno y a toda la hélice tres de la hormona. Así se
genera el complejo "dímero del receptor-hormona
de crecimiento".
Fig. 4-9. Gen del receptor para hormona del crecimiento (cromosoma 5).
Capítulo 4 • Bases neuroendocrinas del crecimiento
Se piensa que sólo las células indiferenciadas
tienen receptores para hormona de crecimiento, lo
cual explica su efecto predominante que favorece
la diferenciación de células madres; pero una vez
diferenciadas, éstas se vuelven insensibles a la hormona de crecimiento y sensibles al factor de crecimiento tipo insulina-1. Por ejemplo, la hormona de
crecimiento actúa en precondrocitos pero no en condrocitos, en preadipocitos pero no en adipocitos.
La porción intracelular o citoplásmica del receptor de la hormona de crecimiento contiene por
lo menos dos regiones distintas desde el punto de
vista conformacional y funcional, las cuales son
indispensables para que se produzca la activación
del receptor y se generen mediadores de los efectos
metabólicos (fig. 4-10):
1. La "caja-2", importante para la señal de transducción, consta de 23 aminoácidos, es particularmente rica en serina y posee características
hidrofóbicas. En esta región se encuentra la actividad tipo cinasa intrínseca del receptor, que
al facilitar la autofosforilación, activa la porción localizada inmediatamente por arriba denominada "caja-1".
Fig. 4-10. Mecanismos intracelulares de acción de la hormona del crecimiento. STAT = transductoras señal y activadoras de la transcripción; MAP = proteincinasas activadoras de
la mitogénesis; JAK = tirosincinasas tipo Janus.
33
2. La "caja-1" consta de los aminoácidos 280
a 287, y es rica en prolina. En este ámbito,
se produce la activación de una serie de proteínas:
A. Tirosincinasa perteneciente a la serie de cinasas tipo Janus (cinasa Janus tipo 2). Su
activación es inmediata a la unión de la hor
mona de crecimiento con el receptor, y su
efecto transitorio consiste en facilitar la fos
forilación de las tirosinas de la misma proteína y de otras cascadas de autofosforila
ción o fosforilación de proteínas celulares.
B. Proteínas transductoras de la señal y activadoras de la transcripción (STAT, del inglés signal transducer and activators of
transcription), que se activan luego de ser
fosforiladas por la cinasa Janus tipo 2 autofosforilada. Las proteínas STAT ya fosforiladas se agrupan para formar dímeros
(homodímeros y heterodímeros); éstos se
translocan hacia el núcleo en donde se unen
a secuencias específicas del ácido desoxirribonucleico que regulan a los genes
de citocinas, y por otro lado favorecen los
efectos transcripcionales de la hormona de
crecimiento. Existe evidencia de que la especificidad de la acción de hormona de crecimiento en cada tipo celular depende de
las proteínas STAT activadas (STAT-1,
STAT-3, STAT-5), así como de la asociación de homodímeros o de heterodímeros.
Por ejemplo, la inducción de isoenzimas
del citocromo P-450 en ambos sexos y de
la enzima 6-beta-hidroxilasa (que cataliza
la 6-beta hidroxilación del ácido litocólico), particularmente en células hepáticas de
varones, depende de la proteína STAT-5;
en cambio, la transcripción del gen del fac
tor de crecimiento tipo insulina-1 depende
de la activación de dos promotores que parecen no guardar homología con las STAT
tipo 1, 3 o 4, pero se relacionan con la activación de un interferón gamma.
C. Activación de las proteincinasas activadoras de la mitogénesis (MAP, del inglés mitogen activatedprotein), miembros de la familia de serina-treonina-tirosina; regulan
tanto el crecimiento como la diferenciación.
D. La unión de la hormona de crecimiento y
el dímero del receptor estimula la forma
ción de diacilglicerol. Esto induce fosforilación de la proteincinasa C y, por un lado,
produce aumento de la entrada de calcio
en la célula y, por otro, en conjunto con la
cinasa Janus tipo 2 activa a las cinasas de
34
Sección I • Bases para el estudio del crecimiento
las proteincinasas activadoras de la mitogénesis.
E. Fosforilación de la cinasa tipo 3 de fosfatidilinositol, por lo general dependiente de
insulina, y que aumenta la entrada de glucosa a nivel celular.
Proteínas transportadoras de la
hormona de crecimiento
Se han identificado por lo menos dos proteínas
transportadoras de hormona de crecimiento: una
posee baja afinidad, tiene un peso molecular de 165
kDa, se une preferentemente a la variante hormonal de 20 kDa y transporta alrededor de 5 a 8% de
la hormona de crecimiento circulante; la otra muestra afinidad alta, se une preferentemente a la variante de 22 kDa y se encarga de transportar 40 a
50% de la hormona de crecimiento. Así, queda como
libre 24 a 55% de la hormona de crecimiento.
La proteína transportadora de hormona de crecimiento con alta afinidad es idéntica en estructura
al dominio extracelular del receptor de membrana
para hormona de crecimiento, y está constituida por
239 a 246 aminoácidos, principalmente de origen
hepático; al parecer se origina por proteólisis específica de la fracción extracelular del receptor para
hormona de crecimiento, ya que su síntesis y la del
receptor parecen estar codificadas en la misma región genómica.
La proteína transportadora de hormona de crecimiento mantiene concentraciones de constancia
relativa, que tienden a ser ligeramente superiores
durante las mañanas. Las concentraciones de hormona de crecimiento y su proteína transportadora
son bajas en el feto; pero a los seis años se duplican
y continúan en ascenso de manera paulatina. Las
cifras de dicha proteína transportadora son proporcionales a la estatura, el peso y la masa corporal
(IMC) del individuo, y se modifican de acuerdo con
esta última (disminuyen en desnutrición y pérdida
de peso, y aumentan en obesos); asimismo, esas
cifras aumentan con el estradiol y disminuyen con
la testosterona.
Niños con deficiencia de hormona de crecimiento presentan aumento de las concentraciones
de proteína transportadora al recibir hormona de
crecimiento humana biosintética.
La proteína transportadora aumenta la vida
media de la hormona de crecimiento de 7 a 27 minutos. Asimismo, existe una correlación inversa entre los valores de proteína transportadora de hormona de crecimiento y la concentración media de hormona de crecimiento durante 24 horas, la amplitud
media de sus pulsos y la suma de las amplitudes de
los pulsos, así como una correlación directa con las
cifras de factor de crecimiento tipo insulina-1. También, los valores de la proteína son inversamente
proporcionales a los de las bilirrubinas séricas, y
directamente proporcionales a los de la albúmina.
Los pacientes ya sea con cirrosis hepática, insuficiencia renal crónica, diabetes mellitus insulinodependiente (DMID), desnutrición o enfermedades agudas, así como de Larón, presentan cifras
bajas de la proteína transportadora; esas cifras también se observan sólo en 4.7% de los niños con
estatura baja, aunque hay que señalar que el RÍA
para dicha proteína sólo detecta al péptido capaz
de unirse de modo funcional con la hormona de
crecimiento, y no las concentraciones totales.
FACTORES DE CRECIMIENTO TIPO
INSULINA (IGF)
Como ya se mencionó antes, las acciones del sistema de la hormona de crecimiento sobre el crecimiento lineal, y diversas funciones metabólicas,
dependen no tanto de la hormona como de los factores de crecimiento sintetizados a través de su
mediación.
Aunque en un principio se les conoció como
"somatomedinas", después recibieron el nombre de
factores de crecimiento tipo insulina debido a la
homología estructural que por lo menos en uno de
ellos existe con esta hormona y particularmente con
la proinsulina.
Los factores de crecimiento tipo insulina-1 y
tipo insulina-2 están constituidos por cadenas polipeptídicas simples con 62% de homología estructural entre ambos; el primero es un péptido básico
de 70 aminoácidos con peso molecular de 7 649, y
el segundo es un péptido ligeramente ácido de 67
aminoácidos con peso molecular de 7 471. Ambos
tienen una homología de 30% con la proinsulina, y
se sintetizan como prepropéptidos con un tamaño
molecular de 20 a 22 kDa.
El gen del factor de crecimiento tipo insulina1 se localiza en el brazo largo del cromosoma 12 y
contiene seis exones, de los cuales el 3 y el 4 codifican para el péptido maduro; el gen que codifica
para el tipo insulina-2 se encuentra en el brazo corto
del cromosoma 11, contiguo al de la insulina, y tiene
nueve exones y cuatro promotores adyacentes a
éstos. La proteína madura está codificada por los
exones 7, 8 y parte del 9. Los genes de ambos factores son marcadamente largos y complejos si se
les compara con otras hormonas peptídicas.
Los dos factores mencionados actúan sobre
células de origen ectodérmico, mesodérmico y endodérmico. De acuerdo con el momento del ciclo
Capítulo 4 • Bases neuroendocrinas del crecimiento
celular, pueden tener efectos sobre el crecimiento,
estimulando su proliferación, diferenciación y funciones celulares específicas durante la fase de síntesis de material genético; en cambio, cuando la
célula se encuentra metabólicamente activa, es decir, cuando efectúa procesos de oxidorreducción de
nutrimentos, producen efectos metabólicos similares a los de la insulina, sobre todo en células con
capacidad proliferativa o de función específica.
Ambos factores son sintetizados de manera autocrina y paracrina, especialmente por células de origen mesodérmico, y su expresión local está regulada por el gradiente de desarrollo del tejido.
Factor de crecimiento tipo insulina-1
El factor de crecimiento tipo insulina-1 está regulado de manera directa por la hormona de crecimiento y se produce en hígado (in vitro) después
de 12 a 24 horas de acción de la hormona, la cual
también favorece su expresión tisular local. Sin
embargo, en el ámbito hipofisario, este factor posee un efecto de retroalimentación negativa para la
secreción de hormona de crecimiento.
Otras hormonas hipofisarias regulan la producción y secreción local de este factor. Por ejemplo,
la hormona estimulante de la tiroides induce aumento de las cifras del factor tipo insulina-1 en las
células del folículo tiroideo; la hormona luteinizante
(LH) y la gonadotropina coriónica humana (HCG)
estimulan la producción en células de la granulosa
y en células de Leydig; la hormona foliculostimulante (FSH) promueve la síntesis de dicho factor en
células de la granulosa en ovarios, y en las células
de Sertoli en testículos. Las dosis farmacológicas
de estrógenos suprimen los valores del factor en
individuos normales; la paratohormona (PTH) los
aumenta en osteoblastos.
Existe gran variedad de péptidos paracrinos que
estimulan la producción del factor de crecimiento
tipo insulina-1, entre ellos los factores de crecimiento derivado de las plaquetas, nervioso, epidérmico
y el transformador de los linfocitos. Pero, cuando
la ingestión calórica es inferior a 12 kcal/kg se desarrolla una insensibilidad "fisiológica" a la hormona de crecimiento, como mecanismo adaptativo, debido a la reducción de sus receptores periféricos, en particular a nivel hepático, y en consecuencia se afecta en sentido negativo la expresión
del gen y la síntesis del factor de crecimiento tipo
insulina-1; por ello, las concentraciones séricas de
este último son menores durante el ayuno.
En pacientes con sepsis disminuye la producción hepática y las concentraciones séricas del factor mencionado, sin que la administración de hor-
35
mona de crecimiento humana (HGH) promueva la
recuperación. Esto sugiere existencia de insensibilidad a la hormona, y lo mismo sucede en pacientes
con tumores sólidos o con leucemia; sin embargo,
en éstos ocurre una rápida normalización luego del
inicio de la quimioterapia.
Por otro lado, las lesiones en músculo, tendones, nervios, endotelio de los vasos sanguíneos,
riñon, tejido subcutáneo y células epidérmicas producen elevaciones transitorias del factor hasta por
tres a cinco semanas, en relación con el fenómeno
de reparación tisular.
El factor de crecimiento tipo insulina-1 requiere
de transportadores séricos para su distribución tisular, y circula unido a una globulina específica;
así se forma un complejo con peso molecular de
150 kDa. Esa globulina determina la vida media y
las concentraciones plasmáticas relativamente constantes del factor durante todo el día; además, le
confiere propiedades de biodisponibilidad ya que
el complejo no puede atravesar las fenestras endoteliales y, por tanto, evita su paso hacia tejidos, líquido cefalorraquídeo y circulación linfática. Para
introducirse a los tejidos, el complejo formado (factor de crecimiento tipo insulina-globulina) se une
a una albúmina, la cual posee mayor especificidad
y capacidad de fijación para el factor; así, éste se
desplaza para formar un complejo factor-albúmina
con un peso molecular de 45 kDa y ello le permite
atravesar las fenestras endoteliales y circular en el
medio extracelular. Este complejo es atraído por el
receptor hístico y de ese modo queda fijado a la
superficie celular; por su parte, la albúmina regresa
al torrente sanguíneo y vuelve a competir con otra
globulina por una nueva molécula de factor de crecimiento tipo insulina (fig. 4-11).
Aunque no está demostrado que la acción del
factor tipo insulina-1 para acelerar la velocidad de
crecimiento y su síntesis dependan de hormonas
sexuales, se han realizado estudios en mujeres con
disgenesia gonadal que muestran como resultado
aumento significativo de concentraciones séricas
luego de iniciar tratamiento con etinilestradiol. Asimismo, en varones con hipogonadismo, el uso de
testosterona en dosis tan bajas como 2 mg/kg induce incremento de los valores séricos.
En riñón se ha demostrado que la concentración de factor de crecimiento tipo insulina-1 en los
túbulos colectores es 10 veces superior a la de otras
estructuras renales.
En las gónadas se alcanzan cifras máximas
durante las etapas de espermatogénesis y ovogénesis, y aumenta la expresión del gen que codifica
para la síntesis de citocromo P-450 aromatasa y de
progesterona, estradiol y andrógenos.
36
Sección I • Bases para el estudio del crecimiento
Fig. 4-11. Transporte de los factores de crecimiento tipo insulina (IGF). LCR = líquido cefalorraquídeo.
Estudios derivados de la observación del crecimiento en sujetos normales y en niños con deficiencia de hormona de crecimiento han permitido
determinar que los factores neuroendocrinos se encargan de por lo menos 50% del crecimiento lineal
del ser humano; de este porcentaje, las acciones endocrinas del factor tipo insulina-1 promueven 85%
del crecimiento, mientras que las acciones autocrinas y paracrinas generan el 15% restante (fig. 4-12).
También se ha demostrado que el factor de
crecimiento tipo insulina-1 tiene efectos en células
derivadas del mesodermo, al inducir diferenciación
y proliferación celulares en músculo estriado, eritrocitos, condrocitos, osteoblastos, fibroblastos y
adipocitos. En el sistema nervioso, regula el creci-
miento y la diferenciación de las neuronas fetales;
estimula la síntesis de proteínas neuronales, y aumenta el crecimiento de dendritas y axones; asimismo, incrementa el tamaño del cuerpo neuronal
y la cantidad de células de Purkinje en el cerebelo,
la formación de sinapsis y la síntesis de mielina.
Estos efectos dependen de la correlación entre el
factor de crecimiento tipo insulina-1 y su proteína
transportadora IGFBP-1, ya que cuando esta última se encuentra elevada en su relación equimolar
con el factor, los efectos descritos son mucho menores e incluso pueden inhibirse.
En el músculo estriado, el factor de crecimiento tipo insulina-1 estimula el transporte y la producción de lactato, la captación de glucosa, la glu-
Fig. 4-12. Representación esquemática de la acción de los factores de crecimiento sobre la velocidad de crecimiento en pacientes sanos.
Capítulo 4 • Bases neuroendocrinas del crecimiento
cólisis y la glucogénesis; en comparación con la
insulina, es 50% menos potente en el músculo estriado y 90% menos potente en el músculo cardiaco.
Promueve la síntesis de proteínas, de tal manera que
cuando las células se encuentran en fase de división del ciclo celular, inicia procesos replicativos.
En osteoblastos, estimula la síntesis de ácido
desoxirribonucleico y ácido ribonucleico, y posee
50 veces más potencia que la hormona de crecimiento en relación con concentraciones molares
similares. Siempre y cuando el factor de crecimiento
derivado de plaquetas (PDGF) reclute células en
reposo e inicie la mitosis, el factor de crecimiento
tipo insulina-1 actúa como mitógeno y estimula la
proliferación de osteoblastos, la síntesis de colágena tipo 1 y de aposición de la matriz; también inhibe la degradación de colágena y facilita la diferenciación de osteoprecursores hacia osteoblastos. En
condroprecursores, potenciado por testosterona,
induce la diferenciación hacia condroblastos.
Los condrocitos sintetizan proteínas transportadoras de factores de crecimiento tipo insulina
1GFBP-3 e IGFBP-4, y existe una relación directamente proporcional entre las concentraciones de
estas proteínas transportadoras y la incorporación
de timidina a los ácidos nucleicos y la proliferación celular.
En el tejido adiposo, el factor de crecimiento
tipo insulina-1 estimula el transporte y la oxidación
de glucosa (es 50 veces menos potente que la insulina), así como la síntesis de lípidos (es 100 veces
menos potente que la insulina). En los fibroblastos
induce la síntesis de tropocolágena, con lo cual
aumenta la cantidad de material intercelular de
unión.
Factor de crecimiento tipo insulina-2
En apariencia el factor de crecimiento tipo insulina-2 no está regulado por hormona de crecimiento.
Sin embargo, en pacientes con deficiencia de esta
hormona aumentan las concentraciones del factor
al iniciar el tratamiento con la hormona de crecimiento humana, después del incremento de proteína transportadora de factor de crecimiento tipo insulina-3.
Los valores séricos del factor de crecimiento
tipo insulina-2 son mucho mayores durante el período fetal, y declinan durante el posnatal. Se ha
demostrado concordancia entre la velocidad de
expresión del desarrollo tisular y la cantidad de este
factor sintetizado; ello hace suponer su intervención
activa durante la fase de diferenciación celular.
En las células de la capa granulosa del ovario,
la síntesis del factor está inducida y regulada por la
37
hormona foliculostimulante, la gonadotropina coriónica humana y el dibutiril del cAMP; mientras
que en la glándula suprarrenal depende de la hormona suprarrenocorticotrópica y está mediada por
el dibutiril del cAMP.
Algunos tumores, entre ellos el de Wilms, neuroblastoma, hepatoblastoma, rabdomiosarcoma,
feocromocitoma y liposarcoma, son capaces de sintetizar de novo el factor de crecimiento tipo insulina-2, aunque no se ha podido determinar la función de éste en el desarrollo o crecimiento de la
neoplasia.
Receptores para el factor
de crecimiento tipo insulina
Existen dos clases de receptores: uno para el factor
de crecimiento tipo insulina-1 y otro para el del tipo
insulina-2. El primero está constituido por un heterotetrámero con gran homología para el receptor
de insulina; el segundo consiste en una cadena polipeptídica simple, idéntica a la del receptor catiónindependiente para el 6-fosfato de mañosa. Ambos
receptores están glucosilados y muestran reacciones cruzadas con el receptor para insulina, aunque
la afinidad para esta hormona es 100 veces menor.
El receptor para el factor de crecimiento tipo
insulina-1 está codificado en el cromosoma 15,
consta de 21 exones y ocupa un mínimo de 100
kilobases del ácido desoxirribonucleico del cromosoma; asimismo, se sintetiza como un precursor
proteínico de 1 367 aminoácidos que requiere un
rompimiento proteolítico para dar lugar a dos subunidades, alfa y beta (100 a 135 y 90 a 95 kDa,
respectivamente), unidas por puentes disulfuro. Los
exones 1 a 11 codifican para la unidad alfa y el sitio
de rompimiento proteolítico está contenido en el
exón 11; la unidad beta está codificada por los exones 12 a 15.
La subunidad alfa se localiza extramembrana,
y la porción codificada por el exón tres contiene la
porción rica en cisteínas, la cual en apariencia resulta crítica para la alta afinidad de unión con el
factor de crecimiento tipo insulina-1. La subunidad
beta está incluida en la membrana y contiene un
dominio tirosincinasa que se extiende hacia la región citoplásmica. La autofosforilación de la unidad beta a nivel de las tirosinas 1131, 1135 y 1136
promueve la actividad tipo tirosincinasa inherente
del receptor, y permite la fosforilación de otras tirosinas importantes.
La activación total del receptor requiere la dimerización de dos hemirreceptores alfa-beta. La
transmisión posreceptor produce estimulación de
la fosfolipasa C, que genera 1,2-diacilglicerol
38
Sección I • Bases para el estudio del crecimiento
y 1,4,5-trifosfato de inositol como segundo mensajero, y fosforilación de varias proteínas intracelulares.
El receptor para el factor de crecimiento tipo
insulina-1 se expresa de manera ubicua con concentraciones más elevadas durante el desarrollo del
embrión y de la organogénesis; su deficiencia en
animales de experimentación se relaciona con hipocrecimiento intrauterino y muerte neonatal (debido a insuficiencia respiratoria por infradesarrollo
de los músculos respiratorios y pulmón), así como
con pobre desarrollo cerebral y disminución de la
osificación.
Los receptores para los factores de crecimiento tipo insulina-1 y tipo insulina-2 (y 6-fosfato de
mañosa) se encuentran presentes en etapa temprana del embrión y se identifican en los organismos a
partir de su constitución por ocho células; los principales efectos de estos receptores son el aumento
en la captación de glucosa, la síntesis de ácido desoxirribonucleico, ácido ribonucleico y proteínas,
y el aumento en la proliferación celular.
El receptor para el factor de crecimiento tipo
insulina-2 se codifica en el cromosoma 19, y se
sintetiza como cadena proteínica simple con peso
molecular de 270 kDa. Este receptor es 92% extracelular y reconoce tanto a dicho factor como a 6fosfato de mañosa, el cual es particularmente necesario para el control de enzimas lisosómicas. Además, produce influjo de calcio a las células a través
de un canal catiónico dependiente de voltaje, así
como activación de fosfolipasa C con aumento de
trifosfato de inositol y 1,2-diacilglicerol; predomina en el sistema cardiovascular, sistema musculosquelético y pericondrio. Aparentemente, el alelo paterno no se expresa en la misma proporción que el
materno, en particular durante los estadios medio a
tardío de la gestación.
insulina, incluso en grado superior al de los receptores tisulares para los factores de crecimiento.
Las proteínas transportadoras de factor de crecimiento tipo insulina se encuentran en el ámbito
intersticial y unidas a las membranas celulares.
Debido a que la afinidad de estas proteínas por el
factor de crecimiento tipo insulina es mayor que la
de los receptores hacia éstas, los complejos formados por dicho factor y su proteína transportadora,
que se localizan en el ámbito intersticial, inhiben
los efectos biológicos de las hormonas, mientras
que aquellos complejos localizados en las membranas celulares los potencian en gran variedad de
células (con excepción de la proteína transportadora del factor de crecimiento tipo insulina-4).
Noventa y cinco por ciento de los factores de
crecimiento tipo insulina circula unido a sus proteínas transportadoras (90% a la proteína transportadora tipo 3). Esos factores sirven de reservorio, al
impedir la degradación y regular el efecto de factor
de crecimiento tipo insulina libre, ya que aumentan
su vida media a 14 a 18 horas y evitan que crucen
la membrana vascular; también regulan el efecto
hipoglucemiante y el crecimiento celular excesivo
(fig. 4-13).
Proteína transportadora-1 del factor
de crecimiento tipo insulina-1
La proteína transportadora-1 del factor de crecimiento tipo insulina-1 consta de 259 aminoácidos, tiene
peso molecular de 28.1 kDa y no requiere glucosilación para activarse. La proteína fosforilada inhibe la acción del factor que transporta (al afectar su
Proteínas transportadoras de factor
de crecimiento tipo insulina
Este grupo está constituido por proteínas séricas que
unen específicamente los factores de crecimiento
tipo insulina-1 y tipo insulina-2, pero no a la insulina, cuyos genes y secuencia de aminoácidos identificados corresponden por lo menos a nueve variantes; de éstas, sólo se han demostrado acciones
para seis, aunque se sabe que todas ellas poseen
una región aminoterminal rica en cisteínas y una
carboxiloterminal muy similares entre sí, aun entre
diversas especies, lo cual sugiere una evolución que
se caracteriza por duplicaciones génicas sucesivas.
La fosforilación aumenta la afinidad de la proteína
transportadora hacia el factor de crecimiento tipo
Fig. 4-13. Funciones de las proteínas transportadoras de
factores de crecimiento tipo insulina. A. Aumento de vida media en la circulación. B. Prevención de hipoglucemia inducida
por IGF (factor de crecimiento tipo insulina). C. Facilitación
del paso transvascular. D. Limitación de acción con receptor
tisular. E. Presentación al receptor ("pool" liberación lenta).
F. Efecto celular a través de sus propios receptores.
Capítulo 4 • Bases neuroendocrinas del crecimiento
asociación con la matriz y la polimerización de la
proteína transportadora, con lo cual aumenta su
vinculación con dicho factor y disminuye la forma
libre); en cambio, la forma no fosforilada potencia
esa acción, a pesar de que su afinidad es cuatro a
seis veces menor que la fosforilada.
La proteína transportadora se sintetiza en endometrio, decidua placentaria, células de la granulosa e hígado, y se encuentra presente en los líquidos folicular y amniótico así como en suero. Sus
concentraciones son elevadas al nacer y declinan
de manera paulatina hasta la pubertad, pero aumentan de manera transitoria durante episodios de hipoglucemia y en ayuno prolongado, así como durante el ejercicio físico intenso. La producción de
dicha proteína disminuye por aumento de la acción
de la insulina y se estimula por efecto del factor de
crecimiento tipo insulina-1; sin embargo, la insulina aumenta su paso al espacio extravascular.
Existen variaciones circadianas con valores
séricos más altos durante la noche, que se regulan
por la falta de luz solar y probablemente por la
relación entre melatonina y serotonina.
El efecto principal de la proteína transportadora es impedir las acciones del factor sobre el metabolismo (hipoglucemia) y el crecimiento (proliferación, y diferenciación), en particular en células
de la granulosa y neuronas.
En el ámbito del sistema nervioso central, la
proteína transportadora de factor de crecimiento tipo
insulina-1 tiende a inhibir el crecimiento mediado
por éste; en animales transgénicos que la producen
en exceso, el volumen cerebral y cerebeloso, así
como el tamaño de las células, el número y tamaño
de dendritas y axones, el tamaño del cuerpo neuronal, el número de células de Purkinje en el cerebelo
y la mielinización son significativamente menores
que en animales controles.
Los pacientes con ovarios poliquísticos relacionados con hiperinsulinismo tienen valores
disminuidos de la proteína transportadora (por elevación de insulina y de hormona foliculostimulante), lo cual permite concentraciones ováricas más
elevadas de factor de crecimiento tipo insulina-1
libre y aumenta la producción de andrógenos, con
lo que se inhibe el desarrollo y se facilita la atresia
folicular.
Proteína transportadora-2 del factor
de crecimiento tipo insulina-1
La proteína transportadora-2 del factor de crecimiento tipo insulina-1 consta de 289 aminoácidos;
su peso molecular es de 31.3 kDa y no requiere
glucosilación para activarse.
39
Se sintetiza en hígado, cerebro, ovario y endometrio, y tiene 10 veces más afinidad por el factor
de crecimiento tipo insulina-2 que por el tipo insulina-1.
Las concentraciones más elevadas se encuentran en la etapa fetal, en particular en el neuroepitelio del telencéfalo, células guales, plexos coroideos y neuronas con proyecciones retinianas a la
corteza cerebelosa y centros sensorios; en ese periodo de la vida parece estar regulada por el factor
de crecimiento tipo insulina-2. Las concentraciones séricas más bajas se han encontrado en ancianos y pacientes con deficiencia de hormona de crecimiento, aunque también se encuentran concentraciones bajas durante la pubertad. En ninguna
etapa del crecimiento humano se ha demostrado la
existencia de variaciones circadianas.
Las concentraciones séricas de esta proteína
aumentan por aplicación de insulina y factor de
crecimiento tipo insulina-1, al igual que durante
episodios transitorios de hipoglucemia y en algunos estados patológicos como insuficiencia hepática, insuficiencia renal crónica, y leucemia.
Inhibe de manera primaria la acción del factor
de crecimiento tipo insulina.
Proteína transportadora-3 del factor
de crecimiento tipo insulina-1
La proteína transportadora-3 del factor de crecimiento tipo insulina-1 está constituida por 264
aminoácidos; su peso molecular es de 28.7 kDa,
requiere glucosilación para activarse y es la más
importante de las proteínas transportadoras. Su asociación con una subunidad glucosilada acidolábil y
con factor de crecimiento tipo insulina da lugar a
un complejo de 150 kDa que permite la unión con
el receptor de dicho factor.
Se sintetiza, por acción directa de la hormona
de crecimiento, en hígado, fibroblastos, ovarios y
placenta. Sus valores circulantes son constantes
durante todo el día y, a diferencia de las otras proteínas transportadoras, sus valores aumentan de
modo progresivo desde la etapa neonatal hasta la
pubertad, para permanecer constantes durante la
vida adulta y decrecer en la senectud.
En niños y en adolescentes, la concentración
sérica de esta proteína parece tener una relación directamente proporcional con el grado de secreción
de hormona de crecimiento.
Aumenta la vida media del factor de crecimiento tipo insulina y potencia los efectos biológicos de
éste al facilitar su interacción con el receptor que le
corresponde. Sin embargo, el exceso de esta proteína en relación con el factor de crecimiento tipo insu-
40
Sección I • Bases para el estudio del crecimiento
lina-1 produce disminución notable de las acciones
de dicho factor; así lo evidencian estudios recientes:
1. Existe una relación inversamente proporcional
entre las concentraciones de la proteína transportadora-3 del factor de crecimiento tipo insulina-1 y la incorporación de timidina a nivel
de los ácidos nucleicos.
2. Las concentraciones de la proteína mayores a
100 ng/ml disminuyen la síntesis de ácido desoxirribonucleico, sin importar las concentraciones del factor de crecimiento tipo insulina-1.
3. La relación molar entre la proteína transportadora y el factor de crecimiento tipo insulina-1
menor a 0.7 se relaciona con cese del crecimiento, mientras que una relación mayor de
0.7 se asocia con lo contrario.
4. La máxima potencia inhibidora del crecimiento se localiza en una fracción de 16 kDa de la
molécula de la proteína transportadora.
5. La infusión de la proteína en cultivos celulares
bloquea el paso de la fase G-l del ciclo celular
a las fases S y G-2.
La unidad acidolábil está constituida por una
proteína de 552 aminoácidos (22% de los cuales son
leucina), tiene un peso de 84 a 86 kDa, y se une de
manera selectiva a la proteína transportadora-3
de factor de crecimiento tipo insulina-1, pero no al
un factor de crecimiento tipo insulina.
La mayor expresión de esta proteína se encuentra en bulbo olfatorio, cuerpos geniculados lateral
y dorsal, cóclea, núcleos vestibulares y lemnisco.
Proteína transportadora-6 del factor
de crecimiento tipo insulina-1
Esta proteína está constituida por 216 aminoácidos,
tiene un peso molecular de 22.8 kDa y requiere
glucosilación para activarse.
Se sintetiza sólo en etapa posnatal. Fija 70 veces
con más avidez el factor de crecimiento tipo insulina-2 que el tipo insulina-1 e inhibe la bioactividad de ambos.
Proteasas de proteína transportadora
de factor de crecimiento tipo insulina
Estas proteasas degradan a la proteína transportadora y alteran su afinidad de unión y, por tanto, la
distribución del factor de crecimiento tipo insulina.
Asimismo, se les ha encontrado en el suero de
mujeres en gestación y de pacientes con enfermedades graves, así como en neoplasias y en la insensibilidad a hormona de crecimiento.
La proteasa para proteína transportadora-4 del
factor de crecimiento tipo insulina-1 se activa por
el factor de crecimiento tipo insulina-2 (fig. 4-14).
La duración de las acciones de los factores de
crecimiento tipo insulina depende en particular de
Proteína transportadora-4 del factor
de crecimiento tipo insulina-1
La proteína transportadora-4 del factor de crecimiento tipo insulina-4 consta de 237 aminoácidos,
tiene un peso molecular de 26.3 kDa y requiere glucosilación para activarse.
Se sintetiza en hígado, cerebro, ovario y hueso, parcialmente en respuesta al factor de crecimiento tipo insulina-1. Inhibe la bioactividad de los factores de crecimiento tipo insulina-1 y 2.
Proteína transportadora-5 del factor
de crecimiento tipo insulina-1
La proteína transportadora-5 del factor de crecimiento tipo insulina-1 está constituida por 252 aminoácidos, tiene un peso molecular de 28.6 kDa y
requiere glucosilación para activarse.
Se le ha identificado en líquido folicular. Fija
varias veces con más facilidad al factor de crecimiento tipo insulina-2 que al tipo insulina-1; pero
inhibe la bioactividad de ambos factores, aunque
a nivel neuronal potencia los efectos del tipo insulina-1.
Fig. 4-14. Sistema de la hormona de crecimiento y factores de crecimiento tipo insulina (IGF).
Capítulo 4 • Bases neuroendocrinas del crecimiento
la acción de las proteasas; aunque los efectos de
éstas y su regulación no se han demostrado con plenitud, sí se sabe que a mayor actividad de éstas existe
menor efecto de estos mediadores (factores) del sistema de la hormona de crecimiento.
FACTORES DE CRECIMIENTO
AUTOCRINOS Y PARACRINOS
Factor de crecimiento epidérmico
El factor de crecimiento epidérmico es un polipéptido lineal con peso molecular de 6 kDa. Se ha
descrito su efecto mitogénico sobre células mesenquimatosas y su efecto proliferativo sobre la mayoría de los epitelios. Su acción se realiza durante la
fase G-l temprana del ciclo celular, al permitir que
la célula progrese a la fase S y pueda iniciar la síntesis de ácido desoxirribonucleico.
Factor transformador beta
El factor transformador beta posee tres formas isoméricas (beta-1, beta-2 y beta-3), cada una de ellas
con peso molecular de 25 kDa. Es un potente inhibidor de la proliferación epitelial, ya que altera el
estado de fosforilación de las proteínas (enzimas)
reguladoras de la síntesis de ácido desoxirribonucleico. En la matriz ósea, su principal efecto consiste en aumentar la producción de colágena tipo I
y de fíbronectina por los fibroblastos; también induce la formación de condrocitos a partir del mesénquima embrionario.
Factor de crecimiento derivado de plaquetas
Este factor siempre se encuentra como un heterodímero A-B, y la cadena B es análoga al producto del
oncogén v-sis. Tiene efecto mitogénico sobre células mesenquimatosas.
Como factor de regeneración tisular tiene acciones que pueden dividirse en:
1. Autocrinas. Las células mesenquimatosas, pocos minutos después de endocitar al factor,
muestran incremento de la fosforilación de tirosina y de otras proteínas con contenido elevado de treonina y serina. Asimismo, ese factor aumenta el recambio de ácido araquidónico y la producción de prostaciclinas y prostaglandinas de las series E y F. También favorece la captación de aminoácidos y la acción de
la bomba de sodio y potasio. También aumen-
41
ta el número de sus propios receptores en la
célula que lo secretó, y se le ha implicado en el
incremento de adhesividad plaquetaria, la liberación de linfocinas y la división celular acelerada que se observan en procesos de regeneración tisular.
2. Paracrinas. El factor puede ser liberado por
plaquetas activadas, macrófagos y células musculares lisas. Sus efectos se relacionan con estimulación de la formación del tejido conjuntivo. En las primeras dos horas de secretado al
medio extracelular existe un aumento en la quimiotaxis de fibroblastos, células mononucleares y células musculares lisas. Durante las 24
horas siguientes, se produce un aumento de la
proliferación celular y de la viabilidad de las
células periféricas a la lesión. De esta manera,
favorece los mecanismos de reparación del
daño tisular y del control de posibles agentes
patógenos que pudieran comprometer el proceso de cicatrización.
3. Endocrinas. Recluta células en reposo e inicia su mitosis, facilitando además la acción de
diversas sustancias mitógenas, al aumentar la
síntesis de los factores de crecimiento en cada
una de ellas. Por otro lado, aumenta la síntesis
de proteínas transportadoras específicas de diversos factores de crecimiento. En el ovario,
se ha demostrado que su acción favorece el crecimiento y maduración del folículo dominante
y que detiene el crecimiento y maduración de
los folículos secundarios.
Factor de crecimiento de los fibroblastos
El factor de crecimiento de los fibroblastos forma
parte de una familia de péptidos de por lo menos
ocho miembros, con peso molecular de 18 a 26 kDa.
Se une con avidez a las glucosaminas acídicas sulfatadas, como el sulfato de heparán y el sindecán.
Su actividad mitogénica es en extremo potente para
células del tejido conjuntivo y constituye en esencia un agente angiogénico.
Aparece en la vida embrionaria, inmediatamente antes de la organogénesis y es producido por endodermo, mesodermo primitivo, bolsas faríngeas y
neuroepitelio cerebral. Induce el desarrollo de mesodermo en el polo ectodérmico primitivo y contribuye a la alta densidad capilar uterina alrededor del
sitio de implantación.
Durante la migración de células precursoras del
músculo, favorece la secreción de ácido hialurónico que las cubre a manera de saco; así evita su interacción con otras células y facilita su migración
por el mesénquima, hasta su sitio definitivo.
42
Sección I • Bases para el estudio del crecimiento
Factor de crecimiento nervioso
El factor de crecimiento nervioso es un péptido
dibásico de 13 kDa, que muestra 25% de homología estructural con las cadenas A y B de la insulina.
Consta de dos subunidades alfa (necesarias para el
reconocimiento por su receptor de membrana), dos
beta (las cuales se internalizan unidas al receptor,
en presencia de altas concentraciones de zinc, y de
las que dependen las funciones biológicas), y una
gamma (con actividad catalítica para separar las alfa
de las beta).
Su efecto predominante es promover la supervivencia, diferenciación y crecimiento del ectodermo; aunque también posee efecto mitogénico sobre tejido linfoide.
En el tejido nervioso simpático eleva el número de neuronas, al acelerar la velocidad de duplicación celular y el crecimiento y diferenciación de
los precursores neuronales; favorece el crecimiento axónico y aumenta la velocidad de síntesis de
neurotransmisores (fig. 4-15).
En el sistema nervioso central las acciones
comprobadas del factor de crecimiento nervioso
son:
1. Aumenta el número de dendritas en neuronas,
así como el crecimiento de éstas y de axones,
con lo cual favorece su orientación espacial y
facilita el contacto de las terminaciones ner-
viosas entre sí; asimismo, de manera conjunta
con triyodotironina, favorece la síntesis de desmosomas (estructuras de reconocimiento axodendrítico o dendrodendrítico) e induce la organización de la compleja red neuronal de la
corteza cerebral, núcleos básales e hipotálamo.
2. Aumenta la supervivencia neuronal, aun en
condiciones hipóxicas.
3. Facilita el transporte retrógrado de las neuronas sensitivas (de la dendrita hacia el axón),
ganglios de la retina y neuronas de la corteza
cerebral.
4. Acelera la diferenciación de precursores neuronales, y una vez que ésta se completa, aumenta la síntesis de neurotransmisores. No se
ha demostrado que las neuronas que se encuentran bajo el efecto del factor de crecimiento nervioso sinteticen algún neurotransmisor en particular; así, parece que dicho factor facilita la
lectura del ácido ribonucleico mensajero, mas
no determina el tipo de éste que se produce en
cada extirpe neuronal.
Algunos estudios han sugerido que este factor
desempeña una función importante en el desarrollo
de tumores del tipo de neuroblastomas, gliomas y
sarcomas. En particular, se ha demostrado que el
bloqueo farmacológico de su acción produce involución de neuroblastomas y gliomas, y acelera la
diferenciación del neuroblastoma transformándolo
Fig. 4-15. Acciones del factor de crecimiento nervioso (FCN).
Capítulo 4 • Bases neuroendocrinas del crecimiento
de manera progresiva en ganglioneuroblastoma,
ganglioneuroma, e incluso desapareciéndolo.
Desde el punto de vista embriogénico, acelera
la apertura palpebral del embrión, la erupción dentaria y la cicatrización corneal; esto último aun en
adultos. Favorece la fusión de los procesos palatinos al aumentar la producción de ácido hialuronico
y evita entonces el paladar hendido. Además, induce la formación de la yema traqueal y la morfogénesis bronquial; está involucrado en la proliferación del pericardio, la formación de la cápsula renal y la de los conductos biliares (intrahepáticos y
extrahepáticos), y favorece la síntesis de factor surfactante por los neumocitos tipo II.
Vitamina D
La vitamina D3 (1,25-dihidroxicolecalciferol) actúa como factor de crecimiento en la remodelación
e inmunorregulación óseas. Los principales efectos descritos son (fig. 4-16):
1. Acelera la diferenciación de linfoblastos y monoblastos en linfocitos "T" y monocitos, e induce la producción y secreción de linfocinas
por éstos; dichas linfocinas actúan como factores quimiotácticos de monocitos y macrófagos.
2. Aumenta la diferenciación de monocitos y macrófagos en osteoclastos, tanto de manera directa como a través de aumento en la genera-
43
ción del factor de resorción ósea secretado por
osteoblastos.
3. Aumenta la producción del factor esquelético
por los osteoclastos al acelerar la velocidad de
regeneración y multiplicación de osteoblastos;
también acelera la diferenciación de los precursores de osteoblastos y de ese modo incrementa el número de osteoblastos maduros.
4. Existe una correlación directamente proporcional entre la masa ósea y las concentraciones de
vitamina D3. En recién nacidos se ha observado lo siguiente:
A. En 75 a 85% de niños que nacen en invierno se encuentran valores inferiores a los
descritos como fisiológicos, y una masa
ósea de sólo 73 a 85% con respecto a la
ideal; en cambio, sólo se observan valores
subnormales en 22% de quienes nacen en
verano, y la masa ósea es superior a 91%
con respecto a la ideal.
B. En 85% de los recién nacidos pequeños
para la edad gestacional, las concentraciones de vitamina D3 son subnormales y la
masa ósea es inferior al 70% de la ideal en
comparación con lo que sucede en aquéllos sin retraso de crecimiento intrauterino
que muestran valores normales de la vitamina en 100% de los casos y cuya masa
ósea es superior a 90% con respecto a la
ideal.
Fig. 4-16. Remodelamiento e inmunorregulación óseas dependientes de vitamina 1,25(OH)2 Dj y sus receptores.
44
Sección I • Bases para el estudio del crecimiento
5. Cuando las concentraciones de vitamina D3 son
normales, la masa ósea es directamente proporcional a la ingestión de calcio, al peso y al
ejercicio realizado contra la fuerza de gravedad (correr, saltar, gimnasia, etc.); en cambio,
un ejercicio que no conlleva resistencia gravitacional, como la natación, no produce incre
mento adicional de la masa ósea.
6. Los niños con baja ingestión de calcio, que realizan actividades físicas antigravitacionales,
muestran disminución progresiva de masa ósea,
sin importar su peso.
7. La masa ósea de mujeres lactantes se ha visto
reducida durante los primeros tres meses de este
periodo y recuperada a los nueve meses, sin
que exista una correlación con las concentraciones séricas de vitamina D3. Sin embargo,
en estados poslactancia, las concentraciones de
esa vitamina aumentan de manera significativa, lo cual no ocurre en mujeres que no proporcionan alimentación al seno materno.
DIFERENCIACIÓN Y CRECIMIENTO
ÓSEOS
La génesis del tejido óseo se inicia con la condensación del mesénquima sobre el que actúan una
serie de proteínas morfogénicas óseas y los factores: de mantenimiento del ectodermo apical, de crecimiento derivado de plaquetas y de crecimiento
derivado del hueso. La acción conjunta de estos
factores de crecimiento, producidos por células mesenquimatosas, transforma a éstas en un "cordón
ectodérmico apical". Cuando las condiciones del
medio están dadas por una vascularidad aumentada, con aporte de oxígeno en suficientes cantidades, y falta tensión mecánica del cordón ectodérmico, las células que conforman a éste sintetizan
colágena y tropocolágena y se transforman en osteoprecursores. Por el contrario, cuando existe disminución de la vascularidad y consecuente tensión
superficial de oxígeno baja que además se relaciona con una tensión mecánica aumentada, las
células mesenquimatosas sintetizan glucosaminoglucanos y receptores para la paratohormona, bajo
cuyas influencias se diferencian en condroprecursores (fig. 4-17).
La influencia permisiva de las hormonas estimulante de la tiroides y del crecimiento, así como
de la testosterona, posibilita que los osteoprecursores generen el "principio inductor óseo", el cual
acelera la diferenciación y duplicación de los propios osteoprecursores y los transforma en osteoblastos; éstos a su vez generan cuatro factores de creci-
Fig. 4-17. Formación de las células precursoras de los osteocitos y condrocitos.
Capítulo 4 • Bases neuroendocrinas del crecimiento
miento, cada uno con funciones específicas (fig.
4-18):
1. Factor de crecimiento derivado del hueso. En
las células mesenquimatosas, este factor acelera la duplicación y replicación del ácido desoxirribonucleico, a través del cual se aumentan, entre otros, los proteoglucanos.
2. Factor de crecimiento esquelético. Este favorece la síntesis de ácido desoxirribonucleico por
osteoblastos.
3. Factor de crecimiento derivado del cartílago.
Aumenta la incorporación de sulfato, y de ese
45
modo se incrementa la formación de las sustancias sulfatadas de la matriz orgánica (sulfatos de condroitina y queratán).
4. Interleucina-1. Induce mitosis en los condrocitos y proosteoblastos, los cuales generan colágena inmadura.
Bajo el efecto de tales factores, los osteoblastos
producen hidroxiapatita (base de la matriz mineral
del hueso) y colágena (base de la matriz orgánica
del hueso). Además, se favorece la glucogenólisis
que por un lado genera glucosa para el metabolismo intermediario de los osteoblastos, y por el otro
Fig. 4-18. Factores involucrados en la formación del tejido óseo. TSH = hormona estimulante de la tiroides; GH = hormona del
crecimiento; T2 = diyodotironina; FAI = fosfatasa alcalina inactiva; FAA = fosfatasa alcalina activa.
46
Sección I • Bases para el estudio del crecimiento
Fig. 4-19. Factores que participan en la formación de matriz orgánica del hueso.
radicales fosfato libres que se unen a la fosfatasa
alcalina inactiva y la transforman en activa. Esta, a
su vez, estabiliza los cristales de hidroxiapatita con
lo cual favorece la maduración de la matriz mineral
que dará origen al hueso, y también aumenta la formación de periostio a partir de la matriz orgánica
(fig. 4-18).
La colágena producida por los osteoblastos es
inmadura, y bajo la acción de la triyodotironina (T3) modifica las uniones cruzadas para transformarse en madura. La existencia de esta colágena madura, y a través de la función permisiva de
la testosterona, acelera el proceso de diferenciación del osteoblasto en osteocito. Esta célula se
Fig. 4-20. Factores involucrados en la formación del condrocito.
Capitulo 4 • Bases neuroendocrinas del crecimiento
encarga del mantenimiento fisiológico de la matriz orgánica y de la síntesis de mucopolisacáridos sulfatados, básicamente sulfato de condroitina-A y sulfato de queratán, ambos necesarios para
la formación adecuada de la matriz orgánica (fig.
4-19).
Cuando el cordón ectodérmico apical de células mesenquimatosas se diferencia hacia condroprecursores, éstos sintetizan factor inductor del cartílago, el cual en forma conjunta con el factor de
crecimiento tipo insulina-1 induce la diferenciación
de los propios condroprecursores hacia condroblastos. A su vez, estos condroblastos se diferencian a
condrocitos ante el estímulo de los factores transformador del crecimiento y de crecimiento derivado del cartílago, este último producido por osteoblastos circulantes (fig. 4-20). Los condrocitos
forman cartílago bajo la acción de tres factores de
crecimiento (fig. 4-21):
47
1. Factor de crecimiento derivado del hueso. Lo
producen células mesenquimatosas y osteoblastos, y regula la vascularización del tejido en
desarrollo.
2. Factor derivado del cartílago. Se sintetiza por
los mismos condrocitos; aumenta la incorpo
ración de sulfato, la síntesis de proteoglucanos, ácido desoxirribonucleico y colágena, y
favorece la proliferación de los propios con
drocitos.
3. Factor de crecimiento derivado del cartílago.
Lo producen osteoblastos y condroblastos; re
gula el crecimiento lineal (condensación y moldeamiento del endocondrio) y la osificación
endocondral.
El cartílago, bajo la acción de la triyodotironina y el efecto directo de osteoblastos (que se producen por diferenciación de monocitos inducida por
Fig. 4-21. Factores que participan en la formación del cartílago de crecimiento.
48
Sección I • Bases para el estudio del crecimiento
la vitamina D3, y diferenciación de osteoblastos
regulada por el factor de resorción osteoblástico), origina el disco epifisario y luego el disco de
crecimiento, así como también la médula ósea.
La acción de la testosterona sobre el disco de crecimiento, acelera la sinostosis episodiafisaria, es decir la calcificación del disco de crecimiento, con cese
del crecimiento longitudinal de los huesos largos
(fig. 4-21).
Cuando durante la vida del hueso se produce
una fractura, la formación y mineralización de la
matriz proteínica del hueso (para regenerar la cantidad y calidad del tejido óseo) depende de la acción de los siguientes factores (fig. 4-22):
1. Osteonectina. Une colágena y mineral orgánico.
2. Osteocalcina. Inhibe la mineralización de la
matriz orgánica y atrae mononucleares que se
transformarán en osteoclastos bajo la acción de
la vitamina D3, e iniciarán el proceso de reabsorción ósea.
3. Proteoglucanos libres. Inducen a los precursores óseos a transformarse en osteoblastos, y
así aumenta la actividad osteoblástica.
4. Proteína morfogénica ósea. Funciona como
quimioatrayente de células mesenquimatosas
y favorece la proliferación de células periósticas.
5. Factor transformador del crecimiento, factor
de crecimiento epidérmico y factor de crecimiento derivado de plaquetas. Producen aumento en la síntesis de colagenasa, que acelera
la desmineralización del hueso y favorece la
remodelación ósea.
En resumen, es evidente que la regulación neuroendocrina del crecimiento es muy compleja; en
la actualidad su estudio es sólo parcial, y seguramente se requerirán muchos años más para poder
comprenderla. Sin embargo, debe quedar claro que
el crecimiento y la diferenciación de cada célula,
clona celular, tejido, órgano y sistema, dependen
de la interacción de varios factores inductores del
desarrollo y proliferación; cada uno de éstos actúa
en un "momento" crítico de la evolución orgánica,
el cual está determinado por la dirección, el ritmo
y la velocidad de crecimiento que se codifican de
modo genético a partir de la fecundación del óvulo.
La capacidad de respuesta de una célula a uno
o más factores de crecimiento depende de las condiciones intracelulares y extracelulares, de la existencia de receptores específicos para cada factor,
de la interacción del complejo "factor de crecimien-
Fig. 4-22. Mecanismos de reparación de las fracturas óseas.
Capítulo 4 • Bases neuroendocrinas del crecimiento
to-receptor" con organelos intracelulares y el genoma, así como de los efectos facilitadores o inhibidores de otros factores de crecimiento que actúan
en ese "momento" sobre la célula.
LECTURAS RECOMENDADAS
Argente J, Chowen JA. Neuroendocrinology of growth
hormone secretion. Growth 1994;10:l.
Argente J, Pérez LAJ. Alteraciones genéticas de la hormona
de crecimiento. En: Calzada RL (ed). El sistema de la
hormona de crecimiento. México: Bermúdez, 1995:31.
Berg MA, Argente J, Charnausek S, Gracia R, Guevara JA,
Hopp M et al. Diverse growth hormone receptor gene
mutations in Laron syndrome. Am J Hum Genet 1993;
52:998.
Berneis K, Keller U. Metabolic actions of growth hormone:
direct and indirect. Bailliére's Clin Endocrinol Metab
1996;10:337.
Calzada RL. Deficiencia de hormona de crecimiento: Características clínicas y auxológicas. En: Calzada RL (ed).
El sistema de la hormona de crecimiento. México:
Bermúdez, 1995:105.
Carlsson LMS, Rosberg S, Vitangcol RV, Wong WLT,
Albertsson KW. Analysis of 24-hour plasma profiles of
growth hormone (GH)-binding protein, GH/GH-bindig
protein-complex and GH in healthy children. J Clin
Endocrinol Metab 1993;77:356.
Casanueva F. Physiology of growth hormone secretion and
action. Endocrinol Metab Clin North Am 1992;21:483.
Cogan JD, Phillips JA, Sakati NA, Frisch H, Schoeber E,
Milner D. Heterogeneous growth hormone (GH) gene
mutations in familial GH deficiency. J Clin Endocrinol
Metab 1993;76:1224.
Copeland KC, Nair KS. Acute growth hormone effects on
amino acid and lipid metabolism. J Clin Endocrinol
Metab 1994;78:1040.
Cunningham BC, Ultsch M, de Vos AM et al. Dimerization
of the extracellular domain of the human growth hormone receptor by a single hormone molecule. Science
1991;254:821.
Darnell JE, Kerr IM, Stark GR. Jak-STAT pathway and transcriptional activation in response to IFNs and other
extracellular signaling proteins. Science 1994;264:1415.
Dempster DW, Cosman F, Parisién M, Shen V, Lindsay R.
Anabolic actions of parathyroid hormone in bone.
Endocr Rev 1993;14:690.
Devesa J, Arce V, Lois N, Tresguerres JAF, Lima L. Alpha2-adrenergic agonism enhances the growth hormone
49
response to GH-releasing hormone through an inhibition of hypothalamic somatostatin release in normal
men. J Clin Endocrinol Metab 1990;71:1581.
Fraser T, Gavien JR, Daughaday WH. Growth hormone
dependent growth failure. J Pediatr 1982;101:12.
Frohman LA, Jansson JO. Growth hormone-releasing hormone. Endocrine Review 1986;7:223.
Frohman LA. Growth hormone physiology in health and
disease: insights using genetic and transgenic models. J
Pediatr Endocrinol Metab 1996;9:233.
Guevara JA, Vasconez O, Martínez V, Martínez AL, Rosenbloom AL, Diamond FB, Nonoshita L, Rosenfeld RG.
Insensibilidad a la hormona de crecimiento. En: Calzada RL (ed). El sistema de la hormona del crecimiento.
México: Bermúdez, 1995:77.
Jorgensen JO. Human growth hormone replacement therapy,
pharmacology and clinical aspects. Endocrine Review
1991;12:189.
Moller J, Jorgensen JO, Moller N et al. Effects of growth
hormone administration on fuel oxidation and thyroid
function in normal man. Metabolism 1992;41:728.
Pérez LAJ, Argente J. Molecular basis of familial growth
hormone deficiency. Horm Res 1994;42:189.
Pérez LAJ, Phillips JA, Franke U. Exclusion of growth
hormone-releasing hormone gene mutations in familial
isolated growth hormone deficiency by linkage and
single strand conformation analysis. J Clin Endocrinol
Metab 1994;78:622.
Postel MCV, Kelly PA. Growth hormone receptor signalling. Bailliére's Clin Endocrinol Metab 1996;10:323.
Postel MCV. Growth hormone receptor/binding proteinclinical implications. J Pediatr Endocrinol Metab 1996;
9:279.
Rosenfeld RG, Rosenbloom AL, Guevara JA. Growth hormone (GH) insensitivity due to primary GH receptor
deficiency. Endocrine Review 1994;15:369.
Theill LE, Karim M. Transcriptional control of growth
hormone expression and anterior pituitary development.
Endocr Rev 1993:14:670.
Veldhuis JD. New modalities for understanding dynamic
regulation of the somatotropic axis. J Pediatr Endocrinol
Metab 1996;9:237.
Wolf RF, Heslin MJ, Newman E et al. Growth hormone and
insulin combine to improve whole-body and skeletal
muscle protein kinetics. Surgery 1992; 112:284.
Zadik Z, Chalew SA, Kowarski A. Assessment of growth
hormone secretion in normal stature children using 24hour integrated concentration of GH and pharmacological stimulation. J Clin Endocrinol Metab 1990;71:932.
Capítulo
5
Factores que modifican
el crecimiento
El crecimiento es un fenómeno multifactorial e irreversible que ocurre en todo el organismo, pero cuya
expresión puede modificarse en diversas situaciones, de modo que se impida la progresión óptima
hacia un tamaño final adecuado y acorde con las
características genéticas.
Los factores modificadores son aquellos que
de manera intrínseca, o por su relación con otros,
limitan la expresión de las características genotípicas de un individuo para un momento determinado
y, por tanto, producen un efecto deletéreo sobre el
crecimiento.
La intensidad de la interrupción del crecimiento
es directamente proporcional a la gravedad y duración del estado patológico que la provoque, así
como al momento en que actúe. Por ejemplo, una
limitación de 50% del crecimiento durante un año,
repercute en la estatura definitiva según la edad: si
el individuo la padece durante el primer año de vida,
con crecimiento medio de 25 cm por año es probable que alcance una estatura final 12.5 cm menor
de la esperada; pero si el trastorno se presenta entre
los 6 y 7 años de edad, con crecimiento promedio
de 6 cm por año, disminuirá sólo 3 cm la expectativa de estatura final.
Aunque un factor limitante del crecimiento, sin
importar su duración, produce un efecto similar, sólo
aquéllos presentes durante más de dos a tres meses
repercuten de manera significativa en la estatura
final; por esta razón, en el abordaje de un paciente
con estatura baja por lo general se descartan a priori
las enfermedades agudas. Por ejemplo, una inflamación viral de vías respiratorias superiores (gripe) en un niño de cuatro años, con duración de tres
a cinco días, limita el crecimiento de manera insig50
nificante, ya que en este periodo, y aun cuando sólo
se exprese 50% del crecimiento, se perderían como
máximo 0.5 mm.
Los factores modificadores del crecimiento
pueden abordarse de acuerdo con dos grandes categorías: los factores socioeconómicos y culturales, y los problemas orgánicos.
FACTORES SOCIOECONÓMICOS
Y CULTURALES
A diferencia de los factores determinantes (genéticos y neuroendocrinos), los factores modificadores
de tipo socioeconómico y cultural no se heredan,
pero sí se transmiten de padres a hijos; por tanto,
pueden producir lesión en el crecimiento de una o
varias generaciones consecutivas de la misma población geopolítica (decremento secular del crecimiento). Esto condujo a considerar que la herencia
social se suma a la herencia biológica de un individuo.
Por el contrario, la acción favorable del medio
es más difícil de evaluar, en especial en lo individual. No obstante, en el ámbito colectivo es posible
apreciar el incremento secular del crecimiento ocurrido en países que han modificado las condiciones
sociales y nutricias de la población y en los cuales
las nuevas generaciones alcanzan mayor estatura
que la de sus padres y abuelos como resultado de
una menor alteración en la velocidad y el ritmo del
crecimiento que permite mejorar la expresión de su
capacidad genética de crecimiento (figs. 5-1 a 5-3).
De manera práctica, se puede decir que los
factores sociales modificadores alteran el crecimiento a través de sus repercusiones individuales o con-
Capítulo 5 • Factores que modifican el crecimiento
51
Fig. 5-2. Modificaciones familiares en el epigenotipo de
talla: obsérvese que los abuelos tienen mayor estatura que el
padre, y que los hijos han expresado mejor su capacidad de
crecimiento que éste.
Fig. 5-1. Incremento secular del crecimiento: la hija ha
alcanzado una mayor estatura de la que tienen los padres, al
mejorar las condiciones ambientales.
La nutrición de una población es directamente
proporcional al grado de tecnología social alcanzado, el cual a su vez depende del nivel educacional
y cognoscitivo de dicha población, así como de la
capacidad de desarrollo de sus integrantes (fig. 5-4).
Con base en lo anterior, los factores modificadores se dividen para su estudio en aquellos que
afectan:
juntas en la capacidad de nutrición adecuada de la
población. Es decir,
la existencia de un sistema social inadecuado,
que se mantiene durante generaciones consecutivas en la misma población, limita la disponibilidad de bienes y servicios, y provoca
efectos deletéreos sobre la nutrición
Aún más, esas mismas condiciones de vida
pueden disminuir la oportunidad de recibir estimulación social adecuada y de ese modo limitan el
desarrollo personal de los integrantes de la comunidad.
Los individuos en periodos críticos del crecimiento (del nacimiento a los dos años, la pubertad,
la gestación y la lactancia) y con mayores requerimientos nutricios son los que pueden afectarse con
más facilidad por padecimientos muy frecuentes en
la región. En sociedades preindustriales y en grupos sociales marginados, la frecuencia y prevalencia de alteraciones en el crecimiento son más altas.
Fig. 5-3. Aumento secular del crecimiento. La hija tuvo una
mayor estatura al mejorar las condiciones nutricias.
52
Sección I • Bases para el estudio del crecimiento
naturales utilizados. En lo individual, el uso de la
tecnología permite que el tiempo empleado en la
satisfacción de las necesidades primarias no interfiera con las actividades educativas, recreativas y
sociales.
Una sociedad con carencia total o parcial de la
aplicación sistemática de la tecnología moderna,
determina que un porcentaje elevado de sus integrantes obtenga ingresos económicos inadecuados
y bajo poder adquisitivo; a esto debe sumarse la
posibilidad de que la producción de alimentos básicos sea insuficiente para cubrir las necesidades
nutricias mínimas indispensables y, en consecuencia, se limite el crecimiento y el desarrollo de todos
sus constituyentes (fig. 5-5).
Cuando el tiempo usado y la remuneración del
trabajo supone para cada individuo una capacidad
económica apenas suficiente para cubrir necesidades mínimas, es difícil que pueda proporcionar a
su familia una habitación con adecuadas condiciones higiénicas; de ese modo, se mantiene la prevalencia de enfermedades infectocontagiosas que, ante
el aumento de demandas energéticas necesarias para
la reparación tisular, disminuyen el crecimiento de
los sobrevivientes. Si el Estado carece de recursos
Fig. 5-4. La nutrición de una población es directamente
proporcional al grado de tecnología social alcanzado y condiciona los niveles educacional y cognitive
1. El desarrollo tecnológico.
2. El nivel educacional.
3. La capacidad de desarrollo individual.
Estos factores, solos o en conjunto, limitan la
capacidad económica de la familia y de la población; de ese modo originan, según la Oficina de
Censos de Estados Unidos de América, un estado
de pobreza que se define como aquel conjunto de
situaciones que ocasionan que el costo de la alimentación sea mayor a 33% de los ingresos familiares, lo cual produce un índice bajo de capacidad
económica. Los ingresos familiares se determinan
por el registro del total aportado en un año, tanto
en efectivo como en especie, y el costo total de una
alimentación adecuada se calcula a partir del monto económico necesario para asegurar una dieta suficiente y económica.
Desarrollo tecnológico
La tecnología representa la capacidad para disminuir el esfuerzo de la producción (mediante el uso
de los conocimientos obtenidos por investigación)
y con ello mejorar el rendimiento de los recursos
Fig. 5-5. La falta de tecnología causa bajo poder adquisitivo, alimentación inadecuada y educación insuficiente y, en
consecuencia, ocurre limitación del crecimiento y desarrollo.
Capítulo 5 • Factores que modifican el crecimiento
necesarios para invertir en el saneamiento ambiental y en la promoción de la salud a través de campañas educativas, no sólo se permite el mantenimiento de condiciones inadecuadas de vida, sino
que continúan sin modificarse los conceptos "tradicionales" de salud y enfermedad, y los individuos
aceptan como "normales" las circunstancias "habituales" de vida y, por tanto, son incapaces de transformarlas.
Nivel educacional
La escolaridad del "jefe de la familia" influye de
manera significativa en su ocupación, su nivel económico y su capacidad adquisitiva resultante, al
igual que en el estado nutricio de la familia y en la
posibilidad de que sus hijos expresen el potencial
óptimo de crecimiento.
La escolaridad en la madre determina la actitud que ésta adopte ante la necesidad de vigilar el
crecimiento y el desarrollo de sus hijos, la capacidad para utilizar los recursos económicos en el diseño de una alimentación suficiente y adecuada que
permita un buen estado nutricio, y la preocupación
por mantener condiciones de higiene adecuadas.
Muchas veces los hijos abandonan la escuela a
edades tempranas para convertirse en "aportadores",
ante la falta de condiciones económicas que permitan continuar su educación; la mayoría de ellos
consigue subempleos poco remunerativos, debido
a su bajo nivel escolar y, por tanto, la capacidad de
superación educativa personal se detiene en forma
prácticamente absoluta e irreversible. El abandono
precoz de la escuela y el consecuente "seudoanalfabetismo" implican que los menores asuman por
necesidad conductas sociales propias de los adultos y responsabilidades inadecuadas para su edad.
La posibilidad de matrimonios a edades tempranas, y con cónyuges que también posean educación formal incompleta, aumenta de modo notable;
así se "transmite" la incapacidad para mejorar las
condiciones sociales y ambientales. Asimismo, una
madre que haya vivido en condiciones de saneamiento inadecuado, no sólo las permitirá en su casa,
sino que será incapaz de percibir las necesidades
higiénicas reales de sus hijos y con ello aumenta la
probabilidad de infecciones.
Por otro lado, ocurre que la falta de educación
formal de los padres mantiene modelos inadecuados de educación para los hijos, con falta de estimulación psicomotriz en etapas críticas del desarrollo neuronal. Cuando a ello se suma que la nutrición inadecuada in útero o en los dos primeros años
de vida puede producir modificaciones estructurales y funcionales en la corteza cerebral, es fácil com-
53
prender por qué algunos de estos niños evidencian
incapacidad para resolver problemas que implican
integración de funciones complejas; en términos
reales, esto determina la existencia de disfunción
cerebral, la cual puede no reconocerse cuando la
actividad que se desarrolla de manera rutinaria sólo
requiere de actividad muscular repetitiva.
Dado que la educación escolar tradicional no
aporta conocimientos actualizados en relación con
el grado de competencia profesional requerido, los
padres que crecen en esas condiciones son incapaces de exigir las modificaciones necesarias, ya sea
porque no las perciben o porque tienen dificultades
para entenderlas. Los pocos que completen una educación formal ocupan puestos laborales con una remuneración económica mayor y educan a sus hijos
bajo conceptos más adecuados que posibilitan un
desarrollo psicomotriz óptimo; pero con frecuencia alientan que el resto de la población ocupe niveles laborales bajos, mal remunerados y con escasa posibilidad de superación, lo cual determina el
mantenimiento de una sociedad de "clases socioculturales" (fig. 5-6).
Se permiten así "conductas y opciones limitadas de superación" características de familias, vecindarios y grupos étnicos, que determinan modelos educativos insuficientes para el país y perpetúan el "subdesarrollo".
Capacidad de desarrollo individual
En las sociedades "subdesarrolladas", la capacidad
genética de aprendizaje se desarrolla de manera
incompleta cuando las soluciones a los problemas
prioritarios se encaminan sólo a mejorar temporal
y parcialmente las condiciones económicas, alimentarias, habitacionales y laborales, y deja de percibirse la necesidad de los niños por desarrollar actividades de manipulación y exploración, y cuando
al mismo tiempo no se identifica como benéfico el
desarrollo cognoscitivo, ya que de acuerdo con la
serie de experiencias del niño se determina el grado de habilidad mental para aprender soluciones
nuevas y abandonar las inadecuadas.
La demanda para cambiar los modelos educativos escolares no se genera cuando se descartan
los problemas de aprendizaje de un niño porque la
mayoría de sus compañeros también poseen un
grado bajo de conocimientos y cuando además no
se admite la posibilidad de que todos vivan en condiciones inadecuadas que permitan grados variables
de disfunción motriz, adaptativa, social y del lenguaje.
Una madre educada de esa manera, y pasiva
por tradición, no advierte las necesidades explora-
54
Sección I • Bases para el estudio del crecimiento
Fig. 5-6. Interacción de los factores modificadores del crecimiento.
torias de sus hijos y en cambio permite e incluso
acepta la hipoactividad motriz como un modelo educativo "adecuado" y conveniente; además, por incomprensión, responde en forma mínima a las necesidades de desarrollo infantil, y con frecuencia
castiga al hijo que desarrolla actividad psicomotriz
normal para su edad por considerarla generadora
de alteración familiar. Muchas veces esta situación
se refuerza en la escuela, cuando los maestros consideran adecuada la conducta pasiva, y desaprueban
al niño con inquietudes físicas e intelectuales. Así
se crea una autoimagen negativa en el estudiante,
que tiene que optar por aceptar la pasividad física
y mental como mecanismo positivo de adaptación
social, o en su defecto, adoptar actitudes retadoras
ante los maestros, lo cual con frecuencia coadyuva
al abandono de la escuela con carencia de información adecuada; en cualquiera de ambas situaciones,
tienden a contraer matrimonios con consortes de
condiciones similares, y "adaptan" la educación
de sus hijos hacia la pasividad.
Mientras las características tecnológicas, educativas y de capacidad de desarrollo personal no se
modifiquen de manera positiva, las sociedades
mantendrán condiciones alimentarias y ambientales "tradicionales" y se perpetuarán las carencias
urbanísticas, higiénicas y educativas (fig. 5-6).
No es posible exigir a la sociedad que sea capaz de vigilar el crecimiento y el desarrollo adecuados de sus hijos, o que les proporcione las condiciones nutricias y ambientales óptimas cuando no
se educa para ello.
La resolución depende de actividades organizadas por profesionales conscientes de su función
en el desarrollo de una sociedad y capaces de elaborar planes congruentes en tiempo y espacio para
la realidad sociocultural prevaleciente. Esto genera
una serie de interrogantes:
1. ¿Debe el médico educar a la población para
que viva en condiciones que faciliten la prevención de enfermedades y la desnutrición, así
como enseñarles a reconocer la existencia de
situaciones inadecuadas en su comunidad y la
causa de ellas?
2. ¿Las escuelas de medicina deben capacitar a
sus estudiantes para que resuelvan patologías
sociales?
3. ¿La responsabilidad recae sólo en las autoridades encargadas de elaborar planes de educación y salud?
4. ¿ Las siguientes generaciones deben ser las responsables de mejorar las condiciones de vida
de nuestra población?
Capítulo 5 • Factores que modifican el crecimiento
FACTORES ORGÁNICOS
Los factores orgánicos son aquellas alteraciones,
intrínsecas o extrínsecas, congénitas o adquiridas,
de presentación continua o intermitente, que por sí
mismas o en relación con otras, producen modificaciones estructurales, funcionales o ambas, en el
organismo.
Aunque la etiopatogenia es diversa, muchas de
esas alteraciones actúan a nivel de la capacidad
nutricia del individuo y la lesionan en grado diverso; otras modifican el equilibrio neurohormonal del
individuo, ya sea por deficiencias en la producción
o por cambios en la regulación.
55
reanuda el crecimiento; pero debido a que con frecuencia el crecimiento no alcanzado durante el
periodo de inestabilidad se pierde de manera total,
el crecimiento final observado es menor al esperado conforme las características genéticas.
Las causas más frecuentes de alteración nutricia, y relacionadas con crecimiento subóptimo son:
1.
2.
3.
4.
5.
Ingreso inadecuado.
Malabsorción.
Utilización anormal.
Problemas en la excreción.
Aporte insuficiente de oxígeno.
Ingreso inadecuado
Alteraciones nutricias
La nutrición implica aporte de alimento y oxígeno,
así como utilización y adecuación metabólica para
las necesidades de cada momento y eliminación de
elementos no útiles para el funcionamiento orgánico.
El crecimiento necesita que tres tipos de requerimientos se cubran de manera adecuada:
1. Energéticos, los cuales por lo general se ex
presan en kilocalorías (kcal) y dependen principalmente del consumo de carbohidratos y
grasas.
2. Plásticos, dados por el consumo de proteínas,
vitaminas y minerales.
3. Oxidativos, en relación con el aporte de oxígeno a nivel tisular y celular, para que se pueda
obtener una producción suficiente de energía
y de temperatura.
La carencia prolongada de aporte calórico suficiente (aun cuando se mantenga un equilibrio
adecuado en la proporción de carbohidratos, lípidos y proteínas) disminuye el tejido graso y luego
aumenta el consumo de proteínas tisulares, para
finalmente ocasionar interrupción del crecimiento.
Por otro lado, la deficiencia en la ingestión de
uno o más nutrimentos esenciales, aun cuando la
alimentación sea hipercalórica, produce a corto
plazo detención del crecimiento. Incluso la falta de
un solo aminoácido esencial para ese momento del
crecimiento, aunque la alimentación sea completa
y balanceada por lo demás, conduce a mayor limitación de crecimiento que una dieta carente de todos los aminoácidos esenciales.
Cuando el organismo pierde su homeostasis de
manera temporal, y el individuo no muere, es posible lograr un nuevo estado de equilibrio funcional
denominado homeorresis, y que a partir del cual se
Por lo general el consumo bajo de alimentos tiene
orígenes socioeconómico y cultural y está relacionado con un poder adquisitivo insuficiente y hábitos inadecuados ya mencionados.
Los requerimientos nutricios varían de acuerdo con la edad y el sexo de los individuos, así como
con las necesidades de su momento biológico; por
ello no existen recomendaciones nutricias absolutas. Las guías, como las del cuadro 5-1, sólo ayudan al médico a diseñar el plan y las adaptaciones
individuales más adecuadas.
Es importante considerar aquellas alteraciones
nutricias derivadas del consumo de "sustitutos alimentarios" y de programas dietéticos especiales.
Este es el caso de niños que reciben sustitutos de
leche elaborados con cereales, algunos de los cuales producen desequilibrio en la ingestión de oligoelementos como el zinc y el cromo, y éstos no se
complementan en la alimentación. También debe
enfatizarse que los edulcorantes artificiales no calóricos, del tipo de la sacarina, la sucralosa, la
acesulfatama y la aspartama, aunque no se contra-
56
Sección I • Bases para el estudio del crecimiento
indican de manera absoluta en niños sólo deben
usarse como complemento de una dieta adecuada y
equilibrada.
La adopción de "dietas" bajas en grasas y colesterol, así como de aquéllas con un contenido muy
elevado de fibras, produce cese del crecimiento en
niños que afecta estatura y fenómenos de desarrollo somático como la pubertad. Por ello, en casos
especiales en que se requiere alimentación modificada de algún grupo de nutrimentos, se necesita
tanto un diseño adecuado de la misma como la vigilancia del crecimiento.
En pacientes con enfermedades relacionadas
con el sistema nervioso central, el control de la
saciedad y del apetito pueden alterarse y facilitar el
consumo bajo de alimentos. Los pacientes con problemas psiquiátricos y aquéllos con anorexia nerviosa, a pesar de no tener disfunción primaria en la
regulación del apetito, llegan a ingerir alimentaciones en extremo hipocalóricas que condicionan una
interrupción del crecimiento.
Los pacientes con alteraciones neurológicas,
congénitas o adquiridas, y que con frecuencia presentan retraso mental o limitaciones neuromotoras,
así como aquéllos con enfermedades estomatológicas, pueden mostrar alteraciones en la masticación y en la deglución, y en consecuencia ingestión
inadecuada de alimentos. Los niños con infecciones crónicas por lo general también cursan con ingestión baja de nutrimentos, secundaria al mal estado general, que se agrava cuando existen náusea
y vómito.
Por último, las enfermedades relacionadas con
vómitos pueden causar desnutrición; esto se observa en estenosis congénita del píloro, enfermedad
por reflujo gastroesofágico, malformaciones de tubo
digestivo y neoplasias, entre otras.
no detienen el crecimiento. En este mismo medio,
la carencia parcial primaria de lactasa no origina
frecuente interrupción del crecimiento; pero la deficiencia adquirida por procesos infecciosos agudos de tubo digestivo (cuando no hay reconocimiento médico y se observan cuadros recurrentes de diarrea) se relaciona con estatura baja.
La enfermedad celiaca también produce detención del crecimiento hasta en 25 a 30% de los casos, y en la mayoría de éstos las manifestaciones
entérales aparecen después de tres a cuatro años de
iniciado el padecimiento y de que se ha lesionado
la velocidad de crecimiento.
Las enfermedades inflamatorias intestinales,
como la enfermedad de Crohn y la colitis ulcerosa
crónica inespecífica, originan disminución de la
velocidad de crecimiento hasta en 70% de los casos, aunque sólo en 25% de ellos se informa de
talla final baja. La mayoría de las veces esto se
debe a que se reduce la ingestión (por el dolor, la
anorexia y la instalación de una dieta inadecuada)
y aumenta el catabolismo (por la coexistencia de
fiebre e inflamación, así como por el uso de esteroides).
La fibrosis quística del páncreas puede relacionarse con deficiencia pancreática exocrina y
ocasionar detención del crecimiento, sobre todo por
complicaciones pulmonares.
Por último, debe señalarse que la existencia de
insuficiencia hepática crónica, las alteraciones de
vías biliares y el intestino corto posquirúrgico, son
causa de detención del crecimiento, aunque en estos casos es excepcional que la patología de base
no se diagnostique cuando se presenta el trastorno
del crecimiento.
Problemas de malabsorción
Aunque se identifiquen y traten de manera adecuada, las infecciones de repetición, sobre todo las
crónicas, aumentan las demandas energéticas del
organismo que limitan el crecimiento. Además, es
frecuente que los afectados presenten anorexia e
incluso vómitos, con lo que se acentúa el desequilibrio energético.
Algunas enfermedades hormonales, entre ellas
la diabetes mellitus insulinodependiente y el hipertiroidismo, al aumentar el consumo energético y
disminuir la efectividad metabólica del organismo
se relacionan con detención del crecimiento, lo
mismo desde que inician, cuando no se han reconocido y tratado, que luego de que ocurre descontrol metabólico de moderado a grave. En pacientes con diabetes mellitus insulinodependiente en
evolución desde la etapa prepubescente, se han
Las deficiencias enzimáticas y los procesos inflamatorios crónicos de tubo digestivo se relacionan
con menor absorción de los nutrimentos ingeridos.
Se calcula que 25 a 30% de pacientes con estos problemas pueden manifestar al principio una detención del crecimiento, y varios meses o incluso años
después alteraciones digestivas.
En el medio nacional es posible que la causa
más frecuente de malabsorción sea la diarrea de
repetición, relacionada en buen número de casos
con parasitosis intestinales: la giardiasis, estrongiloidosis y amibiasis producen malabsorción de
manera directa y las helmintiasis (sobre todo la
ascaridiasis y enterobiasis), aunque se asocian con
ingestión inadecuada de nutrimentos, por sí solas
Uso anormal de nutrimentos
Capítulo 5 • Factores que modifican el crecimiento
descrito estaturas finales 4 a 8 cm por debajo de
las esperadas.
Las neoplasias, aun cuando la carga tumoral
(número de blastos) no sea muy elevada, producen
una serie de alteraciones en el equilibrio energético
del organismo afectado. Algunas de esas alteraciones derivan del menor consumo de alimentos por la
anorexia y por vómitos secundarios a la quimioterapia; pero otras dependen de mediadores neuroendocrinos, como el factor de necrosis tumoral que
modifica la efectividad energética de las células con
lo cual facilita su muerte, o de la caquectina que
disminuye la efectividad metabólica y así provoca
que las reservas grasas se consuman en pocos días.
Las hepatopatías y las enfermedades congénitas del metabolismo intermediario de carbohidratos, proteínas y grasas, se relacionan frecuentemente
con estatura baja, pero ésta se considera una manifestación tardía del proceso mórbido.
Excreción anormal de nutrimentos
La causa más frecuente de eliminación bastante
elevada de nutrimentos es la diarrea crónica, sin
importar la causa de origen. No sólo existe absorción insuñciente de alimentos, sino que se afecta la
regeneración del epitelio intestinal y ello ocasiona
que la superficie de absorción disminuya a tal grado que impida la recuperación nutricia rápida.
Los problemas renales que afectan ya sea el
glomérulo (síndrome nefrótico), la función tubular
(acidosis tubular renal, síndrome de Fanconi y otras
tubulopatías), o ambos (insuficiencia renal crónica), causan detención importante del crecimiento;
al principio porque se aumenta la pérdida de elementos aún útiles desde el punto de vista funcional, y después por su relación con alteraciones de
la motilidad intestinal y control del apetito, así como
con náuseas y vómitos. Sin embargo, las limitaciones del crecimiento son, con mucho, más frecuentes en alteraciones del intersticio y túbulos que en
los problemas glomerulares. Luego de una depuración de creatinina inferior a 25 ml/min/1.73 m2, disminuye la velocidad de crecimiento. De hecho, 35
a 65% de pacientes con insuficiencia renal crónica
muestran estatura final baja. En pacientes con raquitismo hipofosfatémico se observa estatura final
entre 140 y 160 cm, de acuerdo con la gravedad de
la enfermedad.
Los pacientes con quemaduras extensas, con
alteraciones dérmicas que facilitan la pérdida de
nutrimentos (eccema crónico), con heridas quirúrgicas que requieran drenajes o con fístulas entérales, urinarias, pleurales, etc., presentan cese temporal del crecimiento.
57
Hipoxemia
Independientemente de su origen, cualquier disminución del aporte de oxígeno a los tejidos se relaciona con trastorno metabólico en el uso energético de los nutrimentos. Cifras menores de 9 a 10 g/
L producen disminución de la velocidad de crecimiento cuando la limitación del aporte se debe a la
existencia de anemia, sin importar si su origen es
nutricio, hemolítico, por disminución en la formación de elementos medulares (aplasia) o por trastornos enzimáticos intraeritrocitarios.
La hemocromatosis también se relaciona con
reducción del crecimiento, aun cuando no origine
disfunción pancreática exocrina o trastornos hepáticos; sin embargo, es evidente que la suma de éstos aumenta la gravedad de la lesión al crecimiento. Las enfermedades pulmonares crónicas, entre
ellas el asma, la displasia broncopulmonar, la hipertensión arterial pulmonar, y la fibrosis quística
del páncreas producen disminución de la velocidad
de crecimiento, que por lo general se relaciona con
alteraciones de la progresión de la maduración orgánica, en tanto exista hipoxemia, pero no siempre con
la existencia de manifestaciones respiratorias. En
el caso del asma y otras alteraciones alérgicas de
vías respiratorias (incluyendo la rinitis alérgica), se
ha demostrado que más de 80 a 90% de los pacientes presenta un patrón retrasado de crecimiento.
Las alteraciones cardiovasculares que modifican el transporte hemático se relacionan con estatura baja. Esto es muy evidente en cardiopatías
congénitas, para muchas de las cuales se han descrito patrones anormales de crecimiento, independientemente de que evolucionen con insuficiencia cardiaca o sin ella. En enfermedades vasculares
periféricas, también existen anormalidades de la
velocidad de crecimiento, aunque no ha podido demostrarse que éstas se deban a alteración de manera primaria, ya que pueden existir muchos otros
factores involucrados, entre ellos la anemia, la afección multiorgánica que con frecuencia se refiere,
las infecciones e incluso el tratamiento que requieren.
OTROS FACTORES MODIFICADORES
DEL CRECIMIENTO
Los pacientes con alteraciones afectivas graves,
como en el síndrome de deprivación emocional,
presentan detención grave del crecimiento. Aunque
en los afectados se han observado desequilibrios
significativos a nivel de los mediadores neurohormonales pretalámicos, lo cual origina disminución
en la secreción de hormona de crecimiento, este
58
Sección I • Bases para el estudio del crecimiento
Fig. 5-7. Requerimientos nutricios y sus alteraciones. SNC = sistema nervioso central.
mecanismo no parece ser el único involucrado en
el trastorno.
La posibilidad de que la lesión al crecimiento
se deba al tratamiento usado para la resolución de
diversos problemas de salud debe enfatizarse de
manera especial, ya que se ha podido demostrar que
algunos fármacos producen efectos lesivos directos sobre el sistema de la hormona del crecimiento.
Por ejemplo, los antihistamínicos, especialmente la
difenhidramina, pero no el astemizol ni el ketotifeno, así como los antiserotoninérgicos, bloquean la
secreción de hormona de crecimiento (fig. 5-7).
LECTURAS RECOMENDADAS
Bodmer WF, Cavalli LLS. Inteligencia y raza. En: Scientific
American. Psicobiología evolutiva. Barcelona: Fontanella, 1976:147.
CEPAL. La juventud latinoamericana en los años ochenta:
igualdad de oportunidades en educación y empleo. División de Desarrollo Social, CEPAL, 1991.
CEPAL. La pobreza en América Latina: dimensiones y
políticas. Chile, 1985.
Cravioto AJ, Arrieta R. Nutrición, desarrollo mental, conducta y aprendizaje. DIF/Unicef, 1982.
Gandner LI. El enanismo por privación. En: Scientific
American. Psicobiologia evolutiva. Barcelona: Fontanella, 1976:121.
Hedstrom I. La situación ambiental en Centroamérica y el
Caribe. Bogotá: Departamento Ecuménico de Investigaciones, 1989.
Jordán JR. Desarrollo humano en Cuba. La Habana: Científico-Técnica, 1979.
Levine S. La estimulación en la primera infancia. En:
Scientific American Collection. Psicobiología evolutiva. Barcelona: Fontanella, 1976:69.
Martínez D. El trabajo de los menores de edad en Centroamérica. Guatemala: PREALC-OIT, 1992.
Myers WE. Protección de los niños trabajadores. Unicef,
1991.
ONU. World population prospects. New York: Population
Division, 1991.
Raimbault AM, Berther E, Villod MT, Dupin H. Alimentos,
nutrición, salud y desarrollo. París: Centro Internacional
de la Infancia, 1981.
Rosenzweig MR, Bennet EL, Diamond MC. Cambios cerebrales en respuesta a la experiencia. En Scientific
American: Psicobiología evolutiva. Barcelona: Fontanella, 1976:138.
Sepúlveda AJ. Estado nutricional de los preescolares y las
mujeres de México. México: Academia Nacional de
Medicina, 1989.
UNESCO/OREAL. La educación pre-escolar y básica en
América Latina y el Caribe. Unicef, 1994.
Unicef. Estado mundial de la infancia. México, 1992.
Unicef. Los niños de las Americas. México: Unicef, 1992.
Capítulo
6
Energética del crecimiento
Los procesos, modificaciones y adaptaciones
energéticas y metabólicas responsables del crecimiento celular son múltiples y complejos, y aunque en la actualidad no se entienden por completo
sí se ha establecido que las principales determinantes energéticas del crecimiento son:
1. Mantener un equilibrio adecuado entre la generación de energía y de temperatura; esto debe
permitir la supervivencia y la síntesis de material de novo a mayor velocidad de lo habitual,
para facilitar la división celular y los posteriores procesos cronológicos del crecimiento.
2. Permitir la alcalinización intramitocondrial que
favorece el acoplamiento de energía a compuestos como el difosfato de adenosina (ADP) para
formar trifosfato de adenosina (ATP), lo mismo que la alcalinización del citoplasma como
acontecimiento previo e indispensable en todas las clonas celulares estudiadas, para permitir la duplicación del material genético nuclear.
El estado de nutrición es un conjunto de funciones armónicas y solidarias entre sí, que tiene
lugar en todas y cada una de las células del organismo, y de las cuales resulta la composición corporal, la salud y la vida misma.
La dieta de consumo, sin embargo, no es sinónimo de nutrición, dado que los nutrimentos sólo
adquieren importancia en la medida en que sean
bien digeridos, absorbidos y metabolizados; cuando así sucede, liberan energía química almacenada
y permiten el equilibrio termoenergético que facilita la incorporación de elementos al protoplasma y
estructuras celulares, es decir, el crecimiento.
Así pues, el estado de nutrición (como concepto
integral) es equivalente al crecimiento logrado con
anterioridad; pero de ninguna manera el crecimiento
expresado hasta un momento dado (que representa
en forma parcial los estados de nutrición previos)
es la manifestación del estado actual de nutrición.
Las alteraciones agudas de la nutrición afectan
primero el ritmo, la velocidad y la composición
corporal pero no la proporcionalidad (se sacrifica
el tamaño pero se conserva la forma); sin embargo,
los trastornos crónicos sí la modifican al limitar con
mayor gravedad los segmentos corporales que en
ese momento deben mostrar mayor velocidad de
crecimiento y desarrollo.
La desnutrición aguda puede detener la división celular; pero si la célula está en etapa de adición de citoplasma, puesto que la replicación no se
modifica, se descartan alteraciones funcionales. Esto
explica en parte las diferencias que se observan en
diversas edades como consecuencia de la desnutrición. Cuando la célula no se encuentra en el momento crítico de síntesis de material genético, el
tejido mantiene el mismo número de células, pese
a que el volumen de cada una de éstas sea menor;
por tanto, se conserva el desempeño orgánico, aunque se detiene la progresión del crecimiento.
Bajo la premisa de que la nutrición consiste en
la ingestión y aprovechamiento de los nutrimentos
en los ciclos oxidativos, se puede inferir que el peso
en relación con la edad es un buen indicador del
estado nutricio prevaleciente en la comunidad y
también señala consecuencias pasadas, mientras que
el peso en relación con la estatura indica el estado
actual de nutrición.
De la misma manera, una estatura inferior a la
esperada para la edad, como común denominador
de una población, indica nutrición previa defectuosa o condiciones ambientales desfavorables, o ambas cosas, pero no es representativa del potencial
genético de crecimiento.
59
60
Sección I • Bases para el estudio del crecimiento
Cuando las alteraciones agudas en el estado
nutricio impiden un equilibrio energético adecuado, el organismo utiliza las reservas nutricias y disminuye el volumen del tejido adiposo para preservar la masa celular del resto del cuerpo y mantener
la velocidad de multiplicación celular; es decir, se
mantiene la estatura y se sacrifica el peso. Por otro
lado, las alteraciones nutricias crónicas disminuyen
tanto el peso como la velocidad de crecimiento y
en consecuencia la estatura acumulada; pero se mantiene la funcionalidad corporal siempre que no se
afecte la diferenciación celular.
Los individuos en fases rápidas de diferenciación y multiplicación celulares, que estén sometidos a desnutrición crónica, verán afectados no sólo
el peso y la estatura, sino también la función orgánica.
Las alteraciones crónicas en el equilibrio acidobásico, hidroelectrolítico, o ambos, limitan la
capacidad de obtención de trifosfato de adenosina
y calor, así como los mecanismos iniciales de duplicación del ácido desoxirribonucleico; de ese
modo, se lesiona el crecimiento y potencialmente
la diferenciación celular.
Así entonces, la relación entre peso, estatura y
edad permite inferir lo siguiente:
1. Estatura y peso bajos para la edad, pero armónicos y con incrementos normales, se observan en individuos con talla baja familiar, o bien
en estados previos de desnutrición ya superados.
2. Peso inferior de lo esperado para la edad y para
la estatura, con velocidad de crecimiento menor de la esperada para la edad, sugiere desnutrición tanto previa como actual.
3. Peso inferior para la edad y la talla, pero con
estatura normal para la edad, indican estado
previo de nutrición adecuada, con desnutrición
actual.
Las alteraciones en la energética del crecimiento, repercuten en éste de acuerdo con el momento critico de diferenciación o multiplicación celular en que se presenten
De acuerdo con su etiología, las alteraciones
de la energética del crecimiento pueden dividirse
en:
1. Falta de aporte nutricio adecuado: desnutrición primaria por consumo inadecuado de alimentos; alteraciones digestivas enzimáticas de
origen hepático, pancreático o enteral; diarrea
crónica de cualquier etiología; nefropatías de
origen glomerular (pérdida de albúmina) o tubular (pérdida de aminoácidos, iones, etc.), o
ambas.
2. Alteraciones en el transporte de nutrimentos a
los tejidos: cardiopatías, neumopatías, anemias
crónicas, disproteinemias, enfermedades vasculares, etcétera.
3. Defectos en la utilización de nutrimentos: en
fermedades congénitas del metabolismo inter
mediario de carbohidratos (glucogenosis, fructosemia, galactosemia, etc.), proteínas (enfer
medad de la orina con olor a jarabe de maple,
glicinemia, alteraciones del ciclo de la urea,
etc.), macromoléculas (esfingolipidosis, mucopolisacaridosis, gangliosidosis, leucodistrofias,
etc.), acidosis orgánicas crónicas (acidosis tu
bulares renales, tanto proximal como distal,
acidosis metilmalónica, etc.), y alteraciones
neuroendocrinas (hipotiroidismo e hipertiroidismo, neuroblastoma, hipoparatiroidismo e hiperparatiroidismo, diabetes, etc.).
Cuando se detecta a tiempo que una enfermedad disminuye la capacidad de crecimiento y el
gradiente de maduración orgánico (es decir, la progresión en estatura y edad biológica), es posible
iniciar un tratamiento adecuado y oportuno y lograr la recuperación de ambos, sin lesionar de
manera grave ni la estatura final esperada ni el desarrollo orgánico. Sin embargo, cuando el gradiente
de maduración no se detiene, la estatura final alcanzada será invariablemente menor a la esperada
en relación con la carga genética del individuo. Por
ello, en términos generales, un individuo con estatura baja, secundaria a la influencia de factores modificadores negativos del crecimiento y con indicios de edad ósea retrasada, tiene mejor pronóstico
para el crecimiento que aquel que mantiene una
edad ósea acorde con la edad cronológica.
La comprensión de la energética del crecimiento permite un mejor abordaje racional del paciente
con alteraciones del crecimiento y desarrollo, y
facilitará la valoración del paciente sometido a tratamiento para una patología orgánica.
Por fines didácticos, los fenómenos de producción térmica, producción energética (trifosfato de
adenosina) y de acidificación celular y mitocondrial
se estudiarán por separado, pero debe entenderse
que todos se llevan a cabo de manera simultánea
durante algunas etapas del ciclo celular.
EQUILIBRIO TERMOENERGETICO
Las células necesitan obtener energía para llevar a
cabo las reacciones metabólicas y mantener una
Capítulo 6 • Energética del crecimiento
temperatura que permita el funcionamiento enzimático en condiciones óptimas. Ambos procesos se
realizan de manera conjunta dentro de la mitocondria; en este organelo se lleva a cabo la integración
del metabolismo oxidativo de carbohidratos, lípidos y proteínas.
La energía metabólica se obtiene de la degradación de los compuestos orgánicos, de modo que
cuando se libera energía contenida en los enlaces
de carbono primordialmente, y de nitrógeno y sulfatas de manera secundaria, los productos finales
son bióxido de carbono y agua; el primero se produce a través del ciclo de Krebs y la segunda en la
cadena respiratoria (ambos acontecimientos son intramitocondriales).
La energía se transporta mediante compuestos
con enlaces moleculares que al romperse pueden
proporcionarla en grandes cantidades; entre ellos,
el prototipo clásico es el trifosfato de adenosina
(ATP), que se utiliza a corto plazo para la realización de:
1. Trabajo osmótico de la célula, es decir, la re
gulación de las concentraciones iónicas intracelulares, el transporte de productos de los organelos y el transporte axoplásmico de neurotransmisores.
2. Trabajo biosintético requerido para la conformación de polisacáridos, lípidos, proteínas, glucoproteínas, lipoproteínas y material genético
(fig. 6-1).
El trifosfato de adenosina producido por el
metabolismo oxidativo se utiliza en el trabajo os-
Fig. 6-1. Balance energético/térmico.
61
mótico y biosintético, y después de liberar un fosfato energéticamente alto se degrada a difosfato de
adenosina; para su regeneración es necesaria la participación de nuevas reacciones oxidativas, en un
círculo metabólico que se perpetúa durante toda la
existencia (fig. 6-2).
Por otro lado, no toda la energía producida
durante el metabolismo oxidativo se emplea en la
generación de trifosfato de adenosina: una parte se
utiliza para mantener la temperatura corporal, ya
quedara que se lleven a cabo las reacciones metabólicas, se requiere una cinética molecular mínima, la cual depende de la temperatura a la que se
encuentra el organismo (para que una molécula reaccione con otra, se necesita en parte del aporte de
energía exógena a la reacción y esto es proporcionado por la energía térmica). Por tanto, es de vital
importancia que el organismo sea capaz de producir una cantidad de temperatura semejante a la que
se gasta en las reacciones metabólicas, y que evite
pérdidas innecesarias de calor.
El control de la temperatura corporal depende
de la producción de calor, de su eliminación y de la
termorregulación:
1. La producción de calor es un proceso químico
y metabólico basado en la degradación oxidativa de los nutrimentos; depende en forma primaria de la velocidad en los procesos intramitocondriales de oxidorreducción, del aporte de
oxígeno (trabajo ventilatorio), de la biodisponibilidad de oxígeno y alimentos (trabajo circulatorio y de perfusión tisular) y de las condiciones osmóticas y regulación del equilibrio
acidobásico. Es decir, de la producción de calor depende la capacidad de satisfacción de las
demandas metabólicas, y la energía obtenida a
través de éstas se utiliza en parte para asegurar
la producción de calor.
Fig. 6-2. Ciclo energético.
62
Sección I • Bases para el estudio del crecimiento
2. La eliminación de calor se efectúa a través de
varios mecanismos; los más importantes son:
A. Evaporación de calor por la piel y ventilación pulmonar; de este modo se pierde al
rededor de 25% de calor.
B. Conducción, convección y radiación; así se
pierde 70% de calor.
C. Acondicionamiento de la temperatura del
aire inspirado y de los alimentos ingeridos,
que por lo general tienen temperatura inferior a la del cuerpo; para esto se usa alrededor de 3% de la producción diaria de
temperatura.
D. Excreción de productos orgánicos de desecho; la pérdida de calor por este medio
representa 2% de la producción diaria de
temperatura.
3. La termorregulación orgánica es mediada tanto por el trabajo mecánico a través de los
músculos esqueléticos (contracción muscular
involuntaria) y de los cambios de postura y actitud, como por el trabajo metabólico determinado en gran medida por la respuesta a catecolaminas en hígado y tejido adiposo pardo.
El tejido adiposo pardo es capaz de utilizar toda
la energía derivada del metabolismo oxidativo para
la generación de calor, sin producir trifosfato de
adenosina; en el ser humano, aunque es más escaso
que en otros mamíferos, este tejido se localiza alrededor de los músculos y vasos sanguíneos del cuello, de la entrada de los grandes vasos al tórax y de
la aorta abdominal, ríñones y glándulas suprarrenales.
Metabolismo basal
El metabolismo basal consiste en los requerimientos de producción de energía para mantener una
temperatura corporal superior a la ambiental que
permita el suministro energético mínimo de los tejidos en reposo.
Debe tomarse en cuenta que el ambiente es
capaz de aumentar y disminuir la temperatura corporal y que, por tanto, la producción de calor del
organismo dependerá y variará de acuerdo con las
condiciones termoclimatológicas; en consecuencia,
existe una relación inversamente proporcional entre la temperatura del ambiente y las necesidades
orgánicas de generar calor.
De los conceptos anteriores se concluye que
existe una temperatura ambiental, por debajo de la
cual un organismo termorregulante en reposo debe
aumentar la tasa de producción metabólica de calor; las variaciones individuales dependen de la edad
y, en recién nacidos, de su maduración funcional y,
por tanto, de la edad gestacional e, indirectamente,
del peso alcanzado, y se denomina "temperatura crítica inferior" (cuadro 6-1).
Un neonato a término, para mantener una temperatura corporal adecuada, gasta 62 kcal/m2/hora
a temperatura ambiental templada; pero si ésta es
inferior a 20°C, el gasto energético se eleva hasta
182 kcal/m2/hora, lo cual implica aumentar casi al
triple su metabolismo oxidativo y, por tanto, su
consumo de reservas de carbohidratos (glucógeno)
y de grasas. De esa manera, a largo plazo será incapaz de sobrevivir en estas condiciones.
El cerebro, el hígado, el corazón y los ríñones
(que tienen un peso conjunto de 6% del cuerpo),
utilizan 66% de la energía obtenida a través del
metabolismo basal, y el tejido muscular, con un peso
del 40 a 50% del corporal total utiliza de 25 a 30
por ciento (fig. 6-3).
En términos generales, el metabolismo basal
disminuye 10% durante el sueño, y las mujeres no
gestantes requieren 10% menos que los varones.
A todo lo anterior debe agregarse que por cada
gramo de tejido nuevo formado se requiere en promedio de 3.2 kcal; esta cifra puede variar entre 1.2
y 7.2 kcal/g de acuerdo con el contenido proteínico
y graso de los alimentos. De ese gasto, 8.4 a 9.2%
se atribuye al trabajo de síntesis; 30 a 40% al trabajo osmótico, y 40 a 50% a la producción de calor.
Entonces, resulta claro que para que un organismo pueda crecer necesita producir energía mediante el metabolismo oxidativo de los nutrimen-
Capítulo 6 • Energética del crecimiento
tos, y que ésta se utiliza tanto para generar trifosfato de adenosina como para mantener la temperatura corporal en valores adecuados.
Metabolismo oxidativo
El organelo intracelular encargado del equilibrio
termoenergético es la mitocondria, en donde se
realiza la cadena respiratoria. Este proceso causa
de manera directa la producción celular de trifosfato de adenosina por medio de reacciones químicas
en que los electrones (donados por oxidación de
compuestos orgánicos y transportados a través de
un sistema de moléculas acarreadoras protónicas
que crean un gradiente electroquímico transmembrana) son aceptados por oxígeno para formar una
molécula de agua. La formación del gradiente electroquímico consiste en diferencias de concentraciones de iones hidrógeno (pH) y del potencial eléctrico transmembrana.
Las reacciones químicas se generan a partir de
iones hidrógeno que se liberan en las reacciones
del ciclo de Krebs luego de rompimiento de las
cadenas de carbono en carbohidratos y lípidos (y
con menor frecuencia en proteínas), con lo cual se
forma bióxido de carbono. El ion hidrógeno se une
a una molécula de dinucleótido de nicotinamida y
adenina (NAD) que se transforma y adopta una
forma reducida (NADH + H+), la cual transporta
un ion hidrógeno y un electrón en forma de par electrónico; en la matriz, cede los pares electrónicos a
moléculas acarreadoras, alternándose acarreadores de protones y acarreadores de electrones, debido a que los protones son solubles en agua mien-
63
tras que los electrones no lo son. Cuando los acarreadores de protones se ponen en contacto con
acarreadores de electrones, los protones se liberan
al agua, y cuando el acarreador de electrones se pone
en contacto con un acarreador de protones, éstos
son donados por el medio para reconstituir un hidrógeno; estas reacciones se denominan reacciones de oxidorreducción (fig. 6-4).
El flujo de protones y electrones se lleva a cabo
en dirección a menor energía libre; es decir, el potencial de oxidorreducción del dinucleótido de nicotinamida y adenina es mayor que el de la ubiquinona, el de ésta mayor al del citocromo B, y así
sucesivamente. La diferencia de potencial entre el
dinucleótido de nicotinamida y adenina en su forma reducida y el oxígeno es de 1.2 V, y dado que la
corriente total de la mitocondria es cercana a 100
Q, se generan 120 w por cada par transportado.
Aunque al principio y por efecto de los acarreadores la mitocondria es rica en iones hidrógeno, más tarde éstos se incorporan al oxígeno para
formar agua a través de los procesos de oxidorreducción de la cadena respiratoria; el efecto final neto
es que el interior de la mitocondria tiene una menor concentración de iones hidrógeno libres, por lo
que su pH es más alcalino que el citoplásmico. Sin
embargo, la alcalinización intramitocondrial tiene
que aumentar a valores extremos para poder generar trifosfato de adenosina, mediante el ciclo de la
ubiquinona (fig. 6-5).
La ubiquinona es un compuesto intramitocondrial con propiedades para aceptar iones hidrógeno
y electrones, y transportarlos tanto en un medio
Fig. 6-4. Reacciones de oxidorreducción intramitocondriales que generan las energías metabólica y térmica. UBIQ =
ubiquinona; CIT = citocromo; OX = oxidado(a); RED =
reducido(a).
64
Sección I • Bases para el estudio del crecimiento
Fig. 6-5. Ciclo de la ubiquinona (véase texto).
hidroñlico como hidrofóbico. De acuerdo con el
número de protones o electrones extra que transporte, la coenzima recibe diferentes nombres, y así:
1. (Fig. 6-5a) Un par de quinonas (2Q) acepta un
par de electrones provenientes del paso de dinucleótido de nicotinamida y adenina en su
forma reducida a dinucleótido de nicotinami
da y adenina; en esta reacción, un par de pro
tones (iones hidrógeno) se libera y pasa al
medio extramitocondrial. Ambas quinonas se
transforman entonces en quinonas oxidadas
(2Qe-).
2. (Fig. 6-5b) Las quinonas oxidadas aceptan un
par de protones de la matriz mitocondrial y se
transforman en semiquinonas (2QH~).
3. (Fig. 6-5c) Las semiquinonas aceptan un par
de electrones proporcionados por el citocromo
B, y se transforman en semiquinonas oxidadas
(2QHe-).
4. (Fig. 6-5d) Las semiquinonas oxidadas acep
tan ahora un par de protones provenientes de
la matriz mitocondrial y se reducen de manera
que se transforman en hidroxiquinonas (2QH2).
5. (Fig. 6-5e) Las hidroxiquinonas liberan un par
de protones (que pasan al medio extramitocon
drial) y otro de electrones (que oxidan al citocromo C), y se transforman en semiquinonas
reducidas (2QH).
6. (Fig. 6-5f) Finalmente, las semiquinonas redu
cidas liberan otro par de protones (que salen
de la mitocondria) y un par de electrones (que
se unen al citocromo B y lo oxidan); así se
transforman en quinonas (2Q).
El balance total es que por cada par transferido por el dinucleótido de nicotinamida y adenina
(en su forma reducida) a la quinona, durante el ciclo salen seis protones (iones hidrógeno) de la mitocondria; así se crea un gradiente negativo de iones
hidrógeno que alcaliniza aún más el pH intramitocondrial.
El citocromo B, al oxidarse, es capaz de aceptar un par de electrones del dinucleótido de nicotinamida y adenina en su forma reducida, con lo cual
se inicia la cadena respiratoria; así, el ciclo de la
ubiquinona y la cadena respiratoria se efectúan de
manera interdependiente, pero también lo pueden
hacer por separado o de modo autónomo.
Por la concentración de iones hidrógeno a uno
y otro lado de la membrana mitocondrial, se determina un gradiente, el cual tiene dos acciones principales: se crea un campo electrostático que ocasiona movimiento de iones, y se favorece la entrada de iones hidrógeno a la mitocondria a través de
canales específicos.
1.
Movimientos iónicos (fig. 6-6). La finalidad de
estos cambios es asegurar un equilibrio eléctrico que permita la captación de difosfato de
adenosina y la generación y salida de trifosfato de adenosina de la mitocondria; a la vez, las
diferencias iónicas producidas permiten la
transformación morfológica de la mitocondria
para mejorar su capacidad energética.
A. Por cada ion hidrógeno que sale de la mitocondria, entra una molécula de sodio os
móticamente activa y, por tanto, aumenta
el contenido de agua intramitocondrial, con
Fig. 6-6. Movimientos iónicos y eléctricos que se generan en
la mitocondria.
Capítulo 6 • Energética del crecimiento
lo cual se modifica la distancia entre la
membrana interna y la externa de este organelo.
B. Para evitar un edema intramitocondrial,
sale de la mitocondria un hidroxilo y junto
con el ion hidrógeno forma agua.
C. La salida del hidroxilo permite la entrada
de un ácido fosfórico, el cual se disocia en
fosfato e ion hidrógeno. El fosfato se utili
za para unirlo a un difosfato de adenosina
y formar trifosfato de adenosina, mientras
que el ion hidrógeno es captado por el ci
clo de la ubiquinona.
D. Luego de formarse, el trifosfato de adeno
sina sale de la mitocondria, con lo cual se
permite el ingreso de un difosfato de ade
nosina antes generado en el trabajo biosintético y osmótico; por la diferencia de car
gas también se acepta la entrada de otro
ácido fosfórico para regenerar trifosfato de
adenosina.
E. Además, por los movimientos iónicos ex
puestos, hay movilización del calcio; sin
embargo, el equilibrio intraextramitocondrial de este ion no se altera, por lo que se
ha supuesto que desempeña una función re
guladora en la obtención de energía.
2. Entrada de iones hidrógeno a la mitocondria.
La generación de energía térmica depende de
la alcalinización de la matriz mitocondrial a través del ciclo de la ubiquinona, y la generación
de trifosfato de adenosina necesita de la recaptación intramitocondrial de los iones hidrógeno.
A. Dada la diferencia de pH intramitocondrial
y extramitocondrial, los iones hidrógeno
tienden a entrar a la mitocondria; este paso
se regula por una proteína de membrana
específica denominada proteína F1-F0.
B. Los iones hidrógeno se unen a la proteína y modifican la carga de ésta al mismo
tiempo que ocasionan un cambio conformacional en la estructura terciaria; de esa
manera se expone un sitio que une de manera selectiva al difosfato de adenosina. Un
fosfato contenido en la proteína se une al
difosfato de adenosina en una reacción espontánea favorecida por el medio altamente hidrofílico del citoplasma, y se genera
así una molécula de trifosfato de adenosina.
C. El trifosfato de adenosina ya unido al complejo proteínico, se disocia de éste, haciendo que el complejo F1-F0 regrese a su configuración inicial (fig. 6-7).
65
Fig. 6-7. Generación de trifosfato de adenosina (ATP) por el
complejo proteínico FI-FQ. ADP = difosfato de adenosina.
La figura 6-8 muestra el equilibrio de todas
estas reacciones, y la figura 6-9 esquematiza el
metabolismo termoenergético que se realiza en la
mitocondria.
Se entiende así que la alcalinización intramitocondrial es indispensable para permitir la generación de trifosfato de adenosina a partir de la energía liberada por el metabolismo oxidativo, y que
además las alteraciones a este nivel pueden lesionar gravemente el equilibrio energético de la célula.
Por cada par electrónico que recorre la cadena
respiratoria, y debido a la diferencia de potencial
de oxidorreducción de los citocromos, se generan
cinco sitios en que se libera energía térmica. Cuando la cadena respiratoria se desacopla, es decir,
cuando se interrumpe el flujo de electrones y protones entre los citocromos y el ciclo de la ubiquinona, toda la energía liberada es térmica y, por tanto, sube la temperatura corporal. En apariencia, el
efecto de catecolaminas, hormonas tiroideas y
pirógenos bacterianos, entre otros compuestos, y
que conlleva a elevación de la temperatura, se debe
a desacoplamiento transitorio de la cadena respiratoria.
La vía energética metabólica o térmica de las
mitocondrias está programada y obedece a un mensaje genético determinado por el ácido desoxirribonucleico mitocondrial, independiente del ácido
desoxirribonucleico nuclear; sin embargo, se des-
66
Sección I • Bases para el estudio del crecimiento
Fig. 6-8. Equilibrio energético de la mitocondria.
conoce cómo funcionan los agentes inductores para
que se genere ácido ribonucleico mitocondrial y se
regule la vía de utilización de energía.
Por ejemplo, en el hipotiroidismo, y debido a
la falta de producción o acción de la triyodotironina, la mayoría de las mitocondrias muestran cadenas respiratorias acopladas. Esto produce:
1. Menor generación de energía térmica con la
consecuente intolerancia a temperaturas am
bientales bajas.
2. Menor demanda de producción de trifosfato de
adenosina, lo cual disminuye la velocidad de
las reacciones del ciclo de Krebs (a través de
las llamadas enzimas alostéricas: cítrico sintetasa, pirúvico cinasa, etc.) y, por tanto, reduce
el metabolismo oxidativo de los nutrimentos,
que a su vez permite una acumulación fácil de
éstos con la consecuente tendencia al aumento
de peso a pesar de ingerir menor cantidad de
alimentos.
La disminución de la generación de energía
térmica produce una "hipotermia relativa intracelular"; ésta ocasiona reducción de la velocidad de
las reacciones metabólicas y, por tanto, las velocidades de crecimiento y desarrollo de la célula se
afectan de manera importante.
En conclusión, el equilibrio termoenergético:
Fig. 6-9. Esquema del metabolismo termoenergético que se
realiza en el ámbito de la mitocondria.
1. Es la serie de reacciones quimicometabólicas
basadas en la degradación oxidativa de los nutrimentos para liberar la energía contenida de
manera principal en los enlaces de carbono.
Capítulo 6 • Energética del crecimiento
(ti
Fig. 6-10. Alcalinización citoplásmica para el crecimiento celular. FCDP = factor de crecimiento derivado de plaquetas;
FCE = factor de crecimiento epidérmico; HAD = hormona antidiurética.
2. El equilibrio entre la producción de energía metabólica (trifosfato de adenosina) y la producción de energía térmica depende de la proporción de cadenas respiratorias acopladas en cada
mitocondria, lo cual a su vez se regula a través
de neurotransmisores por lo general hormonales.
3. La definición de la dirección del equilibrio entre
trifosfato de adenosina y calor así como su rit
mo y velocidad, se determina por la tempera
tura ambiental, los mecanismos de control de
la temperatura, el aporte de nutrimentos diario
y el estado en que se encuentra el organismo
(crecimiento, mantenimiento o recuperación,
o todos éstos).
ALCALINIZACION CITOPLASMICA
Los ciclos energético y térmico son indispensables
para garantizar el trabajo y la eficacia metabólicos;
pero además se requiere de condiciones acidobásicas específicas para facilitar la acción de los factores de crecimiento sobre la regulación de la expresión del genotipo, así como de acelerar los procesos de síntesis de proteínas conforme las necesidades derivadas del signo de crecimiento conveniente
para cada momento.
Se sabe que para que se inicie la duplicación
del ácido desoxirribonucleico, es necesario que el
pH intracitoplásmico aumente 0.1 a 0.3 unidades
(de 7.5 a 7.8). Este fenómeno se presenta de manera universal en todas las células que se han estudiado en modelos in vitro, pero parece corresponder a
una necesidad fisiológica.
La alcalinización citoplásmica se logra a través del llamado canal de sodio e hidrógeno, el cual
por acción de los complejos "factor de crecimien-
to-receptor", permite la salida de un ion hidrógeno
y la entrada concomitante de un sodio.
Los factores de crecimiento identificados
hasta el momento como la causa directa de este
intercambio iónico son: el factor de crecimiento derivado de plaquetas, el factor de crecimiento epidérmico, la insulina, el factor de crecimiento tipo
insulina-1 o somatomedina C, la bombesina y la
hormona antidiurética, aunque es muy probable que
para cada tipo celular existan varios factores y hormonas que tengan un efecto similar.
El sodio captado sale de la célula a través de la
bomba de sodio y potasio, y de ese modo se cambia el pH sin ocasionar diferencias en los parámetros osmóticos y eléctricos de la célula.
La activación del canal de sodio e hidrógeno,
junto con los efectos facilitadores del calcio, fosfolípidos y diacilglicerol, logran que una proteincinasa C inactiva se transforme en proteincinasa C
activa, la cual modifica el índice de fosforilación y
desfosforilación de las proteínas encargadas de
activar al "inductor" de la duplicación del ácido desoxirribonucleico (fig. 6-10). A partir de este momento, la duplicación y replicación del material
genético se lleva a cabo de acuerdo con lo expuesto
en el capítulo 3 (Genética del crecimiento).
Es evidente que en la misma célula no pueden
coexistir ciclos oxidativos y duplicación del material genético, ya que cuando las mitocondrias producen energía térmica, se alcalinizan a expensas de
acidificar el citoplasma y esto inhibe los mecanismos reguladores de la expresión genotípica.
LECTURAS RECOMENDADAS
Alexander G. Body temperature control in mammalian
young. BrMedJ 1975;31:61.
68
Sección I • Bases para el estudio del crecimiento
Berridge MJ, Irvine RF. Inositol phosphates and cell signaling. Nature 1989;341:197.
Boyer PD. A Perspective of the binding change mechanism
for ATP synthesis. FASEB J 1989;3:2164.
Buckowiecki LJ, Folléa N, Lupien J. Metabolic relationship between lipolysis and respiration in rat brown
adipocytes. J Biol Chem 1981;256:12840.
Calzada RL, Bojórquez OA. Respuesta metabólica: modificaciones energéticas y adaptaciones metabólicas en
neonatos. Acta Pediatr Mex 1995;15:288.
Calzada RL, Bojórquez OA. Termorregulación. Acta Pediatr
Mex 1992;13:198.
Catterall WA. Structure and function of voltage-sensitive
ion channels. Science 1988;242:50.
D'Alessio DA, Kavle EC, Mozzoli MA. Thermic effect
of food in lean and obese men. J Clin Invest 1988;81:
1781.
Edelman IS. Thyroid thermogenesis. N Engl J Med 1974;
290:1303.
Garrow JS. Energy balance in man-an overview. Am J Clin
Nutr 1987;45:1114.
Hunter T, Karim M. The regulation of transcription by
phosphorilation. Cell 1992;17:418.
James WPT, Trayhurn P. Thermogenesis and obesity. Br
Med Bull 1981;37:43.
Newsholme EA. A possible metabolic basis for the control
of body weight. N Engl J Med 1980;302:400.
Ravussin E, Lillioja S, Anderson TE, Christin L, Bogardus
C. Determinants of 24-hour energy expediture in man.
JClin Invest 1986;78:1568.
Rothwell NJ, Stock MJ. A role for brown adipose tissue in
diet-induced thermogenesis. Nature 1979;281:31.
Welle S, Campbell RG. Stimulation of thermogenesis by
carbohydrate overfeeding. J Clin Invest 1983;71:916.
Capítulo
7
Cinemática del crecimiento
Estudia las manifestaciones del crecimiento a través del tiempo, sin considerar las causas y fenómenos responsables de su progresión o detención.
Dicho estudio no puede nacerse de manera prospectiva (a futuro), y por ello debe considerarse que
la cinemática evalúa sólo las consecuencias, es decir,
lo que se ha logrado en momentos anteriores de la
vida, y hasta el momento actual.
En la etapa pediátrica, el estudio de la cinemática del crecimiento es indispensable para establecer con grado de certeza adecuado si el fenómeno
posee carácter fisiológico (permitiendo la expresión
adecuada del genoma) o patológico (por influencias negativas de factores determinantes anormales
o por la existencia de factores modificadores, o
ambos).
La velocidad de crecimiento (VC) es la determinante fundamental de la cinemática; para cada
momento del fenómeno se alcanza un gradiente de
maduración y tamaño determinados. Así, por ejemplo, la dirección depende de la diferencia de velocidad de crecimiento de los distintos segmentos
corporales (el encéfalo y, de manera secundaria, el
cráneo tienen mayor velocidad de crecimiento que
las extremidades durante las primeras etapas de la
vida, por lo cual la dirección en la que progresa el
crecimiento es cefalocaudal).
El ritmo de crecimiento indica la relación entre la velocidad de crecimiento de los distintos tejidos y la velocidad de maduración de éstos (el tejido
linfoide muestra gran velocidad de crecimiento
durante los primeros años y luego ésta disminuye,
mientras que el tejido genital acelera su velocidad
de crecimiento y maduración hasta la etapa pubescente).
El momento del crecimiento se refiere al análisis de todas estas variables en un punto del fenómeno (qué dirección y ritmo de crecimiento se
observan a una determinada edad para poder inferir si las velocidades de crecimiento han sido adecuadas o no).
En este capítulo se exponen las medidas prácticas disponibles para evaluar el crecimiento logrado por un niño.
MODELOS DE REFERENCIA
El estudio y la valoración del crecimiento de un
individuo serían difíciles de realizar sin patrones
de referencia obtenidos a través de la medición de
longitudes, circunferencias, diámetros, perímetros
y las relaciones entre todos ellos.
Aunque se dice que la estadística genera patrones pero disminuye la información (ya que se
maneja lo abstracto y se pierde lo concreto), hasta
el momento no existe algún método de análisis del
crecimiento superior a la comparación con patrones estadísticos de la población "asintomática" que
vive en condiciones "ordinarias".
Para que un estudio de crecimiento pueda ser
considerado modelo de referencia adecuado, es
necesario que se observen las siguientes condicionantes:
1. La población estudiada debe ser sana, o por lo
menos no evidenciar algún padecimiento orgánico, a menos que el estudio pretenda enfocar el crecimiento de individuos con una de
terminada patología (síndrome de Turner, síndrome de Down, tetralogía de Fallot, etc.).
2. Debe describirse el entorno social, económico
y cultural de los estudiados, para facilitar así la
comparación de poblaciones que vivan en circunstancias parecidas o considerar las diferencias existentes con la población que se va a contrastar.
69
70
Sección I • Bases para el estudio del crecimiento
3. Los parámetros elegidos deben ser fáciles de
obtener, y ser representativos del fenómeno o
los fenómenos que se desean estudiar.
4. Las medidas y sus puntos de referencia deben
circunscribirse a las descritas en el ámbito internacional y, en caso contrario, deben estar definidas con precisión.
5. Las determinaciones deben basarse en técnicas estándar y aceptadas en el ámbito internacional, de tal manera que se facilite su comparación con las de otros autores.
6. Las medidas deben ser tomadas con el instrumento adecuado, comprobado para su funcionamiento.
7. Todo estudio de crecimiento debe actualizarse
cada 10 años para mantener su validez o cuando sea necesario.
Los modelos de referencia pueden obtenerse a
través de tres tipos fundamentales de estudios: longitudinales, transversales y semilongitudinales.
Estudios longitudinales
Los estudios longitudinales son aquellos que se
generan a través de la medición de un mismo grupo
de individuos durante todo su crecimiento. Son
difíciles de realizar debido al lapso necesario para
la observación (incluso hasta 18 a 20 años) y al
elevado costo que implica; además existe la posibilidad de que un porcentaje de los estudiados deserten, con lo cual se pierde la información que pudieran haber aportado.
Los resultados obtenidos a través de los estudios longitudinales informan sobre "distancias alcanzadas" y acerca de "velocidades de crecimiento", por lo que son útiles para analizar las posibles
repercusiones y recuperaciones de patologías orgánicas o sociogeopolíticas específicas, o ambas,
sobre el crecimiento. A través de ellos se pueden
describir gradientes de maduración.
Estudios transversales
Estos se realizan a través de la medición de uno o
varios grupos de individuos de la misma edad en
un solo "momento" del crecimiento y, por tanto,
son más fáciles, rápidos y económicos que los estudios longitudinales. Por ejemplo, en un lapso relativamente corto, es posible obtener mediciones de
niños de varios grupos de edad (6, 7, 8 años, etc.),
y calcular así la distribución estadística por percentilas de cada grupo de edad.
Este tipo de estudio informa sólo sobre "distancias alcanzadas" para una determinada edad cro-
nológica, pero no es posible tratar de valorar "velocidades de crecimiento"; por tanto, su información
debe considerarse representativa de las condiciones anteriores de vida de cada sujeto estudiado, sin
inferirse con certeza las repercusiones que los factores modificadores del crecimiento hayan podido
tener de manera individual sobre la población.
Debido a que todos los individuos estudiados se analizan en un solo momento de su crecimiento, tampoco es posible establecer "gradientes de maduración".
Estudios semilongitudinales
Los estudios semilongitudinales se realizan a través de la medición de las características de varios
grupos de individuos de la misma edad, seguidos
de manera prospectiva durante un lapso que puede
variar entre uno y más años. Al término del estudio, se sobreponen las gráficas de distancia, y en su
caso de velocidad y gradiente de maduración de
cada uno de los grupos; de este modo, es posible
elaborar un estudio con resultados similares a los
obtenidos mediante un estudio longitudinal. Por
ejemplo, si se desea analizar las características de
crecimiento de una población, se puede cuantificar
el crecimiento de niños de seis, siete y ocho años
de edad durante dos años; al finalizar, se sobreponen las distancias alcanzadas por el primer grupo a
los seis, siete y ocho años, con las alcanzadas por
el segundo a los siete, ocho y nueve años, y por el
tercero a los 8, 9 y 10 años. De esta manera es
posible analizar "estadísticamente" no sólo las distancias sino también las velocidades y los gradientes de maduración.
La ventaja de estos estudios es que pueden
proporcionar resultados similares a los de los estudios longitudinales en menor lapso, costo y posibilidad de deserción de los estudiados. Sin embargo,
tienen algunas desventajas, ya que para cada grupo
estudiado pueden existir diferencias de acuerdo con
el momento en que se inició el estudio. Por ejemplo, si las condiciones socioeconómicas son inadecuadas para permitir una nutrición suficiente, los
pacientes estudiados desde el nacimiento hasta los
dos años (lapso en el que incrementarán en promedio 37 cm) sufrirán mayores repercusiones que los
niños analizados de siete a nueve años (que en ese
mismo periodo crecerán 12 cm); de esa manera, una
lesión equivalente a 25% del crecimiento limitará
9.25 cm en el primer grupo pero sólo 3 cm en el
segundo. Entonces, para que sus resultados puedan
extrapolarse a otras poblaciones, y así se conozca
su verdadera utilidad, es necesario describir las
condiciones generales socioculturales, higiénicas,
Capitulo 7 • Cinemática del crecimiento
ambientales, políticas, económicas, geográficas y
nutricias de la población estudiada durante el periodo analizado.
En estudios de cualquier tipo se recomienda
que las mediciones las realice un mismo observador, en condiciones similares y por duplicado. Cuando hay dos o más observadores involucrados en el
estudio, se sugiere que por lo menos dos de ellos
realicen mediciones para cada sujeto y que cada uno
efectúe como mínimo dos mediciones; en caso de
obtener medidas diferentes entre uno y otro, también se recomienda la repetición y supervisión por
un tercero. Es decir, para que los resultados se consideren confiables y significativos, cada sujeto estudiado debe medirse siempre por el mismo grupo de
observadores, y debe conocerse la variación intraensayo de cada observador, así como las variaciones interensayo entre dos o más observadores.
Aunque parece obvio, es necesario enfatizar
que todos los observadores que trabajan en grupo
deben estar adiestrai respecto de las características ñsicas del equipo de medición, el uso clínico
de estos aparatos, el mantenimiento necesario para
su buen funcionamiento (tanto en condiciones estáticas como durante su transporte de un área de
trabajo a otra), las técnicas de calibración y ajuste,
y de colocación y posición de los estudiados en los
distintos instrumentos de medición.
El análisis de los resultados requiere la división de los estudiados de acuerdo con el sexo, la
edad cronológica y el estadio de desarrollo pubescente alcanzado, como características mínimas in-
71
dispensables. Sin embargo, por lo general este último parámetro se descarta en la mayoría de los
estudios publicados hasta la actualidad.
La elaboración de los modelos de referencia
considera "normales" los datos calculados a través
del promedio de más o menos dos desviaciones
estándar de la población estudiada. Al respecto, es
necesario establecer lo siguiente:
1. Los análisis estadísticos poblacionales deben
interpretarse como representativos de lo "habitual" y no de lo "normal". Un paciente sin
signos ni síntomas de patología, y con un crecimiento y desarrollo normales se sitúa dentro
de lo "habitual", y entonces puede considerársele "normal".
2. El promedio o media de una población no es
lo mismo que la mediana aunque los valores
no difieren de manera importante, por lo que
la forma de analizar las desviaciones estándar
(obtenidas a partir de la media) debe considerarse diferente del análisis de percentilas (obtenidas a partir de la mediana) (figs. 7-1 a 7-4).
3. Ningún niño está obligado a crecer de acuerdo
con valores de la media obtenida por estudios
transversales, y tampoco a alcanzar una estatura de manera paralela a ésta. Por el contrario, se espera una progresión paralela a las percentilas, sólo si el estudio se realizó de manera
longitudinal o semilongitudinal.
4. Una desviación estándar agrupa a 68.26% de
la población estudiada, y corresponde aproxi-
Fig. 7-1. Desviaciones estándar de la talla (varones).
72
Sección I • Bases para el estudio del crecimiento
Fig. 7-2. Desviaciones estándar de la talla (mujeres).
madamente a las percentilas 15.87 y 83.13 de
una población (alrededor de la mitad de la distancia entre las percentilas 10 y 25, y 75 a 90). 5.
Dos desviaciones estándar agrupan a 95.44% de
la población estudiada y corresponden a las
percentilas 2.28 y 97.72 (alrededor de las percentilas 3 y 97).
6. Tres desviaciones estándar agrupan a 99.74%
de la población y corresponden a las percentilas 0.13 y 99.87 (fig. 7-5).
7. No todos los individuos cuyas medidas antropométricas se encuentren entre la percentila 3
y la 97 (dos desviaciones estándar sobre la media) están sanos.
Fig. 7-3. Distribución percentilar de la talla acumulada en varones.
Capítulo 7 • Cinemática del crecimiento
73
Fig. 7-4. Distribución percentilar de la talla acumulada en mujeres.
8. No todos los individuos con medidas antropométricas inferiores a la percentila tres o con
dos desviaciones estándar por debajo de la media, ni aquellos que se sitúan por arriba de la
percentila 97 o dos desviaciones estándar por
arriba de la media, son portadores de enfermedad
les para el tipo de estudio que se pretende llevar a
cabo (figs. 7-6 a 7-9):
Puntos somatométricos de referencia
Impares o sagitales
Glabela. Punto más saliente del entrecejo.
Gnatión. Punto más bajo de la mandíbula.
Nasión. Punto localizado en la raíz de la na-
SOMATOMETRIA
El análisis somatométrico del crecimiento requiere
del conocimiento de los puntos somatométricos de
referencia y las medidas somatométricas más importantes, así como de la selección de los más úti-
riz.
Subnasal. Punto posterior del tabique nasal.
Triquión. Punto medio de la frente, donde inicia el cabello.
Fig. 7-5. Relación entre desviación estándar y percentilas, en relación con la estatura.
74
Sección I • Bases para el estudio del crecimiento
Pares o laterales
Vértice. Punto más elevado de la cabeza.
Opistocráneo. Punto más saliente del occipital.
Suprastemal. Punto medio del borde superior
del esternón.
Onfalión. Punto medio del ombligo.
Sinfisión. Punto medio del borde superior de
la sínfisis púbica.
Eurión. Punto lateral más saliente del cráneo.
Alar. Punto más lateral de las alas de la nariz.
Gonión. Vértice del ángulo mandibular.
Tragión. Punto sobre el borde superior del
trago.
Cigión. Punto más saliente de los arcos cigomáticos.
Estilión. Punto más bajo de la apófisis estiloides del radio.
Radial. Punto más alto del borde superior de
la cabeza del radio.
Dactilión. Borde anteroinferior de la yema del
dedo medio de la mano.
Acromion. Punto más laterosuperior de la apófisis acromion (omóplato).
Telión. Punto medio de las tetillas.
Iliocrestal. Punto más saliente de la cresta iliaca en sentido lateral.
Iliospinal anterior. Punto más bajo de la espina iliaca anterosuperior.
Esfirión. Punto más bajo del maleólo interno.
Tibial. Punto más alto del borde interno de la
tibia.
Medidas somatométricas más importantes
Talla o estatura de pie. Distancia vértice-suelo. El sujeto debe mantener la cabeza en posición
neutral (canto externo del ojo a la misma altura que
Fig. 7-7. Puntos somatométricos de cráneo y cara (vista de perfil).
Capítulo 7 • Cinemática del crecimiento
75
Fig. 7-8. Puntos somatométricos del cráneo.
la implantación superior del pabellón auricular);
cuello, columna, cadera y rodillas extendidas por
completo, y plantas de ambos pies totalmente apoyadas en una superficie horizontal. En niños se
sugiere traccionar la cabeza hacia arriba, firme pero
con suavidad, para asegurar que las articulaciones
de columna y miembros inferiores se encuentran
en extensión fisiológica.
Talla sentado. Distancia vértice-mesa; debe
vigilarse que la espalda se encuentre perpendicular
a la mesa y la columna vertebral en extensión fisiológica.
Longitud o estatura en decúbito (distancia vértice-calcáneo). El paciente debe acostarse en una
superficie dura (evitar colchones o colchonetas) y
perfectamente horizontal, y apoyar las plantas de
ambos pies en una superficie que se encuentra a 90
grados sobre la horizontal; se tracciona a la altura
de los ángulos de las ramas horizontal y vertical de
la mandíbula (gonión) y de la apófisis mastoides,
para asegurarse de que todas las articulaciones de
columna y miembros inferiores se encuentran en
extensión fisiológica. En niños se sugiere realizar
esta medición entre dos personas, para que una de
ellas fije los pies y la otra realice la extensión.
Peso. De manera ideal, el sujeto debe estar
desnudo, con la vejiga y el intestino vacíos y de pie
en el centro de la base de la báscula. Debe recordarse que el peso se modifica en el transcurso del
día (es mayor en las noches que en las mañanas),
por lo que se aconseja medirlo en las mañanas o en
su defecto a una hora similar del día en cada ocasión. A partir de la menarquía, las mujeres tienden
a acumular agua en la segunda mitad del ciclo
menstrual y, por tanto, se recomienda cuantificar el
peso en el mismo día del ciclo menstrual si se pretende mantener un grado de confianza aceptable.
Fig. 7-9. Puntos somatométricos del cuerpo.
Perímetro cefálico. Circunferencia de la cabeza
que se determina pasando una cinta métrica flexible por los siguientes puntos: glabela-eurión-opistocráneo-eurión-glabela.
Diámetro anteroposterior de la cabeza. Distancia glabela-opistocráneo.
Diámetro transverso máximo de la cabeza.
Distancia eurión-eurión.
Altura craneal. Distancia vértice-tragión.
Anchura bicigomática. Distancia cigión-cigión.
Anchura fisiognómica de la cara. Distancia
trigión-gnatión.
Altura morfológica de la cara. Distancia nasión-gnatión.
Altura de la nariz. Distancia nasión-subnasal.
Anchura de la nariz. Distancia alar-alar.
76
Sección I • Bases para el estudio del crecimiento
Perímetro torácico. Circunferencia del tórax
que se determina con una cinta métrica flexible que
a la mitad de una respiración normal o de una inspiración no forzada debe pasar por los siguientes
puntos: telión-acromion-telión-acromion.
Brazada. Distancia dactilión-dactilión; durante
su determinación, los brazos del paciente deben
estirarse al máximo y colocarse perpendiculares a
la columna vertebral.
Longitud del miembro superior. Distancia
acromion-dactilión de cada brazo.
Longitud del antebrazo. Distancia radial-estilión.
Longitud de la mano. Distancia estilión-dactilión.
Perímetro del brazo. La circunferencia, localizada a la mitad de la distancia entre el acromion
y el olécranon, se mide con una cinta métrica flexible mientras el paciente se encuentra de pie y con
el brazo estirado, colgando libremente.
Segmento inferior. Distancia sinfisión-calcáneo. Aunque puede determinarse con el sujeto de
pie, en los niños se aconseja realizar la medición
en decúbito dorsal. En realidad, el segmento inferior está constituido por estructuras óseas paraxiles
(brazos y piernas) y representa la suma de las longitudes de los subsegmentos de los miembros; sin
embargo, para fines de somatometría del crecimiento, es suficiente la determinación de la distancia
sinfisión-calcáneo.
Segmento superior. A la estatura en decúbito
se resta la longitud del segmento inferior. Representa la suma de las longitudes del tronco (tórax,
abdomen y pelvis) y la altura del cráneo.
Longitud del miembro inferior. Distancia iliospinal anterior al suelo, con el sujeto de pie.
Longitud del muslo. Distancia iliospinal anterior-tibial.
Perímetro del muslo. La circunferencia de la
pierna se mide a la altura de la unión entre los tercios medio y superior del muslo; para ello, debe
usarse una cinta métrica de tipo flexible y procurarse que ésta se coloque perpendicular al eje longitudinal del miembro inferior.
Longitud de la pierna. Distancia tibial-esfirión.
Longitud del pie. Distancia de la punta del primer dedo al calcáneo.
Diámetro biacromial. Distancia acromionacromion con el sujeto de pie o sentado.
Diámetro bicrestal. Distancia iliocrestal-iliocrestal con el paciente de pie.
Pliegue cutáneo. Se mide el espesor o grosor
del pliegue cutáneo con un plicómetro de precisión.
El punto que se mide con más frecuencia está a
la altura tricipital (a la mitad de la distancia entre el
acromion y el olécranon, con el brazo en reposo);
pero la determinación también puede hacerse a la
altura interescapulovertebral, subescapular, iliocrestal o abdominolateral, supraumbilical o infraumbilical y en la cara anterolateral del muslo (fig. 7-10).
Longitud del pene. Se mide la distancia entre
el sinfisión y la punta del glande, con el pene flaccido.
Circunferencia del pene. Se mide colocando
la cinta métrica flexible a la mitad de la longitud
del cuerpo del pene y perpendicular al eje longitudinal del miembro en flaccidez.
Volumen testicular. Se compara el tamaño de
ambos testículos con el de los ovoides del orquidómetro de Prader; o bien, se utiliza una plantilla
isométrica de 35 grados y 16 minutos y se determina el orificio en el que los diámetros longitudinal y
transversal coinciden con los bordes de éste.
Análisis de las medidas obtenidas
y de sus relaciones
Talla de pie o talla en decúbito. La estatura en
relación con la edad (menos ecosensible que el
peso), expresa las consecuencias de acciones pasadas y negativas, más o menos persistentes, pero es
independiente de las actuales y futuras. Además,
puesto que representa la suma de la longitud de los
segmentos y subsegmentos¿ puede utilizarse como
variable independiente o punto de referencia al estudiar la proporcionalidad.
Longitud de segmentos y subsegmentos. En términos generales, son más ecosensibles que el tórax
y la cabeza. Su análisis en relación con la talla, o
incluso entre ellos mismos, permite determinar la
proporcionalidad del crecimiento y conocer su carácter armónico (fisiológico) o disarmónico (patológico) (cuadro 7-1).
Brazada. Es representativa del crecimiento
longitudinal del segmento inferior (brazos) y del
crecimiento transversal del tórax (clavículas). En
conjunto, es más ecosensible que el segmento superior. Analizada en relación con la estatura, permite evaluar la proporcionalidad del crecimiento
(cuadro 7-1).
Perímetros cefálico y torácico. Son útiles, en
general, para valorar la lateralidad de la estructura;
en recién nacidos, para evaluar el grado de nutrición intrauterino, y en los primeros seis años de la
vida, mantienen una relación directa con el incremento del contenido intracraneano (figs. 7-11 y
7-12).
Diámetros biacromial y bicrestal. Valoran también la lateralidad. Durante la pubertad son útiles
para determinar el gradiente de maduración y la proporcionalidad corporal.
Capítulo 7 • Cinemática del crecimiento
Fig. 7-10. Distribución percentilar del grosor del pliegue subcutáneo tricipital.
11
78
Sección I • Bases para el estudio del crecimiento
Fig. 7-11. Percentilas de la circunferencia cefálica en varones.
Fig. 7-12. Percentilas de la circunferencia cefálica en mujeres.
Capítulo 7 • Cinemática del crecimiento
Perímetros del brazo y del muslo. En términos
generales, se determinan por la masa muscular que
representa el contenido proteínico del cuerpo, al
respecto del cual es más sensible el perímetro del
muslo.
Pliegue cutáneo. Mantiene correlación con la
reserva energética del organismo representada por
el panículo adiposo, y de acuerdo con lo anterior,
existe una buena relación con aspectos cualitativos
y cuantitativos de la alimentación.
Peso. Representa la masa total del organismo
y es muy ecosensible; su estudio en función de la
estatura se correlaciona con efectos pasados del
estado nutricio a corto y largo plazo así como con
los presentes. Debe analizarse también con base en
el contenido de agua corporal total.
índice de masa corporal (peso dividido entre
el cuadrado de la estatura). Muestra la masa en
función de la estatura, y permite analizar sus relaciones sin tomar en cuenta las diferencias de estatura que se producen durante el crecimiento con
signo positivo (cuadro 7-1).
El análisis completo de la proporcionalidad
debe incluir la correlación de las medidas de lateralidad entre sí y de éstas con la estatura, así como
de los miembros superior e inferior entre sí y de
éstos a su vez con sus subsegmentos y con la estatura.
La determinación de la composición corporal
mantiene mejor correlación con el análisis de los
perímetros y diámetros corporales en función de la
estatura y el peso, así como en función de la relación entre la estatura y el peso.
DIRECCIÓN DEL CRECIMIENTO
Se refiere a la cantidad de tejido que se forma en
relación con la que se destruye. Así, el estudio de la
dirección del crecimiento puede considerar las siguientes características: el signo del crecimiento,
el máximo esperado en condiciones óptimas, y la
relación segmentaria del crecimiento.
En este capítulo sólo se mencionan las relaciones segmentarias, ya que el signo de crecimiento se
explica en el capítulo 2 (El crecimiento como fenómeno biológico) y el máximo esperado en condiciones óptimas se analiza en el capítulo 3 (Genética del crecimiento).
Relación segmentaria del crecimiento
La dirección del crecimiento es un artificio para
analizar la progresión de un fenómeno y depende
del punto de referencia en que se sitúe el observador. Así por ejemplo, si el observador se coloca en
79
el punto medio, el crecimiento invariablemente se
considera centrípeto; pero si se sitúa cercano a uno
de los polos, sería proximodistal o cefalocaudal,
ventrodorsal y cefalocentrífugo.
La dirección cefalocaudal se debe a que la
velocidad de crecimiento del encéfalo es más rápida que la del resto de los segmentos corporales y,
por tanto, en los primeros años de la vida alcanza
proporciones cercanas a 100% de su desarrollo total; sin embargo, 2 o 3 años después del nacimiento, el resto de los segmentos crece de manera progresiva a mayor velocidad que la observada por éste,
y la dirección (en el sentido estricto de la expresión) se torna caudocefálica.
La dirección ventrodorsal es menos evidente
desde el punto de vista antropométrico. Sin embargo, en relación a los órganos de los sentidos, es un
hecho bien conocido que primero crece y madura el receptor (ojos, oídos, etc.), después lo hacen
las vías neuronales periféricas (pares craneales)
y finalmente la corteza cerebral encargada de la
integración final de los estímulos. Incluso para un
mismo tejido, existe en general una dirección ventrodorsal; así por ejemplo, para el tejido nervioso
intracraneal, en especial durante los dos primeros
años de la vida, al principio se observan funciones
dependientes del cerebro y después del cerebelo.
La dirección cefalocentríruga se puede observar en relación con el desarrollo neuromuscular del
niño, entre otros factores. Los músculos cercanos
al encéfalo son los primero en madurar (extensores
del cuello y esternocleidomastoideos), y esto permite mantener firme la cabeza; después lo hacen
los proximales de las extremidades, necesarios para
la realización de los "movimientos gruesos" que
controlan los cambios de posición voluntaria de las
extremidades; finalmente, se alcanza un crecimiento
y maduración similar de las estructuras distales (en
especial de extremidades superiores) encargadas de
los "movimientos finos" y, por tanto, de la adquisición de las funciones de precisión.
La relación segmentaria del crecimiento explica entonces el gradiente de crecimiento y desarrollo esperado a una edad determinada para cada uno
de los distintos segmentos y subsegmentos corporales, y su estudio permite inferir la existencia o
ausencia de alteración en el crecimiento, y en este
último caso el momento más probable de manifestación.
RITMO DEL CRECIMIENTO
El ritmo del crecimiento depende a su vez de los
ritmos de diversos segmentos y subsegmentos que
lo componen, los que a su vez derivan del observa-
80
Sección I • Bases para el estudio del crecimiento
do por las distintas clonas celulares (figs. 7-13 a
7-16).
El ritmo de crecimiento va acompañado de un
gradiente de maduración, de tal manera que en términos generales, cada tejido crece y se diferencia
en proporción directa.
Como se ha mencionado, el tejido encefálico
es el que muestra una mayor velocidad de crecimiento prenatal; por ello, en el momento del nacimiento el gradiente de maduración alcanzado es
mayor al del resto del organismo, y dado que tiene
más tiempo para alcanzar 100% de su volumen total,
su ritmo de crecimiento posnatal es menor.
La falta de crecimiento encefálico y craneal
(que por lo general se manifiesta al nacer por microcefalia) conduce a pensar en lesión del potencial
neuronal de crecimiento durante la etapa intrauterina, y las etiologías más frecuentes son alteraciones genéticas, infecciones congénitas y malformaciones del sistema nervioso. Puesto que la etapa
"crítica" de crecimiento ya se superó, es casi imposible obtener una recuperación del crecimiento y
por ende de la maduración; esto significa que la
función permanece alterada.
Lo anterior es también válido para otros segmentos corporales; por tanto, cuando un sujeto sufre
desnutrición grave durante la fase de crecimiento
rápido de las extremidades, las proporciones finales alcanzadas son distintas a las esperadas en condiciones de homeostasis, con un segmento inferior
corto y uno superior normal.
Un agente limitante del crecimiento tiene repercusiones somáticas mayor o menor de acuerdo
con:
1. El momento del crecimiento y desarrollo en que
ejerza su influencia negativa
2. La intensidad de la lesión del crecimiento o el
desarrollo, o ambos
3. El tiempo que ejerza su influencia negativa
Los segmentos y subsegmentos que en ese
momento debieran expresar un ritmo más acelerado de crecimiento o desarrollo se afectan de mane-
Fig. 7-13. Desarrollo porcentual comparativo tisular de acuerdo con la edad.
Capitulo 7 • Cinemática del crecimiento
Fig. 7-14. Desarrollo porcentual endocrinológico de acuerdo
con la edad.
ra más grave, y entonces se provoca disminución
potencial de los parámetros "máximos esperados".
La posibilidad de recuperación, una vez eliminado
el factor de influencia negativa, depende de:
1. El gradiente de maduración logrado hasta ese
momento.
2. La capacidad de regeneración anatómica o fun
cional, o ambas.
La detención del crecimiento de una unidad
anatomofuncional del organismo puede no sólo
tener repercusiones locales, sino también sistémicas, si otros órganos y segmentos dependen de ella
de manera primaria para su crecimiento o para su
funcionamiento.
Se analizarán dos casos que permitan entender
con mayor facilidad lo anterior:
Ejemplo 1
Un niño sufre detención de crecimiento entre los
seis y siete años de edad después tener un síndrome
de malabsorción intestinal por giardiasis duodenal.
En vista de que hasta ese momento el crecimiento
81
y maduración encefálicos han alcanzado 93% del
total, las posibilidades de lesión a ese grado son
mínimas. Sin embargo, la progresión de la estatura
puede detenerse en 50%, y de los 6 cm que debería
crecer (valor medio para varones de esa edad) sólo
expresa tres. Debido a que del incremento esperado en la estatura 4 cm corresponden al segmento
inferior y 2 cm al superior, el primero se afecta con
mayor intensidad que el segundo, y aumentan sólo
2 y 1 cm, respectivamente.
Si el gradiente de maduración se detiene 50%
durante ese lapso, la edad ósea del paciente progresa sólo seis meses y, una vez eliminada la parasitosis, reanuda su velocidad de crecimiento total y segmentaría de acuerdo con lo esperado para un niño
de seis años y seis meses de edad biológica; así, el
niño alcanza una estatura final 6 a 12 meses después de lo determinado por la genética, con posibilidades de pérdida poco significativa de estatura (por
lo general menos de 1 cm) y sin que se modifiquen
sus proporciones corporales.
Por el contrario, si la edad biológica y el gradiente de maduración no se detuvieran, al suprimirse la malabsorción tendría una edad ósea de siete
años, habría dejado de expresar 3 cm de estatura
final y sus proporciones corporales se modificarían
por pérdida de 2 cm de segmento inferior y de 1 cm
del superior.
Ejemplo 2
Una niña de nueve meses de edad presenta estatura
baja, retraso psicomotriz, piel y cabello resecos,
82
Sección I • Bases para el estudio del crecimiento
Con tratamiento sustitutivo a base de hormonas tiroideas se espera que la paciente recupere
100% del crecimiento perdido y alcance su estatura ideal probablemente entre los 15 y 24 meses de
edad. Es decir, puesto que la interrupción del crecimiento se debió a detención del gradiente de
maduración biológica, en realidad no ocurrió pérdida de estatura sino sólo retraso del crecimiento
esquelético, pero a partir del inicio de la terapéutica se espera observar aceleración del gradiente de
la primera y secundariamente de la velocidad de
crecimiento. Sin embargo, no sucede lo mismo respecto del retraso del desarrollo psicomotriz, ya que
las hormonas tiroideas en esta edad son indispensables para el crecimiento y maduración neuronal
tanto a nivel cortical como del cerebelo. Su carencia durante el "periodo crítico" ocasiona daño irreversible en la adquisición de funciones; entonces,
es probable que el máximo coeficiente de inteligencia se sitúe en valores de 60 a 80% y cause retraso mental moderado que limite la capacidad
genética de desarrollo escolar, laboral y social. Por
otro lado, se afectan las funciones cerebelosas de
equilibrio y coordinación de movimientos finos, con
lo cual se lesiona también el desarrollo deportivo.
VELOCIDAD DE CRECIMIENTO
Fig. 7-16. Crecimiento proporcional prenatal y posnatal, secundario al desarrollo funcional de diversos tejidos.
intolerancia a temperaturas ambientales frías, constipación y macroglosia. Al nacer midió 50 cm de
estatura y en la actualidad mide 60 cm (su estatura
esperada es 68 cm); su edad ósea corresponde a la
esperada para un recién nacido. Ante la sospecha
de hipotiroidismo congénito se solicita realización
de pruebas específicas que corroboran el diagnóstico y muestran ausencia de glándula tiroides.
La paciente muestra déficit de crecimiento de
44.5%, y ha dejado de crecer 8 cm, de los cuales
cinco corresponden al segmento superior y tres al
inferior. En condiciones de homeostasis orgánica,
el segmento superior mide 32 cm al nacer y debe
aumentar 9 cm en un periodo de nueve meses; también el segmento inferior, que al nacimiento cuenta
con una longitud aproximada de 18 cm, aumenta 9
cm en el mismo lapso. El análisis de la somatometría corporal revela un crecimiento de 4 cm para el
segmento superior y 6 cm para el segmento inferior de este paciente.
La velocidad de crecimiento es la distancia o maduración, o ambas, que se logran en un lapso determinado, para cada uno de los constituyentes del
organismo o del cuerpo como unidad.
La velocidad de crecimiento se da en proporción directa al gradiente de maduración orgánico y,
por tanto, mantiene estrecha relación con el "momento biológico" del individuo; esto es evidente
durante la pubertad, cuando se acelera el crecimiento en estatura de manera rápida y ostensible (figs.
7-17 y 7-18).
A continuación se analizan tres patrones de
crecimiento distintos cuando la pubertad se presenta
a diferentes edades cronológicas:
1. Si una paciente ha crecido en promedio 6 cm
por año de los siete a los nueve años, e inicia
su pubertad a los 10 años con una estatura de
139 cm, su crecimiento subsecuente es:
A. De los 10 a los 11 años crece 7 cm (primer
año de pubertad).
B. Aumenta 8.5 cm de los 11 a los 12 años
(segundo año de pubertad) y existe la po
sibilidad de que presente su menarquía a
los 12 años.
C. Entre 12 y 13 años: 6 cm (tercer año de
pubertad).
Capítulo 7 • Cinemática del crecimiento
83
Fig. 7-17. Percentilas de velocidad de crecimiento en varones.
D. De 13 a 14 años: 3 cm (cuarto año de pu
bertad).
E. Entre 14 y 15 años: 1 cm (quinto año de
pubertad).
El crecimiento durante el brote pubescente es de 25.5 cm, y la estatura final
de 164 centímetros.
2. Si esta misma paciente presentara una velocidad acelerada de maduración e iniciara su pubertad a los ocho años de edad, con una estatura de 131 cm, su crecimiento subsecuente sería
A. De ocho a nueve años: 7.5 cm (primer año
de pubertad).
B. Aumentaría 9 cm de los 9 a los 10 años
(segundo año de pubertad) y es probable
que su menarquía se presente a los 10 años.
Su estatura en este momento sería de 147
cm (8 cm más que para el Ejemplo 1).
C. Entre 10 y 11 años: 7.5 cm (tercer año de
pubertad).
D. De 11 a 12 años: 5 cm (cuarto año de pu
bertad).
Fig. 7-18. Percentilas de velocidad de crecimiento en mujeres.
84
Sección I • Bases para el estudio del crecimiento
E. Entre 12 y 13 años: 3 cm (cuarto año de
pubertad).
F. De 13 a 14 años: 1 cm (quinto año de pu
bertad).
El crecimiento durante el brote pubescente es de 33 cm, y la estatura final de
164 centímetros. El brote de crecimiento
se presenta antes y, por tanto, alcanza su
estatura final a menor edad que en el Ejemplo 1; pero la velocidad de crecimiento en
este caso es mayor, por lo que no se modifica la estatura final.
3. Si ahora, esta misma paciente presentara un ritmo lento de maduración e iniciara su pubertad
hasta los 12 años, su crecimiento subsecuente
sería:
A. A los 10 años mediría 134 cm de estatura
(5 cm menos que el Ejemplo 1 y 13 cm
menos que para el Ejemplo 2).
B. A los 12 años mediría 143.5 cm de estatu
ra (9.5 cm menos que para el Ejemplo 1, y
16.5 cm menos que para el Ejemplo 2).
C. Entre 12 y 13 años: 6 cm (primer año de
pubertad).
D. De 13 a 14 años: 7.5 cm (segundo año de
pubertad). Su menarquía se presentará a los
14 años, con una estatura de 157 cm.
E. Entre 14 y 15 años: 4 cm (tercer año de
pubertad).
F. De 15 a 16 años: 2 cm (cuarto año de pubertad).
G. Finalmente, de 16 a 17 años: 1 cm (quinto
año de pubertad).
El crecimiento durante su brote pubescente es de 20.5 cm, y alcanza una estatura final de 164 cm.
El crecimiento prepubescente dura
más tiempo y, por tanto, su estatura al iniciar la pubertad es mayor en comparación
con la de los Ejemplos 1 y 2; asimismo,
aunque su brote de crecimiento es menor,
alcanza la misma estatura que en los dos
ejemplos anteriores, aunque a una mayor
edad.
Con base en lo anterior se puede evidenciar que
cuando el gradiente de maduración difiere del habitual, la velocidad de crecimiento depende de éste
y no de la edad cronológica de los pacientes (fig.
7-19).
La velocidad de crecimiento, por otro lado,
permite inferir el grado de salud de un organismo,
y para que éste desarrolle una capacidad óptima de
crecimiento y mantenga una velocidad de creci-
Fig. 7-19. Diferencias en la velocidad de crecimiento de acuerdo con las variaciones del gradiente de maduración somático:
A. Modelo de maduración rápida; B. Modelo de maduración estándar o media; C. Modelo de maduración lenta.
Capítulo 7 • Cinemática del crecimiento
miento adecuada, requiere que no hayan factores
modificadores negativos que actúen sobre él.
Cuando un paciente, con estatura menor a la
esperada para su edad y carga genética, muestra una velocidad de crecimiento normal, es muy
poco probable que sea portador de una patología
en el momento actual; pero el análisis del crecimiento previo permite deducir con alto grado de
certeza el momento en que sufrió desaceleración
del crecimiento, así como saber, mediante interrogación, las manifestaciones anormales específicas que haya presentado en ese lapso, con la finalidad de tratar de encontrar una explicación. Sin
embargo, cuando no se obtienen datos suficientes
del interrogatorio, es muy difícil delimitar la etiología de la enfermedad, y en este momento, cuando el crecimiento ya es normal, ni siquiera los estudios de laboratorio y gabinete suelen ser útiles
para identificar la génesis del trastorno de crecimiento.
Así pues, el estudio combinado de la maduración biológica y de la velocidad de crecimiento
actuales permiten determinar la normalidad del
gradiente de maduración; asimismo, la relación de
éste con la dirección y el ritmo establece la normalidad del fenómeno del crecimiento.
MOMENTO DEL CRECIMIENTO
Analiza las características somáticas de cada individuo para una etapa determinada de la vida, ya sea
de manera cronológica (edad) o de acuerdo con el
gradiente de maduración logrado (edad biológica).
El análisis de la edad biológica permite valorar de manera muy precisa la maduración de un
individuo, es decir, la distancia que ha recorrido
entre sus puntos inicial y actual, expresada en porcentaje; esto desde luego resulta mucho más útil
que el análisis del "momento cronológico", el cual
es un mero accidente en la vida de un organismo,
secundario al momento en que nació, sin importar
si su maduración en ese momento equivale o no a
nueve meses de vida intrauterina.
Aunque es frecuente que los momentos cronológico y biológico sean semejantes para la mayoría de los niños, no se puede asumir a priori que
existe concordancia entre ambos; entonces, es forzoso realizar un análisis periódico de cada caso y
desde la etapa neonatal, ya que la discordancia entre ambos fenómenos, a cualquier edad y de cualquier magnitud, obliga a descartar la existencia de
enfermedades que no siempre se reconocen clínicamente.
El análisis completo del fenómeno del crecimiento, incluyendo dirección, ritmo y velocidad,
85
debe realizarse siempre en relación con un determinado "momento", es decir, en un punto fijo de la
evolución que represente la suma de los acontecimientos anteriores y de las consecuencias positivas
o negativas, o ambas, que influyeron en el crecimiento.
Algunos autores consideran que el momento
del crecimiento, en especial el inicio de la pubertad
y la edad en que se alcanza la estatura final, mantienen estrecha correlación con la edad de la menarquía en la madre; pero algunos otros señalan que
lo anterior sólo es válido para 35 a 50% de los pacientes.
La edad biológica de un paciente se determina
mediante el análisis de uno o más de los siguientes
factores:
1. Maduración esquelética o edad ósea.
2. Maduración de la dentición o edad dental.
3. índice de maduración pubescente descrito por
Tanner y Marshall.
4. Crecimiento genital mediante somatometría de
pene y testículos.
El orden de estos factores varía de un individuo a otro, pero existe una relativa constancia de
presentación para cada organismo en particular.
Entonces, debe considerarse que una sola determinación (análisis transversal del crecimiento de un
individuo) además comparada con valores estándar poblacionales, no señala por fuerza el grado
exacto de maduración alcanzado; en cambio, la revisión periódica y prospectiva de cada paciente
(análisis longitudinal) sí permite definir con mucha mayor precisión la evolución del gradiente de
maduración.
Otros parámetros que pueden analizarse son las
edades intelectual, afectiva y psicomotriz; sin embargo, ios parámetros poblacionales disponibles
suelen ser complejos y probablemente incompletos, por lo que su estudio sistemático se descarta en
la práctica diaria.
Edad ósea
Se determina por el análisis de los núcleos de crecimiento existentes en diversas partes del cuerpo,
en especial en articulaciones, pies y manos; pero
los núcleos de estas últimas constituyen el objeto
de valoración más difundido y además son los únicos para los que se dispone de métodos que permiten predecir la estatura final de cada individuo. Sin
embargo, diversos autores han realizado análisis de
la maduración esquelética en una o más regiones
corporales, de los cuales los más conocidos son:
86
Sección I • Bases para el estudio del crecimiento
1. Mano: Greulich y Pyle (1959), Tannery Whitehouse (1962 y 1975), Sempé y Pavía (1979).
2. Pie: Hoerr, Pyle y Francis (1962).
3. Rodilla: Pyle y Hoerr (1955 y 1969), Roche,
WaineryThysen(1975).
4. Codo: Sauvegrain, Nahum y Bronstein (1962),
Sempé (1976).
5. Tobillo: Sánchez (1985).
El núcleo de crecimiento de cada hueso en
particular tiene una secuencia invariable y constante de maduración en todos los organismos; pero esa
secuencia es diferente para el conjunto. Por ejemplo, en la mano existen 30 núcleos y, por tanto, al
menos 870 patrones distintos de maduración a evaluar (cada uno se compara con los 29 restantes).
Esto es poco práctico porque se requeriría de modelos matemáticos complejos; pero, en caso de discordancia entre la edad ósea de un paciente y los
parámetros contra los que se está comparando,
permite señalar que se debe utilizar el criterio del
investigador para equilibrar las diferencias y valorar la necesidad de usar otros métodos para calcular la edad biológica, ya sea mediante estudios
radiográficos de otras regiones del cuerpo, o bien
mediante el análisis de las edades dental, sexual y
genital, con lo cual se evita sacar conclusiones apresuradas.
Los parámetros que se utilizan con más frecuencia para estudiar la edad ósea en las manos
son:
1. El atlas de Greulich y Pyle, elaborado en 1959,
y que señala los 30 centros de maduración, en
una secuencia de aparición considerada por los
autores como el patrón observado con más frecuencia en la población de estudio. Este parámetro tiene el inconveniente de que descarta la
descripción de las diferencias individuales de
mostradas y el análisis de las tendencias esta
dísticas; pero debido a su fácil aplicación, se
recomienda en todos los pacientes, siempre y
cuando no estén recibiendo algún tratamiento
para acelerar o retrasar la maduración o para
modificar la estatura final.
2. El método de valoración esquelética de Tanner
y Whitehouse, en su segunda versión (Tanner
y Whitehouse-2), asigna una puntuación numérica al valor de cada hueso, con la consideración de que el paso de un estadio a otro implica
diferentes cambios de maduración. También
analiza los cambios de forma y densidad, pero
no de tamaño de cada núcleo de crecimiento
óseo de la mano, a diferencia del primer estudio (Tanner y Whitehouse-1) en el cual la edad
esquelética se determina por la edad en que 50%
de los pacientes presentó cada núcleo. Luego
del análisis de 7 700 radiografías, los autores
califican nueve estadios de maduración para los
núcleos de radio, metacarpos, falanges, trapecio y ganchoso, y ocho estadios para los del
cubito y el resto del carpo, y concluyen que los
incrementos anuales de maduración de cada uno
son más variables que los incrementos de la
puntuación de maduración sobre todo en el
carpo. Con base en lo anterior, se utilizan sólo
20 de los 30 núcleos posibles para su análisis:
A. Trece huesos largos: radio, cubito y falanges-metacarpos de los dedos pulgar, medio y meñique, denominado método RUS
(huesos cortos, cubito y radio, del inglés
Radio-Ulna-Short bones).
B. Los siete huesos del carpo.
Aunque este método es laborioso, es de
extrema utilidad en pacientes con edad de maduración esquelética atrasada o adelantada respecto de la cronológica, así como en pacientes
en quienes se intenta modificar la estatura final, o bien retrasar o acelerar la maduración.
La comparación de este método con los valores estándar de calificación de maduración esquelética en otras partes del cuerpo muestra la
concordancia adecuada con la rodilla y con el
codo, por lo que si se utiliza el método Tanner
y Whitehouse-2 es innecesario evaluar otras regiones corporales, a diferencia de lo que sucede con el uso del atlas de Greulich y Pyle.
Dado que cada población puede variar sus
valores estándar de maduración esquelética, en
cada región social, económica y geográfica de
un país es conveniente realizar un estudio semilongitudinal para reconocer el grado de concordancia con el método Tanner y Whitehouse2. Así por ejemplo, se ha informado que en los
países orientales (China, Japón, Malasia, etc.),
antes del inicio de la pubertad la maduración
esquelética es ligeramente más lenta, pero que
a partir de la pubertad se acelera más rápido
que lo observado por Tanner. En México, los
estudios realizados (escasos) coinciden en demostrar la existencia de una concordancia adecuada, ya que las diferencias para cada edad
son de 0.3 años.
Por último es conveniente señalar algunos aspectos prácticos para el análisis de la edad ósea en
la población mexicana:
1. En estados de malnutrición, el retraso en la aparición de los núcleos de crecimiento es más
Capítulo 7 • Cinemática del crecimiento
acentuado en radio, cubito, falanges y metacarpos, que en los huesos del carpo.
2. En niveles socioeconómicos bajos, la edad esquelética tiende a retrasarse 0.5 años en la etapa prepubescente y un año en la pubertad.
3. Entre hermanos del mismo sexo, la secuencia
de maduración de cada hueso tiende a ser similar en condiciones fisiológicas.
4. Al considerar el patrón de maduración biológica, la influencia de la rama materna es más
acentuada que la de la rama paterna.
Edad dental
El desarrollo y la erupción de los dientes forman
parte integral del desarrollo general de un niño y,
por tanto, es un elemento de utilidad para evaluar
el gradiente de maduración durante la infancia.
A semejanza de lo que acontece con otros parámetros poblacionales de crecimiento, los estudios
que se utilizan como comparación se realizaron
antes de 1960, cuando se restaba importancia a las
diferencias individuales en el gradiente de maduración (maduradores rápidos, promedio y lentos); por
ello, se carece de descripciones adecuadas para cada
uno de estos grupos. Sin embargo, la contrastación
del paciente, contra lo esperado para el promedio
poblacional, permite definir de manera razonable
el porcentaje de maduración alcanzado para una
edad cronológica determinada.
Existen muy pocos estudios realizados en pacientes menores de cuatro años de edad, y aún no
se cuenta con estudios detallados de las variaciones que se encuentran en distintas poblaciones o en
sujetos con alteraciones nutricias.
La evaluación de la edad dental requiere del
análisis clínico (observación directa de la cavidad
oral), para calificar el número de piezas dentarías y
su grado de erupción, el desgaste de los bordes
dentarios y el número de dientes deciduos o temporales que se han exfoliado. Los datos clínicos se
pueden complementar con el estudio radiográfico;
éste proporciona mayor información, ya que se
puede calificar la existencia de quiste predentario,
el grado de calcificación de la corona y raíz de cada
una de las piezas que aún no han brotado, y la localización con respecto al diente temporal y al borde maxilar o mandibular.
Los métodos más recomendables para su uso
clínico son los descritos por Logan y Kronfeld
(modificado por McCall y Schour) y el de Nolla,
siempre y cuando se conozcan sus limitaciones. En
ambos, la correlación entre la edad ósea y la edad
dental es muy baja durante la dentición temporal,
pero muestra un índice de concordancia de 80% en
87
la dentición permanente. Ambos estudios coinciden en señalar que la dentición definitiva en las niñas
se realiza en promedio con un año de anticipación
respecto de los varones.
Estos métodos, además del valor predictivo en
relación con el gradiente de maduración, permiten
analizar el grado en que una enfermedad sistémica
puede afectar la formación o el crecimiento dentario, o ambos y, por tanto, ejercer medidas preventivas o correctivas. Por ejemplo, cuando un paciente
presenta un patrón retrasado de crecimiento, y a la
edad cronológica en que por lo general se espera la
erupción de una o más piezas dentarías éstas aún no
aparecen, el análisis radiográfico permite definir
ya sea la existencia de alguna anormalidad en la
formación o el crecimiento o ambos, o bien la necesidad de esperar un lapso para que estos dientes
broten; de ese modo, se evita la extracción prematura de las piezas temporales que sólo ocasiona un
crecimiento menor de las definitivas (ya que estas
últimas se nutren de o en forma conjunta con las
raíces de los primeros), una dirección anormal del
brote de las piezas definitivas (ya que las temporales sirven como guía erupcional) o una posición
anómala que requiera de manejo ortodóncico.
índice de maduración sexual
Está basado en la aparición de las denominadas
características sexuales secundarías, y el método
más comúnmente utilizado es el descrito por Tanner
y Marshall, que sólo analiza los cambios mamarios
en mujeres, los genitales en varones y la distribución del vello púbico en ambos sexos.
Estos autores describen las observaciones realizadas en individuos del norte de Europa; por tanto, posee limitaciones al aplicarse a la población
indígena americana, pero no por ello carece de validez. Para una descripción más detallada, se sugiere referirse al capítulo 9 (Crecimiento posnatal).
Es importante señalar que aunque existen variaciones individuales en la edad de aparición de
las manifestaciones pubescentes, una vez que se
inicia el estadio 2 de desarrollo, la secuencia suele
tener la misma duración en todas las razas, y la
menarquía o la espermenarquía se presentan al terminar el estadio tres o al iniciarse el cuatro.
La clasificación tiene como limitante más importante el que no permite definir gradientes de
maduración en etapa prepubescente.
Somatometría genital
El análisis de la progresión del volumen testicular
y del volumen peneano es de gran utilidad para el
88
Sección I • Bases para el estudio del crecimiento
estudio del gradiente de maduración, ya que en particular el crecimiento testicular (en condiciones fisiológicas) muestra una concordancia de 95% con
la edad de maduración esquelética.
Para la determinación del volumen testicular
existen dos métodos útiles en el ámbito clínico por
su sencillez:
1. Orquidómetro de Prader. Consiste en una serie de ovoides de madera o de material plástico, que se comparan por observación con cada
uno de los testículos. Cada uno de los ovoides
tiene inscrito el volumen en centímetros cúbicos al que equivale un testículo de las mismas
dimensiones. Su inconveniente es que la comparación sólo es aproximada y, por tanto, ligeramente subjetiva, por lo cual los incrementos
de volumen testicular entre dos momentos distintos pueden pasar desapercibidos o minimizarse.
2. Cálculo del volumen testicular mediante el análisis de los diámetros transversal y longitudinal de cada testículo. Este método es mucho
más preciso, y al principio requiere del uso de
una fórmula geométrica; sin embargo, en el Instituto Nacional de Pediatría (México), los doctores Carlos Robles Valdés y Paulino Alvarez
Navarro desarrollaron un método de muy fácil
aplicación con el uso de una plantilla isométrica
de 35 grados 16 minutos, ya que sólo se necesita colocar el testículo en uno de los orificios
ovoidales de la plantilla y extrapolar este dato
a la tabla de volumen correspondiente. Además de ser más objetivo que el método de
Prader, permite analizar cambios discretos en
el volumen testicular, así como diferencias
entre ambos testículos.
El índice de volumen peneano se calcula mediante la determinación de la longitud del pene en
centímetros (desde la implantación de la base a la
altura de la sínfisis del pubis y hasta la punta del
pene) y de la circunferencia del mismo (a la altura
del tercio medio del cuerpo peneano). Una vez
obtenidos estos datos se utiliza la siguiente fórmula:
Longitud X el cuadrado de la circunferencia
4 Pi (12.56649)
Este método, descrito también por los doctores Robles y Alvarez Navarro, requiere que el pene
se encuentre en estado de flaccidez. Aunque existen variaciones individuales en el volumen peneano, la progresión del crecimiento es similar en
todos los individuos, por lo menos en edades prepubescentes. Tiene además la ventaja de que se contrarrestan diferencias aisladas en la longitud o en la
circunferencia, o ambas, cuyo análisis por separado no muestra una correlación adecuada con el gradiente de maduración. Así pues, el conocimiento
de los "momentos" del crecimiento y del desarrollo de los distintos constituyentes del organismo permite predecir la vulnerabilidad existente y, por tanto, saber:
1. Qué órganos, aparatos y sistemas pueden lesionarse ante una enfermedad (orgánica, social
o ambas) que afecta a un individuo con un gradiente de maduración determinado.
2. Cuáles son las medidas preventivas o de reha
bilitación indicadas para cada paciente en par
ticular.
3. Cómo vigilar el crecimiento y el desarrollo del
paciente una vez controlado el proceso mórbido.
Debe quedar establecido de modo claro que:
El análisis de la cinemática del crecimiento es
un parámetro tan útil para evaluar la salud de
un individuo, como la revisión tradicional por
aparatos y sistemas; por ello se recomienda su
uso complementario
Un niño que crece y se desarrollo dentro de lo
normal, y además sin síntomas y signos evidentes
en un examen clínico, sólo puede considerarse sano
cuando el crecimiento y el desarrollo son adecuados para su momento biológico; pero, por el contrario, individuos asintomáticos y asignológicos que
muestran un crecimiento o un desarrollo disarmónicos deben ser estudiados como portadores de una
patología orgánica o social, o ambas, sin manifestaciones clínicas, o bien sin detección médica. Incluso es posible aventurarse a señalar que las patologías que no lesionen el crecimiento o el desarrollo pueden catalogarse como "menores", ya que no
repercuten a nivel sistémico, en tanto que la alteración de éstos es sinónimo de "gravedad" hasta no
demostrarse lo contrario.
LECTURAS RECOMENDADAS
Anderson M, Green WT. Lenghts of the femur and tibia.
Am J Dis Child 1948;75:279.
Buschang PH, Malina RM, Little BB. Linear growth of
zapotee school children: growth status and yearly velocity for leg lenght and sitting height. Ann Hum Biol
1986;13:225.
Capítulo 7 • Cinemática del crecimiento
Cameron N. The methods of auxological anthropometry.
En: Falkner F, Tanner JM (eds). Human Growth. 2nd
ed. New York: Plenum, 1986:3.
Cole TJ. Do growth chart centiles need a face lift? Br Med
J 1994;308:641.
Comas J. Manual de antropología física. México: Instituto
de Investigaciones Históricas, UNAM, 1966.
Faulhaber J, Villanueva M. Investigación longitudinal del
crecimiento. México: Instituto Nacional de Antropología
e Historia, 1976.
Faulhaber J. Crecimiento: somatometría de la adolescencia.
México: Instituto de Investigaciones Antropológicas,
UNAM, 1989.
Frisancho AR. Anthropometric standards for the assessment
of growth and nutritional status. USA: The University
of Michigan Press, 1987.
Hindemarsh PG, Brook CGD. Auxological and biochemical assessment of short stature. Acta Paediatr Scand
1988;343 (supl):73.
Jordán JR. El crecimiento del niño. Barcelona: Jims, 1988.
Krogman WM. Child growth. USA: The University of
Michigan Press, 1972.
Ramos RG. Análisis de dos estudios de peso y de talla
hechos con SO años de diferencia en niños de la ciudad
de México. Bol Med Hosp Infant Mex 1978;35:441.
Ramos RG. Somatometría pediátrica. Arch Invest Med
1975;6(supl 1):83.
89
Ramos RMR, Rostemberg I, Armandares S. Somatometric
profile in patients with turner syndrome. Rev Invest Clin
1976;28:219.
Ramos RMR. Crecimiento y proporcionalidad corporal en
adolescentes mexicanas. México: Instituto de Investigaciones Antropológicas, UNAM, 1986.
Tanner JM, Davies PSW. Clinical longitudinal standards of
height and height velocity for north american children.
J Pediatr 1985;107:317.
Tanner JM, Whitehouse RH, Takaishi M. Standards from
birth to maturity for height, weight, height velocity and
weight velocity. Arch Dis Child 1966;41:454.
Tanner JM. Use and abuse of growth standards. En: Falkner
F, Tanner JM (eds). Human Growth. 2nd ed. New York:
Plenum, 1986:95.
Voss LD, Bailey BJR, Cumming K, Wilkin TJ, Betts PR.
The wessex growth study: first report. Acta Paediatr
Scand 1989;349(supl):65.
Voss LD, Wilkin TJ, Bailey BJR, Betts PR.The reliability
of height and height velocity in the assessment of growth
(the Wessex Growth Study). Arch Dis Child 1991;66:
833.
Voss LD, Wilkins TJ, Betts PR. Do we need new growth
charts? Lancet 1987;II:447.
Wetzel NC. On the motion of growth. J Pediatr 1934;4:465.
Widdowson EM. Harmony of growth. Lancet 1970;l:
901.
Capítulo
8
Crecimiento prenatal
La etapa del crecimiento que abarca desde la concepción hasta el término de la gestación es de gran
importancia, ya que durante ella se logra la diferenciación fenotípica del producto; desde el punto
de vista funcional y estructural, se inicia en el
ámbito celular y después continúa de manera progresiva en la formación tisular, orgánica y somática.
Durante este periodo se adquieren, entre otros
aspectos, 25 a 35% de la longitud total del ser humano, 3 a 6% del peso total, 50 a 60% del índice
de masa corporal y entre 40 y 80% de la diferenciación funcional. Por ello es de particular importancia entender algunos conceptos sobre la regulación del crecimiento fetal y embrionario, y su interrelation con la placenta y la madre; esto a su
vez permite comprender la necesidad de estudiar
al recién nacido que presente estatura, peso o ambos, menores a los esperados para su edad gestacional.
El crecimiento intrauterino depende en esencia de la función y la masa placentarias, por lo
cual el crecimiento de la placenta es tan importante o más que el crecimiento del producto. Aunque
en principio esta afirmación parece descabellada,
debe considerarse que la primera célula que constituye al embrión se forma en la cuarta división
mitótica (de las 42 que se realizan desde la etapa
de cigoto hasta el nacimiento), y antes de ésta ya
existen tres células que forman estructuras extraembrionarias y 12 que conforman un esbozo de
placenta; asimismo, cuando se efectúa la quinta
división, ya existen dos células embrionarias y 24
placentarias. En condiciones de funcionamiento
placentario adecuado y provisión de elementos
necesarios para el crecimiento y desarrollo del producto, durante las siguientes tres semanas se forma el blastocisto (desde entonces se distinguen las
capas embrionarias); de la semana 3 a la 8 se desarrolla el embrión (con diferenciación estructural);
y de la 9 a la 40 se forma el feto (con desarrollo
funcional; fig. 8-1).
La comparación de esas 42 divisiones intrauterinas (en las que por hiperplasia se forman la
mayoría de las células) con las cinco divisiones
mitóticas que ocurren desde el nacimiento hasta que
se alcanza la estatura final (etapa en que el crecimiento se debe prácticamente a hipertrofia de
células ya formadas y a aumento de material extracelular) permite comprender por qué los acontecimientos adversos durante la vida prenatal tienen
consecuencias más graves para la supervivencia y
función que aquellos que se presentan a partir del
nacimiento. De hecho, la mayoría de las alteraciones graves durante el primer trimestre de la gestación (etapa de hiperplasia) producen aborto del
producto; en cambio, aquellas que se presentan a
partir del cuarto mes (etapa de hipertrofia) sólo limitan el tamaño alcanzado durante el embarazo,
pero permiten, en general, la viabilidad y el mantenimiento de la función. Esto significa que entre más
temprano ocurra retraso de crecimiento intrauterino, la probabilidad de alteraciones estructurales y
funcionales (genéticas o congénitas) y de afección
de la supervivencia es mayor; asimismo, la posibilidad de recuperación extrauterina del crecimiento
es menor.
La carga genómica del producto depende del
material que el óvulo y el espermatozoide aportan
en igual proporción; sin embargo, la incidencia de
alteraciones secundarias a uno u otro gameto tiene
características especiales.
En condiciones habituales, un eyaculado contiene alrededor de 10 a 20 millones de espermatozoides. Si se considera que de una cifra media
(15 millones) alrededor de 50% mostrará altera93
94
Sección II • Concepto integral del crecimiento
Fig. 8-1. Divisiones mitóticas del óvulo fecundado y su relación con las estructuras extraembrionarias y con el embrión.
ciones estructurales (en cabeza, cuerpo o cola, o
en todos ellos), sólo 7.5 millones tendrán capacidad normal para lograr la fecundación; de éstos,
50% presenta movilidad atípica, y de los que conservan una movilidad normal sólo 50% es bastante
viable para alcanzar al óvulo en el tercio proximal
de la trompa de Fallopio. Es decir, sólo 1 875 millones tendrán posibilidades efectivas de fecundar
y, por tanto, la probabilidad de alteración genética
por el gameto masculino es de una entre 1 875 millones.
En el caso del óvulo, en cada ciclo menstrual
inician su maduración alrededor de 200 folículos,
de los cuales sólo uno es fecundado. La posibilidad
de alteración genética del gameto femenino es de 1
entre 200; es decir, la probabilidad de error genético es 9 000 veces mayor en el óvulo que en el espermatozoide. Sin embargo, debe señalarse que un
óvulo con información genética defectuosa tiene
muy pocas posibilidades de producir un folículo
dominante con velocidad de crecimiento adecuada
para generar condiciones intraováricas que impidan el crecimiento del resto de los folículos reclutados en ese ciclo, y que, por tanto, pueda ser ovulado y fecundado.
Las investigaciones señalan que 40% de los
errores genéticos del huevo fecundado se debe a
fallas en el genoma del óvulo; 20% a alteraciones
en el genotipo del espermatozoide, y el 40% restante a problemas intrínsecos del producto originados durante las divisiones meióticas o mitóticas
(falta de disyunción, translocaciones no balanceadas, deleciones, etc.).
La mayoría de las alteraciones cromosómicas
dan lugar a abortos durante el primer trimestre del
embarazo, por lo que la frecuencia de recién nacidos con trastornos génicos es bastante menor que
la de fetos con las mismas alteraciones.
En términos generales, la pérdida, el exceso y
la falta de material genético autosómico en los cromosomas sexuales se relacionan con talla baja al
nacer, menor estatura final de la esperada para las
características de la familia y retraso psicomotriz
de intensidad variable; además, en la mayoría de
estos pacientes se pueden detectar con relativa facilidad dismorfias cuyo conjunto es importante para
la identificación clínica de la genopatía.
Para que durante la gestación se produzca un
aumento adecuado de contenido celular y así el
producto exprese de manera óptima sus características genéticas es indispensable que exista un aporte adecuado de nutrimentos y de oxígeno, momento a momento y de acuerdo con sus necesidades;
estos elementos dependen a su vez del estado de
salud y nutrición de la madre.
A diferencia de lo que sucede desde la semana 34 de gestación hasta el término de la pubertad, durante la vida intrauterina no existe un incremento proporcionado de peso y talla en el feto.
Así, por ejemplo, la máxima velocidad de crecimiento longitudinal se logra en la semana 20 de
vida con lo cual se aumenta hasta 2.5 cm por se-
Capítulo 8 • Crecimiento prenatal
mana (equivalentes a ¡ 130 cm por año!), y el peso
en ese momento sólo representa 5% del que se alcanzará al ñnal del embarazo; durante esa semana
la velocidad de ganancia ponderal se incrementa,
y alcanza su máximo entre 32 y 34 semanas. Asimismo, la talla al nacer no guarda relación con la
información genética de estatura ñnal heredada por
ambos padres; en cambio, existe una correlación
de 40 a 80% entre el peso y el fenotipo familiar
(fig. 8-2).
Existen múltiples influencias genéticas que
contribuyen al peso del feto normal: 20% es de
origen materno, 16% es de causa fetal y 2% depende del sexo del producto. El porcentaje restante (62%) depende de factores ambientales:
hasta 18% corresponde al ambiente materno, y 6%
al ambiente intrauterino; 8% depende de la edad
materna y número de partos, y de 30% se desconoce.
Los requerimientos cambiantes y de adaptación
dinámica evidencian la necesidad de un sistema que
controle el aporte y aprovechamiento de los elementos nutricios, y cuya regulación primaria radica en la interacción feto-placenta.
95
LA PLACENTA: ÓRGANO REGULADOR
DEL CRECIMIENTO
En la actualidad se conoce mejor el subsistema
placentario que el fetal y por ello es posible establecer los siguientes lincamientos generales de regulación:
1. El tamaño de la placenta es el determinante
principal del tamaño fetal. De esta manera
entre mayores sean el peso, el área y el volumen de la placenta, existen más posibilidades
de transferencia de nutrimentos de la madre al
producto, y en consecuencia, más capacidad
de expresión de las características genéticas de
éste.
2. Las alteraciones cromosómicas en las células
constituyentes de la placenta, o tanto en ésta
como en el embrión, se relacionan de manera
casi universal con pérdida del producto de la
concepción. Cuando sólo el producto presenta
alguna genopatía, la posibilidad de aborto dis
minuye ligeramente y en 3 a 15% de los casos
se logra la gestación a término.
Fig. 8-2. Representación de la velocidad de crecimiento de la estatura y el incremento de peso.
96
Sección II • Concepto integral del crecimiento
3. La producción de hormonas placentarias mantiene proporción directa con la masa placentaria, la cual aumenta conforme progresa la
gestación que depende a su vez del flujo sanguíneo, la nutrición y la oxigenación que recibe.
4. Una de las principales hormonas producida por
la placenta es la somatotropina coriónica, también conocida como lactógeno placentario u
hormona de crecimiento placentaria, la cual
tiene por lo menos tres acciones (fig. 8-3):
A. En el organismo materno, estimula la pro
ducción de eritropoyetina (en el ámbito renal); por ello, en condiciones de buena nutrición materna, aumenta la cantidad de hemoglobina y de eritrocitos sintetizados (en
la médula ósea) con lo cual se asegura el
aporte de oxígeno a la placenta y al producto (a través del sistema cardiovascular).
Los efectos de la hormona sobre la nutrición de la unidad fetoplacentaria pueden
disminuir o anularse por la existencia de
alteraciones maternas en ríñones, corazón,
pulmones o médula ósea, o bien por la
carencia materna de aminoácidos, metales y cofactores enzimáticos de origen vitamínico necesarios para la síntesis de
hemoglobina. En cualesquiera de estas situaciones los valores séricos maternos de
lactógeno placentario se elevan de manera
transitoria e indican condiciones fetales hipóxicas.
B. En la placenta tiene efectos somatotrópicos al favorecer el crecimiento y la diferenciación del sincitiotrofoblasto y el
citotrofoblasto; es decir, promueve el crecimiento placentario y la diferenciación
funcional de la barrera hematoplacenta-
Fig. 8-3. Factores involucrados en la regulación del crecimiento prenatal. DHEA = dehidroepiandrosterona.
Capítulo 8 • Crecimiento prenatal
ría. Cuando se presentan alteraciones placentarias (como infartos, desprendimientos, implantaciones anómalas, etc.), se hace
evidente un aumento transitorio pero al
final insuficiente de somatotropina coriónica que siempre se relaciona con menor
aporte de nutrimentos al producto y, por
tanto, con retraso de crecimiento intrauterino.
C. Es probable que tenga más de un efecto
sobre el producto; pero respecto del crecimiento se encuentra una relación directamente proporcional entre la hormona y la
producción de factores de crecimiento tipo
insulina-1 y tipo insulina-2, los cuales están involucrados en el crecimiento y diferenciación tisular, ya sea mediante un efecto primario, o bien al favorecer la síntesis
de otros factores de crecimiento tisular
específicos.
5. La placenta se encarga de producir estrona y
17-beta-estradiol a partir de colesterol de origen materno y en colaboración con los tejidos
fetales. En la placenta el colesterol se transforma en pregnenolona; este compuesto se metaboliza por el producto hacia 17-hidroxipregnenolona y después a sulfato de dehidroepiandrosterona (DHEA-S), el cual retorna a
la placenta para transformarse en compuesto
estrogénico. Cuando la placenta no puede
desulfatar el sulfato de dehidroepiandrosterona, la viabilidad fetal se afecta gravemente, y
con frecuencia se produce aborto. Por otro
lado, el 17-beta-estradiol estimula la producción de renina-angiotensina-aldosterona maternas (involucrando ríñones y suprarrenales),
las cuales por un lado aumentan el volumen
de líquido intravascular y por el otro mantienen un tono vascular adecuado, lo que permite lograr un flujo placentario y umbilical su
ficientes para mantener la homeostasis de la
nutrición fetal.
6. De acuerdo con el estado nutricio de la madre
y con base en las regulaciones antes mencionadas, se permite el aporte de glucosa, aminoácidos y oxígeno que asegura el establecimiento de un estado crónico de anabolismo
fetal, siempre y cuando el incremento en el
volumen de la placenta preceda de manera
proporcional al crecimiento del producto.
7. Otro factor determinante del crecimiento placentario es la "edad de placentación" o de envejecimiento placentario. La duración óptima
de la placenta es de 36 semanas si se asume
que durante las dos primeras semanas del em-
97
barazo, aún no se ha formado (puesto que el
óvulo se encuentra en migración desde la trompa hacia el útero), y que la duración real de un
embarazo a término es de 38 semanas (el dato
de 40 semanas contempla las dos semanas que
transcurren entre la última menstruación y la
fecha probable de fecundación). A partir de este
momento, se considera que la placenta mantiene un ritmo de crecimiento insuficiente para
proporcionar un aporte nutricio adecuado al
producto. Esto explica por qué todo producto
mayor de 40 semanas de gestación, de acuerdo
con la fecha de última menstruación, debe
considerarse portador de retraso de crecimiento intrauterino hasta que no se demuestre lo
contrario. De hecho, los estudios comparativos de crecimiento y proporcionalidad corporal, realizados en neonatos a término y postérmino, demuestran que el crecimiento correspondiente a las semanas 40 a 44 de gestación
se limita hasta en 30% si el producto permanece dentro del útero.
8. Por lo general el producto de la primera gestación a término tiene menor peso y talla al
momento del nacimiento que los productos de
embarazos subsecuentes, y este hecho parece
estar determinado en parte por la existencia de
un retraso en la edad de placentación. Algunos
autores han demostrado que incluso la estatura
final alcanzada por el primer hijo tiende a ser
menor a la de otros hermanos del mismo sexo.
REGULACIÓN FETAL
DEL CRECIMIENTO
La mayoría de los conocimientos respecto de la
regulación del crecimiento fetal por parte del mismo producto se extrapolan de otras especies animales a los seres humanos, por lo que sería temerario
afirmarlos de manera categórica en estos últimos;
sin embargo, existen algunos datos ya comprobados en seres humanos que se resumen a continuación:
1. El aporte de glucosa y de aminoácidos a través
de la placenta determina la secreción de insulina fetal en una relación directamente proporcional.
2. Aunque no es posible definir la función homeostática de la insulina en las primeras semanas del embarazo y antes de la existencia de
tejido pancreático funcional, se ha demostrado
que el cigoto de dos células puede producir
insulina, por lo menos desde el punto de vista
inmunorreactivo.
98
Sección II • Concepto integral del crecimiento
3. A partir de la duodécima semana de gestación,
la insulina fetal constituye uno de los reguladores principales de la velocidad de aporte placentario de glucosa y aminoácidos; a mayor
cantidad de éstos, existe mayor producción de
insulina que genera mayor capacidad para su
captación a futuro.
4. Entre mayor es la captación de aminoácidos
por el producto, existe mayor capacidad de síntesis proteínica y mayor posibilidad de mantener una velocidad de crecimiento intrauterina
adecuada. Además, la insulina se considera
cofactor para facilitar la duplicación y replicación del ácido desoxirribonucleico, con lo cual
se asegura una capacidad apropiada de crecimiento.
5. Desde el momento de la fecundación y durante las primeras 12 semanas de la gestación
(cuando se han formado alrededor de 4 000 millones de células), el crecimiento se caracteriza
por multiplicación celular acelerada, y se
observa un gradiente ácido desoxirribonucleico/proteínas mayor a 1. La cifra de insulina inmunorreactiva aumenta en proporción directa al
incremento del número de células; asimismo,
las limitaciones en el aporte de nutrimentos o en
la cantidad de insulina fetal, o en ambas, se
relacionan con aborto (fig. 8-4). 6. Desde la
duodécima semana de gestación se modifica el
crecimiento y la hipertrofia predomina de
manera paulatina sobre la hiperpla-sia. Al mismo
tiempo, aumenta la cantidad de receptores para
factores de crecimiento tipo insulina-1 y tipo
insulina-2, y se acelera la síntesis de proteínas y
el crecimiento lineal del producto.
Fig. 8-4. Diferencias en el tipo de crecimiento durante la vida intrauterina.
Capítulo 8 • Crecimiento prenatal
7. Desde la semana 24 (alrededor de 120 000 millones de células) y con más énfasis a partir de
la semana 30 (220 000 millones de células), la
insulina regula la conversión de carbohidratos
y proteínas en lípidos para aumentar el tejido
graso subcutáneo; éste tiene como principal
finalidad evitar la pérdida de temperatura cor
poral para permitir al neonato de más de 2.5
kg de peso (510 000 millones de células) mantener una homeostasis térmica y contar en la
semana 36 de la gestación con alrededor de
660 000 millones de células. Esto se comprueba desde el punto de vista metabólico por el
hecho de que la captación neta de aminoácidos es mayor que las necesidades de síntesis
proteínica; por tanto, se piensa que los aminoácidos se utilizan en vías oxidativas y por
otro lado se transaminan y se convierten en
lípidos (fíg. 8-4).
8. Si el aporte de oxígeno o nutrimentos, o de ambos, es inferior al mínimo indispensable para
mantener una velocidad de crecimiento adecuada, el feto aumenta su secreción de catecolaminas, con lo cual produce resistencia periférica a la acción de la insulina y, por tanto, limita su tasa de crecimiento; de esa manera se
asegura la función y la supervivencia a costa
de una talla menor.
9. Cuando la deprivación de oxígeno predomina
sobre la de nutrimentos, la hipoxemia causa ele
vación de adrenalina así como de noradrenalina y dopamina, las cuales a su vez originan redistribución del flujo sanguíneo entre los órganos fetales pero muy poca alteración en la
resistencia vascular umbilical; esto asegura la
nutrición de los órganos vitales localizados
sobre el tejido musculosquelético y las visceras abdominales y torácicas. En casos crónicos, el resultado final es retraso de crecimiento
intrauterino desproporcionado, con perímetro
cefálico superior al torácico y al abdominal.
Vale la pena resaltar que la nicotina aumenta
la resistencia vascular uterina y disminuye el
flujo sanguíneo, y con ello favorece el desa
rrollo de hipoxemia e hipercapnia fetales.
La hipoxia es el principal factor determinante de la hipercatecolaminemia. Se ha demostrado que cuando la hipoxia es grave durante periodos cortos, o leve a moderada pero
crónica, produce incremento en la secreción de
catecolaminas; es probable que éstas tengan
una función fisiológica en la regulación del crecimiento fetal, ya que ante situaciones de aporte
insuficiente de oxígeno aumenta la probabilidad de disfunciones enzimáticas múltiples y,
99
por tanto, de alteraciones funcionales y estructurales del tejido en formación. La hiperproducción de catecolaminas bloquea la secreción
de insulina y disminuye de manera secundaria
la velocidad de crecimiento y duplicación celular, con lo cual previene la generación de
células anormales. Se han encontrado catecolaminas altas en embarazos con:
A. Flujo placentario insuficiente por infartos,
desprendimientos prematuros, placenta
ácreta o sincreta, trombosis de arterias placentarias e hipertensión arterial materna.
B. Alteraciones en la oxigenación fetal por
anemia materna crónica (sin importar la
causa); neumopatías o cardiopatías maternas, o ambas; tabaquismo (más de tres cigarrillos al día, tanto si la madre los fuma
como si inhala el humo procedente de otros
fumadores), y desarrollo de la gestación a
más de 3 500 m sobre el nivel del mar.
C. Disminución del flujo placentario debido
a deshidratación por gastroenteritis, hiperemesis gravídica, uso inadecuado de
diuréticos o estados que ocasionen acumulación de líquido extracelular pero disminuyan el volumen intravascular (desnutrición, síndrome nefrótico e insuficiencia
cardiaca).
10. En casos de aporte balanceado de oxígeno y
nutrimentos, la secreción de insulina disminuye sin originar aumento de catecolaminas cuando los valores de esos nutrimentos son inferio
res a los requerimientos calóricos fetales (95
kcal/kg/día, de las cuales 40 son necesarias para
el crecimiento y 55 son oxidadas). En estados
crónicos, y sobre todo si la ingestión materna
es menor a 1 500 kcal diarias en el tercer trimestre, se produce retraso de crecimiento intrauterino armónico, por lo general con perímetros (cefálico, torácico y abdominal), esta
tura y peso bajos pero proporcionados.
11. Los hijos de madre diabética mal controlada
durante la gestación y, por tanto, hiperglucémica, presentan hiperinsulinismo luego del
paso de grandes cantidades de glucosa a través
de la placenta; en consecuencia, la velocidad
de crecimiento fetal es mayor durante la primera mitad del embarazo, y en las últimas semanas el depósito de tejido graso se realiza en
mayor cuantía, lo cual explica la existencia de
macrosomía neonatal. En ausencia de control
metabólico adecuado previo al embarazo y
debido a que la secreción fetal se bloquea por
catecolaminas, los hijos de madre hiperglucémica que además presenta alteraciones micro-
100
Sección II • Concepto integral del crecimiento
vasculares o macrovasculares (o ambas) secundarias a diabetes, sobre todo insulinodependiente o no insulinodependiente, pueden sufrir
retraso de crecimiento intrauterino moderado
a grave que se manifiesta como peso y talla
normales para la edad gestacional en lugar de
macrosomía esperada por falta de control materno.
12. La regulación de la temperatura corporal del
producto depende completamente del organismo materno y por ello la energía obtenida a
través de los nutrimentos puede emplearse casi
en exclusiva para su anabolismo. Aunque las
mitocondrias de las células fetales conservan
la capacidad de transformar la energía química en térmica, desacoplando la cadena respiratoria, este proceso no se desarrolla en la vida
prenatal y, por tanto, toda la energía química
se utiliza para el crecimiento celular; esto ex
plica la capacidad orgánica del embrión y del
feto para mantener velocidades de crecimiento
y duplicación celulares más de 100 000 veces
superiores a las observadas en la vida posnatal. Los mecanismos para obtener energía son
similares a los observados en adultos, excepto
en que la utilización de oxígeno produce menor cantidad de radicales libres.
13. En casos de retraso de crecimiento intrauterino no relacionado con alteraciones fetales, pero
debido a falta de aporte de nutrimentos o de
oxígeno, es posible observar recuperación del
crecimiento en las primeras 2 a 11 semanas de
vida extrauterina, sin importar la edad gestacional. Diversos estudios han mostrado correlación negativa entre la longitud del producto
al nacimiento y el aumento de talla en los primeros tres meses de vida posnatal.
CARACTERÍSTICAS MATERNAS
QUE MODIFICAN EL CRECIMIENTO
FETAL
Por parte de la madre existen también algunas situaciones que es conveniente analizar en función
del crecimiento fetal (fig. 8-5):
1. Desde la fecundación del óvulo, el organismo
materno transforma su signo de crecimiento de
neutro a positivo, con la consiguiente formación de tejido, predominantemente por hipertrofia en ámbitos mamario, uterino, adiposo,
glandular (hipófisis, tiroides, suprarrenales) y
otros.
2. La nutrición materna es el factor más importante para permitir el crecimiento fetal óptimo
y tiene relación directa con el estado económico y cultural de la familia. Un estudio realizado en Estados Unidos demostró que un ingreso per capita menor a 12 dólares se relaciona
con mayor riesgo de hijos que presenten retraso moderado de crecimiento intrauterino; asi
mismo, las repercusiones son mayores cuando
dicho ingreso es menor a ocho dólares.
En la población nacional, y bajo el supuesto de que la familia esté constituida sólo por el
padre y la madre, un ingreso mensual menor a
480 dólares (alrededor de 3 700 pesos) debería relacionarse con hijos no bien nutridos in
útero.
3. La alteración del equilibrio entre consumo y
gasto energético de la madre limita el aporte al
producto más que a la placenta, por lo que disminuye la velocidad de crecimiento fetal. Esto
ocurre en mujeres trabajadoras que durante la
gestación realizan trabajo físico de moderado
Fig. 8-5. Factores maternos que modifican el crecimiento y maduración fetales. RCIU = retraso de crecimiento intrauterino.
Capítulo 8 • Crecimiento prenatal
a intenso; sus hijos tienden a mostrar un peso
y estatura al nacer más bajos que los de mujeres no trabajadoras. Una situación similar se
presenta cuando existen infecciones maternas
transgestacionales, aunque éstas no produzcan
fiebre u otras manifestaciones, como es frecuente en las infecciones de vías urinarias.
Las madres que tienen actividades laborales que demandan gasto energético acentuado
y prolongado, y que durante el tercer trimestre
cursan con infecciones, presenten partos prematuros e incluso productos pequeños para su
edad gestacional.
4. El aporte de nutrimentos hacia el producto es
mayor en el tercer trimestre que en etapas previas del embarazo. El análisis del grosor del
panículo adiposo subcutáneo en la madre evidencia aumento progresivo desde el inicio de
la gestación hasta el segundo trimestre, y a
partir de este momento muestra disminución.
Cuando el organismo materno es un "mal aportador" de nutrimentos al producto, durante el
tercer trimestre es frecuente observar crecimiento fetal menor al ideal que se relaciona
con incremento del grosor del tejido adiposo
subcutáneo materno en esa última etapa de la
gestación.
5. Después del alumbramiento, la madre requie
re por lo menos de 18 a 24 meses para estar en
condiciones de iniciar una nueva gestación (pe
riodo intergestacional mínimo). Cuando se ini
cia otro embarazo en un lapso menor, existe
riesgo elevado de retraso de crecimiento intra
uterino.
En poblaciones en donde los periodos intergestacionales (desde el momento del parto
hasta el inicio del siguiente embarazo) son
cortos, debido a falta de conocimientos al respecto, es frecuente observar que el segundo
producto posee peso y estatura menores que
los del primero, y que el tercero presenta retraso de crecimiento intrauterino más acentuado,
y así subsecuentemente. Por el contrario, se
informa que en casos de periodos intergestacionales adecuados y condiciones nutricias
óptimas, los segundos hijos, al igual que los
subsiguientes, muestran peso y estaturas mayores que los del primero (fig. 8-6).
6. La estatura de la madre no parece limitar el
crecimiento del producto, aunque se ha comu
nicado que madres con estatura menor a 143
cm presentan mayor incidencia de recién naci
dos con estatura o peso bajos, o ambas cosas.
Sin embargo, hasta que no se demuestre lo con
trario, el retraso en el crecimiento intrauterino,
101
Fig. 8-6. Frecuentemente los embarazos tienen un periodo
intergestacional más corto de lo recomendado.
más que atribuirse a las características somatométricas de la madre por menor capacidad
de volumen pelvicoabdominal, debe considerarse consecuencia de la malnutrición que limitó el crecimiento de la mujer. De hecho, los
estudios al respecto señalan que una madre que
nace con retraso de crecimiento intrauterino
(peso bajo predominante) tiene 70% de posibilidades de concebir hijos con limitaciones del
crecimiento, sin importar el estado nutricio que
mantenga durante las gestaciones.
EFECTOS AMBIENTALES SOBRE EL
CRECIMIENTO INTRAUTERINO
En relación con las condiciones ambientales en que
se desarrolla un embarazo (macroambiente), se han
demostrado pocas situaciones que interfieren con
el crecimiento fetal:
1. Los niños nacidos a más de 5 000 m de altura
tienen peso 16% menor que aquéllos nacidos a
menos de 300 m sobre el nivel del mar. Esto
puede explicarse por una disminución de la
oxigenación hemática que no se compensa con
incremento de las concentraciones sanguíneas
de hemoglobina demostrada en estas mujeres,
y que, por tanto, conduce a hipoxemia placentaria (con disminución de la masa de este órgano) e hipoxemia fetal que origina retraso desproporcionado de crecimiento intrauterino con
menor peso del esperado para la longitud.
102
Sección II • Concepto integral del crecimiento
2. Los efectos de la contaminación ambiental en
los fetos no están bien definidos, aunque algunos estudios sugieren que desde el momento
del nacimiento existe acumulación de plomo
en huesos y que la respuesta neurológica está
retrasada una semana. Asimismo, en mujeres
con problemas atópicos o inflamatorios de vías
respiratorias, y que radican en una zona de alta
contaminación por ozono y por partículas pequeñas, se ha encontrado disminución de la
capacidad de oxigenación tisular, que aunque
no parece limitar la masa placentaria, sí ocasiona alrededor de 4 a 5% de reducción en el
peso del producto.
3. La latitud geográfica y las variaciones climáticas no parecen modificar el crecimiento intrauterino, aun cuando estas últimas sean extremas. Las diferencias sutiles encontradas
entre algunas poblaciones, parecen deberse,
más que a las condiciones geológicas, a las
condiciones sociales, culturales y económicas
prevalecientes entre los pobladores de cada
región. Sin embargo, es importante considerar que en ocasiones las condiciones geopolíticas se relacionan con el tipo de alimentos que
pueden producirse, la capacidad tecnológica
de los habitantes de una región determinada y
las facilidades de distribución y adquisición de
nutrimentos; esto determina en conjunto que
los aspectos cualitativos y cuantitativos de la
alimentación sean insuficientes y ello muestra proporción directa con el crecimiento
fetal.
LECTURAS RECOMENDADAS
Aynsley AG. Metabolic and endocrine interrelations in the
human fetus and neonate. Am J Clin Nutr 1985;41:399.
Basset NS, Oliver MH, Breier BH, Gluckmann PD. The
effect of maternal starvation on plasma insulin-like
growth factor-I concentrations in the late gestation ovine
fetus. Pediatr Res 1990;27:401.
Battaglia FC, Meschia G. Fetal nutrition. Annu Rev Nutr
1988;8:43.
Challier JC, Hauguel S, Demaizieres V. Effect of insulin in
glucose uptake and metabolism in the human placenta.
J Clin Endocrinol Metab 1986;672:803.
De Pablo F, Scott LA, Roth J. Insulin and insulin-like growth
factor in early development: peptides, receptors and
biological events. Endocr Rev 1990; 11:558.
Fisher DA. The unique endocrine milieu of the fetus. J Clin
Invest 1986;78:603.
France JT, Liggins GC. Placental sulfatase deficiency. J Clin
Endocrinol Metab 1969;29:138.
Handwerger S. The physiology of placental lactogen in
human pregnancy. Endocr Rev 1991;12:329.
Harwell C, Padbury JF, Anand RS. Fetal catecholamine
responses to maternal hypoglycemia. Am J Physiol
1990;259:1126.
Hill DJ, Hogg J. Growth factors and the regulation of pre
and postnatal growth. Bailliere's Clin Endocrinol Metab
1989;3:579.
Hill DJ, Milner RDG. Insulin as a growth factor. Pediatr
Res 1985;19:879.
Milner RD, Hill DJ. Fetal growth control: the role of insulin and related peptides. Clin Endocrinol 1984;21:415.
Milner RDG. Prenatal growth control. En: Gluckman PD,
Heymann MA (eds). Perinatal and pediatric pathophysiology. London: Hodder & Stoughton Limited, 1993:162.
Mirlesse V, Frankenne F, Alsat E, Poncelet M, Hennen G,
Evain-Brion D. Placental growth hormone levéis in
normal pregnancy and in pregnancies with intrauterine
growth retardation. Pediatr Res 1993;34:439.
Petraglia F, Florio P, Nappi C, Genazzani AR. Peptide signaling in human placenta and membranes: autocrine,
paracrine and endocrine mechanisms. Endocr Rev 1996;
17:156.
Ringler GE, Strauss JF. In vitro systems for the study of
human placental endocrine function. Endocr Rev 1990;
11:105.
Sieff CA. Hematopoietic growth factors. J Clin Invest
1987;79:1549.
Simpson ER, McDonald PC. Endocrine physiology of the
placenta. Annu Rev Physiol 1981;43:163.
Walker WH, Fitzpatrick AL, Barrera HAS. The human placental lactogen genes: structure, function, evolution and
transcriptional regulation. Endocr Rev 1991; 12:316.
Warshaw JB. Intrauterine growth restriction revisited.
Growth, Genetics and Hormones 1992;8:5.
Zegher F, Vanderschueren ML, Spitz B, Faijerson Y, Blomberg F, Beckers A, Hennen G, Frankenne F. Perinatal
growth hormone (GH) physiology: effect of GH-releasing factor on maternal and fetal secretion of pituitary
and placental GH. J Clin Endocrinol Metab 1990;77:520.
Capítulo
9
Crecimiento posnatal
La etapa posnatal del crecimiento es la mejor estudiada, ya que de manera periódica y regular se
pueden realizar determinaciones somatométricas y
bioquímicas con mucha facilidad. Durante este
periodo se observa armonía individual y poblacional sorprendente, por lo que el análisis de los parámetros somatométricos y metabólicos es un reflejo
fiel de la normalidad del fenómeno; ello permite
valorar la progresión del crecimiento en cada paso
en particular, e identificar de manera adecuada las
repercusiones actuales y pasadas de uno o varios
sucesos patológicos sobre éste.
Es necesario hacer conciencia de que previo al
nacimiento, el individuo ha recorrido ya las fases
de crecimiento y desarrollo más rápidas de su vida,
y que, por tanto, el crecimiento posnatal general
mostrará una desaceleración progresiva durante toda
la etapa prepubescente, para evidenciar un incremento en su velocidad de crecimiento lineal sólo
durante la pubertad. Así, por ejemplo, durante los
tres primeros meses de la vida posnatal, la velocidad de crecimiento equivale a 45 cm/año y el incremento de peso a 10 kg/año; ambos valores disminuyen a 15 cm/año y 3 kg/año de los 9 a los 12 meses
de vida. Posteriormente y durante casi toda la infancia, la velocidad de crecimiento es de 5 a 7 cm/
año y el aumento de peso de 2 a 3 kg/año; durante
la pubertad se observa una nueva aceleración y los
varones alcanzan una velocidad de crecimiento de
9.5 cm/año y las mujeres de 8.2 cm/año (fig. 9-1).
De acuerdo con los parámetros establecidos,
las disminuciones en la velocidad de crecimiento
que ocasionen discontinuidad en la ganancia de
estatura por año se consideran patológicas, excepto en las siguientes condiciones:
1. Antes de los tres años de edad, ya que en este
periodo un niño modifica su ritmo de creci-
miento de acuerdo con su potencial genético; es
decir, cuando la estatura y el peso al nacer son
mayores a los esperados para los patrones
familiares, durante los tres primeros años de
vida tiende a mostrar menor velocidad de crecimiento hasta situarse en la percentila promedio
familiar. Cuando la estatura y el peso son
menores a los esperados, sucede lo contrario. 2.
Durante la pubertad, ya que su presentación a
edades muy diversas origina cinética individual.
En otras palabras, los individuos que inician el
desarrollo de su pubertad a los 10 años de vida
posnatal también reducen su velocidad de crecimiento alrededor de los 13 a 14 años de edad
cronológica; en cambio, quienes comienzan su
maduración pubescente a los 14 años, reducen su
velocidad de crecimiento entre los 17 y 18 años
de edad cronológica.
El patrón de crecimiento puede estudiarse de
manera continua desde el nacimiento hasta después
de la pubertad; pero como en realidad parece estar
regulado por distintos factores, es conveniente dividirlo en etapas de estudio. En términos generales, el crecimiento posnatal se divide en cuatro etapas:
1.
2.
3.
4.
Del nacimiento a los dos años de edad.
De los dos años hasta el inicio de la pubertad.
Pubertad.
Posterior a la pubertad.
De esa manera, se analiza primero el crecimiento infantil durante los dos primeros años; durante
esta etapa y cada vez en menor grado a partir del
nacimiento, los ajustes se realizan conforme el estado nutricio mediante una regulación que evoca
mucho a la fetal, ya que puede ser independiente
103
104
Sección II • Concepto integral del crecimiento
Fig. 9-1. Incremento de peso y estatura de acuerdo con la edad.
de las características genotipicas heredadas de los
padres. En ausencia de factores modificadores, el
crecimiento en la niñez se debe en esencia a un
control neuroendocrino hipofisario y tiroideo, y
progresa de acuerdo con el genotipo familiar; en
cambio, el crecimiento durante la pubertad ocurre
por el efecto de las hormonas gonadales sobre la
secreción de hormona de crecimiento y sus acciones directas sobre el tejido óseo (figs. 9-2 y 9-3).
Durante los primeros dos años de vida, ya sin
la influencia del medio intrauterino sobre el crecimiento, se permite una expresión conforme el potencial genético individual, y con ello se asegura
una correlación familiar bien definida.
A partir del segundo año de vida y hasta el
inicio de la pubertad, continúa la reducción de velocidad del crecimiento, pero con bastante menor
intensidad: a los tres años de edad se logran 6 cm/
Fig. 9-2. Tipo de crecimiento posnatal y su relación con el crecimiento combinado.
Capitulo 9 • Crecimiento posnatal
105
Fig. 9-3. Velocidad de crecimiento posnatal y su relación con la velocidad de crecimiento combinada.
año y en el momento que precede al inicio de la
pubertad sólo 4 cm/año.
Durante la pubertad existe un brote de crecimiento en peso y estatura, así como cambios en el
tamaño y función de los órganos sexuales; de ese
modo se alcanzan longitudes definitivas de las extremidades y una composición corporal estable.
En la etapa posterior a la pubertad el crecimiento forma parte de la fase de reducción ñnal de velocidad, y se logra básicamente a expensas del segmento superior en las mujeres y de ambos segmentos en los varones. La composición corporal puede
cambiar sólo si se requieren ajustes acordes con
estados nutricios previos alterados.
La velocidad de crecimiento puede alcanzar
hasta cuatro veces lo normal durante las fases de
recuperación de enfermedades crónicas con repercusión sistémica que hayan ocasionado detención
del crecimiento, de tal manera que en general es
fácil determinar la eficacia de la terapéutica usada
para resolver la enfermedad. Por el contrario, cuando se soluciona un estado patológico limitante del
crecimiento y después no se observa crecimiento
de recuperación, deben estudiarse las siguientes
condiciones:
1. No se ha resuelto la alteración de manera total
y adecuada.
2. Hubo lesión permanente y biológicamente sig
nificativa en otros aparatos y sistemas, de ma-
nera que la recuperación del equilibrio orgánico no alcanza el grado previo a la enfermedad
(de homeostasis se pasa a homeorresis).
3. Existe una enfermedad no detectada o previamente oculta por la anomalía de base.
La recuperación en la maduración biológica se
realiza de manera más lenta que la recuperación de
la estatura; sin embargo, se ha demostrado que en
pacientes con enfermedades crónicas graves, por
ejemplo insuficiencia renal, la edad ósea progresa
de manera lenta pero normal hasta la fase prepubescente, e incluso se acelera durante la pubertad.
LOS DOS PRIMEROS AÑOS DE EDAD
Durante los dos primeros años de vida, la velocidad y ritmo del crecimiento no dependen por completo de los factores determinantes genéticos del
individuo. Sin embargo, conforme transcurre más
del año de vida extrauterina, hay tendencia a cambiar la progresión de la estatura y alrededor de los
24 meses de edad ésta se localiza en la percentila
familiar; por ello se dice que en este lapso se producen los ajustes necesarios de acuerdo con el genotipo definitivo.
La correlación entre la estatura de los padres y
la longitud del producto al nacer muestra un índice
bajo de 0.2, que aumenta a 0.5 a los 18 meses de
vida. Como ya se mencionó antes, los niños que
106
Sección II • Concepto integral del crecimiento
durante la vida intrauterina alcanzan valores somatométricos superiores a los esperados para su genotipo, desde que nacen pueden mantener una velocidad de crecimiento menor a la considerada habitual, hasta que se sitúan en el genotipo familiar;
a partir de entonces, la velocidad de crecimiento se
modifica para normalizarse de acuerdo con los
parámetros poblacionales. Sin embargo, este ajuste
se hace más evidente entre los 6 y los 18 meses de
edad (fig. 9-4).
El producto de la concepción que presenta retraso en el crecimiento intrauterino por causas ajenas a él (maternas, placentarias, nutricias, etc.), en
presencia de homeostasis corporal adecuada puede
mostrar aceleración notoria de la velocidad de crecimiento durante los primeros 12 meses de vida
posnatal, aunque la recuperación más acentuada se
observa con frecuencia en las primeras 8 a 12 semanas de la vida. Una vez que se alcanza la percentila genética, la velocidad de crecimiento disminuye y se sitúa cerca del promedio poblacional.
En ausencia de enfermedad, no ha podido demostrarse con exactitud la influencia de los factores neuroendocrinos sobre la regulación del crecimiento. Incluso se duda de que el sistema de la
hormona del crecimiento desempeñe una función
reguladora importante desde el punto de vista endocrino, aunque los efectos paracrinos y autocrinos de las somatomedinas como factores de crecimiento tisular específicos se consideran indispensables para la maduración de clonas celulares y para
mantener la armonía entre los diversos tipos citológicos que constituyen a los tejidos. Las hormonas
tiroideas ejercen varios efectos reguladores sobre
el crecimiento y el desarrollo, en especial de los
Fig. 9-4. Ajustes del crecimiento posnatal para situarse en la
estatura genética.
tejidos nerviosos y musculosquelético sobre todo
en relación con los fenómenos de reconocimiento
celular y el establecimiento de las sinapsis intercelulares. La tiroxina actúa a través del factor de crecimiento nervioso o junto con él para favorecer la
polimerización de los microtúbulos, y de ese modo
controla la axogénesis y la sinaptogénesis; en este
sentido, está comprobado que el paciente con hipotiroidismo congénito presenta intensa inhibición de
la sinaptogénesis y en consecuencia afectación profunda de la multiplicación glial, la migración y
arborización neuronal, las conexiones simpáticas y
la mielinización de la corteza cerebral (que se realizan a partir de la gestación y que continúan hasta
los primeros dos años de la vida), lo cual origina
retraso psicomotriz muchas veces irreversible cuando el tratamiento no se inicia de manera oportuna y
adecuada en los primeros días de la vida posnatal.
La función de las hormonas tiroideas en el crecimiento y maduración musculosqueléticos es indirecta: potencia los efectos de diversos mediadores
autocrinos y paracrinos, en especial de los factores
de crecimiento epidérmico, derivado de plaquetas,
osteoblástico y de la vitamina D3. En ausencia de
esas hormonas, la maduración y calcificación esqueléticas se retrasan; asimismo, la cantidad de
miofibrillas y la síntesis de colágena se altera, con
lo cual disminuye la selectividad de la unión entre
las dendritas y las miofibrillas, lo que a su vez repercute en la maduración y control de los movimientos finos de las extremidades.
También se ha demostrado que la maduración
del aparato auditivo depende en fases tempranas de
la acción directa de las hormonas tiroideas, por lo
que en ausencia de éstas es frecuente encontrar
hipoacusia de leve a grave así como limitación para
el reconocimiento de secuencias sonoras.
Durante los dos primeros años de vida no se ha
encontrado función neurorreguladora relevante de
la paratohormona, la calcitonina, los glucocorticoides, las hormonas sexuales y el glucagon, aunque
es evidente que las dos primeras son importantes
para la formación ósea.
Respecto de la vitamina D y el calcio, se ha
demostrado que entre 75 y 85% de los niños que
nacen en invierno tienen valores subnormales de
vitamina D3 activa (1 ¿S-dihidroxicolecalciferol) en
comparación con aquellos que nacen en verano (22
a 25%), y esto tiene que ver con la masa ósea de los
neonatos (85% en invierno frente a 91% en verano). El peso en relación con el peso y el crecimiento intrauterino también influyen en los valores de
vitamina D3 activa, ya que los pequeños para la edad
gestacional tienen concentraciones séricas subnormales de 85% y la masa ósea es en promedio de
Capitulo 9 • Crecimiento posnatal
70%, en comparación con aquellos que muestran
un peso adecuado para la edad gestacional y al
mismo tiempo valores normales de vitamina D3 y
masa ósea en 100 y 90%, respectivamente.
Los factores modificadores del crecimiento
pueden lesionar de manera transitoria o permanente la velocidad y el ritmo de crecimiento, sobre todo
las anomalías que alteran el estado nutricio o la
oxigenación tisular de manera crónica, o ambas.
Cuando el crecimiento de una clona celular se encuentra en etapa crítica (periodo de máxima velocidad de crecimiento o maduración, o ambas), es
posible que el crecimiento se dañe de manera irreversible pese al control de la enfermedad; pero en
caso contrario, es frecuente observar un periodo de
recuperación de crecimiento. En otras palabras, una
alteración crónica y con repercusión sistémica puede detener de manera transitoria el crecimiento, y
éste puede recuperarse sólo cuando durante la interrupción no se altera la hiperplasia en la maduración e hipertrofia celulares. En caso de recuperación se dice que el individuo logra la homeostasis;
en caso contrario, ésta se pierde y el nuevo equilibrio u homeorresis por fuerza conduce a una masa
corporal final menor a la establecida por el genotipo individual.
Las enfermedades agudas, aunque pueden disminuir hasta en 10% el crecimiento diario (con lo
que se limita hasta 0.03 mm el crecimiento esperado), no modifican de manera importante la estatura
final.
El ritmo de maduración de los varones y de las
mujeres es diferente. Al nacer, las mujeres presentan una maduración biológica dos semanas más
avanzada que los varones, y al año de edad la distancia ya es de por lo menos ocho semanas; esta
diferencia en el gradiente de maduración se conserva hasta terminar la maduración pubescente.
La maduración también varía en relación con
el peso al nacer. Así, por ejemplo, la epífisis femoral distal se presenta en 100% de los niños cuando
éstos pesan más de 3 kg, mientras que la epífisis
tibial superior sólo se observa en el 79% de los
casos; en neonatos menores de 2 kg, las proporciones son de 75 y 62%, respectivamente.
El recién nacido premaduro mantiene siempre
el mismo grado de retraso del crecimiento; pero éste
es significativamente distinto desde el punto de vista
poblacional sólo hasta los dos años de edad, ya que
a partir de esa edad los parámetros que se utilizan
para la valoración somatométrica y gradientes de
maduración biológica (estatura, peso, perímetro
cefálico, brote dentario, etc.) se analizan en promedio de manera trimestral o cuatrimestral; mientras
que antes de esa edad, cada 30 días.
107
En resumen, el crecimiento durante los dos
primeros años de la vida posnatal tiene las siguientes características:
1. Se realizan ajustes en la velocidad y el ritmo
de crecimiento para alcanzar los parámetros de
terminados genéticamente.
2. El control neuroendocrino depende en esencia
de las hormonas tiroideas y de los factores de
crecimiento histoespecíficos.
3. Las enfermedades que evolucionan con alteraciones en la nutrición u oxigenación, o ambas
cosas, pueden modificar el ritmo y la velocidad de crecimiento.
4. Las mujeres muestran un gradiente de maduración mayor que el de los varones.
5. Existen diferencias significativas en el crecimiento somático y psicomotriz de acuerdo con
la edad biológica real (basada en la edad gestacional).
6. En esta etapa se observan velocidades de crecimiento y maduración mayores que en edades posteriores; por ello es más probable que
las lesiones orgánicas crónicas, que actúan durante periodos críticos del crecimiento, afecten el crecimiento y el desarrollo de manera
intensa y permanente.
DESDE LOS DOS AÑOS HASTA EL INICIO
DE LA PUBERTAD
En términos generales, al iniciar esta etapa ya se
llevaron a cabo los ajustes somáticos encaminados
a situar al paciente en sus parámetros genéticos
óptimos, aunque un porcentaje pequeño de niños
sanos puede continuar esta adaptación hasta los tres
o incluso los cuatro años de edad. La mayoría de
los pacientes no debe presentar modificaciones en
la velocidad y el ritmo de crecimiento, y por tanto, la
estatura avanza de manera paralela a la de los parámetros poblacionales; es decir, entre los dos años y
el inicio de la pubertad el paciente debe crecer en
la misma percentila de estatura y con una velocidad de crecimiento adecuada. Hasta que no se demuestre lo contrario, las desviaciones del canal
percentilar deben sugerir anormalidades, y obligan
a investigar la posibilidad de enfermedades sistémicas.
En este periodo se estabiliza el gradiente de
maduración, sobre todo de los dos a cuatro años
de vida. Asimismo, a estas edades, aquellos pacientes que poseen un determinante genotípico de
maduración lenta evidencian reducción en la velocidad de crecimiento con detención de la maduración biológica, de manera que la estatura se si-
108
Sección II • Concepto integral del crecimiento
túa con mucha frecuencia por debajo de la percentila familiar e incluso de la percentila tres de
crecimiento poblacional. Sin embargo, luego del
análisis individual del problema se encuentra: maduración biológica (ósea, dental y sexual) retrasada con respecto a la esperada para la edad cronológica; proporciones corporales armónicas en
relación con la maduración biológica, y estatura
adecuada para la edad ósea, es decir, acorde con la
percentila genética familiar. Desde los cuatro años
de edad, las velocidades de crecimiento y de maduración biológica coinciden de nuevo con las informadas para la población general; así, el análisis
retrospectivo permite diagnosticar con facilidad si
existe patrón retrasado de crecimiento, pero el análisis durante la etapa de disminución de esas velocidades requiere que el diagnóstico se establezca
por exclusión, es decir, a través de descartar la existencia de enfermedades crónicas con pocas manifestaciones.
Desde los dos años hasta el inicio de la pubertad, también se observa que una correlación directamente proporcional y lineal del incremento de talla
con respecto al aumento de peso de las visceras
abdominales (en particular del hígado), y de la masa
renal y filtración glomerular con respecto al metabolismo basal y a la estatura.
Además, las diferencias de maduración biológica secundarias a la edad gestacional se tornan
poco significativas; sin embargo, las mujeres aún
muestran maduración avanzada con respecto a los
varones, y esto se acentúa de manera muy significativa a partir de los seis a siete años de edad.
El control neuroendocrino se ejerce en esencia
por el sistema de la hormona del crecimiento y las
hormonas tiroideas (cap. 4) (fig. 9-5).
Desde el punto de vista genotípico familiar, se
sabe que los individuos con crecimiento, correspondiente a la percentila 97 poblacional producen al
día mayor cantidad de hormona de crecimiento que
aquéllos ubicados en la percentila 50, y éstos a su
vez presentan la misma diferencia con los situados
en la percentila tres. Estos datos confirman que el
control neuroendocrino varía de un individuo a otro
y que los factores genéticos determinantes desempeñan una función importante en esta regulación,
lo cual, en ausencia de condiciones biológicas, socioculturales o ambientales adversas, puede explicar las tallas relativamente constantes a través de
distintas generaciones de una familia (fig. 9-6).
Fig. 9-5. Influencia de diversos factores sobre la velocidad de crecimiento.
Capitulo 9 • Crecimiento posnatal
109
Fig. 9-6. Representación esquemática de la secreción de hormona de crecimiento en niños con diferentes tallas familiares.
La correlación entre la estatura de un individuo y la esperada para su genotipo familiar es apenas de 0.3 al momento del nacimiento, pero aumenta
hasta 0.8 a partir de los dos años de edad.
En países alejados del ecuador, se ha descrito
que aunque la velocidad de crecimiento anual es
constante, cuando se realiza un análisis estacional
se observa mayor velocidad durante la primavera y
el verano que en otoño e invierno; esto debe tomarse en cuenta durante el cálculo de la velocidad de
crecimiento mostrada por un niño en periodos
menores de 12 meses.
La diferencia de estatura en distintos grupos
raciales es un hecho conocido. Así, por ejemplo, los
dinkas y los watutsi poseen una estatura poblacional promedio de 196 cm para los varones, mientras
que otras tribus de África Central sólo alcanzan una
estatura final promedio de 172 cm aunque viven en
condiciones similares desde el punto de vista sociocultural, geopolítico y nutricio. No se conoce con
certeza el origen de estas diferencias, pero investigaciones recientes han demostrado lo siguiente:
1. Existen variaciones entre las clonas de células
que constituyen el somatotropo de manera que
algunas son más sensibles al efecto de la hormona liberadora de hormona de crecimiento;
la existencia de mayor cantidad de células derivadas de esas clonas se relaciona con mayor
cantidad de secreción de hormona de crecimiento al día; en cambio, cuando la mayoría
de las células tienen una sensibilidad baja, la
producción de hormona de crecimiento es
menor.
2. Individuos con estaturas alrededor de la percentila 50 poblacional poseen una proporción
similar de células bastante sensibles y de células menos sensibles, y los sujetos con talla familiar alta tienen un evidente predominio de
células con mayor sensibilidad. Por el contrario, los individuos con talla baja familiar presentan una constitución somatotrópica dependiente en su mayoría de células con sensibilidad baja.
El crecimiento observado durante la etapa prepubescente no depende por completo del control
neuroendocrino, ya que la velocidad de crecimiento es independiente de las concentraciones séricas
de hormona de crecimiento hasta en 25%; esto se
110
Sección II • Concepto integral del crecimiento
evidencia por el hecho de que los pacientes con
deficiencia total aislada de la hormona muestran
velocidades de crecimiento constantemente bajas y
equivalentes a 20 a 30% de las observadas en niños
sanos.
El efecto de los factores modificadores en la
etapa prepubescente es menos ostensible a corto
plazo que en edades previas, puesto que los periodos críticos del crecimiento son menos frecuentes
y además se observa mejor capacidad para recuperar el crecimiento una vez eliminada la influencia
de dichos factores.
En conclusión, las características del crecimiento desde los dos años hasta antes de iniciar la pubertad son:
1. Casi nunca se observan ya modificaciones de
ajuste al genotipo familiar, y cuando éstas persisten, se manifiestan sólo antes de los cuatro
años de edad.
2. Desde los dos a cuatro años de edad se manifiestan ajustes en el patrón de maduración biológica del individuo.
3. El control neuroendocrino se encarga en promedio de 75% del crecimiento, y es dependiente del sistema de la hormona del crecimiento.
4. Los factores modificadores lesionan menos el
crecimiento que en otras etapas, y es frecuente
observar la recuperación total del mismo luego del control de la enfermedad.
5. Aún hay variaciones en el gradiente de maduración entre varones y mujeres; esto se acentúa a partir de los seis a siete años de edad, de
manera que en el inicio de la pubertad puede
existir una diferencia de dos a tres años.
6. Las diferencias en relación con la edad gestacional dejan de tener significado estadístico,
aunque persisten.
7. La estatura guarda una correlación lineal y directamente proporcional con el crecimiento visceral, masa renal y filtración glomerular.
Según estudios recientes, la masa ósea de los
niños prepubescentes:
1. Aumenta un mes posterior al inicio de la deambulación.
2. Aumenta de manera directamente proporcional al peso del paciente, y el ejercicio desempeña una función secundaria en la ganancia de
tejido esquelético. De hecho, cuando el ejercicio se practica bajo el efecto de la fuerza de
gravedad (carrera, salto, gimnasia, etc.), se
aprecia un ligero incremento en la ganancia de
masa ósea por unidad de tiempo; pero cuando
se efectúa sin intervención de dicho efecto (natación) no se observa ganancia adicional. Por
el contrario, los niños que realizan ejercicio e
ingieren poco calcio presentan pérdida de masa
ósea.
PUBERTAD
Los cambios pubescentes ocurren en todos los individuos, siempre y cuando se alcance un gradiente de maduración, composición corporal y proporcionalidad similares e independientes de la edad
cronológica; es decir, en individuos con una misma
edad biológica, sin importar el tiempo empleado
para alcanzarla.
Estas características de maduración parecen
depender más del control genético que del neuroendocrino. Sin embargo, es evidente que aquellos
individuos con maduración acelerada inician a edad
más temprana su brote pubescente de crecimiento;
en cambio, quienes maduran de manera lenta o tardía pueden diferirlo hasta por cuatro años con respecto a los primeros, o en promedio dos años de
acuerdo con los patrones poblacionales habituales
(figs. 9-7 y 9-8).
Durante la pubertad, las hormonas sexuales se
agregan al control neuroendocrino descrito para
etapas previas (hormonas tiroideas y sistema de la
hormona del crecimiento); entonces se producen
modificaciones en la velocidad de crecimiento,
composición corporal y maduración de la capacidad reproductora, con ajustes que originan un fenotipo determinado para cada individuo.
Los andrógenos (posiblemente suprarrenales en
principio) aumentan sus concentraciones séricas en
ambos sexos. Este incremento relacionado con
mayor cantidad de hormona luteinizante, y es posible que también con cambios en la concentración y
acciones de la insulina, induce mayor síntesis de
aromatasas periféricas que se encargan de la conversión de andrógenos en estrógenos, con efectos
diversos en distintos ámbitos:
1. En el hipotálamo, el aumento de estrógenos
producidos por aromatización de andrógenos,
pero no por estrógenos gonadales, sensibiliza
al somatotropo para que a concentraciones
constantes de hormona liberadora de hormona
de crecimiento, sintetice y secrete mayor cantidad de hormona de crecimiento al día, lo cual
favorece el aumento de la velocidad de crecimiento (fig. 9-9).
2. A través de receptores intracelulares, pero también por efecto de receptores para dihidrotestosterona (por acción intracelular de la 5-alfa-
Capítulo 9 • Crecimiento posnatal
Fig. 9-7. Diferencias en el patrón del crecimiento de acuerdo con el inicio de la pubertad.
Fig. 9-8. Diferencias en el brote de crecimiento pubescente de acuerdo con el patrón de maduración.
111
112
Sección II • Concepto integral del crecimiento
mulante, y en mujeres el modelo pulsátil es más
acentuado que en varones.
En las mujeres los pulsos de hormona luteinizante se relacionan con mayor producción de estradiol ovárico, el cual se encarga del crecimiento
y maduración de la glándula mamaria; por tanto,
existe una relación directa entre la gonadarquía y
la telarquía.
Maduración de mamas
Para el análisis de los cambios mamarios, Tanner
ha descrito cinco etapas o estadios de maduración
sexual:
Fig. 9-9. Diferencias en la secreción de hormona de crecimiento
de acuerdo con la edad.
reductasa que convierte testosterona a dihidrotestosterona), los estrógenos originados por
aromatización intracelular de andrógenos sensibilizan al receptor para factor de crecimiento
tipo insulina-1 y aumentan la efectividad de las
vías metabólicas a nivel posreceptor; esto produce mayor capacidad de respuesta ósea al
crecimiento, ya que se favorece el aumento de la
proliferación celular y de síntesis de la matriz
ósea, así como la mineralización. Sin embargo,
la proliferación celular disminuye por el efecto
contrario de estrógenos circulantes 3. En
varones y mujeres, los estrógenos gonada-les, en
particular los que no se obtienen de la
aromatización intracelular de andrógenos, aceleran la calcificación del cartílago de crecimiento;
por ello, en dos a tres años, éste desaparece casi
por completo y se alcanza la estatura definitiva.
Los cambios somáticos o características sexuales que acompañan a la pubertad se presentan en
respuesta a distintos estímulos neuroendocrinos
El primer acontecimiento demostrado es que
la hormona hipotalámica liberadora de gonadotropinas (hormona liberadora de hormona luteinizante [LHRH]) cambia el modelo de secreción tónico
(de concentraciones séricas similares de manera
constante) por el modelo de secreción pulsátil que
en principio es más acentuado durante las tardes y
después logra un patrón maduro de mayor secreción nocturna. Esto también origina que las hormonas luteinizante y foliculostimulante cambien de
manera similar hacia el patrón pulsátil; en ambos
sexos, las concentraciones séricas de la hormona
luteinizante son mayores que las de la foliculosti-
1. Prepubescente. Sin datos que sugieran maduración.
2. El tejido glandular empieza a crecer, por lo que
hay ligera elevación del contorno del busto. La
aréola puede aumentar su diámetro de manera
muy leve. Esta etapa es por lo general de inicio
unilateral, y pueden transcurrir hasta seis meses para que la glándula contralateral presente
este estadio. Al mismo tiempo, las terminaciones nerviosas libres proliferan cerca de la superficie del tejido mamario y de la piel, por lo
que con frecuencia las niñas refieren una sensación de parestesia o incluso de dolor ante
estímulos de presión como recargar el tórax
contra una superficie de consistencia aumentada (libros, colchón, paredes, abrazos, etc.) o
ante cambios bruscos de humedad o temperatura como los que se presentan al inicio del aseo
corporal en regadera, al principio de cada episodio de lluvia o al entrar a otro ambiente de
muy distinta temperatura.
3. El pezón se diferencia y adquiere coloración
más oscura que la de la piel circundante y la
aréola, y se acelera su velocidad de crecimiento. El diámetro de la aréola puede continuar
aumentando de manera lenta.
4. La aréola sufre gran hiperplasia e hipertrofia;
asimismo, se pigmenta y aumenta su diámetro
con rapidez, y aparecen los corpúsculos de
Morgagni. En algunas mujeres, el aumento de
volumen es tan notable que puede observarse
un contorno propio de la aréola sobre la superficie del busto, lo cual da la impresión de que
el pezón se encuentra incluido dentro de ella.
El volumen del busto inicia un incremento más
acelerado.
5. Disminuye la velocidad de crecimiento de la
aréola, y se adquieren las proporciones finales
de ésta y del pezón. El busto continúa aumentado de volumen hasta por uno a tres años.
Capítulo 9 • Crecimiento posnatal
Estos cambios se producen en todas las mujeres; sin embargo, se ha informado que en la población indígena de América existe detención de la
maduración cuando se alcanza la etapa tres, la progresión a la etapa cuatro se produce hasta el inicio
de la primera gestación, y la etapa cinco se observa
hasta terminar la lactancia de esta primera gestación.
El volumen de las mamas no se relaciona con
su capacidad de maduración, sino que está regulado por características genéticas de una de las dos
ascendencias familiares (paterna o materna) y está
influido por el estado nutricio de la paciente a partir de los siete a ocho años de edad.
Por lo general, el varón observa una maduración mamaría incompleta que alcanza los estadios
2 o 3 descritos por Tanner, y que se denomina ginecomastia pubescente; ésta ocurre porque una proporción relativamente alta de andrógenos suprarrenales sufre aromatización en los tejidos periféricos
que los convierte en estrógenos. Luego del aumento en la producción de andrógenos testiculares, la
ginecomastia tiende a revertirse de manera gradual
y a desaparecer por completo, excepto en aquellos
que durante la pubertad mantienen 30% más del
peso ideal y en aquéllos con antecedentes familiares de ginecomastia persistente.
Maduración púbica
En ambos sexos, los andrógenos suprarrenales inducen cambios en los folículos pilosos que poseen
receptores para andrógenos. El vello púbico se clasifica por Tanner en estadios, con la finalidad de
uniformar criterios:
1. Ausencia de vello sexual. Debe señalarse, que
a partir de los siete años en niñas y de los nueve en niños, el vello en la mitad inferior del
abdomen y de las extremidades con frecuencia
comienza a pigmentarse de manera ligera pero
persistente, lo cual no debe confundirse con los
estadios señalados para el vello púbico.
2. Engrosamiento, pigmentación y crecimiento
acelerado del vello que se encuentra a la altura
de escroto y alrededor de la base del pene en
los varones, así como del vello presente alrededor de los labios mayores en las mujeres.
3. Continúa el engrosamiento y pigmentación del
vello, que además se riza y se extiende por la
parte central de la región púbica hacia la sínfisis del pubis.
4. El vello alcanza la región de la sínfisis del pubis, y es más abundante en la región central del
abdomen.
113
5. El vello se extiende a las regiones inguinales y
alcanza las zonas superior, anterior y lateral
interna de los muslos; además se distribuye
desde la región genital hacia la región anal. El
vello es ahora muy abundante.
6. Extensión del vello desde la sínfisis del pubis
hacia la cicatriz abdominal. En los varones esta
etapa es mucho más acentuada, y en las mujeres debe indicar hiperandrogenismo aunque no
constituye un suceso anormal en todos los casos.
Además del aumento de vello púbico, también
se incrementa la pilosidad en otras regiones corporales, entre ellas:
1. Caras anterior y posterior del tórax, a la altura
pectoral y lumbosacra respectivamente. En
varones, la cantidad y pigmentación del vello
es por lo general más acentuadas que en mujeres de la propia familia.
2. El vello de la cara se pigmenta a la altura de la
región nasolabial (bigote) y de la rama ascendente del maxilar superior (patillas). Esto ocurre en ambos sexos con una intensidad similar
durante alrededor de un año; pero posteriormente en las mujeres tiende a limitarse e incluso a desaparecer, mientras que en los varones
continúa progresando durante dos a seis años,
y también aparece a la altura de la rama horizontal de la mandíbula (barba) y parte anterosuperior del cuello.
3. El vello que surge en axilas al principio es escaso y delgado a lo largo de la línea media axilar; posteriormente se engruesa y pigmenta
más, y se distribuye hasta la línea lateral de las
axilas. Tanner denomina a estas etapas dos y
tres, respectivamente.
4. El vello que forma las cejas tiende a engrosar
y a crecer en progresión lenta; en mujeres esto
ocurre durante alrededor de cuatro años y en
los varones continúa durante toda la vida.
5. Surge vello, por lo general escaso, en hombros
y en la parte superior de la espalda, y en ocasiones en brazos y muslos.
6. Aparece vello escaso y delgado a la altura de
la primera falange de los dedos de la mano,
excepto el pulgar, y de los cinco dedos de los
pies.
De manera similar a lo descrito para la maduración mamaria, las poblaciones indígenas de Mesoamérica presentan pilosidad corporal mucho
menor a la observada en las de origen ario y mediterráneo, y el vello tiende a ser menos rizado; por
114
Sección II • Concepto integral del crecimiento
ello, no es raro observar mujeres adultas con vello
sexual similar al descrito en el estadio tres y varones que alcanzan sólo un estadio tres a cuatro; asimismo, el vello en tronco (anterior y posterior) tiende a ser muy escaso o ausente, y el vello facial más
separado y delgado.
Debe señalarse que el vello corporal de antebrazos y cara posterior de las manos, así como de
regiones pretibiales, no depende en esencia de efectos androgénicos, sino de características genéticas
(principalmente en pueblos mediterráneos), aunque
su expresión fenotípica se evidencia durante la
pubertad.
Otros cambios secundarios al incremento de
andrógenos suprarrenales son: aparición de lesiones comedónicas y acneicas en cara y tronco; recesión de la línea de implantación del cabello, y
engrasamiento de las cuerdas vocales que torna más
grave el tono de la voz. Es importante señalar que
en mujeres el engrosamiento es muy leve, por lo
que el tono de la voz cambia mucho menos respecto del observado en la infancia, y estos cambios prácticamente se detienen a los cuatro años
después del inicio de la pubertad. En cambio, en
varones el engrosamiento de las cuerdas vocales es
mucho más rápido y acentuado, por lo que el tono
de la voz es significativamente más grave que el
observado antes de la pubertad, y aunque los cambios de la voz son más evidentes en los primeros
cuatro años después del inicio de esta etapa, no se
detienen y continúan en lenta progresión durante
toda la vida.
En ambos sexos, aunque con mayor intensidad
en los varones, el aroma del sudor se torna más
fuerte y penetrante.
Maduración de las gónadas
El aumento de hormona foliculostimulante en varones induce espermatogénesis e incremento de
volumen testicular, y la acción de hormona luteinizante sobre las células esteroidógenas gonadales
(Leydig) aumenta la capacidad de síntesis de testosterona, la cual potencia los cambios originados
por los andrógenos suprarrenales. En conjunto, los
cambios en los genitales masculinos han sido clasificados por Tanner en cinco etapas de maduración sexual:
1. Genitales prepubescentes.
2. Crecimiento testicular, y engrosamiento y pigmentación del escroto. El pene comienza a crecer sobre todo en sentido longitudinal. Se presentan erecciones frecuentes y en ocasiones
eyaculación sin espermatozoides.
3. Aumenta la pigmentación y rugosidad del escroto. El pene continúa en crecimiento longitudinal pero ahora incrementa también su circunferencia de manera importante.
4. Existe diferenciación definitiva del glande, con
gran hipertrofia e hiperplasia que le den apariencia de desproporción respecto del cuerpo
del pene. A partir de esta etapa se presentan
eyaculaciones con espermatozoides.
5. El glande disminuye su crecimiento, y la longitud y circunferencia peneanas alcanzan sus
dimensiones definitivas; asimismo, el cuerpo
y el glande del pene llegan a sus tamaños definitivos.
En mujeres, la hormona foliculostimulante
produce crecimiento y maduración de folículos
ováricos y la hormona luteinizante origina síntesis
de estrógenos en las células esteroidógenas (teca
interna), con lo cual se inicia la regulación de los
ciclos menstruales. La menarquía suele ocurrir
cuando el índice de maduración sexual se encuentra en etapa cuatro (mamaria o púbica), y en las
mexicanas se presenta a la edad promedio de 12
años con 11 meses. No es raro que durante los primeros 12 a 24 meses estos ciclos sean anovulatorios,
por lo que suelen ser irregulares y sin dismenorrea.
Durante el desarrollo de la pubertad los huesos craneales engruesan alrededor de 15%; la frente se hace prominente por el crecimiento de los arcos
superciliares y de los senos frontales (que aparecen
aproximadamente a los nueve años de edad). En
otros mamíferos (sin descartar de manera categórica a los seres humanos), se ha demostrado que el
crecimiento de los caninos depende de la testosterona.
Ambos sexos, pero en mayor grado el masculino, presentan las siguientes características:
1. Aumento de volumen cardiaco, con mayor presión de eyección sistólica y mayor capacidad
de las cavidades durante la diastole; en consecuencia, la frecuencia cardiaca disminuye en
estado de reposo.
2. Aumento de volúmenes pulmonar y respiratorio basal, así como aceleración de la velocidad
de intercambio gaseoso a nivel alveolar
3. Incremento de la tensión arterial con presión
sistólica de más de 100 mm Hg.
4. Aumento de la eritropoyesis medular, así como
de las concentraciones de hemoglobina y de la
capacidad de ésta para transportar oxígeno, lo
cual mejora el aporte tisular.
5. Incremento de filtración glomerular, de manera paralela al incremento de la masa muscular
Capítulo 9 • Crecimiento posnatal
Las mujeres muestran máxima velocidad de
crecimiento durante el estadio dos de maduración
mamaria, y los varones a partir del estadio cuatro
de maduración genital. La diferencia de estaturas
entre varones y mujeres de igual edad cronológica
puede explicarse por lo anterior, aunado al hecho
de que las mujeres en promedio inician su pubertad dos años antes que los varones y que el estadio
dos de maduración mamaria es un acontecimiento inicial durante la pubertad, mientras que el estadio cuatro es un suceso de la segunda mitad de esa
etapa.
La menarquía en las mujeres ocurre casi siempre cuando la velocidad de crecimiento se encuentra en descenso. De hecho, hasta 95.5 + 1.2% de las
mexicanas han alcanzado su estatura casi definitiva
en el momento de la primera menstruación, y aumentan sólo 3 a 5 cm posteriormente. En contraste,
la espermenarquía en varones se presenta antes o
de manera simultánea al incremento máximo de la
velocidad de crecimiento.
En ambos sexos, durante la primera mitad de
la pubertad el segmento inferior crece ligeramente
más rápido que el segmento superior. Sin embargo,
el crecimiento de ambos segmentos en las mujeres
se iguala en la segunda mitad de la pubertad, hasta
la menarquia; después, el segmento inferior deja
de crecer por completo y entonces el crecimiento
posmenárquico se debe sólo al segmento superior.
En los varones el crecimiento de ambos segmentos
se mantiene en proporciones iguales hasta el término de la pubertad, lo cual explica la diferencia de la
relación de segmentos entre varones y mujeres adultos; asimismo, cuando el segmento inferior, que es
más sensible a cambios nutricios, sufre deterioro
de crecimiento longitudinal prepubescente, se mantiene una relación anormal incluso hasta la vida
adulta.
Durante la pubertad la máxima velocidad de
crecimiento de los pies se alcanza seis meses antes
que la del resto de los miembros inferiores y, por
tanto, el subsegmento del segmento inferior deja
de crecer más pronto.
La proporcionalidad corporal se establece en
el año previo al inicio del brote de crecimiento
pubescente (antes de los 11 años en mujeres mexicanas), como resultado de la interacción de factores genéticos y ambientales, y sufre cambios mínimos después del inicio de la pubertad; de esa manera, aunque en etapas prepubescentes la proporcionalidad se relaciona con la edad biológica, llegado el brote de crecimiento pubescente resulta
poco útil como parámetro de desarrollo.
Las medidas de composición corporal no mantienen correlación con la menarquía; ésta se pre-
115
senta cuando se alcanza una masa crítica corporal
dependiente de tejido muscular (proteínas), sin
importar el peso, la estatura y la edad cronológica.
También entre crecimiento, nutrición y proporcionalidad hay ausencia total de correlación con la edad
cronológica a la que se presenta la menarquía, aunque en diversos estudios se ha señalado que ésta
coincide con 36.7 a 48.1 kg de peso. Dado que la
menarquía se presenta a una misma edad biológica, es evidente la estrecha relación entre la estatura
y el peso, y entre el peso y la cantidad de grasa y
músculo, pero no entre el peso y la relación de grasa
y de músculo; también es notable la falta de dependencia entre la proporcionalidad corporal y el tamaño del cuerpo.
Las medidas somatométricas se relacionan muy
de cerca con el nivel socioeconómico de la población estudiada. Las variables más afectadas son las
del crecimiento físico, y al modificarse con distinta
intensidad originan cambios en la proporcionalidad;
las menos afectadas son las de composición corporal. Por ello, el fenotipo varía en grado y momento
acorde con las agresiones ambientales; pero el estado de nutrición se conserva en tiempo y satisfacción de acuerdo con las circunstancias.
En el transcurso de la edad biológica, los púberes de ambos sexos con nivel socioeconómico
bajo pierden velocidad de crecimiento y obtienen
menor estatura, pero conservan una buena composición corporal; ésta es una conducta biológica prácticamente universal.
La predicción de estatura en etapas prepubescentes tiene un margen de error de 0.4 desviaciones estándar para mujeres (5 a 7 cm), y de 0.5 desviaciones estándar para varones (6 a 8 cm).
POSPUBERTAD
Una vez culminada la pubertad, el organismo tiende a adquirir un signo neutro de crecimiento (equilibrio entre generación y destrucción de tejido);
además, la capacidad de crecimiento longitudinal
óseo está por terminar, de manera que la estatura
alcanzada, la proporcionalidad y la composición
corporales se orientan a permanecer sin modificaciones. Sin embargo, todavía se presentan algunos
cambios durante los siguientes tres a cinco años.
En los subsegmentos del segmento inferior es
notorio que la pierna deja de crecer por completo a
partir de la menarquía (y en pocos pacientes dos
años después), mientras que el muslo puede continuar creciendo hasta por dos años más. Las relaciones de antebrazo x 100/miembro superior y de
pierna X 100/miembro inferior, sugieren gradien-
116
Sección II • Concepto integral del crecimiento
tes pospubescentes específicos e independientes del
gradiente cefalocaudal.
Al término de la pubertad el crecimiento no
cesa por completo, en especial en el segmento superior en mujeres, ya que debido a la aposición de
hueso a las caras superior e inferior de los cuerpos
vertebrales la columna vertebral continúa en desarrollo hasta alrededor de los 30 años, con un incremento de 1 a 5 cm en los primeros tres años posteriores a la menarquía, y después aumenta hasta 3 a
5 mm en total. En algunos estudios se ha demostrado que durante la primera gestación, algunas mujeres incrementan su estatura entre 1 y 3 cm, a expensas del segmento superior.
La estatura permanece constante en mujeres de
30 a 45 años y en varones de 25 a 60 años, y después empieza a disminuir, tanto por pérdida de grosor de los cuerpos vertebrales y deshidratación de
los discos intervertebrales como por disminución
de los espacios entre los huesos largos del miembro inferior.
La anchura de hombros (diámetro biacromial),
tórax y de la pelvis (diámetro bicrestal) en las
mujeres inicia su periodo de crecimiento rápido
hacia la mitad de la pubertad, y al final de ella en
los varones, pero hasta cinco años después se adquieren las proporciones transversales. Algunas
mujeres al término de la gestación muestran ligero
incremento del diámetro bicrestal en comparación
con el observado antes del embarazo. Una vez que
se alcanza el crecimiento transversal máximo del
cuerpo, cesa por completo el periodo de crecimiento con signo positivo.
Durante los dos a cinco años posteriores a la
menarquía, las mujeres tienden a aumentar su acumulación de grasa; de ese modo, la relación de área
grasa en comparación con el área total del cuerpo,
que previo a la menarquía es de 33.1%, llega a
36.9% en este lapso.
El aumento de peso posmenárquico se acompaña de algunos cambios de composición corporal,
y se debe a mayor acumulación relativa de grasa
que de músculo. De manera tardía, cuando el peso
se hace asintótico, el brazo pierde grasa y presenta
aumento relativo del área muscular.
Cinco años después de la menarquía, las medidas de peso, estatura, superficie corporal, perímetro cefálico, segmento superior, segmento inferior,
diámetro biacromial, diámetro bicrestal, y de hecho, todas las relacionadas con el crecimiento
cefalocaudal, se hacen asintóticas, con excepción
de la longitud del pie y de la mano que lo hacen a
partir de la menarquía.
Las proporciones corporales de individuos
pertenecientes a distintas etnias son variadas. Así
por ejemplo, los negros tienden a poseer longitud
de piernas mayor a la de caucásicos y mediterráneos; pero los hombros de estos últimos (diámetro
biacromial), para ambos sexos, son más anchos en
relación con las caderas (diámetro bicrestal).
LECTURAS RECOMENDADAS
Ambler GR, Gluckman PD. Postnatal growth-an overview.
En: Gluckman PD, Heymann MA (eds). Perinatal and
pediatric pathophysiology. London: Hodder and Stoughton Limited, 1993:170.
Cameron N. Weight and skinfold variations at menarche
and the critical body weight hypothesis. Ann Hum Biol
1976;3:279.
Frisch RE, Revelle R, Cook S. Components of the critical
weight at menarche and it initiation of the adolescent
spurt: estimated total water, lean body mass and fat. Hum
Biol 1973;45:469.
Frisch RE, Revelle R. Height and weight at menarche and
a hypothesis of critical body weight and adolescent
events. Science 1970;169:397.
Frisch RE. Weight at menarche. Pediatrics 1972;50:445.
Hiernaux J. Bodily shape differentiation of ethnic groups
and of the sexes through growth. Human Biol 1968;40:
44.
Johnston FW, Roche AF, Schell LM, Wettenhall MD. Critical weight at menarche: critique of a hypothesis. Am J
Dis Child 1975;129:19.
Malina R. Adolescent changes in size, build, composition
and performance. Hum Biol 1974;46:117.
Maresh MM. Linear growth of long bones of extremities
from infancy through adolescence. Am J Dis Child
1955;89:725.
Marín G, Domeñe H, Barnes KM, Blackwell BJ, Cassorla
FG, Cutler GB. The effects of estrogen priming and
puberty on the growth hormone response to standardized treadmill exercise and arginine-insulin in normal
girls and boys. J Clin Endocrinol Metab 1994;79:537.
Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in girls and boys. Arch Dis Child 1969;44:
291.
Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in girls and boys. Arch Dis Child 1970;45:
13.
Martha PM, Rogol AD, Carlsson MS, Gesundheit N, Blizzard RM. A longitudinal assessment of hormonal and
physical alterations during normal puberty in boys. I:
serum growth hormone-binding protein. J Clin Endocrinol Metab 1993;77:452.
Nilsson A, Isgaard J, Isaksson OGP. The role of growth
hormone in postnatal growth and metabolism. En:
Gluckman PD, Heymann MA (eds). Perinatal and pediatric pathophysiology. London: Hodder & Stoughton
Limited, 1993:174.
Capitulo 9 • Crecimiento posnatal
Ramos RG. Análisis de dos estudios de peso y de talla
hechos con 50 años de diferencia en niños de la
ciudad de México. Bol Med Hosp Infant Mex
1978;35:441.
Ramos RG. Somatometría pediátrica. Arch Invest
Med 1975;6(supl 1):83.
117
Rose SR, Municchi G, Barnes KM. Spontaneous
growth hormone secretion increases during puberty
in normal girls and boys. J Clin Endocrinol Metab
1991;73:428.
Tanner JM. Earlier maturation in man. Scientific Am
1968; 218:21.
Capítulo
10
Estudio del paciente
con talla baja
La estatura inferior a la esperada para la edad y sexo
de un paciente constituye sólo la representación
clínica que se demuestra con mayor frecuencia en
alteraciones del crecimiento; pero por lo general
ésta no es el único signo ni forzosamente el más
llamativo en un análisis completo y adecuado del
crecimiento de un niño.
El crecimiento, en la valoración general de un
paciente, conduce al diagnóstico de un estado patológico en presencia de una o más de las siguientes condiciones:
1. Estatura acumulada menor a la esperada para
la edad cronológica del paciente, con relaciones somatométricas ya sea armónicas o disarmónicas. Puesto que en el análisis de la estatura acumulada se utilizan parámetros percentilares de distribución poblacional que consideran anormal la estatura inferior a la percentila
3, existe por definición 3% de la población
general que tiene estatura baja.
2. Estatura acumulada inferior a la esperada para
las estaturas familiares, desde los dos años de
edad. En este caso, la frecuencia de diagnóstico de estatura baja es cercana a 10 o incluso
15% de la población general.
3. Velocidad de crecimiento inferior a la espera
da para la edad cronológica del paciente. Dado
que se considera sin lugar a dudas como anormal una velocidad inferior a la percentila 10
de crecimiento, existe por definición 10% de
la población con velocidad de crecimiento subnormal.
118
BASES DEL DIAGNOSTICO
El estudio adecuado del crecimiento de un paciente requiere de los siguientes elementos:
1. Parámetros poblacionales de estatura acumulada. Permiten situar al paciente dentro o fuera
de los límites "habituales" (no por fuerza "normales") en que se distribuyen las estaturas de
la población.
2. Parámetros familiares de crecimiento. Su propósito es disminuir la dispersión de estaturas
poblacionales y situar al paciente en un contexto biológico más cercano a sus características genéticas; esto permite definir si la estatura acumulada para la edad es acorde con el
mínimo esperado según la manifestación epigenotípica de crecimiento familiar, sin importar su ubicación dentro o fuera del límite habitual de estatura poblacional.
3. Velocidad de crecimiento. Su utilidad radica
en definir si existe alguna evidencia de limitación en el incremento de estatura que pueda
indicar anomalía actual. Para evaluar este parámetro se usan percentilas poblacionales y se
asume que la especie humana debe mostrar incrementos similares para una edad biológica
determinada.
4. Edad biológica, determinada a través de los gradientes de maduración esquelética, genital,
sexual y dental. El crecimiento pasado y presente es función de la maduración somática;
por ello, sin una evaluación aproximada de la
Capítulo 10 • Estudio del paciente con talla baja
velocidad de "envejecimiento" en relación con
la edad cronológica, es imposible determinar
la normalidad de este fenómeno.
5. Análisis de las proporciones corporales, y en
su caso de la composición corporal. Esto permite establecer la armonía del crecimiento, así
como determinar con mayor precisión el momento en que la progresión del crecimiento
pudo modificarse y el grado de influencia de
una enfermedad sobre la estatura.
6. Búsqueda intencionada y minuciosa de signos
o síntomas presentes y pasados que puedan se
ñalar la existencia de una alteración orgánica,
afectiva o sociocultural, ya que la estatura baja
en la mayoría de los pacientes se debe a uno o
varios procesos patológicos que se presentan
de manera aislada o en asociación, en el pasado o presente, o ambos.
La siguiente dinámica de análisis del crecimiento se basa en la sencillez y la confiabilidad, y sólo
requiere de la evaluación de variables fáciles de
obtener y a bajo costo:
1. Verificar si la estatura se encuentra por arriba
o por debajo de la percentila 3 poblacional, a
través de las gráficas de estatura acumulada
según edad y sexo. Por norma internacional,
los menores de dos años de edad deben medirse en decúbito dorsal, sin importar si caminan
o no (longitud), y los mayores de esa edad
deben ponerse de pie (estatura); en ambos casos es necesario vigilar que las piernas, columna y cuello se extiendan por completo y que la
cabeza se coloque en posición neutra (la línea
imaginaria a través del canto externo del ojo y
del centro del conducto auditivo externo debe
tener un ángulo de 90 grados en relación con
la columna vertebral). Evitar que el paciente
se acueste sobre una colchoneta durante la
determinación de la longitud.
2. A cualquier edad la longitud es 1 a 3 cm mayor que la estatura. Por ello, toda gráfica de
crecimiento que represente estaturas desde el
nacimiento hasta los 18 o 20 años de edad debe
mostrar un "escalón" exactamente a los dos
años de edad (momento en que se determina la
longitud y la estatura), debido a la diferencia
del método empleado para medir al paciente.
Lo contrario es señal inequívoca de que la gráfica se "redibujó" y su información pierde validez, ante lo cual no se recomienda su uso.
3. En cuantificaciones de la longitud, cualquier
valor inferior al de la percentila 3 debe considerarse diagnóstico de estatura baja; aunque los
119
valores superiores no indican necesariamente
crecimiento adecuado, ya que en menores de
dos años pudiera haber falta de expresión del
patrón de crecimiento familiar.
4. Desde los dos años de edad, la estatura mínima esperada para el patrón familiar se determina de la siguiente manera:
A. Se calcula la estatura final esperada, utilizando las siguientes fórmulas de acuerdo
al sexo del paciente:
Varón: talla media familiar + 6.5 cm
Mujer: talla media familiar - 6.5 cm La
talla media familiar se obtiene mediante el
promedio aritmético de las estaturas del
padre y de la madre.
B. La estatura final obtenida se extrapola a las
gráficas poblacionales para el sexo respectivo y para los 18 o 20 años de edad. Por
ejemplo: el padre de un varón mide 178
cm y la madre 167 cm, de manera que la
estatura final esperada es de 179 cm; ésta
corresponde a 2 cm más de la percentila
50 poblacional y constituye la "percentila
familiar".
C. La estatura actual del paciente se extrapola a las gráficas, y se le considera normal
cuando es hasta 4 cm mayor o menor que
la "percentila familiar". Siguiendo el ejemplo anterior, el niño a los siete años con
seis meses mide 116 cm, y se sitúa en la
percentila tres poblacional y, por tanto, dentro de los límites habituales de distribución
poblacional. Sin embargo, de acuerdo con
la percentila familiar debería esperarse una
estatura de 127 cm (con límites de 123 a
131 cm) correspondiente a la percentila 50
poblacional ± 2 cm; este déficit de 11 cm
por debajo de lo esperado indica estatura
D. La estatura es sólo la manifestación epigenotípica del crecimiento de un individuo;
con base en esto, es conveniente comprobar si los padres del paciente tienen una
estatura acorde con las de sus hermanos y
padres (tíos y abuelos del niño), por lo que
se recomienda utilizar las mismas fórmulas para determinar la estatura mínima esperada para los padres. Debe recordarse que
algunos problemas de crecimiento pueden
heredarse o transmitirse de generación en
generación.
5. Se define la velocidad de crecimiento (estatura actual menos estatura hace 365 días) y los
resultados se extrapolan a las gráficas de velocidad de crecimiento. Una velocidad de ere-
120
Sección II • Concepto integral del crecimiento
cimiento normal, con estatura acumulada
baja, señala que un trastorno ya resuelto limitó
el crecimiento en el pasado; una velocidad de
crecimiento baja con estatura acumulada normal indican una alteración actual; una velocidad de crecimiento baja con estatura acumulada baja representan la coexistencia de alteraciones anterior y actual.
6. La medición de la armonía corporal es importante para constatar la proporcionalidad del crecimiento. Aunque pueden utilizarse diversas relaciones somáticas, se recomienda por lo menos analizar las relaciones entre los segmentos
superior e inferior y entre la brazada y la estatura, así como comparar estos valores con los
habituales para la población general a una edad
cronológica determinada.
La relación entre los segmentos superior e
inferior (SS/SI) se determina de la siguiente
manera: la distancia en decúbito dorsal entre
el borde superior de la sínfisis del pubis y los
talones (segmento inferior) se resta a la longitud (estatura), lo cual da por resultado la longitud del segmento superior que a su vez se
divide entre el segmento inferior. En un varón
de ocho años de edad con 124 cm de longitud
(estatura en decúbito) y segmento inferior de
61 cm, el segmento superior es de 63 cm (124
— 61 = 63) y la relación de segmentos superior
e inferior equivale a 1.03 (63/61 = 1.03); dicha
relación corresponde a la descrita para la edad,
por lo que se asume que el crecimiento de
ambos segmentos ha sido armónico.
La relación entre brazada y talla (Br/T) se
determina midiendo la longitud de la brazada
(distancia entre las yemas del dedo medio de
una mano y el de la mano contralateral, con
los brazos a 90 grados con respecto a la columna y extendidos por completo) para restarla a la estatura de pie. Si la brazada es de 119.5
cm y la estatura 122 cm, la relación entre ambos es de -2.5 cm (119.5 - 122 = -2.5); este
resultado corresponde a lo esperado para la
edad, por lo que se asume que la relación entre
el crecimiento longitudinal (estatura) y los crecimientos longitudinal y transversal (brazada)
es adecuada:
estatura = crecimiento longitudinal de la
suma de los segmentos
superior e inferior
brazada = crecimiento longitudinal de
los brazos más crecimiento
transversal del tórax
Las alteraciones del crecimiento óseo (displasia y raquitismo) o enfermedades con reper-
cusión ósea grave (nutricias, cardiacas, endocrinas y neoplásicas) pueden causar disarmonía.
7. Por último se determina la edad biológica a través de la edad ósea, edad dental y edad sexual.
En menores de un año la edad ósea se determina en rodilla y mano, del año en adelante en
mano no dominante (izquierda en diestros y
derecha en zurdos), y a partir de la pubertad en
la cresta iliaca además de la mano. Para calcular la edad dental se debe considerar el número
de piezas dentarias (temporales o permanentes), su grado de erupción y si sus superficies
se ponen en contacto con la pieza equivalente
de aposición (inferiores con superiores). En
etapas prepubescentes, la edad sexual se puede calcular en varones mediante la determinación de los volúmenes testicular y peneano, y
a partir de la pubertad por el índice de maduración sexual de Tanner y Marshall, para ambos sexos.
CAUSAS Y FISIOPATOLOGIA
Las alteraciones del crecimiento pueden deberse a
uno o varios factores (genéticos, neuroendocrinos,
nutricios, orgánicos, sociales o ambientales); es
posible que entre ellos exista no sólo adición sino
sinergismo.
Factores genéticos
Las características genéticas de un individuo (genotipo) determinan de manera importante la adquisición de una estatura que represente 100% de la
capacidad de crecimiento. La disminución del material genético (monosomías, deleciones, translocaciones no balanceadas), exceso (polisomías) o expresión anormal del mismo, conduce en general a
una estatura menor a la esperada para la familia y la
comunidad que se manifiesta desde la vida intrauterina; de esa manera, el paciente presenta estatura baja desde el momento del nacimiento, la cual se
acompaña casi invariablemente de defectos en la
estructura y función de uno o más órganos, así como
de dismorfias (alteraciones en forma, dimensiones
y localización de vello corporal, párpados, nariz,
pabellones auriculares, boca, cuello, dedos, piel y
faneras, genitales, etc.) capaces de producir morbilidad y disfunción para la integración sociocultural.
La estatura baja que constituya una de las
manifestaciones de alteración genética debe conducir a la definición prioritaria de una o más de las
siguientes características:
Capítulo 10 • Estudio del paciente con talla baja
1. Aunque el cariotipo sea normal es probable que
uno o más genes se encuentren afectados; por
tanto, deben confirmarse y en su caso descartarse alteraciones estructurales o funcionales
multiorgánicas, secundarias a deficiencia de
una o más enzimas, receptores, neurotransmisores, proteínas intracelulares y extracelulares,
etcétera.
2. No todas las alteraciones secundarias a la
genopatía se manifiestan desde el nacimiento;
en consecuencia, es necesario mantener una vigilancia a largo plazo para evaluar los riesgos
específicos de cada paciente (inmunológicos,
oncológicos, degenerativos, etc.).
3. Precisar si existe transmisión familiar de la
enfermedad y proporcionar consejo genético a
los padres, y en su momento, al paciente y a
sus hermanos.
4. Vigilar el crecimiento a través de gráficas específicas para la enfermedad que afecta al paciente (estatura acumulada, velocidad de crecimiento, proporcionalidad somática); así, es
posible identificar de manera oportuna las desviaciones del patrón cuando se agregan otros
factores limitantes del crecimiento. En gráficas para población "normal", las desviaciones
del crecimiento son evidentes sólo de manera
tardía, ya que es más difícil precisar si el crecimiento o una estatura acumulada se alejan
de las percentilas poblacionales a una velocidad mayor de la permitida para la alteración
del niño.
121
produce), paracrina (sobre células cercanas a la que
los produce) y endocrina (sobre células distantes a
la que los produce).
Los factores reguladores del crecimiento mejor estudiados son los que integran el sistema de la
hormona del crecimiento y se explican a continuación (fig. 10-1):
1. En el ámbito pretalámico, el aumento de tonos
adrenérgico, serotoninérgico y colinérgico facilita la secreción pulsátil de la hormona liberadora de hormona de crecimiento, mientras
que la exposición crónica a bloqueadores adrenérgicos, antihistamínicos, antiserotoninérgicos
y anticolinérgicos que atraviesan la barrera
hematoencefálica puede disminuirla.
2. La hormona liberadora de hormona de crecimiento se produce en los núcleos arqueado y
ventromedial del hipotálamo. La destrucción
hipotalámica con disminución o pérdida de la
secreción de dicha hormona liberadora puede
originarse por malformaciones hipotalámicas
o vasculares, lesiones hipóxicas en la etapa
perinatal o en otras edades, neuroinfecciones,
tumoraciones suprasellares y metástasis tumorales.
La existencia de un patrón genético de talla
familiar baja se asume en un paciente con estatura
baja para los parámetros poblacionales pero acorde
con las estaturas familiares, y en ausencia de enfermedad demostrable. Sin embargo, este diagnóstico
debe establecerse con cautela cuando las proporciones corporales no son adecuadas para la edad (p. ej.,
en displasias óseas con afección leve del crecimiento óseo de uno o más segmentos corporales y que se
transmiten con bases genéticas) o cuando existe evidencia de que dos o más generaciones familiares
han vivido en condiciones nutricias, sociales o ambientales subóptimas, que limitan la expresión adecuada de la capacidad de crecimiento y, por tanto,
generan un patrón patológico de crecimiento inferior al habitual para el resto de la población.
Factores neuroendocrinos
La expresión del crecimiento está modulada por la
interacción de gran cantidad de factores que actúan
de manera autocrina (sobre la misma célula que los
Fig. 10-1. Eje del sistema de la hormona de crecimiento.
122
Sección II • Concepto integral del crecimiento
3. Los somatotropos hipofisarios producen hormona de crecimiento de manera pulsátil, con
base en el equilibrio entre la estimulación de
la hormona liberadora y la inhibición de somatostatina. La secreción de hormona de cre
cimiento disminuye o se pierde en aplasia o
hipoplasia hipofisaria, tumores suprasellares y
su tratamiento (quirúrgico, radioterapia), neuroinfecciones y alteraciones vasculares hipotalamohipofisarias, así como en deficiencia
congénita de hormona de crecimiento o panhipopituitarismo congénito o adquirido.
4. La hormona de crecimiento induce síntesis y
secreción de factor de crecimiento tipo insulina-1 o somatomedina C, y de las proteínas
transportadoras de hormona de crecimiento y
de factor de crecimiento tipo insulina-1 (proteína transportadora-3 de factor de crecimiento
tipo insulina-1), principalmente en hígado. Asi
mismo, las hepatopatías y nefropatías crónicas,
la desnutrición grave y la falta de receptores
hepáticos para hormona de crecimiento (síndrome de resistencia a hormona de crecimiento) producen deficiencia en el crecimiento.
5. El factor de crecimiento tipo insulina-1 actúa
en los ámbitos tisular y óseo a través de receptores específicos y de ese modo induce crecimiento celular. La falta de respuesta a dicho
factor y, por tanto, la detención del crecimiento se producen en caso de deficiencia de receptores o de la acción del complejo factor de
crecimiento tipo insulina-receptor (síndrome de
Pigmeo), displasias óseas y raquitismo.
6. Recientemente se ha demostrado que algunos
niños con estatura baja producen menor cantidad de hormona de crecimiento durante 24
horas, a pesar de que sus valores séricos basaÍes y la respuesta a estimulación con fármacos
para inducir liberación aguda de esa hormona
son normales. Esta alteración se denomina
"disfiinción en la neurosecreción de hormona
de crecimiento" y puede ser primaria (hereditaria o congénita) o causada por deprivación
psicosocial (fig. 10-2).
En la etapa intrauterina de crecimiento, la deficiencia en la producción placentaria de somatomamotropina coriónica o lactógeno placentario y
de estrógenos, así como la falta de secreción de
insulina fetal, se relacionan con estatura baja neonatal.
La existencia de hipotiroidismo, deficiencia
congénita o adquirida de paratohormona y vitamina D y el exceso de glucocorticoides (endógena o
yatrógena) durante la etapa posnatal limitan el cre-
Fig. 10-2. Esquema de las diferencias en el patrón de secreción de hormona de crecimiento en pacientes con deficiencia congénita de hormona de crecimiento (superior), disfunción en la neurosecreción de hormona de crecimiento (medio),
y pacientes normales (inferior).
cimiento del niño, y durante la pubertad esto ocurre cuando se carece de esferoides sexuales.
Factores nutricios
El crecimiento de una o varias células depende de
la capacidad de sintetizar material de novo; por ello,
es evidente que cualquier alteración que disminuya
el aporte o el uso adecuado de nutrimentos también
repercute de manera negativa en la capacidad de
crecimiento y se relaciona con estatura menor a la
esperada.
Las demandas nutricias cambian de acuerdo
con la edad y condiciones del organismo, por lo
que en cada caso específico debe valorarse la cantidad y calidad de la alimentación, y no sólo que la
nutrición coincida con las recomendaciones para la
población general (recomendaciones frente a requerimientos). Ante aporte nutricio inadecuado, la velocidad de crecimiento disminuye pero no se detiene a menos que dicho aporte sea inferior al mínimo
necesario y se obligue al organismo a disponer de
las proteínas tisulares (catabolismo).
Capítulo 10 • Estudio del paciente con talla baja
En general, las alteraciones nutricias son de
origen multifactorial y con más frecuencia implican:
1. Falta de aporte de nutrimentos por condiciones económicas adversas o bajo nivel cultural que dificulta la adquisición de alimentos
adecuados para el ingreso per cápita de la familia.
2. Infecciones o infestaciones del tubo digestivo
que dificultan la digestión y absorción de nutrimentos y que, al producir anorexia, frecuentemente se relacionan con aporte inadecuado
de nutrimentos.
3. Deficiencias enzimáticas entérales, ya sea primarias o secundarias a procesos diarreicos crónicos. Entre las causas frecuentes de detención
del crecimiento se encuentran deficiencia de
lactasa y de otras disacaridasas, fibrosis quística del páncreas y enfermedad celiaca.
4. Procesos inflamatorios intestinales que producen anorexia, absorción y gasto energético
inadecuados ante el solo proceso inflamatorio.
Estos detienen el crecimiento y no siempre danmanifestaciones clínicas en los primeros años
de la vida. La enfermedad de Crohn y la colitis
ulcerosa crónica inespecífica tienden a presentarse en niños pequeños como anorexia y dolor abdominal, los cuales se atribuyen con facilidad a otras alteraciones o incluso se califican como normales.
5. Trastornos neuromusculares que dificultan la
alimentación del paciente o el reconocimiento
de sus necesidades alimentarias, entre ellos parálisis cerebral infantil, enfermedades genéticas con retraso psicomotriz, o retraso mental
secundario a hipoxia e infecciones del sistema
nervioso central. Estos trastornos ocasionan
deterioro del crecimiento.
6. Enfermedades que aumentan los requerimientos nutricios, como infecciones sistémicas, procesos inflamatorios graves, hipertiroidismo, fístulas arteriovenosas y enfermedades febriles
prolongadas.
7. Entidades patológicas renales que permiten la
pérdida de nutrimentos por defectos en la resorción o secreción glomerular y tubular, por
ejemplo glomerulonefritis, síndrome nefrótico,
insuficiencia renal, acidosis tubular renal y otras
tubulopatías.
Enfermedades orgánicas
Las enfermedades orgánicas capaces de alterar el
crecimiento de un individuo son de dos tipos: aquellas que limitan el aporte de nutrimentos a las célu-
123
las y las que aumentan los requerimientos nutricios
del organismo. Además de las alteraciones nutricias mencionadas, las primeras incluyen:
1. Anemias de cualquier etiología que disminuyen el aporte de oxígeno a los tejidos y, por
tanto, dificultan el metabolismo aeróbico de los
nutrimentos. El crecimiento se afecta de manera importante e incluso puede detenerse
cuando la hemoglobina es inferior a 10 g/L,
sin importar la causa de la anemia.
2. Cardiopatías y vasculopatías que trastornan el
aporte sanguíneo a los tejidos y en consecuencia dificultan el crecimiento general y local.
Esto es más evidente en cardiopatías que evolucionan con cianosis y en aquéllas con flujos
anormales de izquierda a derecha.
3. Neumopatías crónicas que evolucionan con disminución de la oxigenación de hemoglobina,
y sobre todo aquellas que presentan hipertensión venocapilar pulmonar. Debe tomarse en
cuenta que el patrón de crecimiento se modifica con frecuencia, aunque no de manera grave,
en pacientes con asma (no siempre diagnosticada) y alergias de vías respiratorias superiores que facilitan la presentación de obstrucción
nasal crónica.
4. Insuficiencias crónicas hepática y renal.
Los procesos que aumentan los requerimientos energéticos por sí solos no lesionan el crecimiento, a menos que el aporte nutricio sea inadecuado. Por tanto, en estos casos es frecuente observar mecanismos mixtos de detención del crecimiento; esto sucede en infecciones meningoencefálicas
o entérales que se acompañan de disminución del
aporte (por rechazo al alimento o anorexia) y pérdida de nutrimentos (por vómito, diarrea o ambos),
los cuales junto con el aumento de los requerimientos propios del proceso inflamatorio conducen de
manera progresiva al paciente hacia un estado catabólico.
En la etapa prenatal, el crecimiento del producto se puede limitar por factores maternos, placentarios o fetales, ya sea aislados o en conjunto:
1. Factores maternos: tabaquismo, alcoholismo y
aun drogadicción durante la gestación, ingestión de medicamentos (anticonvulsivos del tipo
de difenilhidantoína, fenobarbital, antihipertensores, sedantes, anticoagulantes cumarínicos,
etc.), infecciones, enfermedad hipertensiva de
la gestación, malnutrición, anemia, trabajo físico intenso, y disfunción de uno o varios órganos o aparatos.
124
Sección II • Concepto integral del crecimiento
2. Factores plácentenos: placenta pequeña debido a infecciones, infartos, desprendimientos e
incluso implantación anómala; embarazo múltiple, trabajo de parto prematuro, etcétera
3. Factores fetales: alteraciones genéticas por disminución o exceso del contenido cromosómico, malformaciones congénitas, infecciones,
etcétera.
Condiciones sociales y ambientales
La combinación de nivel cultural bajo, higiene
ambiental inadecuada (agua potable, disposición de
excretas, etc.), programas de alimentación familiar
incorrectos, falta de vigilancia del crecimiento y
prevención de enfermedades por un equipo de salud de la comunidad, así como mala calidad del
afecto proporcionado a los niños, se observan con
mucha frecuencia en comunidades cuyos individuos
muestran estaturas bajas en más de una generación.
Estudios realizados en diversas poblaciones
han evidenciado que la piedra angular de las condiciones sociales y ambientales inadecuadas es el
bajo nivel cultural de la población, ya que al mejorarlo, incluso sin transformar de inmediato la capacidad económica, se modifican favorablemente las
condiciones de higiene, la alimentación y la calidad
del afecto proporcionado a los niños, lo cual repercute en una mejor calidad de vida y crecimiento.
Un niño con deprivación emocional (con maltrato físico o sin él) que se aleja del medio agresor
o supresor recobra una velocidad de crecimiento
normal a partir de ese momento; pero sólo se observa recuperación del crecimiento perdido con
anterioridad cuando se le proporciona una calidad
de afecto adecuada.
MANIFESTACIONES CLÍNICAS
Las características físicas del paciente con estatura
baja pueden orientar hacia la causa de ésta; sin
embargo, para iniciar el estudio sindromático es más
práctico analizar la relación entre la velocidad de
crecimiento y la edad ósea. Entonces es posible
establecer tres grupos de pacientes de acuerdo con
el patrón de crecimiento: intrínseco, retrasado y
atenuado (fig. 10-3).
Patrón intrínseco de crecimiento
Se caracteriza por edad ósea acorde con la cronológica y velocidad de crecimiento normal. Los pacientes, por definición, tienen un crecimiento actual normal, aunque es posible que en el pasado
hayan existido una o más alteraciones limitantes del
crecimiento que ya desaparecieron, y que no modificaron la velocidad de maduración somática. Asimismo, la pubertad y la osificación de los núcleos
de crecimiento se realiza a la edad habitual según
el sexo y la población, de tal manera que se espera
una estatura final baja.
La estatura correspondiente a la esperada para
la "percentila familiar" y proporciones corporales
armónicas, junto con falta de evidencia clínica o
Fig. 10-3. Análisis inicia! sindromático del paciente con talla baja.
Capítulo 10 • Estudio del paciente con talla baja
paraclínica de enfermedad, conduce a pensar en
estatura baja familiar, aunque lo procedente es vigilar la progresión del crecimiento. En estas circunstancias, debe considerarse la existencia de factores
sociales y ambientales negativos y en su caso tratar
de modificarlos a través de un programa de educación (fig. 10-4).
La estatura inferior a la esperada para la "percentila familiar" manifiesta la existencia de un factor patológico involucrado, por lo que debe investigarse:
1. Retraso de crecimiento intrauterino: estatura al
nacimiento inferior a 48 cm (con gestación de
37 a 38 semanas), con peso inferior o no al
esperado para la longitud.
2. Alteraciones genéticas (aun con cariotipo normal): por lo general existen dismorfias que pueden sugerir este problema e incluso orientar
hacia el diagnóstico etiológico.
3. Displasias óseas con afección leve del creci
miento o que afectan los segmentos superior e
inferior en igual magnitud y, por tanto, no
desproporcionen al paciente de manera grave.
Algunos casos de displasias óseas mantienen
una velocidad de crecimiento normal a pesar
de una ligera desproporción en las relaciones
somáticas.
Cuando el paciente muestra estatura baja que
sin causa aparente no corresponde al patrón familiar,
es conveniente valorarlo en un centro especializado.
Patrón retrasado de crecimiento
Se caracteriza por edad ósea retrasada con respecto
a la cronológica y velocidad de crecimiento normal (fig. 10-5).
En este grupo se encuentran pacientes cuya
velocidad de maduración es menor a la observada
125
para el promedio de la población y, por tanto, alcanzan la pubertad y la estatura final entre uno y
tres años después de la edad habitual.
La mayoría de los pacientes con estas características tiene proporciones corporales normales para
la edad ósea, y el análisis de la "edad-talla" (estatura para la edad ósea) les confiere un pronóstico
de estatura dentro de los parámetros habituales para
la población. En estos casos, es necesario investigar la existencia de enfermedades orgánicas y factores nutricios adversos a través de una exploración física cuidadosa; invariablemente debe realizarse una somatometría de relaciones corporales y
un interrogatorio exhaustivo para discernir la presencia o ausencia de enfermedad. Es primordial
buscar y en su caso descartar: anemias leves, procesos inflamatorios o infecciones o infestaciones
entérales, enfermedad por reflujo gastroesofágico,
enfermedades alérgicas de vías respiratorias superiores, nefropatías sin insuficiencia renal (acidosis
tubular renal y otras tubulopatías, infecciones y
malformaciones), enfermedades neoplásicas en sus
primeras etapas, procesos infecciosos agudos de
repetición, cardiopatías acianógenas y no descompensadas.
El patrón retrasado puede desarrollarse en pacientes con trastornos ya resueltos que detuvieron
el crecimiento. El laboratorio y el gabinete son
particularmente útiles debido a que muchos de esos
pacientes son asintomáticos y asignológicos.
El paciente sin alteración actual, ni antecedentes personales patológicos y con antecedentes familiares hereditarios de "maduración lenta" (adultos con estatura final normal que tuvieron estatura
baja prepubescente y retrasaron la aparición de
características sexuales secundarias en relación con
sus compañeros de escuela), puede diagnosticarse
con retraso constitucional del crecimiento; a partir
de ese momento es conveniente vigilar la progresión de velocidad de crecimiento y edad ósea.
Fig. 10-4. Análisis inicial sindromático del patrón intrínseco de talla baja.
126
Sección II • Concepto integral del crecimiento
y después se normalizó y se situó paralelo a las
percentilas poblacionales (aunque por debajo de lo
esperado para la percentila familiar).
Es conveniente que el paciente con estatura baja
que no corresponde a retraso constitucional del
crecimiento, y sin causa demostrable, se estudie y
trate en un centro especializado.
Patrón atenuado de crecimiento
Por lo general, según relato de algunos padres
confirmado por mediciones anteriores, los niños con
patrón retrasado crecieron de manera normal hasta
los 1 8a 24 meses; desde este momento hasta los
tres a cuatro años de edad el crecimiento fue lento,
Se caracteriza por edad ósea retrasada respecto de
la cronológica y velocidad de crecimiento baja.
A diferencia de los dos grupos anteriores con
variantes normales del crecimiento, los pacientes
que corresponden a este grupo son portadores de
enfermedad y deben estudiarse para identificarla
(fig. 10-6).
En pacientes con proporciones corporales armónicas, las causas más frecuentes de patrón retrasado de crecimiento son enfermedades crónicas con
afección sistémica grave, anomalías que afectan el
sistema de la hormona de crecimiento, exceso de
glucocorticoides y también deficiencia de esteroides sexuales cuando esta alteración se presenta a
partir de los 10 a 12 años de edad. Asimismo, en
pacientes con proporciones corporales disarmónicas debe investigarse la posibilidad de hipotiroidismo, displasias óseas y raquitismos.
Todos los pacientes que corresponden a este
grupo deben remitirse a un centro especializado que
les realice un diagnóstico etiológico y les proporcione el tratamiento más adecuado.
Fig. 10-6. Análisis inicial sindromático del patrón atenuado de talla baja.
Capítulo 10 • Estudio del paciente con talla baja
PRUEBAS DE LABORATORIO Y
GABINETE
Ningún examen de laboratorio o gabinete (con excepción de la edad ósea) se recomienda en todos
los pacientes con estatura baja, y corresponde al
criterio del especialista señalar la utilidad de cualquiera de los siguientes:
1. Biometría hemática. Es útil para confirmar y
en su caso descartar anemias, infecciones crónicas, procesos proliferativos hematooncológicos, y de manera indirecta para valorar la capacidad de oxigenación pulmonar y el estado
nutricio del paciente.
2. Química sanguínea. La elevación en las cifras
de urea y creatinina pueden sugerir la existen
cia de insuficiencia renal aun en estadio no terminal, siempre y cuando el paciente se encuentre bien hidratado en el momento del estudio.
Aunque las alteraciones en el metabolismo de
los carbohidratos que originan hipoglucemia e
hiperglucemia pueden detener el crecimiento,
es muy poco frecuente que este signo sea el
primero que manifieste el paciente.
3. Electrólitos séricos. Las alteraciones en la concentración sérica de sodio, potasio, cloro, calcio o fosfatos debe orientar el estudio hacia trastornos tubulares renales, enfermedades entéra
les, ya sea primarias o secundarias, raquitis
mos carenciales e incluso algunos de tipo hereditario, y en ocasiones poco frecuentes, hacia acidosis orgánicas.
4. Gasometría venosa. Aquellas acidosis metabólicas provocadas por tubulopatías renales
pueden ocasionar estatura baja y alteraciones
de la motilidad intestinal y transmisión neuromuscular. Otros tipos de acidosis metabólicas
son causa rara de estatura baja y con frecuencia se manifiestan primero por alteraciones neurológicas. Una alcalosis metabólica con hipopotasemia debe hacer pensar en el síndrome
de Bartter.
5. Examen general de orina. Su ejecución permite detectar infección de vías urinarias, acidosis
tubular y otras tubulopatías y glomerulopatías.
De manera excepcional, la densidad urinaria
baja (menor de 1008 a 1010) que no coexiste
con glucosuria, proteinuria o electrocituria induce a descartar diabetes insípida, ya que los
afectados tienen otras manifestaciones previas
a la detención del crecimiento.
6. Coproparasitoscópico. Las infestaciones enterales difícilmente causan detención del crecimiento por sí solas, y debido a que en el medio
7.
8.
9.
10.
11.
127
nacional con frecuencia aparecen como factor
relacionado es conveniente su búsqueda. Especial mención requieren la giardiasis, esquistosomiasis y tricocefalosis, que pueden ocasionar malabsorción intestinal y detener el crecimiento.
En ocasiones el análisis de excremento, particularmente del pH, la existencia de cantidades
anormales de azúcares reductores y grasas, y
una actividad tríptica deficiente, orientan hacia la detección de fibrosis quística del páncreas, enfermedad celiaca y otras alteraciones
entérales.
Pruebas de funcionamiento de la tiroides. Es
conveniente realizar este estudio en pacientes
con velocidad de crecimiento baja relacionada
con datos dudosos de disfunción tiroidea o
bocio. En ocasiones, algunos pacientes sin
cuadro clínico de hipofunción tiroidea evidencian hipotiroidismo compensado o bien disminución de proteína transportadora de hormonas tiroideas (TBG), y al recibir tratamiento con
dosis sustitutivas de L-tiroxina mejoran la velocidad de crecimiento.
Radiografías anteroposterior (AP) y lateral de
cráneo. Son útiles para valorar la silla turca y
datos sugestivos de hipertensión intracraneana.
Por otro lado, permiten visualizar los senos paranasales, cuya aparición depende de la maduración biológica, y en su caso detectar con
precisión la sinusitis o la obstrucción en adenoides. También facilita el análisis primario de
las características de la dentadura definitiva, a
través de la búsqueda del estadio de madura
ción dentaria que mantiene correlación aproxi
mada con la edad biológica (quiste predentario,
formación de la corona y de las raíces, distan
cia con la dentición temporal, etc.).
Serie ósea. Con el propósito de analizar las
características de epífisis, diáfisis y metáfisis
óseas, grado de osificación u osificaciones
anormales, así como de determinar si existen
datos sugestivos de displasia, en pacientes con
estatura baja disarmónica deben realizarse radiografías: anteroposterior, lateral y Towne de
cráneo; anteroposterior y lateral de columna
vertebral; anteroposterior de pelvis y comparativas de huesos largos, manos y pies. Los
datos radiológicos son útiles para orientar el
diagnóstico en pacientes con raquitismo, y a
veces en aquéllos con hipotiroidismo.
Cariotipo en sangre periférica analizado con
técnica de bandeo y con lectura de mínimo 50
metafases. Es útil para confirmar y en su caso
descartar alteraciones genéticas. Se recomien-
128
Sección II • Concepto integral del crecimiento
da en toda mujer con estatura baja que registre
velocidad de crecimiento normal o subnormal y
edad ósea acorde con la cronológica, aun sin
estigmas sugestivos de disgenesia gonadal, ya que
los llamados "mosaicos Turner" se diagnostican
en niñas aparentemente normales pero de estatura
baja con mayor frecuencia que en quienes
presentan cuadros clínicos similares a los descritos
en la literatura para este síndrome. 12. Cultivos de
orina (e incluso excremento). Su realización es
muy útil aun en ausencia de manifestaciones
clínicas, ya que hasta 90% de los pacientes con
infecciones crónicas de vías urinarias, en especial
las mujeres, es asintomáti-co y lo único que se
observa es anorexia, dolor ocasional de abdomen
y estatura baja.
Las pruebas mencionadas o cualquiera otra
indicada según las características físicas específicas deben analizarse con base en edad, sexo y edad
biológica y sobre todo en el contexto individual, ya
que en ocasiones los valores aceptados como normales pueden no serlo para el momento de un niño
en particular. Asimismo, los exámenes poco frecuentes en la población general deben efectuarse
en laboratorios y gabinetes radiológicos de reconocida capacidad y calidad.
El pronóstico del paciente con estatura baja,
en relación con el crecimiento y la estatura final
esperada, depende absolutamente de la causa y de
las condiciones de vida del paciente.
La estatura baja no origina alteraciones orgánicas por sí sola, pero en general representa un signo de falta de salud; por ello, lo más importante no
es establecer el diagnóstico de crecimiento inadecuado sino encontrar su causa para ofrecer un tratamiento adecuado y oportuno, y en consecuencia
mejorar el pronóstico de calidad de vida y evitar
complicaciones.
En términos generales, cualquier paciente con
estatura baja puede presentar alteraciones para la
adaptación psicosocial y entre ellas las más frecuentes son:
1. Mayor necesidad de aceptación por su grupo
social.
2. Necesidad de desarrollar tareas y habilidades
que sobrepasen las del promedio de sus compañeros, para mejorar la autoestima.
3. Falta de equilibrio emocional con irritabilidad
fácil.
4. Poca tolerancia a la frustración.
5. Tendencia a relacionarse afectivamente con
otros niños de estatura baja o con minusválidos.
6. Sensación de ineficiencia física.
Las características acentuadas requieren ya sea
de un programa de educación para los padres, de
tal manera que éstos apoyen positivamente el desarrollo psicosocial del niño, o en su caso de valoración y manejo psicológico especializado.
LECTURAS RECOMENDADAS
Aynsley AG, Macfarlane JA. Method for the earlier recognition of abnormal stature. Arch Dis Child 1983;58:535.
Bercu BB. A determinant of stature: regulation of growth
hormone secretion. Adv Pediatr 1986;33:331.
Calzada RL, Bojórquez OA. Abordaje del paciente con talla
baja. Act Pediatr 1988;4:1.
Demirjian A. Interrelationships among measures of somatic,
skeletal, dental and sexual maturity. Am J Orthod 1985;
88:433.
Gluckman PD. Fetal growth: an endocrine perspective. Acta
Pediatr 1989;349(supl):21.
Growne CA, Thorburn GD. Endocrine control of fetal
growth. Biol Neonate 1989;55:331.
Kaplan SL. Normal and abnormal growth. En: Rudolph AM,
Hoffman JIE (eds). Pediatrics. USA: Appleton & Lange,
Baltimore, 1991:75.
Kramer MS. Determinants of low birth weight. Bull WHO
1987;65:663.
Mahoney CP. Evaluating the child with short stature. Ped
ClinNorthAm 1987;34:825.
Robles VC, Calzada RL. Clonidina en el síndrome de disfunción neurorreguladora de hormona de crecimiento.
Invest Med Intern 1991;18:26.
Rodríguez HR. El crecimiento: bases fisiopatológicas. En:
Moreno BE, Tresguerres JAF (eds). Retrasos del crecimiento. Madrid: Díaz de Santos, 1991:1.
Rosenfeld RG. Diagnosis and management of growth disorders. Drug Ther 1983;5:61.
Schwartz ID, Bercu BB. Normal growth and development.
En: Hung W (ed). Clinical Pediatric Endocrinology.
USA: Mosby Year Book, 1992;13.
Tanner JM. Normal growth and techniques of growth assessment. Clin Endocrinol Metab 1986;15:411.
Vaughan VC. Assessment of growth and development during infaney and early childhood. Pediatr Rev 1992; 13:88.
Voss LD, Mulligan J, Betts PR, Wilkin TJ. Poor growth in
school entrants as an index of organic disease: the
wessex growth study. British Med J 1992;305:1400.
Wilson DM. Treatment of short stature and delayed adolescence. Ped Clin North Am 1987;34:851.
Capítulo
11
Retraso de crecimiento
intrauterino
Los recién nacidos con longitud o peso, o ambos,
menores a los esperados para su edad gestacional
(48 cm y 2 500 g en embarazos mayores de 38
semanas) requieren de estudio completo a la brevedad posible para determinar las causas del crecimiento intrauterino inadecuado y desarrollar las
medidas terapéuticas necesarias encaminadas a la
recuperación extrauterina del crecimiento.
Hasta no demostrar lo contrario, debe considerarse la posibilidad de que existan alteraciones
genéticas en el paciente mismo, ya que en estudios
al respecto se ha evidenciado que entre 5 y 27% de
pacientes con retraso de crecimiento intrauterino
también padecen síndromes dismorfológicos con o
sin representación en el análisis del cariotipo en
sangre periférica, en especial aquellos que pesan
menos de 2 kg al final de una gestación a término.
En ausencia de dismorfias es necesario tomar
en cuenta alteraciones maternas o placentarias o
ambas, que de manera aislada o en conjunto lesionaron el estado nutricio del feto y que constituyen
la causa de crecimiento intrauterino anormal hasta
en 25 a 30% de los casos (fig. 11-1).
Las infecciones congénitas producen alteraciones orgánicas moderadas a graves en la mayoría de
los afectados, pero sólo se encuentran como factor
determinante en 1 a 3% del total de pacientes con
estatura o peso bajos al nacer.
Fig. 11-1.
131
132
Sección III • Talla baja por diversos trastornos
La importancia de identificar la causa de la
alteración intrauterina del crecimiento radica en lo
siguiente:
1. La detección oportuna de un síndrome genético obliga a evaluar sus riesgos específicos para
disminuir la morbilidad y mortalidad; también
permite establecer un programa de rehabilitación útil desde los primeros días de vida, así
como proporcionar consejo genético adecuado a los padres.
2. La identificación de una alteración nutricia intrauterina (ya sea de origen materno o placentario) permite desarrollar medidas terapéuticas
adecuadas y específicas para facilitar la recuperación del crecimiento en las primeras ocho
semanas de vida extrauterina; de lo contrario,
es muy probable que el déficit persista durante
toda la vida y se alcance una estatura final
menor a la esperada en relación con las características genéticas o por lo menos epigenéticas
del paciente.
3. Sin importar la causa del retraso de crecimiento intrauterino, los afectados integran 30% del
total de "muertes súbitas" en recién nacidos y
lactantes, aunque se calcula que 90 a 95% de
ellas pueden evitarse si se determinan los riegos específicos para cada caso en particular.
4. El riesgo de hipocrecimiento fetal en hijos de
madre con antecedentes de retraso de crecimiento intrauterino es 2.21; asimismo, aunque
la longitud de estos niños sea normal, la posibilidad de peso bajo para la estatura es 2.96 mayor
que en hijos de madres sin este antecedente.
5. Los niños con retraso de crecimiento intrauterino, en especial cuando poseen peso menor al
esperado para la estatura, también padecen con
mucha mayor frecuencia diabetes mellitus e hipertensión arterial en la etapa de adulto joven.
6. Las mujeres con peso bajo al nacer y antecedentes de obesidad en la infancia experimentan la menarquía a menor edad con la consecuente detención temprana del crecimiento.
7. La vinculación de peso bajo al nacer con perímetro abdominal menor al esperado para la estatura y escasa ganancia de peso de la madre
durante la gestación mantiene una correlación
inversamente proporcional con valores séricos
elevados de colesterol de lipoproteínas de baja
densidad y mayor incidencia de alteraciones
coronarias. Esto también ocurre cuando se
combinan peso bajo al nacer y placenta grande.
El análisis de las relaciones entre peso, estatura y perímetro cefálico es útil para determinar la
intensidad del daño prenatal- en la mayoría de los
pacientes, aunque no en todos permite realizar un
abordaje sindromático. Se considera que los pacientes con peso bajo para la estatura sufrieron detención de crecimiento de primer grado y esto por lo
general significa nutrición inadecuada sólo en las
últimas semanas del embarazo. Aquellos pacientes
con talla baja y peso adecuado para ella deben considerarse portadores de alteración de segundo grado que casi siempre indica desnutrición intrauterina de duración media o afección grave que posteriormente permitió una recuperación incompleta.
Finalmente, los pacientes con disminución en estatura, peso y perímetro cefálico presentan afección
de tercer grado, que evidencia daño temprano, prolongado y grave.
Además de los aspectos anteriores, el abordaje
diagnóstico debe incluir la valoración de los perímetros torácico y abdominal y sus relaciones con
los parámetros mencionados. Esto implica la necesidad de identificar al paciente de acuerdo con su
armonía corporal, por lo que se sugiere incluirlo
para su estudio inicial en dos grupos sindromáticos: proporcionado o armónico y desproporcionado o disarmónico.
GRUPOS SINDROMATICOS DE ESTUDIO
Proporcionado o armónico
Este grupo incluye pacientes con longitud menor a
la esperada para la edad gestacional, peso adecuado para la estatura, y perímetros cefálico, torácico
y abdominal en armonía.
El crecimiento de estos pacientes representa,
hasta no demostrar lo contrario, el ajuste "fisiológico" de un organismo sano con fines de supervivencia en las mejores condiciones posibles, que se
realiza ante la combinación de:
1. Aporte insuficiente de nutrimentos, pero balanceado con respecto a la proporción entre carbohidratos y proteínas.
2. Flujo sanguíneo (uteroplacentario) normal durante la gestación.
3. Oxigenación tisular adecuada.
El retraso de crecimiento proporcionado también pudiera deberse a alteraciones genéticas en el
feto, sin que el aporte de nutrimentos (carbohidratos, proteínas y oxígeno) o el flujo uterino sean
inadecuados.
En términos generales, es posible que la "nutrición fetal inadecuada" se produzca de manera
crónica y a partir del segundo trimestre de la gesta-
Capítulo 11 • Retraso de crecimiento intrauterino
ción, aunque con duración variable, por lo que existe
una relación directamente proporcional entre el
déficit del crecimiento y la duración e intensidad
de la desnutrición.
Durante la etapa neonatal estos pacientes deben considerarse con alto riesgo de morbilidad y
mortalidad frente a procesos que disminuyan la
oxigenación tisular y, por tanto, debe investigarse
la presencia de anemia, insuficiencia cardiaca, y
trastornos o enfermedades que dificulten o disminuyan la ventilación pulmonar. En particular es
importante informar a los padres de los riesgos que
se corren cuando se permite el exceso de ropa o
cobijas, así como de almohadas que originen obstrucción de vías respiratorias superiores.
La identificación de estos niños ("pequeños
pero normales") como portadores de una alteración
del crecimiento intrauterino con frecuencia es
inadecuada, y ello evita que se proporcionen las
medidas necesarias para facilitar el crecimiento de
recuperación. No es raro encontrar este antecedente durante el estudio de pacientes con estatura baja
en edad preescolar o escolar; asimismo, en la literatura al respecto se menciona que hasta 35% de
ellos tiene talla baja a los cuatro años de edad.
Las indicaciones proporcionadas para facilitar
la recuperación del crecimiento en la etapa posnatal pueden incluir el mantenimiento de la alimentación "a libre demanda", siempre y cuando el paciente no esté limitado para expresar su necesidad
de alimentación ni los padres para percibirlas y
reconocerlas.
En términos generales, desde el tercer o cuarto
día de vida posnatal o cuando el peso de estos pacientes es superior a 1 800 g también se adquiere
una capacidad adecuada para mantener la temperatura corporal estable a temperaturas ambientales
habituales (homeotermia).
Desproporcionado o disarmónico
Cuando en estos casos se toma la estatura como
parámetro de comparación, el perímetro cefálico
tiende a estar conservado pero es posible que existan una o las dos situaciones siguientes:
1. Peso por debajo del esperado para la estatura,
ya sea normal o baja para la edad gestacional.
2. Perímetros torácico y abdominal menores a los
esperados para la estatura y la edad gestacio
nal, o incluso inferiores a los esperados para el
peso del paciente.
La somatometría de estos pacientes es el resultado del ajuste "de sobrevivencia" de un feto que
133
creció en las condiciones inadecuadas que se caracterizan por:
1. Aporte bajo de nutrimentos, con frecuente desproporción entre las calorías totales y las proteínas.
2. Flujo uteroplacentario insuficiente durante periodos breves pero probablemente repetidos,
que dieron lugar a exacerbaciones o agudiza
ciones en la disminución de calorías y proteínas.
3. Aporte de oxígeno inadecuado, ya sea debido a
disminución del flujo umbilical o a factores
maternos, por lo que ante condiciones de "hipoxemia" se realizó un ajuste circulatorio para preservar la supervivencia y la función de los "órganos vitales" (sistema nervioso central, hígado,
corazón, ríñones), así como de la placenta.
En pacientes con perímetro cefálico inadecuado para la estatura debe investigarse la posibilidad
de afecciones cerebrales, entre las cuales son frecuentes las infecciones congénitas (en particular el
síndrome de TORCH) y las malformaciones que
dañan el sistema nervioso central.
Los trastornos que durante el primer trimestre
de la gestación ocasionan un retraso de crecimiento intrauterino conducen por lo general al aborto;
en cambio aquellos que surgen desde el segundo
trimestre, y particularmente después de la semana
30 de la gestación, no anulan la posibilidad de sobrevivencia intrauterina.
El binomio "desnutrición e hipoxemia fetales"
origina desproporción somatométrica al nacer de
acuerdo con su duración e intensidad. Por lo general, primero se afecta el perímetro abdominal, después el peso y finalmente el perímetro torácico;
pero, luego del mejoramiento de las condiciones
intrauterinas, la recuperación se realiza en el siguiente orden: peso, perímetro torácico y perímetro abdominal. Entonces, el retraso de crecimiento
intrauterino, peso y perímetro abdominal inadecuados para la estatura y perímetro torácico normal
reflejan en el recién nacido aporte insuficiente y
crónico sin recuperación intrauterina. Por su parte,
la combinación de perímetros torácico y abdominal bajos con peso menos afectado indica que las
condiciones fueron malas durante un periodo largo, pero que luego mejoraron y permitieron una
recuperación parcial.
Los recién nacidos con proporciones disarmónicas corren alto riesgo de episodios de hipotermia
e hipoglucemia, por lo cual entre otras cosas debe
recomendarse a los padres: vigilar periodos de ayuno no mayores de 3 a 4 horas; controlar la temperatura corporal, y mantener un ambiente térmico
134
Sección III • Talla baja por diversos trastornos
constante y cercano a los 32 a 34°C durante un lapso
de 7 a 21 días, ya sea mediante el uso de incubadora o en su defecto de cobijas. En países en vías de
desarrollo, el contacto constante del niño con la
temperatura corporal de la madre ("madre canguro"), que en promedio es de 37°C, ha resuelto con
eficacia la imposibilidad de usar incubadoras por
tiempos prolongados, ya que el control térmico se
lleva a cabo hasta que el niño alcanza un peso corporal superior a los 2 000 o 2 300 gramos.
En estos pacientes deben investigarse alteraciones gastrointestinales y hepáticas que impidan
una glucemia normal, así como trastornos que evitan la expresión de las necesidades alimentarias del
paciente (daño neurológico, hipotiroidismo congénito, enfermedades neuromusculares, etc.); también
debe educarse a los padres sobre las respuestas del
recién nacido o lactante a sus requerimientos nutricios, así como sobre el tipo de alimentación y la
preparación de ésta.
Las características antropométricas disarmónicas inducen con relativa frecuencia a considerar
de alto riesgo a los recién nacidos afectados, por
lo que las medidas que coadyuvan a la recuperación se otorgan a una proporción elevada de ellos.
En consecuencia, hasta 80% de los pacientes han
iniciado la recuperación del crecimiento en las primeras ocho semanas de vida extrauterina, y se
sitúan cerca o por arriba de las percentila 50 para
peso, estatura y perímetro cefálico a partir de los
seis meses de edad. En aquéllos sin tratamiento adecuado o de recuperación incompleta es habitual
observar un patrón retrasado de crecimiento, con
estatura inferior a la esperada epigenéticamente,
velocidad de crecimiento normal y edad ósea retrasada.
VIGILANCIA DEL CRECIMIENTO
INTRAUTERINO E IDENTIFICACIÓN
DE DESARROLLO FETAL INADECUADO
El retraso de crecimiento intrauterino depende
de la relación entre: causa, momento de inicio,
duración, gravedad e hipoxemia
En condiciones ideales se posibilita la vigilancia del crecimiento intrauterino y, por tanto, la detección de crecimiento fetal inadecuado puede realizarse mediante el uso transgestacional de uno o
varios de los siguientes parámetros que se señalan
en el cuadro 11-1. Tales parámetros deben evaluarse de manera prospectiva durante la gestación, al
menos en dos momentos distintos del embarazo, y
a partir de ello emitir el diagnóstico transgestacional de crecimiento fetal anómalo si ése fuera el caso;
de lo contrario, al nacer pueden existir serias limitaciones para determinar con precisión las causas
que interactuaron en el origen del retraso de crecimiento intrauterino, así como el momento en que
se presentaron, su duración e intensidad y la posibilidad de que haya ocurrido hipoxia relacionada o
la gravedad de ésta.
No obstante lo anterior, es necesario confirmar
o en su caso descartar la existencia de alteraciones
fetales mediante una exploración física acuciosa,
así como de alteraciones maternas y uteroplacentarias, ya sea a través de un interrogatorio directo
Cuadro 11-1. Parámetros para evaluar el crecimiento fetal inadecuado
Parámetro
Ultrasonográficos
Diámetro biparietal
Circunferencia abdominal
Longitud del fémur
Distancia vértice-cóccix
Volumen uterino
Peso fetal
Volumen de líquido amniótico
Flujo
Bioquímicos
Lactógeno placentario
3-metil-histidina
Oxitocinasa
beta-1 -glucoproteína
Fosfatidilglicerol
Clínicos
Fondo uterino
Sensibilidad (%)
Especificidad (%)
90
80
87
90
77
90
84
90
93
22
86
88
89
80
86
95
90
93
80
97
90
85
87
90
Valor predictivo
100
40
97
95
80
95
90
97
18
76
78
54
50
79
Capítulo 11· Retraso de crecimiento intrauterino
a la madre o incluso mediante el examen físico y
exámenes de laboratorio (biometría hemática, examen general de orina, urocultivo, etc.) durante los
primeros días posparto. Asimismo, el médico que
atendió a la madre durante el embarazo o incluso el
que atendió el parto podrían informar en ese sentido sobre las condiciones generales de salud, la presencia de hipertensión arterial, edema, hiperglucemia e infecciones intercurrentes, y características
de la placenta y del útero.
Alteraciones maternas
Estas se deben a falta de aporte nutricio o a enfermedades maternas sistémicas, y otras más tienen
relación con el grosor del pliegue tricipital y la
estatura de la madre:
Falta de aporte nutricio. En la población mexicana es común que la ingestión materna sea insuficiente para las demandas de la gestación; las causas más frecuentes son:
1. Estado nutricio deficiente previo a la gestación,
ya sea debido a las características sociales,
económicas y culturales de la población de
origen de la madre, o bien de manera relacionada a un periodo intergestacional menor a dos
años que impiden la recuperación nutricia ade
cuada.
2. Gestación relacionada con trabajo físico e infecciones transgestacionales que aumentan las
demandas metabólicas del cuerpo materno y
en consecuencia limitan el aporte al producto.
3. Además de lo anterior, debe confirmarse o des
cartarse la existencia de anemia materna, entre
las cuales es frecuente la deficiencia de folatos
o hierro o ambos; sin embargo, también es
necesario considerar la anemia falciforme, la
talasemia, anemias autoinmunitarias, etc. Al
gunos estudios han demostrado que en altitudes mayores a 2 000 m sobre el nivel del mar,
la mujer embarazada debe tener concentración
de hemoglobina superior a 12 g/dl para compensar la disminución del contenido ambiental de oxígeno; sin este ajuste, el producto de
la gestación debe considerarse sometido a hipoxia crónica.
4. Alteraciones gastrointestinales maternas. Aun
que éstas ocurren por lo general desde etapas
previas a la gestación, es posible que pasen desapercibidas; por tanto, es conveniente interrogar específicamente sobre datos sugestivos de
colitis ulcerosa crónica inespecífica, enfermedad de Crohn, pancreatitis crónica y malabsorción intestinal.
135
Enfermedades maternas sistémicas
1. Alteraciones cardiacas y pulmonares, así como
trastornos vasculares (vasculitis de cualquier
causa) que se vinculan o no con hipertensión
arterial sistémica crónica y preeclampsia antes
de la semana 37, y disminuciones del volumen
plasmático materno (diuréticos, diarrea, vómito). Esto puede limitar el flujo sanguíneo aportado a la placenta, la cual requiere de un consumo "fijo" de 40 a 50% puesto que retiene un
porcentaje relativamente constante del aporte
que recibe a través del flujo uterino, sin importar los requerimientos fetales. De ese modo,
hasta no demostrar lo contrario debe pensarse
que existió aporte nutricio insuficiente para el
producto cuando se tiene evidencia transgestacional de: hipertensión arterial (nefropatías,
vasculitis, etc.), insuficiencia cardiaca (cardiopatías congénitas o adquiridas, que involucren
miocardio, pericardio o válvulas), obstrucción
crónica o intermitente de vías respiratorias
(asma, enfisema, neumonías, etc.).
2. Infecciones de vías urinarias y vaginales. Es
tas alteraciones pasan desapercibidas en un porcentaje elevado de mujeres o bien sus manifestaciones se justifican de manera errónea por la
misma gestación (polaquiuria, tenesmo leve,
flujo vaginal constante); por ello es de particular importancia investigar mediante interrogatorio si se diagnosticaron y trataron durante el
embarazo o realizar cultivos después del término de la gestación para confirmar o descartar su presencia según el caso.
3. La diabetes mellitus gestacional es frecuente
en la población mexicana de mujeres embarazadas y por lo general se inicia después de la
semana 12 de embarazo y cede, por lo menos
temporalmente, al término del mismo. Aunque
la mayoría de los hijos de estas mujeres presentan macrosomía, no debe olvidarse que la
combinación de la diabetes mellitus y la hiper
tensión arterial grave es capaz de conducir a
limitaciones en el crecimiento fetal; en conse
cuencia, el recién nacido puede tener peso yestaturas adecuados pese a la hiperglucemia
crónica materna (retraso de crecimiento intrauterino), o bien peso y perímetro abdominal
disminuidos en relación con la estatura.
4. Aunque se lleve a cabo un control glucémico
adecuado durante la gestación, los hijos de
mujeres con diabetes insulinodependiente que
se complica con nefropatía, neuropatía y vasculopatía con frecuencia padecen retraso de
crecimiento fetal.
136
Sección III • Talla baja por diversos trastornos
5. El alcoholismo y la drogadicción materna, así
como la ingestión de algunos medicamentos,
pueden lesionar el crecimiento fetal. Esto es
más evidente cuando a la toxicomanía se agrega disminución en la ingestión alimentaria. El
tabaquismo activo (madre fumadora) y pasivo
(madre no fumadora que convive con fumadores) origina detención del crecimiento, y en
particular disminución del perímetro cefálico
si la exposición es igual o superior a tres cigarrillos al día. Cuando la exposición es superior
a 20 cigarrillos por día es frecuente encontrar
retraso de crecimiento intrauterino, por lo general disarmónico y de intensidad de moderada a grave.
Sin importar su relación con malformaciones, algunos medicamentos tienen efectos lesivos bien determinados sobre el crecimiento
fetal. Entre esos fármacos se encuentran: aminopterina, anticoagulantes cumarínicos, antidepresores, antitiroideos, bloqueadores de los
canales de calcio, fenobarbital, difenilhidantoínas, narcóticos, prednisona, trimetadiona y antihipertensores no cardioselectivos.
Estudios realizados en mujeres gestantes han
permitido observar que el aporte de nutrimentos al
producto guarda una relación directamente proporcional a las modificaciones del grosor del pliegue
cutáneo tricipital, el cual en condiciones óptimas
debe aumentar progresivamente durante las primeras 30 semanas de la gestación y a partir de entonces disminuir.
Las relaciones entre el peso del producto al
nacer y las modificaciones en el grosor del pliegue
tricipital alrededor de la semana 12 y 38 se muestran en el cuadro 11-2.
Lo anterior evidencia dos correlaciones:
1. A menor grosor del pliegue tricipital en las semanas 9 a 12 de la gestación corresponde
menor peso al nacimiento; esto se relaciona con
el estado nutricio de la madre previo al inicio
de la gestación, y corrobora lo señalado respecto de la falta de aporte nutricio
2. Cuando la grasa subcutánea en la madre no
disminuye durante el tercer trimestre de la gestación, el peso del producto es inferior a consecuencia de falta de aporte adecuado. Independientemente de sus causas, esta situación
permite establecer una opción etiológica distin
ta: la madre puede ser "buena" o "mala" aportadora de nutrimentos durante las semanas en que
la ganancia ponderal del producto es más rápida, es decir, a partir de la semana 34 de la ges-
tación. El mismo estudio evidencia que el ingreso per capita es un factor relacionado, ya
que las familias de niños con peso menor a 2.9
kg tienen ingreso promedio de 57 dólares mensuales (alrededor de 450 pesos mexicanos),
mientras que las de niños con peso superior a
3.2 kg mostraban un ingreso por persona de
213 dólares mensuales (alrededor de 1 700 pesos mexicanos)
La estatura materna no parece ser una limitante fundamental del crecimiento fetal; sin embargo,
se ha descrito que las mujeres con estatura inferior
a 155 cm tienen hijos con estatura menor a la esperada sólo cuando el peso de éstos es mayor a 3.5
kg, aunque hasta la fecha se desconocen las razones de ello.
Alteraciones uteroplacentarias
Las restricciones moderadas o graves en la capacidad del contenido intrauterino limitan en ese mismo grado el incremento de estatura, pero en general no afectan el peso y los perímetros del niño y
por ello éste tiende a ser proporcionado. Entre dichas restricciones se encuentran el útero bicorne,
el útero tabicado y la miomatosis intrauterina transgestacional.
La insuficiencia istmicocervical se vincula por
lo general con crecimiento fetal inadecuado. Aunque en algunos casos se han demostrado que dicha
insuficiencia se debe a infecciones, también en
ausencia de éstas existe mayor riesgo de retraso de
crecimiento intrauterino, con frecuencia desproporcionado.
El principal órgano "nutricio" del producto es
la placenta, y por ello es evidente que su grado de
insuficiencia origina retraso de crecimiento intrauterino directamente proporcional. En especial debe
confirmarse o en su caso descartarse la existencia
de abruptio placentae, infecciones, infartos o cal-
Capítulo 11 • Retraso de crecimiento intrauterino
cificaciones sugestivas de infartos, tumores hemangiomatosos de la placenta o de la cavidad pélvica e
inserción anómala del cordón umbilical; asimismo,
es necesario determinar el tamaño y peso de la placenta en relación con la edad gestacional.
El tamaño de la placenta es directamente proporcional a la ingestión proteínica durante la gestación, pero inversamente proporcional a la ingestión
de carbohidratos cuando existe desequilibrio entre
calorías y proteínas ingeridas.
Alteraciones fetales
Cualquier malformación, ya sea de origen genético
o congénita, es capaz de limitar el crecimiento intrauterino del producto, con excepción de persistencia del conducto arterioso, arteria umbilical única, luxación congénita de cadera y criptorquidia.
Así entonces, es fundamental realizar una exploración ñsica minuciosa con búsqueda intencionada
de dismorfias en todo paciente que al nacer evidencie retraso de crecimiento intrauterino.
Es de particular importancia señalar que en
promedio las pacientes con síndrome de Turner tienen peso de 84% con respecto al ideal para la edad
gestacional, y los pacientes con trisomías 13, 18 y
21 sólo alcanzan, en término medio, 80% del peso
ideal. El síndrome de Down, las monosomías y las
deleciones, también se relacionan con peso bajo para
la estatura.
Entre los síndromes genéticos que se asocian
con talla baja y casi siempre con peso bajo para la
estatura al nacer se encuentran los de: De Lange,
Mulibrey, Dubowitz, Bloom, Seckel, Williams,
Noonan, Aárskog, Rubinstein-Taybi, Silver-Russell,
Sanctis-Cacchione, Johanson-Blizzard, HallermanStreif, Opitz, Smith-Lemli-Opitz, Robinow, OpitzFrías, Rothmund-Thomson, Werner y Cockayne.
Las alteraciones congénitas que se vinculan con
mayor detención del crecimiento son: gastrosquisis,
atresia de duodeno, agenesia de páncreas, onfalocele, cardiopatías congénitas complejas y malformaciones renales graves.
Las displasias óseas en su gran mayoría ocasionan talla baja neonatal. Esto se detecta con mayor facilidad cuando además de la somatometría
propuesta se determina la relación de segmentos
(superior e inferior y brazada-estatura). Algunas
displasias, como la osteogénesis imperfecta, la
acondroplasia y la displasia tanatofórica son muy
evidentes al momento del nacimiento; pero otras
como las displasias espondiloepifisarias pueden
pasar desapercibidas en esta etapa de la vida.
Las infecciones fetales, la mayoría congénita,
limitan el crecimiento del feto; por tanto, en la
137
madre y en el producto deben investigarse aquéllas
más frecuentes en la población. En el medio nacional es necesario evaluar y en su caso descartar la
afección por paludismo, toxoplasmosis, rubéola,
citomegalovirus, herpes, síñlis, varicela-zoster,
parotiditis, hepatitis A y poliovirus. Aunque en la
actualidad se conoce poco sobre el efecto del síndrome de inmunodeficiencia adquirida (SIDA) en
el crecimiento fetal, debe investigarse por fuerza
en presencia de retraso de crecimiento intrauterino.
Los embarazos múltiples cursan invariablemente con retraso de crecimiento intrauterino. En el caso
de los gemelos, por lo general uno maniñesta armonía en las proporciones corporales (casi siempre el de mayor estatura y peso) y otro muestra
disarmonía. En embarazos con tres o más productos, el crecimiento intrauterino es inversamente
proporcional al número de productos gestados y
la mayoría de los fetos tienen retraso de tipo desproporcionado. Además, existe la posibilidad de que
ocurra "transfusión feto a feto", en cuyo caso el
"donador" crece con parámetros disarmónicos mientras que el "aceptor" es por lo general armónico.
La capacidad de nutrición de la placenta depende de su edad. Por ello, en embarazos mayores
de 42 semanas de duración se presenta siempre
retraso de crecimiento intrauterino; cuando el embarazo termina entre la semana 40 y 42, el producto es por lo general proporcionado, pero después
de este momento existe una relación inversamente
proporcional entre la duración del embarazo y el
peso y perímetro abdominal del producto.
Aunque la evaluación prospectiva se dificulta
en la primera gestación, es sabido que el primer
hijo de una madre muestra estatura y perímetro
cefálico limitados en 2 a 3% y peso menor hasta en
10% en relación con el embarazo dos y los subsecuentes. Por tanto, todo producto de la gestación
dos o posterior que tenga características somatométricas inferiores a las observadas en la primera
debe considerarse portador de retraso de crecimiento intrauterino, sin importar que sus parámetros se
mantengan dentro de los límites "habituales" para
los recién nacidos sanos. Esta consideración es en
especial importante en mujeres multíparas cuyo
intervalo intergestacional ha sido persistentemente
menor a dos años, de tal manera que sus productos
muestran peso y estatura progresivamente menores
conforme avanza el número de embarazos.
RECUPERACIÓN DEL RETRASO
DE CRECIMIENTO INTRAUTERINO
Los recién nacidos con retraso de crecimiento intrauterino son aptos para recibir medidas que per-
138
Sección III • Talla baja por diversos trastornos
mitán la recuperación extrauterina del déficit de
crecimiento transgestacional, con excepción de
aquellos que padezcan trastornos genético. Esto se
fundamenta en que el control del crecimiento mantiene sus características fetales por lo menos hasta
6 a 12 meses de vida extrauterina.
El crecimiento en estos pacientes está regulado por la relación insulina y factor de crecimiento
tipo insulina-1 y no por la relación hormona de crecimiento y dicho factor; asimismo, la secreción de
insulina mantiene correlación directa con la cantidad de calorías y de glucosa aportada a través de la
alimentación.
Es importante señalar que en los niños con
retraso de crecimiento intrauterino el crecimiento
lineal esperado depende por completo de la masa
previa: a mayor peso corresponde mayor aceleración en la velocidad de recuperación y, por tanto,
el tiempo en que se alcanza la percentila 50 para la
población se reduce. Así entonces, se sabe que los
recién nacidos con parámetros somatométricos alrededor de la percentila 50 también aumentan 1.1
kg de peso cada seis semanas; los que se encuentran en la percentila 25 crecen 9.1% más despacio,
y quienes se ubican en la percentila 10 aumentan
su peso sólo 900 g cada seis semanas, lo cual representa un crecimiento 18.2% menor (fig. 11-2).
A lo anterior debe agregarse que durante los
primeros seis meses de vida extrauterina los varones
ubicados en la percentila 50 muestran incrementos
3 a 6% mayores que las mujeres. Esto también es
válido para pacientes premaduros, de acuerdo con
estudios prospectivos realizados en éstos.
Los incrementos de peso en individuos nacidos luego de 28 semanas de gestación, y que no
presentaron complicaciones son los siguientes:
Grupo
1 (percentila
2 (percentila
3 (percentila
3)
50)
90)
28
34
semanas semanas
700 g
1400 g
1 100 g 2 200 g
1500 g 3 000 g
40
semanas
2 100 g
3 300 g
4 500 g
Cada paciente requiere de evaluación específica para adaptar las indicaciones terapéuticas a sus
necesidades, sin embargo, vale la pena señalar algunas medidas recomendadas:
1. El aporte nutricio debe contener las proporciones de calorías y proteínas que requiere un feto
de 34 a 36 semanas de gestación. Cuando el
producto es además premaduro, hay que considerar los requerimientos necesarios de acuerdo con la semana de gestación en que se terminó el embarazo.
Fig. 11-2. Diferencias en la recuperación del retraso de crecimiento intrauterino de acuerdo con el peso al momento de nacer.
Capítulo 11· Retraso de crecimiento intrauterino
2. Al prepararse la alimentación debe tomarse en
cuenta la cantidad de agua así como la concentración u osmolaridad necesarias, de acuerdo
con el peso y estatura equivalentes para la edad
gestacional calculada.
3. La administración de alimentos tiene que realizarse conforme a la capacidad de succión y
deglución del paciente, para evitar que éste
efectúe un esfuerzo que consuma calorías en
exceso. Entonces es necesario elegir el método más adecuado entre biberón, alimentador y
alimentación a través de sonda nasogástrica.
4. La periodicidad de la alimentación depende en
buena parte de la proporcionalidad corporal.
En ese sentido, los pacientes armónicos pueden recibir alimentación a "libre demanda",
siempre y cuando los periodos interalimentarios
no excedan de seis horas; en cambio, los disarmónicos deben abstenerse de ayunos mayores
a 3 o 4 horas.
5. Es indispensable mantener estable la tempera
tura corporal del paciente para evitar que el me
tabolismo basal utilice 50% del aporte calóri
co. Por ello, se recomienda considerar la posi
bilidad de usar incubadora a temperatura de 32
a 34°C, lo cual disminuye de manera ostensi
ble el gasto calórico del paciente con fines de
termogénesis y en consecuencia permite utili
zar la diferencia de calorías en el proceso de
crecimiento. Si lo anterior no es posible, se
sugiere recurrir a la técnica de "madre cangu
ro" que consiste en mantener al paciente en
contacto permanente con la piel del tronco de
la madre, lo cual le aporta en promedio 37°C
de temperatura. En condiciones ideales, el pa
ciente tiene que permanecer desnudo o sólo con
pañal, mientras la ropa o cobijas lo rodean a él
junto a su madre.
Cuando el paciente es capaz de mantener
su temperatura corporal en condiciones basaÍes y también pesa más de 2 kg puede valorarse la conveniencia de cubrirlo sólo con ropa y
cobijas suficientes; en este caso se requiere
evitar la sudación en exceso que facilita la
pérdida de calor del cuerpo hacia el ambiente
6. Es esencial asegurarse que la concentración de
hemoglobina del paciente sea adecuada, y que
no existan infecciones intercurrentes capaces
de limitar el crecimiento.
La recuperación del retraso de crecimiento
intrauterino es una medida terapéutica imprescindible, ya que los afectados pueden tener complicaciones y mayor morbilidad general entre menor sea
la edad gestacional y más bajo el peso al nacer,
139
aunque no corren riesgo de generar hiperbilirrubinemia. Algunas consecuencias observadas en pacientes que no recuperaron el crecimiento son las
siguientes:
1. Aumento en la incidencia de diabetes mellitus
no insulinodependiente e hipertensión arterial,
con riesgo elevado de sufrir aterosclerosis prematura en la etapa de adulto joven. Aunque se
desconoce la relación causa y efecto, a los seis
meses de edad posnatal se ha encontrado corelación directa entre la capacidad de producción de insulina y la recuperación del crecimiento.
2. Las mujeres que padecieron retraso de crecimiento intrauterino durante los dos primeros
trimestres de la gestación conciben hijos con
retraso de crecimiento intrauterino moderado
a grave en 90% de los casos; en cambio, sólo
15% de aquellas que sufrieron hipocrecimiento intrauterino durante el tercer trimestre de su
gestación tienen hijos con esa característica.
3. A los cuatro años de edad es posible observar
perímetro cefálico menor al esperado para la
estatura, el cual se acompaña de disfunción cerebelosa moderada y disfunción cognoscitiva
leve en intensidad directamente proporcional
al peso observado al nacer.
4. A los ocho años de edad, sólo ha sobrevivido
30% de los pacientes con peso menor de 1 kg
al nacer. De ellos, sólo 50% presenta un desempeño escolar adecuado (21% tiene retraso
psicomotriz leve; 21%, moderado, y 8% grave), y 48% manifiesta alteraciones visuales o
visoperceptuales.
La recuperación del crecimiento durante los
seis primeros meses de vida extrauterina al parecer
conduce a crecimiento adecuado en las etapas preescolar y escolar; sin embargo, algunos estudios han
demostrado que hasta 37.5% de los pacientes desarrollan grados variables de disfunción en la neurosecreción de hormona de crecimiento.
Los pacientes que no lograron recuperar la
deficiencia intrauterina del crecimiento, sobre todo
quienes poseen proporciones armónicas, adoptan
un patrón intrínseco de crecimiento (estatura baja,
edad ósea acorde con la cronológica y velocidad de
crecimiento normal) que ocasiona estatura menor
a la esperada de acuerdo con las características
epigenéticas de sus ascendientes: varones 7.5 cm
por debajo de lo esperado, y mujeres 9.6 cm inferior a la media familiar. Sin embargo, a menor peso
y estatura al nacer corresponde menor estatura
final.
140
Sección III • Talla baja por diversos trastornos
El peso y la talla al nacer correspondientes a
menos de dos desviaciones estándar por debajo de
la media poblacional supone en ambos sexos una
estatura final ubicada 0.4 desviaciones estándar por
debajo del promedio. La estatura al nacer correspondiente a más de dos desviaciones estándar por
debajo del promedio implica estatura final situada
0.9 desviaciones estándar inferiores; si además el
peso muestra ese mismo esquema gráfico, la estatura final se coloca 1.2 desviaciones estándar abajo
de la media familiar.
El tratamiento de estos pacientes por medio de
hormona de crecimiento humana biosintética es aún
controvertido. La administración de esta hormona
durante el primer año de la vida, a dosis de 0.3 a
0.7 U/kg/semana, aumenta en 2 a 4 cm la velocidad
de crecimiento lograda durante este periodo; pero
algunos pacientes muestran aceleración desproporcionada de la edad ósea y esto hace pensar que su
estatura final no mejorará. Otros estudios han demostrado que las dosis superiores de esta hormona
(1.4 U/kg/semana) aumentan la estatura hasta en
13.8 a 18.7 cm durante los dos primeros años de
tratamiento; por ello, aunque la edad ósea se adelante, la estatura obtenida es equivalente a la pérdida del crecimiento intrauterino y en consecuencia
la estatura final se sitúa dentro de los límites esperados para las características epigenéticas de los
pacientes o incluso por encima de ellos. Sin embargo, hasta en 50% de estos pacientes se ha encontrado duplicación en las concentraciones séricas de
insulina, y aunque a corto plazo esto no altera la
regulación del metabolismo de carbohidratos sí abre
la posibilidad de desarrollo de diabetes mellitus en
la edad adulta en una proporción mayor de la esperada para la población general.
El niño sin "crecimiento de recuperación" a
pesar de haber implementado todas las medidas
terapéuticas necesarias (con excepción del uso de
hormona de crecimiento) debe considerarse bajo
sospecha de alteraciones genéticas y reexaminarse
en busca de dismorfias, considerando lo siguiente:
1. Sólo 1% de los pacientes con alteraciones genéticas no presenta dismorfias, sin importar la
armonía o disarmonía de sus proporciones
corporales.
2. De los pacientes armónicos, 17% padece alteraciones genéticas que se acompañan de dis
morfias.
3. De los sujetos disarmónicos al nacer, 66% tiene un síndrome genético caracterizado por dismorfias múltiples.
Los recién nacidos que no muestren crecimiento extrauterino normal, y en particular aquéllos con
retraso de crecimiento intrauterino no recuperado,
deben estudiarse y valorarse en busca de una o más
de las siguientes causas:
1. Alimentación insuficiente
A. Preparación insuficiente de la fórmula, ya
sea en cantidad o en calidad.
B. Desconocimiento de la madre respecto de
las características de los hábitos alimenta
rios del paciente.
C. Alteraciones en la relación madre e hijo,
ya sea desde el punto de vista psicológico
o bien porque la madre se separa del niño
desde el primer mes de vida, con frecuencia
para incorporarse a actividades laborales.
D. Deprivación económica que dificulta la adquisición de nutrimentos adecuados para
el paciente.
E. Limitaciones perceptuales en la madre, ya
sea por desconocimiento de las manifesta
ciones de demanda del paciente, o bien por
presentar retraso psicomotriz leve, hipoacusia o anacusia, incapacidad para el despla
zamiento (fracturas, alteraciones musculosqueléticas, etc.).
2. Dificultades para la alimentación
A. Anormalidades congénitas de nariz, boca
o mandíbula, entre ellas atresia de coanas,
micrognatia grave, glosoptosis, labio lepo
rino y paladar hendido.
B. Anormalidades congénitas del tracto gas
trointestinal superior, del tipo de atresia
esofágica, fistula traqueoesofágica, hernia
diafragmática, estenosis pilórica, etcétera.
C. Alteraciones cardiacas congénitas y disnea
de origen respiratorio.
3. Alteraciones para la absorción de nutrimentos
A. Deficiencia de disacaridasas o malabsorción de monosacáridos.
B. Alergia a las proteínas de la leche de vaca.
C. Fibrosis quística del páncreas.
D. Enfermedad celiaca.
E. Inmunodeficiencias congénitas.
F. Enfermedad de Hirschsprung.
G. Acrodermatitis enteropática.
H. Atresia o hipoplasia de vías biliares.
I. Antecedentes de enfermedad isquémica intestinal, estados posteriores a la corrección
quirúrgica de gastrosquisis, onfalocele, vólvulos, resección intestinal, etcétera.
J. Desnutrición proteínica y calórica.
4. Incremento del metabolismo
A. Infecciones crónicas.
B. Hipertiroidismo neonatal.
C. Fístula arteriovenosa.
Capítulo 11 • Retraso de crecimiento intrauterino
5. Menor utilización de nutrimentos
A. Infección intrauterina o cromosomopatías.
B. Retraso mental o trastornos metabólicos,
en especial enfermedades por atesoramien
to como glucogenosis, galactosemia, lipidosis y esfingolipidosis.
C. Alteraciones en el metabolismo de los aminoácidos, en especial aquellas que evolucionan con hiperamonemia.
D. Hipoxemia, ya sea por anemia, enfermedad pulmonar o cardiopatías.
E. Hipotiroidismo congénito.
6. Alteraciones neurológicas. Estas pueden impedir la adecuada expresión del paciente encaminada a satisfacer sus demandas nutricias;
además suelen coexistir con alteraciones nutricias y de ese modo incrementan el riesgo de
malnutrición. Algunas de ellas son:
A. Inmadurez que ocasiona disminución en los
reflejos de succión y deglución.
B. Alteraciones en el mecanismo de la deglu
ción.
C. Hipotonía generalizada, debido a miastenia grave, síndrome de Werdnig-Hoffman
o incluso a hipotonía congénita.
D. Daño a sistema nervioso central por hipoxia
o kernicterus.
E. Hemorragia intracraneana o hematoma
subdural.
F. Retraso mental de cualquier causa.
Todos los pacientes con retraso de crecimiento
intrauterino por causas distintas a alteraciones genéticas deben lograr la recuperación luego de que
se les aplican las medidas terapéuticas necesarias y
se previene la presencia de situaciones limitantes
del crecimiento posnatal.
No obstante lo anterior, incluso en pacientes
con trastornos genéticos, la identificación temprana de riesgos específicos para su trastorno permite
establecer conductas adecuadas tanto preventivas
como de rehabilitación. Estos niños, pueden tener
relacionados factores maternos y uterinos capaces
de limitar el crecimiento; en este caso, el crecimiento de recuperación alcanza lo esperado como "normal" para su padecimiento de base.
En conclusión, el retraso de crecimiento intrauterino debe considerarse:
Un acontecimiento transitorio de limitación del
crecimiento fetal, que en la mayoría de los
casos puede someterse a tratamiento de tal
manera que se logre recuperación extrauterina total
141
LECTURAS RECOMENDADAS
Albrecht ED, Pepe GJ. Placental steroid hormone biosynthesis in primate pregnancy. Endocr Rev 1990; 11:
124.
Chernausek SD, Breen TJ, Frank GR. Linear growth in
response to growth hormone treatment in children with
short stature associated with intrauterine growth retardation: the national cooperative group study experience.
J Pediatr 1996;128:22.
Dorr HG, Versmold HT, Sippell WG. Antenatal betamethasone therapy: effects on maternal, fetal and neonatal
mineralocorticoid, glucocorticoid and progestins. J
Pediatr 1986;108:990.
Evain DB. Hormonal regulation of fetal growth. Horm Res
1994;42:207.
Fisher DA. Endocrinology of fetal development. En: Wilson J, Foster D (eds). Textbook of Endocrinology. Philadelphia: WB Saunders, 1991:1049.
Frank DA, Bauchner H, Parker S et al. Neonatal body proportionality and body composition after in utero exposure to cocaine and marijuana. Pediatrics 1990;l 17:622.
Gardoni J, Chang A, Kalyan B. Customized antenatal growth
charts. Lancet 1991;339:283.
Gluckman PD, Grumbach MM, Kaplan SL. The neuroendocrine regulation and function of growth hormone and
prolactin in the mammalian fetus. Endocr Rev 1981;
2:363.
Gunn TR, Gluckman PD. The endocrine control of the onset
of thermogenesis at birth. Bailliere's Clin Endocrinol
Metab 1989;3:869.
Harwell C, Padbury JF, Anand RS. Fetal catecholamine
responses to maternal hypoglycemia. Am J Physiol
1990;259:1126.
Heinrich UE. Intrauterine growth retardation and familial
short stature. Bailliere's Clin Endocrinol Metab 1992;
6:589.
Hill DJ, Milner RDG. Insulin as a growth factor. Pediatr
Res 1985;19:879.
Kaplowitz P, Webb J. Diagnostic evaluation of short children with height 3 SD or more below the mean. Clin
Pediatr 1994;33:530.
Lasarre C, Hardouin S, Daffos F et al. Serum insulin-like
growth factors and insuline-like growth factor binding
proteins in the human fetus: relationships with growth
in normal subjects and in subjects with intrauterine
growth retardation. Pediatr Res 1991;29:219.
Leppig KA, Werler MM, Cann CI. Predictive value of minor anomalies. J Pediatr 1987;110:531.
Mirlesse V, Frankenne F, Alsat E, Poncelet M, Hennen G,
Evain-Brion D. Placental growth hormone levels in
normal pregnancy and in pregnancies with intrauterine
growth retardation. Pediatr Res 1993;34:439.
Nieto Ad, Villar J, Matorras RW, Valenzuela RP. Intrauterine growth retardation at term: association between
142
Sección III • Talla baja por diversos trastornos
anthropometric and endocrine parameters. Acta Obstet
Gynecol Scand 1996;75:127.
Phillips JA. Genetic diagnosis: differentiating growth disorders. Hosp Pract 1985;20:85.
Sibley CP, Boyd RDH. Mechanism of transfer across the
human placenta. En: Polin RA y Fox WW (eds). Fetal
and neonatal physiology. Philadelphia: WB Saunders,
1992:62.
Siler TK. Endocrine and paracrine function in the human
placenta. En: Polin RA, Fox WW (eds). Fetal and neonatal physiology. Philadelphia: WB Saunders, 1992:74.
Varvarigou A, Vagenakis AG, Makri M, Beratis NG. Growth
hormone, insulin-like growth factor-1 and prolactin in
small for gestational age neonates. Biol Neonate 1994;
65:94.
Wilson D, Baldwin R, Ariagno R. A randomized, placebocontrolled trial of dexamethasone on the hypothalamic
pituitary adrenal axis in preterm infants. J Pediatr
1988;113:764.
Capítulo
12
Displasias óseas
El crecimiento en función de la estatura del individuo representa el incremento de longitud del sistema esquelético, por lo que en condiciones fisiológicas se asume que un individuo con progresión
normal de estatura se encuentra sin anormalidad
alguna.
El diagnóstico inicial de la estatura baja desde
el inicio debe diferenciar entre una alteración intrínseca del hueso o la existencia de una o más
anomalías que impiden crecer a un hueso por lo
demás sano.
Las enfermedades esqueléticas primarias agrupan gran número de trastornos denominados displasias óseas que tienen un factor etiopatogénico
común: la alteración congénita o hereditaria del
tejido conjuntivo que lesiona la síntesis o conformación de la matriz ósea y se expresa como anormalidades en el tamaño, la forma y la remodelación del cartílago y de los huesos que conforman al
cráneo, tronco o extremidades.
En la actualidad se reconocen más de 80 displasias óseas. La clasificación se ha unificado, pero
la nomenclatura todavía es muy variada porque
aunque la mayoría de las denominaciones se basan
en la parte del esqueleto más afectada, la descripción desde el punto de vista clínico puede realizarse de acuerdo con los resultados radiográficos e
incluso con base en los hallazgos histopatológicos.
Así por ejemplo, cuando la afección involucra a la
columna vertebral, sin importar la región vertebral
anormal, se utiliza el término "espóndilo" entre múltiples posibilidades denominativas que impiden inferir la etiología específica y que no son excluyentes
entre sí; en cambio, la afección en los huesos largos
se describe de acuerdo con la zona radiográfica más
alterada, que puede ser la diáfisis, metáfisis o epífisis. Otras denominaciones se basan en el subsegmento de las extremidades que clínicamente se en-
cuentra más acortado; se nombra "rizomélica" cuando es proximal, "mesomélica" si es medio y "acromélica" en afecciones distales. En algunas ocasiones se le agrega el prefijo tanato- a la enfermedad
que se relaciona con índice alto de mortalidad.
En este capítulo se describen las características generales del grupo conocido en la actualidad
como osteocondrodisplasias, aunque no se aborda
el tema de las disostosis (malformaciones óseas
individuales, ya sea aisladas o en combinación, entre
ellas la craneosinostosis y el síndrome de KlippelFeil), las alteraciones metabólicas primarias que
repercuten directamente en el hueso (mucopolisacaridosis y otras) y las osteólisis.
Si bien no todas las displasias óseas originan
estatura baja o desproporción corporal flagrante,
es esencial establecer la sospecha diagnóstica en
todo paciente que evidencie estatura baja desproporcionada durante la realización de una somatometría completa y minuciosa que incluya como
mínimo:
1.
2.
3.
4.
5.
Estatura de pie o en decúbito, o ambas.
Estatura sentado.
Longitud de segmentos superior e inferior.
Relación de segmentos superior e inferior.
Longitud de la brazada y relación brazada-es
tatura.
6. Perímetro cefálico y en algunos casos períme
tro torácico.
El diagnóstico definitivo se establece en la
mayoría de los pacientes de acuerdo con las características radiográficas, y en condiciones ideales es
necesario integrar un equipo multidisciplinario para
el análisis particular de cada caso; pero para facilitar el estudio es importante tomar en cuenta las siguientes consideraciones:
143
144
Sección III • Talla baja por diversos trastornos
1. Posibilidad de afección de otros familiares, que
se confirma o descarta mediante el análisis de
la estatura de éstos y su correlación con la estatura final esperada de los padres, tíos y abuelos de acuerdo con las características fenotípicas de la familia. Los parientes con sospecha
de alteración del crecimiento deben ser entrevistados y sometidos a medición en busca de
estatura baja y desproporción corporal; también es necesario someterlos a estudios radio
gráficos completos.
El análisis de familiares afectados y de la
existencia o ausencia de consanguinidad permite determinar el tipo de transmisión hereditaria de la displasia, y después proporcionar
consejo genético a cada individuo y a su familia. Para fines de estudio, en este capítulo se
señala el tipo de transmisión mendeliana que
se ha encontrado en gran número de pacientes;
pero es conveniente tomar en cuenta la posibilidad de que ocurran casos esporádicos para
cada una de las osteodisplasias, los cuales en
proporción pueden representar incluso mayoría en comparación con los que se heredan por
patrón mendeliano.
2. Algunas displasias (entre ellas, acondroplasia,
acondrogénesis, displasia espondiloepifisaria
congénita, condrodisplasia punctata, etc.) se
acompañan de alteración prenatal del crecimiento de manera que es posible identificarlas
desde la etapa neonatal, mientras que otras se
diagnostican con frecuencia después de los dos
años de edad (displasia epifisaria múltiple, displasia espondilometafisaria, seudoacondroplasia, hipocondroplasia, etc.).
Por otro lado, el grado de afectación del
crecimiento varía de un padecimiento a otro (e
incluso entre individuos con una misma etiología). Por ejemplo, en términos generales,
aquellos pacientes con hipocondroplasia o con
displasia epifisaria múltiple desarrollan una estatura cercana a la considerada habitual para la
población sana (-1.5 a -3 desviaciones estándar por debajo de la media), que en países sin
desarrollo de tecnología obliga a realizar un
diagnóstico diferencial y complementario con
problemas nutricios. Las displasias con alteración en las metáfisis casi siempre evolucionan
con mayor limitación del crecimiento; pero el
hipocrecimiento más acentuado se observa en
aquellos que sufren afección grave y principal
del cartílago de crecimiento (acondroplasia,
acondrogénesis, etc.).
3. Es importante determinar si existe alteración
respiratoria debida a disminución de la capaci-
4.
5.
6.
7.
8.
dad torácica por afección en costillas, ya que
en la mayoría de estos pacientes la enfermedad puede ser letal en los primeros días o meses de la vida. También es indispensable investigar la existencia de inestabilidad atlantoaxil,
debido a que un traumatismo leve a moderado
o incluso el simple intento de intubación traqueal puede provocar lesión o sección medular. Deben evaluarse a este respecto todos los
pacientes con sospecha de displasias epifisarias, seudoacondroplasia, displasia espondilometafisaria, hipoplasia cartílago-pelo, síndrome de Kniest, displasia metatrófica y displasia
frontometafisaria.
Ante una estatura disarmónica relacionada con
genu varum es imprescindible estudiar al
paciente en busca de acondroplasia, hipocon
droplasia, displasias metafisarias e hipoplasia
cartílago-pelo. La estatura disarmónica relacionada con genu valgum es más frecuente en displasias que afectan a la columna y particular
mente en las espondiloepifisarias, por lo que
éstas deben investigarse.
Aunque en la mayoría de los pacientes la alteración esquelética no modifica la resistencia
ósea y por ello no se relaciona con predisposición a fracturas, el desarrollo presente o pasado de éstas debe hacer sospechar osteogénesis
imperfecta, osteopetrosis o picnodisostosis.
Las displasias que afectan las epífisis o las metáfisis pueden originar retardo en la aparición
radiográfica de los núcleos de crecimiento sobre todo en los huesos largos, por lo que algunos de estos pacientes presentan edad ósea
retrasada.
La mayoría de los pacientes con displasias
óseas poseen desarrollo intelectual normal;
pero el efecto emocional y psicosocial debido
a la estatura muy baja y fenotipo distinto al del
resto de la población con frecuencia se convierte en factor de alto riesgo para la falta de
integración sociocultural.
En la actualidad, estudios de biología y genética molecular han demostrado la existencia de
alteraciones comunes para padecimientos que
inicialmente no se consideraban emparentados. Un ejemplo de lo anterior es el análisis de
los receptores para el factor de crecimiento
de los fibroblastos. En la caracterización de las
mutaciones génicas para al menos tres tipos de
receptores se ha probado que la alteración
de un locus distinto dentro del mismo gen produce fenotipos distintos. De ese modo, los pacientes con síndromes de Pfeiffer, Crouzon y
Apert padecen alteraciones en el receptor tipo
Capítulo 12 • Displasias óseas
dos, en localizaciones muy cercanas pero específicas para cada uno de ellos, y que afecta
el dominio transmembrana del receptor; en
cambio, los trastornos independientes unos de
otros, para un locus del gen que codifica para
el dominio transmembrana del receptor tipo
tres, se observan en pacientes con acondroplasia, hipocondroplasia y displasia tanatofórica
(fig. 12-1).
El estudio de los pacientes con sospecha de
displasia ósea requiere de un equipo multidisciplinario, por lo que resulta impráctico señalar todas
las características de cada una de las osteocondrodisplasias. En consecuencia, sólo se describen aquellos trastornos que se consideran más frecuentes en
la población nacional de acuerdo con la estadística
de la Clínica Multidisciplinaria para el Estudio de
las Displasias Oseas del Instituto Nacional de Pediatría (cuadro 12-1).
El cuadro clínico puede variar de un paciente
a otro, tanto en la expresión clínica clásicamente
descrita como en su intensidad; por ello, aunque
los algoritmos de diagnóstico disponibles sean útiles durante el abordaje general, es esencial valorar
a cada paciente de acuerdo con sus características
145
individuales antes de establecer el diagnóstico definitivo.
Todas las displasias óseas afectan al crecimiento esquelético desde la vida intrauterina, pero desde el punto de vista clínico por lo general se dividen en aquellas que suelen diagnosticarse desde el
nacimiento y las que con frecuencia se identifican
en pacientes mayores de dos años de edad.
DISPLASIAS IDENTIFICARLES
DESDE EL NACIMIENTO
En términos generales todas las displasias identificables desde el nacimiento evolucionan con una
longitud menor a 48 cm al nacer y desproporción
en la relación de segmentos superior e inferior. Para
fines de estudio, éstas se dividen en las relacionadas con mortalidad temprana y las relacionadas con
talla baja neonatal.
La mayoría de las displasias relacionadas con
mortalidad temprana se caracteriza por tronco estrecho que dificulta la ventilación pulmonar y estatura muy baja. Durante el diagnóstico diferencial
de estos trastornos deben considerarse los siguientes aspectos:
Fig. 12-1. Alteraciones génicas en algunas displasias óseas. A. Mutaciones en el gen de la colágena tipo 2 (cadena alfa-1),
que codifica para el dominio de triple hélice de la colágena, y sus relaciones con distintas displasias óseas. B. Alteraciones en
el gen del receptor tipo 2 para el factor de crecimiento de los fibroblastos y las displasias óseas resultantes.
146
Sección III • Talla baja por diversos trastornos
Cuadro 12-1. Frecuencia de displasias óseas
de acuerdo con estadísticas de la Clínica
Multidisciplinaria para el Estudio de las Displasias
Oseas del Instituto Nacional de Pediatría
Displasia ósea
pueden haber islotes óseos múltiples. Los huesos
tubulares son cortos y con frecuencia se identifican
fracturas costales.
Se transmite con patrón autosómico recesivo.
Frecuencia (%)
Acondroplasia
34.5
Hipocondroplasia
16.5
Displasia epifisaria múltiple
Displasia espondiloepifisaria congénita
16.5
5.5
Síndrome de Kniest
Displasia metafísaria tipo Schmid
3.7
3.7
Displasia metafísaria tipo McKusick
Otras displasias metafisarias
3.7
3.7
Displasia espondiloepifisaria tardía
3.7
Síndrome de Larsen
Displasia espondilometafisaria
1.9
1.9
Displasia metatrófica
1.9
Displasia tanatofórica
Brazos y piernas muy cortos, macrocefalia con cráneo anormal, con frecuencia en forma de trébol. La
talla media es de 40 cm en el momento del nacimiento.
El estudio radiográfico muestra costillas cortas, platispondilia y pelvis pequeña y ancha.
Durante la gestación con frecuencia se identifica polihidramnios.
La mayoría de los casos se presentan de manera esporádica.
Displasia campomélica
1. El paciente con longitud menor de 30 cm en el
momento del nacimiento puede padecer acondrogénesis.
2. La estatura neonatal cercana a 40 cm implica
la necesidad de analizar la forma del cráneo.
La probabilidad de encontrar displasia tanatofórica aumenta cuando el cráneo es anormal y
con frecuencia en forma de trébol; asimismo,
es posible que los pacientes con hipotonía grave aun con cráneo normal tengan displasia
campomélica y, en ausencia de hipotonía, el
cuadro clínico puede mostrar displasia torácica asfixiante.
3. En un paciente con cataratas, la estatura neo
natal cercana a 48 cm debe inducir a pensar
como primera posibilidad en la condrodisplasia punctata rizomélica.
A continuación se presentan las principales
características de las displasias relacionadas con
mortalidad temprana, entre las que se encuentran:
acondrogénesis, displasia tanatofórica, displasia
campomélica, displasia torácica asfixiante y condrodisplasia punctata rizomélica.
Acondrogénesis
Brazos y piernas tienden a ser muy cortos, con estatura promedio al nacer de 25 a 30 cm; también se
observa macrocefalia y cuello corto.
Los estudios radiográficos evidencian falta casi
total de osificación del esqueleto axil y del pubis,
con presencia de hueso membranoso dentro del cual
La cara tiende a ser plana, y existe micrognatia e
implantación baja de los pabellones auriculares. La
estatura media al nacer es de 42 cm; las piernas
muestran incurvamiento anterior.
De manera muy característica, los pacientes
sufren hipotonía muscular muy grave que origina
capacidad ventilatoria insuficiente. En las radiografías se comprueba el incurvamiento de huesos largos vinculado con hipoplasia de metacarpianos y
falanges, platispondilia y sólo 11 pares de costillas.
Se transmite con patrón autosómico recesivo.
Displasia torácica asfixiante
Los brazos y las piernas son cortos, mientras que
las manos y los pies son anchos. Cerca de la cuarta
parte de los pacientes muestran polidactilia. El
volumen torácico tiende a ser muy disminuido.
El estudio radiográfico muestra que las costillas son cortas en extremo. Otros datos son epífisis
cónicas con fusión prematura, metáfisis anchas e
irregulares y pelvis pequeña con acetábulo plano.
Los pacientes que no mueren por asfixia suelen desarrollar insuficiencia renal rápidamente progresiva.
Se hereda con patrón autosómico recesivo.
Condrodisplasia punctata rizomélica
La talla al nacer es muy cercana a 48 cm pese a que
los brazos y piernas son cortas, en especial en su
porción proximal. La mayoría de los pacientes tiene cataratas congénitas.
Capítulo 12 • Displasias óseas
147
Las radiografías muestran metáfisis ensanchadas e irregulares, y de manera característica se identifican calcificaciones epifísarias puntiformes.
Se transmite con patrón autosómico recesivo.
Por otro lado, los pacientes que padecen displasia relacionada con talla baja neonatal se identifican por la progresión subnormal del crecimiento en los dos primeros años de la vida, cuando no
se diagnostican por sus características clínicas en
el momento del nacimiento. Sin embargo, algunos
de ellos acuden a examen médico por problemas
ortopédicos, cardiacos o neurosensoriales sin que
se sospeche displasia de este tipo. En general, la
observación inicial puede establecerse de acuerdo
con los siguientes parámetros:
1. El tronco pequeño y los brazos y piernas normales pueden ser manifestaciones de displasia
espondiloepifisaria congénita.
2. Proporciones de segmentos cercanas a lo normal, pero en ausencia de clavículas, implican
la posibilidad de displasia cleidocraneal.
3. Tronco normal, piernas relativamente pequeñas y brazos de longitud reducida hacen sospechar la existencia de displasia acromesomélica.
4. El hipocrecimiento notable de piernas y brazos, con un tronco relativamente normal, pueden orientar hacia la diferenciación diagnóstica de acuerdo con los siguientes datos:
A. Acondroplasia: lordosis, frente prominente y facies tosca.
B. Síndrome de Ellis van Creveld o displasia
condroectodérmica: alteraciones dentales,
polidactilia y cardiopatía.
C. Condrodisplasia punctata no rizomélica:
contracturas en flexión y retraso psicomotriz.
D. Displasia diastrófica: contracturas en
flexión, pie equinovaro, pulgar aducto y
escoliosis.
E. Síndrome de Kniest: sordera o miopía o
ambas.
F. Displasia mesomélica: desviación cubital
de la mano.
G. Displasia metatrófica: xifoscoliosis grave.
Acondroplasia
Se identifica con facilidad desde el nacimiento, y
sus manifestaciones clínicas varían poco conforme
aumenta la edad (fig. 12-2).
Hay evidente desproporción somatométrica
originada por hipocrecimiento muy marcado del
segmento inferior (brazos y piernas), aunque la
columna vertebral también está afectada. El perímetro cefálico es normal, pero puede existir macrocefalia que en ocasiones aumenta debido a hidrocefalia.
Algunas características clínicas presentes de
manera casi universal son:
1.
2.
3.
4.
5.
6.
7.
8.
Frente prominente.
Puente nasal deprimido.
Prognatismo progresivo leve a moderado.
Apiñamiento y maloclusión dental.
Otitis de incidencia aumentada.
Disminución del diámetro sagital del tórax.
Hiperlordosis lumbar con glúteos prominentes.
Acortamiento predominantemente proximal de
las extremidades (rizomélico), aunque las manos y los pies tienden a ser también pequeños.
9. Con frecuencia signo del tridente (cuando se
observa la mano abierta, los dedos cuarto y
quinto forman un grupo separado del segundo
y tercero, y éstos a su vez del pulgar), y longitud similar de los dedos segundo, tercero y
148
Sección III • Talla baja por diversos trastornos
cuarto. Existe limitación articular en hombros,
codos y cadera. Las piernas pueden estar arqueadas.
El estudio radiológico demuestra las siguientes alteraciones:
Huesos tubulares cortos y anchos. En ocasiones se encuentran curvaturas diafisarias moderadas
y tibias (pero no peroné) cortas.
Espacios articulares en particular amplios antes de que aparezcan los cartílagos de crecimiento.
En la columna se observan cuerpos vertebrales
con tendencia piriforme y leve platispondilia, así
como disminución cefalocaudal de la distancia interpeduncular que se acentúa conforme aumenta la
edad. Las costillas tienden a ser cortas.
Pelvis corta y ancha en particular a consecuencia de hipoplasia grave del cuerpo del iliaco, con
escotaduras sacroiliacas cortas y acetábulos trirradiados.
El estudio del cráneo muestra agujero magno
muy pequeño que se considera dato indispensable
para establecer el diagnóstico, aunque esta característica también puede observarse en la hipocondroplasia.
La estatura final tiende a ser muy pequeña, con
medias de 132 cm en varones y 123 cm en mujeres.
Se transmite con patrón autosómico dominante, pero es frecuente encontrar mutaciones de novo.
Las complicaciones observadas con más frecuencia son: hidrocefalia por agujero magno estrecho; parestesias progresivas y paraplejías agudas
por traumatismos secundarios a hipoplasia de los
arcos neurales; canal raquídeo estrecho, y protrusión de discos intervertebrales hacia éste.
En el momento del nacimiento, el diagnóstico
diferencial debe incluir: acondrogénesis, displasia
tanatofórica, condrodisplasia punctata y displasia condroectodérmica; en cambio, durante la infancia dicho diagnóstico toma en cuenta hipocondroplasia, displasias metafísarias, formas graves
de displasia epifisaria múltiple y seudoacondroplasia.
El estudio radiográfico muestra vértebras planas y ovoides (en forma de pera), hipoplasia de la
apófisis odontoides, iliacos cortos y anchos. Las
epífisis son displásicas e irregulares, y con frecuencia no existen en cadera y rodilla. Hay acortamiento rizomélico de extremidades.
Se hereda de manera autosómica dominante y
se alcanzan 90 a 130 cm de estatura final.
El diagnóstico diferencial debe tomar en cuenta la seudoacondroplasia y el síndrome de Morquio.
Condrodisplasia punctata no rizomélica
Las piernas y los brazos muestran acortamiento leve
y la facies es mongoloide; además, existe retraso
psicomotriz, cataratas congénitas, modificaciones
ictiociformes en la piel y contracturas articulares.
En varones con tipo de herencia ligado al cromosoma X la enfermedad suele ser letal.
Por medio de estudios radiológicos es posible
identificar calcificaciones epifisarias, pero éstas
tienden a desaparecer conforme progresa la edad.
Las metáfisis son normales.
Se transmite con patrón autosómico dominante, y ligado al cromosoma X. La talla final puede
ser baja (130 cm), pero existen casos en los que se
reportan tallas dentro de los límites normales (hasta 170 cm).
Displasia metatrófica
Por lo general existe micromelia, tronco corto con
xifoscoliosis grave y articulaciones aumentadas de
volumen.
Por medio de estudios radiológicos se puede
observar acortamiento rizomélico de las extremidades con ensanchamiento metafisario. En la columna hay platispondilia con vértebras cuneiformes.
El iliaco es hipoplásico, hay falta de osificación del
pubis y el sacro tiene aspecto de cola.
Se transmite con patrón autosómico recesivo y
se alcanzan 120 cm como estatura final media.
Displasia espondiloepifisaria congénita
Displasia distrófica
De modo característico el tronco es pequeño, y brazos y piernas son normales, pero pueden dar la impresión de ser largos. El paciente mide en promedio 45 cm de talla en el momento del nacimiento.
Dentro de las manifestaciones clínicas se encuentran: pectus carinatum, miopía, hipotonía y
fatiga muscular fácil; la cara tiende a ser redonda y
aplanada, y el cuello corto; los ojos son prominentes y puede existir paladar hendido.
La mayoría de los pacientes tienen pulgar aducto
(como pidiendo "aventón"), pie equinovarus, escoliosis y deformidades articulares con contracturas
en flexión. En el pabellón auricular se han encontrado quistes y edema local de presentación aguda.
En radiografías del esqueleto se encuentran
huesos tubulares cortos, acortamiento del primer
metacarpiano, estrechamiento de la distancia interpeduncular a nivel lumbar, epífisis ausentes o fragmentadas y metáfisis anchas.
Capítulo 12 • Displasias óseas
149
Se hereda de manera autosómica recesiva. Se
alcanzan 120 cm de estatura final media.
Displasia condroectodérmica o síndrome
de Ellis van Creveld
Clínicamente existe acortamiento centrífugo y progresivo de brazos y piernas (esto es, más acentuado
en las partes distales que en las proximales), y genu
valgum. Se observa polidactilia (más frecuentemente localizada entre el pulgar y el índice), uñas frágiles, cóncavas, pequeñas y con estrías longitudinales. Un tercio de los pacientes posee dientes natales;
todos manifiestan erupción dentaria retrasada y
pueden carecer de incisivos (fig. 12-3).
Una característica patognomónica es la presencia de puentes labiogingivales con pérdida del surco natural entre la encía y la parte interior del labio
(fig. 12-4).
Las cardiopatías que facilitan el desarrollo de
insuficiencia cardiaca se desarrollan en 60% de los
pacientes; las más frecuentes son los defectos del
Fig. 12-3. Displasia condroectodérmica o de Ellis van Creveld.
Fig. 12-4. Puentes labiogingivales con pérdida del surco
natural entre la encía y el labio en la displasia condroectodérmica o síndrome de Ellis van Creveld.
tabique auricular, aunque también pueden ocurrir
defectos del tabique interventricular y transposición
de grandes vasos.
Hasta 25% de los pacientes sufre alteraciones
genitales. En mujeres debe investigarse la posibilidad de útero tabicado, y en varones epispadias o
hipospadias, micropene y criptorquidia.
Los estudios radiológicos evidencian el desarrollo de huesos tubulares cortos y gruesos con
mayor afección acromélica. En extremidades inferiores, el peroné se halla más afectado; mientras que
el acortamiento de la tibia es más acentuado en la
parte medial que en la lateral a la altura del extremo proximal y con frecuencia se observan exostosis mediales. En extremidades superiores existe: hipoplasia con incurvamiento posterior del olécranon;
alargamiento distal y acortamiento proximal tanto
de cubito como de radio; fusión de los huesos del
carpo (grande y ganchoso) con aparición lenta, y
epífisis de las falanges medias de los dedos segundo a quinto en forma cónica. En cadera se puede
encontrar infradesarrollo supraacetabular con acortamiento de la espina ciática interna y formación
de espolones acetabulares. Las costillas suelen ser
ligeramente cortas y es usual que las metáfisis tengan apariencia de brillantez en relación con el resto
de los segmentos del hueso.
La estatura final es baja y varía entre 110 y
160 cm; asimismo, en la mayoría de los pacientes
la enfermedad se hereda de manera autosómica
dominante, aunque también se tiene conocimiento
de transmisión con carácter autosómico recesivo.
150
Sección HI • Talla baja por diversos trastornos
El diagnóstico diferencial debe incluir el síndrome de Hallerman-Streiff, con displasia cleidocraneal y con displasia torácica asfixiante.
Displasia mesomélica
Acortamiento intenso de brazos y piernas con mayor afectación del segmento medio, desviación
cubital de las manos y micrognatia.
Los huesos tubulares son cortos y toscos, existe hipoplasia acentuada del segmento proximal del
peroné y el radio se encuentra incurvado.
Se hereda de manera autosómica, tanto dominante como recesiva. La estatura final media es de
130 centímetros.
Displasia acromesomélica
Los brazos se afectan más que las piernas, aunque
ambas extremidades presentan hipocrecimiento. Las
manos son pequeñas e incurvadas, con el primer
dedo grande. Es posible el desarrollo de macrocefalia.
Los estudios radiológicos evidencian huesos
tubulares cortos y además metacarpianos y falanges anchos. Las vértebras son de forma oval.
La estatura final oscila entre 95 y 123 cm; asimismo, el trastorno se transmite con carácter autosómico recesivo.
Displasia cleidocraneal
Aplasia o hipoplasia característica de las clavículas
que origina tórax estrecho, braquicefalia, retraso en
el cierre de la fontanela anterior y alteraciones dentarias.
Por medio de radiografías se confirma la existencia de aplasia o hipoplasia clavicular, y es posible encontrar desarrollo anormal de huesos de la
cara y retraso en la osificación del pubis.
Se hereda con carácter autosómico dominante,
y la estatura final media es de 156 cm en varones y
de 144 cm en mujeres.
Síndrome de Kniest
Extremidades cortas y deformidades articulares e
inestabilidad atlantoaxil; es frecuente que las manos posean disposición en "tridente". Asimismo,
existe megacefalia con cara plana y cuello corto y
alrededor de 50% de los pacientes padecen miopía
o sordera, o ambas.
El estudio radiológico evidencia diáfisis cortas, platispondilia e hipoplasia proximal del fémur.
La estatura final media es de 135 centímetros. Asi-
mismo, el trastorno se hereda con carácter autosómico dominante.
DISPLASIAS IDENTIFICADAS
DURANTE LA INFANCIA
Cualesquiera de las displasias descritas a continuación pueden evidenciarse durante los primeros
meses de la vida, pero lo más frecuente es que el
diagnóstico se establezca durante la etapa preescolar o escolar, cuando la estatura baja se identifica
como disarmónica.
El estudio inicial basado en características clínicas es poco útil en este grupo de padecimientos,
ya que la mayoría afecta de manera predominante
el crecimiento del esqueleto paraxil y existen pocas manifestaciones específicas de un trastorno en
particular; sin embargo es necesario considerar los
siguientes aspectos:
1. Posible desarrollo de displasias espondilometafisaria y espondiloepifisaria tarda en pacientes con hipocrecimiento del tronco, y extremidades normales.
2. Posibilidad de displasia metafisaria tipo McKusik o displasia tricorrinofalángica en pacientes con cabello fino y escaso y con frecuencia
hipopigmentado.
3. La displasia metafisaria tipo Shwachman se
acompaña de insuficiencia pancreática y neutropenia (cíclica o persistente).
4. Algunas manifestaciones de discondroestenosis, displasia metafisaria tipo Jansen y displasia epifisaria múltiple son afección de brazos y
piernas con limitación para la movilidad articular. En la displasia epifisaria múltiple es frecuente el dolor articular.
5. Posible hipocondroplasia en niños con apariencia atlética.
6. Sospechar picnodisostosis ante retraso notable
del cierre de la fontanela anterior.
7. La displasia metafisaria tipo Schmid y seudoacondroplasia se caracterizan por acortamiento con predominio rizomélico.
La mayoría de las displasias identificadas durante la infancia se complican con osteoartritis
durante la etapa de adulto joven. A continuación se
mencionan las características principales de estos
trastornos.
Hipocondroplasia
Acortamiento moderado del segmento inferior más
acentuado en piernas que en brazos (figs. 12-5 y
12-6).
Capítulo 12 • Displasias óseas
151
Fig. 12-6. Proporciones corporales en hipocondroplasia.
Fig. 12-5. Madre e hijo con hipocondroplasia.
Las características clínicas son similares a las
de la acondroplasia, aunque en menor gravedad
(frente prominente, hiperlordosis lumbar moderada, manos y pies cortos) y con frecuencia se halla
laxitud articular. La apariencia física suele ser atlética y 26% de los pacientes afectados presenta retraso psicomotriz.
El estudio radiológico demuestra huesos tubulares cortos y anchos, con cartílagos de crecimiento pequeños. Las metáfisis distales en muñeca y
rodilla son ensanchadas, mientras que la metáfisis
proximal de la tibia da la apariencia de ser cuadrada; el peroné tiende a ser más largo que la tibia. En
la columna existe disminución del espacio interpeduncular lumbar y acortamiento de las costillas; en
la pelvis, los iliacos son cortos y cuadrados. El
agujero magno del cráneo es pequeño.
El trastorno se transmite de manera autosómica dominante y la estatura final varía entre 130 y
150 cm con una media de 140 centímetros.
El diagnóstico diferencial debe incluir principalmente acondroplasia, pero también es imprescindible considerar las displasias espondiloepifisaria
y metafisaria.
Displasia epifisaria múltiple
Es usual que el diagnóstico se establezca entre los
5 y 10 años por estatura baja con acortamiento leve
a moderado de brazos y piernas mayor que el del
tronco. Se presenta dolor episódico e intermitente
de miembros inferiores, así como limitación articular en flexión de cadera, codos y rodillas. No es
raro que haya dislocación de la rótula, subluxación
de la cabeza del radio y deslizamiento epifisario en
el extremo proximal del fémur.
Coxa vara grave y genu valgum o varum. Las
manos son pequeñas con dedos cortos y delgados.
152
Sección III • Talla baja por diversos trastornos
Alteraciones osteoarticulares, tanto clínicas
como radiológicas bilaterales pero no siempre simétricas. Con frecuencia, cadera, rodillas, tobillos
y hombros se encuentran más alterados que codos,
muñecas y manos.
El estudio radiológico muestra epífisis irregulares, fragmentadas, pequeñas y de aparición lenta
(sobre todo en fémur, húmero y carpo), así como
metáfisis ligeramente anchas. Las vértebras son irregulares y tienen escotaduras anteriores.
Entre otros datos radiológicos se encuentran
borde lateral inferior de la tibia más delgado que el
medial y peroné largo con prolongación del maléolo
externo que condiciona una superficie articular
oblicua; en rodillas, es posible observar doble rótula, y cóndilos femoral y tibial cuadrados y angulados. Asimismo, pueden existir centros secundarios
de osificación.
La estatura final media es de 150 centímetros.
El trastorno se transmite con carácter autosómico,
tanto dominante como recesivo.
El diagnóstico diferencial debe incluir condrodisplasia punctata (aunque en la displasia epifisaria múltiple no se desarrollan cataratas, escoliosis
o alteraciones de la piel), hipotiroidismo y enfermedad de Perthes.
Displasia espondilometafisaria
Acortamiento importante del tronco con extremidades normales, xifosis dorsal y lordosis lumbar,
limitación y dolor articular. Los pies suelen ser
pequeños.
Las radiografías muestran: metáfisis irregulares y escleras de manera universal, edad ósea retrasada, platispondilia con esclerosis de los bordes
superior e inferior de las vértebras, iliacos cortos y
con disminución de la escotadura ciática, así como
unión peculiar de pelvis y fémur.
Se transmite con carácter autosómico dominante. La estatura final varía entre 130 y 150 centímetros.
El diagnóstico diferencial debe considerar displasias metafisarias, hipotiroidismo y enfermedad
de Morquio.
Seudoacondroplasia
Con frecuencia el diagnóstico se establece entre los
dos y cinco años de edad por la presencia de estatura baja con extremidades pequeñas que muestran
acortamiento rizomélico y xifoscoliosis dorsal.
El estudio radiológico muestra: huesos tubulares cortos e incurvados, metáfisis anchas, epífisis
pequeñas e irregulares, platispondilia con vértebras
biconvexas y distancia interpeduncular lumbar normal. Los huesos del carpo y del metacarpo son
cortos en exceso.
La estatura final media es de 120 centímetros.
El trastorno se hereda de manera autosómica dominante.
El diagnóstico diferencial debe incluir acondroplasia.
Displasia espondiloepifisaria tardía
Acortamiento y ensanchamiento de tronco, acompañados de cuello corto y esternón protruido.
Las radiografías muestran platispondilia y epífisis con alteraciones leves, sobre todo en fémur.
La estatura final media es de 140 centímetros.
El trastorno se hereda de manera tanto autosómica
recesiva como ligada al cromosoma X.
Condrodisplasia metafisaria tipo Schmid
Acortamiento rizomélico de las extremidades, lordosis lumbar exagerada y rodillas anchas.
Los estudios radiológicos muestran: metáfisis
irregulares y deshilachadas, estrías óseas que se
extienden hacia el cartílago epifisario, epífisis cuadradas y alteraciones en la osificación endocondral
que mejoran con el reposo.
Se transmite con carácter autosómico dominante y la estatura final varía entre 130 y 150 centímetros.
El diagnóstico diferencial incluye raquitismos,
sobre todo el resistente a la vitamina D.
Condrodisplasia metafisaria tipo Jansen
Estatura baja en extremo por acortamiento de las
extremidades. Se desarrollan deformidades articulares con limitaciones en flexión de cadera y rodilla, así como ensanchamiento importante en los
extremos de los huesos largos.
En las radiografías se aprecia metáfisis con
afección grave y simétrica caracterizada por ensanchamiento grave, imagen acopada y alteraciones en
la calcificación que aparentan densidad mixta entre cartílago y hueso. Existen bandas escleras hasta
las epífisis, las cuales son normales.
La estatura final media es de 125 centímetros.
El trastorno se transmite con carácter autosómico
dominante.
El diagnóstico diferencial debe incluir endocondromatosis (enfermedad de Ollier).
Capítulo 12 • Displasias óseas
Condrodisplasia metafisaria tipo Shwachman
Neutropenia, insuficiencia pancreática y coxa vara
progresiva.
En las radiografías se observan alteraciones
metafisarias proximales con esclerosis, que afectan
con más frecuencia el cuello femoral.
Se hereda con carácter autosómico recesivo. La
estatura final varía entre 130 y 150 centímetros.
El diagnóstico diferencial debe incluir fibrosis
quística del páncreas.
Condrodisplasia metafisaria tipo McKusik
Extremidades muy pequeñas con mayor afección
de las inferiores. El tronco también puede ser corto.
Cabello fino, escaso, de color claro y frágil,
incluso en cejas y pestañas. Además las manos y
los pies son pequeños y los dedos presentan hiperextensión. Con frecuencia hay limitaciones para la
flexión en codos, y los maléolos laterales son prominentes (fig. 12-7).
153
El estudio radiológico muestra: incurvamiento
acentuado de huesos largos; metáfisis anchas, acopadas e irregulares sobre todo en rodillas y tobillos
y en algunos sitios con quistes radiolúcidos; epífisis aplanadas; vértebras pequeñas en sentido sagital y posible acortamiento de la distancia interpeduncular a la altura lumbar. Asimismo, las costillas
son cortas, mientras que el peroné es muy largo en
su extremo distal. Las falanges medias son cortas y
de forma triangular.
Los pacientes pueden tener megacolon congénito, síndrome de malabsorción intestinal y fístula
traqueoesofágica.
La estatura final varía entre 110 y 145 centímetros. El trastorno se hereda con carácter autosómico recesivo.
Discondrostenosis
Estatura baja con acortamiento mesomélico de las
extremidades, acompañada de limitaciones articulares en codo y muñeca, así como de hipoplasia
mandibular.
Las radiografías muestran: acortamiento de
huesos largos más acentuado en antebrazo y piernas; pueden existir luxaciones en codos y muñecas.
El trastorno se transmite de manera autosómica dominante. La estatura final varía entre 135 y
165 centímetros.
Displasia tricorrinofalángica
Alteraciones del cabello, el cual es fino y escaso;
sin embargo, las cejas suelen estar engrosadas en
su porción media. La nariz es grande y bulosa.
En las radiografías se observan falanges cónicas con fusión prematura de pulgar, índice y meñique.
Se transmite con carácter autosómico dominante. La estatura final varía entre 140 y 160 centímetros.
Picnodisostosis
Fig. 12-7. Condrodisplasia metafisaria tipo McKusik.
Clínicamente existe macrocefalia, dolicocefalia con
persistencia de la fontanela anterior, hipoplasia de
la mandíbula, anemia y fracturas patológicas.
Las radiografías muestran: opacidad ósea moderada, aplasia distal de las falanges e hipoplasia
de clavículas.
Se hereda con carácter autosómico recesivo. La
estatura final varía entre 135 y 155 centímetros.
Por otro lado, la sospecha de alteración primaria del esqueleto debe conducir a:
154
Sección III • Talla baja por diversos trastornos
1. Realizar una somatometría completa.
2. Solicitar un estudio radiológico completo que
incluya: cráneo (anteroposterior, lateral y Towne), columna (anteroposterior y lateral), pelvis
(anteroposterior) y huesos largos, manos y pies
(anteroposterior).
3. Evaluar la presencia de restricción torácica que
origine insuficiencia respiratoria, así como de
inestabilidad atlantoaxil.
4. Integrar un diagnóstico presuncional e infor
mar a los padres de la posibilidad diagnóstica.
5. Enviar al paciente a una institución de tercer
nivel cuando no se cuenta con equipo multidisciplinario adecuado y con experiencia en el
campo.
6. Luego del diagnóstico definitivo, evaluar las
posibilidades terapéuticas para corregir las al
teraciones ortopédicas y mejorar el pronóstico
de estatura final.
7. Proporcionar consejo genético a la familia.
LECTURAS RECOMENDADAS
Beighthon P, Cremi B, Faure C et al. International nomenclature of constitutional diseases of bones. Ann Radiol
1983;26:457.
Beighton P, Cremi BJ. Sclerosing bone dysplasias. New
York: Springer-Verlag, 1980.
Carnevale A, Espinosa LG, Mayen G, Takenaga MR, Lizalde
YA, Grether GP, Armendares S. Displasias óseas. México: Academia Mexicana de Pediatría, 1990.
Clark RN. Congenital dysplasias and dwarfism. Pediatr Rev
1990;12:149.
Del Castillo RV. Padecimientos genéticos que semejan talla
baja familiar. En: Calzada RL (ed). Variantes normales
del crecimiento. México: INP, 1996:149.
Díaz EG, Carnevale A, Mayen DG. Acondroplasia e hipocondroplasia: datos clínicos y radiológicos. Acta Pediatr
Mex 1989;10:66.
Gruhn JG, Gorlin RJ, Langer LO. Dyssegmental dwarfism.
Am J Dis Child 1978; 132:382.
Guízar JJV, Ramírez V. Alteraciones en el crecimiento y
desarrollo esquelético. Displasias óseas. En: Guízar JJV
(ed). Genética Clínica. 2a ed. México: El Manual Moderno, 1994:553.
Horton W. Genetic heterogeneity in multiple epiphyseal
dysplasia. Growth, Genetics and Hormones 1995; 11:7.
Horton WA, Hall JG, Scott CI. Growth curves for height
for diastrophic dysplasia, spondyloepiphyseal dysplasia congenita, and pseudoachondroplasia. Am J Dis
Child 1982;136:316.
Horton WA, Rotter JI, Rimoin DL. Standard growth curves
for achondroplasia. J Pediatr 1978;93:435.
Jones KL. Smith's recognizable patterns of human malformation. Philadelphia: WB Saunders, 1988.
Kaufmann HJ (ed). Intrinsic diseases of bones. New York:
Karger-Basel, 1973.
Mayen DG, Carnevale A, Takenaga R, Lizalde A, Del Castillo V. Estudio clínico y radiológico de las enfermedades de la epífisis femoral. Rev Inv Clin 1991;43:364.
Mullís PE, Patel MS, Brickett PM et al. Growth characteristics and response to growth hormone therapy in patients with hypocondroplasia. Clin Endocrinol 1991;34:
265.
Pauli RM. Osteochondrodysplasia with mild clinical manifestations: a guide for endocrinologists and other.
Growth, Genetics and Hormones 1995;11:1.
Rimoin DL. International nomenclature of constitutional
diseases of bone. J Pediatr 1978;93:614.
Robinow M, Chumlea WC. Standard for limb bone lenght
ratios in children. Radiology 1982;143:433.
Shapiro F. Epiphyseal disorders. N Engl J Med 1987;317:
1702.
Springer JW, Langer L, Wiedemann HR. Bone dysplasias:
an atlas of constitutional disorders of skeletal development. Philadelphia: WB Saunders, 1974.
Stanescu V, Stanescu R, Moroteaux P. Pathogenic mechanisms in osteochondrodysplasias. J Bone Joint Surg
1984;66:817.
Taybi H, Lachman RS. Radiology of syndromes, metabolic
disorders and skeletal dysplasias. 4th ed. Baltimore:
Mosby, 1996.
Capítulo
13
Talla baja familiar
Todo ser humano tiende a expresar las características fenotípicas de sus ascendientes. La estatura no
escapa a esta tendencia y, por tanto, debe asumirse
que el crecimiento y desarrollo en condiciones
óptimas implica una talla ideal que de no manifestarse señala la existencia de factores limitantes del
estado de salud durante un lapso relativamente prolongado.
Parece fácil establecer el diagnóstico de talla
baja en familias que expresan como condición común una estatura inferior a dos desviaciones estándar por debajo de la media poblacional, con límites
de 150 a 160 cm para los varones y 140 a 150 cm
para las mujeres, y siempre y cuando reúnan una
serie de constantes biológicas de crecimiento que
se mencionan a continuación (fig. 13-1). Las características de crecimiento de estos individuos no
deben diferir de las consideradas adecuadas para
una población, y por lógica excluyen la existencia
de alteraciones:
1. Estatura baja por lo menos en 50% de los adultos de dos generaciones previas, sin evidencias
de enfermedad orgánica o social.
2. Velocidad de crecimiento superior a la percentila 25 o por lo menos superior a la percentila
10 de los modelos de referencia; por ello, la
progresión de la estatura acumulada es paralela a la que se registra en los patrones o modelos poblacionales de referencia.
3. Edad biológica acorde con la edad cronológica, considerando por lo menos la maduración
esquelética y sexual como representativa de la
maduración somática en general.
4. Armonía en las proporciones corporales tanto
longitudinales como transversales, y composición corporal similar a la referida en los modelos poblacionales.
5. El cálculo de la estatura final del niño debe en
contrarse dentro de un intervalo considerado
como posibilidad de variante fisiológica con
respecto a la estatura de sus ascendientes y, por
tanto, la estatura expresada desde los dos años
de edad debe ser adecuada para el patrón de
crecimiento familiar (fig. 13-2).
6. No debe existir evidencia flagrante de altera
ción orgánica o social.
Así entonces parece relativamente sencillo establecer el desarrollo de talla baja familiar; sin
embargo, es conveniente explicar y detallar los
puntos señalados como esenciales para el diagnóstico.
ANTECEDENTES HEREDOFAMILIARES
En relación con la estatura baja en los ascendientes
genéticos de un niño es conveniente tomar en cuenta
dos posibilidades: tienen menor capacidad de crecimiento en ausencia de enfermedad o bien padecen anomalía orgánica o psicosocial que limita el
crecimiento de dos o más generaciones de la misma familia y que pasa desapercibida por su carácter prevalente y endémico en el grupo sociocultural
en cuestión.
La primera posibilidad supone que los individuos son "sanos", por lo que la estatura baja podría
ser secundaria a secreción diaria de hormona de
crecimiento menor a la habitualmente presente en
la mayoría de la población y sin vínculos con alteraciones orgánicas o funcionales hipotalamohipofisarias. De hecho hay evidencias de que los individuos ubicados cerca de la percentila 3 poblacional
de estatura acumulada también muestran secreción
diaria de hormona de crecimiento menor a la observada en individuos que se encuentran en la per155
156
Sección III • Talla baja por diversos trastornos
Fig. 13-1. Crecimiento característico de la talla baja familiar.
centila 50, y que aun éstos secretan menor cantidad
de hormona de crecimiento que quienes se sitúan
en la percentila 97; esto ha llevado a considerar que
la herencia de estatura se determina por la capacidad de secreción diaria de hormona de crecimiento. Sin embargo, no es sencillo afirmar la exactitud
de esta condición fisiológica debido a los siguientes datos:
1. Aunque ciertos estudios demuestran una tendencia familiar caracterizada por un patrón de
secreción de hormona de crecimiento inferior
al habitual para la población, el problema consiste en definir los límites de la normalidad.
Los estudios de secreción espontánea, en varias ocasiones y a un mismo sujeto, encuentran variaciones importantes entre dos o más
días; asimismo, se carece de estudio prospectivo y longitudinal que demuestre que todos los
integrantes de una o varias familias con estatura baja "fisiológica" mantienen secreción hormonal espontánea constante (patrón integrado
de 24 horas, patrón integrado durante el sueño, hormona de crecimiento urinaria), aunque
es cierto que en edades prepubescentes es más
usual encontrar correlación entre la secreción
espontánea de hormona de crecimiento y la
velocidad de crecimiento durante esa etapa.
Esto es cuestionable porque múltiples estudios
refieren falta de correlación entre la secreción
espontánea de un día al azar y la velocidad de
crecimiento, tanto en individuos con estatura
normal como en niños con talla baja familiar. 2.
Una situación similar a la anterior se presenta al
analizar la respuesta a pruebas de estimulación
farmacológica con hormona liberadora de
hormona de crecimiento, hipoglucemia inducida
por insulina, arginina, L-dopa, clonidina y otras,
en dos o más días elegidos al azar. Las
variaciones de respuesta al mismo fármaco por
parte de un mismo sujeto son de hasta 40 a 50% en
términos de elevación o no y de concentraciones
máximas de hormona de crecimiento.
Asimismo, las variaciones de fármaco a fármaco pueden ser incluso de 70%, lo cual puede
conducir hacia el diagnóstico de "deficiente" o
"insuficiente" para la secreción de hormona de
crecimiento en más de 30% de los
Capítulo 13 • Talla baja familiar
157
Fig. 13-2. Crecimiento estatural con respecto a la talla baja familiar, acorde con la estatura familiar epigenotípica.
pacientes, a pesar de que éstos carezcan de
alteraciones del crecimiento.
3. La diferencia de estatura entre los individuos
con talla baja familiar y aquéllos con estatura
normal para la población podría deberse no a
la capacidad de secreción hipofisaria de hormona de crecimiento, sino a la respuesta celular a concentraciones similares de hormona de
crecimiento. Actualmente, en niños con estatura
baja fisiológica se sabe poco sobre la capacidad de respuesta celular a la propia hormona
(libre o unida a su proteína transportadora), y a
las somatomedinas o factores de crecimiento
tipo insulina (libres o unidos a sus proteínas
transportadoras). Sin embargo, hasta en 40%
de los niños estudiados con crecimiento normal es evidente la falta de correlación entre los
picos de secreción de hormona y las concentraciones de su proteína transportadora, o entre
la hormona y la concentración de factor de
crecimiento tipo insulina-1 o de proteína transportadora-3 de factor de crecimiento tipo insulina-1; por ello, desde el punto de vista teórico
puede asumirse que existen diferencias (¿ge-
néticas?) en la eficacia con que la hormona
promueve el crecimiento.
En algunos pacientes con talla baja familiar
que poseen enfermedad orgánica o social, o de
ambos tipos, se ha evidenciado aumento en la secreción de somatostatina (tono), mientras que en
otros se ha encontrado disminución del tono adrenérgico o serotoninérgico. Cualquiera de estas variaciones aisladas o en conjunto explicarían la disminución en la secreción integrada de hormona de
crecimiento; pero otros estudios han mostrado que
con el mejoramiento del afecto recíproco entre el
paciente y sus padres se modifican esos neurotransmisores y se "normaliza" la secreción de hormona
de crecimiento; esto último pone en entredicho la
ausencia de trastorno en estas familias y deja entrever que la deprivación emocional e incluso el
maltrato físico pueden transmitirse como características socioculturales de generación en generación, sin que se detecte anormalidad en ellas. Se
han encontrado situaciones similares en el balance
de neurotransmisores hipotalámicos al mejorar el
equilibrio energético-proteínico y al detectar atopía
158
Sección III • Talla baja por diversos trastornos
respiratoria o digestiva e intolerancias alimentarias
parciales.
Lo anterior evidencia la necesidad de realizar
una encuesta encaminada a discernir la calidad de
la nutrición en poblaciones donde es posible que el
equilibrio nutricio sea subóptimo, bajo el riesgo de
pasar por alto las alteraciones biológicas porque en
esas condiciones es frecuente que el nivel cultural
de la familia sea insuficiente y ello dificulta que
sus integrantes reconozcan la situación prevalente
que ha afectado a varias generaciones y se ha convertido en un modus vivendi aceptado como normal. Esto también es válido durante el análisis de
las condiciones higiénicas de preparación y preservación de los alimentos que coadyuvan al desarrollo de parasitosis endémicas o epidémicas (p. ej., la
giardiasis) que a su vez pueden limitar el crecimiento sin dar lugar a signos o síntomas agregados.
Los aumentos de estatura en familias que cambian su habitat y mejoran sus condiciones de alimentación, educación y escolaridad hacen dudar de
la condición "fisiológica" de la talla baja familiar.
Por otro lado, es necesario considerar que los
varones con estatura baja por lo general se casan
con mujeres más bajas que ellos, sin importar la
existencia de estados patológicos condicionantes de
un crecimiento subóptimo; asimismo, cuando no se
investiga al respecto es fácil determinar de manera
errónea que existe una tendencia familiar "fisiológica" para expresar una estatura menor a la habitual para la población.
Desde el punto de vista estadístico, si los padres y hermanos de un niño tienen talla baja la
posibilidad de que éste también tenga estatura pequeña es de 50%; esa posibilidad es de 25% si sólo
los abuelos y los tíos muestran esa alteración, y se
reduce a 12.5% si únicamente los primos lo hacen.
Sin embargo, cuando todos los familiares tienen
estatura baja, la probabilidad de que el paciente
exprese un crecimiento limitado es de 92.5%, pero
no de 100%, lo cual señala la posible influencia de
múltiples factores en la talla baja familiar. De ese
modo, hasta no demostrar lo contrario debe considerarse que la talla baja familiar es secundaria a un
estado patológico biológico, psicológico y social.
VELOCIDAD DE CRECIMIENTO
La progresión del crecimiento momento a momento
se vincula directamente con el estado de salud, de
modo que una velocidad de crecimiento normal sólo
puede lograrse ante ausencia real de enfermedad.
Cuando los niños pertenecientes a una familia con
estatura baja desarrollan velocidad de crecimiento
consistentemente normal existe razón para
asegurar que mantienen un buen estado de salud
(fig. 13-3). Sin embargo, es necesario estar conscientes de las dificultades que implica considerar
"normal" la velocidad de crecimiento de un individuo, para lo cual es indispensable tomar en cuenta
por lo menos dos características:
1. Diversos estudios señalan que en "términos generales" cualquier niño situado en la percentila 3 de estatura acumulada, o por debajo de
ésta pero de manera paralela, desarrolla una
velocidad de crecimiento superior a la señalada en la percentila 25 para este parámetro; por
ello se ha propuesto este límite como diagnóstico de normalidad del crecimiento anual. Sin
embargo, la aceptación de esta premisa conduce a concluir que la cuarta parte de los individuos considerados normales en una población
expresan en realidad un crecimiento subóptimo, lo cual pone en entredicho la veracidad de
la información contenida en las gráficas de velocidad de crecimiento. Por otro lado, también
debe "uestionarse si 25% de una población que
muestra una característica común es anormal
o posee una variante fisiológica normal.
2. La velocidad de crecimiento de un organismo
depende de la ganancia de masa entre dos momentos; en consecuencia, para que ocurra un
aumento proporcional y equivalente entre dos
sujetos de la misma edad pero con distinta estatura se requiere que el de menor volumen
inicial desarrolle una velocidad de crecimiento más baja para lograr un incremento fisiológico. Si esto es cierto, entonces un niño con
estatura baja puede mantener velocidades de
crecimiento menores que las observadas en
otros más altos, y ser completamente normal.
Así, la velocidad de crecimiento que se sitúa
por arriba de lo esperado para lograr un incremento fisiológico de la masa podría significar
un crecimiento de recuperación, lo cual no
ocurre en niños sanos con talla baja familiar
que no tienen que recuperarse de algún estado
patológico.
En la actualidad también se ha puesto en duda
que una enfermedad orgánica modifique la velocidad de crecimiento a tal grado que sea ostensible
su reducción, ya que en algunos estudios de población escolar aparentemente sana el análisis de esa
velocidad ha sido insuficiente para identificar a los
niños con trastornos de reciente adquisición como
enfermedad celiaca, hipotiroidismo e intoxicación
por plomo, o bien enfermedades congénitas del tipo
de síndrome de Noonan y neurofibromatosis; en
Capítulo 13 • Talla baja familiar
159
Fig. 13-3. Velocidad de crecimiento cuando hay la talla baja familiar.
cambio, el análisis de la estatura baja sí muestra
sensibilidad en ese sentido. Así, por ejemplo, algunos pacientes con enfermedad celiaca y padres de
estatura baja habían sido considerados portadores
de talla baja familiar, y sólo el estudio de anemia
leve evidenció el trastorno intestinal que además
compartían con el padre o la madre.
La tendencia familiar de crecimiento se establece entre los 6 y 24 meses de vida extrauterina;
por ello es posible encontrar velocidades de crecimiento bajas en niños menores de dos años de edad
que observaron crecimiento intrauterino mayor del
esperado para el genotipo familiar y que a partir de
esa edad inician un ajuste "fisiológico" hacia el
canal de crecimiento familiar.
Parece pues evidente que una velocidad de
crecimiento normal no descarta de manera categórica la existencia de enfermedad, y un niño con talla
baja puede crecer por debajo de la percentila 25 sin
que esto represente anomalía individual. Esto obliga a analizar cada caso de manera particular.
EDAD BIOLÓGICA ACORDE
CON LA EDAD CRONOLÓGICA
La edad biológica acorde con la edad cronológica
es una característica muy constante en los niños con
talla baja familiar, pero es necesario considerar algunos aspectos relativos a la evolución de la maduración somática:
1. No todos los individuos muestran concordancia entre los diversos factores que contribuyen
al análisis de la edad biológica. La edad ósea y
el volumen gonadal tienden a mantener una relación estrecha y directamente proporcional en
tre sí (correlación de 0.85 a 0.9), de tal manera
que las modificaciones en sólo uno de los dos
parámetros puede indicar el desarrollo de en
fermedad orgánica, sobre todo en edades prepubescentes; sin embargo esa correlación disminuye incluso hasta 0.6 luego del inicio del
desarrollo sexual.
2. La edad dental muestra una correlación prepubescente de 0.6 a 0.7 con la edad ósea y el
volumen gonadal, y por ello es menos utilizada. Esto se explica porque la secuencia cronológica de aparición y pérdida de piezas temporales, y la aparición de las permanentes puede
variar hasta en 6 a 12 meses en individuos con
la misma edad ósea y el mismo volumen gonadal.
3. Como se menciona en capítulos anteriores, la
progresión de la edad ósea es constante para
160
Sección III • Talla baja por diversos trastornos
cada núcleo de crecimiento analizado, pero
variable para el conjunto total de núcleos de
un individuo en relación con otros. Así entonces, para definir la normalidad o anormalidad
en la maduración esquelética, es necesario
analizar cada caso en particular y de manera
ideal utilizar el método de Tanner-Whitehouse
en su segunda versión.
4. El aumento de volumen testicular es constante
para cada individuo, pero difiere con respecto
a lo observado en otros. El uso de métodos subjetivos en el análisis del crecimiento gonadal,
como pudiera ser el orquidómetro de Prader,
dificulta aún más la comparación. Por otro lado,
las variaciones en la velocidad de crecimiento
testicular son más acentuadas al iniciar la pubertad y, por tanto, menos sensibles para el
estudio de la maduración biológica.
ARMONÍA Y COMPOSICIÓN
CORPORALES
En todos los estudios realizados en individuos con
talla baja familiar es evidente que las proporciones
corporales son adecuadas para la edad cronológica; sin embargo es importante señalar algunas limitaciones al respecto:
1. La descripción de las relaciones de segmentos
y subsegmentos corporales se han realizado en
individuos con estatura normal, por lo que las
variaciones en la estatura pueden producir modificaciones en la armonía sin que ello represente una alteración.
2. En un niño con retraso de crecimiento intrauterino, el segmento superior (tórax) se afecta
más que el segmento inferior; en ausencia de
crecimiento de recuperación también se retrasa la proporcionalidad corporal con respecto a
la edad cronológica, que puede normalizarse
hasta cuando se alcanza la estatura definitiva.
La talla baja familiar, en su caso, debe tomarse
en cuenta durante la evaluación de la armonía
corporal.
3. En un paciente con alteraciones nutricias u orgánicas, el crecimiento del segmento inferior
está más limitado que el del tórax. Aunque éste
puede ser un dato útil para establecer la diferencia entre talla baja familiar fisiológica y
patológica, el retraso de crecimiento intrauterino puede originar neutralización en la disarmonía prevista y ocultar el desarrollo de enfermedades posnatales.
4. Existen muy pocos trabajos prospectivos y longitudinales que muestren cambios en la com-
posición corporal de niños con talla baja familiar. Sin embargo, la comparación de la composición corporal con los hallazgos habituales
para una población "sana" obliga a recordar
que, en contraste con lo que se observa en otros
países, la población latinoamericana tiende a
poseer mayor masa magra (muscular) en relación con el tejido adiposo; por ello esas comparaciones deben realizarse con cautela, en
especial durante el análisis del estado nutricio
y proteínico por el porcentaje de tejido magro
en extremidades.
AUSENCIA DE ENFERMEDAD
El examen clínico del paciente con frecuencia es
insuficiente para demostrar un buen estado de salud. En condiciones de estatura normal, el análisis
de la progresión del crecimiento puede representar
un signo muy útil de la presencia o ausencia de
enfermedades; pero en niños con estatura baja se
pierde esta oportunidad.
Es importante recordar que algunos exámenes
básicos de laboratorio ayudan a complementar la
impresión clínica. Entre ellos se sugieren: biometría hemática, análisis parasitológico de heces, examen general de orina, electrólitos séricos incluyendo bicarbonato y en las mujeres, en particular,
urocultivo.
Las evidencias de alteración nutricia sin que
la ingestión de alimentos sea insuficiente (anemia
leve, microcitosis, albúmina o transferrina en límites bajos, etc.) deben conducir a investigar en primer lugar el desarrollo de enfermedades inflamatorias intestinales e intolerancias alimentarias, y en
segundo lugar infecciones poco sintomáticas (senos paranasales, vías urinarias, infestaciones intestinales y, en mujeres, aparato genital). No debe de
pasarse por alto la palpación de la glándula tiroides y el interrogatorio intencionado y dirigido en
busca de hipofunción tiroidea. La detección de
alguna situación anómala debe investigarse hasta
descartar complicaciones secundarias. Por ejemplo,
luego de encontrar infección de vías urinarias es
importante evaluar la conveniencia de buscar reflujo
vesicoureteral, malformaciones renales e incluso
alteraciones en la función glomerular y en la
función tubular, antes de considerar terminado el
abordaje y definir por ende el tratamiento necesario.
Con base en lo anterior, después de sospechar
la existencia de talla baja familiar y antes de definir
el crecimiento como una característica "fisiológica" que no requiere tratamiento para mantener un
buen estado de salud, es necesario demostrar la
Capítulo 13 • Talla baja familiar
161
Fig. 13-4. Efecto adverso del uso de andró-genos en pacientes con talla baja familiar: estatura final lograda en comparación con
la esperada.
ausencia de factores modificadores del crecimiento orgánicos y psicosociales y comprobar la normalidad en la progresión del crecimiento por medio de la observación prospectiva y cuidadosa, asi
como del análisis de la talla acumulada, la velocidad de crecimiento y la maduración somática (edad
biológica y proporcionalidad corporal).
En un paciente sin anomalía demostrable, la
modificación positiva de la estatura final esperada
es difícil, cuestionable e implica un costo económico elevado, y en algunos pacientes la aplicación
de medidas empíricas o con conocimientos insuficientes ocasiona una menor estatura final (fig.
13-4).
Algunos grupos de pacientes con talla baja
familiar que han sido tratados con hormona de crecimiento humana biosintética a dosis de 1 U/kg/
semana, han mostrado que la velocidad de crecimiento aumenta de 2 a 4 cm/año hasta en 50% de
los pacientes. Sin embargo, aún no existen datos
confiables para evaluar si la ganancia de estatura es
un acontecimiento "temporal" y si una vez suspendida la aplicación del medicamento ocurre "desaceleración fisiológica del crecimiento" sin modifica-
ción de la estatura final, o bien si en efecto se gane
estatura al terminar el periodo de crecimiento.
LECTURAS RECOMENDADAS
Albertsson KW, Rosberg S, Isaksson O, Westphal O. Secretory pattern of growth hormone in children of differing
growth rates. Acta Endocrinol 1983;103:272.
Allen DB, Brook CGD, Bridges NA, Hindmarsh, Guyda
HJ, Frasier D. Therapeutic controversies: growth hormone (GH) treatment of non-GH deficient subjects. Clin
Endocrinol Metab 1994;79:1239.
Audi L, Granada M, Carrqascosa A. Growth hormone secretion assessment in the diagnosis of short stature. J
Pediatr Endocrinol Metab 1996;9:313.
Butenandt O. Diagnostic value of growth hormone releasing hormone tests in short children. Acta Paediatr Scand
1989;349:3.
Carlsson LMS, Attie KM, Compton PG, Vitangeol RV,
Merimee TJ. Reduced concentration of serum growth
hormone-binding protein in children with idiopathic
short stature. J Clin Edocrinol Metab 1994;78:1325.
Castillo CD, Garcia H, Venegas P, Torrealba 1, Panteón E,
Concha N, Pérez P. Zinc supplementation increases
162
Sección III • Talla baja por diversos trastornos
growth velocity of male children and adolescents with
short stature. Acta Paediatr 1994;83:833.
Drug and Therapeutics Committee of the Larson Wilkins
Pediatric Endocrine Society. Guidelines for the use of
growth hormone in children with short stature. J Pediatr
1995;127:857.
García LM. Abordaje diagnóstico en el paciente con sospecha de talla baja familiar. En: Calzada RL (ed). Variantes normales del crecimiento. México: INP, 1996:173.
Ghigo E, Arvat E, Nicolosi M, Bellone J, Valetta M, Mazza
E, Imperiale E, Procopio M, Ghigo M, Camanni F. Acute
clonidine administration potentiates spontaneous diurnal, but not nocturnal, growth hormone secretion in
normal short children. J Clin Endocrinol Metab 1990;71:
433.
Goddard AD, Covello R, Shiuh-Ming L, Clackson T, Attie
KM, Gesundheit N, Rundle AC, Well JA, Carlosson
LMS. Mutations of the growth hormone receptor in
children with idiopathic short stature. N Engl J Med
1995;333:1093.
Greco L, Power C, Peckham C. Adult outcome of normal
children who are short or underweight at age 7 years.
British Med J 1995;310:696.
Grunt JA, Schwartz ID. Growth, short stature and use of
growth hormone: considerations for the practicing pediatrician. Curr Probl Pediatr 1992;Oct:390.
Hopwood HI, Hintz RL, Gertner JM. Growth response of
children with non-growth hormone deficiency and marked short stature during three years of growth hormone
therapy. J Pediatr 1993;123:215.
Lanes R, Lee PA, Plotnick LP, Kowarski A, Migeon CJ. Are
constitutional delay of growth and familial short stature
different conditions? Clin Pediatr 1980; 19:31.
Lee PDK, Rosenfeld RG. Psychosocial correlates of short
stature and delayed puberty. Pediatr Clin North Am
1987;34:851.
Mahoney CP. Evaluating the child with short stature. Pediatr
Clin North Am 1987;34:825.
Mauras N, Carlsson LMS, Murphy S, Merimee TJ. Growth
hormone-binding protein levels: studies of children with
short stature. Metabolism 1994;43:357.
McCaughey ES. Growth hormone treatment of idiopathic
short stature: a controlled study in a well defined population. Acta Paediatr 1994;406:25.
Phillip M, Chalew SA, Kowarski AA, Stene MA. Plasma
IGFBP-3 and its relationship with quantitative growth
hormone secretion in short children. Clin Endocrinol
1993;39:427.
Preece MA. The genetic contribution of stature. Horm Res
1996;45:56.
Ranke MB. Towards a consensus on definition of idiopathic
short stature: summary. Horm Res 1996;45:64.
Roberts DF. Genetics of growth. Br Med Bull 1981;37:239.
Sandrini R. Talla baja familiar. En: Calzada RL (ed). Variantes normales del crecimiento. México: INP, 1996:
133.
Tassoni P, Cacciari E, Cau M, Colli C, Tosi M, Zucchini S,
Cicognani A, Pirazzoli P, Salardi S, Balsamo A, Frejaville E, Cassio A, Zappulla F. Variability of growth
hormone response to pharmacological and sleep tests
performed twice in short children. J Clin Endocrinol
Metab 1990;71:230.
Zadik Z, Chalew SA, Raiti S, Kowarski AA. Do short children secrete insufficient growth hormone? Pediatrics
1985;76:355.
Capítulo
14
Retraso constitucional
del crecimiento
El proceso de maduración somática, encaminado a
obtener 100% del tamaño y la función, es un fenómeno poco entendido hasta el momento actual y
sus determinantes en términos de regulación son
prácticamente desconocidos.
Algunos estudios sugieren que la disminución
en el aporte y concentración hipotalámica de esteroides sexuales, durante los cuatro a seis primeros
meses de la gestación, origina menor capacidad de
respuesta de los receptores adrenérgicos alfa-2 con
la consecuente disminución en la secreción de hormona liberadora de hormona de crecimiento y aumento de somatostatinas. Esto puede producir una
secreción circadiana espontánea de hormona de
crecimiento menor de la esperada, aunque no por
fuerza distinta a la encontrada en la población
"sana"; en consecuencia, los afectados muestran
respuestas neurohormonales dentro de lo "habitual",
que sin embargo son inferiores a las correspondientes a la capacidad del organismo.
Lo anterior puede explicar la disminución en
la secreción espontánea de hormona de crecimiento en algunos pacientes, pero no representa un dato
concluyente sobre el control de la "velocidad de
maduración" y tampoco se ha demostrado que esta
velocidad mantenga una relación directamente proporcional con concentraciones de hormona de crecimiento, de hormona liberadora de hormona de
crecimiento o de somatostatina.
No obstante lo antes mencionado, se puede
constatar que los seres humanos alcanzan gradientes de maduración similares en edades cronológicas muy variadas, y la estatura acumulada para una
misma edad cronológica es diferente entre los individuos que no desarrollan el mismo patrón de ma-
duración puesto que el crecimiento ocurre en función de dicha maduración.
La estatura final de un individuo, en ausencia
de enfermedad, concuerda con la expresada por su
familia, pero el momento en que se termina el crecimiento y, por tanto, se alcanza la talla final puede
variar hasta en cuatro años cronológicos.
Existen múltiples posibilidades y manifestaciones de un patrón de maduración diferente a lo "habitual" que no implica la existencia de una alteración y se considera, por tanto, "variante normal del
crecimiento"; sin embargo, para fines prácticos de
estudio y vigilancia es necesario agrupar en estados sindromáticos a los individuos con ese patrón.
El retraso constitucional del crecimiento se
manifiesta en individuos cuyo ritmo de maduración
es consistentemente más lento que el "habitual" para
la población general, y se caracteriza por lo siguiente:
1. Antecedentes heredo familiares de patrón retrasado de maduración con estaturas finales normales para las características genéticas.
2. Estatura normal al nacer y durante los primeros 12 a 24 meses de la etapa extrauterina de la
vida.
3. Disminución de la velocidad de crecimiento durante 1 a 2 años que se manifiesta por lo general entre los 24 y los 48 meses de edad, lo cual
origina estatura menor a la esperada para las
características familiares e incluso inferior a las
percentilas habituales de distribución poblacional de la estatura.
4. Posterior a esta etapa, la velocidad de crecimiento se normaliza y la estatura progresa de
163
164
5.
6.
7.
8.
9.
Sección III • Talla baja por diversos trastornos
manera paralela a las percentilas poblacionales, aunque por lo general en límites bajos o
incluso por debajo de éstos.
Los parámetros utilizados para evaluar la maduración somática (edad esquelética, edad dental, edad genital y edad sexual) evidencian retardo de ésta en relación con lo esperado para
la edad cronológica, así como progreso normal.
Las proporciones corporales son armónicas y
adecuadas para la edad biológica, pero inadecuadas si se les compara con las esperadas para
la edad cronológica.
La pubertad se presenta en edades cronológicas más avanzadas en relación con lo observado en la población general, pero su progresión
y término son normales.
En promedio, la estatura final se alcanza dos e
incluso cuatro años después de lo observado en
el resto de la población, y se sitúa sin variación
dentro de los límites esperados para las características epigenéticas familiares (fig. 14-1).
Se carece de evidencia actual o pasada de enfermedad orgánica afectiva o social capaz de
limitar el crecimiento.
Aunque el diagnóstico adecuado de retraso
constitucional del crecimiento debe realizarse por
exclusión, es bastante fácil de establecer si se toman en cuenta los parámetros mencionados con sus
respectivas consideraciones.
ANTECEDENTES HEREDOFAMILIARES
DE RETRASO CONSTITUCIONAL
Es difícil que los padres informen acerca de las
estaturas que observaron a lo largo de su propio
crecimiento para comprobar la existencia de patrón
sugestivo de maduración lenta, pero durante el interrogatorio se ha encontrado estatura baja en la
etapa preescolar y hasta el inicio de la pubertad, la
cual hasta en 60 a 90% de los pacientes se tuvo de
manera tardía en relación con los compañeros de
escuela.
Es indispensable determinar si el padre y la
madre alcanzaron la estatura adecuada para sus
características familiares, por lo que la estatura
actual de ambos se compara con la de sus respectivos hermanos y padres, de acuerdo con la siguiente
fórmula:
Fig. 14-1. Curva de crecimiento característica del retraso constitucional del crecimiento.
Capitulo 14 • Retraso constitucional del crecimiento
Padre: talla media familiar + 6.5 cm
Madre: talla media familiar - 6.5 cm
La talla media familiar se obtiene por el promedio de estatura de los abuelos del paciente. Así,
por ejemplo, cuando en la rama paterna el abuelo
mide 173 cm y la abuela 160 cm, se espera una
estatura de 173 cm para el padre con variaciones
permitidas de 4 cm más o 4 cm menos (169 a 177
cm); si en la rama materna el abuelo mide 178 cm
y la abuela 163 cm, se espera una estatura de 164
cm, con 160 a 168 cm como límites máximos tolerados.
Los padres que desarrollan un patrón retrasado de crecimiento y poseen estatura final inferior a
la esperada para las características de los abuelos,
o bien menor a la alcanzada por los hermanos de su
mismo sexo, deben someterse a estudios para investigar anomalías orgánicas heredadas o factores
ambientales y afectivos limitantes del crecimiento
y que pudieran haberse transmitido de una generación a otra.
El retraso constitucional del crecimiento se
transmite por un patrón mendeliano de herencia, y
se comporta de manera autosómica dominante. En
la población general, existe 50% de probabilidad
de encontrar uno o más sujetos afectados en una
sola familia y 29% de hallarlo en ambas. La ausencia de antecedentes familiares de maduración lenta
obliga a descartar enfermedad en el niño, y a considerar la existencia de limitación secundaria del
crecimiento hasta que no se demuestre lo contrario.
ESTATURA NORMAL AL NACER
Los pacientes con retraso constitucional siempre
poseen estatura normal al nacer.
La estatura menor a la esperada para la edad
gestacional sugiere el desarrollo de retraso de crecimiento intrauterino disarmónico. En este caso, la
ausencia de crecimiento de recuperación durante
los primeros cuatro meses de edad conduce a un
patrón retrasado de crecimiento muy similar al
observado en el retraso constitucional (velocidad
de crecimiento normal, edad biológica retrasada y
estatura baja), pero el pronóstico de estatura final
es inferior al esperado para las características epigenéticas de la familia.
El retraso intrauterino de crecimiento diagnosticado al momento del nacimiento que no muestra
patrón de recuperación a pesar de la aplicación de
medidas terapéuticas adecuadas debe estudiarse en
relación con alteraciones genéticas, ya que cuando
las entidades patológicas maternas o placentarias
165
dejan de actuar sobre un organismo sano también
permiten la recuperación ad integrum de la homeostasis del crecimiento. En estos pacientes, en especial desde los tres años de edad, es posible observar
un patrón retrasado de crecimiento que es indispensable diferenciar del retraso constitucional del crecimiento de acuerdo con el antecedente de estatura
baja en el momento del nacimiento.
DISMINUCIÓN DE LA VELOCIDAD
DE CRECIMIENTO
El análisis retrospectivo y la reconstrucción del
patrón de crecimiento del paciente con sospecha
de retraso constitucional permiten observar con
facilidad un progreso de estatura paralela a las percentilas poblacionales y velocidad de crecimiento
actual normal luego de un periodo de disminución
de esa velocidad con el consecuente retraso de estatura que situó al paciente por debajo de lo esperado genéticamente (fig. 14-2).
No obstante lo anterior, esa evaluación se dificulta cuando el ajuste de maduración se produce
durante el análisis del paciente, es decir, el crecimiento del paciente atraviesa las siguientes etapas
consecutivas:
1. La velocidad de crecimiento disminuye, sin
acompañarse de retraso en la edad biológica
(ósea, dental, genital y sexual).
2. La velocidad de crecimiento continúa baja y la
maduración biológica empieza a retrasarse.
3. La velocidad de crecimiento tiende a normalizarse, pero la maduración biológica continúa
en progresión con más lentitud de lo esperado.
4. La velocidad de crecimiento se mantiene normal y la maduración biológica progresa a un
ritmo normal, de manera que se mantiene un
retraso constante en relación con la edad cro
nológica.
Las tres primeras etapas no se consideran características del patrón retrasado de crecimiento y
sí en cambio de un patrón atenuado (indicador invariable de enfermedad con afección moderada a
grave); por tanto, aunque existan antecedentes
heredofamiliares de retraso constitucional del crecimiento, es obligado investigar la posibilidad de
anomalía limitante del crecimiento, ya que el paciente pudo haber heredado una variante normal
pero también es posible que padezca enfermedades
intercurrentes capaces de detener el crecimiento y
la maduración.
Aunque el patrón retrasado de crecimiento
puede empezar a manifestarse a partir de los 12
166
Sección III • Talla baja por diversos trastornos
Fig. 14-2. Patrón característico de la velocidad de crecimiento en el retraso constitucional del crecimiento.
meses, lo habitual es que se observe la siguiente
secuencia en el crecimiento posnatal:
1. Durante los primeros cuatro a seis meses de la
vida es posible observar un crecimiento acelerado que sitúa la longitud del paciente en percentilas progresivamente más altas: por ejemplo, al nacer mide 48 cm, que corresponden a
la percentila tres, y a los seis meses de edad
tiene una longitud de 69 cm que corresponde a
la percentila 90. Hasta que no se demuestre lo
contrario, debe considerarse que hubo retraso
de crecimiento intrauterino y recuperación
posterior adecuada; la falta de esta última indica posible crecimiento prenatal adecuado que
no requirió de recuperación, o bien retraso de
crecimiento intrauterino de intensidad leve que
no fue detectado y tratado.
En los primeros seis meses de la vida posnatal, e incluso hasta el término del primer año,
la regulación del crecimiento mantiene características fetales; es decir, el factor determinante
más importante para una progresión adecuada
es el estado nutricio y la ausencia de alteraciones genéticas.
2. A partir de los 12 meses de edad (aunque pue
de observarse desde los seis meses) ocurre un
"ajuste genético" del crecimiento cuya finalidad es situar la longitud del paciente en la correspondiente para sus características familiares. Así, los niños que al año de edad muestran
estatura menor de la esperada aceleran de modo
transitorio su velocidad de crecimiento hasta
alcanzar la "percentila media familiar", mientras que aquéllos con longitud mayor muestran
reducción temporal de la velocidad de crecimiento hasta alcanzar la percentila genéticamente adecuada. La duración de este periodo
es variable y la aceleración se inicia por un lado
alrededor de los 12 meses, mientras que la desaceleración ocurre por otro lado a partir de los
18 meses; pero en términos generales y para
ambos casos, el ajuste termina entre los 24 y
28 meses de edad.
3. Desde los dos años de edad, y por lo general
hasta los cuatro años, ocurre el denominado
"ajuste de maduración" en el que se evidencia
el inicio de retraso constitucional de acuerdo
con las características hereditarias (siguiendo
las cuatro etapas antes mencionadas).
Cualquier paciente tiene posibilidades de mostrar recuperación de retraso intrauterino, seguida por
un ajuste genético y después por un ajuste de ma-
Capítulo 14 · Retraso constitucional del crecimiento
duración; por ello en algunas ocasiones es diñcil
establecer la "normalidad" del crecimiento, ya sea
mediante seguimiento prospectivo o por análisis
retrospectivo, y se requiere descartar enfermedades
orgánicas, sociales y afectivas. En conclusión, el
diagnóstico de retraso constitucional del crecimiento se emite sólo tras haber "excluido" la existencia
de factores modificadores del crecimiento.
CRECIMIENTO DESDE LOS CUATRO
AÑOS HASTA EL INICIO
DE LA PUBERTAD
El crecimiento se realiza normalmente luego del
ajuste de maduración, es decir:
1. La velocidad de crecimiento se mantiene por
arriba de la percentila 10 de la población.
2. La estatura progresa de modo normal y sus incrementos muestran un patrón paralelo a las
percentilas poblacionales, aunque puede situarse incluso por debajo de la percentila 3 o más
de dos desviaciones estándar por abajo del promedio.
3. Los parámetros para analizar la maduración
biológica (edades ósea, dental, sexual y genital) progresan a una velocidad normal, por lo
que mantienen un retraso constante en relación
con la edad cronológica (por lo general de dos
a tres años).
La "ganancia de crecimiento" es decir el incremento en centímetros y el gradiente de maduración biológica lograda en el término de un año son
normales por completo, y si se toman como única
base de valoración señalan la normalidad en el
control neuroendocrino del crecimiento.
Los estudios realizados en relación con el sistema de la hormona del crecimiento encuentran:
1. La secreción de hormona de crecimiento inducida por fármacos (clonidina, insulina, etc.) y
hormona liberadora de hormona de crecimiento muestra respuestas similares a las observadas
en niños que se ubican por arriba de la percentila 50 de estatura acumulada y de la percentila
25 de velocidad de crecimiento y que además
mantienen una edad biológica acorde con la
cronológica.
2. La secreción espontánea de hormona de crecimiento, analizada mediante la determinación
del patrón de 12 horas (nocturno) o de 24 horas, o bien mediante la eliminación urinaria de
hormona de crecimiento, es semejante a la
descrita para niños con crecimiento normal. Sin
167
embargo, algunos estudios han demostrado
disminución leve de este parámetro a partir de
los 10 a 12 años de edad.
3. Las concentraciones séricas de factor de crecimiento tipo insulina-1 y de proteína transportadora de factor de crecimiento tipo insulina-3
son similares a las descritas para población
sana, lo que indica que la acción de la hormona de crecimiento a nivel periférico se realiza
de manera adecuada. En pacientes de más de
10 años, las concentraciones séricas de factor
de crecimiento tipo insulina-1 son menores de
las esperadas para la edad cronológica, pero
acordes con la edad ósea.
Así entonces, un paciente con retraso constitucional del crecimiento mantiene un crecimiento
paralelo a los parámetros poblacionales desde los
cuatro años y hasta los 10 años en mujeres o 12
años en varones, y durante esta etapa no se espera
una aceleración espontánea, por lo que el niño adquiere de modo constante una estatura más baja que
la de la mayoría de sus compañeros, pero con velocidad de crecimiento normal. De hecho, la aceleración espontánea del crecimiento con el consecuente progreso más rápido de estatura obliga a investigar la existencia de:
1. Patrón retrasado de crecimiento "patológico",
es decir, secundario a una-enfermedad que-no
se diagnosticó, y que de alguna manera se resolvió espontáneamente, permitiendo un crecimiento de "recuperación".
2. Una aceleración patológica de la maduración,
originada por un proceso de pubertad precoz u
otro-trastorno que de manera-anómala produce
esteroides sexuales (hiperplasia suprarrenal de
presentación tardía, carcinoma suprarrenal,
quistes ováricos, tumores gonadales, etc.) u
hormona de crecimiento (adenomas hipofísarios, síndrome de McCune-Albright, etc.).
MADURACIÓN BIOLÓGICA
Los parámetros para analizar el gradiente de maduración biológico presentan y mantienen una relación proporcional con la edad cronológica en que
el paciente alcanza la estatura acorde con el patrón
familiar de crecimiento.
1. El estudio mas difundido se refiere al análisis
del gradiente de maduración esquelética, que
analiza los denominados "núcleos de crecimiento" que se visualizan en distintas regiones anatómicas. El método de más uso es la
168
Sección III • Talla baja por diversos trastornos
valoración de los 30 núcleos de la mano. De
éstos, la mano contiene el conjunto de cartílagos de crecimiento de las falanges y metacarpianos y de los huesos cortos del carpo. La
comparación de estos núcleos con lo esperado
para la edad cronológica permite demostrar que
existe un retraso de dos a tres años en la mayoría de los pacientes, aunque hay que considerar las siguientes características:
A. Cada núcleo de crecimiento muestra una
secuencia inalterable de maduración, pero
independiente de la de otros núcleos, por
lo que sólo en las manos pueden existir 30
distintas secuencias. Esto significa la posibilidad de que los pacientes con retraso en
la maduración muestren diferencias en
cuanto a la presencia de los núcleos, incluso es posible que posean algunos de los correspondientes para una determinada edad
cronológica y carezcan de otros que por lo
general ya debieron aparecer para este
momento.
B. Existen diferencias respecto de la edad de
aparición de los núcleos de crecimiento
entre una población y otra, y en particular
entre estratos socioeconómicos bajos y altos de una misma población con patrones
de maduración ligeramente distintos, por
lo que la comparación mediante estudios
extranjeros (en especial los métodos de
Greulich-Pyle y de Tanner-Whitehouse)
puede evidenciar variaciones que deben
analizarse en función de cada caso específico.
C. Aunque se carece de estudios prospectivos
que permitan analizar el momento en que
la maduración esquelética se detiene o progresa con más lentitud, lo habitual es que
esto ocurra después de los 18a 24 meses
de edad cronológica; de lo contrario, esa
maduración debe considerarse anormal
hasta que no se demuestre otra cosa.
En toda mujer con estatura baja y edad
ósea normal o ligeramente retrasada, sin
importar la diferencia con la edad cronológica, debe investigarse la existencia del
síndrome de Turner mediante el análisis
con técnica de bandeo del cariotipo en sangre periférica. Cuando existe una monosomía regular del cromosoma X (45,XO) es
frecuente encontrar estigmas físicos sugestivos y suficientes para establecer la sospecha diagnóstica; sin embargo, en pacientes
con mosaicos (45,XO/46,XX) es posible
que se carezca de características físicas
sugestivas o que éstas sean tan ligeras que
no orienten el diagnóstico.
2. Los estudios sobre el gradiente de maduración
dental son pocos y aun los más cuidadosos lo
enfocan sólo en comparación con la edad cro
nológica, por lo que en la actualidad no hay
patrón que permita definir el comportamiento
de erupción dentaria en pacientes con retraso
constitucional del crecimiento. Sin embargo,
suele ocurrir que el brote de los dientes tempo
rales es adecuado para la edad cronológica o
está ligeramente retrasado, y que la erupción
de las piezas definitivas o permanentes se atra
sa tanto como la maduración esquelética.
El retraso en la maduración biológica posee bajo valor para establecer el diagnóstico
de retraso constitucional del crecimiento, pero
es muy importante que la familia sepa que los
dientes temporales no deben extraerse de manera prematura ya que el crecimiento y erupción de las piezas definitivas depende de la
nutrición proporcionada por los temporales. En
ocasiones, el odontólogo puede interpretar de
modo equivocado el retraso en la aparición de
los dientes definitivos como un signo de anormalidad dentaria, y proceder a extraer los temporales para acelerar la erupción de los primeros, lo que ocasiona erupción espontánea más
retrasada y muy probablemente malposiciones
dentarias.
3. El gradiente de maduración genital en varones,
que se determina mediante el cálculo de los
volúmenes peneano y testicular, mantiene una
correlación directamente proporcional con la
edad ósea, excepto en aquellos pacientes afectados por alteración gonadal.
Es importante determinar la existencia o ausencia de hipogonadismo de cualquier etiología en
pacientes en quienes se reconoce por primera vez
la asociación de estatura baja y retraso en la aparición de la pubertad, o bien en aquellos que detienen su crecimiento sólo en relación con el retraso
de la pubertad. Si el niño se evalúa con regularidad
desde los primeros años de la vida, y se sabe que su
edad ósea está retrasada en relación con la cronológica es posible predecir con facilidad el inicio tardío de la pubertad, y en la mayoría de los casos no
es necesario realizar estudios específicos al respecto.
La medición del volumen testicular pierde validez cuando el paciente padece criptorquidia bilateral y es operado después de los tres años de edad, o
bien si ha recibido medicamentos para estimular la
función androgénica testicular, entre ellos gonado-
Capítulo 14 • Retraso constitucional del crecimiento
tropina coriónica humana o mezclas de hormonas
luteinizante y foliculostimulante. De igual manera,
la determinación del volumen peneano deja de ser
útil si el paciente recibe tratamiento con testosterona, derivados androgénicos o anabólicos, o bien si
ha recibido de manera intermitente gonadotropina
coriónica en cantidades mayores a las 10 000 unidades totales.
PROPORCIONES CORPORALES
Las proporciones corporales del paciente con retraso constitucional son casi siempre inadecuadas
para la edad cronológica, pero corresponden a lo
esperado para la edad ósea. No existen estudios que
permitan analizar la dispersión de los valores de
cada segmento y su relación en pacientes con edad
ósea retrasada; por ello, contra lo esperado en poblaciones con edades ósea y cronológica equivalentes, el contraste de esos valores se realiza siempre y ello limita su uso en el retraso constitucional
del crecimiento.
El seguimiento prospectivo de cada caso permite determinar si la proporcionalidad corporal
avanza de manera paralela a la maduración esquelética; de lo contrario debe investigarse la existencia de alguna enfermedad responsable de patrón
retrasado de crecimiento y en su caso abandonar el
diagnóstico de retraso constitucional. Sin embargo
es necesario tomar en cuenta que los segmentos
crecen en función de la masa previa; en consecuencia, aunque sea de manera temporal, es posible
observar proporciones corporales ligeramente distintas de las esperadas para la edad biológica, sin
que ello signifique un crecimiento disarmónico.
Por otro lado, los antecedentes de herencia
africana, sugeridos por rasgos negroides, cabello
hirsuto y labios anchos, con frecuencia se acompañan por segmento inferior más largo que el superior, con relaciones entre ellos más cercanas a 1.0
en edades prepubescentes, e inferiores a 0.9 en
edades pubescentes.
Los pacientes que se recuperan de modo adecuado de retraso de crecimiento intrauterino, y más
tarde adoptan un patrón retrasado de crecimiento,
con frecuencia muestran segmento inferior más
corto del esperado para la media poblacional; durante las primeras etapas de la pubertad se observa
tendencia a la recuperación, aunque la longitud
obtenida es menor a la esperada cuando se alcanza
la estatura final.
Cualquier anomalía que lesione el estado nutricio limita más el crecimiento del segmento inferior que el del segmento superior, aunque se carezca de datos evidentes de desnutrición calórica o
169
calórica y proteínica, lo que en la población nacional hace imprescindible la vigilancia sistemática de
la proporcionalidad corporal en pacientes con diagnóstico de retraso constitucional.
DESARROLLO DE LA PUBERTAD
Los individuos con velocidad de maduración somática menor a la del promedio poblacional alcanzan la pubertad en edades cronológicas más avanzadas que implican un retraso de hasta tres a cuatro
años con respecto a la media poblacional.
Las características sexuales secundarias comienzan a aparecer cuando se alcanza un gradiente
de maduración ósea, lo cual ocurre de los 10 a 11
años en mujeres y de los 12 a 13 años en varones.
Si la edad esquelética es inferior a estas edades,
resulta innecesario elaborar perfiles hormonales
relacionados con la maduración sexual (hormonas
luteinizante y foliculostimulante, estradiol o testosterona).
Por otro lado, la valoración hormonal a partir
del retraso en la aparición de la pubertad no debe
conducir a la sospecha de hipogonadismo hipogonadotrófico sin el análisis de la edad ósea, porque puede emitirse un diagnóstico equivocado.
Una vez que se inicia, la pubertad progresa
normalmente hasta su término, tanto en función del
avance de las características sexuales secundarias,
como de la menarquía o espermenarquía y de la
velocidad de crecimiento.
Los estudios de pacientes con retraso constitucional del crecimiento muestran:
1. La concentración sérica de sulfato de deshidroepiandrosterona es adecuada para la edad ósea
de los individuos.
2. Los estudios de pulsatilidad espontánea de hormonas luteinizante y foliculostimulante mantienen una correlación adecuada entre la presencia e intensidad de éstos y la edad ósea de
los pacientes estudiados.
3. La respuesta a pruebas de estimulación gonadal con hormona liberadora de hormona lutei
nizante sigue un patrón adecuado para la edad
ósea, y la estimulación con dosis bajas de
andrógrenos (en ambos sexos) evidencia una
capacidad de respuesta en límites pubescentes.
4. La velocidad-de crecimiento durante la puber
tad tiende a ser normal, sin embargo algunos
estudios han demostrado que en pacientes con
patrón retrasado de crecimiento el pico máximo de velocidad de crecimiento es 2 a 3 cm
inferior al observado en individuos controles.
Este dato es cuestionable porque los estudios
170
Sección III • Talla baja por diversos trastornos
no excluyen a individuos con antecedentes
personales de anomalías capaces de limitar el
crecimiento, sino sólo a aquellos que están libres de enfermedad actual. Como se explica
más adelante, en los estudios del crecimiento
es indispensable evitar la combinación de esos
dos grupos que poseen características y pronóstico distintos, con el fin de asegurar la falta
de interferencia en los resultados.
ESTATURA FINAL ALCANZADA
En principio es necesario asumir que los pacientes
con retraso constitucional del crecimiento deben
alcanzar una estatura acorde con lo esperado para
las características epigenéticas de la familia, aunque es cierto que la edad en que esto se logra es
mayor que en la población general. Por lo general,
las mujeres alcanzan la estatura definitiva alrededor de los 16 a 18 años, y los varones de los 18 a
los 21 años (fig. 14-3).
En algunos estudios, los pacientes con retraso
constitucional del crecimiento y velocidad de maduración lenta vinculada con velocidad de creci-
miento normal muestran estatura final un poco
menor a la esperada para la familia (cuadro 14-1).
Estos datos pueden manejarse de distinta manera,
de acuerdo con la interpretación personal del investigador:
1. La diferencia entre la estatura alcanzada y la
esperada es en promedio de 2 cm (mínimo +0.3
cm, máximo -3.3 cm), por lo que el grupo de
los pacientes con retraso constitucional del
crecimiento alcanza una estatura final dentro
de los límites aceptados (con variaciones de 4
cm respecto de la estatura media de los padres).
2. La diferencia entre la estatura final y la familiar es bastante menor, y el promedio se ubica
hasta 1.85 desviaciones estándar por debajo de
la media lo cual indica que los pacientes con
retraso constitucional no logran una estatura
final adecuada y deben ser tratados para mejo
rar su crecimiento.
3. En un grupo de pacientes con patrón retrasado
de crecimiento, la estatura final de algunos es
adecuada y la de otros es bastante más baja de
lo esperado; esto sugiere que en el universo
Fig. 14-3. Ajuste entre talla y talla para la edad ósea en el retraso constitucional del crecimiento, y su relación con la estatura
epigenotípica familiar.
Capítulo 14 • Retraso constitucional del crecimiento
Cuadro 14-1. Resultados de estudios en pacientes con
posible retraso constitucional del crecimiento
Autor
y año
Pacientes
Talla
familiar
Estatura
final
Volta, 1988
Ranke, 1982
27
20
168.4
170.6
168.7
167.3
Kalkreuth, 1990
Crowne, 1990
14
42
173.9
165.4
171.3
163.6
Holl, 1990
88
171.2
168.4
Willig, 1990
77
176.6
168.9
268
169.9
167.9
Promedio
171
cional del crecimiento no debe padecer o haber padecido enfermedad crónica o recurrente, parece lógico concluir que los estudios han
carecido de criterios de exclusión para identificar a aquellos niños sanos que presentaban
patrón retrasado a causa de un ajuste "fisiológico" temporal ante una situación limitante del
crecimiento, la cual, al controlarse de manera
espontánea o mediante tratamiento médico,
permitió desde entonces una maduración a velocidad normal pero limitó la expresión total
de la capacidad genética de crecimiento.
ANTECEDENTES PERSONALES
PATOLÓGICOS
estudiado existen algunos individuos con variantes normales del crecimiento y otros que
posiblemente padecieron alguna enfermedad
crónica, diagnosticada o no, que originó retraso en el patrón de maduración y al mismo tiempo ejerció un efecto negativo sobre los aumentos de estatura (fig. 14-4). De ese modo, si se
asume que un individuo con retraso constitu-
De acuerdo con lo antes expuesto, parece evidente
que el retraso constitucional del crecimiento es un
diagnóstico de exclusión que implica por fuerza
haber confirmado o descartado la existencia de
enfermedad crónica o recurrente. Así entonces, el
interrogatorio sobre el estado de salud previo del
paciente es un elemento de gran utilidad, y se requiere consignar y analizar de manera individual la
Fig. 14-4. Patrón de crecimiento en pacientes con "patrón retrasado".
172
Sección III • Talla baja por diversos trastornos
relación de alguna alteración con un patrón retrasado de crecimiento; asimismo, es esencial que la
exploración física sea lo más minuciosa y detallada
posible para excluir la presencia actual de alguna
enfermedad, alteración nutricia y características
socioculturales que produzcan maltrato físico o
deprivación emocional.
Hasta que no se demuestre lo contrario, el crecimiento de los pacientes con características muy
sugestivas de retraso constitucional y antecedentes
personales de anomalías capaces de originar patrón
retrasado debe atribuirse a esta segunda posibilidad y no manejarse como variante normal sino como
proceso de pérdida de homeostasis, con recuperación en apariencia adecuada pero parcial (homeorresis) y que limita el crecimiento final.
Es importante señalar algunas situaciones que
pueden pasar desapercibidas con relativa facilidad
y que originan patrón retrasado pero no retraso
constitucional del crecimiento:
4.
5.
1. Infección de vías urinarias, sobre todo en mujeres. Hasta en 90% de los casos, este trastorno no origina signos (fiebre, inflamación uretral, piuría, diarrea, etc.) o síntomas (disuria,
polaquiuria, tenesmo, dolor, nicturia, enuresis,
etc.) que llamen la atención de los afectados y
sus familiares. En ocasiones, la infección se
identifica a través de urocultivo recomendado
luego de encontrar anorexia y distensión abdominal en conjunto; pero en un porcentaje
elevado de pacientes no se llega a establecer el
diagnóstico y se permite la evolución crónica
que incluso puede conducir a reflujo vesicoureteral con modificaciones lentas de la función renal.
2. Infestaciones intestinales, en especial giardiasis. Pueden originar sólo anorexia y distensión
abdominal posprandial, y pese a que la malabsorción secundaria llega a producir esteatorrea
suficiente para que las heces floten en el agua,
estos datos no se reconocen por el paciente o
sus familiares. Por otro lado, la realización
periódica de estudios parasitológicos en heces
no siempre corrobora la existencia de infesta
ciones. En pacientes con enfermedad celiaca o
con fibrosis quística del páncreas pueden presentarse cuadros similares que pasan desapercibidos fácilmente porque no se manifiestan
con intensidad, o bien porque en las primeras
etapas de su historia natural sólo originan detención del crecimiento.
3. Obstrucción nasal crónica, casi siempre secundaria a rinitis alérgica. Se confunde por lo
general con procesos infecciosos bacterianos
6.
7.
de repetición, que de manera obvia resisten el
tratamiento con antibióticos, o bien que se presentan de manera recurrente. La combinación
de hipoxemia e hipercapnia se relaciona con
patrón retrasado de crecimiento en pacientes
con respiración oral persistente, ronquidos
nocturnos o periodos breves de apnea durante
el sueño, entre otras manifestaciones; asimismo, aun con manejo específico para el problema alérgico, muchos de los pacientes mantienen esta característica de crecimiento. El retraso se acentúa más cuando existen cuadros
de sinusitis o pólipos nasales.
Asma bronquial. Se vincula con patrón retra
sado de crecimiento, aun cuando no ocasione
procesos recurrentes de broncospasmo, sino
sólo tos durante el ejercicio físico moderado a
intenso o disnea leve que puede limitar la capacidad y el gusto para participar en actividades físicas de conjunto.
Procesos inflamatorios intestinales, en particular la enfermedad acidopéptica en el niño, la
esofagitis por reflujo gastroesofágico, la enfermedad de Crohn y la colitis ulcerosa crónica
inespecífica. Con frecuencia, estos trastornos
se relacionan con anorexia y dolor abdominal
recurrente, así como con patrón retrasado de
crecimiento; sin embargo en la mayoría de los
pacientes se diagnostican de manera tardía, y
la alteración del crecimiento puede persistir
luego del tratamiento cuando no se normalizan la ingestión calórica y proteínica y la absorción intestinal.
Disfunciones tubulares renales, en especial las
acidosis tubulares y el síndrome de Bartter, y
las malformaciones e infecciones crónicas que
ocasionan reflujo vesicoureteral con deterioro
lento pero progresivo de la función glomerulotubular. Estos trastornos no se detectan con
facilidad sobre todo en ausencia de episodio
intercurrente y sintomático de infección de vías
urinarias. Incluso después de varios exámenes
generales de orina que muestran pH alcalino o
presencia de proteinuria leve con o sin glucosuria, estos datos pueden atribuirse de manera
equivocada a otras causas en el niño (fiebre,
ejercicio, inflamaciones sistémicas, etc.).
Sin importar su etiología, las concentraciones
de hemoglobina menores a 12 g/L pero superiores a 10 g/L, originan patrón retrasado de
crecimiento. En estas condiciones, el paciente
es con frecuencia asintomático (sin disnea, palpitaciones, anorexia grave, etc.) y asignológico
(sin taquicardia, taquipnea, palidez acentuada
de piel ni tegumentos, etc.); por ello no recibe
Capítulo 14 • Retraso constitucional del crecimiento
8.
9.
10.
11.
tratamiento y durante periodos prolongados
sufre anemia, la cual ocasiona patrón retrasado de crecimiento.
Algunas cardiopatías sin repercusión hemodinámica importante, y en particular las que evolucionan con comunicaciones arteriovenosas
(persistencia del conducto arterial, comunicación interauricular, drenaje anómalo de venas
pulmonares, fístulas arteriovenosas) o con obstrucciones leves de la cámara de salida ventricular (estenosis aórtica, estenosis pulmonar).
Estas pueden pasar desapercibidas durante
la exploración física superficial, pero suelen
acompañarse de patrón retrasado de crecimiento.
El equilibrio inadecuado en la ingestión calórica y proteínica, aunque no sea de intensidad
suficiente para evitar los aumentos esperados
de peso, puede disminuir de manera leve la
velocidad de crecimiento (permitiendo que el
paciente se ubique por arriba de la percentila
10 en las gráficas de velocidad) y retrasar la
velocidad de maduración biológica. Esto es
sobre todo importante en aquellos niños que
"entre comidas" ingieren productos con alto
contenido de carbohidratos de absorción rápida y que disminuyen la cantidad de alimentos
que consumen en los horarios "regulares" de
alimentación. Aunque en la mayoría de los
casos se requiere de un acontecimiento adverso coadyuvante para modificar significativa
mente el crecimiento (entre ellas, infecciones,
infestaciones o inflamaciones intestinales, infección de vías urinarias y anemia), no por ello
deja de ser importante su investigación por parte
del médico tratante.
El hipotiroidismo adquirido y de lenta instalación, como sucede en las tiroiditis, puede ocasionar manifestaciones poco específicas durante tiempo prolongado, y con mucha frecuencia
se vincula con patrón retrasado de crecimiento. La falta de palpación tiroidea en el examen
sistemático del paciente impide identificar el
aumento de consistencia de la glándula, con o
sin aumento de volumen o la presencia de dolor a la presión leve.
En particular es importante interrogar sobre las
características de comportamiento familiar,
para tratar de identificar agresiones físicas recurrentes (maltrato físico) o deprivación emocional. Estas condiciones tienden a presentarse en estratos socioeconómicos bajos y altos
con mayor frecuencia que en los medios; sobre todo cuando ambos padres trabajan o realizan actividades sociales repetidas fuera del
173
hogar y los niños quedan al cuidado de sus
hermanos o de otros familiares o encargados,
cuando existe alcoholismo o drogadicción, o
bien cuando el niño padece retraso mental leve
o alteraciones conductuales o del aprendizaje,
como en el síndrome de déficit de atención. En
muchas ocasiones, los padres fueron educados
bajo un sistema similar, y al no cuestionar la
actitud de sus ascendientes, casi siempre por
falta de interés en aprender las características
adecuadas de educación para los hijos, permiten la expresión de esas entidades patológicas
sociales que a su vez transmiten a los hijos
como un concepto adecuado de vigilancia y
preocupación por el bienestar familiar.
12. Las enfermedades neoplásicas dan manifestaciones relativamente rápidas en la etapa pediátrica; pero los tumores intracraneales, en especial los que se localizan en la silla turca o en
regiones vecinas, pueden pasar fácilmente desapercibidos cuando no originan hipertensión
intracraneana, disfunción motriz o de pares
craneales o deficiencias hormonales adenohipofisarias o neurohipofisarias como diabetes
insípida, deficiencia de hormona de crecimiento
e hipotiroidismo, entre las más frecuentes. Algo
similar ocurre en el caso de los linfomas abdominotorácicos o los sarcomas óseos.
Con base en lo anterior, en todo paciente con
sospecha de retraso constitucional del crecimiento
es recomendable valorar la utilidad de al menos los
siguientes estudios:
1.
2.
3.
4.
5.
6.
7.
8.
9.
Biometría hemática.
Química sanguínea.
Electrólitos y bicarbonato sérico.
Examen general de orina y urocultivo.
Análisis químico de heces: pH, azúcares y grasas.
Coproparasitoscópico en serie de tres o incluso de seis.
Perfil tiroideo mínimo: triyodotironina activa
(T3), tiroxina (T4) y hormona estimulante de
la tiroides.
Análisis con técnica de bandeo del cariotipo
en sangre periférica, en mujeres.
Radiografías anteroposterior y lateral de cráneo y radiografía posteroanterior de tórax.
Ante la sospecha de alguna enfermedad específica deben solicitarse, a la brevedad posible, los
estudios adecuados e incluso recomendar la valoración especializada, y es inconveniente continuar
la observación pasiva del paciente para ver "cómo
174
Sección III • Talla baja por diversos trastornos
se comporta en los siguientes meses". Asimismo
debe recordarse que:
El diagnóstico de retraso constitucional
del crecimiento se establece por exclusión,
y siempre y cuando exista patrón hereditario
de maduración biológica lento y se carezca de
evidencia respecto de enfermedad actual o
pasada capaz de limitar el crecimiento
El tratamiento del retraso constitucional es
cuestionable porque éste se considera "variante
normal" del crecimiento. Se recomienda explicar
con detalles al paciente y a los padres el patrón de
crecimiento hasta lograr la estatura final; en caso
de que algún familiar cercano haya presentado esta
variante de crecimiento y alcanzado una estatura
final normal, también es prudente platicar con él
para conocer la percepción de un individuo del
mismo estrato socioeconómico y cultural. Asimismo, es importante eliminar la angustia que aqueja
al paciente y a los padres, y hacer énfasis en los
siguientes puntos:
1. La capacidad genética de crecimiento heredada se expresa por completo, sólo que de manera más lenta; de ese modo el paciente alcanza
la estatura final dos o tres años después que
sus amigos y compañeros.
2. Los niños entienden con facilidad que su cuerpo "se hace viejo más despacio" que el de sus
amigos; es decir, se comportan como "tragaaños", y por ello aparentan menor edad de la
que tienen.
3. El paciente y los padres comprenden con facilidad que la maduración se presenta despacio
pero normal. Así por ejemplo: dos coches salen a la carretera a 100 km/hora rumbo a una
ciudad cercana; uno de ellos se detiene a cargar gasolina para después reanudar su viaje a
100 km/hora y permanece constantemente atrás
del que no se detuvo, sin que ello signifique
que el motor está dañado, por lo que llega a su
destino poco después que el primero y en excelentes condiciones. Es decir, llega "retrasa
do" pero normal, y así se comporta el crecimiento del paciente en relación con el de otros
compañeros, por lo que a este patrón se le
denomina "retraso constitucional".
4. También es importante señalar que esta variante
normal del crecimiento se debe a herencia y
no a alguna enfermedad.
5. Es necesario que el paciente y los padres estén
conscientes de que, en la sociedad nacional, la
estatura forma parte de los "valores persona-
les" del individuo, desde el inicio de la pubertad hasta el término de la adolescencia, y
que debe atenderse la posibilidad de que la
autopercepción y autoimagen del niño esté
dañada.
Así entonces, puede indicarse tratamiento en
las siguientes condiciones:
1. Cuando existen alteraciones de adaptación psicosocial, ocasionadas por temor del paciente a
integrarse y participar en las actividades sociales, culturales y deportivas con compañeros que
pueden sin embargo aceptarlo, o por rechazo
de los demás integrantes del gremio debido a
las diferencias físicas que existen y que tardarán 2 o 3 años en desaparecer, con las correspondientes limitaciones en:
A. Las actividades deportivas, en las cuales
muestra menor rendimiento dado que la capacidad y fuerza físicas son prepubescentes y esto en ocasiones no puede ser compensado con mayor agilidad.
B. El establecimiento de relaciones afectivas
con individuos del sexo contrario ("noviazgo"), por considerarse que el paciente aún
es "un niño" desde el punto de vista físico.
C. La entrada en centros de convivencia o recreación (cines, teatros, discotecas, etc.)
cuyas actividades están permitidas sólo
para "adolescentes", es decir, para aquellos individuos que presentan cambios somáticos pubescentes.
2. Cuando el niño ha realizado con éxito algún
tipo de actividad deportiva o social que conlleva varios años previos de preparación y adiestramiento, y en torno a las cuales existen competencias reglamentadas de acuerdo con la edad
y sin importar el peso, por ejemplo tenis, ballet, danza, fútbol, baloncesto, gimnasia, atletismo. El paciente está incapacitado para mantener un rendimiento adecuado (como antes lo
hacía) ya que las categorías superiores implican rendimiento y coordinación musculares
mayores de los que somáticamente puede desarrollar, y es desplazado o rechazado con la
consecuente modificación en su autoimagen y
autopercepción del éxito.
En caso de que se considere necesario proporcionar tratamiento al paciente, es importante señalar a los padres que se intentará modificar de manera positiva la velocidad de maduración, pero que
no se logrará incrementar la estatura final genéticamente determinada.
Capítulo 14 • Retraso constitucional del crecimiento
La valoración del tratamiento es muy importante porque cada vez son más frecuentes los informes de alteraciones psicológicas con repercusión
en la integración social de pacientes con patrón
retrasado de crecimiento. Las opciones terapéuticas que existen son:
1. Medicamentos que disminuyen el tono somatostatinérgico del hipotálamo, y que, por tanto
(desde el punto de vista teórico) permiten aumentar la secreción espontánea de hormona de
crecimiento. Entre los principales están:
A. Ornitina (alfacetoglutarato de ornitina):
2 g durante seis noches consecutivas y una
de descanso (12 g/semana). En promedio
aumenta la velocidad de crecimiento en 2
a 4 cm/año en 32% de los pacientes.
B. Arginina (aspartato o clorhidrato de arginina): 125 a 250 mg/kg/día, dos horas después de la cena. En 45% de los pacientes
acelera la velocidad de crecimiento en 2 a
4 cm/año, pero el efecto parece ser mucho
más importante en los primeros cuatro
meses que posteriormente.
C. Clonidina: 150 mg/m2/día, en las noches.
En promedio incrementa la velocidad de
crecimiento en 3 a 4 cm/año en 65% de los
pacientes.
En estos casos, es imprescindible evaluar
la respuesta por lo menos tres meses después
de manejo constante; si esa respuesta es insuficiente conviene suspender el tratamiento.
Cuando se continúa con la administración del
medicamento deben analizarse cada 3 a 6 meses la velocidad de crecimiento lograda, la proporcionalidad corporal, los cambios en volumen testicular y peneano y la progresión de la
edad ósea, ya que se corre el riesgo de que progresen tan rápido que igualen o superen la edad
cronológica con lo cual el crecimiento se detiene a menor edad de lo esperado y la estatura
final es inferior a la esperada genéticamente.
2. Medicamentos con efecto androgénico, que aumentan la secreción espontánea de hormona de
crecimiento, y cuya mayor eficacia se logra
siempre y cuando la edad ósea sea menor de
10 años, tanto en varones como en mujeres.
A. Oxandrolona: 0.1 mg/kg/día, en una o dos
dosis diarias, durante 3 a 6 meses. Aumenta la velocidad de crecimiento en 4 a 6 cm/
año en 85% de los pacientes, pero no se
recomienda su uso en mujeres por la posibilidad de causar clitorimegalia.
B. Testosterona (varones): 50 mg/m2 cada tres
a cuatro semanas, durante tres meses. De
175
este modo acelera la velocidad de crecimiento en 4 a 8 cm/año en 95% de los
pacientes.
C. Testosterona (mujeres, sin importar peso y
superficie corporal): 20 mg cada tres a cuatro semanas, durante tres meses. Incremen
ta la velocidad de crecimiento en 4 a 6 cm/
año en 80% de las pacientes.
D. Etinilestradiol (mujeres): 1 a 4 |ig/día durante cuatro a seis meses, siempre y cuando la edad cronológica sea mayor a 13 años.
Aumenta la velocidad de crecimiento en 3
a 5 cm/año en 85% de los pacientes.
La edad ósea avanza de manera rápida con
cualquiera de esas opciones; por ello es necesaria su evaluación, así como la de la velocidad de crecimiento, el volumen testicular (pero
no el peneano) y las proporciones corporales
cada dos a tres meses, para evitar que se crezca
y se madure tan rápido que se disminuya la estatura final esperada
El tratamiento debe suspenderse una vez que
el paciente presenta evidencias de inicio de la maduración pubescente (volumen testicular mayor de
4 cm3, o aparición de botón mamario).
LECTURAS RECOMENDADAS
Adam L, Souberbielle JC, Brauner R. Management of the
short stature due to pubertad delay in boys. J Clin
Endocrinol Metab 1994;78:478.
Albanese A, Stanhope R. Does constitutional delayed puberty cause segmental disproportion and short stature?
Eur JPediatr 1993;152:293.
Albanese A, Stanhope R. Investigation of delayed puberty.
Clin Endocrinol 1995;43:105.
Albanese A, Stanhope R. Predictive factors in the determination of final height in boys with constitutional delay
of growth and puberty. J Pediatr 1995; 126:545.
Bierich JR. Constitutional delay of growth and development. Growth, Genetics and Hormones 1987;3:9.
Calzada RL, García MF, González AP. Retraso constitucional del crecimiento. En: Calzada RL (ed). Variantes
normales del crecimiento. México: INP, 1996:219.
Cara JF, Johanson AJ. Growth hormone for short stature
not due to classic growth hormone deficiency. Pediatr
Clin North Am 1990;37:1229.
Crowne EC, Wallace HB, Moore R. Degree of activation
of the pituitary-testicular axis in early pubertal boys
with constitutional delay of growth and puberty determines the growth response to treatment with testosterone or oxandrolone. J Clin Endocrinol Metab 1995;
80:1869.
176
Sección III • Talla baja por diversos trastornos
García BH. Patrón retardado de crecimiento y sistema de
hormona de crecimiento. En: Calzada RL (ed). Variantes
normales del crecimiento. México: 1NP, 1996:255.
Heinze HJ, Bercu BB. Short stature and the patterns of
growth hormone secretion. Endocrinologist 1993;3:331.
Kannengels F, Ernoud C, Bourguignon JP. Two subsets of
constitutional delay of growth and puberty with early
or late onset of growth failure. Horm Res 1992;37:62.
Kerrigan JR, Martha PM, Veldhuis JD, Blizzard RM, Rogol
AD. Altered growth hormone secretory dinamics in prepubertal males with constitutional delay of growth.
Pediat Res 1993;33:278.
LaFranchi S, Hanna CE, Mandel SH. Constitutional delay
of growth: expected vs final adult height. Pediatrics
1991;87:82.
Lee PDK., Rosenfield RG. Psychosocial correlates of short
stature and delayed puberty. Pediatr Clin North Am
1987;34:851.
Mahoney CP. Valoración del niño con estatura corta. Clin
Pediatr Norte Am 1987;4:885.
Nishimura ME. Consideraciones terapéuticas del retraso
constitucional del crecimiento y de la pubertad. En:
Calzada RL (ed). Variantes normales del crecimiento.
México: INP, 1996:291.
Pombo MA. Abordaje diagnóstico en el retraso constitucional del crecimiento. En: Calzada RL (ed). Variantes
normales del crecimiento. México: INP, 1996:271.
Preece MA, Greco L, Savage MO et al. The auxology of
growth delay. Pediatr Res 1980;15:76.
Preece MA. Prediction of adult height: methods and problems. Acta Paediatr Scand 1988;347:4.
Rosenfield R. Diagnosis and management of delayed puberty: clinical review. J Clin Endocrinol Metab 1990;
70:509.
Tanner JM. Normal growth and techniques of growth assessment. Clin Endocrinol Metab 1986;15:411.
Capítulo
15
Retrasos del crecimiento
de origen alimentario
El crecimiento de acuerdo con la programación
genética de un organismo y el logro de longitudes
adecuadas para cada etapa requieren de la existencia de las siguientes condiciones:
1. Aporte suficiente de nutrimentos, que asegure
el mantenimiento intracelular de concentraciones óptimas de aminoácidos y ácidos grasos
(esenciales como no esenciales), así como el
equilibrio termoenergético necesario para garantizar el trabajo celular, el depósito de elementos nutritivos disponibles a corto plazo y
la síntesis de novo que permita tener un excedente disponible para aumentar el volumen
celular.
2. Factores neuroendocrinos en cantidad y calidad suficientes para regular las funciones celulares en función de las características del
momento en que se encuentra el organismo
como un sistema complejo de interacciones
(endocrinas). Esas funciones celulares incluyen las inherentes a la propia célula como unidad funcional (autocrinas) y las necesarias para
adaptarse a su ambiente y a las condiciones del
tejido del que forma parte (paracrinas).
3. Capacidad de respuesta adecuada y rápida de
los "órganos blanco o diana" a los estímulos
que regulan el crecimiento; para ello se requiere
de la existencia de receptores para diversos factores neuroendocrinos, los cuales se localizan
en la superficie de la membrana celular, en el
citoplasma y en las membranas de los organelos y del núcleo.
Las alteraciones del crecimiento por trastornos
de la nutrición se acompañan de alteración en uno
o más de los factores anteriores, ya que en términos generales todos los pacientes presentan las siguientes características:
1. Anorexia ocasionada por el padecimiento de
base, lo cual conduce a disminución de hasta
50% en el consumo de calorías.
2. Ingestión insuficiente de alimentos que no permite consumir el mínimo indispensable de los
requerimientos básicos para mantener el funcionamiento homeostático. En ocasiones, es
tos pacientes se someten a dietas que limitan la
ingestión de algunos nutrimentos, y no siempre reciben un aporte complementario adecuado, suficiente y constante.
3. Disminución en la capacidad de absorción que,
aunque puede ser primaria, se intensifica con
frecuencia por infecciones entérales crónicas,
o bien por pérdida de gran porcentaje de la
superficie de absorción de las criptas intestinales debido a desnutrición crónica.
4. Con frecuencia las manifestaciones clínicas pasan desapercibidas durante lapsos prolongados
incluso para el mismo paciente; en consecuencia, el diagnóstico se retrasa al no considerar
que todo niño con velocidad de crecimiento
baja, aun antes de que se manifieste estatura
menor de la esperada, debe estudiarse con intención hasta encontrar la causa.
Las enfermedades de origen alimentario que
de manera más habitual se relacionan con detención del crecimiento son:
1. Desnutrición primaria crónica.
2. Enfermedad celiaca y otros tipos de malabsorción.
177
178
3.
4.
5.
6.
7.
8.
9.
Sección III • Talla baja por diversos trastornos
Fibrosis quística del páncreas.
Enfermedades inflamatorias intestinales.
Intestino corto congénito o posquirúrgico.
Gastroenteritis crónicas o intermitentes.
Enfermedades hepatobiliares.
Hipertrofia congénita de píloro.
Enfermedad por reflujo gastroesofágico.
manifestaciones secundarias al trastorno del trabajo
celular, de las cuales se notifican con más frecuencia las debidas a "disfunción", "dilución" y "atrofia" y que representan desnutrición de tercer grado.
En todos los casos anteriores, es importante
considerar que desde la adquisición de un signo
neutro de crecimiento se modifica la regulación
neuroendocrina:
DESNUTRICIÓN CRÓNICA
Es probable que la desnutrición crónica sea la causa patológica más común de alteraciones del crecimiento en Latinoamérica, en especial en los países
"en vías de desarrollo", en los que hasta 70% de
sus pobladores viven en condiciones socioeconómicas y culturales inadecuadas.
La falta de aporte que permite mantener las
funciones celulares de trabajo (en particular las
requeridas para mantener los equilibrios hidroelectrolítico, acidobásico y osmolar), y que al mismo
tiempo bloquea la posibilidad de sintetizar material de novo a la velocidad necesaria para conservar un signo positivo de crecimiento, con frecuencia se manifiesta a corto y mediano plazo sólo a
través de incrementos de estatura que se ubican entre
la percentila 3 y 10 de velocidad de crecimiento.
Los afectados por lo general mantienen un peso adecuado para la estatura, porque el aporte calórico bajo
no ocasiona autoconsumo tisular que a su vez disminuya la masa antes sintetizada. De ese modo se
sostiene un signo positivo de crecimiento, aunque
en valores bajos, y el paciente es considerado portador de desnutrición en primer grado.
En ausencia de factores infecciosos agregados,
el aporte insuficiente para mantener la velocidad
de síntesis de novo que caracteriza al signo positivo de crecimiento ocasiona detención casi total del
incremento de la masa; en consecuencia, los aumentos de estatura son menores a 3 cm/año, y el
peso disminuye en lenta progresión, por lo que a
mediano o largo plazo puede evidenciarse déficit
leve a moderado de éste. Los pacientes afectados
manifiestan signo neutro de crecimiento, que representa una adaptación extrema para conservar la
función y también implica la existencia de condiciones muy precarias de nutrición. Para fines de
estudio, estos pacientes se consideran en segundo
grado de desnutrición.
Con la ingestión aún más disminuida o la existencia de factores infecciosos agregados se evidencia la reducción de la masa corporal del individuo,
por lo que además de detención de crecimiento
ocurre pérdida de peso por consumo tisular anormal
o "autocanibalismo". En estas condiciones, el signo
de crecimiento es negativo, y con rapidez se agregan
1. Aumentan las concentraciones de hormona
suprarrenocorticotrópica y cortisol como respuesta metabólica a corto plazo; entre otros
efectos, esto disminuye la síntesis hepática y
renal de factor de crecimiento tipo insulina-1,
aun cuando se mantengan cifras normales o
altas de hormona de crecimiento, como un
proceso adaptativo que reduce la velocidad de
crecimiento pero permite mantener la función
celular.
2. La falta de aporte calórico y de elevación
de cortisol en conjunto hace descender la
secreción de insulina, lo cual contribuye al
consumo de lípidos como fuente energética y
merma de manera sensible la velocidad de los
depósitos de triglicéridos en tejido graso. El
resultado a mediano y largo plazo es un consumo mayor a la síntesis, con disminución
progresiva e incluso desaparición total del depósito graso subcutáneo y perivisceral. Este
equilibrio hormonal también incrementa la utilización energética y reduce la síntesis de proteínas, al favorecer la gluconeogénesis. Aun
que la secuencia varía de un individuo a otro
en distintas condiciones, por lo general primero se utilizan los aminoácidos no esenciales que
aún no constituyen proteínas (depósito intracelular); posteriormente, las proteínas ya sin
tetizadas con menor importancia en la regulación metabólica; por último, pueden utilizarse
proteínas estructurales y reguladoras de la función celular. En tejidos, la depleción avanza en
el orden siguiente: músculo, visceras abdominales, hueso y al final órganos vitales.
3. Sin importar los valores séricos de factor de
crecimiento tipo insulina-1, la capacidad de respuesta de los receptores tisulares para esta
hormona disminuye porque existe menor número de ellos en la membrana celular y por la
presencia de sustancias en apariencia catiónicas, derivadas del metabolismo incompleto
de aminoácidos, que bloquean la unión factor
de crecimiento tipo insulina-1 y receptor así
como las acciones posreceptor.
4. La desyodación periférica de tiroxina (T4) cambia en condiciones de desnutrición, y reduce
Capítulo 15 • Retrasos del crecimiento de origen alimentario
las concentraciones de triyodotironina activa
(T3), mientras coadyuva al aumento de triyodotironina inversa (rT3), la cual no tiene efecto
hormonal o regulador.
La finalidad primaria de este mecanismo
de adaptación consiste en disminuir los requerimientos calóricos con fines de termogénesis,
con lo cual es posible utilizar este "ahorro energético" para mantener el trabajo celular.
La merma de concentraciones séricas
de triyodotironina activa y el aumento de las de
triyodotironina inversa origina reducción en la
síntesis hipofisaria de hormona de crecimiento
con la consecuente disminución de la síntesis
de factor de crecimiento tipo insulina-1 y de
su proteína transportadora específica (proteína
transportadora-3 de factor de crecimiento tipo
insulina-1).
A nivel posreceptor se produce bloqueo
para las acciones de la hormona de crecimiento
cuando además de las modificaciones en triyodotironina activa se requiere menor síntesis de
tiroxina total como mecanismo de adaptación a
un estado de deprivación nutricio, aun cuando se
mantengan concentraciones séricas normales de
tiroxina libre (FT4). 5. La masa ósea disminuye
de manera progresiva cuando las concentraciones
séricas de insulina y de factor de crecimiento
tipo insulina-1 son bajas mientras que las de
cortisol se mantienen elevadas; esto se hace
evidente aun en las radiografías simples.
El paciente que recibe tratamiento adecuado y de nuevo logra adquirir un buen estado
nutricio debe presentar un crecimiento de
recuperación relativamente acelerado, siempre
y cuando se eliminen los factores patológicos
relacionados o concomitantes y se asegure un
aporte adecuado de vitaminas y oligoelementos para las necesidades del momento.
179
4. Aumento de insulina y disminución del cortisol, con el consiguiente aumento en lipogénesis
y disminución en gluconeogénesis y lipólisis.
5. Recuperación de la capacidad celular de res
puesta a factor de crecimiento tipo insulina-1
y, en su caso, normalización de las concentra
ciones séricas de hormona de crecimiento.
Hasta que no se demuestre lo contrario, el paciente con antecedentes de desnutrición crónica
requiere de dos años de recuperación posteriores a
la reanudación de un crecimiento con aumentos
adecuados de estatura y peso, antes de lograr un
estado nutricio que lo libere de riesgos de descompensación metabólica y nutricia ante infecciones,
infestaciones u otros acontecimientos adversos. Sin
embargo, el fenómeno de recuperación no sucede
cuando la lesión del crecimiento es de larga duración y ocurre durante las fases rápidas del crecimiento y posteriormente subsiste en condiciones
precarias de vida; en estos casos también se afecta
el tamaño de manera definitiva (fig. 15-1).
ENFERMEDAD CELIACA
Y MALABSORCION
La enfermedad celiaca (llamada también esprue no
tropical o enteropatía inducida por gluten) se considera una causa poco frecuente de malabsorción
crónica, aunque es probable que se encuentre subestimada, sobre todo porque hay pacientes que no
presentan cuadro clínico grave o completo de acuerdo con las descripciones "clásicas" notificadas en
la literatura médica.
Desde el punto de vista metabólico, la recuperación del estado de desnutrición se acompaña de
las siguientes etapas secuenciales:
1. Síntesis de proteínas funcionales y estructurales
que permiten la readquisición de homeostasis acidobásica, hidroelectrolítica y osmolar, así como de la termogénesis y termorregulación.
2. Síntesis de proteínas reguladoras del metabolismo energético (enzimas alostéricas y más tarde no alostéricas).
3. Aumento en las concentraciones séricas de hormonas tiroideas, hasta su normalización.
Fig. 15-1. Diferencias en tamaño final en un modelo animal: rata bien nutrida (izquierda) y rata con desnutrición durante todo el periodo de crecimiento (derecha).
180
Sección HI • Talla baja por diversos trastornos
Entre 30 y 50% de los afectados alcanzan una
estatura menor a dos desviaciones estándar por
debajo de la media poblacional; hasta 80% muestra
crecimiento acumulado inferior al esperado para sus
características epigenéticas, y prácticamente en
todos se demuestra velocidad de crecimiento inferior a la percentila 25 para este parámetro.
La disminución en la velocidad de crecimiento
con frecuencia precede al establecimiento del diagnóstico en uno a dos años y mantiene correlación
con el momento en que se introducen en la dieta
alimentos que contienen gluten (predominantemente trigo, pero también cebada, centeno y avena).
Además de la detención del crecimiento, el
cuadro clínico se caracteriza por irritabilidad,
anorexia, cansancio, distensión y dolor abdominal
recurrentes así como por evacuaciones diarreicas
abundantes, malformadas, fétidas y con esteatorrea
que se identifican porque las evacuaciones flotan
en el agua; algunos pacientes también padecen
vómito. Se ha demostrado que los niños mayores
de dos a tres años con frecuencia sufren anemia de
instalación y progresión graduales.
Al principio el problema primario de malabsorción se limita a la gliadina, pero la diarrea crónica
y la malnutrición secundarias producen disminución progresiva del epitelio de las criptas intestinales que a su vez origina dificultades para absorber otros elementos nutricios y con ello se crea un
círculo vicioso entre malabsorción y desnutrición.
Además, la anorexia, que en la mayoría de los pacientes es moderada a grave, limita la ingestión
alimentaria hasta en 30 a 40% de lo recomendado
para la edad y coadyuva de manera importante al
desarrollo de la desnutrición.
En todos los afectados baja la velocidad de
maduración biológica, lo cual se identifica con facilidad por retraso en la edad ósea con respecto a la
cronológica; sin embargo, el patrón de crecimiento
varía de acuerdo con la velocidad:
1. En las etapas iniciales de la enfermedad, o bien
cuando la intensidad es leve a moderada, la
velocidad de crecimiento se sitúa con frecuencia entre las percentilas 3 y 10 y conduce a
patrón retrasado.
2. Conforme la enfermedad progresa y adquiere
intensidad de moderada a grave o bien cuando
se agregan factores infecciosos o de cualquier
otro tipo con efecto negativo sobre el crecimiento, la velocidad de crecimiento cae por debajo
de la percentila 3 y origina patrón atenuado.
Las hormonas involucradas en el sistema de la
hormona del crecimiento, ya antes mencionadas,
se modifican en estados de desnutrición crónica.
Por ello, durante la fase "activa" de la enfermedad,
el análisis de la secreción de hormona de crecimiento inducida por estímulos farmacológicos o incluso
de la secreción integrada de 24 horas (innecesarios
en este momento de la evolución) conduce a emitir
de manera equivocada los diagnósticos de deficiencia de hormona de crecimiento o de secreción inapropiada de ésta. Una vez que el paciente se encuentra bajo tratamiento y presenta crecimiento de
recuperación, los resultados de nuevas pruebas
muestran suficiencia en el sistema de la hormona
de crecimiento.
El crecimiento de recuperación debe observarse en los primeros seis meses después de la suspensión de la ingestión de alimentos con contenido de
gluten y se acompaña no sólo de aceleración en la
velocidad de crecimiento y de aumento de peso,
sino también de recuperación del retraso en la edad
ósea y, en su caso, de aparición de características
sexuales secundarias al permitirse la progresión
normal de la pubertad (fig. 15-2).
El fracaso en la aceleración de la velocidad de
crecimiento, indicativa de la recuperación, obliga a
valorar el sistema de la hormona de crecimiento,
ya que en series grandes de estudio se ha informado que hasta 10% de los niños afectados presentan,
con mayor o menor gravedad, este tipo de alteraciones.
Otros trastornos originan síndrome de malabsorción, y deben considerarse dentro del programa
de diagnóstico inicial de niños con alteraciones del
crecimiento. Los más frecuentes son: alergia a las
proteínas de la leche, infestación por Giardia, deficiencias de disacaridasas intestinales e insuficiencia pancreática. Estos se detallan más adelante.
Entre las enfermedades poco frecuentes que se
vinculan con malabsorción intestinal, esteatorrea y
detención del crecimiento con patrón retrasado o
atenuado se encuentran hipoplasia de vías biliares,
insuficiencia hepática crónica, alfa-lipoproteinemia
y beta-lipoproteinemia, y linfangiectasia intestinal.
En estas enfermedades, la detención del crecimiento ocurre por la coexistencia de varios factores, de
los cuales los más frecuentes son: anorexia moderada a grave, náusea y vómito y malabsorción de
grasas.
Hasta que no se demuestre lo contrario, todo
paciente con malabsorción de grasas sufre deficiencia de vitaminas liposolubles (A, D, E y K), y de
ácidos grasos esenciales (linoleico, linolénico y
araquidónico), y tiene aporte insuficiente de triglicéridos de cadena media y larga. Es necesario señalar, que la malabsorción de aminoácidos y de
vitamina B12 o de ácido fólico no se acompañan de
Capítulo 15 • Retrasos del crecimiento de origen alimentario
181
Fig. 15-2. Representación esquemática del crecimiento de una niña con enfermedad celiaca y su respuesta al tratamiento.
evacuaciones anormales, pero sí de detención del
crecimiento.
luar la conveniencia de utilizar complementos de
calcio, sobre todo en lactantes cuyo crecimiento de
recuperación es sólo parcial.
Alergia a las proteínas de la leche
Infestación por Giardia
Gran número de alimentos pueden provocar respuesta alérgica en el tubo digestivo, pero la leche es con
mucho el más frecuente. Un porcentaje elevado de
niños que se alimentan con leche de vaca poseen
anticuerpos contra las proteínas de ésta; sin embargo, sólo algunos muestran alteraciones del crecimiento o síntomas digestivos a partir de las primeras semanas de introducción de la leche, y con frecuencia presentan evacuaciones acuosas, con gran
cantidad de moco e incluso sangre, acompañadas
de vómito y dolor abdominal. La persistencia de la
diarrea ocasiona pérdida de las vellosidades intestinales y puede entonces simular un síndrome celiaco.
La suspensión de la leche se acompaña de desaparición de la sintomatología a partir de las 24 a
48 horas, y de reanudación del crecimiento en los
primeros 15 días.
En el paciente alimentado con sustitutos de
leche elaborados a base de soya, es prudente eva-
Por su alta frecuencia, es necesario evaluar en busca de Giardia a los pacientes que presenten evacuaciones acuosas persistentes, en particular en las
áreas suburbanas.
La infestación crónica tal vez se acompañe de
dolor abdominal posprandial que limita la ingestión alimentaría del paciente y con ello se intensifica el deterioro nutricio causado por la diarrea;
asimismo, los niños sufren distensión abdominal y
esteatorrea de manera habitual, así como disminución moderada de la velocidad de crecimiento con
retraso de la edad ósea.
El tratamiento de erradicación del parásito tiene que proporcionarse a toda la familia, ya sea de
modo empírico o bien después que se identifique la
Giardia o sus quistes en el estudio coproparasitoscópico seriado o mediante la determinación de anticuerpos séricos específicos.
182
Sección III • Talla baja por diversos trastornos
El crecimiento de recuperación ocurre en las
primeras cuatro a seis semanas y por lo general
permite que la estatura del paciente se sitúe en la
percentila que ocupaba antes de la infestación. Sin
embargo, no es raro observar que la edad ósea permanece un poco retrasada con respecto a la cronológica y que el crecimiento experimenta un patrón
retrasado.
En zonas endémicas, en particular zonas urbanas y suburbanas con instalación relativamente reciente de agua "potable", y en donde aún se realizan construcciones o urbanización, deben realizarse estudios periódicos de escrutinio para confirmar
o descartar la existencia de giardiasis y de otras
parasitosis intestinales relacionadas, e incluso la
posibilidad de reinfestaciones en pacientes antes
tratados y sus familiares.
Deficiencia de disacaridasas intestinales
Posterior a la instalación de episodios agudos de
diarrea de diversa causa (alimentaria, tóxica, viral,
bacteriana, etc.), es frecuente observar reducción
transitoria en la capacidad de absorción de azúcares, que puede manejarse de manera adecuada
mediante indicaciones dietéticas que permitan la
recuperación del epitelio de las vellosidades intestinales. La falta de estos cuidados puede conducir a
persistencia de evacuaciones acuosas, con contenido alto de ácido láctico (producto de la degradación bacteriana incompleta de carbohidratos) que
ocasiona flatulencias y eritema perianal. Cuando
este cuadro se hace crónico, la anorexia y las pérdidas intestinales originan desnutrición progresiva
que limita el crecimiento.
Insuficiencia pancreática
La forma primaria de este trastorno, causada por
agenesia o hipoplasia del páncreas, es muy rara
en niños y por lo general es incompatible con la
vida o bien se manifiesta por diabetes mellitus insulinodependiente desde la etapa neonatal. La mucoviscidosis se describe posteriormente en este
capítulo.
El uso de medicamentos antineoplásicos, en
particular de L-asparaginasa, se relaciona con
episodios de pancreatitis tóxica que a largo plazo,
sobre todo si son repetitivos, originan insuficiencia pancreática crónica; ésta se manifiesta por
diarrea crónica y esteatorrea y sin variaciones produce patrón retrasado o incluso atenuado de crecimiento.
FIBROSIS QUISTICA DEL PÁNCREAS
O MUCOVISCIDOSIS
La fibrosis quística del páncreas o mucoviscidosis
es la causa más frecuente de malabsorción en la
etapa pediátrica, ya que la falta parcial o casi total
de enzimas pancreáticas digestivas dificulta y disminuye la velocidad de digestión de grasas y proteínas, con lo cual limita la posibilidad de absorción de los nutrimentos.
El cuadro clínico tiene un espectro muy amplio
e incluye pacientes asintomáticos cuyo diagnóstico se establece de manera fortuita en vida o incluso
en estudios anatomopatológicos. Sin embargo, es
importante sospechar la existencia de la enfermedad en pacientes que sufran detención del crecimiento con patrón retrasado o atenuado, aun sin
manifestaciones sistémicas, o en aquéllos con hipocrecimiento acompañado de infecciones pulmonares de repetición o de síndrome de malabsorción.
Las manifestaciones de distensión abdominal,
diarrea con esteatorrea y desnutrición son más frecuentes y de mayor intensidad entre mayor es la
insuficiencia pancreática exocrina.
La estatura baja (más de dos desviaciones
estándar por debajo de la media poblacional) se
encuentra hasta en 50% de los afectados. Pero el
análisis de la estatura alcanzada en relación con
la esperada para la familia evidencia que existen
problemas hasta en 70% de los pacientes; cuando
además se valora la velocidad de crecimiento, se
observa que hasta 85% de ellos tienen valores inferiores a la percentila 10 para este parámetro.
La detención del crecimiento suele iniciar alrededor del año de edad y se hace muy evidente a
partir de los dos años; además, aunque la intensidad varía con la gravedad de la mucoviscidosis, las
mujeres tienen tendencia a afectarse con más gravedad. Cuando el diagnóstico no se ha establecido
o la terapéutica ha sido incompleta o insuficiente,
es posible que no se produzca el brote de crecimiento de la pubertad; de ese modo, la estatura final
disminuye entre 15 a 20 cm más de lo esperado en
ambos sexos, y se alcanzan estaturas finales menores a 145 cm en varones y 135 cm en mujeres.
La causa de la detención del crecimiento se
encuentra en la coexistencia de disminución en la
ingestión y de exceso de nutrimentos en las pérdidas fecales.
La anorexia, con frecuencia de intensidad moderada a grave, puede exacerbarse cuando se agregan:
1. Episodios agudos o crónicos de supuración pulmonar.
Capítulo 15 • Retrasos del crecimiento de origen alimentario
2. Esofagitis.
3. Alteraciones en vías biliares por espesamiento
de la bilis.
4. Medicamentos que ocasionan irritación gastro
intestinal.
La pérdida del consumo calórico, ocasionada
por la malabsorción, se incrementa durante los
episodios supurativos pulmonares e infecciones
entérales que aumentan los requerimientos energéticos del organismo (figs. 15-3 y 15-4). Con frecuencia se recomienda a los pacientes que ingieran
alimentos bajos en grasas, los cuales disminuyen la
esteatorrea y las molestias abdominales pero ocasionan reducción agregada de 10 a 20% en el consumo calórico.
El mayor condicionante de la desnutrición y,
por tanto, de las alteraciones del crecimiento es el
consumo alimentario de los pacientes. Los estudios
prospectivos de individuos cuyo programa dietético incluye triglicéridos con ácidos grasos de cadena larga muestran crecimiento de recuperación: en
el lapso de 6 a 18 meses se normaliza la velocidad
de crecimiento; posteriormente aumenta el peso
hasta alcanzar más de 90% en relación con el ideal
183
para la estatura, y finalmente se observa crecimiento de recuperación.
Cuando la anorexia constituye un factor limitante de la ingestión alimentaria, la gastrostomía
permite lograr recuperación del crecimiento; en los
siguientes seis meses a partir del aumento en la
velocidad de crecimiento ocurren incrementos de
38% en el nitrógeno total corporal, de 5% en el
potasio corporal total, de 20% en peso y de 13% en
la masa magra.
Los estudios prospectivos comparan el grado
de seguridad y eficacia que existe en la ingestión
oral y mediante gastrostomia de alimentos con triglicéridos integrados por ácidos grasos de cadena
larga; se han contrastado los incrementos de peso y
estatura en un periodo de observación de 18 meses
previos al inicio del tratamiento y otro periodo
posterior similar de tratamiento continuo. Estos
estudios confirman que la nutrición oral y la nutrición por gastrostomía brindan igual seguridad, pero
esta última es más eficaz. En el cuadro 15-1 se
muestra un ejemplo de lo anterior en que se evidencia mejoramiento del crecimiento cuando el
aporte de ácidos grasos de cadena larga es suficiente; asimismo, la alimentación oral permite un au-
Fig 15-3. Representación esquemática del crecimiento de una niña con fibrosis quística del páncreas no diagnosticada.
184
Sección III • Talla baja por diversos trastornos
Fig. 15-4. Efecto de las complicaciones en el crecimiento de un paciente con fibrosis quística del páncreas.
mentó de peso de sólo 22.8% y de estatura de 50.6%
en relación con los resultados de la gastrostomía.
La máxima velocidad de recuperación del crecimiento se alcanza entre los 6 y 12 meses de iniciado el tratamiento, mientras que la recuperación
total de estatura y de la concordancia entre edad
ósea y cronológica se logra entre los 18 y 24 meses
de tratamiento.
Los pacientes con enfermedad moderada que
reciben tratamiento antes de la aparición de características sexuales secundarias tienen mucho mejor
pronóstico para estatura final que los otros grupos
de edad o de gravedad, siempre y cuando los episodios supurativos pulmonares se identifiquen y manejen de manera oportuna y adecuada.
En conclusión, es posible neutralizar el efecto
deletéreo de la mucoviscidosis sobre el crecimiento a través de un programa terapéutico adecuado en
la mayoría de los pacientes; asimismo, en aquellos
de edad prepubescente con insuficiencia pancreática exocrina moderada es posible lograr crecimiento de recuperación.
Cuadro 15-1. Estudio comparativo de la recuperación
del crecimiento por medio de gastrostomía
La inflamación intestinal crónica tiene múltiples
causas; pero los dos trastornos mejor estudiados
desde el punto de vista de las alteraciones del crecimiento, y de la recuperación de éstas, son la enfermedad de Crohn y la colitis ulcerosa crónica
inespecífica (CUCI).
La enfermedad de Crohn (enteritis regional o
granulomatosa) se origina por un proceso inflamatorio de evolución lenta pero constante, que afecta
a la mucosa y a la submucosa de la pared intestinal;
durante el proceso patológico se observan granulo-
18 meses previos
Vía oral
Gastrostomía
Media (DE)
Media (DE)
Media (DE)
0.13 (0.04)
0.21 (0.09)
0.92 (0.45) kg/mes
1.56 (0.48)
0.32 (0.08)
2.52 (0.98)
0.37 (0.12)
11.04 (5.40) kg/año
0.73 (0.15) cm/mes
3.84 (0.96)
4.44 (1.44)
8.76 (1.80) cm/año
DE = desviación estándar.
ENFERMEDAD INTESTINAL
INFLAMATORIA
Capítulo 15 • Retrasos del crecimiento de origen alimentario
mas constituidos por células epiteliales gigantes en
la mucosa y en los ganglios linfáticos regionales.
La aparición de la enfermedad es por lo general insidiosa, y sus manifestaciones incluyen
anorexia, meteorismo, fatiga, dolor abdominal de
tipo cólico e intermitente, diarrea con evacuaciones sanguinolentas (hasta en 90% de los pacientes), fiebre (en 30%), anemia, dedos en palillo de
tambor, cálculos vesiculares y litiasis renal. Con
frecuencia, los pacientes mayores de 10 a 12 años
muestran retraso o detención en la aparición de las
características pubescentes del crecimiento y desarrollo somático (fig. 15-5).
La colitis ulcerosa crónica inespecífica se debe
a un proceso inflamatorio crónico de etiología aún
desconocida y que afecta todo el colon de manera
difusa. Sus manifestaciones incluyen diarrea sanguinolenta, dolor abdominal de tipo cólico, fiebre,
anemia, pérdida de peso, edema distal y artritis. La
revisión endoscópica del colon muestra úlceras,
inflamación difusa y abscesos de las criptas. Algunos pacientes tienen manifestaciones que sugieren
alteraciones en la autoinmunidad, del tipo de iritis,
eritema nodoso y piodermitis gangrenosa.
185
En las primeras etapas de la enfermedad no se
altera el crecimiento, pero en todos los pacientes
con evolución prolongada ocurre detención de crecimiento con estatura baja (figs. 15-5 y 15-6).
En términos generales, las alteraciones del crecimiento en ambas enfermedades consisten en:
1. Estatura menor a dos desviaciones estándar por
debajo de la media poblacional en 15 a 30%
de los pacientes; pero en relación con la esta
tura esperada para las características epigenéticas de la familia del paciente, 30 a 55% de
los niños tienen estatura baja, y hasta 88%
muestran velocidad de crecimiento por debajo
de lo señalado en la percentila 10.
2. La edad ósea se encuentra retrasada; sus valores
son variables pero la media equivale a dos años
menor de lo esperado para la edad cronológica.
3. La disminución en la velocidad de crecimiento puede preceder hasta en cuatro años al inicio de la sintomatología, y el desarrollo de estatura mucho menor de la esperada antecede
por lo menos dos años a la instalación de las
manifestaciones clínicas.
Fig. 15-5. Representación esquemática del crecimiento de una niña con enfermedad de Crohn y su respuesta al tratamiento.
186
Sección III • Talla baja por diversos trastornos
Fig. 15-6. Representación esquemática del crecimiento de una niño con colitis ulcerativa crónica inespecífica y su respuesta
al tratamiento.
4. Todos los pacientes que no reciben tratamiento muestran retraso en la aparición de las manifestaciones sexuales secundarias o por lo menos lentitud importante en la progresión de las
mismas.
Las causas de los trastornos del crecimiento
son:
1. Ingestión calórica muy baja a consecuencia de
la anorexia y del dolor abdominal; las deficiencias son de 50 a 80% de los requerimientos y
el consumo calórico suele variar entre 39 y 67
kcal/kg/día.
2. Malabsorción de grasas debido a las alteraciones de la mucosa, así como a las alteraciones
biliares y la proliferación bacteriana que con
frecuencia afectan a los pacientes.
3. Hipoalbuminemia y aumento de la excreción
fecal de proteínas, que se acompaña casi sin
variación de trastornos en la absorción de zinc,
magnesio y fosfatos, así como de hierro, el cual
se pierde durante los episodios de sangrado de
tubo digestivo.
4. Aumento de los requerimientos energéticos del
organismo a consecuencia de los episodios intercurrentes de fiebre y del proceso constante
de inflamación.
Ninguna de las dos enfermedades tiene tratamiento específico. En la actualidad se emplean esteroides para disminuir el proceso inflamatorio que
origina el trastorno enterocolítico, y salicilazosulfapiridina para la enfermedad de Crohn.
La disminución de la inflamación que se acompaña de incremento sustancial en la ingestión calórica (hasta lograr por lo menos un aporte de 130 a
150% de los requerimientos habituales de los pacientes) hace evidente el crecimiento de recuperación en las primeras 8 a 10 semanas de tratamiento.
Los pacientes con enfermedad de Crohn, en
quienes es técnicamente imposible la resección
quirúrgica del segmento afectado, muestran aumento más o menos importante del crecimiento, ya que
los pacientes con velocidad previa de 2.4 aumentan a 7.3 cm/año en edades prepubescentes.
El uso de alimentación parenteral que al principio aporta 100% de los requerimientos y se com-
Capítulo 15 • Retrasos del crecimiento de origen alimentario
plementa con ingestión habitual de los pacientes
permite lograr un crecimiento de recuperación temporal, mientras que con el uso de esteroides o de
cirugía es posible volver a adquirir la capacidad de
nutrición enteral. Sin embargo, los esteroides no
inducen la estatura final esperada en la mayoría de
los pacientes debido a que es necesario utilizarlos
en dosis elevadas y durante periodos prolongados;
de ese modo, se observan estaturas de 3 a 6 cm
menores de las esperadas, al término de su crecimiento.
El inicio del tratamiento en la pubertad, aun
cuando induzca un crecimiento de recuperación,
conduce a lograr una estatura final 8 a 11 cm menor de lo esperado para las características epigenotípicas de la familia.
Los pacientes con enfermedad de Crohn sufren
retraso de crecimiento secundario a un estado de
desnutrición crónica. Por ello no existe alguna
indicación formal para utilizar hormona de crecimiento humana biosintética, al menos hasta que se
recupere el estado nutricio adecuado, se mantenga
una ingestión calórica equivalente a 100% o más
de sus requerimientos y haya concluido el periodo
de recuperación del crecimiento; en este momento
se normaliza el equilibrio en la regulación y funcionamiento del sistema de la hormona del crecimiento.
El uso de esteroides sexuales para inducir o
incrementar el crecimiento y maduración pubescentes tampoco se recomienda, ya que el eje hipotálamo-hipófisis-gónada no se encuentra afectado y el
hipogonadismo hipogonadotrófico mencionado representa sólo un mecanismo de compensación "fisiológico" del organismo con desnutrición.
Las pruebas de estimulación con hormona liberadora de hormona luteinizante (hormona hipotalámica estimuladora de la secreción hipofisaria
de gonadotropinas) producen respuesta hipofisaria
normal aun en pacientes con afección grave; asimismo, la estimulación gonadal con gonadotropina coriónica permite evidenciar una capacidad
esteroidógena normal en testículos y en ovarios.
Mientras se readquiere un estado nutricio adecuado, los pacientes púberes muestran producción
hormonal normal espontánea en un lapso máximo
de 8 a 10 semanas, con presentación o reanudación
del desarrollo de las características sexuales secundarias.
DIARREA CRÓNICA
Las poblaciones rurales y suburbanas de países en
vías de desarrollo, aun sin las alteraciones funcionales primarias del tubo digestivo antes señaladas,
187
muestran incidencia y frecuencia altas de episodios
diarreicos de repetición secundarios a infecciones o infestaciones entérales; los cuadros clínicos abarcan desde cuatro a seis episodios anuales
de diarrea con duración media de siete días, hasta
la diarrea crónica con duración mayor de dos a
cuatro semanas que se presenta más de seis veces
al año. En estos pacientes el crecimiento se ve alterado por combinación de uno o más de los siguientes factores:
1. Mínima ingestión de alimentos debido a que
las condiciones socioeconómicas facilitan un
estado crónico de malnutrición, sobre todo a
expensas de la ingestión de proteínas de origen animal, y debido a la anorexia que caracteriza a cada uno de los episodios de diarrea.
La disminución de la ingestión que implica la pérdida de 10 a 30% de los requerimientos diarios origina detención del crecimiento
durante el episodio de diarrea.
En lactantes que presentan un cuadro agudo de gastroenteritis infecciosa se ha encontrado que el consumo de kilocalorías por día
disminuye en promedio de 450 a 350, lo cual
significa una pérdida de 22.2%, aun en ausencia
de modificaciones en el tiempo de lactancia.
Cuando el balance nitrogenado del organismo
no permite un aprovechamiento proteínico mínimo de 0.9 g/kg/día, el crecimiento disminuye e incluso cesa por completo durante ese periodo; de esa cifra de proteínas, al menos 50 a
60% tiene que ser de origen animal, sobre todo
en poblaciones cuya dieta básica consiste en
alimentos elaborados de maíz y leguminosas,
con predominio de frijol.
2. Además de la alteración en la ingestión, hay
pérdida en la capacidad de absorción de gran
número de factores nutricios, entre ellos lactosa, grasas, proteínas, vitamina A, zinc y cobre.
La readquisición de esa capacidad de absorción requiere de la recuperación del epitelio
intestinal y la síntesis de las enzimas necesarias para su digestión en un periodo de 3 a 14
días; en este lapso tienen que vigilarse las características de las evacuaciones para asegurar
la ausencia de esteatorrea, evacuaciones disminuidas de consistencia, flatulencias o eritema perianal que indican malabsorción secun
daria al problema infeccioso.
3. Aumento en los requerimientos energéticos del
organismo por el proceso infeccioso e inflamatorio que condicionó el cuadro enteral.
Aunque existen variaciones individuales al respecto, se calcula que las necesidades calóricas
188
Sección III • Talla baja por diversos trastornos
se incrementan en 5 a 8% por cada grado centígrado que se eleve la temperatura.
Así entonces, para promover el crecimiento de
recuperación posterior al cese del cuadro de diarrea, el paciente debe recibir, digerir y absorber,
sobre sus necesidades calóricas diarias, un porcentaje equivalente al que perdió, lo cual representa
una ingestión diaria aproximada de 115 a 138% al
menos durante dos veces el tiempo que se tuvo la
enfermedad; también debe asegurarse que la ingestión de vitaminas, zinc y otros oligoelementos sea
adecuada. Entre menor sea la edad de los pacientes
y mayor sea la duración del cuadro enteral, ocurre
mayor detención del crecimiento durante el año en
que se presenta la enfermedad.
El cuadro 15-2 presenta un estudio prospectivo y comparativo de un grupo de pacientes que
recibieron alimentación complementaria con zinc
como parte del tratamiento de su enfermedad y otros
que no lo hicieron. En ambos casos, la diarrea tiene
una duración similar y los resultados muestran las
diferencias entre el crecimiento logrado y el esperado (en días por año).
Otros estudios han demostrado que sobre el
déficit de estatura promedio observado, entre una
población indígena (49%) y una población no indígena (18%), la estatura final se sitúa 4 cm por debajo de lo esperado cuando los episodios de diarrea
son de grado leve y los individuos reciben alimentación complementaria adecuada posterior al control
de cada uno de ellos; en caso de diarrea grave, el
déficit de estatura es de 6 cm aunque se haya proporcionado alimentación complementaria adecuada.
Los pacientes que no reciben e ingieren los
alimentos complementarios durante el tiempo requerido presentan déficit de estatura final de 7 cm
en caso de episodios leves de diarrea, y de hasta 9
cm en caso de episodios graves.
Los estudios retrospectivos concluyen que no
existe diferencia entre la estatura esperada y la lo-
grada al término del crecimiento cuando los cuadros entérales representan menos de 6.5% del tiempo de vida durante los tres primeros años de edad;
pero cuando la duración de esos cuadros es mayor,
se produce un déficit de estatura de 3 a 5 cm tanto
a los tres años como durante la adolescencia y al
término del crecimiento. Esto también ocurre a pesar
de la ausencia de episodios de diarrea o desnutrición a partir del cuarto año de la vida y hasta el
término del crecimiento.
Lo anterior significa que aunque se vigile de
cerca a estos individuos para asegurar la ingestión
alimentaria y el estado general de salud adecuados,
es posible que no se logre recuperar por completo
el déficit de crecimiento producido por episodios
repetitivos de diarrea que dan lugar a acontecimientos intermitentes de desnutrición aguda en organismos previamente desnutridos o subnutridos.
CRECIMIENTO DE RECUPERACIÓN EN
LOS TRASTORNOS DEL CRECIMIENTO
DE ORIGEN NUTRICIO
El crecimiento de recuperación es el que ocurre en
los pacientes que muestran velocidad de crecimiento
muy baja de manera temporal como un mecanismo
de adaptación "fisiológico", pero que una vez controlados permiten la readaptación del funcionamiento del organismo en condiciones de homeostasis.
En este sentido es necesario enfatizar que:
1. El crecimiento de recuperación y la capacidad
para lograr una estatura final dentro de las características epigenéticas sólo se logra antes del
inicio de la pubertad. Cuando las condiciones
de nutrición no son óptimas al iniciar los cambios pubescentes, la estatura final es sin variación menor a la esperada.
2. El crecimiento de recuperación siempre va precedido por la adquisición de una composición
corporal adecuada.
3. La regulación fisiológica del sistema de la hormona del crecimiento, así como la respuesta
celular en límites fisiológicos a las concentraciones séricas de la hormona del crecimiento y
de factor de crecimiento tipo insulina-1, sólo
se obtienen cuando la composición corporal
refleja un estado nutricio normal.
4. Durante el crecimiento de recuperación, aumenta la sensibilidad de los condrocitos proximales a la hormona del crecimiento al igual
que la producción autocrina y efectos paracrinos del factor de crecimiento tipo insulina-1
en condrocitos proximales e intermedios, incluso ante falta de evidencia de modificado-
Capítulo 15 • Retrasos del crecimiento de origen alimentario
nes en la secreción hormonal, aunque algunos
autores informan un ligero incremento en la
amplitud de los pulsos de secreción.
5. Existe un mecanismo de regulación que influye sobre el tamaño corporal absoluto, el tamaño corporal relativo al punto diana o estatura
final fenotípica, y la capacidad y duración de
los episodios de desaceleración (como ajuste
"fisiológico" ante acontecimientos adversos
que producen pérdida de la homeostasis) y de
aceleración o "recuperación" del crecimiento
a partir de la readquisición de la homeostasis
funcional. Es posible que ese mecanismo se
localice en el sistema nervioso central y en
particular en el tálamo o hipotálamo; pero aún
no se ha demostrado su presencia en experimentos en seres humanos.
6. Además del "regulador central del crecimiento", existen otros mecanismos denominados
"control del crecimiento proporcionado" que
permiten ajustar los incrementos de la masa de
los tejidos blandos al crecimiento esquelético.
Lo anterior se deduce por los acontecimientos
de los episodios de desnutrición y en los que
se hace evidente la siguiente secuencia:
A. El tamaño del esqueleto y la masa de los
tejidos blandos sufren desproporción durante los episodios de detención del crecimiento causados por desnutrición crónica
o crónica agudizada.
B. Una vez que se logra un estado nutricio adecuado, es posible que el crecimiento del esqueleto inicie la recuperación acelerada
(¿por efectos del "regulador central del
crecimiento"?), pero el incremento de la
masa de los tejidos blandos (músculo y
visceras) no se produce de manera simultánea.
C. Cuando se ha logrado recuperar el crecimiento longitudinal del esqueleto, se produce un ajuste paulatino y proporcionado
de la velocidad de crecimiento de los tejidos blandos, hasta que se adquieren las
relaciones adecuadas (¿por efecto del "control del crecimiento proporcionado"?); de
esa manera, la masa y el volumen de los
tejidos blandos se mantienen siempre bajo
una relación directamente proporcional a
la longitud del esqueleto. Esto permite explicar por qué los individuos que presentan episodios crónicos o intermitentes de
desnutrición mantienen una masa muscular menor que aquellos que no los sufren,
y aunque la estatura final de ellos sea similar es necesario considerar que los prime-
189
ros alcanzaron un crecimiento menor al
ideal mientras que los segundos lograron
expresar de manera adecuada sus características epigenéticas familiares.
7. El uso de glucocorticoides durante tiempo
prolongado, y a dosis mayores de las consideradas fisiológicas (13 a 20 mg/m2/día de
hidrocortisona o su equivalente para otros
esteroides), tal vez se relacione con recuperación inicial del crecimiento; sin embargo,
tiende a producir estaturas finales por debajo
de las esperadas, así como disarmonía en las
proporciones corporales, ya que retrasa la
maduración del esqueleto axil y acelera la
del esqueleto apendicular.
LECTURAS RECOMENDADAS
Bergstrom WH, DeLeon AS, Van Gemund JJ. Growth aberrations in renal disease. Pediatr Clin North Am 1996;
11:563.
Beutner EH, Kumar V, Chorzelski TP. Screening for celiac
disease. N Engl J Med 1989;320:1087.
Byard PJ. Early childhood growth in patients with cystic
fibrosis. Ann Hum Biol 1990;17:483.
Calzada RL, Bojórquez OA. Causas orgánicas que originan
un patrón retrasado de crecimiento. En: Calzada RL (ed).
Variantes normales del crecimiento. México: INP, 1996:
241.
Graham GC, Adrianzen T, Rabold J. Later growth of malnourished children. Am J Dis Child 1982; 136:348.
Griffiths AM, Nguyen P, Smith C, Macmillan JH, Sherman
OM. Growth and clinical course of children with Crohn's
disease. Gut 1993;34:939.
Groll A, Preece MA, Candy DCA, Tanner JM. Short stature
as the primary manifestation of coeliac disease. Lancet
1980;2:1097.
Kirschner BS. Growth and development in chronic inflammatory bowel disease. Acta Paediatr Scand 1990;366:
98.
Knudtzon J, Fluge G, Aksnes L. Routine measurements of
gluten antibodies in children of short stature. J Pediatr
Gastroenterol Nutr 1991; 12:190.
Prader A, Tanner JM, Von Harnack GA. Catch-up growth
following illness or starvation. J Pediatr 1963;62:646.
Ramos RG. La somatometría en el diagnóstico del estado
de nutrición. Gaceta Med Mex 1976;111:321.
Ranke MB. Disease-specific growth charts: do we need
them? Acta Paediatr Scand 1989;356:17.
Rizzoni C, Broyer M, Guest G, Fine R, Holliday MA.
Growth retardation in children with chronic renal disease: scope of the problem. Am J Kidney Dis 1986;
7:256.
Underwood LE. Nutritional regulation of IGF-1 and
IGFBPs. J Pediatr Endocrinol Metab 1996;9:303.
190
Sección III • Talla baja por diversos trastornos
Vance ML. Nutrition, body composition, physical activity
and growth hormone secretion. J Pediatr Endocrinol
Metab 1996;9:299.
Verge CF, Cowell CT, Howard NJ, Donahue KC, Silink M.
Growth in children with X-linked hypophosphatemic
rickets. Acta Paediatr Scand 1993;388:70.
Verkasalo M, Kuitunen P, Leistri DS, Peheentupa J. Growth
failure from symptom less coeliac disease. Helv Pediatr
Acta 1978;33:489.
Villalpando HS. Causas nutricionales que semejan talla baja
familiar. En: Calzada RL (ed). Variantes normales del
crecimiento. México: 1NP, 1996:141.
Waterlow JC, Payne PR. The protein-gap. Nature 1975;
258:113.
Winick H. Cellular growth during early malnutrition. Pediatrics 1971;47:969.
Capítulo
16
Crecimiento en enfermedades
renales
En términos generales todas las alteraciones crónicas en las funciones renales son capaces de modificar el patrón genético de crecimiento de un niño,
y el efecto sobre la estatura final depende del tiempo de evolución, el grado de deterioro de la función renal y la edad en que se presentó el trastorno
(fig. 16-1).
Según las estimaciones, la mayoría de los pacientes con insuficiencia renal crónica alcanzan una
estatura final que se sitúa en 1.03 a 3.8 desviaciones estándar por debajo de la media poblacional, lo
que representa una estatura inferior a la percentila
3. Los varones parecen afectarse de manera más
grave, ya que la diferencia de estatura respecto de
las mujeres es de 13 cm en una población sana y
disminuye a 7 cm en quienes padecen insuficiencia
renal crónica. El trasplante renal tal vez normalice
la velocidad de crecimiento, pero 30 a 50% de los
pacientes obtienen estatura final baja.
La velocidad de filtración glomerular inferior
a 25 ml/min/1.73 m2 tiende a detener el crecimiento. Sin embargo, las alteraciones del crecimiento
son de origen multifactorial en cada caso en particular, por lo que es difícil definir el efecto cuantitativo de cada uno de los acontecimientos involucrados en la detención del crecimiento. Aun en
enfermedades renales agudas como la glomerulonefritis, la velocidad de crecimiento disminuye
conforme se deteriora la función glomerular, sin
importar si existe o no insuficiencia renal crónica.
La proteinuria por sí sola puede deteriorar el
crecimiento, tanto en el síndrome nefrótico congénito como en el adquirido. Además, el uso de corticosteroides es un factor agregado en la disminución de la velocidad de crecimiento, aunque su efec-
to es transitorio y en algunos niños es posible observar "crecimiento de recuperación" luego de su
suspensión.
Algunas disfunciones tubulares y enfermedades intersticiales se relacionan con detención del
crecimiento y del gradiente de maduración. La
mayoría de los pacientes con acidosis tubular renal
(proximal o distal) muestran normalización de la
velocidad de crecimiento cuando se corrige la pérdida de cationes y la acidosis metabólica, pero sólo
un porcentaje mínimo logra el "crecimiento de recuperación". Los niños con infecciones de vías
urinarias recurrentes y relacionadas con reflujo
vesicoureteral también presentan esa normalización
luego de la resolución médica o quirúrgica del trastorno o de ambas maneras (fig. 16-2).
La diabetes insípida nefrogénica ocasiona que
hasta 50% de los pacientes alcancen estatura menor a la esperada para su edad, tal vez por la existencia de hipernatremia, hipovolemia intravascular
y malnutrición. En 100% de los pacientes, la resolución de las alteraciones se relaciona con "crecimiento de recuperación".
La persistencia de hipopotasemia en el síndrome de Bartter se ha vinculado con detención del
crecimiento, pero la gravedad de la depleción del
catión y la disminución de la velocidad de crecimiento no mantienen una relación en proporción
directa; además, luego del inicio de la pubertad con
frecuencia hay tendencia a la recuperación de la
estatura, de tal manera que la talla final no es significativamente inferior a la esperada para las características genéticas de los pacientes (fig. 16-3).
Los pacientes con nefropatías, en particular en
la insuficiencia renal crónica, padecen al menos
191
192
Sección III • Talla baja por diversos trastornos
Fig. 16-1. Gráfica de crecimiento de un niño con malformación e infección crónica de vias urinarias y respuesta al tratamiento
quirúrgico.
cuatro alteraciones orgánicas que influyen en la
obtención de estatura baja:
1.
2.
3.
4.
Acidosis metabólica persistente.
Alteraciones nutricias.
Osteodistrofia renal.
Alteraciones hormonales.
1.
2.
ACIDOSIS METABÓLICA PERSISTENTE
3.
Una vez que la velocidad de filtración glomerular
disminuye 50% o más, se hace evidente la incapacidad renal para excretar amonio; entonces la acidosis
metabólica es inevitable y se intensifica por el catabolismo y nutrición insuficiente que se observa prácticamente en todos los pacientes, así como por las
alteraciones relacionadas del equilibrio electrolítico.
La acidosis metabólica modifica varias funciones
y, aunque la velocidad de filtración glomerular sea
normal, produce detención del crecimiento en
pacientes con acidosis tubular renal, tanto proximal como distal, ya sea que se relacione o no con
un síndrome genético como el de Silver-Russell
(figs. 16-4 a 16-9):
Incrementa de manera importante el catabolismo de proteínas, en particular valina y leucina,
al aumentarse la actividad de la enzima deshidrogenasa de cetoácidos de cadena ramificada,
pero también de manera general por el aumento en la producción de glucocorticoides.
Favorece la pérdida de electrólitos a través
de la orina, en particular potasio y calcio, y en
menor cuantía fosfatos y magnesio.
Bloquea los mecanismos intramitocondriales
para la obtención de trifosfato de adenosina, ya
que durante el ciclo de la ubiquinona se
requiere de un flujo de seis iones hidrógeno
desde la mitocondria hacia el citoplasma que
tenga relación con la cadena respiratoria y
permita la alcalinización de la matriz mitocondrial, para después invertirse y ser captados en
pares por una proteína de membrana como
parte del proceso de fosforilación oxidativa.
Los iones hidrógeno mitocondriales no pueden
salir cuando el citoplasma tiene un pH ácido, y
con ello se altera el flujo electrónico de la cadena respiratoria y además se bloquea la fosforilación oxidativa, con la consecuente falta
Capítulo 16 • Crecimiento en enfermedades renales
193
Fig. 16-2. Gráfica de crecimiento de un paciente pediátrico con infección crónica de vías urinarias.
de generación de trifosfato de adenosina. Al
disminuir la energía metabólica, se detiene el
proceso de crecimiento celular.
4. Bloquea la expresión y regulación de los mecanismos involucrados en la síntesis de proteínas, ya que en condiciones de acidosis no se
lleva a cabo la alcalinización citoplásmica requerida para que el mRNA salga del núcleo y
regule la síntesis ribosómica; por el contrario,
un medio extracelular con pH bajo favorece la
entrada de iones hidrógeno al citoplasma.
5. En condiciones de acidosis disminuye de manera significativa la secreción de hormonas, en
tre ellas las del sistema de crecimiento. En la
hipófisis inhibe la síntesis de mRNA y la secreción de hormona de crecimiento, e interfiere con la producción hepática de factor de crecimiento tipo insulina-1.
ALTERACIONES NUTRICIAS
Los pacientes con nefropatía crónica frecuentemente sufren anorexia moderada a grave, náusea y vómito y disfunciones en la motilidad gastrointestinal, lo cual limita de manera importante su inges-
tión alimentaria y la absorción de los nutrimentos.
Además, las modificaciones terapéuticas en el consumo proteínico pueden agravar el estado de nutrición inadecuado.
La ingestión insuficiente de calorías y la detención del crecimiento guardan una relación directamente proporcional. Algunos estudios han
demostrado que mientras el aporte sea menor a 67
a 80% de lo recomendado, el crecimiento disminuye hasta en 34%; en cambio, cuando el consumo es
mayor de 80 a 100% se produce obesidad pero no
recuperación del crecimiento.
La persistencia de condiciones catabólicas conduce a decremento de la masa muscular y se vincula con concentraciones séricas bajas de albúmina y
transferrina por disminución en su velocidad de
síntesis. La disminución en la síntesis de proteínas
debido a alimentación inadecuada y el aumento del
catabolismo contribuyen en conjunto a reducir la
incorporación de las proteínas a procesos biológicos y coadyuvan al aumento en el uso energético
de las mismas. Sin importar la cantidad aportada
por la ingestión, la conversión a proteínas corporales funcionales es menos eficiente en condiciones
de uremia.
194
Sección III • Talla baja por diversos trastornos
Fig. 16-3. Gráfica de crecimiento en el síndrome de Bartter y reacción al tratamiento con indometacina y suplemento de potasio.
Fig. 16-4. Gráfica de crecimiento de un paciente con acidosis tubular renal tratado de manera adecuada a partir de los
tres meses de edad.
La capacidad de síntesis proteínica tisular se
encuentra mermada en parte por la resistencia a la
insulina, de manera que la conversión de proteínas
ingeridas en intracelulares no se lleva a cabo, e
incluso un aumento en la ingestión se relaciona con
mayor utilización energética pero no con la formación de tejidos, lo cual genera obesidad.
Entre las alteraciones nutricias, la anemia ejerce un influjo predominante sobre el crecimiento,
ya sea que se deba a falta de generación de eritropoyetina o de manera agregada a ingestión y aprovechamiento insuficiente de nutrimentos. Desde el
punto de vista teórico, la anemia detiene el crecimiento por varios mecanismos: el apetito disminuido y las infecciones intercurrentes dañan el anabolismo tisular, y la oxigenación deficiente de las
células que constituyen el cartílago de crecimiento
en huesos largos limita el crecimiento óseo. Por otro
lado, la realización adecuada de la cadena respiratoria requiere de concentración intramitocondrial
de oxígeno alta y constante; por tanto, los mecanismos de reducción y oxidación se bloquean en condiciones de hipoxemia, y la eficacia en la producción energética se acentúa, con lo cual se favorece
la persistencia de un estado catabólico crónico.
Capítulo 16 • Crecimiento en enfermedades renales
195
ALTERACIONES HORMONALES
Fig. 16-5. Gráfica de crecimiento de un paciente con acidosis tubular renal con tratamiento incorrecto.
Puesto que en condiciones de uremia es frecuente
observar hemolisis, la hemosiderosis resultante de
este proceso puede producir daño y deficiencia
parcial de hormonas en hipófisis.
OSTEODISTROFIA RENAL
En principio se considera que las alteraciones óseas
metabólicas ocasionan en parte la detención del
crecimiento en niños con insuficiencia renal crónica. Sin embargo, las deformidades esqueléticas
pueden contribuir al retraso en el crecimiento pero
no existe forzosamente un daño paralelo entre las
epífisis y las metáfisis de los huesos largos, y el
crecimiento sólo se frena cuando el hiperparatiroidismo secundario produce destrucción grave de la
estructura metafisaria que incluso puede fracturar
la metáfisis o cuando ocurre desplazamiento epifisario importante. Aun con el uso de dihidroxicolecalciferol (vitamina D3), el crecimiento no mejora.
En condiciones de uremia, se produce resistencia a las acciones de la paratohormona sobre
el hueso, y con ello se limita la mitosis de las células osteoprecursoras y de los condrocitos y
también disminuye la expresión de los receptores para vitamina D. Pero estos efectos son temporales y pueden revertirse, por lo que el lento crecimiento es sensible de recuperación y la estatura
final se sitúa muy cerca de la esperada genéticamente.
Durante la insuficiencia renal se modifica el estado
de homeostasis hormonal. En condiciones fisiológicas el riñón se encarga de degradar 33% de insulina y glucagon, y 67% de proinsulina, péptido C,
paratohormona, hormona de crecimiento y prolactina, a través de la captación peritubular de la membrana basolateral, con degradación lisosómica.
A partir de una disminución de 50% del flujo
glomerular, la depuración de hormonas se reduce
de modo paralelo al descenso del flujo sanguíneo
renal; por tanto, conforme progresa la insuficiencia renal disminuye la captación tubular y peritubular al igual que la depuración extrarrenal (hepática y muscular), y ello origina aumento desproporcionado de las concentraciones séricas de estas
hormonas.
El sistema del eje de crecimiento requiere considerar también que las proteínas transportadoras
de hormona de crecimiento y de somatomedinas no
se eliminan de la circulación cuando se reducen las
funciones renales de excreción y por tanto, pese a
las concentraciones séricas elevadas de éstas, las
fracciones libres están en realidad disminuidas con
el consecuente decremento en su actividad biológica. Por último, se ha demostrado reducción de la
sensibilidad tisular a hormona de crecimiento y
somatomedinas, lo cual se explica por la modificación en la densidad de los receptores tisulares, presencia de sustancias inhibidoras o cambios estructurales del complejo hormona-proteína transportadora-receptor.
Con base en lo anterior es posible considerar
que las alteraciones en el eje de las hormonas de
crecimiento son las siguientes:
1. El niño con uremia se encuentra en un estado
de resistencia tisular a la acción fisiológica de
la hormona de crecimiento, como lo sugiere el
descenso de la expresión del receptor para estahormona y de la producción de factor de crecimiento tipo insulina-1.
2. La actividad biológica de las somatomedinas
decae a causa del aumento de las proteínas
transportadoras circulantes luego de descenso
en su eliminación renal; por ello, pese a concentraciones totales normales de factor de crecimiento tipo insulina-1, las fracciones libres
en que reside la actividad biológica son bajas.
3. En contraste, la sensibilidad del cartílago de
crecimiento a los esteroides sexuales se mantiene o incluso aumenta. En consecuencia, el
crecimiento prepubescente de los pacientes con
insuficiencia renal crónica se caracteriza por
196
Sección III • Talla baja por diversos trastornos
Fig. 16-6. Gráfica de respuesta al tratamiento en un niño con acidosis tubular renal.
reducción en la velocidad de crecimiento; conforme progresa la edad se acentúa la diferencia de estaturas con respecto al promedio poblacional, y además se observa incapacidad de
"recuperación" mediada por el eje de la hormona de crecimiento o somatotrópico. En relación con el crecimiento pubescente, los pacientes con insuficiencia renal crónica poseen
insensibilidad parcial al efecto de los esteroides gonadales en el eje somatotrópico; así, la
secreción diaria de hormona de crecimiento no
aumenta ni se potencia su efecto en el cartílago de crecimiento, pero tampoco se modifica
la sensibilidad del cartílago de crecimiento a
Fig. 16-7. Paciente con síndrome de Silver-Russell (nótese la
hemihipotrofia derecha).
las hormonas sexuales, de manera que el cierre
del cartílago de crecimiento procede normalmente, con lo cual se limita bastante el incremento de estatura vinculado con la pubertad.
Los pacientes sometidos a trasplante presentan recuperación en la sensibilidad del eje
somatotrópico a los esteroides gonadales y es
posible que el brote de crecimiento pubescen-
Fig. 16-8. Gráfica de crecimiento y respuesta al tratamiento
en un paciente con síndrome de Silver-Russell y acidosis
tubular renal.
Capítulo 16 • Crecimiento en enfermedades renales
197
Fig. 16-9. Gráfica de respuesta al tratamiento en un varón con síndrome de Silver-Russell y acidosis tubular renal.
te ocurra sin alteraciones; pero el uso de glucocorticoides a dosis altas puede bloquear casi
por completo los efectos de la testosterona y el
estradiol y al mismo tiempo ocasionar velocidades subnormales de crecimiento. Se ha demostrado que entre la dosis de glucocorticoides y la amplitud de los episodios de secreción
de hormona de crecimiento hay una relación
inversamente proporcional.
4. Las pruebas de estimulación con hormona liberadora de hormona de crecimiento, argini-na,
L-dopa e hipoglucemia inducida por insulina
muestran elevaciones muy acentuadas de
hormona de crecimiento. Paradójicamente, la
hiperglucemia origina elevación marcada de los
valores de hormona de crecimiento aunque por
lo general produce disminución; asimismo, la
aplicación de hormona liberadora de tirotropina intravenosa, que fisiológicamente no modifica esos valores, produce incremento extremo
en pacientes con uremia.
Lo anterior permite comprender por qué la
detención del crecimiento en pacientes con insuficiencia renal debe analizarse de manera individual,
y por qué el crecimiento no mejora en ausencia de
homeostasis completa pese a la corrección de uno
solo de los factores en teoría involucrados en la
estatura baja. Diversos investigadores han demostrado que aun con la corrección de la acidosis, desnutrición y osteodistrofia renal no se observa normalización del crecimiento, por lo que en la actualidad
se realizan diversos estudios para conocer el efecto
de la administración de hormona de crecimiento
humana biosintética bajo homeorrexis. En estas
condiciones es conveniente conocer las acciones del
sistema de la hormona del crecimiento sobre el
funcionamiento renal,
Se ha demostrado que existen receptores para
hormona de crecimiento en túbulos proximales y el
asa de Henle, y para factor de crecimiento tipo insulina-1 a nivel glomerular, túbulos proximales, asa
de Henle, túbulos distales asi como en túbulos colectores corticales y medulares.
La hormona de crecimiento y el factor de crecimiento tipo insulina-1 aumentan la gluconeogénesis y la formación de amonio, y este último también estimula la resorción de fosfato dependiente
de sodio, el transporte transepitelial de sodio, la
velocidad de filtración glomerular, el flujo plasmático renal y la velocidad de crecimiento del riñon.
Sin duda, el uso de hormona de crecimiento
humana biosintética en pacientes con insuficiencia
renal crónica acelera casi al doble la velocidad de
crecimiento durante el primer año de tratamiento;
asimismo, aunque su eficacia disminuye con el tiempo, la estatura mejora en 1.5 desviaciones estándar
en los dos primeros años y dos desviaciones estándar en cuatro años, tanto en relación con el crecimiento del mismo paciente como en estudios con
placebo. Además, la edad ósea progresa de manera
paralela a la cronológica, por lo que se piensa que
es posible alcanzar una estatura final bastante mayor (fig. 16-10).
Los efectos de hormona de crecimiento biosintética durante la pubertad son más difíciles de
198
Sección III • Talla baja por diversos trastornos
Fig. 16-10. Gráfica de crecimiento de un varón con insuficiencia renal crónica.
evaluar, sobre todo porque la velocidad a la que
progresa la edad ósea es mayor que en pacientes
controles, pero el consenso general es que se logra
inducir un brote de crecimiento pubescente de intensidad adecuada, aunque de menor duración que
en pacientes sanos, con lo que la estatura final
mejorará en 1 a 1.5 desviaciones estándar.
La hormona de crecimiento biosintética, además de acelerar la velocidad de crecimiento, produce disminución del tejido subcutáneo (efecto
lipolítico) y mayor incorporación de las proteínas
alimentarias a proteínas tisulares, y esto demuestra
que los efectos de los glucocorticoides utilizados
en la mayoría de los pacientes se contrarrestan por
lo menos durante el primer año de tratamiento.
La hormona de crecimiento aumenta el flujo
glomerular en el riñon, y la hiperfiltración sostenida deteriora la función renal a mediano y largo
plazo; por ello se ha estudiado con detalle este parámetro en pacientes sometidos a trasplante, sin
encontrar diferencias con respecto al grupo placebo a dos y tres años de tratamiento.
Algunos grupos han demostrado que los episodios de rechazo agudo al trasplante renal aumentan en pacientes manejados con hormona de
crecimiento biosintética; sin embargo, otros han
observado que no existe diferencia a tres ni a cuatro años de tratamiento.
La eficacia de la hormona de crecimiento biosintética a distintas dosis se ha estudiado en pacientes con diálisis y sin ella. De ese modo, se ha encontrado que la administración de 1 UI/kg/semana
produce efectos superiores que a dosis menores
(aumenta la velocidad de crecimiento de 2.8 a 5.3
cm/año en pacientes prepúberes, y de 2.9 a 5.9 cm/
año en pacientes púberes); además, en pacientes con
diálisis peritoneal o hemodiálisis el efecto es mejor
que en pacientes que aún no se someten a estos
procedimientos. Asimismo, la eficacia es mayor
cuando el estado acidobásico y la nutrición del paciente son adecuados y cuando la dosis de esteroides se administra en días alternos. Mehls y colaboradores informan que la estatura aumenta en 1.5 y
2 desviaciones estándar luego de 2 y 4 años de tratamiento, respectivamente. Koch y colaboradores
mostraron que en pacientes con insuficiencia renal
crónica y con manejo conservador, la velocidad de
crecimiento aumentó de 4.9 a 8.9 cm/año; este efecto se confirmó en estudios controles con placebo,
en que la velocidad de crecimiento aumentó 2.9 cm
luego de seis meses de tratamiento, mientras que el
incremento fue de 4.2 a 7.3 cm/año en pacientes
con diálisis.
Un grupo de estudio europeo-australiano informa datos similares de velocidad de crecimiento, y
además mediante el análisis del uso de hormona de
crecimiento en la edad ósea demostró que ésta mantiene correlación con el avance de la edad cronológica; también concluyó que el aumento de la creatinina sérica de 204 a 230 y 262 mmol/L en 12 y 24
meses se debe al incremento de la masa muscular, sin
modificar la expectativa de funcionamiento renal.
Todos los estudios anteriores concluyen que,
en pacientes prepúberes, la respuesta observada en
términos de velocidad de crecimiento es mayor en
el primer año e incluso en el segundo año de trata-
Capítulo 16 • Crecimiento en enfermedades renales
miento entre menor sea su edad y su velocidad de
crecimiento y entre mejor sea su funcionamiento
renal residual antes del inicio del tratamiento con
hormona de crecimiento biosintética. La respuesta
en púberes es más diñcil de evaluar por la aceleración que experimenta la edad ósea en esta etapa.
Los efectos de la hormona de crecimiento en
pacientes que han sido sometidos a trasplante son:
aceleración de la velocidad de crecimiento sin que
se modifique la velocidad de progresión de la edad
ósea; ligero aumento en la velocidad de filtración
glomerular sin modificaciones a dos y tres años en
la función renal, y episodios de rechazo en número
similar al observado en pacientes controles. No se
han observado efectos indeseables secundarios al
uso de hormona de crecimiento biosintética; pero
es posible que los pacientes con predisposición
genética presenten elevación en los valores séricos
de insulina, sin deterioro de los de glucemia, y se
acepta que evolucionan con resistencia transitoria
a la insulina, la cual no origina diabetes mellitus.
El incremento de la velocidad de crecimiento
es mayor en pacientes que recibieron trasplante y
en quienes se apegan a tratamiento conservador que
en los sujetos sometidos a diálisis, y es posible que
ello tenga relación con la función renal más baja de
este último grupo. Aun con el uso concomitante de
glucocorticoides y de inmunosupresores se observa un incremento significativo en la velocidad de
crecimiento.
LECTURAS RECOMENDADAS
Arnols WC, Danford D, Holliday MA. Effects of caloric
supplementation on growth in uremia. Kidney Int 1983;
24:205.
Bartosh S, Kaiser B, Rezvani I, Polinsky M, Schulman S,
Palmer J, Baluarte HJ. Effects of growth hormone administration in pediatric allograft recipients. Pediatr
Nephrol 1992;6:68.
Bennet WM, Haymond MW. Growth hormone and lean tissue catabolism during long-term glucúcorticoid treatment. Clin Endocrinol 1992;36:161.
Bojórquez OA. Uso de hormona de crecimiento en pacientes
con insuficiencia renal crónica. En: Calzada RL (ed).
El sistema de la hormona de crecimiento. México:
Litografía Bermúdez, 1995:221.
Challa A, Krieg RJ, Thabet MA, Veldhuis JD, Chain JCM.
Growth hormone secretion and hepatic insuline-like
growth factor-I mRNA in acidotic rats. Am J Soc
Nephrol 1992;3:325.
Cooke RE, Boyden DG, Haller E. The relationship of acidosis and growth retardation. J Pediatr 1960;57:326.
Fine R. Pathophysiology of growth retardation in children
with chronic renal failure. J Pediatr Endocrinol 1994;
7:79.
199
Fine RN. Allograft rejection in growth hormone and nongrowth hormone treated children. J PediatrEndocrinol
1994;7:127.
Hokken ACSK, Hacken WHL, Stijnen T, Wit JM, de Miunick Keizer-Schrama SMPF, Drop SLS. 24-hour plasma
growth hormone (GH) profiles, urinary GH excretion
and plasma insulin-like growth factor I and II levels in
prepubertal children with chronic renal insufficiency and
severe growth retardation. J Clin Endocrinol Metab
1990;71:688
Hokken ACSK. Growth hormone treatment in children
before and after renal transplantation. J Pediatr Endocrinol Metab 1996;9:359.
Janssen F, van-Damme RL, Van MD, Hall M, Proesmans
W, Goos G. Effects of recombinant human growth hormone on graft function in renal-transplanted children
and adolescents: the three-year experience of a Belgian
Study Group Transplant. Proc 1993;25:1049.
Mehls O, Ritz E. Skeletal growth in experimental uremia.
Kidney Int 1983;21(supl):53.
Mehls O, Tonshoff B, Haffner D, Wiihl E, Schaefer F. The
use of recombinant human growth hormone in short
children with chronic renal failure. J Pediatr Endocrinol
1994;7:107.
Potter DE, Najarían J, Belzar F, Holliday MA, Horns G,
Salvatierra O. Long-term results of renal transplantation in children. Kidney Int 1991;40:752.
Powell DR, Liu F, Baker B, Lee PDK, Belsha DW. Characterization of insuline-like growth factor binding protein3 in chronic renal failure serum. Pediatr Res 1993;33:
136.
Rizzoni G, Broyer M, Brunner FP. Combined report of regular hemodialysis and transplantation in Europe, 1985.
Proc EDTA 1986;23:55.
Schaefer F, Hamill G, Stanhope R, Preece MA, Scháer K.
Cooperative study group on puberal development in
chronic renal failure. Pulsatile growth hormone secretion in peripubertal patients with chronic renal failure.
J Pediatr 1991; 119:568.
Scharer K, Gilli G. Growth in children with chronic renal
insufficiency. En: Fine RN, Gruskin AB (eds). End-stage
renal disease in children. Philadelphia: WB Saunders,
1984:27.
Tónshoff B, Veldhuis JD, Heinrich U, Mehls O. Deconvolution analysis of spontaneous and stimulated growth
hormone secretion in prepubertal children with chronic
renal failure. Horm Res 1991;35.
Van Diemen RS, Donckerwolcke RA. Growth and sexual
maturation in paediatric patients treated by dialysis and
following kidney transplantation. Acta Peadiatr Scand
1988;343(supl):109.
Van Es A, on behalf of Team European Study Group. Growth
hormone treatment in short children with chronic renal
failure and after renal transplantation: combined data
from European clinical trials. Acta Paediatr Scand
1992;379(supl):42.
Capítulo
17
Crecimiento en el síndrome
de Turner
El síndrome de Turner se caracteriza por falta total
o parcial del cromosoma X, y se manifiesta por
estatura baja e insuficiencia ovárica de distintas
intensidades.
En toda niña con estatura baja debe sospecharse síndrome de Turner aunque carezca de las características somáticas propias de pacientes con
fórmula cromosómica correspondiente a monosomía regular del cromosoma X (45,XO), ya que según se detalla más adelante la pérdida parcial de
uno de los cromosomas X se relaciona con muy
pocas características físicas específicas o incluso
ninguna de ellas (figs. 17-1 y 17-2). En particular
la deficiencia de más de 10 cm de estatura para la
edad con respecto a lo esperado para las características familiares debe despertar recelos, sin importar si existe o no retraso en la edad ósea. También
es necesario considerar la posibilidad de que exista
síndrome de Turner en toda niña que al nacer tenga
una longitud menor de 48 cm y sobre todo si posee
edema localizado en pies o manos (linfedema).
El diagnóstico se establece mediante análisis
del cariotipo en sangre periférica, pero es importante señalar que la fórmula cromosómica hallada
en los linfocitos no representa por fuerza un fenómeno universal en todas las células somáticas del
organismo; esto explica por qué la estatura de pacientes con cariotipo similar puede variar de manera significativa, y también permite entender las diferencias informadas en la capacidad de sintetizar
estrógenos ováricos con la consecuente variancia
en el inicio y progresión de la pubertad e incluso de
la capacidad reproductora. De hecho, se cree que el
embrión con cariotipo universal 45,XO no es viable y se aborta en el primer trimestre de la gestación, y que, por tanto, los que pueden sobrevivir
200
durante la gestación corresponden a organismos que
contienen ambos cromosomas X en un porcentaje
más o menos indeterminado de las células somáticas.
Fig. 17-1. Paciente con síndrome de Turner por monosomía
regular 45.XO.
Capítulo 17 • Crecimiento en el síndrome de Turner
Fig. 17-2. Paciente con síndrome de Turner por mosaico 45,XO/
46,XX.
La incidencia del síndrome está determinada
sólo para las niñas con monosomía regular en linfocitos, pero mientras se realicen cariotipos en
mujeres con estatura baja, sin fenotipo característico, se observará incidencia cada vez más alta de
monosomías irregulares o "mosaicos" que muestran una fórmula cromosómica 45,XO/46,XX en
porcentaje diverso.
Sin importar la causa que originó la sospecha
diagnóstica, es importante considerar algunas características que se encuentran en la mayoría de las
pacientes con síndrome de Turner y que se relacionan con el fenómeno del crecimiento: fases del
crecimiento, estatura final, edad ósea, masa ósea y
sistema de la hormona de crecimiento.
FASES DEL CRECIMIENTO
La mayoría de las niñas con síndrome de Turner
atraviesan por las siguientes fases de crecimiento:
1. El crecimiento intrauterino se retrasa de manera moderada, y al nacer las afectadas miden
en promedio 3 cm menos que las sanas. Asi-
201
mismo, el crecimiento intrauterino puede limitarse aún más cuando coexiste con disfunciones nutricioplacentarias, y la longitud normal
al nacer no excluye la posibilidad del síndrome. Desde luego existe la posibilidad de nacimiento prematuro, y ello hace más difícil evaluar las diferencias entre una paciente con síndrome de Turner y otra prematura pero sana.
2. Siempre y cuando el crecimiento intrauterino
se haya afectado por alteraciones extrafetales,
durante los primeros seis meses de edad puede
evidenciarse crecimiento de recuperación, que
sin embargo difícilmente sitúa la longitud por
arriba de la percentila 50 poblacional.
En los escasos estudios realizados, es muy
frecuente observar estatura muy cercana o por
debajo de la percentila 3 poblacional a pesar
de medidas diseñadas para permitir el crecimiento de recuperación posnatal.
3. Entre los seis meses y los tres años, la veloci•dad de crecimiento es similar a la que se registra en niñas sanas, por lo que la progresión de
la estatura se mantiene equidistante de la percentila 50 y de la media poblacional, y la velocidad de crecimiento se ubica incluso en la per
centila 25.
4. A partir del tercer año en la mayoría de las pacientes existe disminución de la velocidad de
crecimiento, que origina incremento de la es
tatura menor al esperado de modo persistente,
lo cual poco a poco acentúa el déficit de esta
tura en la etapa prepubescente; esto también
ocurre en 100% de las pacientes durante el
cuarto año.
A los 12 años de edad, las pacientes tienen un déficit promedio de 15 cm, en relación
con lo esperado para sus características epigenéticas familiares. Sin embargo, la estatura en
esta etapa muestra una correlación directamente
proporcional con la talla media familiar, de
manera que se ubica en las percentilas poblacionales "habituales" cuando la estatura de los
padres se localiza por arriba de la media; es
posible que esto dificulte la detección de alteraciones del crecimiento cuando se carece de
análisis periódico completo de este fenómeno
y cuando la estatura mínima esperada de una
mujer no se calcula de acuerdo con las estaturas de los padres.
5. En la mayoría de las pacientes el desarrollo
pubescente no se presenta de manera espontánea debido a falta de producción hormonal
ovárica y por ello tampoco se genera aceleración de crecimiento ("pico o brote" de crecimiento pubescente), con lo cual la estatura
202
Sección III • Talla baja por diversos trastornos
baja es mucho más ostensible en esta etapa. Sin
embargo, la maduración esquelética también
progresa con lentitud y, por tanto, se prolonga
el crecimiento incluso hasta los 15 o 16 años,
de modo que en términos generales hay un
déficit de 7 a 8 cm de estatura atribuido a la
limitación pubescente
ESTATURA FINAL
Los informes de estatura en las mujeres adultas con
síndrome de Turner varían de modo considerable
entre una población y otra, como se muestra en el
ejemplo del cuadro 17-1. La diferencia de hasta 10
cm en pacientes con características genéticas similares se explica con base en factores nutricios o
ambientales capaces de limitar el crecimiento de
cualquier individuo.
El análisis de la descripción del crecimiento
en distintos grupos estudiados permite determinar
lo siguiente:
1. En términos generales, la media de estatura descrita para las pacientes de una población determinada se encuentra 20 cm por debajo de lo
expresado en la percentila 50 poblacional que
corresponde a mujeres en apariencia sanas.
2. El patrón de crecimiento reportado por los distintos autores es sin variación casi paralelo; es
decir, los incrementos de estatura de las pacientes con síndrome de Turner (como grupo) son
muy semejantes, sin importar las características geográficas.
3. La variabilidad de la estatura es en cuantía similar a la observada en población normal, lo
cual confirma que la estatura final obtenida
mantiene una relación en proporción directa
con la estatura epigenética de la familia. De
esa manera, las pacientes que provienen de
Cuadro 17-1. Informes de estatura en mujeres adultas
con síndrome de Turner
Desviación
Estudio
Promedio
estándar
45
136.7
6.9
117
136.9
5.5
90
62
142.3
142.7
6.0
6.4
Lyon
Dinamarca
138
76
142.9
146.8
6.7
6.8
Alemania
46
146.9
7.2
Japón
México
Estados Unidos
Italia
Número
familias altas miden hasta 20 cm más que aquellas provenientes de familias con estatura baja.
En este sentido es posible analizar dos posibilidades:
A. La estatura final esperada es de 170 cm (con
límites de 166 a 174 cm) cuando el padre
y la madre miden 183 y 170 cm, respectivamente. Si una de las hijas de esta pareja
padece síndrome de Turner es muy probable que su estatura final se sitúe en 148 a
152 cm, es decir, muy cercana a la percentila 3 poblacional. Estas características
pueden hacer que el diagnóstico no se sospeche sino hasta cerca de los 10 a 11 años
de edad, cuando se evidencia retraso pubescente o cuando la función ovárica es
relativamente suficiente y la paciente se
somete a revisión médica por amenorrea
primaria o incluso esterilidad.
B. La estatura final esperada es de 150 cm
cuando el padre y la madre miden 163 y
150 cm, respectivamente; por ello, una niña
con el problema genético alcanza una estatura adulta media de 130 cm, muy alejada de la percentila 3 poblacional. En este
caso, es probable que desde la edad escolar la hija se someta a evaluación por estatura baja.
La estatura final de las pacientes con síndrome
de Turner en apariencia mantiene una correlación
adecuada con la talla media familiar. Pero estudios
recientes demuestran que la estatura materna es un
determinante más valioso que la paterna, y que el
coeficiente de correlación entre la estatura de hija y
madre es de 0.334 frente a 0.281 entre madres e hijas
sanas; en cambio, la correlación de la estatura del
padre es de 0.266 en comparación con 0.365 en individuos sanos. Este hecho pudiera sumarse a las evidencias existentes en el sentido de que el cromosoma
X faltante o anormal es de origen paterno y debe
tomarse en cuenta para predecir la estatura final que
alcanzará una niña con síndrome de Turner, ya sea de
manera espontánea o mediante tratamiento médico.
En la actualidad no es concluyente si la estatura final alcanzada se relaciona con el cariotipo en
sangre periférica. Sin embargo, es notorio que las
pacientes con isocromosoma X poseen estatura
bastante menor que aquéllas con monosomía regular, mientras que las portadoras de mosaico 45,XO/
46,XX logran alcanzar las mayores estaturas.
Así entonces, las pacientes con mosaico XO/
XX cuyos padres posean estaturas ubicadas por
arriba de la media poblacional tienen mejor pronóstico de estatura final que aquellas con iso-
Capítulo 17 • Crecimiento en el síndrome de Turner
cromosoma X y padres de estatura baja. En el cuadro 17-2 se observan las diferencias encontradas
en un estudio alemán-austriaco realizado en 1991.
La normalidad del crecimiento debe establecerse utilizando como parámetro de comparación
las tablas diseñadas para grupos de pacientes con
síndrome de Turner, ya que con frecuencia el uso
de gráficas para mujeres sin anomalía conlleva el
riesgo de infraestimar desviaciones pequeñas que
alejan a la paciente de su canal percentilar de crecimiento (figs. 17-3 a 17-5).
De manera similar, cuando el pronóstico de
estatura final se evalúa mediante gráficas de crecimiento es aconsejable emplear modelos construidos de manera específica con pacientes que poseen
síndrome de Turner y además considerar la estatura de los padres y la edad ósea de la paciente.
EDAD OSEA
La maduración biológica progresa en las pacientes
con síndrome de Turner de manera distinta a la
descrita de modo habitual para la población general.
Diversos factores hormonales y ambientales originan velocidad de maduración más lenta que en las
niñas sanas; incluso los estudios de seguimiento
minucioso han descrito que la progresión evoluciona
con periodos de detención seguidos por periodos
de aceleración rápida, cuyo resultado anual sin
embargo implica una maduración menor a 365 días.
Por lo general, desde los 2 a 3 años de edad
empieza a notarse disminución en la velocidad de
la edad ósea. En promedio, de los 4 a los 9 años la
edad ósea se encuentra retrasada un año con respecto a la cronológica; posteriormente muestra
desaceleración más marcada, con retraso de dos
años de los 10 a los 15, y hasta de tres años de los
15 a los 18 años de edad cronológica. La maduración completa o de 100% se logra alrededor de los
20 e incluso 25 años.
Por otro lado, durante el análisis radiográfico
de la edad ósea es necesario tomar en cuenta que la
Cuadro 17-2. Resultados de un estudio alemán-austriaco
(1991) donde se relacionan el cariotipo y la estatura final
Desviación
Cariotipo
45,XO
Número
Promedio
estándar
24
147.0
7.5
46,X,i(Xq)
8
143.0
6.5
45,XO/46,XX
Otros
9
3
149.2
150.4
6.2
8.5
44
146.9
7.2
Total
203
estructura ósea de estas pacientes es distinta y se
caracteriza por trabeculación irregular de los huesos del carpo que puede dificultar su observación
durante los primeros estadios de calcificación, por
lo que la interpretación debe realizarse con cautela.
MASA OSEA
Además de las anormalidades esqueléticas (acortamiento del cuarto metacarpiano, disminución del
ángulo del carpo, deformidad de Madelung y trabeculación irregular de los huesos del carpo), las pacientes con síndrome de Turner manifiestan disminución de la masa ósea.
La determinación de los parámetros aceptados
como índice confiable de masa ósea (grosor cortical y diámetro diafisario) demuestra que existe
déficit de hasta 1.3 desviaciones estándar para el
grosor cortical y de hasta 2.16 desviaciones estándar para el diámetro diafisario en relación con el
promedio poblacional para la edad.
La disminución de la masa ósea se hace más
notable desde los ocho años de edad, y alcanza su
máximo a los 13 años, pero en edades posteriores
se comporta de manera similar que en mujeres
posmenopáusicas. Así entonces, parece evidente que
la masa ósea guarda una relación directamente proporcional con la deficiencia en la producción ovárica de estrógenos, si bien pudiera estar incrementada por la disminución concomitante observada en
la hormona de crecimiento y en sus efectos.
Existen muy pocos estudios en los que se haya
analizado la masa ósea mediante densitometría y
ellos confirman los hallazgos ya mencionados; esto
demuestra que la disminución de masa ósea en relación con los pacientes controles se debe a un fenómeno esquelético universal para cada organismo.
La causa de disminución en la masa ósea parece ser de manera predominante menor captación y
retención de minerales (calcio y fósforo) en el sistema esquelético, pero también la síntesis inadecuada del tejido de sostén y pérdida acelerada del
mineral óseo.
SISTEMA DE LA HORMONA DE
CRECIMIENTO
Los estudios encaminados a analizar la secreción
de hormona de crecimiento, tanto espontánea como
inducida por fármacos, han mostrado que las características de pacientes con síndrome de Turner
son similares a las de personas sanas de su misma
edad y sexo, por lo que al menos en edades prepubescentes habituales no debe afirmarse a priori que
existe déficit de esta hormona, y cualquier sospe-
204
Sección III • Talla baja por diversos trastornos
Fig. 17-3. Curvas de talla acumulada en pacientes mexicanas con síndrome de Turner (líneas continuas) y su comparación con
niñas europeas con el mismo padecimiento (líneas discontinuas).
cha de disfunción en este sentido debe valorarse y
en su caso demostrarse. Sin embargo, de manera
universal desde los ocho años de edad disminuyen
de manera significativa las concentraciones séricas
de factor de crecimiento tipo insulina-1 y de proteína transportadora de factor de crecimiento-3 tipo
insulina-1, así como la secreción espontánea de
hormona de crecimiento; es probable que estos
descensos se deban a hipoestrogenismo y se restablezcan con la administración de etinilestradiol.
Por otro lado la progresión de la edad ósea y la
reducción de la velocidad de crecimiento, así como
de las concentraciones de factor de crecimiento tipo
insulina-1 y proteína transportadora-3 de factor de
Fig. 17-4. Gráfica de crecimiento de niñas mexicanas con síndrome de Turner, comparadas con niñas normales (de acuerdo con
el estudio del doctor Ramos Galván).
Capítulo 17 • Crecimiento en el síndrome de Turner
Fig. 17-5. Velocidad de crecimiento en niñas mexicanas
con síndrome de Turner en comparación con velocidad de crecimiento de niñas mexicanas normales.
crecimiento tipo insulina-1 deben considerarse
marcadores relativamente adecuados de la función
ovárica; esta situación es en particular importante
en las niñas con cariotipos 45,XO/46,XX.
Sin importar las características de crecimiento
de las pacientes con síndrome de Turner, es necesario considerarlas un organismo completo; por
eso es importante estudiar la posibilidad de enfermedades orgánicas y psicomotrices descritas de
modo habitual en relación con la alteración del
cariotipo, y evaluar con periodicidad el estado general de salud y el posible efecto de las condiciones socioeconómicas y culturales. Una vez establecido el diagnóstico, es de valor especial descartar o
confirmar la existencia de las siguientes entidades
patológicas:
1. Estenosis aórtica. Es importante realizar un
electrocardiograma y una telerradiografía de tórax, ya sea que se detecte o no la existencia de
soplo sistólico. La frecuencia de cardiopatías
es de 20% en promedio.
2. Alteraciones renales. Pueden incluir desde
agenesia renal unilateral, riñon ectópico y riñón en herradura hasta reflujo vesicoureteral.
Las afectadas requieren de evalución a través
de pruebas de funcionamiento renal que inclu
yen desde un examen general de orina y determinación de la depuración de creatinina hasta
un ultrasonido renal y urografia excretora, y si
es necesario también cistouretrografía. Se in
forma que hasta 40% de las pacientes padece
alguna anormalidad renal.
3. Alteraciones en oído medio. Abarcan desde hipoplasia del conducto auditivo externo hasta
hipoacusia, y hay predisposición marcada a in-
205
fecciones de oído medio relacionadas o debidas a infecciones de garganta, nariz y senos
paranasales.
4. A partir de los seis a siete años de edad se apre
cia un incremento en la incidencia de tiroiditis
linfocíticas crónicas que en principio se carac
terizan sólo por aumento de consistencia de la
tiroides y más tarde originan crecimiento pau
latino y disminución de la función. El hipotiroidismo resultante puede modificar el creci
miento y la capacidad de adecuación a activi
dades académicas. El diagnóstico tiene que
establecerse luego de detectar incremento de
consistencia de la glándula, y es conveniente
confirmarlo mediante pruebas de función tiroi
dea con anticuerpos y biopsia por aspiración
con aguja fina.
5. Aunque en los primeros informes de la litera
tura médica se menciona que el coeficiente in
telectual de las pacientes es menor que el de la
población general, los estudios actuales muestran, sin lugar a dudas, que el coeficiente es
normal, y que el rendimiento escolar es similar al de la población. Incluso algunos estudios
han comprobado que la incidencia de problemas mentales, cuando existen, es menor en
pacientes con cariotipo 45,XO (18%) que en
pacientes con otras fórmulas cromosómicas
(32%).
Las pacientes con síndrome de Turner
poseen un nivel académico máximo similar al
de sus hermanas, pero registran mucho mayor
índice de desempleo (media de 23% con límites de 6 a 50%) que ellas y que las pacientes
con otras fórmulas cromosómicas, lo cual ha
tratado de explicarse con base en el aspecto
físico que las sitúa en condición de desventaja
en relación con el resto de las aspirantes a un
trabajo y con base en el aumento considerable
de la competencia por encontrar empleos bien
remunerados desde 1970. Sin embargo, no
parece haber diferencia estadística relacionada
con la estatura o coeficiente intelectual entre
aquellas que consiguen y mantienen un trabajo remunerado y aquellas que no lo consiguen
o que lo pierden. Otro hecho de importancia
es que 35% de las pacientes nunca ha tenido
pareja sexual, y que 15% adicional no ha conseguido una relación estable de pareja; esto puede deberse a falta de información y educación,
a terapia estrogénica insuficiente o faltante,
o a que hasta 52% de las mujeres adultas con
síndrome de Turner tienen problemas con la
autoimagen y seguridad, y no aceptan ser portadoras de un trastorno orgánico.
206
Sección III • Talla baja por diversos trastornos
El tratamiento hormonal de las pacientes con
síndrome de Turner está fuera de los propósitos de
esta obra, pero no pueden dejar de mencionarse las
conclusiones de los diversos estudios de intervención que se han realizado.
Hormona de crecimiento
Cuando la estatura final esperada es menor a 150
cm es posible considerar el uso de hormona de crecimiento humana biosintética. Como se ha demostrado para otros grupos de pacientes, el efecto es
mejor a menor edad, menor edad ósea y menor
velocidad de crecimiento previas al inicio de la terapéutica.
La dosis recomendada es de 1.0 U/kg/semana,
dividida en siete días, con aplicación nocturna. La
aceleración en la velocidad de crecimiento durante
el primer año de tratamiento varía entre 4 y 7 cm/
año; disminuye en 20 a 25% durante el segundo
año, y hasta 50% en el tercer año.
En pacientes menores de 10 años de edad se
recomienda administrar sólo hormona de crecimiento, y no se ha observado utilidad en la combinación
de ésta y anabólicos del tipo de la oxandrolona, o
estrógenos.
En pacientes mayores de 10 años de edad se
recomienda combinar el tratamiento de hormona
de crecimiento con etinilestradiol, pero sólo durante
el primer año de manejo y con la finalidad de
aumentar la ganancia de estatura.
El estudio alemán en que se evalúa el tratamiento de 228 pacientes concluye que los mejores resultados se obtuvieron con la combinación de hormona de crecimiento en dosis de 0.8 U/kg/semana
(en especial la obtenida por ingeniería genética a
través de células de mamífero) y oxandrolona en
dosis de 0.05 a 0.1 mg/kg/día.
Estrógenos
En la media de la población sin insuficiencia gonadal se observa incremento de las concentraciones
séricas de estradiol a partir de los siete años de edad,
con valores mayores a 50 pg/ml a los nueve años,
y pulsatilidad a partir de los 11 años. Por ello se ha
recomendado el uso de estrógenos en las pacientes
con síndrome de Turner a partir de las mismas edades, aunque su mayor inconveniente es que producen aceleración en la velocidad de maduración esquelética, lo cual puede disminuir la eficacia de la
hormona de crecimiento si ésta no se utiliza en
combinación desde el principio del tratamiento.
Para la inducción de la pubertad se recomienda el uso de etinilestradiol por vía oral a dosis ba-
jas, o la aplicación transdérmica de 17-beta-estradiol. En ese sentido existen algunas controversias;
pero el consenso general es que el tratamiento debe
iniciarse una vez que la pubarquía aparece de manera espontánea, y que sus efectos son subóptimos
cuando la paciente ya alcanzó un estadio equivalente a la etapa cuatro de vello púbico de acuerdo
con la clasificación de Tanner y Marshall. La maduración mamaria progresa con más lentitud que
en la población general, y en término medio se requieren de tres a cuatro años para lograr un desarrollo mamario completo, aunque el volumen final
alcanzado es menor que el de otras mujeres de la
misma familia.
La administración de estrógenos, cuando está
indicada, debe hacerse en menor dosis posible, y
durante ella es necesario evaluar la respuesta clínica de la paciente y el grosor del endometrio uterino
mediante ultrasonido, ya que existe la posibilidad
de que ocurra hiperplasia de este último.
La eficacia y los resultados finales del tratamiento estrogénico sustitutivo varían de acuerdo con
la sensibilidad individual, por lo que cada caso
requiere de análisis específico para definir la dosis mínima requerida en los distintos momentos
del desarrollo y la que se mantendrá a partir de entonces.
Además de los datos de crecimiento y de desarrollo pubescente ya señalados, la terapia sustitutiva estrogénica mejora sensiblemente la masa ósea
de las pacientes y evita, por tanto, la instalación de
osteoporosis temprana.
LECTURAS RECOMENDADAS
Altamirano BN. Tratamiento de pacientes con síndrome de
Turner con hormona de crecimiento humana biosintética.
En: Calzada RL (ed). El sistema de la hormona de
crecimiento. México: Bermúdez, 1995:213.
Armendares S. Síndrome de Turner. Diagnóstico y manejo
terapéutico. México: Salvat, 1979.
Bemasconi S, Ghiconi L, Volta C, Morano M, Giovanelli
G. Spontaneous growth hormone secretion in Turner's
syndrome. J Pediatr Endocrinol 1992; 101.
Brook GDC, Miirset G, Zachmann M, Prader A. Growth in
children with 45 X0 Turner syndrome. Arch Dis Child
1974;49:789.
Butenandt O, Schmitt S. Metabolic aspects in growth hormone treatment of Ulrich-Turner syndrome. J Pediatr
Endocrinol Metab 1992;5:95.
Conte F, Grumbach M, Kaplan S. A disphasic pattern of
gonadotropin secretion in patientes with the syndrome
of gonadal dysgenesis. J Clin Endocrinol Metab 1975;
40:670.
Capítulo 17 • Crecimiento en el síndrome de Turner
Fernandez AL, Basterra C (eds). Second International
Turner contact group meeting. Stockholm: Kabi Pharmacia Peptide Hormones, 1995:1.
Joss EE. Anabolic steroids in girls with Turner's syndrome.
Acta Paediatr Scand 1988;343:38.
Kastrup KW/Turner Study Group. Estrogen therapy
in Turner's syndrome. Acta Paediatr Scand 1988;343:43.
Lippe B, Rosenfeld RG & Genentech Collaborative Group.
Treatment of Turner's syndrome with recombinant human growth hormone. Acta Paediatr Scand 1988;343:47.
Lyon AJ, Preece MA, Grant DB. Growth curve for girls
with Turner syndrome. Arch Dis Child 1985;60:932.
Naeraa R, Nielsen J. Standards for growth and final height
in Turner's syndrome. Arch Dis Child 1985;60:932.
Nilsson OK/Swedish Paediatric Group for Growth Hormone
Treatment. The Swedish somatonorm Turner trial: twoyear results. Acta Paediatr Scand 1989;356:160.
Page LA. Final height in 45 X0 Turner's syndrome with
spontaneous sexual development. Review of European
and American Reports. J Pediatr Endocrinol 1993;6:153.
Ramos RG, Rostenberg I, Armendares S. Somatometric
profile in patients with Turner's syndrome. Rev Invest
Clin Mex 1976;28:219.
207
Ranke MB, Pfluger H, Rosendahl W. Turner syndrome:
spontaneous growth in 150 cases and review of the literature. Eur J Pediatr 1983; 141:81.
Ranke MB, Stubbe P, Majewski F, Bierich JR. Spontaneous growth in Turner's syndrome. Acta Paediatr Scand
1988;343 (supl):22.
Robles VC, Altamirano BN, Calzada RL. Results of 1-year
growth hormone treatment in nine girls with Turner's
syndrome. Acta Paediatr Scand 1991;372:156.
Stahnke N, Attanasio A, van den Broeck J, Partscj CJ, Zeisel
HJ. GH treatment studies to final height in girls with
Turner syndrome-the German experience. En. Albertsson KW, Ranke MB (eds). Turner Syndrome in a life
span perspective: research and clinical aspects. Amsterdam: Elsevier Science BV, 1995:95.
Van der Schueren ML, Massa G, Maes M. Growht-promoting effect of growth hormone and low-dose ethinyl estradiol in girls with Turner's syndrome. J Clin Endocrinol
Metab 1990;70:122.
Zamboni G, Antoniatzzi F, Tato L. Recombinant human
growth hormone replacement therapy and bone metabolism in children. J Pediatr Endocrinol Metab 1993;6:33.
Capítulo
18
Deficiencia de hormona
de crecimiento
En el presente capítulo se describen y analizan de
manera crítica las características clínicas que permiten establecer la sospecha diagnóstica de deficiencia de hormona de crecimiento, y además se
exponen las controversias al respecto.
En primer lugar, las manifestaciones clínicas
de la deficiencia de hormona de crecimiento pueden variar de acuerdo con la etiología entre un
paciente afectado y otro, y además se modifican con
la edad y gravedad del trastorno, por lo que incluso
en un mismo individuo es posible encontrar diferencias en la descripción, entre dos momentos distintos de la vida.
La investigación sobre la capacidad de secreción hipofisaria de hormona de crecimiento se realiza en gran número de individuos con estatura baja.
Por esta razón en la actualidad debe asumirse que
en principio existe deficiencia de esa hormona en
todo individuo con secreción espontánea disminuida de hormona de crecimiento, suficiente para condicionar que su estatura se sitúe por fuera de los
rangos establecidos como habituales para una población. Asimismo, el calificativo de insuficiente
de hormona de crecimiento puede aplicarse a un
gran porcentaje de individuos en situaciones como
talla baja familiar, talla baja idiopática, sobrevivientes de desnutrición crónica y de enfermedades sistémicas, retraso de crecimiento intrauterino, e incluso en niños con maltrato físico y deprivación
afectiva; por ello ha podido establecerse que las
únicas características comunes en estos pacientes
son estatura más de dos desviaciones estándar por
debajo del promedio poblacional (con excepción
de las deficiencias transitorias de hormona de crecimiento), velocidad de crecimiento baja, edad ósea
208
retrasada, y armonía en las proporciones corporales durante la infancia. A los grupos mencionados
es conveniente agregar las enfermedades que se
caracterizan por resistencia periférica a la hormona
de crecimiento y aquéllos con falta de producción
de factor de crecimiento tipo insulina-1, las cuales
se analizarán en capítulos posteriores.
Con base en lo anterior, es evidente que existe
dificultad para establecer la frecuencia con que se
presenta deficiencia de hormona de crecimiento en
una población determinada, con excepción de la
denominada deficiencia de hormona de crecimiento "clásica", que se encuentra en uno de cada 6 000
a 30 000 niños.
Las características generales de los pacientes
con deficiencia de hormona de crecimiento son
estatura baja y velocidad de crecimiento subnormal, edad ósea retrasada y armonía en las proporciones corporales. A continuación se detallan cada
una de ellas.
TALLA BAJA Y VELOCIDAD
DE CRECIMIENTO SUBNORMAL
Los niños con deficiencia de hormona de crecimiento deben necesariamente de crecer poco, pero esto
es una condición relativa y no absoluta, ya que
aunque son más bajos que otros niños de su edad y
población, y expresan crecimiento menor al esperado para su genotipo, no todos ellos tienen estatura baja ni toda la estatura baja se acompaña de
deficiencia de hormona de crecimiento. Por ejemplo, es posible que la deficiencia sea transitoria y
no evolucione con alguna manifestación, excepto
por disminución en la velocidad de crecimiento y
Capítulo 18 · Deficiencia de hormona de crecimiento
209
ligero retraso en la edad ósea, como sucede en niños con deprivación emocional.
A largo plazo todos los pacientes con deficiencia de hormona de crecimiento muestran estatura
inferior a la observada en la población general; pero
es necesario considerar que la estatura al nacer es
normal en la mayoría de ellos y sólo a partir de los
3 a 6 meses de edad es evidente la diferencia de
centímetros, que se acentúa partir de los dos años.
La excepción la constituye la denominada deficiencia congénita de hormona de crecimiento, que se
caracteriza por talla baja prenatal.
En hermanos gemelos es relativamente sencillo establecer la sospecha diagnóstica frente a diferencia notable de estatura, la cual debe atribuirse a
alteración intrínseca, ya que las condiciones sociales, nutricias y educación se asumen como similares (figs. 18-1 a 18-3).
La sospecha de deficiencia de hormona de crecimiento después de los dos años de edad también
Fig. 18-2. Proporcionalidad corporal en gemelos: sano (atrás)
y con deficiencia de hormona de crecimiento (adelante).
Fig. 18-1. Hermanos gemelos, sano (izquierda) y con deficiencia congénita de hormona de crecimiento (derecha).
debe conducir a pensar en la posibilidad de que
existan alteraciones nutricias, sobre todo cuando
éstas prevalecen en la población, ya que en países
en desarrollo es frecuente que la estatura baja se
deba a subexpresión de la capacidad genética de
crecimiento por falta de aporte calórico o proteínico y que sin variación se acompañe de velocidad
de crecimiento inferior a la esperada para la edad.
También es común encontrar infestaciones o infecciones crónicas, relacionadas con desnutrición, que
comprometen la homeostasis corporal y en su caso
facilitan o acentúan el catabolismo. Esta consideración es importante porque la secreción de hormona de crecimiento espontánea e inducida por
medicamentos (hormona liberadora de hormona de
crecimiento, clonidina, arginina, insulina, etc.) disminuye en estados catabólicos crónicos secundarios a deprivación calórica (relacionada o no con
infecciones e infestaciones), aunque no en deprivación proteínica pura, lo cual puede originar confusión para diagnosticar deficiencia de esa hormona,
sobre todo cuando el trastorno nutricio se agudiza
por falta de aporte reciente o por infecciones concomitantes que en combinación reducen la tasa de
velocidad de crecimiento de manera sustancial. Lo
anterior también es válido para pacientes con alte-
210
Sección III • Talla baja por diversos trastornos
Fig. 18-3. Micropene en el hermano gemelo con deficiencia de hormona de crecimiento (derecha) y su comparación
con el hermano sano (izquierda).
raciones graves y crónicas en la función renal, enteral, hepática y cardiaca.
El grupo de pacientes que sufre retraso de crecimiento intrauterino, y en los dos primeros años
de la vida no muestra crecimiento de recuperación,
tiende a permanecer con estatura ubicada más de
dos desviaciones estándar por debajo de la media y
con velocidad de crecimiento en los límites inferiores, lo que puede constituir un factor de confusión en el diagnóstico de deficiencia de hormona
de crecimiento.
El análisis de la velocidad de crecimiento requiere considerar que la definición de "normalidad"
en este parámetro no es tan clara ni tan fácil como
establecer talla baja. Algunos estudios han demostrado que los niños que aumentan su estatura de
acuerdo con lo señalado en la percentila 3 de estatura acumulada, registran velocidad de crecimiento en general superior a la percentila 25, por lo que
se considera que un incremento anual de estatura
inferior a lo establecido para la percentila 10 implica sin duda velocidad de crecimiento subnormal, e
incluso algunos autores proponen como límite de
normalidad la percentila 25. Sin embargo, también
es cierto que individuos con retraso constitucional
del crecimiento y pronóstico de estatura final normal, que, por tanto, no son insuficientes en la producción de hormona de crecimiento, pueden mostrar velocidades de crecimiento inferiores a la percentila 3, en particular cuando se compara su crecimiento con la edad cronológica de individuos que
ya iniciaron el brote de crecimiento pubescente.
Por otro lado, es necesario considerar que la
velocidad de crecimiento depende de la exactitud
en la medición de la estatura durante dos ocasiones
separadas por un lapso determinado, idealmente de
365 días y, por tanto, la obtenida en lapsos meno-
res de un año es poco confiable si no se utiliza un
estadímetro preciso, ya que entonces la diferencia
inexacta de 0.1 cm en el lapso de un mes suma una
disminución anual de 1.2 cm y genera una apreciación equivocada. Lo mismo sucede cuando en cada
ocasión el paciente se mide en estadímetros distintos o por dos personas diferentes, ya que las variaciones interensayo e intraensayo suelen ser hasta
de 0.5 a 1 cm; además, la velocidad de crecimiento
se describe en relación con la edad cronológica
y no con la edad ósea de un individuo, pero por
acuerdo internacional el crecimiento en condiciones patológicas debe analizarse en relación con esta
última, lo cual dificulta la comparación con velocidades de crecimiento de individuos sanos y la definición de progresión normal del crecimiento.
Los resultados de medición de la estatura muestran variaciones diurnas, que son mayores en la
mañana que en la tarde y en la noche. La velocidad
de crecimiento tampoco es constante día a día durante un año, sino que existen variaciones significativas de crecimiento estacional, ya que durante
otoño e invierno las velocidades de crecimiento son
más bajas y durante la primavera y el verano se
tornan mayores; estas diferencias con facilidad
pueden ser mayores de 2.5 cm, por lo que se acepta
que las determinaciones de la velocidad de crecimiento cada cuatro a seis meses tienen muy poca
predictibilidad sobre el crecimiento anual real.
EDAD OSEA RETRASADA
La edad ósea representa la valoración de la maduración del individuo, es decir, la distancia que ha
recorrido entre su punto inicial y final. Aunque
existen patrones generales de maduración esquelética, el orden en que ocurren los fenómenos varia
de un individuo a otro. Por ejemplo, en la mano
hay una secuencia invariable y constante para cada
hueso, pero es diferente entre un individuo y otro
para el conjunto de huesos; es decir, existen 30
secuencias distintas de maduración si se considera
cada uno de los huesos del carpo, metacarpo, falanges, cubito y radio.
Por otro lado, la relación entre edad ósea y edad
cronológica no es por fuerza constante entre dos o
más poblaciones, ni de una época a otra en la misma población, y es asimismo variable entre dos
regiones anatómicas del mismo individuo.
La edad ósea en pacientes con deficiencia de
hormona de crecimiento se encuentra retrasada con
respecto a la cronológica (incluso en la mayoría de
las deficiencias transitorias), pero el grado es variable y pueden existir diferencias mínimas entre
menores de dos años, y límites de 2 a 6 años de
Capítulo 18 • Deficiencia de hormona de crecimiento
retraso a la edad de 12 años. El retraso de tres o
más años en la edad ósea con respecto a la cronológica obliga siempre a tomar en cuenta la posibilidad de alteraciones concomitantes, como hipotiroidismo hipofísario o hipotalámico, disfunciones
orgánicas (nefropatías, cardiopatías, etc.) y alteraciones nutricias y parasitosis.
En estados de malnutrición y en niveles socioeconómicos bajos, la edad ósea evoluciona con lentitud en comparación con individuos bien nutridos
de la misma población, y es probable que existan
diferencias de 1 a 1.5 años entre estos dos grupos,
que aunado a la variación "permitida" en condiciones fisiológicas puede originar disparidad de hasta
dos años; esto junto con estatura baja, velocidad de
crecimiento subnormal y falta de respuesta en la
secreción de hormona de crecimiento conlleva el
riesgo de sobrediagnosticar deficiencias hormonales, en particular deficiencia de hormona de crecimiento.
ARMONÍA DE LAS PROPORCIONES
CORPORALES
El crecimiento esquelético sobre todo en la etapa
posnatal se produce de modo fundamental por la
regulación del sistema de la hormona de crecimiento, de manera que la progresión del crecimiento óseo
se afecta hasta en 60 a 75% ante concentraciones
bajas de hormona de crecimiento o de factor de
crecimiento tipo insulina-1 o ambos.
En condiciones fisiológicas, la velocidad de
crecimiento de las extremidades es mayor que la
del tronco, de modo que las relaciones entre los
segmentos superior e inferior y entre brazada y
estatura son en progresión más cercanas a 1.0 y 0,
respectivamente, conforme avanza la maduración
somática. Las proporciones corporales del paciente con deficiencia de hormona de crecimiento pueden ser anormales si se comparan con las esperadas para la edad cronológica; pero son adecuadas
en relación con la edad ósea, por lo menos durante
la etapa prepubescente. A partir de la pubertad, sobre
todo cuando existe retraso durante el inicio, hay leve
disarmonía somática que se acentúa hasta llegar a
la edad adulta; así, el segmento inferior es ligeramente más corto que el superior en relación con lo
que se observa en pacientes sin deficiencia de hormona de crecimiento, de manera que se conservan
proporciones "infantiles" muchas veces sólo apreciables mediante somatometría detallada.
Los pacientes con alteraciones nutricias con
frecuencia sufren modificaciones en las proporciones corporales, ya que el segmento inferior (ecosensible) tiende a mostrar mayor repercusión en la
211
velocidad de crecimiento que el superior (ecorresistente); sin embargo, existe la posibilidad de esta
diferencia sea de tan poca magnitud que no permita la distinción entre este tipo de pacientes y aquéllos con deficiencia de hormona de crecimiento. En
pacientes con retraso de crecimiento intrauterino
sin recuperación temprana también es posible observar características somatométricas similares,
aunque en estos casos es habitual que el segmento
superior se afecte más que el inferior; asimismo,
puede ocurrir "normalización" de las proporciones
corporales que neutralice la desproporción intrauterina cuando se agrega una enfermedad crónica o
desnutrición que limita el crecimiento del segmento inferior con más intensidad que el del superior.
CARACTERÍSTICAS CLÍNICAS
La deficiencia de hormona de crecimiento debe
sospecharse en pacientes con estatura baja, velocidad de crecimiento baja, edad ósea atrasada, armonía en las proporciones corporales, ingestión adecuada de nutrimentos y sin antecedentes de peso o
estatura bajas al nacimiento ni de padecimientos
orgánicos crónicos o alteraciones emocionales o
psiquiátricas. Pero además existen causas etiopatogénicas que agregan manifestaciones útiles en el
manejo diagnóstico del paciente.
La clasificación de uso actual para la deficiencia de hormona de crecimiento tiende a facilitar el
abordaje clínico de los pacientes (fig. 18-4):
1. Deficiencia idiopática de hormona de crecimiento o "forma clásica", con o sin antecedentes de trauma perinatal. Los afectados muestran una o más de las siguientes características:
A. Edad gestacional normal, ya que no hay
relación del padecimiento con los nacimientos prematuros.
B. Menor adaptación extrauterina que se manifiesta por una calificación menor a siete
en los cinco minutos de vida neonatal según la escala de apgar (5.2% frente a 1.2%
en niños sin esta deficiencia hormonal), y
ello sugiere hipoxia neonatal.
C. Con frecuencia, presentación no cefálica
al final del embarazo ( l i a 62%), ya que la
pélvica es la más observada (7.1% comparado con 2.8% en niños sin esta deficiencia hormonal).
D. La resolución del embarazo mediante extracción abdominal (cesárea) es más habitual en pacientes que más tarde desarrollan deficiencia de hormona de crecimien-
212
Sección III • Talla baja por diversos trastornos
Fig. 18-4. Sitios de alteración en el sistema de la hormona del crecimiento.
to (16.6%) que en aquellos que no lo hacen (10.4%)
E. El análisis del neonato con desarrollo posterior de deficiencia de la hormona de crecimiento muestra que la estatura y el peso
se sitúan por debajo del promedio poblacional. Los pacientes con deficiencia de
origen orgánico se afectan menos que aquéllos con deficiencia idiopática ya que en el
primer caso la estatura y peso se ubican en
-0.08 y -0.22 desviaciones estándar, respectivamente, mientras que en el segundo
caso estas características corresponden a
-0.87 y -0.6 desviaciones estándar, respectivamente.
F. Cuando el único antecedente de la deficiencia idiopática posterior es la presentación
pélvica, el crecimiento durante el primer
año de la vida está menos afectado que
cuando existen otros antecedentes perinatales tanto únicos como relacionados;
en el primer caso la estatura se ubica en
—0.91 ± 1.34 desviaciones estándar, mientras que en el segundo caso la estatura se
ubica en -2.7 ± 0.86 y -2.02 ± 1 des
viaciones estándar, en varones y mujeres
respectivamente.
G. Sólo en la deficiencia idiopática se observan diferencias entre varones y mujeres en
proporción de tres a uno.
2. Deficiencia orgánica de hormona de crecimiento. Se ha demostrado que existen alteraciones en los genes de hormona liberadora de
hormona de crecimiento y hormona de crecimiento, sin que durante la exploración física
se encuentren datos que distingan estos dos
subgrupos. Además se han descrito vinculaciones entre la deficiencia de esa hormona y los
siguientes:
A. Malformaciones de la línea media cráneofacial, entre ellas displasia septoóptica, síndrome de silla turca vacía, incisivo central
único, paladar hendido, quiste aracnoideo,
hidrocefalia congénita y labio leporino.
B. Síndromes genéticos como la pancitopenia
de Fanconi (aplasia de médula ósea e hiperpigmentación cutánea con alteraciones
radiales en extremidades), síndrome de
Rieger (displasia del iris, hipoplasia dental, atrofia óptica, microcórnea y glaucoma), displasia ectodérmica con o sin
paladar hendido (hipoanhidrosis/anhidrosis, distermias, hipoplasia de cabello y
dientes).
Capítulo 18 • Deficiencia de hormona de crecimiento
C. Infecciones congénitas, con predominio de
rubéola, pero también toxoplasmosis, citomegalovirus y herpes.
D. Tumores intracraneales de cualquier etiología, pero predominan craneofaringioma,
astrocitoma, gliomas, disgerminoma, ependimomas y meduloblastomas. En estos
casos con frecuencia hay datos de masa
ocupativa, entre ellas cefalea, vómito, al
teraciones visuales, motoras y sensitivas,
así como otras deficiencias de la hipófisis
de las cuales la diabetes insípida es la más
habitual.
E. Lesiones intracraneanas adquiridas: traumatismo craneoencefálico, hidrocefalia, infecciones, histiocitosis y enfermedades
granulomatosas.
3. Deficiencias genéticas de hormona de crecimiento. Pueden heredarse con carácter autosómico recesivo o dominante o ligadas al cromosoma X, y muchas de ellas evolucionan con
hipopituitarismo congénito total o parcial; se
estima que uno de cada 4 000 a 10 000 nacidos vivos presenta este tipo de deficiencia, y
que hasta 5 a 30% de los pacientes cuenta con
otro familiar afectado.
A. El tipo IA se hereda con patrón mendeliano autosómico recesivo y es la forma más
grave de deficiencia de hormona de creci
miento, con valores séricos indetectables
tanto en condiciones básales como luego
de estímulo con agentes farmacológicos.
El defecto molecular se sitúa en el gen
que codifica para la hormona hipofisaria,
y ocurre deleción de tamaño variable de
ambos alelos que casi siempre consiste en
la pérdida de 6.7 kilobases (70% de los
casos). Las diferencias existentes en el origen geográfico de los pacientes y la heterogeneidad observada en los haplotipos
sugieren que estas deleciones representan
fenómenos recombinacionales independientes. Además existe consanguinidad en
elevado número de familias afectadas, lo
cual sugiere que los pacientes heredan los
dos alelos mutantes idénticos.
En estos casos, el tratamiento con hormona de crecimiento biosintética se relaciona con la formación de anticuerpos que
inhiben en un lapso breve el efecto del
agente farmacológico utilizado, con pérdida del crecimiento en el primer mes.
B. El tipo IB se hereda de manera autosómica
recesiva y se relaciona con niveles plasmáticos bajos pero detectables de hormona de
213
crecimiento en pruebas de estimulación farmacológica. Todavía se desconoce el locus
afectado y las alteraciones responsables de
esta enfermedad, pero se supone que existe activación parcial o procesamiento
anómalo del producto del gen que codifica
para hormona liberadora de hormona de
crecimiento.
C. El tipo II se transmite de manera autosómica dominante. La alteración genética
parece residir en un alelo del intrón III del
gen para hormona de crecimiento; también
se han descrito sustituciones de un nucleótido en la secuencia 5' donante para el empalme de ácido ribonucleico mensajero,
sustituciones simples y deleciones de 18
pares de bases. Todas estas alteraciones
producen el mismo efecto en el procesa
miento postranscripcional del ácido ribonucleico, con lo que se origina escape o
pérdida del exón tres del ácido ribonucleico maduro del gen. La proteína mutante que
resulta es la hormona de crecimiento de
17.5 kDa, que carece de los aminoácidos
32 a 71, incluyendo un residuo de cisteína.
D. El tipo III se transmite con carácter recesivo ligado al cromosoma X y todos los varones afectados presentan también hipogammaglobulinemia. El defecto genético
parece localizarse en la región 21.3 a 22
del brazo largo del cromosoma X y en un
locus contiguo, probablemente necesario
para la expresión de la hormona de crecimiento.
E. Se ha descrito la relación de la deficiencia
de hormona de crecimiento con deficiencia de hormonas suprarrenocorticotrópica,
estimulante de la tiroides, luteinizante y foliculostimulante (panhipopituitarismo). La
mayoría de los casos notificados son esporádicos, pero existen familias en que se
transmite de manera autosómica recesiva
(tipo 1) o ligada al cromosoma X (tipo 2).
Las alteraciones genéticas relacionadas
consisten en: mutación sin sentido en el
codón 172 (arginina a detención), mutación
missence en la posición 158 (cambio de
arginina a prolina y arginina a triptófano),
y mutaciones en el gen Pit-1.
La cara de pacientes con deficiencia de la hormona de crecimiento crece de manera desproporcionada, lo que le da un aspecto inmaduro, con frecuencia referido como "cara de muñeco" o de
"querubín", en la que destacan frente prominente.
214
Sección III • Talla baja por diversos trastornos
nariz pequeña y puente nasal deprimido. La desproporción radica en el hipocrecimiento longitudinal y transversal de la cara, que se evidencia por
medio de somatometría facial cuidadosa. Romer y
colaboradores analizaron a 121 niños con deficiencia de hormona de crecimiento (88 varones y 33
mujeres) entre 6 a 13 años de edad cronológica y
dos a ocho años de edad ósea y demostraron que la
cara es más angosta y más corta, ya que las medidas somatométricas se ubicaron en desviaciones
estándar por debajo del promedio poblacional:
— 1.04, distancia bigonial; -1.01, distancia biocular; -0.82, anchura de la nariz; -1.02, altura facial; -0.78, altura de la nariz; -0.75, altura de la
cara superior, y -0.52 altura de los labios. Otras
medidas reflejaron ligera desproporción corporal:
-0.59, tronco (dato más acentuado en el sexo femenino); — 0.42, diámetro o distancia biacromial;
+0.41, miembros inferiores; +0.26 miembros superiores.
La piel y el cabello son delgados y su crecimiento es más lento que en niños normales, por lo
que con frecuencia hay trazos vasculares dérmicos
que dan la impresión de que el cabello del paciente
es más ralo que el del resto de los integrantes de su
familia. La fontanela anterior tiende a retrasar su
cierre, por lo que tampoco es raro que se observe
aún abierta en niños mayores de un año de edad.
Cuando la deficiencia de hormona de crecimiento
se acompaña de hipotiroidismo por deficiencia de
hormona estimulante de la tiroides, el único dato
constante de hipofunción tiroidea es la resequedad
de la piel.
La erupción dentaria está retrasada y las piezas permanentes aparecen de manera irregular, es
decir, no adoptan los patrones de erupción descritos. La voz de los pacientes tiende a mostrar un tono
más agudo.
Los pacientes con hipopituitarismo congénito
con frecuencia desarrollan hipoglucemia tras ayunos de mediana duración (4 a 6 horas), sobre todo
en los dos primeros años de la vida. Es habitual que
estos episodios se acompañen de cetonemia y cetonuria, y que las concentraciones séricas de insulina
permanezcan en valores fisiológicos inferiores, o
aun por debajo de lo considerado como normal. En
pacientes con deficiencia aislada de hormona de
crecimiento también se han presentado episodios
de hipoglucemia, pero con intensidad y duración
menores que en pacientes con hipopituitarismo, por
lo que con frecuencia pasan desapercibidos.
El desarrollo de micropene y la aparición de
pubertad retrasada debe inducir a sospechar posibles
deficiencias gonadotrópicas en pacientes con deficiencia de la hormona de crecimiento, aunque esto
es difícil de demostrar entre los dos años de edad
cronológica y el momento en que los niños alcanzan una edad ósea de 13 años. En un buen número
de pacientes con deficiencia aislada de la hormona
de crecimiento se ha demostrado que la pubertad
se alcanza con una edad ósea adecuada, pero invariablemente retrasada en relación con la edad cronológica, sin que ello se deba a hipogonadismo.
La mayoría de los pacientes tiene tendencia a
acumular grasa en el tronco y partes proximales de
las extremidades, y esto se demuestra mediante la
determinación del grosor del tejido subcutáneo en
tríceps y regiones subescapular y supraumbilical.
El aumento de grasa subcutánea es más ostensible
por la hipoplasia muscular relativa que se manifiesta
por disminución de la eficacia durante el ejercicio
físico, cansancio muscular fácil y disminución de
la fuerza. En pacientes con deficiencia de la hormona de crecimiento la relación de grasa y músculo en
el muslo es de 85/15% en comparación con 37/63%
en pacientes normales, mientras el área muscular
total es sólo de 1.58 + 0.08 cm2/kg frente a 1.87 +
0.07 cm2/kg, respectivamente. La característica de
acumulación grasa no se observa en pacientes con
deficiencia de hormona de crecimiento que sufrieron retraso de crecimiento intrauterino y tampoco
en pacientes de origen asiático como los amerindios.
Por otro lado, algunos autores consideran que
hasta 5 a 10% de los pacientes con deficiencia de
hormona de crecimiento padecen algún tipo de displasia septoóptica, por lo que recomiendan la búsqueda intencionada de manifestaciones clínicas
sugestivas de esta relación, entre ellas: hipoplasia
del nervio óptico unilateral o bilateral, doble contorno de la papila óptica, nistagmo, alteraciones en
la capacidad visual (se refiere ceguera unilateral o
bilateral hasta en 25% de estos casos), hipotonía y
retraso psicomotriz leve a intenso.
Es importante considerar que los niños y adultos con deficiencia de hormona de crecimiento tienen disminución en la capacidad para participar en
juegos que impliquen ejercicio físico, al igual que
en la fuerza muscular y la coordinación neuromuscular; esto con frecuencia se traduce en aislamiento
del paciente y preferencia por tareas intelectuales o
estáticas y más individuales que gremiales, sin
importar las modificaciones de adaptación psicosocial motivadas por la diferencia de estatura
respecto de la mayoría de sus compañeros. Los
pacientes con esa deficiencia también poseen percepción disminuida de lo que significa un buen
estado de salud.
Todas las manifestaciones referidas son más
acentuadas y fáciles de detectar cuando la evolución del trastorno es mayor; por tanto su aparición
Capítulo 18 • Deficiencia de hormona de crecimiento
215
es muy variable en pacientes con deficiencia adquirida de hormona de crecimiento.
Conforme se administra hormona de crecimiento humana biosintética, las manifestaciones clínicas de la deficiencia tienden a revertirse de manera
progresiva y paralela al aumento de la velocidad de
crecimiento (figs. 18-5 y 18-6).
DISFUNCION EN LA NEUROSECRECION
DE HORMONA DE CRECIMIENTO
A partir de 1986 se propuso que algunos pacientes
con estatura baja presentan secreción inadecuada
de hormona de crecimiento en condiciones basaÍes, pero que ante estímulos farmacológicos muestran incrementos normales en los valores séricos
de la hormona, y así se acuñó el término disfunción
en la neurosecreción de hormona de crecimiento.
Las características universales de estos pacientes
son la velocidad de crecimiento en límites bajos y
edad ósea retrasada a consecuencia de hiposecreción espontánea de hormona de crecimiento que
se evidencia en el estudio de 24 horas, ya que las
muestras de sangre cada 15 a 20 minutos registran
picos de secreción altos pero estrechos, o amplios
pero bajos, lo cual se traduce en secreción menor a
Fig. 18-6. Respuesta al uso de hormona de crecimiento biosintética (mismo paciente de la figura 18-5).
lo considerado como límite fisiológico luego de
analizar el área bajo la curva de la secreción total
(fig. 18-7). Sin embargo, esta metodología de escrutinio ha sido muy cuestionada, ya que hasta 35%
de los pacientes con estatura baja registran en alguna
ocasión secreción integrada de 24 horas que se considera anormal, pero que al repetirla muestran concentraciones promedio dentro de límites normales.
Sin que se haya llegado a un consenso universal es
posible sugerir que:
Fig. 18-5. Pacientes con deficiencia congénita de hormona de
crecimiento.
1. Pacientes con antecedentes de radiación en la
región hipotalamohipofisaria, que hayan recibido entre 850 y 2 000 rads totales, pueden
sufrir daño hipotalámico que origine disfunción en la neurosecreción de hormona de crecimiento siempre y cuando la velocidad de
crecimiento sea baja y la edad ósea se encuentre atrasada.
2. Niños que hayan recibido más de 2 400 rads
experimentan casi de manera invariable una de
ficiencia de hormona de crecimiento, sin respuesta a estimulación farmacológica, por lo que
no deben considerarse portadores de disfunción
neurosecretora.
216
Sección III • Talla baja por diversos trastornos
sos, es necesario realizar pruebas de secreción
bajo estímulo farmacológico que permitan definir la existencia de hiposecreción de hormona
de crecimiento, y en caso de comprobación se
requiere estudiar al paciente como un deficiente
de hormona de crecimiento. 5. El paciente que
muestra secreción integrada baja y responde a
estímulos farmacológicos es probable, pero no
por fuerza cierto, que padezca disfunción en la
neurosecreción de hormona de crecimiento, por
lo que se recomienda repetir una y hasta dos
veces las evaluaciones ya descritas antes de
afirmar este diagnóstico, sobre todo en pacientes
sin antecedentes de enfermedad crónica
sistémica o de radiación a cráneo.
Lo anterior se debe a que la secreción de hormona de crecimiento al día puede variar de acuerdo con:
Fig. 18-7. Patrones de secreción de hormona de crecimiento
en pacientes con deficiencia, disfunción neurosecretora y sujetos sanos.
3. El análisis de la secreción espontánea de hormona de crecimiento durante 24 horas permite
diferenciar sólo a pacientes normales de casos
dudosos; es decir, la suficiencia de la secreción
de hormona de crecimiento se asegura al obtener picos de secreción de altura y amplitud
normales con promedio de secreción por día
dentro de parámetros adecuados.
4. Cuando la altura de los picos o el área bajo la
curva del patrón de secreción se encuentran por
debajo de los límites "fisiológicos" es conveniente tomar en cuenta la posibilidad de trastorno en la producción, secreción o acción de
la hormona de crecimiento, siempre y cuando
el estado nutricio sea adecuado y se carezca de
antecedente patológico reciente. En estos ca-
1. Características epigenotípicas familiares de estatura final que se traducen, entre otras, por una
capacidad variable para secretar hormona de
crecimiento. Se sabe que en comparación con
lo que sucede en individuos cuya estatura final
se sitúa en la percentila 50, esta secreción es
bastante superior en familias cuya media de
talla se sitúa en la percentila 97, en tanto que
es con claridad menor en familias cuya esta
tura final corresponde a la percentila 3 poblacional.
2. La temperatura media de las distintas estaciones del año, ya que existen diferencias entre
invierno y verano para un mismo individuo.
3. La existencia o no de estrés físico o emocional, así como de deprivación emocional. Esto
conduce de manera transitoria a menor secreción espontánea de hormona de crecimiento.
El defecto confirmado en la neurosecreción
puede tratarse a mediano y largo plazo con fármacos
capaces de estimular la secreción de hormona de
crecimiento, o bien mediante el uso de hormona
de crecimiento humana biosintética. En estos casos
tiene que valorarse la velocidad de crecimiento cuyo
incremento notorio indica que la terapéutica es
exitosa.
La respuesta en términos de incremento de
estatura acumulada y de velocidad de crecimiento
debe compararse con la esperada para la edad biológica, y no con la edad cronológica, sobre todo en
aquellos pacientes cuya edad cronológica sugiere
inicio a corto plazo de las características pubescentes, pero que mantienen una edad ósea retrasada y
Capítulo 18 • Deficiencia de hormona de crecimiento
que, por tanto, no iniciarán su pubertad ni a corto
ni a mediano plazo.
LECTURAS RECOMENDADAS
Abdenur JE, Plugiese MT, Cervantes C, Fort P, Lifshitz E.
Alterations in spontaneous growth hormone secretion
and the response to GHRH in children with nonorganic
nutricional dwarfing. J Clin Endocrinol Metab 1992;
75:930.
Albertsson KW, Niklasson A, Karlberg P. Birth data for
patients who later develop growth hormone deficiency:
preliminary analysis of a national register. Acta Paediatr
Scand 1990; 370 (supl):115.
August GP, Lippe BM, Blethen L et al. Growth hormone
treatment in the United States; demographic and diagnostic features of2331 children. J Pediatr 1990;l 16:899.
Bercu BB, Root AW, Shulman DI. Preservation of dopaminergic and alpha-adrenergic function in children with
growth hormone neurosecretory dysfunction. J Clin
Endocrinol Metab 1986;63:968.
Brokk CGD. Growth hormone deficiency: features, assessment and management. En: DeGroot LJ (ed). Endocrinology. 2nd ed. Baltimore: WB Saunders, 1989:351.
Cohen LE, Wondisford FE, Salvatoni A, Maghnie MM,
Brucker FD, Weintraub BD, Radovick S. A "hot-spot"
in the Pit-1 gene responsible for combined pituitary
hormone deficiency: clinical and molecular correlates.
J Clin Endocrinol Metab 1995;80:679.
Costin G, Murphree AL. Hypothalamic-pituitary function
in children with optic nerve hypoplasia. Am J Dis Child
1985;139:249.
Craft WH, Underwood LE, Van Wik JJ. High incidence of
perinatal insult in children with idiopathic hypopituitarism. J Pediatr 1980;96:397.
Cuneo RC, Salomon F, Wiles CM, Sonksen PH. Skeletal
muscle performance in adults with growth hormone
deficiency. Horm Res 1990;33:55.
De Luca F, Bernasconi S, Blandino A, Cavallo L, Cisternino
M. Auxological, clinical and neuroradiological findings
in infants with early onset growth hormone deficiency.
Acta Paediatr 1995;84:561.
Dean HJ, McTaggarth TH, Fish DG, Friesen HG. The educational, vocational and marital status of growth hormone deficiency adults treated with growth hormone
during childhood. Am J Dis Child 1985;139:1105.
Frazer T, Gavin JR, Daughaday WH. Growth hormone dependent growth failure. J Pediatr 1982;101:12.
Gelander L, Karleberg J, Albertsson-Wilkland K. Seasonally in short-term human growth. Acta Paediatr Scand
1993;388(supl):110.
Gelfand RA, Mathews DE, Bier OM, Sherwin RS. Role of
counter-regulatory hormones in the catabolic response
to stress. J Clin Invest 1984;74:2238.
217
Goodman HG, Grumbach MM, Kaplan SL. Growth and
growth hormone (II): a comparison of isolated growth
hormone deficiency and multiple pituitary hormone
deficiencies in 35 patientes with idiopathic hypopituitarism dwarfism. N Engl J Med 1968;278:57.
Indmarsh PC, Brook CGD. Auxological and biochemical
assessment of short stature. Acta Paediatr Scand 1988;
343(supl):73.
Lebl J, Zemková D, Kolousková S. Differences in postnatal growth pattern in idiophatic growth hormone deficiency following breech and normal deliveries. Acta
Paediatr Scand 1990;370(supl):168.
Marshall WA. Evaluation of growth rate in height over
periods of less than 1 year. Arch Dis Child 1971;46:414.
McArthur RG, Morgan K, Phillips JA, Bala M, Klassen J.
The natural history of familial hypopituitarism. Am J
Med Genet 1985;22:555.
McGavley GA, Cuneo RC, Solomon F, Sonksen PH. Psychological well-being before and after growth hormone
treatment in adults with growth hormone deficiency.
Horm Res 1990;33:52.
Mirlesse V, Frankenne F, Alsat E, Poncelet M, Hennen G,
Evain DB. Placental gowth hormone levels in normal
pregnancy and in pregnancies with intrauterine growth
retardation. Pediatr Res 1993;34:439.
Parkin JM. Incidence of growth hormone deficiency. Arch
Dis Child 1974;49:904.
Phillips LS, Unterman TG. Somatomedin activity in disorders of nutrition and metabolism. Clin Endocrinol Metab
1984;13:145.
Preece MA. Diagnosis and treatment of children with growth
hormone deficiency. Clin Endocrinol Metab 1982; 11:1.
Ramos RMR. Crecimiento y proporcionalidad corporal en
adolescentes mexicanas. México: UNAM, 1986.
Ranke BM. The Kabi International Group Study. Aetiology, classification list with comments. Acta Paediatr
Scand 1991;379(supl):87.
Rappaport R, Czarnichow P. Growth hormone deficiency.
En: Bertrand J, Rappaport R, Sizonenko PC (eds). Pediatric Endocrinology, 2nd ed. Baltimore: Williams &
Wilkins, 1993:220.
Rimoin DI. Hereditary forms of growth hormone deficiency
and resístante. Brith Defects 1976;12:15.
Romer TE, Preece MA, Arasimowicz E. Disproportion of
head and body in children with growth hormone deficiency: a possible aids for screening. Acta Paediatr
Scand 1990;367(supl):155.
Ross RJM, Miell JP, Buchanan CR. Avoiding autocannibalism. Considerations of growth hormone and insulinelike growth factor. Br Med J 1991;303:l 147.
Rudman D, Davis T, Priest JH. Growth hormone deficiency
in children with cleft lip or palate. J Pediatr 1978;93:
368.
Schoenle EJ, Zapf J, Prader A, Torresani T, Wender EA,
Zachmann M. Replacement of growth hormone (GH)
218
Sección III • Talla baja por diversos trastornos
in normally growing GH-deficient patients operated for
craniopharyngioma. J Clin Endocrinol Metab 1995;
80:374.
Steendijk R. Diagnostic and aetiologic features of idiopathic
and symptomatic growth hormone deficiency in the
netherlands. a survey of 176 children. Helv Paediatr Acta
1980;35:129.
Tanner JM, Huges PCR, Whitehouse RH. Comparative rapidity of response of height, link muscle and link fat to
treatment with human growth hormone in patients with
and without growth hormone deficiency. Acta Endocrinol 1977;84:681.
Tanner JM, Whitehouse RH. Valoración de la maduración
esquelética y predicción de la talla adulta (método TW2). 2a ed. Ancora, 1983:1.
Tönshoff B, Schaefer F, Mehls O. Disturbance of growth
hormone and insulin-like growth factors axis in uremia.
Pediatr Nephrol 1990;4:654.
Underwood LE, Thissen JP, Moats-Staats BM, Bruton E,
Maes M, Ketelsleger JM. Nutritional regulation of IGF1 and postnatal growth. En: Spencer EM (ed). Modern
concepts of insulin-like growth factors. New York:
Elsevier, 1991:37.
Whitehouse RH, Tanner JM, Healy MJR. Diurnal variation
in stature and sitting height in 12-14 year old boys. Ann
Hum Biol 1974; 1:103.
Capítulo
19
Resistencia a la hormona
de crecimiento
Esta enfermedad se define por falta de acción total
o parcial del sistema de la hormona del crecimiento cuando hay concentraciones séricas normales o
aumentadas de esa hormona.
La mayoría de los pacientes afectados posee
defectos genéticos que originan la síntesis de un
receptor anormal para la hormona de crecimiento;
sin embargo esto puede ser de expresión variable
(insensibilidad total o parcial) o adquirido (permanente o transitorio). La clasificación de los síndromes de resistencia a la acción de la hormona de
crecimiento incluye los siguientes:
1. Síndrome de insensibilidad primaria. De modo
habitual se trata de un defecto hereditario o
congénito y es permanente:
A. Deficiencia congénita del receptor para hormona de crecimiento (defectos cuantitativos y cualitativos).
B. Anormalidades en la transducción de la señal de la hormona de crecimiento (defectos en el posreceptor).
C. Defecto primario en la síntesis de factor de
crecimiento tipo insulina-1.
2. Síndrome de insensibilidad secundaria. Con
frecuencia se trata de una situación adquirida
y transitoria:
A. Anticuerpos circulantes dirigidos contra la
hormona de crecimiento y que inhiben sus
acciones.
B. Anticuerpos dirigidos contra el receptor de
la hormona de crecimiento.
C. Insensibilidad originada por desnutrición
o por padecimientos sistémicos y graves:
uremia, diabetes mal controlada, hiper-
catabolismo, quemaduras extensas, fracturas, sepsis, síndrome de inmunodeficiencia adquirida, quimioterapia, anorexia
nerviosa, malabsorción, síndrome de intestino
corto, caquexia oncológica, cirugía abdominal
extensa,
insuficiencia
respiratoria,
insuficiencia hepática, etcétera. D. Otros
trastornos.
En términos generales, los pacientes con alteraciones congénitas tienen defectos en la síntesis
del receptor para la hormona de crecimiento, lo cual
provoca pérdida total o parcial de los efectos metabólicos de la hormona. En cambio, los pacientes
con trastornos adquiridos presentan alteraciones en
la secreción hipofisaria de hormona de crecimiento
o de la capacidad de respuesta de los órganos blanco, pero no sufren modificaciones estructurales en
los distintos efectores del sistema de la hormona
del crecimiento.
El receptor para la hormona del crecimiento
(GHR) se sintetiza a partir de un gen único que se
localiza en el cromosoma cinco y de modo específico entre las regiones 5pl3 y 5pl2, cercano a los
genes que codifican para los receptores de prolactina e interleucina-7. Forma parte de una superfamilia de receptores denominada citocina-hematopoyetina u hormona de crecimiento/prolactina, que
incluyen a receptores para prolactina, la mayoría
de las interleucinas, el factor estimulador del crecimiento de granulocitos y de los macrófagos, la eritropoyetina, el factor leucémico inhibidor, el factor
ciliar neurotrófico y la oncostatina M.
La secuencia primaria de aminoácidos de todas estas hormonas y citocinas es diferente. Pero
219
220
Sección III • Talla baja por diversos trastornos
en todas ellas, la estructura tridimensional contiene
una arquitectura caracterizada por cuatro hélices,
y la porción aminoterminal de la porción extracelular del receptor (que consiste en alrededor de 120
aminoácidos con una homología de 14 a 25%) forma 14 bandas beta antiparalelas vinculadas en siete
pares, con cuatro residuos de cisteína que a su vez
constituyen dos puentes disulfuro y una secuencia
idéntica en la porción más proximal a la membrana
celular.
El gen del receptor para la hormona del crecimiento está constituido por nueve exones funcionales y varios exones no funcionales: el exón dos
codifica para el péptido señal; los dominios 3 a 7
para la porción extracelular del receptor (idéntica a
la proteína transportadora de hormona de crecimiento); el exón ocho para el dominio transmembrana,
y los exones 9 y 10 para la porción citoplásmica o
intracelular.
La síntesis primaria produce una proteína de
638 aminoácidos, que más tarde pierde 18 (péptido
señal de la membrana) para producir un péptido maduro de 620 aminoácidos, con una masa molecular de 65 kDa antes de ser glucosilado.
En condiciones fisiológicas, la hormona de
crecimiento necesita unirse a dos receptores específicos para realizar sus acciones y entonces se forma un complejo caracterizado por un dímero del
receptor para la hormona y una molécula de hormona de crecimiento (receptor-hormona-receptor).
La hormona circulante se transporta por medio de
su proteína transportadora específica denominada
proteína transportadora de hormona de crecimiento (idéntica a la porción extracelular del receptor
mencionado), y al alcanzar la membrana celular se
traslada desde ahí a un monómero del receptor específico; subsecuentemente se une al segundo monómero de receptor específico y forma el complejo
receptor-hormona-receptor, a partir del cual se inicia la transducción celular (fig. 19-1).
Existe una variante del receptor para la hormona del crecimiento en la que se pierde el exón
tres (GHRd3) y que, a pesar de que origina una
fracción extracelular más pequeña, no parece modificar la unión de la hormona de crecimiento con
el receptor. De hecho, existe evidencia de que ambas isoformas unen con propiedades idénticas no
sólo a la hormona de crecimiento, sino también a la
hormona de crecimiento placentaria, que reemplaza a la forma hipofisaria a partir de la mitad de la
gestación. Por otro lado, la síntesis de las isoformas
puede variar de un tipo celular a otro o incluso
coexistir en la misma célula, cada una con función
adecuada, y estudios más recientes han demostrado la existencia de células con heterodímeros de
Fig. 19-1. Modelos de las posibles alteraciones teóricas
para el receptor de la hormona de crecimiento. A. Si la mutación
afecta el sitio de unión con la hormona de crecimiento, no se
forman homodímeros del receptor y, por tanto, existe falta total
de acción o resistencia total. B. Cuando la mutación permite la
unión con la hormona de crecimiento, pero afecta la transducción de la señal debido a la existencia de un homodímero "nofuncional", existirá falta total de acción o resistencia total. C.
Cuando hay mutación en un receptor híbrido, ocurrirá un efecto
escaso de la hormona de crecimiento, frecuentemente menor a
50% del esperado. D. El homodímero normal transmitirá la
señal de la hormona sin ningún problema.
funcionalidad normal, en los que un receptor corresponde a la expresión normal del exón tres y el
otro corresponde a la proteína que no contiene la
información codificada en éste (heterodímero receptor para la hormona de crecimiento/GHRd3). En
la actualidad se reconocen por lo menos dos grupos de pacientes con resistencia congénita a la hormona de crecimiento:
1. Insensibilidad total a la hormona de crecimiento. El doctor Zvi Laron la describió de modo
inicial en tres hermanos de una familia judía
yemenita en 1966, y el doctor Jaime Guevara
Aguirre la encontró en dos poblaciones de
Ecuador. En ambos grupos la alteración se
transmite de manera autosómica recesiva; esto
significa que los individuos afectados son homocigotos para el defecto, aunque en ocasiones se ha notificado la existencia de heterocigotos dobles, es decir, individuos con dos defectos independientes desde el punto de vista
genético, pero con acciones aditivas en lo funcional (fig. 19-2).
La mayoría de los pacientes posee estatura baja en especial desde la etapa posnatal, concentraciones séricas altas de hormona de crecimiento y disminución de las cifras de factor
de crecimiento tipo insulina-1, proteína transportadora-3 de factor de crecimiento tipo insulina-1 y factor de crecimiento tipo insulina-2.
También la mayoría tiene concentraciones bajas de proteína transportadora de hormona de
crecimiento y equivalentes a la determinación
Capítulo 19 • Resistencia a la hormona de crecimiento
221
Fig. 19-2. Mutaciones del gen para el receptor de hormona
de crecimiento referidas en pacientes con resistencia a dicha
hormona.
cuantitativa de receptor para la hormona del
crecimiento, pero se ha descrito un subgrupo de
pacientes con valores séricos normales. 2.
Insensibilidad parcial a la hormona de crecimiento con un fenotipo mucho más heterogéneo,
y que no sólo parece ser mucho más frecuente,
sino que incluso pudiera deberse a varios
defectos genéticos diferentes.
RESISTENCIA TOTAL A LA HORMONA
DE CRECIMIENTO
El análisis del gen para el receptor de hormona de
crecimiento ha sido analizado en numerosos pacientes y, como es de esperarse en un defecto genético
autosómico recesivo, la mayoría de los pacientes
tiene padres consanguíneos heterocigotos, de manera que el defecto se expresa sólo en los hijos
homocigotos para la misma mutación genética,
aunque se han encontrado heterocigotos dobles (un
defecto genético distinto en cada alelo).
Para fines clínicos, los pacientes pueden agruparse en dos diferentes fenotipos de acuerdo con la
cantidad de proteína transportadora de hormona de
crecimiento circulante o la capacidad de unión sérica para la hormona de crecimiento: sin expresión
(75% de los casos descritos) y con expresión del
receptor para la hormona del crecimiento (25% de
los pacientes). Así se demuestra la heterogenicidad
de este síndrome (fig. 19-3).
Fenotipo sin expresión de proteína
transportadora de hormona de crecimiento
El marcador que determina esta variante es la ausencia de concentraciones detectables de proteína transportadora de hormona de crecimiento en suero que
puede deberse a una de las siguientes mutaciones:
1. Deleción del gen de receptor para hormona de
crecimiento. Existe deleción de los exones 3,5
Fig. 19-3. Gráfica de la correlación entre talla e 1GFBP-3
(proteína transportadora de factor de crecimiento tipo insulina-3) en pacientes con proteina transportadora de hormona de
crecimiento (GHBP) (+) y otro grupo tanto positivo como
negativo.
y 6, con lo que además se genera un codón que
detiene la síntesis proteínica en el codón cinco
del exón siete, de manera que la porción extracelular del receptor para hormona de crecimiento sólo contiene 53 aminoácidos.
2. Mutaciones que originan una proteína anormal. Producen una proteína truncada con de
leción tanto del sitio de unión extracelular
de la hormona al receptor para hormona de crecimiento, como de la porción transmembrana
e incluso intracelular. En la mayoría de los pa
cientes, en los exones 4 o 7, el codón CGA (que
codifica para una arginina en la posición 43)
ocurre metilación y desaminación de la citosina
para convertirla en timina (TGA), lo cual se
traduce de modo funcional en una codificación
para detener la síntesis proteínica (codón de
terminación R43X). Se han identificado muta
ciones similares y sin sentido en otros sitios
(C38X, Q65X y W80X). También se han des
crito otras más que no involucran la codifica
ción para arginina en los exones 6 y 7 (W157X,
E183X, R217X, 320delTA y 230delT), que
no impiden la traslación de la proteína del re
ceptor para hormona de crecimiento con ca
pacidad de unión pero producen un fenotipo
bioquímico con ausencia de proteína transpor
tadora específica, debido probablemente a ines
tabilidad del mRNA.
3. Defectos de empalme. La alteración del primero o del último dinucleótido de una secuencia intrónica es indispensable para el empalme
de los exones. Se han demostrado cuatro mutaciones para el gen del receptor para hormona
de crecimiento, que se relacionan con ausencia total de actividad plasmática para unir a esta
222
Sección III • Talla baja por diversos trastornos
hormona; en la población de Ecuador se encontró dentro del exón seis, que ocasiona una
proteína con deleción de ocho aminoácidos de la
región extracelular del receptor. 4. Mutaciones
sin sentido. Involucran una región crítica de la
molécula, y modifican de manera directa o
indirecta la unión con la hormona de crecimiento.
Se han descrito 10 mutaciones, de las cuales ocho
afectan a la porción extracelular del receptor y
dos a la intracelular.
Fenotipo con expresión de proteína
transportadora de hormona de crecimiento
Algunos pacientes con características clínicas y
bioquímicas idénticas a las de resistencia total de
hormona de crecimiento muestran actividad normal
para unir a la hormona de crecimiento circulante y
también poseen concentraciones normales o incluso altas de la proteína transportadora de esa hormona; este grupo de pacientes, aunque heterogéneo en su etiología, parece tener afección menos
grave y, por tanto, menor déficit de estatura.
Las alteraciones genéticas pueden afectar la
dimerización del receptor que resulta crítica para
la promoción del crecimiento y los efectos metabólicos de la hormona, y se transmiten con carácter
autosómico dominante.
Otros pacientes muestran defectos de la región
intracelular del receptor vinculados con alteraciones de la proteína transportadora-3 de factor de crecimiento tipo insulina-1.
Por último, las mutaciones que interfieren con
el empalme del exón ocho (que codifica para la
región transmembrana) también permiten la expresión de proteína transportadora de hormona de crecimiento pero no su fijación a la membrana celular,
y ello origina incluso concentraciones altas en suero, con capacidad de unión para la hormona de
crecimiento, pero sin efecto celular.
En estos pacientes se mantiene una proporción
entre el grado de insensibilidad a la hormona, determinado por la estatura, y las concentraciones
séricas de proteína transportadora-3 de factor de crecimiento tipo insulina-1.
Características típicas
El fenotipo de los pacientes con resistencia total a
hormona de crecimiento es muy similar, sin importar el defecto genético que la ocasione; pero es
necesario considerar que la mayoría de ellos pertenece a las poblaciones de Israel (deleciones complejas del gen de receptor para la hormona del crecimiento) y de Ecuador (homocigotos para una sola
mutación que produce un receptor incompleto). Y
sus características son las siguientes:
1. Talla baja. En la población israelita y europea
parece existir retraso de crecimiento intrauterino y 60% posee estatura ubicada más de dos
desviaciones estándar por debajo del promedio poblacional. En la población de Ecuador la
estatura al nacimiento parece ser normal.
El crecimiento posnatal está alterado desde la etapa de lactancia y la estatura se sitúa por
debajo de la media poblacional: entre —4y —8
desviaciones estándar (DE) para la población
israelita; entre -6.8 y -9.6 DE para Ecuador,
y entre -3.2 y -10.4 DE para la población
europea. La velocidad de crecimiento desde el
tercer año de vida se mantiene entre 3 y 4 cm/
año para varones y 4 a 5 para mujeres, lo cual
de modo estadístico se sitúa dentro de límites
normales de distribución poblacional, aunque
sin variación por debajo de la percentila 25.
No existe pico de crecimiento pubescente
y la pubertad se inicia de manera tardía en
varones (alrededor de los 16 años) y normal en
las mujeres, pero éstas dejan de crecer hasta
los 16 a 19 años mientras que los primeros terminan su crecimiento cerca de los 20 años; asimismo, la estatura final es de 111 a 128 cm
para mujeres y de 116 a 132 cm para varones.
2. Peso. Al nacimiento se encuentra entre —0.72
y —1.59 desviaciones estándar por debajo del
promedio. Durante el crecimiento posnatal, la
progresión es adecuada o un poco baja para la
estatura, y hay mayor grosor del pliegue sub
cutáneo con acumulación de grasa a nivel del
tronco y disminución de las masas muscular y
ósea. Al término de la pubertad la progresión
del peso continúa y con frecuencia se desarrolla obesidad al llegar a la edad adulta.
3. Desarrollo intelectual. Es variable y se ha notificado como superior al promedio en la población ecuatoriana, normal en el grupo europeo y alterado en el estudio israelita.
4. Desarrollo motor. Se encuentra retrasado en
todos los pacientes, es probable que a consecuencia de hipomuscularidad.
5. Edad ósea retrasada de manera universal con
respecto a la cronológica, pero es mayor de la
esperada para la edad a la que debe alcanzarse
una estatura determinada en relación a la población general.
6. Retención de la dentición primaria. Esto origina que incluso los dientes se pudran antes de
ser exfoliados y que ocurra apiñamiento dental al emerger la dentición permanente. El ter-
Capítulo 19 • Resistencia a la hormona de crecimiento
7.
8.
9.
10.
11.
12.
13.
cer molar se pierde en 90% de los pacientes,
aunque puede haber hipodoncias agregadas
En varones, micropene durante la infancia,
pero en ambos sexos las características sexuales secundarias se desarrollan de manera normal y se conserva la fertilidad.
Cabellor ralo, hipoplasia ungueal, pies y manos pequeños.
Perímetros cefálicos mayores de los esperados
para la estatura, frente prominente, puente
nasal deprimido e hipoplasia mediofacial. Es
posible que esta facies, considerada como clásica, no se observe en individuos con menor
grado de afección, ya que la longitud de la cara
y la estatura mantienen una correlación directamente proporcional (en desviaciones están
dar por debajo de la media). Algunos pacientes tienen signo "del sol naciente", lo que junto con el cierre tardío de la fontanela anterior
puede dar la impresión de hidrocefalia. Las
escleróticas tienden a ser azules y la voz aguda. En la población de Ecuador 16% desarrollan ptosis, asimetría facial y limitación para la
extensión del codo.
Proporcionalidad corporal infantil. El segmento superior tiende a ser mayor de lo esperado para la longitud del inferior; pero este dato
sólo se presenta en etapa pubescente en la población de Ecuador y en la europea, y durante
toda la vida en la población israelita.
Displasia de cadera con luxación congénita en
alrededor de 25% de los individuos de todas
las series estudiadas.
Durante los primeros siete años de vida en el
grupo de Ecuador existe mayor morbilidad y
mortalidad (18% comparado con 11 % en la población general, con p < 0.05), originada por
padecimientos infecciosos (neumonía, diarrea
y meningitis).
Con frecuencia los valores séricos de hormona de crecimiento están elevados. La concentración media es de 16 ug/L, pero los límites
varían entre 0.5 y 80, debido a que la secreción hipofisaria mantiene su patrón pulsátil. El
número de picos de secreción se mantiene normal y la respuesta es fisiológica (estimulación
con hormona liberadora de hormona de crecimiento y disminución con somatostatina), pero
la magnitud de éstos se encuentra incrementa
da. Se ha informado que la inhibición nocturna de la secreción hipofisaria es incompleta.
Las pruebas de estimulación química de ma
nera habitual producen valores altos de hormo
na de crecimiento (12 a 230 ug/L con media
de 75).
223
14. Concentraciones séricas de factor de crecimiento tipo insulina-1 bajas. Estas no aumentan con el uso de hormona de crecimiento (luego de cuatro días de tratamiento con dosis de
0.1 U/kg/día el punto de corte es un incremento máximo de 15 ug/L). Sin embargo en el grupo ecuatoriano, alrededor de los 16 años se produce un incremento espontáneo en los valores
(de 3 a 25 ug/L), es probable que como respuesta a los esteroides sexuales.
15. Concentraciones séricas de factor de crecimiento tipo insulina-2 bajas. En apariencia
esto se debe a disminución de proteína transportadora-3 de factor de crecimiento tipo insulina1, ya que la suma de los factores de crecimiento
tipo insulina-1 y tipo insulina-2 es casi idénti
ca a las concentraciones de proteína transportadora-3 de factor de crecimiento tipo insuli
na-1.
16. Valores séricos en extremo bajos de proteína
transportadora-3 de factor de crecimiento tipo
insulina-1. Se notifican concentraciones de
226 ng/ml en individuos prepubescentes y 433
en adultos en comparación con 2 665 en la po
blación sana ecuatoriana y 530 (-3 a —14.7
desviaciones estándar por debajo de la media
poblacional) en el grupo europeo. Un incremento menor a 400 ng/ml se observa a través de
la prueba de estimulación de hormona de crecimiento durante cuatro días a dosis de 0.1 U/
kg/día. Las concentraciones de proteína transportadora-1 de factor de crecimiento tipo insulina-1 se encuentran muy elevadas, mientras
que las de proteína transportadora-2 de factor
de crecimiento tipo insulina-1 son normales.
17. Las concentraciones séricas de proteína transportadora de hormona de crecimiento tienden
a ser bajas, pero en individuos con el mismo
defecto genético se han encontrado valores
normales.
18. Hasta 50% de los afectados presentan hipoglucemias de ayuno durante la infancia, que tiende a remitir al alcanzar la edad adulta, aunque
puede reaparecer luego de ayunos prolonga
dos. La mayoría de los pacientes presentan con
centraciones séricas bajas de insulina, que al
parecer se debe a un efecto compensatorio ante
la falta de acciones de la hormona de creci
miento sobre el metabolismo de carbohidratos.
RESISTENCIA PARCIAL A LA HORMONA
DE CRECIMIENTO
Los grados de resistencia a la hormona de crecimiento son distintos y los fenotipos son variables.
224
Sección III • Talla baja por diversos trastornos
Se han descrito pacientes con valores bajos de proteína transportadora de hormona de crecimiento y
de factor de crecimiento tipo insulina-1, en quienes
existen alteraciones en la región extracelular del
receptor (por mutaciones de punto en la cadena de
aminoácidos); éstas originan hasta 300 veces menor sensibilidad a la hormona de crecimiento y, con
menor grado de afección, mutaciones que afectan
la región intracelular (proteína transportadora de
hormona de crecimiento normal con factor de crecimiento tipo insulina-1 bajo).
Algunos pacientes considerados en principio
portadores de talla baja familiar o de talla baja idiopática se han reconocido con este síndrome. Las
características bioquímicas de éste se han descrito
en niños, y se cuenta con poca información sobre
adultos. Los datos más constantes son:
1. Aumento de hormona de crecimiento, tanto en
la secreción espontánea como en la inducida
por estimulación química hipotalámica o hipofisaria.
2. Disminución en la concentración sérica de pro
teína transportadora de hormona de crecimien
to, aunque algunos niños expresan concentra
ciones normales de acuerdo con la gravedad
del defecto genético subyacente.
Más de 18% de los pacientes con talla baja
idiopática expresa concentraciones de proteína transportadora de hormona de crecimiento
más de dos desviaciones estándar por debajo
del promedio esperado para su sexo y edad y
más de 90% posee concentraciones inferiores
a la media, sin que exista relación con estatura, índice de masa corporal o edad ósea (fig.
19-4). Esta característica se ha observado también en dos poblaciones con estatura baja: los
habitantes de las montañas Ok de Papua (Nueva Guinea) y los pigmeos de Zaire.
Fig. 19-4. Gráfica del crecimiento en función de la relación entre secreción y acción de la hormona de crecimiento.
GHBP = proteína transportadora de hormona de crecimiento.
3. Disminución en la concentración sérica de factor de crecimiento tipo insulina-1. Los niños
con talla baja idiopática y con valores reducidos de proteína transportadora de hormona de
crecimiento también tienen valores aumenta
dos de hormona de crecimiento (durante un
periodo de 12 horas), pero el factor de crecimiento tipo insulina-1 es bastante menor que
en aquéllos con talla baja idiopática y concentraciones normales de proteína transportadora
de hormona de crecimiento, lo cual sugiere que
este subgrupo posee insensibilidad parcial a la
hormona de crecimiento.
4. Las mutaciones funcionales del receptor para
la hormona del crecimiento son muy frecuentes mientras que la disfunción en la neurosecreción y las anormalidades moleculares de la
hormona de crecimiento (hormona bioinactiva)
se encuentran de manera muy ocasional.
Se ha notificado que alrededor de 30% de
los pacientes con talla baja idiopática y con expresión familiar presenta mutaciones en el receptor de hormona de crecimiento con predominio en los exones 4 a 7, los cuales codifican
para su porción extracelular.
En términos generales, los pacientes homocigotos para un defecto en el receptor específico se comportan como una resistencia total
a la hormona de crecimiento, mientras que los
heterocigotos expresan menor afección funcional (resistencia parcial). Sin embargo, es necesario considerar los siguientes aspectos:
A. Las mutaciones que alteran la unión de la
molécula con el receptor y la dimerización
de éste, tienden a comportarse de manera
recesiva; es decir, se requiere que ambos
padres sean heterocigotos.
B. En contraste, los heterocigotos para un de
fecto que ocasione unión adecuada entre
la hormona de crecimiento y su receptor,
pero con transducción alterada del mensaje (probablemente por interferencia con la
autofosforilación de la tirosina), pueden expresar deficiencias de crecimiento hasta en
50% de los casos, con lo cual adquiere
carácter hereditario semidominante.
5. Respuesta variable al uso de hormona de crecimiento, tanto en lo referente a la elevación
de proteína transportadora de hormona de crecimiento y de factor de crecimiento tipo insulina-1, como de la aceleración en la velocidad
de crecimiento.
Con base en lo anterior, en niños con estatura
baja de expresión familiar (rama paterna o materna
Capítulo 19 • Resistencia a la hormona de crecimiento
o ambas) parece que se abre un panorama más
completo para identificar la causa de alteraciones
del crecimiento en los casos en que no se demuestra deficiencia de hormona de crecimiento o síndrome de insensibilidad total para las acciones de
ésta, pero hay respuestas parciales (en mayor o
menor grado) a concentraciones séricas normales
de la hormona sin ninguna otra causa orgánica responsable del hipocrecimiento.
LECTURAS RECOMENDADAS
Attie KM, Carlsson LMS, Rundle AC, Sherman B/The
National Cooperative Growth Study. Evidence for partial growth hormone insensitivity among patients with
idiopathic short stature. J Pediatr 1995; 127:244.
Bjarnason R, Albertsson-Wikland K, Carlsson LMS. Acute
and chronic effects of subcutaneous growth hormone
(GH) injections on plasma levels of GH binding protein
in short children. J Clin Endocrinol Metab 1995;80:
2756.
Blum WF, Cotterill AM, Postel MCV. Improvement of diagnostic criteria in growth hormone insensitivity syndrome: solutions and pitfalls. Acta Paediatr 1994;399:
117.
Blum WF, Ranke MB, Savage MO, Hall K. Insulin-like
growth factors and their binding proteins in patients with
growth hormone deficiency: Suggestions for new diagnostic criteria. Acta Paediatr 1992;383:125.
De Vos AM, Ultsch M, Kossiakoff A: Human growth hormone and extracellular domain of its receptor: crystal
structure of the complex. Science 1992;255:306.
Goddard AD, Covello R, Luoh SM et al. Growth hormone
receptor mutations in idiopathic short stature. N Engl J
Med 1995;333:1093.
Guevara JA, Rosenbloom AL, Fielder PJ et al. Growth hormone receptor deficiency in Ecuador: clinical and bio-
225
chemical phenotype in two populations. J Clin Endocrinol Metab 1993;76:417.
Kelly PA, Djiane J, Postel MCV, Elderly M. The prolactin/
growth hormone receptor family. Endocrin Rev 1991; 12:
235.
Laron Z, Blum WF, Chatelain P et al. Classifications of
growth hormone insensitivity syndrome. J Pediatr 1993;
122:241.
Rosenbloom A, Guevara JA, Rosenfeld R, Fielder P. The
little woman of Loja-growth hormone receptor deficiency in an inbred population in southern Ecuador. N
Engl J Med 1990;323:1367.
Rosenbloom A, Savage MO, Blum WF et al. Clinical phenotype and biochemical characteristics of growth hormone
receptor deficiency (Laron syndrome). Acta Paediatr
1992,383:117.
Rosenbloom AL, Guevara JA, Rosenfeld RG, Fielder PJ. Is
there heterozygote expression of growth hormone deficiency? Acta Paediatr 1994;399:125.
Rosenfeld RG, Albertsson KW, Cassorla F et al. Diagnostic controversy: The diagnosis of childhood growth
hormone receptor deficiency revisited. J Clin Endocrinol
Metab 1995;80:1532.
Rosenfeld RG, Rosenbloom AL, Guevara JA. Growth hormone (GH) insensitivity due to primary GH receptor
deficiency. Endocrine Review 1994;15:369.
Savage MO, Blum WF, Ranke MB et al. Clinical features
and endocrine status in patients with growth hormone
insensitivity (Laron syndrome). J Clin Endocrinol Metab
1993;77:1465.
Savage MO, Carlsson L, Chatelain PG et al. Growth hormone insensitivity syndromes. Acta Paediatr 1995;
411:87.
Wickelgren RB, Landin KLL, Ohlsson C, Carlsson LMS.
Expression of exon 3-retaining and exon 3-excluding
isoforms of the human growth hormone receptor is regulated in an inter-individual, rather than a tissue-specific
manner. J Clin Endocrinol Metab 1995;80:2154.
Capítulo
20
Detención del crecimiento
por agentes terapéuticos
El crecimiento, es decir el equilibrio continuo entre la generación y la destrucción de masa, puede
modificarse por la acción de diversos agentes químicos, la mayoría de los cuales limitan la velocidad de síntesis y en consecuencia cambian el signo
del crecimiento de manera por lo general transitoria y dependiente de la edad. Así por ejemplo, en
un niño ocurre disminución de la velocidad de crecimiento y aumento lento de la talla acumulada y
con mucho menos frecuencia bloqueo en la progresión de la misma; en un adulto, el signo neutro
de crecimiento cambia a negativo luego de que disminuye la capacidad de síntesis de nuevo material,
y en consecuencia se reduce la masa corporal; en
un anciano con signo neutro de crecimiento se acentúa la pérdida de masa al existir menor capacidad
de síntesis.
Aunque haya bloqueo en la velocidad de síntesis, se requiere tiempo para que la falta de progresión del crecimiento se haga evidente u objetiva. Por ejemplo, cuando un niño crece a velocidad
de 6 cm/año (0.5 cm/mes) y un medicamento bloquea el crecimiento en 50%, este hecho se percibe
hasta después de al menos 3 o 4 meses y aun así el
crecimiento de 1 cm en lugar de los dos esperados
puede pasar inadvertido con facilidad sin que se le
atribuya al uso del medicamento. Esto implica falta
de análisis adecuado sobre la capacidad de diversos medicamentos para disminuir la velocidad de
crecimiento, y las causas más frecuentes de ello son:
1. Cada especie animal tiene distinta sensibilidad
a los fármacos, y los efectos sobre el crecimiento no se extrapolan con facilidad a los seres
humanos.
226
2. No es ético administrar medicamentos a niños
sanos con la finalidad de analizar su posible
repercusión en el crecimiento.
3. La disminución de la velocidad de crecimiento es muy difícil de valorar en anomalías con
duración menor a una o dos semanas, ya que
es imposible demostrar modificaciones aunque
se usen aparatos de medición con valores micrométricos, como el knemómetro.
4. En entidades patológicas con duración mayor
de un mes, la única manera de demostrar que
ocurre disminución de la velocidad de crecimiento es contar con grupos control. Por ejemplo, el uso constante de un solo medicamento
se compara con la administración intermitente; o bien uno o varios grupos de niños que reciben el fármaco a la misma dosis pero con distinta periodicidad, se compara con otro grupo
que no se somete a tratamiento siempre y cuando no exista contraindicación ética para ello.
5. Incluso los individuos con una misma enfermedad crónica muestran distintos grados de al
teración en el crecimiento, tanto por el efecto
de la enfermedad como por la sensibilidad diversa al medicamento. Por ello, en condiciones ideales debe compararse el uso continuo
de un solo fármaco con el uso intermitente y
con la utilización de placebo en un mismo
paciente, aunque esta última situación es muy
difícil de mantener sin alterar la gravedad de la
enfermedad y sin transgredir las normas éticas.
Con base en lo anterior, se comprende por qué
no es factible predecir la futura limitación de la
velocidad de crecimiento y gravedad de ésta.
Capítulo 20 • Detención del crecimiento por agentes terapéuticos
En términos generales, los medicamentos pueden dividirse en aquellos que actúan sobre el sistema de la hormona del crecimiento y los que lo hacen
sobre el órgano blanco.
ALTERACIÓN DEL SISTEMA
DE LA HORMONA DE CRECIMIENTO
Bloqueadores beta
Los bloqueadores beta modifican los efectos adrenérgicos alfa sobre el hipotálamo y así disminuyen
la síntesis de hormona liberadora de hormona de
crecimiento; el resultado es un desequilibrio entre
la hormona de crecimiento y la somatostatina, lo
cual dificulta o incluso bloquea la secreción de la
primera y en consecuencia se reduce la velocidad
de crecimiento.
Los bloqueadores beta también hacen bajar la
velocidad de replicación del ácido desoxirribonucleico, lo que puede potenciar el daño sobre el crecimiento (fig. 20-1).
El efecto en el hipotálamo depende de que el
fármaco atraviese la barrera hematoencefálica y de
la sensibilidad individual. Por otro lado, la administración intensiva de bloqueadores beta parece
facilitar la liberación de hormona de crecimiento,
mientras que el uso a largo plazo se ha relacionado
con disminución de la producción diaria.
227
Antihistamínicos
Una vez sintetizada la hormona liberadora de hormona de crecimiento (GHRH), el mecanismo involucrado en su secreción depende en parte de la acción de la histamina y por eso los antihistamínicos
que atraviesan la barrera hematoencefálica favorecen la existencia de un tono somatostatinérgico.
El cromoglicato (que inhibe la liberación de
histamina), la difenhidramina y la clorfeniramina
(que bloquean a los receptores H-l) pueden reducir las concentraciones de hormona liberadora de
hormona de crecimiento; cuando se sustituyen por
otro que no atraviesa la barrera hematoencefálica
es frecuente observar aumento en la velocidad de
crecimiento. Es necesario asumir que el antihistamínico tiene una acción central cuando su uso produce hipersomnia o insomnio (fig. 20-2).
Antiserotoninérgicos
La mayoría de estos fármacos tienen usos terapéuticos que requieren que la molécula cruce la barrera hematoencefálica y, en consecuencia, la posibilidad de que disminuyan la secreción de hormona
de crecimiento es alta.
La serotonina es un neurotransmisor hipotalámico que facilita la síntesis y secreción de hormona liberadora de hormona de crecimiento; sin embargo, constituye un agente permisivo y no prima-
228
Sección III • Talla baja por diversos trastornos
rio en la regulación de esa hormona, por lo que la
intensidad del efecto sobre el crecimiento tiende a
ser leve (fig. 20-3).
Los antidepresores tricíclicos y los inhibidores
de la monoaminooxidasa casi nunca se administran
durante la etapa pediátrica; pero es importante señalar que la ciproheptadina, con frecuencia utilizada para aumentar el apetito, es un antiserotoninérgico, y en aquéllos más sensibles es capaz de disminuir la secreción de hormona de crecimiento.
Barbitúricos
El fenobarbital y otros anticonvulsivos disminuyen
la secreción de hormona liberadora de hormona de
crecimiento y aumentan la de somatostatina, lo cual
a su vez reduce la producción de hormona de crecimiento. Este efecto es mucho más acentuado con
concentraciones supraterapéuticas y, como casi
nunca se monitorizan los valores séricos para ajustar la dosis, no es de extrañar que algunos informes
sugieran que el paciente con crisis convulsivas presenta velocidad de crecimiento menor a la esperada
para niños sanos de su mismo sexo y edad (fig. 20-4).
ALTERACIONES CELULARES
Difenilhidantoínas
La difenilhidantoína y otros anticonvulsivos con
efecto similar compiten con la vitamina D3 (1,25-
Fig. 20-4. Sitio de acción de los barbitúricos sobre la secreción de hormona liberadora de hormona de crecimiento
(GHRH).
dihidroxicolecalciferol) en el tejido óseo, modificando el metabolismo de calcio. Esa vitamina favorece la diferenciación de monocitos y macrófagos en osteoclastos y la producción del factor de
crecimiento esquelético por estos últimos; por otro
lado, acelera la diferenciación de los precursores
hacia osteoblastos maduros en el hueso. En consecuencia, estos medicamentos disminuyen la incorporación de hidroxiapatita en la matriz mineral y
de colágena en la matriz orgánica, así como la formación del disco de crecimiento; en pacientes
menores de un año pueden mermar la cantidad de
médula ósea, y de ese modo se favorece la existencia de anemia, que por su efecto hipóxico, constituye un factor agregado en la afectación de la velocidad de crecimiento.
Glucocorticoides
Los glucocorticoides disminuyen la velocidad
de crecimiento ya que actúan en distintos niveles
del sistema de la hormona del crecimiento (fig.
20-5):
Fig. 20-3. Nivel de acción de los antiserotoninérgicos sobre la secreción de hormona liberadora de hormona de crecimiento (GHRH).
1. Reducen la secreción de hormona de crecimiento por aumento del tono somatostatinérgico en
el hipotálamo (fig. 20-6).
2. En la hipófisis, alteran el patrón de secreción
pulsátil de hormona de crecimiento y en consecuencia la cantidad circulante de ésta se hace
menor.
Capítulo 20 • Detención del crecimiento por agentes terapéuticos
229
Fig. 20-5. Mecanismos de los esteroides para inhibir el crecimiento lineal en seres humanos. GHRH = hormona liberadora de
hormona de crecimiento; SS = somatostatina; IGF = factor de crecimiento tipo insulina; DE = desviación estándar.
3. Bloquean de manera parcial los efectos endocrinos de los factores de crecimiento tipo insulina.
4. Disminuyen la capacidad de respuesta del tejido conjuntivo a hormona de crecimiento y factores de crecimiento tipo insulina.
5. Disminuyen in vitro la capacidad de replicación de los condrocitos (fíg. 20-7).
La hidrocortisona, en dosis superior a 25 mg/
m2/dia, interfiere con la calcificación ósea y disminuye además la síntesis de proteínas celulares, con
lo que la velocidad de crecimiento desciende de
manera moderada a intensa. Si se utiliza prednisona, la dosis equivalente para generar esta alteración
es de 6 mg/m2/día.
En la mayoría de los casos, los esteroides se
utilizan a dosis muy superiores a las mencionadas
por lo que se han buscado esquemas terapéuticos
para evitar la detención del crecimiento y se ha
demostrado que la administración en días alternos
mejora 50% la velocidad de crecimiento, y la dosis mayor en la mañana que en la noche aumenta
la posibilidad de lesionar el proceso de crecimiento. Estos efectos parecen ser transitorios, ya que la
talla genética familiar tiende a alcanzarse aunque
el crecimiento muestra un patrón retrasado (fig.
20-8).
Antineoplásicos
Fig. 20-6. Respuesta secretora de hormona de crecimiento
(GH) a la estimulación aguda con hormona liberadora de hormona de crecimiento (GHRH), tras cuatro días de administración de prednisona.
En términos generales limitan de manera intensa la
capacidad de crecimiento y reproducción celular.
Algunos, como la 6-mercaptopurina, el metotrexato y la azatioprina, inhiben la biosíntesis del anillo
de purinas; esto limita la cantidad de precursores
necesarios para la formación de ácidos nucleicos,
con la consiguiente disminución de la capacidad
de síntesis proteínica. Las hidroxiureas bloquean
la biosíntesis de desoxirribonucleótidos al bloquear
la actividad de la enzima ribonucleótido reductasa,
y el 5-fluorouracilo inhibe la síntesis de monofosfato de desoxitimidina (fig. 20-9).
Otros fármacos que alteran directamente la síntesis del ácido desoxirribonucleico son: citarabina,
230
Sección III • Talla baja por diversos trastornos
Fig. 20-7. Proliferación de condrocitos con aplicación constante de hormona de crecimiento (GH), dexametasona y con ambos
en el medio de cultivo.
mitomicina, cisplatino y los agentes alquilantes del
tipo de la mostaza nitrogenada, ciclofosfamida,
clorambucil y melfalán (fig. 20-9).
Las bleomicinas, dactinomicina y daunorrubicina, producen daño directo a la molécula de ácido
desoxirribonucleico e impiden su reparación, mientras que la doxorrubicina y la actinomicina-D bloquean la transcripción de ese ácido (fig. 20-9).
Finalmente, algunos antineoplásicos originan
alteraciones en los mecanismos involucrados de
manera directa en la duplicación celular. Entre ellos
se encuentra la L-asparaginasa que bloquea el funcionamiento de la desaminasa de asparagina, así
como la vinblastina, la vincristina y la colquicina
que dañan a los microtúbulos celulares, con lo que
la orientación del material genético y de los organelos celulares no se lleva a cabo de manera fisiológica (fig. 20-9).
Fig. 20-8. Gráfica del crecimiento de un paciente bajo tratamiento con esteroides.
Radioterapia
Los efectos de la radioterapia dependen de la dosis
total, de la edad al recibirla y de uno o más sitios
radiados.
La radioterapia aplicada a la altura de fosa
anterior del cráneo produce deficiencia de hormona de crecimiento con afección general del fenómeno, y cuando se aplica en la fosa posterior o
columna vertebral limita el desarrollo del segmento superior.
Se ha demostrado que los pacientes con antecedentes de radioterapia para tumores intracraneales (craneofaringiomas, meduloblastomas, gliomas,
germinomas, etc.) sufren deficiencia total o parcial
de hormona de crecimiento, ya que en estos casos
el campo de radiación involucra directamente la
región hipotalamohipofisaria. Los pacientes con
tumores orbitarios (retinoblastoma) y nasales presentarán deficiencia casi total de hormona de crecimiento en un lapso de dos a ocho años aunque
durante el tratamiento se proteja la hipófisis.
Sin duda, los pacientes que reciben radiación
corporal total (preparación para trasplante de médula ósea) tienen mayores posibilidades de daño al
somatototropo y de agravamiento de la lesión que
aquéllos con radioterapia "profiláctica" al sistema
nervioso central (leucemias).
La aplicación intracraneana o craneospinal de
más de 3 000 cGy en total, sin importar el número
de sesiones y la duración del tratamiento, revela
deficiencia de hormona de crecimiento en un lapso
máximo de cinco años en 100% de los pacientes.
Con dosis menores, la deficiencia total se presenta
en alrededor de 65%; pero cuando el paciente ya
alcanzó la pubertad sólo se altera la neurosecreción
(fig. 20-10).
El dato clínico más sensible para demostrar
alteración en la secreción de hormona de crecimien-
Capítulo 20 • Detención del crecimiento por agentes terapéuticos
231
Fig. 20-9. Mecanismo de acción de los antineoplásicos sobre el crecimiento celular.
to es la velocidad de crecimiento, por lo que ésta
debe analizarse de manera periódica. Además, cuando se corrobora la existencia de detención del cre-
Fig. 20-10. Gráfica de la secreción de hormona de crecimiento basal y con estimulación aguda mediante hormona liberadora de hormona de crecimiento (GHRH), en pacientes
con antecedentes de radioterapia en comparación con sujetos
control sanos.
cimiento es necesario estudiar la posibilidad de
hipotiroidismo de origen hipofisario o hipotalámico, ya que éste se manifiesta hasta en 50% de los
pacientes con radioterapia craneal, y aquellos que
reciben radioterapia craneospinal presentan afección tiroidea primaria en un porcentaje similar.
La gravedad de la alteración del crecimiento
espinal es mayor entre menor sea la edad del paciente. Por ello, los menores de 10 años padecen
mayor detención del crecimiento en el segmento
superior que a su vez origina desproporción corporal; sin embargo, esta disarmonía se evidencia hasta que el paciente presenta el brote de crecimiento
pubescente.
En términos generales, los pacientes con deficiencia total o parcial de hormona de crecimiento
secundaria a la radioterapia tienen una buena respuesta a la aplicación de hormona de crecimiento
biosintética, en torno a la cual es necesario considerar lo siguiente:
1. El uso de hormona de crecimiento biosintética
en los dos primeros años posteriores a la erradicación de la neoplasia se relaciona con mayor riesgo de recurrencia. En la actualidad
parece claro que este fenómeno no implica que
la hormona sea cancerígena sino que acelera
el crecimiento de la neoplasia existente pero
232
Sección III • Talla baja por diversos trastornos
no demostrada a través de los métodos convencionales de estudio.
2. La hormona de crecimiento acelera la velocidad de crecimiento en pacientes que presentan
crecimiento desproporcionado por alteración
del segmento superior; pero acentúa la desproporción porque el segmento inferior (brazos y
piernas) es ligeramente más sensible a la hormona que el superior; por otro lado, estos pacientes tienen daño primario en la columna
vertebral que limita la capacidad de respuesta
al medicamento.
Por último es conveniente señalar que la radioterapia entre los tres y los seis años de edad puede
originar pubertad precoz verdadera. Las niñas la
desarrollan con más frecuencia y a menor edad. Por
tanto, una aceleración de la velocidad de crecimiento no explicada debe inducir a pensar en este trastorno.
LECTURAS RECOMENDADAS
Bartlett DL, Charland S, Torosian MH. Growth hormone,
insulin and somatostatin therapy of cancer cachexia.
Cancer 1994;73:1499.
Burguera B, Murruais C, Peñalva A, Dieguez C, Casanueva
FF. Dual and selective actions of glucocorticoids upon
basal and stimulated growth hormone release in man.
Neuroendocrinology 1990;51:51.
Cassorla F, Mericq V, García H, Cristiano A, Avila A, Boric
A, Iñiguez G, Merriam GR. The effects of beta 1-adrenergic blockade on the growth response to growth hormone releasing hormone therapy in deficient children.
J Clin Endocrinol Metab 1995;80:2997.
Chou RH, Wong GB, Kramer JH, Wara DW, Matthay KK,
Crittenden MR, Swift PS, Cowan MJ, Wara WM. Toxicities of total-body irradiation for pediatric bone marrow transplantation. Int J Radiat Oncol Biol Phys 1996;
34:843.
Crowley S, Hindmarsh PC, Matthews DR, Brook CG.
Growth and the growth hormone axis in prepubertal
children with asthma. J Pediatr 1995;126:297.
Dieguez C, Mallo F, Señaris R, Pineda J, Martul P, Leal
AC, Pombo M, Casanueva FF. Role of glucocorticoids
in the neurorregulation of the somatotropic (GH) axis;
explication of gender differences in GH neurorregulation
in the humans. J Pediatr Endocrinol Metab 1996;9:255.
King AP, Carter SC. Dexamethasone-induced antagonism
of GH action by down-regulation of GH binding in 3T3F442A fibroblasts. Endocrinology 1995;136:4796.
Martin AJ, Landau LI, Phelan PD. The effect on growth of
childhood asthma. Acta Paediatr Scand 1981;70:683.
Ninan T, Russell G. Asthma, inhaled corticosteroid treatment and growth. Arch Dis Child 1992;67:703.
Ogilvy ALS, Shalet SM. Growth and puberty after growth
hormone treatment after irradiation for brain tumours.
Arch Dis Child 1995;73:141.
Roman J, Villaizan CJ, Garcia FJ, Azcona C, Salvador J,
Sierrasesumaga L. Chemotherapy-induced growth hormone deficiency in children with cancer. Med Pediatr
Oncol 1995;25:90.
Sanchez CP, Goodman WG, Brandli D, Goldenhersh M,
Murray C, Carlton E, Hahn T, Salusky IB. Skeletal response to recombinant human growth hormone in children treated with long-term corticosteroids. J Bone
Miner Res 1995;10:2.
Sklar CA, Constine LS. Chronic neuroendocrinological
sequelae of radiation therapy. Int J Radiat Oncol Biol
Phys 1995;3O:11I3.
Solimán AT, Madina EH, Abdel MF, El-Zalabany MM,
Asfour M, Morsi MI. Nocturnal growth hormone (GH)
secretion and GH response to clonidine provocation in
children before and after long-term prednisone therapy.
JTrop Pediatr 1995;41:344.
Stubberfield TG, Byrne GC, Jones TW. Growth and growth
hormone secretion after treatment for acute lymphoblastic leukemia in childhood. 18-Gy versus 24-Gy cranial
irradiation. J Pediatr Hematol Oncol 1995;17:167.
Van der Berghe G, de-Zegher F, Lauwers P. Dopamine suppresses pituitary function in infants and children. Crit
Care Med 1994;22:1747.
Van der Berghe G, de-Zegher F, Lauwers P, Veldhuis JD.
Growth hormone secretion in critical ¡lines: effect of
dopamine. J Clin Endocrinol Metab 1994;79:1141.
Vassilopoulou S, Klein MJ, Moore BD, Reid HL, Ater J,
Zietz HA. Efficacy of growth hormone replacement
therapy in children with organic growth hormone deficiency after cranial irradiation. Horm Res 1995;43:188.
Volovitz B, Amir J, Malik H, Kauschansky A, Varsano I.
Growth and pituitary function in children with severe
asthma, treated with inhaled budenoside. N Engl J Med
1993;329:1703.
Indice alfabético
Nota: Los números en cursivas se refieren a ilustraciones; los que van seguidos por una c se refieren a cuadros.
A
Agenesia de páncreas, retraso de crecimiento intrauterino y, 137
Aborto, alteraciones de la hiperplasia y, 93
Absorción, de nutrimentos, talla baja y, 122
intestinal, diarrea crónica y, 187
nefropatía crónica y, 193
patrón retrasado de crecimiento y, 172
Acción intracelular de los factores de crecimiento, 26
Acetilcolina, hormona liberadora de hormona de crecimiento y, 28
somatostatina y, 27
Ácidos grasos libres, hormona de crecimiento y, 29, 32
Ácidos nucleicos, regulación genética y, 16
Acidosis metabólica, estatura baja y, 127
persistente, crecimiento y, 192-193, 194
Acidosis, corrección de la, crecimiento y, 197
energética del crecimiento y, 60
tubular renal, crecimiento y, 192-193, 197
detención del crecimiento y, 57
patrón, intrínseco de crecimiento y, 125, 126
retrasado de crecimiento y, 172
talla baja y, 123
Acondrogénesis, 146
Acondroplasia, 146c, 147-148, 147
retraso de crecimiento intrauterino y, 137
Acreción, signo positivo del crecimiento y, 10
Acromion, somatometría, en la, 74
Actinomicina-D, ácido desoxirribonucleico y, 230, 231
Acumulación de grasa, pospubertad y, 116
Adaptación extrauterina, deficiencia idiopática de hormona
de crecimiento y, 211
Adaptación psicosocial, deficiencia de hormona de
crecimiento y, 214
estatura baja y, 128
Adenohipófisis, deficiencia orgánica de hormona de
crecimiento y, 213
Adipocitos, factor de crecimiento tipo insulina-1 y, 36, 37
hormona de crecimiento y, 33
Administración, glucocorticoides, de los, 229
Adrenalina, hipoxemia y, 99
Adulto(s), detención del crecimiento, en el, 226
signo negativo del crecimiento y, 10, 12
signo neutro del crecimiento y, 10, 11
Agenesia renal, síndrome de Turner, en el, 205
Agente inductor, formación del, 18, 19
transcripción y, 17, 18
Agua, recuperación del retraso de crecimiento intrauterino
y, 139
Ajuste(es), del crecimiento posnatal, 106
genético del crecimiento, 166
de maduración del crecimiento, 166, 167
Alar, punto, somatometría, en la, 74
Albúmina, nefropatía crónica y, 193
proteínas transportadoras de la hormona de crecimiento y,
34
talla baja familiar y, 160
Alcalinización citoplásmica, acidosis metabólica, en la, 192
canal de sodio e hidrógeno en la, 67
ciclo oxidativo y, 67
desoxirribonucleico y, ácido, 67
duplicación de material genético y, 67, 68
factores de crecimiento en la, 67
Alcalosis metabólica, estatura baja y, 127
Alcoholismo, crecimiento fetal inadecuado y, 136
patrón retrasado de crecimiento y, 173
Alergia, a las proteínas de la leche, retrasos del crecimiento.
en los, 181
de vías respiratorias, talla baja y, 123
16-alfa hidroxilasa, hormona de crecimiento y, 30
Alfa-lipoproteinemia, patrón retrasado de crecimiento y, 180
5-alfa-reductasa, hormona de crecimiento y, 30
pubertad y, 110-111
Alimentación, adecuada, diseño de una, 6
información sobre, 6
dificultades para la, 140
recuperación del retraso de crecimiento intrauterino y,
139, 140
Alimentos, talla baja familiar y, 160
trastornos de la nutrición y, 177
Alquilantes, ácido desoxirribonucleico y, 230, 231
Alteraciones afectivas, factores orgánicos del crecimiento,
en los, 58
Alteración cromosómica, embarazo y, 94
placenta y, 95
233
234
Indice alfabético
Alteraciones celulares, detención del crecimiento, en la,
228-232
Alteraciones congénitas, receptor de hormona de crecimiento y, 219
Alteraciones del crecimiento, paciente con, expresiones
sobre el, 5
ideas sobre, 5
plan de estudio del, 5
tratamiento del, 5
Alteración(es) genética(s), deficiencia genética de hormona
de crecimiento y, 213
dismorfias y, 140
expresión de proteína transportadora de hormona de
crecimiento y, 222
gameto femenino y, 94
gameto masculino y, 94
patrón intrínseco de crecimiento y, 125, 124
Alteraciones digestivas enzimáticas, energética del
crecimiento y, 60
Alteraciones emocionales, deficiencia de hormona de
crecimiento, 211
Alteraciones en oído medio, síndrome de Turner, en el, 205
Alteraciones génicas, displasias óseas, en las, 145
Alteraciones hormonales, crecimiento en enfermedades
renales y, 195-199, 196
Alteraciones neurológicas, ingreso inadecuado y, 56
recuperación del retraso de crecimiento intrauterino y,
140, 141
Alteraciones nutricias, causas de, 55
crecimiento en enfermedades renales y, 193-195
deficiencia de hormona de crecimiento y, 209, 211
diferenciación celular y, 60
factor orgánico del crecimiento, como, 55
programas dietéticos y, 55
segmento inferior y, 211
segmento superior y, 211
sustitutos alimentarios y, 55
talla baja familiar y, 160
talla baja y, 122
Alteraciones orgánicas, estatura baja y, 128
Alteraciones placentarias, somatotropina coriónica y, 97
Alteraciones del receptor, resistencia a la hormona de
crecimiento, en la, 220, 220
Alteraciones renales, síndrome de Turner, en el, 205
Alteración respiratoria, displasias óseas y, 144
Alteraciones visuales, deficiencia orgánica de hormona de
crecimiento y, 212
Altura, craneal, somatometría, en la, 75
facial, deficiencia de hormona de crecimiento y, 214
de los labios, deficiencia de hormona de crecimiento y,
214
morfológica de la cara, somatometría, en la, 76
de la nariz, deficiencia de hormona de crecimiento y, 214
somatometría, en la, 76
Amenorrea primaria, síndrome de Turner, en el, 202
Amerindios, grasa y, 214
Amibiasis, malabsorción y, 56
Aminoácidos, hormona de crecimiento y, 29
insulina fetal y, 98
lípidos y, 99
placenta y, 97
Aminopterina, crecimiento fetal inadecuado y, 136
Anabólicos, síndrome de Turner, en el, 206
Anabolismo, fetal, placenta y, 97
regulación genética y, 15
Análisis del crecimiento, dinámica del, 119-120
signo del fenómeno en el, 10
Análisis estacional, crecimiento entre los dos primeros años
y el inicio de la pubertad y, 109
Análisis inicial sindromático del paciente con talla baja,
124, 126
Análisis de la detención del crecimiento, 226
Anchura bicigomática, somatometría, en la, 75
Anchura, fisiognómica de la cara, somatometría, en la, 75
de la nariz, deficiencia de hormona de crecimiento y, 214
somatometría, en la, 76
Andrógenos, hormona de crecimiento y, 29, 30
retraso constitucional del crecimiento, en el, 170
suprarrenales, pubertad y, 114
talla baja familiar y, 161
Anemia materna, catecolaminas y, 99
Anemia, colitis ulcerosa, en la, 185
crecimiento fetal inadecuado y, 135
crecimiento intrauterino proporcionado y, 133
difenilhidantoína y, 228
energética del crecimiento y, 60
enfermedad de Crohn, en la, 185
mecanismos de la detención del crecimiento en la, 194
nefropatía crónica y, 194
patrón intrínseco de crecimiento y, 125, 125
patrón retrasado de crecimiento y, 174
talla baja familiar y, 160
talla baja y, 123
Anorexia, enfermedad de Crohn, en la, 184
fibrosis quística del páncreas, en la, 183
nefropatía crónica y, 193
nerviosa, hormona de crecimiento y, 29
ingreso inadecuado y, 56
resistencia a la hormona de crecimiento y, 219
patrón retrasado de crecimiento y, 172
talla baja y, 123, 124
trastornos de la nutrición y, 177
Anormalidades, esqueléticas, síndrome de Turner, en el, 203
moleculares, resistencia parcial a hormona de crecimiento
y, 224
Antecedentes, heredofamiliares, retraso constitucional del
crecimiento, en el, 164, 165
patológicos, picos de secreción y, 216
retraso constitucional del crecimiento, en el, 171-175
Anticoagulantes, crecimiento fetal inadecuado y, 136
Anticolinérgicos, hormona liberadora de hormona de
crecimiento y, 122
Anticuerpos, receptor de hormona de crecimiento, contra,
219
resistencia a la hormona de crecimiento y, 219
Antidepresores, crecimiento fetal inadecuado y, 136
tricíclicos, detención del crecimiento, en la, 228
Antihipertensores, crecimiento fetal inadecuado y, 136
Antihistamínicos, detención del crecimiento, en la, 227, 227
hormona del crecimiento y, 58
hormona liberadora de hormona de crecimiento y, 122,
227, 227
sitio de acción de los, 227, 227
velocidad de crecimiento y, 227
Antineoplásicos, crecimiento celular y, 229, 229
detención del crecimiento, en la, 229, 229, 230
duplicación celular y, 229, 230
Antiserotoninérgicos, hormona del crecimiento y, 58
hormona liberadora de hormona de crecimiento y, 121
detención del crecimiento, en la, 227, 228
Antitiroideos, crecimiento fetal inadecuado y, 136
Aparato auditivo, crecimiento de los dos primeros años y, 106
hormonas tiroideas y, 106
Indice alfabético
Aparato de Golgi, transcripción y, 21
Apetito, ingreso inadecuado y, 56
Apgar, escala de, deficiencia idiopática de hormona de
crecimiento y, 211
Aplasia de médula ósea, deficiencia orgánica de hormona de
crecimiento y, 212
Aporte calórico, desnutrición crónica y, 178
signo positivo del crecimiento y, 10
Aporte de nutrimentos, talla baja y, 122
Aporte nutricio, crecimiento fetal inadecuado y, 135
placenta y, 97
recuperación del retraso de crecimiento intrauterino y, 138
signo neutro del crecimiento y, 10
Area muscular, deficiencia de hormona de crecimiento y,
214
Arginina, hormona de crecimiento y, 29
receptor de hormona de crecimiento, del, 221
retraso constitucional del crecimiento, en el, 175
talla baja familiar y, 156
Armonía corporal, medición de la, 120
talla baja familiar y, 155, 160
Armonía del crecimiento, proporciones corporales y, 119
Aromatasas, pubertad y, 110
Arterieesclerosis, recuperación del retraso de crecimiento
intrauterino y, 139
Artritis, colitis ulcerosa, en la, 185
Ascaridiasis, malabsorción y, 56
Asimetría facial, resistencia total a hormona de crecimiento
y, 223
Asma, crecimiento fetal inadecuado y, 135
detención del crecimiento y, 57
patrón retrasado de crecimiento y, 172
talla baja y, 123
Astemizol, hormona del crecimiento y, 57
Astrocitoma, deficiencia orgánica de hormona de crecimiento y, 212
ATP. Véase Trifosfato de adenosina.
Atresia de duodeno, retraso de crecimiento intrauterino y,
137
Atrofia óptica, deficiencia orgánica de hormona de
crecimiento y, 212
Aumentos de estatura, talla baja familiar y, 158
Autocrina, comunicación celular, 25
Axogénesis, crecimiento de los dos primeros años y, 106
Azatriopina, ácidos nucleicos y, 229
biosíntesis de purinas y, 229
síntesis proteínica y, 229
B
Balance energético térmico, 66
Bandas cromosómicas, cariotipo y, 17
Barbitúricos, detención del crecimiento, en la, 228, 228
hormona de crecimiento y, 228
hormona liberadora de hormona de crecimiento y, 228,
228
sitio de acción de los, 228, 228
somatostatina y, 228
Barrera hematoencefálica, antihistamínicos y, 227
antiserotoninérgicos y, 227
bloqueadores beta y, 227
Bartter, síndrome de, estatura baja y, 127
patrón retrasado de crecimiento y, 172
velocidad de crecimiento, en el, 191, 192, 194
Bases neuroendocrinas del crecimiento, 25-49, 47, 48
diferenciación y crecimiento óseos en las, 44-48, 48
factores de crecimiento para la, 45-49, 48
235
factor(es) de crecimiento tipo insulina, 34-40, 47
-1, 35-37, 38
-2,37
proteína(s) transportadora(s) de, 38, 38
-1,39
-2,39
-3, 39-40
-4,40
-5,40
-6, 40, 41
proteasas de, 40, 40
receptores para los, 37-38
factor(es) de crecimiento, autocrinos y paracrinos en las,
41-44
derivado de plaquetas en las, 41
epidérmico en las, 40, 41
fibroblastos, de los, en las, 41, 42
nerviosos en las, 42-43, 42
transformador beta en las, 41
vitamina D como, 41-42, 43
factores de crecimiento en las, 25-26, 48
características generales de los, 26, 27
funciones de los, 25
hormona de crecimiento en las, 26-34, 27
proteínas transportadoras de la, 34
receptor de la, 32-34, 32
regulación de la secreción de la, 26-32, 30
síntesis y efectos directos de la, 30-32
sistema de la, 26
17-beta-estradiol, placenta y, 97, 96
5-beta-hidroxilasa, hormona de crecimiento y, 30
Beta-lipoproteinemia, patrón retrasado de crecimiento y,
180
Bicarbonato sérico, retraso constitucional del crecimiento,
en el, 173
talla baja familiar y, 160
Bilirrubinas séricas, proteínas transportadoras de la
hormona de crecimiento y, 34
Biometría hemática, estatura baja y, 127
retraso constitucional del crecimiento, en el, 173
talla baja familiar y, 160
Blastocisto, formación del, 93, 94
Bleomicina, ácido desoxirribonucleico y, 230, 231
Bloqueadores adrenérgicos, hormona liberadora de
hormona de crecimiento y, 122
Bloqueadores beta, detención del crecimiento, en la, 227,
227
hormona liberadora de hormona de crecimiento y, 227,
227
sitio de acción de los, 227, 227
somatostatina y, 227, 227
Bombesina, alcalinización citoplásmica y, 67, 67
Brazada, armonía corporal y, 120
estatura y, 211
somatometría, en la, 76
velocidad de crecimiento y, 211
Britten y Davidson, teoría de, 17
C
Cabello fino, displasias y, 150
Cabello, deficiencia de hormona de crecimiento y,
214
resistencia total a hormona de crecimiento y, 223
Cadena respiratoria, hipotiroidismo y, 66
temperatura corporal y, 65, 66
Calcificación, pubertad y, 112
236
Indice alfabético
Calcio, acidosis metabólica, en la, 192
alcalinización citoplásmica y, 67, 67
difenilhidantoína y, 228
estatura baja y, 127
hormona de crecimiento y, 32
Turner, síndrome de, en el, 203
Calcitonina, crecimiento de los dos primeros años y, 106
somatostatina y, 28
Cálculos vesiculares, enfermedad de Crohn, en la, 185
Calidad de vida, modificación de la, 4
Calor, eliminación de, 61, 62
producción de, 61
Canal de sodio e hidrógeno, alcalinización citoplásmica y,
67, 67
Caninos, crecimiento de los, testosterona y, 114
Cansancio muscular, deficiencia de hormona de crecimiento
y, 10
Capacidad, de crecimiento, pospubertad y, 115
de respuesta, órganos blanco y, 219
visual, deficiencia de hormona de crecimiento y, 214
Captación de minerales, síndrome de Turner, en el, 203
Caquexia oncológica, resistencia a la hormona de crecimiento y, 219
Cara, de muñeco, deficiencia de hormona de crecimiento y,
213
de querubín, deficiencia de hormona de crecimiento y.
213
puntos somatométricos de la, 212
Características, clínicas, deficiencia de hormona de
crecimiento, de la, 211-215
del crecimiento, clona celular y, 16
dos primeros años, de los, 107
entre los dos primeros años y el inicio de la pubertad,
109, 110
físicas, síndrome de Turner, en el, 200, 205
genéticas, vello corporal y, 114
maternas en el crecimiento prenatal, 100-101, 100
sexuales, retraso constitucional del crecimiento, en el, 169
típicas, resistencia a la hormona de crecimiento, de la,
222-223
Carbohidratos, placenta y, 137
resistencia total a hormona de crecimiento y, 223
Cardiopatía(s), deficiencia de hormona de crecimiento y, 211
energética del crecimiento y, 60
materna, catecolaminas y, 99
patrón intrínseco de crecimiento y, 125, 125
patrón retrasado de crecimiento y, 173
síndrome de Turner, en el, 205
talla baja y, 123
Cariotipo, análisis del, retraso del crecimiento intrauterino
y, 131
estatura final y, 203, 203 c
retraso constitucional del crecimiento, en el, 173
en sangre periférica, estatura baja y, 127, 128
Cartílago, de crecimiento, hormona de crecimiento y, 196
insuficiencia renal crónica y, 196, 197
y, diferenciación y crecimiento óseos, 47, 48
Catabolismo, regulación genética y, 15
Catecolaminas, células anormales y, 99
flujo placentario y, 99
hipoxia y, 99
insulina fetal y, 99
madre diabética y, 100
nutrimentos y, 99
Causas en el paciente con talla baja, 120-124, 124
Cefalea, deficiencia orgánica de hormona de crecimiento y,
212
Cefalocaudal, crecimiento, 79
Cefalocentrífugo, crecimiento, 79, 80
Ceguera, deficiencia de hormona de crecimiento y, 214
Célula(s), diferenciada, capacidad reproductora de
la, 9
funciones de la, 9
velocidad de recambio y, 9
fetales, mitocondrias y, 100
totipotenciales, diferenciación de las, 9
velocidad de recambio y, 9
número de, hiperplasia y, 8
hipertrofia y, 8
Centrípeto, crecimiento, 79
Cerebro, metabolismo basal y, 62
Cesárea, deficiencia idiopática de hormona de crecimiento
y, 212
Cianosis, talla baja y, 123
Cicatrización, signo positivo del crecimiento y, 10
Ciclo, celular, factores de crecimiento y, 25
energético, 67
Ciclofosfamida, ácido desoxirribonucleico y, 230, 231
Cigión, somatometría, en la, 74
Cigoto, insulina fetal y, 97
Cinemática del crecimiento, 69-89, 77c, 78
determinante fundamental de la, 69
dirección del crecimiento en la, 79-80
relación segmentaria en la, 79, 80
modelos de referencia en la, 69-72,
elaboración de los, 71, 72, 73
estudios longitudinales en los, 70
estudios semi longitudinales en los, 70, 71
estudios transversales en los, 70
momento del crecimiento en la, 69, 85-88
edad dental en el, 87
edad ósea en el, 85-87
índice de maduración sexual en el, 87
somatometría genital en el, 87-88
ritmo del crecimiento en la, 69, 79-82
somatometría en la, 73-79
análisis de la, 76-79
medidas más importantes para la, 74-76
puntos de referencia para la, 73, 74
velocidad del crecimiento en la, 69, 82-85
Ciproheptadina, detención del crecimiento, en la, 228
Circunferencia, cefálica, percentiles de la, 78
del pene, somatometría, en la, 76
Cirrosis hepática, proteínas transportadoras de la hormona
de crecimiento y, 34
Cirugía abdominal, resistencia a la hormona de crecimiento
y, 219
Cisplatino, ácido desoxirribonucleico y, 230, 231
Citarabina, ácido desoxirribonucleico y, 230, 231
Citocina-hematopoyetina, receptores, receptor de hormona
de crecimiento y, 219
Citoesqueleto, expresión de los genes y, 16
Citomegalovirus, deficiencia orgánica de hormona de
crecimiento y, 212
retraso de crecimiento intrauterino y, 137
Citoplasma, factores de crecimiento y, 26
Citotrofoblasto, somatotropina coriónica y, 96
Clasificación, deficiencia de hormona de crecimiento, de la,
211-214, 219
resistencia a la hormona de crecimiento, de la, 219
Clona(s) celular(es), crecimiento de la, 16
desarrollo de la, 16
diferenciación de la, 16
especialización de la, 16
Indice alfabético
etapas de la, 16
expresión funcional de genes y, 16
factores de crecimiento y, 25
gen sensor-integrado y, 18, 19
genes y, 16
Clonidina, retraso constitucional del crecimiento, en el,
167, 173
somatostatina y, 27, 28
talla baja familiar y, 156
Clorambucil, ácido desoxirribonucleico y, 230, 231
Clorfeniramina, detención del crecimiento, en la, 227
Cloro, estatura baja y, 127
Coactivadores de la transcripción, región TATA y, 19
Cobre, absorción de, diarrea crónica y, 187
Codo, resistencia total a hormona de crecimiento y, 223
Coeficiente intelectual, síndrome de Turner, en el, 205
Colágena, difenilhidantoína y, 228
Colesterol, hormona de crecimiento y, 31
placenta y, 96, 97
Colitis ulcerosa, alteraciones del crecimiento en la,
185-186
crecimiento en la, 186
crecimiento fetal inadecuado y, 135
etiología de la, 185
manifestaciones de la, 185
patrón retrasado de crecimiento y, 172
talla baja y, 123
talla final y, 56
tratamiento de la, 186-187
Colquicina, duplicación celular y, 230, 231
Columna vertebral, pospubertad y, 115
Complejo basal de transcripción, región TATA y, 20
Composición corporal, alteración de tejidos y, 8
armonía del crecimiento, 119
cambios pubescentes y, 110
crecimiento de recuperación y, 188
modificación de tejidos y, 8
pospubertad y, 115
reemplazo de tejidos y, 8
sustitución de tejidos y, 8
talla baja familiar y, 155, 160
Comunicación arteriovenosa, patrón retrasado de crecimiento y, 173
Comunicación intercelular, autocrina, 25
crecimiento y, 25
endocrina, 25
factores de crecimiento y, 25
interacciones celulares y, 25
paracrina, 25
Comunidad, necesidades de la, 5
Condensación celular, crecimiento y, 25
Condiciones de vida, crecimiento y, 12
estatura final y, 12
homeorresis y, 12
proporcionalidad y, 12
Condiciones sociales y ambientales en el paciente con talla
baja, 123, 124
Condiciones supresoras del crecimiento, 5
Condrocito(s), crecimiento de recuperación y, 188
diferenciación y crecimiento óseos y, 47, 47
factor de crecimiento tipo insulina-1 y, 36, 37
hormona de crecimiento y, 33
uremia y, 195
Condrodisplasia metafisaria, Jansen, tipo, 153
McKusik, tipo, 146c, 153
Schmid, tipo, 146c, 152
Schwachman, tipo, 153
237
Condrodisplasia punctata, no rizomélica, 148
rizomélica, 147, 148
Conducto arterial, patrón retrasado de crecimiento y, 173
Congénita, resistencia, a la hormona de crecimiento, 220, 220
Consanguinidad, deficiencia genética de hormona de
crecimiento y, 213
Consumo calórico, fibrosis quística del páncreas, en la, 183,
184
Control, del crecimiento proporcionado, 189
del crecimiento, características del, 137
genético, cambios pubescentes y, 110
neuroendocrino, cambios pubescentes y, 110
crecimiento entre los dos primeros años y el inicio de
la pubertad y, 108
Coordinación neuromuscular, deficiencia de hormona de
crecimiento y, 214
Coproparasitoscópico, estatura baja y, 127
retraso constitucional del crecimiento, en el, 173
Corazón, metabolismo basal y, 62
Corticosteroides, velocidad de crecimiento en la, 191
Cortisol, desnutrición crónica y, 178
Cráneo, puntos somatométricos del, 74
Craneofaringioma(s), deficiencia orgánica de hormona de
crecimiento y, 212
hormona de crecimiento y, 230
Creatinina, estatura baja y, 127
Crecimiento, actual, patrón intrínseco de crecimiento y,
124, 125
alterado, normalidad del, 3
características del, genes y, 12
celular, cromosoma X y, 16
estadio de, genes y, 16
factor de crecimiento tipo insulina-1 y, 122
fenotipo y, 23
fetal, 22, 23
genotipo y, 23
máximo, 22, 23
óptimo, 22, 23
posnatal, 23
con esteroides, 230
en enfermedades renales, 191-199, 192
acidosis metabólica persistente y, 192-193
acidosis tubular y, 192-193, 196
alteraciones hormonales y, 195-199
alteraciones nutricias y, 193-195
osteodistrofia renal y, 195
espinal, radioterapia y, 231
esquelético, deficiencia de hormona de crecimiento y, 211
familiar, parámetros del, 118
como fenómeno biológico, 8-11, 12
análisis del, 10
composición corporal, cambio de, en el, 8-10
definición del, 8
forma, cambio de, en el, 8-10
hiperplasia en el, 8-10
hipertrofia en el, 8-10
masa, incremento de, en el, 8-10
signo, del, 8, 12
positivo, 10, 12
neutro, 10, 11
negativo, 10, 11
velocidad de recambio en el, 8-10
volumen, incremento de, en el, 8-10
como fenómeno social, 3-7, 8
características que interactúan sobre el, 8
comprensible para la comunidad, 3, 4
comunicación intercelular y, 25
238
Indice alfabético
concepto de, 3
decremento secular del, 12, 13
deprivación nutricia y, 6-7
dinámico, 3
estudios del, 3-5
fallas de los, 4-5
modelos nacionales del, 4
óptimo, 3
promoción y vigilancia del, 5
estrategias de la, 5, 6
vigilancia del, 3, 4
genital, edad biológica y, 85
incremento secular del, 12, 13
inicial, características del, 8
intrauterino, altura sobre el nivel del mar y, 101, 102
deficiencia de hormona de crecimiento y, 209
latitud geográfica y, 102
resistencia total a hormona de crecimiento y, 222
retraso del, hijos de madres con, 101
retraso del. Véase Retraso, del crecimiento intrauterino.
segmento inferior y, 211
segmento superior y, 211
talla baja familiar y, 159
Turner, síndrome de, en el, 200
variaciones climáticas y, 102
lineal, masa previa y, 138
recuperación del retraso de crecimiento intrauterino y, 137
del niño, norma técnica para el control del, 5
óptimo, capacidad genética y, 3
comunidad mexicana y, 6
derecho de todos los niños, como, 6, 7
dirección del, 4
educación óptima y, 7
mantenimiento del, 4
momento del, 4
Organización Mundial de la Salud y, 6, 7
ritmo del, 4
velocidad del, 4
óseo, pospubertad y, 115
posnatal, 103-105, 104
desde los dos años hasta la pubertad, 105, 107-110
dos primeros años de edad en el, 105-107, 105
estatura, incremento de, en el, 103-105, 104
glucocorticoides y, 122
gónadas, maduración de las, en el, 114-115
hipotiroidismo y, 122
maduración púbica en el, 113-114
mamas, maduración de las, en el, 112-113
paratohormona y, 122
peso, incremento de, en el, 103-105
pospubertad, en la, 115-116
pubertad, en la, 110-115
resistencia total a hormona de crecimiento y, 222
tipos de, 103-105, 104
velocidad del, 103-105, 105
vitamina D y, 122
prenatal, 93-102, 104
características maternas en el, 100-101, 100
efectos ambientales sobre el, 101-102
factores maternos del, 100
placenta, la, en el, 95-97, 96
regulación fetal del, 97-100, 96
proceso multifactorial, como, 25
programación genética y, 177
progresión normal del, 210
proporcionado, control del. Véase Control del crecimiento
proporcionado.
proporcional secundario, 82
pubescente, patrón de maduración y, 111
proporcionalidad corporal y, 114
de recuperación, acidosis tubular y, 191
alergia a las proteínas de la leche, en la, 181
composición corporal y, 188
corticosteroides y, 191
deficiencia de hormona de crecimiento y, 209
diabetes insípida nefrogénica y, 191
diarrea crónica y, 187, 188
enfermedad celiaca, en la, 180, 181
fibrosis quística del páncreas, en la, 182
infecciones de vías urinarias y, 191, 192
infestación por giardia, en la, 182
pubertad y, 188
retrasos del crecimiento, en los, 188-189
Turner, síndrome de, en el, 201
velocidad de crecimiento y, 105, 106
requerimientos del, 55
retardo del, 93, 94
retraso constitucional del. Véase Retraso constitucional
del crecimiento.
en el síndrome de Turner. Véase Turner, síndrome de,
crecimiento en el.
Crisis convulsivas, detención del crecimiento, en la, 228
Crohn, enfermedad de, alteraciones del crecimiento en la,
185-186
crecimiento en la, 185
crecimiento fetal inadecuado y, 135
manifestaciones de la, 184, 185
origen de la, 184
patrón retrasado de crecimiento y, 172
talla baja y, 123
talla final y, 56
tratamiento déla, 186-188
Cromoglicato, detención del crecimiento, en la, 227
Cromosoma(s), cinco, receptor de hormona de crecimiento
y, 219
factor de crecimiento, tipo insulina-1, del, 34
tipo insulina-2, del, 35
sexual, estatura final y, 94
retraso psicomotriz y, 94
talla al nacer y, 94
X, crecimiento celular y, 16
deficiencia genética de hormona de crecimiento y, 213
estatura final y, 202
Turner, síndrome de, en el, 200
Cronómero, bandas cromosómicas y, 17
cariotipo y, 17
núcleo de interfase y, 17
Cuerpo, puntos somatométricos del, 75
Cultivo de orina, estatura baja y, 128
Curva de crecimiento, retraso constitucional del crecimiento, en el, 164
D
Dactilión, somatometría, en la, 74
Dactinomicina, ácido desoxirribonucleico y, 230, 231
Daño neurológico, crecimiento intrauterino disarmónico y,
134
Daunorrubicina, ácido desoxirribonucleico y, 230, 231
Decremento secular del crecimiento, 12, 13
Defecto molecular, deficiencia genética de hormona de
crecimiento y, 213
Defectos de empalme, receptor de hormona de crecimiento,
del, 221, 222
Indice alfabético
Defectos en la síntesis, receptor de hormona de crecimiento,
del, 219
Defectos genéticos, insensibilidad total a la hormona de
crecimiento y, 220
receptor de ia hormona de crecimiento y, 219
Deficiencia, congénita, receptor de la hormona de crecimiento y, 219
de crecimiento, hepatopatías crónicas y, 122
nefropatías crónicas y, 122
de hormona de crecimiento, 208-218
armonía de las proporciones corporales y, 211
características clínicas de la, 211-215, 212
clasificación de la, 211, 212
crecimiento de recuperación y, 210
crecimiento intrauterino y, 210
deprivación proteínica y, 210
disfunción en la neurosecresión y, 215-217
edad ósea retrasada y, 210, 211
frecuencia de la, 208
genética, 213-214
idiopática, 211, 212
inducida por medicamentos, 210
malformaciones y, 212
orgánica, 212, 213
proporciones infantiles en la, 211
talla baja prenatal y, 209
talla baja y, 208-210
tipo IA, 213
tipo IB, 213
tipo II, 213
tipo III, 213
velocidad de crecimiento subnormal y, 208-210
enzimáticas entérales, talla baja y, 123
gonadotrópica, micropene y, 214
pubertad retrasada y, 214
Definición, resistencia a la hormona de crecimiento, de la,
219
Deglución, ingreso inadecuado y, 56
Deleciones, complejas del receptor de hormona de
crecimiento, 222
retraso de crecimiento intrauterino y, 137
Demanda energética, signo neutro del crecimiento y, 10, 11
Densidad urinaria, estatura baja y, 127
Dentición primaria, resistencia total a hormona de
crecimiento y, 222
Depuración de hormonas, flujo sanguíneo renal y, 195
Desarrollo, beneficios de reconocer el, 4
concepto de, 3
endocrinológico con la edad, 81
fetal, vigilancia del, 134-137, 134
individual, aspectos del, 3
factores socioeconómicos y culturales y, 53-55
intelectual, resistencia total a hormona de crecimiento y,
222
motor, resistencia total a hormona de crecimiento y.
222
del niño, Norma técnica para el control del, 5
de la pubertad, retraso constitucional del crecimiento, en
el, 169-170
tecnológico, factores socioeconómicos y culturales, en
los, 52, 53
Desempeño escolar, recuperación del retraso de crecimiento
intrauterino y, 139
Desempleo, síndrome de Turner, en el, 205
Deshidratación materna, catecolaminas y, 99
Deshidroepiandrosterona, sulfato de, placenta y, 96, 97
retraso constitucional del crecimiento, en el, 169
239
Desnutrición, corrección de la, crecimiento y, 197
crecimiento intrauterino disarmónico y, 133
crónica, diferencias en tamaño final, en la, 179, 188c
recuperación de la, 179
retrasos del crecimiento, en los, 178-180, 179
deficiencia de hormona de crecimiento y, 210
diferenciación celular y, 60
división celular y, 59
energética del crecimiento y, 60
hormona de crecimiento y, 29
intrauterina, 132
materna, catecolaminas y, 99
peso y edad y, 60
proteínas transportadoras de la hormona de crecimiento y,
34
resistencia a la hormona de crecimiento y, 219
secuencia de la, 189
Desoxirribonucleico, ácido, alcalinización citoplásmica y,
67,67
bloqueadores beta y, 227
descubierto, generación del, 17, 25
genes receptores y, 18
ribonucleico activador, ácido y, 18
ribonucleico mensajero, ácido y, 18
detención del crecimiento, en la, 227
fármacos que alteran el, 229, 230
genes sensor-integrados y, 17
gradiente del, 98
histonas y, 16
insulina fetal y, 98
no histonas y, 16
proteínas nucleares y, 16
receptores de la membrana y, 16
transcripción y, 17
Desproporción corporal, radioterapia y, 231
Detención del crecimiento por agentes terapéuticos, 226-227
adulto, en el, 226
alteraciones celulares en la, 228-232
análisis de la, 226-227
grupos control en la, 226
hormona de crecimiento en la, 227-228
knemómetro en la, 226
masa corporal en la, 226
niño, en el, 226
sensibilidad a los fármacos en la, 226
signo de crecimiento en la, 226
síntesis, velocidad de, en la, 226
uso continuo de fármacos en la, 226
uso intermitente de fármacos en la, 226
Detención del crecimiento, displasias óseas y, 122
Dexametasona, condrocitos y, 230
Diabetes, energética del crecimiento y, 60
estatura final y, 57
insípida, deficiencia orgánica de hormona de crecimiento
y, 213
mellitus, crecimiento fetal inadecuado y, 136
hormona de crecimiento y, 29
recuperación del retraso de crecimiento intrauterino y.
139
retraso del crecimiento intrauterino y, 132
patrón retrasado de crecimiento y, 173
resistencia a la hormona de crecimiento y, 219
Diacilglicerol, alcalinización citoplásmica y, 67, 67
hormona de crecimiento y, 34
Diagnóstico del paciente con, patrón atenuado de crecimiento, 126, 127
talla baja, 118-120
240
Indice alfabético
Diálisis peritoneal, hormona de crecimiento y, 198
Diámetro, anteroposterior de la cabeza, somatometría, en la,
75
biacromial, deficiencia de hormona de crecimiento y, 214
pospubertad y, 116
pubertad y, 116
somatometría, en la, 76, 77
bicrestal, pubertad y, 116
pospubertad y, 116
somatometría, en la, 76, 77
diafisiario, síndrome de Turner, en el, 203
transverso máximo de la cabeza, somatometría, en la, 75
Diarrea, colitis ulcerosa, en la, 185
crecimiento fetal inadecuado y, 135
Crohn, enfermedad de, en la, 185
crónica, retrasos del crecimiento, en los, 187, 188, 188c
energética del crecimiento y, 60
estatura baja y, 56
excreción anormal de nutrimentos y, 57, 58
fibrosis quística del páncreas, en la, 182
malabsorción y, 56
patrón retrasado de crecimiento y, 172
resistencia total a hormona de crecimiento y, 223
talla baja y, 123
Dieta(s), de consumo, nutrición y, 59
ingreso inadecuado y, 56
trastornos de la nutrición y, 177
Difenhidramina, detención del crecimiento, en la, 227
hormona del crecimiento y, 58
Difenilhidantoína, calcio y, 228
crecimiento fetal inadecuado y, 136
detención del crecimiento, en la, 228
hidroxiapatita y, 228
médula ósea y, 228
velocidad de crecimiento y, 228
vitamina D3 y, 228
Diferenciación, celular, alteraciones nutricias y, 60
compartimentalización y, 51
especificidad y, 18
estímulos específicos y, 9
gen productor y, 18
gen receptor y, 18
proceso de, 18
programación genética y, 9
crecimiento y, 25
y crecimiento óseos, 44-49, 44, 45
factores de crecimiento para la, 45-49, 45
Digestión, talla baja y, 122
Dihidrotestosterona, pubertad y, 110
Dimerización, receptor de hormona de crecimiento, del,
222
Dinkas, estatura poblacional promedio de los, 109
Dirección del crecimiento, condiciones de vida y, 12
genes y, 12
óptimo, 4
Disacaridasas intestinales, deficiencia de, retrasos del
crecimiento, en los, 182
Disco de crecimiento, difenilhidantoína y, 228
Discondrotenosis, 153
Disfunción cerebelosa, recuperación del retraso de
crecimiento intrauterino y, 139
Disfunción cerebral, nivel educacional y, 53
Disfunción en la neurosecresión, deficiencia de hormona de
crecimiento y, 215-217
Disfunción motriz, patrón retrasado de crecimiento y, 173
Disgerminoma, deficiencia orgánica de hormona de
crecimiento y, 212
Dismorfias, alteraciones genéticas y, 140
recuperación del retraso de crecimiento intrauterino y.
140
retraso de crecimiento intrauterino y, 137
Displasia, acromesomélica, 150
broncopulmonar, detención del crecimiento y, 57
campomélica, 146
cleidocraneal, 150
condroectodérmica, 149-150, 149
distrófica, 148
epifisiaria múltiple, 146c, 151, 152
espondiloepifisiaria congénita, 146c, 148
espondiloepifisiaria tardía, 146c, 152
espondiloepifisiaria, retraso de crecimiento intrauterino y,
137
espondilometafisiaria, 146c, 152
mesomélica, 150
metatrófica, 146c, 148
tanatofórica, 146
tanatofórica, retraso de crecimiento intrauterino y, 137
torácica asfixiante, 146, 147
tricorrinofalángica, 153
Displasia de cadera, resistencia total a hormona de
crecimiento y, 223
Displasia del iris, deficiencia orgánica de hormona de
crecimiento y, 212
Displasia ectodérmica, deficiencia orgánica de hormona de
crecimiento y, 212
Displasia septoóptica, deficiencia de hormona de crecimiento y, 214
deficiencia orgánica de hormona de crecimiento y, 212
Displasias óseas, 143-154, 146c
acondrogénesis en las, 146
acondroplasia en las, 146c, 147-148
alteración respiratoria en las, 144, 145
alteraciones génicas en las, 144
armonía corporal y, 120
condrodisplasia metafisiaría, tipo Jansen en las, 152
tipo McKusik en las, 146c, 153, 154
tipo Schmid en las, 146c, 152
tipo Schwachman en las, 153
condrodisplasia punctata, no rizomélica en las, 148
rizomélica en las, 147, 148
detención del crecimiento y, 122
diagnóstico diferencial de las, 145, 146, 148, 150,
151-152
discondrotenosis en las, 153
displasia, acromesomélica en las, 150
campomélica en las, 146
cleidocraneal en las, 150
condroectodérmica en las, 148-150
distrófica en las, 148
epifisiaria múltiple en las, 146c, 151, 152
espondiloepifisiaria congénita en las, 146c, 148
espondiloepifisiaria tardía en las, 146c, 152
espondilometafisiaria en las, 146c, 152
mesomélica en las, 150
metatrófica en las, 146c, 148
tanatofórica en las, 146
torácica asfixiante en las, 146, 147
tricorrinofalángica en las, 153, 154
edad ósea en las, 144
Ellis van Creveld, síndrome de, en las, 149-150
fracturas en las, 144
frecuencia de las, 145, 146c
genu varum en las, 144
hipocondroplastia en las, 146c, 151, 152
Indice alfabético
identificables desde el nacimiento, 146c, 145-150
identificadas durante la infancia, 146c, 150-154
inestabilidad atlantoaxil en las, 144
Kniest, síndrome de, en las, 150
patrón atenuado de crecimiento y, 126, 126
patrón intrínseco de crecimiento y, 125, 125
picnodisostosis en las, 153
retraso de crecimiento intrauterino y, 137
seudoacondroplasia en las, 152
somatometría de las, 143, 144
transmisión mendeliana de las, 144-154
Disproteinemia, energética del crecimiento y, 60
Distancia bigonial, deficiencia de hormona de crecimiento
y, 214
Distancia biocular, deficiencia de hormona de crecimiento
y, 214
Distancias alcanzadas, estudios longitudinales y, 70
estudios transversales y, 70
Distensión abdominal, ñbrosis quística del páncreas, en la,
182
patrón retrasado de crecimiento y, 172
Distermia, deficiencia orgánica de hormona de crecimiento
y, 212
Disuria, patrón retrasado de crecimiento y, 172
Diuréticos, catecolaminas y, 99
crecimiento fetal inadecuado y, 135
División celular, desnutrición y, 59
División meiótica, error genético y, 94
División(es) mitótica(s), crecimiento prenatal y, 93
error genético y, 94
estatura y, 93
estructuras extraembrionarias y, 94
óvulo fecundado y, 94
Dolor abdominal, colitis ulcerosa, en la, 185
enfermedad de Crohn, en la, 184
patrón retrasado de crecimiento y, 172
Dolor, patrón retrasado de crecimiento y, 172
Dominio transmembrana, receptor de hormona de crecimiento, del, 220
Dopamina, hipoxemia y, 99
hormona liberadora de hormona de crecimiento y, 27
Dosis, glucocorticoides, de los, 229
Down, síndrome de, retraso de crecimiento intrauterino y,
137
Doxorrubicina, ácido desoxirribonucleico y, 230, 231
Drogadicción, crecimiento fetal inadecuado y,
136
patrón retrasado de crecimiento y, 173
Duplicación celular, antineoplásicos y, 230, 231
E
Eccema, detención del crecimiento y, 57
Edad biológica, cambios pubescentes y, 110
determinación de la, 85, 120
disfunción neurosecretora de hormona de crecimiento y,
216
edad cronológica y, 118, 119
momento del crecimiento y, 85
percentilas poblacionales y, 118
talla baja familiar y, 155, 159-160
Edad cronológica, ajuste de maduración y, 167
cambios pubescentes y, 110
deficiencia de hormona de crecimiento y, 210
disfunción neurosecretora de hormona de crecimiento y,
216
edad ósea y, 210, 214
241
momento del crecimiento y, 85
patrón intrínseco de crecimiento y, 125, 125
talla baja familiar y, 155, 159-160
Turner, síndrome de, en el, 203
velocidad de crecimiento y, 84, 85, 210
Edad de placentación, 97
Edad dental, cálculo de la, 120
dentición definitiva y, 87
dentición temporal y, 87
edad biológica y, 85
edad cronológica y, 87
evaluación de la, 87
gradiente de maduración y, 87
Edad gestacional, deficiencia idiopática de hormona de
crecimiento y, 211
Edad ósea retrasada, deficiencia de hormona de crecimiento
y, 210, 211
Edad ósea, deficiencia de hormona de crecimiento,
211
deficiencias hormonales y, 211
determinación de la, 85-87, 120
disfunción neuroendocrina de hormona de crecimiento y,
215
displasias y, 144
edad biológica y, 85
edad cronológica y, 210, 211, 214
enfermedad celiaca, en la, 180
estatura baja y, 211
hipogonadismo y, 169
malnutrición y, 211
nivel socioeconómico y, 211
núcleos de crecimiento en la, 86
patrón atenuado de crecimiento y, 126, 126
patrón intrínseco de crecimiento y, 124, 125
proporciones corporales y, 169, 211
radiación y, 215
resistencia total a hormona de crecimiento y, 222
Turner, síndrome, en el, 203
variación fisiológica de la, 211
velocidad de crecimiento y, 210
Edad sexual, cálculo de la, 120
Edad, estatura definitiva, de la, 170, 171
secreción de hormona de crecimiento según la, 112
Edema, colitis ulcerosa, en la, 185
Turner, síndrome, en el, 200
Educación óptima, niños y, 7
Efecto celular, expresión de proteína transportadora de
hormona de crecimiento y, 222
Efectos ambientales sobre el crecimiento prenatal,
101-102
Ejercicio físico, deficiencia de hormona de crecimiento y.
214
Electrólitos, acidosis metabólica, en la, 192
estatura baja y, 127
retraso constitucional del crecimiento, en el, 173
talla baja familiar y, 160
Elementos incrementadores, región TATA y, 20
Elementos promotores proximales, región TATA y, 20
Ellis van Creveld, síndrome de, 149-150, 149
Embarazo múltiple, retraso de crecimiento intrauterino y.
137
Embarazo, duración real del, 97
periodo intergestacional y, 100
Embrión, desarrollo del, 93, 94
Endocitosis, factores de crecimiento y, 26
Endocrina, comunicación celular, 25
Endometrio, velocidad de recambio y, 9-10
242
Indice alfabético
Energética del crecimiento, 59-68, 62c, 66
alcalinización citoplásmica en la, 67-68, 67
alteraciones de la, 60-61
aporte nutricio en las, 60
transporte de nutrimentos en las, 60
utilización de nutrimentos en las, 60
determinantes de la, 59-60
equilibrio termoenergético en la, 60-67, 62c, 66
ciclo de la ubiquinona en el, 63, 64
metabolismo basal en el, 62-63, 62c, 63
metabolismo oxidativo en el, 63-67, 63
movimientos iónicos en el, 63, 65-67
temperatura corporal en el, 61, 62, 63
trifosfato de adenosina en el, 61, 62, 63
Energéticos, requerimientos de, 55
Energía metabólica, acidosis metabólica, en la, 192
Energía química, crecimiento celular y, 100
Energía, expresión de los genes y, 16
radicales libres y, 100
Enfermedad acidopéptica, patrón retrasado de crecimiento y,
172
Enfermedad celiaca, patrón retrasado de crecimiento y, 172
retrasos del crecimiento, en los, 179-182, 181
talla baja familiar y, 159
talla baja y, 123
Enfermedad crónica, segmento superior y, 211
Enfermedad febril, talla baja y, 123
Enfermedad granulomatosa, deficiencia orgánica de
hormona de crecimiento y, 213
Enfermedad intestinal, retrasos del crecimiento, en los.
184-187
Enfermedad neoplásica, patrón intrínseco de crecimiento y,
125
Enfermedad(es), detención del crecimiento y, 177, 180,
181
patrón atenuado de crecimiento, en el, 126, 165, 166
retraso constitucional del crecimiento, en el, 171
talla baja familiar y, 160-161
Enfermedades agudas, crecimiento de los dos primeros años
y, 106
Enfermedades alérgicas, patrón intrínseco de crecimiento y,
125
Enfermedades crónicas, velocidad de crecimiento y, 105
Enfermedades genéticas, talla baja y, 123
Enfermedades orgánicas, paciente con talla baja, en el,
123-124
patrón intrínseco de crecimiento y, 125, 125
Enfisema, crecimiento fetal inadecuado y, 135
Enterobiasis, malabsorción y, 56
Entropía, regulación genética y, 15
Enuresis, patrón retrasado de crecimiento y, 172
Envejecimiento placentario, 97
Enzimas, regulación genética y, 15
Ependimoma, deficiencia orgánica de hormona de
crecimiento y, 212
Epidermis, velocidad de recambio y, 9-10
Epigenotipo, estatura final y, 12
Epitelio intestinal, velocidad de recambio y, 9-10
Equipo de salud y crecimiento, 3
Equipo médico, monitorización del crecimiento y, 3
Eritrocito, factor de crecimiento tipo insulina-1 y, 36
Eritropoyesis medular, pubertad y, 114
Eritropoyetina, nefropatía crónica y, 194
somatotropina coriónica y, 96, 97
Error genético, espermatozoide y, 94
huevo fecundado y, 94
óvulo y, 94
Erupción dentaria, deficiencia de hormona de crecimiento y,
214
Esclerótica, resistencia total a hormona de crecimiento y,
223
Esfingolipidosis, energética del crecimiento y, 60
Esfirión, somatometría, en la, 74
Esofagitis, patrón retrasado de crecimiento y, 172
Especificidad, diferenciación celular y, 18
factores de crecimiento, de los, 26, 26
Espermarquia, velocidad de crecimiento y, 115
Espermatogénesis, hormona foliculoestimulante y, 114
Espermatozoide(s), error genético y, 94
eyaculado, en el, 94
fecundación y, 94
velocidad de recambio y, 9-10
Espermenarquia, retraso constitucional del crecimiento, en
el, 169
Esquistosomiasis, estatura baja y, 127
Estaciones, variación diaria de hormona de crecimiento y,
216
Estado de salud, deficiencia de hormona de crecimiento y,
215
Estado nutricio, crecimiento de los dos primeros años y, 107
crecimiento del esqueleto y, 189
estatura y peso y, 59
nivel educacional y, 53
peso y edad y, 59
picos de secreción y, 215, 216
segmento inferior y, 169
Estado(s) patológico(s), crecimiento de recuperación y, 105
signo neutro del crecimiento y, 10, 11
Estados catabólicos, deficiencia de hormona de crecimiento
y, 210
Estatura actual, percentila familiar y, 119
Estatura acumulada, disfunción neurosecretora de hormona
de crecimiento y, 216
estaturas familiares y, 118
parámetros poblacionales de la, 118
talla baja familiar y, 158
Estatura adecuada para la edad, importancia de la, 4
peso apropiado y, 4
Estatura al nacer, deficiencia de hormona de crecimiento y, 209
infecciones congénitas y, 131
infecciones maternas y, 100, 101
mujeres trabajadoras y, 100, 101
retraso constitucional del crecimiento, en el, 165
Estatura alcanzada, fibrosis quística del páncreas, en la, 182
Estatura baja familiar, resistencia parcial a hormona de
crecimiento y, 224, 225
Estatura baja neonatal, somatotropina coriónica y, 122
Estatura baja, agravantes para la, 6
colitis ulcerosa, en la, 185
deficiencia de hormona de crecimiento y, 211
descubrimiento de una causa de, 5
diarrea y, 56
factores genéticos y, 120-121
infecciones congénitas y, 131
infestaciones entérales y, 6
insensibilidad total a la hormona de crecimiento y, 220
insulina fetal y, 99
limitaciones nutricias y, 6
proteína transportadora y, 224
proteínas transportadoras de la hormona de crecimiento y.
34
Turner, síndrome de y, 168
variante fisiológica, como, 6
Zaire, pigmeos y, 224
Indice alfabético
Estatura de pie, somatometría, en la, 75, 76
Estatura definitiva, edad de la, 170, 171
Estatura en decúbito, somatometría, en la, 75, 76
Estatura entre los dos años y el inicio de la pubertad, 107
Estatura esperada, flbrosis quística del páncreas, en la, 182
retraso constitucional del crecimiento, en el, 170, 171c
Estatura final esperada, percentila familiar y, 119
percentila poblacional y, 119
Estatura final, cariotipo en sangre periférica y, 202, 203c
condiciones de vida y, 12
cromosoma sexual y, 94
deficiencia de hormona de crecimiento y, 210
diabetes y, 57
diarrea crónica y, 188
epifenotipo y, 12
estatura esperada y, 170
factores que modifican el crecimiento y, 50
fenotipo y, 12
funciones renales y, 191
gemelos univitelinos y, 12
genotipo y, 12
grupos étnicos y, 12
insuficiencia renal y, 57
material genético y, 94
patrón intrínseco de crecimiento y, 125, 125
raquitismo y, 57
resistencia total a hormona de crecimiento y, 222
retraso constitucional del crecimiento, en el, 169-17le
talla baja familiar y, 155
tendencia familiar de la, 12
Turner, síndrome de, en el, 202-203, 202c, 203c
uremia y, 195
variación diaria de hormona de crecimiento y, 216
Estatura genética, crecimiento posnatal y, 106
Estatura materna, crecimiento fetal inadecuado y, 136
Estatura media, síndrome de Turner, en el, 202
Estatura menor de la esperada, análisis del paciente con, 5
proporciones corporales y, 6
Estatura mínima esperada, cuantificación de la, 119
métodos para determinar la, 13-15
padres, de los, 119
Estatura, ajuste de maduración y, 167
crecimiento fetal inadecuado y, 136
análisis del crecimiento y, 119
armonía corporal y, 120
brazada y, 211
crecimiento intrauterino, disarmónico y, 133
proporcionado y, 132
daño prenatal y, 132
deficiencia de hormona de crecimiento y, 209
desnutrición crónica y, 178, 179
diabetes insípida nefrogénica y, 191
diarrea crónica y, 188, 188c
dietas y, 56
displasias óseas y, 146-154
embarazo múltiple y, 137
enfermedad celiaca, en la, 179
expresión de proteína transportadora de hormona de
crecimiento y, 222
flbrosis quística del páncreas, en la, 182
grupos raciales y, 109
hipernatremia y, 191
hipovolemia y, 191
hormona de crecimiento y, 29, 30, 29
incremento de, en el crecimiento posnatal, 103-105, 104
menarquia y, 115
perímetro cefálico y, 223
243
población infantil de México, de la, 23, 23c
pospubertad y, 115, 116
primera menstruación y, 114
proteínas transportadoras de la hormona de crecimiento y,
34
signo neutro del crecimiento y, 10, 11
velocidad de crecimiento y, 211, 211
Estatura, predicción de la, mujeres, para, 115
varones, para, 115
Esteatorrea, fibrosis quística del páncreas, en la, 182
Estenosis aórtica, patrón retrasado de crecimiento y, 173
Turner, síndrome de, en el, 205
Estenosis pulmonar, patrón retrasado de crecimiento y, 173
Esterilidad, síndrome de Turner, en el, 202
Esferoides sexuales, patrón atenuado de crecimiento y, 126
Esteroides, crecimiento de un paciente bajo, 229, 230
Estilión, somatometría, en la, 74
Estimulación gonadal, retraso constitucional del crecimiento, en el, 170
Estradiol, proteínas transportadoras de la hormona de
crecimiento y, 34
Turner, síndrome de, en el, 206
Estrategias, promoción y vigilancia, de, 5, 6
Estrés emocional, variación diaria de hormona de
crecimiento y, 216
Estrés físico, variación diaria de hormona de crecimiento y,
216
Estrógenos, calcificación y, 112
factor de crecimiento tipo insulina-1 y, 35
hormona de crecimiento y, 29, 30
pubertad y, 110
Turner, síndrome de, en el, 206
Estrona, placenta y, 97
Estrongiloidosis, malabsorción y, 56
Estructura celular, regulación genética y, 15
Estructura tridimensional, receptor de hormona de
crecimiento, del, 220
Estructura, regulación genética y, 15
Estudio del crecimiento, 4-5
aplicación de los resultados de los, 5
calidad de vida y, 4
comunidad y, 4, 5
condiciones, económicas y, 4
geopolíticas y, 4
elementos del, 118, 119
fallas de los, 4-5
hipótesis de los, 4
modelos, internacionales y, 4
nacionales y, 4
objetivos de los, 4
Plan Nacional de Salud y, 4
planteamiento de los, 4
realización de los, 4
Estudios, en la cinemática del crecimiento, 70-71
análisis de resultados de los, 71, 72
longitudinales, 70
recomendaciones para los, 71
semilongitudinales, 70, 71
transversales, 70
Etapa posnatal, deficiencia de hormona de crecimiento y.
211
insensibilidad total a la hormona de crecimiento y, 220
Etapa prenatal, factores que limitan el crecimiento en la.
123
Etinilestradiol, retraso constitucional del crecimiento, en el.
175
Turner, síndrome de, en el, 206
244
Indice alfabético
Eurión, somatometría, en la, 74
Examen de orina, estatura baja y, 127
retraso constitucional del crecimiento, en el, 173
Excreción anormal de nutrimentos, factor orgánico del
crecimiento, como, 57
Exón(es), deficiencia genética de hormona de crecimiento y,
213
empalme de los, receptor de hormona de crecimiento, del,
221
expresión de proteína transportadora de hormona de
crecimiento y, 222
receptor de hormona de crecimiento, del, 220
resistencia parcial a hormona de crecimiento y, 224
resistencia total a la hormona de crecimiento y, 221
talla baja idiopática y, 224
Exploración física, deficiencia orgánica de hormona de
crecimiento y, 212
Expresión genética celular, activación del genoma y, 17
aspectos básicos de la, 16-17
complejidad de la, 16-17
desoxirribonucleico, ácido, en la, 16
nucleoproteínas acidas y, 16
regulación de la, 16, 17
ribonucleico, ácido, en la, 16
Expresión genética, nucleosoma y, 17
transcripción y, 17
Expresión genómica, nucleosomas y, 17, 24
Expresión genotípica, nucleosoma y, 17
Expresión somática, genética del crecimiento y, 12-15
Extremidades, velocidad de crecimiento de las, 211
Eyaculado, espermatozoides en el, 94
F
Factor de crecimiento derivado de plaquetas,
alcalinización citoplásmica y, 67, 67
reparación de fracturas y, 48
Factor de crecimiento epidérmico,
alcalinización citoplásmica y, 67, 67
reparación de fracturas y, 48
Factor de crecimiento tipo insulina-1,
acidosis metabólica, en la, 193
alcalinización citoplásmica y, 67, 67
desnutrición crónica y, 178-179
eje funcional del, 37
función ovárica y, 205
funcionamiento renal y, 197
insensibilidad total a la hormona de crecimiento y, 220
progresión del crecimiento y, 211
pubertad y, 112
receptores y, 98
recuperación de peso y, 137
resistencia a la hormona de crecimiento y, 219
resistencia parcial a hormona de crecimiento y, 223,
224
resistencia total a hormona de crecimiento y, 223
retraso constitucional del crecimiento, 167
somatotropina coriónica y, 96
talla baja, familiar y, 157
idiopática y, 224
Turner, síndrome de, en el, 205
uremia y, 195
Factor de crecimiento tipo insulina-2, insensibilidad total a
la hormona de crecimiento y, 220
resistencia total a hormona de crecimiento y, 223
receptores y, 98
somatotropina coriónica y, 96, 97
Factor de crecimiento tipo insulina-3, función ovárica y,
205
insensibilidad total a la hormona de crecimiento y, 220
resistencia total a hormona de crecimiento y, 223
retraso constitucional del crecimiento, 167
talla baja familiar y, 157
talla y, 221
Turner, síndrome de, en el, 205
Factor hipofisario específico de transcripción, hormona de
crecimiento y, 28
Factor transformador del crecimiento, reparación de
fracturas y, 48
Factor(es) de crecimiento tipo insulina, 34-40, 36
-1, 35-37, 36
acción del, 35
complejo del, 35
cromosoma del, 34
efectos del 35-36
gen del, 34
ingestión calórica y, 35
producción del, 35
transportadores del, 35, 36
valores séricos del, 35
-2, 37
cromosoma del, 35
efectos del, 35
gen del, 35
regulación del, 37
valores séricos de, 37
receptores para los, 37-38
activación de los, 38
cromosoma de los, 37, 38
efectos de los, 3
proteína(s) transportadora(s) de, 38-39, 38
-1,39
-2, 39
-3, 39-40
-4,40
-5, 40
-6, 40, 41
proteasas de, 40, 41
glucocorticoides y, 228
Factor(es) de crecimiento, 25-26, 25
acción de los, 25, 25
acción intracelular de los, 26, 26
autocrinos y paracrinos, 40-44, 40
características generales de los, 26, 27
comunicación intercelular y, 25
derivado de plaquetas, 41
derivado del cartílago, 44-45
derivado del hueso, 44-46
diferenciación y crecimiento óseos, de, 44-49, 45, 46
epidérmico, 41
esquelético, 45
fibroblastos, de los, 41, 42
funciones de los, 25
interleucina-1, como, 45
nervioso, 42-43, 42
transformador beta, 41
vitamina D como, 43-44, 43
Factor(es) neuroendocrino(s), crecimiento de los dos
primeros años y, 106
paciente con talla baja, en el, 121-122
Factor(es) nutricio(s), absorción de, diarrea crónica y, 187
paciente con talla baja, en el, 122-123
patrón intrínseco de crecimiento y, 125
Turner, síndrome de, en el, 202
Indice alfabético
Factores de la velocidad de crecimiento, 108
Factores en la regulación del crecimiento prenatal, 100
Factores genéticos en el paciente con talla baja, 120-121
Factores maternos, crecimiento fetal y, 100
Factores orgánicos, crecimiento y, 55-58, 55c
Factores que causan retraso del crecimiento intrauterino, 137
Factores que modifican el crecimiento, 50-58, 54, 55c
alteraciones afectivas en los, 57
factor(es) orgánico(s) en los, 55-58, 55c
alteraciones nutricias como, 55
excreción anormal de nutrimentos como, 57
hipoxemia como, 57-58
ingreso inadecuado como, 55-56, 55c
malabsorción como, 56
uso anormal de nutrimentos como, 56, 57
factores socioeconómicos y culturales en los, 50-55
capacidad de desarrollo individual y, 53-54
desarrollo tecnológico en los, 52, 53, 53
nivel educacional en los, 53-54, 54
fármacos en los, 58, 58
incremento secular del crecimiento y los, 50, 51, 51
interacción de los, 54
tecnología social en los, 51, 57
Factores socioeconómicos y culturales, crecimiento, del,
50-55, 55
capacidad de desarrollo individual y, 53-54
desarrollo tecnológico en los, 52, 53, 53
incremento secular del crecimiento y los, 50, 51, 5/
interacción de los, 54
nivel educacional en los, 53-54, 54
Factores, determinantes del crecimiento, 11
genéticos, 11
neuroendocrinos, 11
Factores, modificadores del crecimiento, 11
orgánicos, 11
socioculturales, 11
Familiar, deficiencia genética, de hormona de crecimiento, 213
retraso constitucional del crecimiento, en el, 164
Fanconi, pancitopenia de, deficiencia orgánica de hormona
de crecimiento y, 212
síndrome de, detención del crecimiento y, 57
Fármaco(s), crecimiento fetal inadecuado y, 136
factores orgánicos del crecimiento, como, 57, 58
hormona del crecimiento y, 57
sensibilidad a los, detención del crecimiento, en la, 226
Fases del crecimiento, síndrome de Turner, en el, 201-202
Fatiga, enfermedad de Crohn, en la, 184
Fecundación, espermatozoide y, 94
signo de crecimiento y, 100, 101
Femenino, gameto, alteración genética y, 94
Fenobarbital, crecimiento fetal inadecuado y, 136
Fenotipo, 3
crecimiento celular máximo y, 23
estatura final y, 12
expresión del, 3
genotipo y, 3
insensibilidad parcial a la hormona de crecimiento y, 220
proteína transportadora de hormona de crecimiento y,
220-221
resistencia total a hormona de crecimiento, de la, 222
Fertilidad, resistencia total a hormona de crecimiento y, 223
Fetales, alteraciones, en el retraso del crecimiento
intrauterino, 137-138
Feto, formación del, 93
incremento de, peso en el, 94
talla en el, 94
trastornos génicos y, 94
245
Fibroblasto, factor de crecimiento tipo insulina-1 y, 37
Fibrosis quística del páncreas, patrón retrasado de
crecimiento y, 172
retrasos del crecimiento, en los, 182-184, 184c
Fibrosis quística, detención del crecimiento y, 56, 57
talla baja y, 122
Fiebre, colitis ulcerosa, en la, 185
Crohn, enfermedad de, en la, 185
patrón retrasado de crecimiento y, 172
Filtración glomerular, pubertad y, 115
Fisiopatología del paciente con talla baja, 120-124
Fístula arteriovenosa, patrón retrasado de crecimiento y, 173
talla baja y, 123
Flujo, placentario, catecolaminas y, 99
uteroplacentario, crecimiento intrauterino disarmónico y,
133
vaginal, crecimiento fetal inadecuado y, 135
5-FluoruaciIo, desoxitimidina y, 229, 231
Fontanela anterior, deficiencia de hormona de crecimiento
y, 214
displasias y, 150, 151
resistencia total a hormona de crecimiento y, 223
Forma, cambio de, alteración de tejidos y, 8
modificación de tejidos y, 8
reemplazo de tejidos y, 8
sustitución de tejidos y, 8
Formación de tejido, crecimiento y, 25
Fosfatos, acidosis metabólica, en la, 192
estatura baja y, 127
Fosfolípidos, alcalinización citoplásmica y, 67, 68
Fósforo, hormona de crecimiento y, 32
Turner, síndrome de, en el, 203
Fracturas, displasias óseas y, 144
reparación de las, 48, 49, 48
resistencia a la hormona de crecimiento y, 219
Frecuencia cardiaca, pubertad y, 115
Frecuencia, deficiencia de hormona de crecimiento, de la,
208
Frente prominente, deficiencia de hormona de crecimiento
y, 213
resistencia total a hormona de crecimiento y, 223
Fructosemia, energética del crecimiento y, 60
Fuerza muscular, deficiencia de hormona de crecimiento y.
214
Función celular, desnutrición crónica y, 178
Función, regulación genética y, 16
signo negativo del crecimiento y, 10, 11
signo neutro del crecimiento y, 10
Funcionamiento, factores de crecimiento y, 25
G
GABA. Véase Gammaaminobutírico, ácido.
Galactosemia, energética del crecimiento y, 60
Galanina, hormona de crecimiento y, 29
somatostatina y, 28
Gammaaminobutírico, ácido, hormona liberadora de
hormona de crecimiento y, 27
somatostatina y, 27
Gangliosidosis, energética del crecimiento y, 60
Gasometría venosa, estatura baja y, 127
Gastrina, somatostatina y, 28
Gastroenteritis, catecolaminas y, 99
Gastrosquisis, retraso de crecimiento intrauterino y. 137
Gastrostomía, fibrosis quística del páncreas, en la, 183, 184c
Gemelos, deficiencia de hormona de crecimiento y, 2/6
Gen operador, transcripción y, 17
246
índice alfabético
Gen productor, diferenciación celular y, 19
expresión final del, 19
mutaciones del, 19
transcripción y, 17
Gen receptor, desoxirribonucleico descubierto, ácido y, 18
diferenciación celular y, 18
transcripción y, 17
Gen represor, transcripción y, 17
Gen sensor integrado, clonas celulares y, 18, 19
expresión final del, 19
mutaciones del, 19
proteínas reguladores y, 19
transcripción y, 17
Gen(es), deficiencia genética de hormona de crecimiento y,
213
deficiencia orgánica de hormona de crecimiento y, 212
deleción del, receptor de hormona de crecimiento, del,
221-222
factor de crecimiento tipo insulina-1, del, 34
factor de crecimiento tipo insulina-2, del, 35
generación del, 21
receptor de hormona de crecimiento, del, 219
Genes, expresión de los, especialización tisular y, 16
tipos celulares y, 16
Genética del crecimiento, 12-24, 23c, 24
expresión somática en la, 12-15, 25
dirección de la, 12-15, 25
ritmo de la, 12-15, 25
velocidad de la, 12-15, 25
regulación, 15-23, 23c, 25
desoxirribonucleico descubierto, ácido, en la, 17-25
transcripción, factores iniciadores de la, en la, 17, 23,
25
Genéticos, síndromes, deficiencia orgánica de hormona de
crecimiento y, 212
retraso de crecimiento intrauterino y, 137
Génicos, trastornos, feto y, 94
recién nacido y, 94
Genitales masculinos, etapas de maduración de los, 114
Genoma, activación del, expresión genética celular y, 17
error genético y, 94
expresión del, 17
fundamento anatómico del, 17
momento crítico del crecimiento y, 21
Genotipo familiar, crecimiento entre los dos primeros años
y el inicio de la pubertad y, 109
velocidad de crecimiento y, 105, 108
Genotipo, crecimiento celular máximo y, 23
deficiencia de hormona de crecimiento y, 208
error genético y, 94
estatura final y, 12
Genu varum, displasias óseas y, 144
Germinomas, hormona de crecimiento y. 230
Gestación, signo positivo del crecimiento y, 10
Giardiasis, estatura baja y, 127
malabsorción y, 56
patrón retrasado de crecimiento y, 172
Ginecomastia, maduración de las mamas y, 113
Glabela, somatometría, en la, 74
Glándulas endocrinas, velocidad de recambio y, 9
Glaucoma, deficiencia orgánica de hormona de crecimiento
y, 212
Glicerol, hormona de crecimiento y, 32
Glicinemia, energética del crecimiento y, 60
Glioma(s), deficiencia orgánica de hormona de crecimiento
y, 212
hormona de crecimiento y, 230
Glomerulonefritis, talla baja y, 123
Glucagon, crecimiento de los dos primeros años y, 106
flujo sanguíneo renal y, 195
Glucocorticoides, acidosis metabólica, en la, 192
administración de los, 229
crecimiento de los dos primeros años y, 106
crecimiento de recuperación, en el, 189
crecimiento posnatal y, 122
detención del crecimiento, en la, 228, 231
factores de crecimiento tipo insulina y, 228, 231
hipófisis y, 228
hipotálamo y, 228, 231
hormona de crecimiento y, 28, 197
hormona liberadora de hormona de crecimiento y,
228
patrón atenuado de crecimiento y, 126, 126
patrón retrasado de crecimiento y, 229
secreción pulsátil y, 228
somatostatina y, 228
talla familiar y, 229
tejido conjuntivo y, 228
velocidad de crecimiento y, 228, 229
Glucogénesis, factor de crecimiento tipo insulina-1 y, 36
Glucogenólisis, hormona de crecimiento y, 31
Glucogenosis, energética del crecimiento y, 60
Glucólisis, factor de crecimiento tipo insulina-1 y, 36
Gluconeogénesis, desnutrición crónica y, 178
hormona de crecimiento y, 32
Glucosa, factor de crecimiento tipo insulina-1 y, 36, 37
hormona de crecimiento y, 32, 34
insulina fetal y, 97, 98
placenta y, 97
Glucosuria, patrón retrasado de crecimiento y, 172
Gnatión, somatometría, en la, 73
Gónadas, factor de crecimiento tipo insulina-1 y, 35
maduración de las, 114-115
Gonadotropina coriónica, factor de crecimiento tipo
insulina-1 y, 35
Gonión, somatometría, en la, 73
Gradiente(s) de maduración, cambios pubescentes y, 87
edad cronológica y, 84, 85
edad dental y, 87
estudios, longitudinales y, 70
semilongitudinales y, 70
transversales y, 70
momento del crecimiento, 85
ritmo del crecimiento y, 79, 81
velocidad del crecimiento y, 82, 83
volumen testicular y, 88
Gráfica del crecimiento, 3
Grasa subcutánea, hipoplasia muscular y, 214
Grasa(s), absorción de, diarrea crónica y, 187
amerindios y, 214
crecimiento intrauterino y, 214
deficiencia de hormona de crecimiento y, 214
hormona de crecimiento y, 32
resistencia total a hormona de crecimiento y, 222
Greulich-Pyle, atlas de, 86
método de, 168
Grosor cortical, síndrome de Turner, en el, 203
Grosor del pliegue subcutáneo, distribución del, 77
Grupos control, detención del crecimiento, en la, 226
Grupos de edad, estudio de los, 4
Grupos raciales, estatura y, 109
percentila poblacional y, 110
Grupos sindromáticos de estudio del retraso del crecimiento
intrauterino, 132-134
Indice alfabético
H
Haplotipos, deñciencia genética de hormona de crecimiento
y, 213
Heces, análisis de las, retraso constitucional del crecimiento, en el, 173
Helmintiasis, malabsorción y, 56
Hemocromatosis, detención del crecimiento y, 57
Hemodiálisis, hormona de crecimiento y, 198
Hemoglobina, crecimiento fetal inadecuado y, 135
patrón retrasado de crecimiento y, 172
pubertad y, 115
recuperación del retraso de crecimiento intrauterino y, 139
somatotropina coriónica y, 96
talla baja y, 123
Hepatitis A, retraso de crecimiento intrauterino y, 137
Hepatopatías crónicas, deficiencia de crecimiento y, 122
Herencia africana, segmento inferior y, 169
Herencia, deficiencia genética de hormona de crecimiento y,
213
Herpes, deficiencia orgánica de hormona de crecimiento y,
212
retraso de crecimiento intrauterino y, 137
Heterocigotos, insensibilidad total a la hormona de
crecimiento y, 220
resistencia parcial a hormona de crecimiento y, 224
resistencia total a la hormona de crecimiento y, 224
Heterogenicidad, resistencia total a la hormona de
crecimiento, de la, 221
Hidrocefalia, deficiencia orgánica de hormona de crecimiento e, 212, 213
resistencia total a hormona de crecimiento e, 223
Hidrocortisona, calcificación ósea e, 228
crecimiento de recuperación, en el, 189
velocidad de crecimiento e, 229
Hidroxiapatita, difenilhidantoína e, 228
17-hidroxipregnenolona, placenta e, 97
Hidroxiurea, desoxirribonucleótidos e, 229, 231
Hígado, metabolismo basal e, 62
velocidad de recambio e, 9-10
Hipercapnia, nicotina e, 99
patrón retrasado de crecimiento e, 172
Hipercatabolismo, resistencia a la hormona de crecimiento
e, 219
Hiperemesis gravídica, catecolaminas e, 99
Hiperglucemia, crecimiento fetal inadecuado e, 136
estatura baja e, 127
Hipernatremia, estatura e, 191
Hiperparatiroidismo, energética del crecimiento e, 60
Hiperplasia celular, factores de crecimiento e, 26
Hiperplasia, alteraciones de la, 93
hipertrofia e, 98
signo positivo del crecimiento e, 10
tejidos e, 8
Hiperplasia, etapa de, crecimiento anormal e, 8
malformaciones e, 8
pubertad e, 8, 9
velocidad de recambio e, 9
vida prenatal e, 8
vulnerabilidad, intervalo de, en la, 8
Hipertensión arterial, crecimiento fetal inadecuado e, 135
recuperación del retraso de crecimiento intrauterino e.
139
retraso del crecimiento intrauterino e, 132
Hipertensión arterial pulmonar, detención del crecimiento e.
57
Hipertensión intracraneana, patrón retrasado de crecimiento
e, 173
247
Hipertiroidismo, energética del crecimiento e, 60
Hipertrofia, alteraciones de la, 93
crecimiento e, 25
fecundación e, 100
predominio de la, 98
signo positivo del crecimiento e, 10
Hipertrofia celular, factores de crecimiento e, 26
Hipoactividad motriz, desarrollo individual e, 54
Hipoacusia, síndrome de Turner, en el, 205
Hipocondroplasia, 146c, 151, 151, 152
Hipoestrogenismo, síndrome de Turner, en el, 204
Hipófisis, glucocorticoides e, 228
Hipogammaglobulinemia, deficiencia genética de hormona
de crecimiento e, 213
Hipoglucemia, crecimiento intrauterino disarmónico e, 134
deficiencia de hormona de crecimiento e, 214
estatura baja e, 127
hipopituitarismo e, 214
hormona de crecimiento e, 29
resistencia total a hormona de crecimiento e, 223
Hipogonadismo, edad ósea e, 169
retraso constitucional del crecimiento, en el, 168
Hipomuscularidad, resistencia total a hormona de crecimiento e, 222
Hipoparatiroidismo, energética del crecimiento e, 60
Hipopituitarismo, deficiencia genética de hormona de
crecimiento e, 213
hipoglucemia e, 214
Hipoplasia de cabello, deficiencia orgánica de hormona de
crecimiento e, 212
Hipoplasia de vías biliares, patrón retrasado de crecimiento
e, 180
Hipoplasia del nervio óptico, deficiencia de hormona de
crecimiento e, 214
Hipoplasia dental, deficiencia orgánica de hormona de
crecimiento e, 212
Hipoplasia mediofacial, resistencia total a hormona de
crecimiento e, 223
Hipoplasia muscular, cansancio muscular e, 214
ejercicio físico e, 214
grasa subcutánea e, 214
Hipoplasia ungueal, resistencia total a hormona de
crecimiento e, 223
Hipopotasemia, velocidad de crecimiento en la, 191, 192
Hipotálamo, glucocorticoides e, 228
hormona liberadora de hormona de crecimiento e, 121
Hipotermia, crecimiento intrauterino disarmónico e, 134
Hipotiroidismo, cadena respiratoria e, 66
crecimiento intrauterino disarmónico e, 134
crecimiento posnatal e, 122
deficiencia de hormona de crecimiento e, 211
energética del crecimiento e, 60
estatura baja e, 127
patrón atenuado de crecimiento e, 126
patrón retrasado de crecimiento e, 173
radioterapia e, 230
talla baja familiar e, 159
Turner, síndrome de, en el, 205
Hipotonía, deficiencia de hormona de crecimiento e, 214
Hipovolemia, estatura e, 191
Hipoxemia, altura sobre el nivel del mar e, 101, 102
crecimiento intrauterino e, 99
factor orgánico del crecimiento, como, 57-58
nicotina e, 99
patrón retrasado de crecimiento e, 172
resistencia vascular umbilical e, 99
Hipoxemia fetal, crecimiento intrauterino disarmónico e, 133
248
Indice alfabético
Hipoxia fetal, somatotropina coriónica e, 96
Hipoxia neonatal, deficiencia idiopática de hormona de
crecimiento e, 211
Hipoxia, catecolaminas e, 99
Histamina, detención del crecimiento, en la, 227
hormona liberadora de hormona de crecimiento e, 27
Histiocitosis, deficiencia orgánica de hormona de
crecimiento e, 213
Histonas, desoxirribonucleico, ácido e, 16
expresión del genoma e, 17, 25
ribonucleico, ácido e, 16
Hombros, anchura de los, pubertad y, 116
Homeorresis, condiciones de vida y, 12
crecimiento y, 55
crecimiento de recuperación y, 105
hormona de crecimiento y, 197
retraso constitucional del crecimiento, 172
Homeostasis, deficiencia de hormona de crecimiento y,
209
placenta y, 97
regulación genética y, 16
Homeotermia, crecimiento intrauterino proporcionado y,
133
Homocigotos, insensibilidad total a la hormona de
crecimiento y, 220
resistencia parcial a hormona de crecimiento y, 224
resistencia total a la hormona de crecimiento y, 221
Hormona antidiurética, alcalinización citoplásmica y,
67, 67
Hormona bioinactiva, resistencia parcial a hormona de
crecimiento y, 224
Hormona de crecimiento placentaria. Véase Somatotropina
coriónica.
Hormona de crecimiento, 23-34, 27, 28
acidosis metabólica, en la, 193
antiserotoninérgicos y, 227
barbitúricos y, 228
cartílago de crecimiento y, 196
complejo de la, 220
crecimiento de los dos primeros años y, 106
crecimiento de recuperación y, 188
crecimiento entre los dos primeros años y el inicio de la
pubertad y, 108, 109
cromosoma de la, 30
deficiencia de la. Véase Deficiencia de hormona de
crecimiento.
desnutrición crónica y, 178
detención del crecimiento, en la, 227-228
diálisis peritoneal y, 198
disfunción de la neurosecreción de la, 122, 215
enfermedad celiaca, en la, 180
estructura de la, 31
factor de crecimiento tipo insulina-1 y, 122
flujo sanguíneo renal y, 195
funcionamiento renal y, 197
genes de la, 30
glucocorticoides y, 197, 228
hemodiálisis y, 198
hiposecreción de la, 216
homeorresis y, 197
insensibilidad total a la, 220
insuficiencia renal crónica y, 196
patrón atenuado de crecimiento y, 126
picos de secreción de la, 215-216
proteínas transportadoras de la, 34, 122, 220
receptor de la, 32-34, 32
recuperación de peso y, 137
recuperación del retraso de crecimiento intrauterino y,
139, 140
regulación de la secreción de la, 26-31, 28
resistencia a la. Véase Resistencia a la hormona de
crecimiento.
retraso constitucional del crecimiento, en el, 163, 167,
175
secreción de la, en la resistencia parcial, 224
secreción por edad de la, 112
síntesis y efectos directos de la, 30-32
sistema de la, 26
talla baja familiar y, 155, 156, 161
talla familiar y, 109
talla genética y, 106
transplante renal y, 198, 199
Turner, síndrome de, en el, 205
uremia y, 195
variación diaria de la, 216, 217
Hormona estimulante de la tiroides, deficiencia genética de
hormona de crecimiento y, 213
retraso constitucional del crecimiento, en el, 173
Hormona foliculoestimulante, deficiencia genética de
hormona de crecimiento y, 213
espermatogénesis y, 114
maduración de folículos y, 114
pubertad y, 112
retraso constitucional del crecimiento, en el, 169
volumen testicular y, 114
Hormona hipofisiaria, deficiencia genética de hormona de
crecimiento y, 213
Hormona liberadora de hormona de crecimiento, 26-29
ámbito pretalámico y, 121, 122
antihistamínicos y, 227
antiserotoninérgicos y, 227
barbitúricos y, 228
bloqueadores beta y, 227
cromosoma de la, 27
efectos de la, 27
glucocorticoides y, 228
hipotálamo y, 122
proceso de secreción de la, 27-28
producción de la, 122
pubertad y, 111
retraso constitucional del crecimiento, en el, 163, 167
serotonina y, 227
síntesis de la, 27
somatostatina y, 27-28
talla baja familiar y, 156
Hormona liberadora de hormona estimulante de la tiroides,
somatostatina y, 28
Hormona liberadora de hormona luteinizante.
pubertad y, 112
retraso constitucional del crecimiento, en el, 170
Hormona luteinizante, deficiencia genética de hormona de
crecimiento y, 213
estrógenos y, 114
factor de crecimiento tipo insulina-1 y, 35
gónadas, maduración de las y, 114
pubertad y, 112
retraso constitucional del crecimiento, en el, 169
testosterona y, 114
Hormona suprarrenocorticotrópica, deficiencia genética de
hormona de crecimiento y, 213
desnutrición crónica y, 178
Hormonas placentarias, masa placentaria y, 95
Hormonas sexuales, crecimiento de los dos primeros años y,
106
Indice alfabético
Hormonas tiroideas, crecimiento de los dos primeros años y,
106
crecimiento entre los dos primeros años y el inicio de la
pubertad y, 108
hormona de crecimiento y, 29
Hueso, factores en la formación de la matriz de, 45, 45
Huesos craneales, pubertad y, 114
Huevo fecundado, error genético y, 94
I
Identificación del retraso del crecimiento intrauterino, 134138
alteración nutricia en la, 132
importancia de la, 132
síndrome genético en la, 132
Iliocrestal, punto, somatometría, en la, 74
Ilioespinal anterior, punto, somatometría, en la, 74
IMC. Véase Masa corporal.
Incisivo central único, deficiencia de hormona de crecimiento y, 212
Incremento de peso y talla de acuerdo con la edad, 104
Incremento secular del crecimiento, 6, 12, 13
factores socioeconómicos y culturales y los, 50, 51
índice de maduración pubescente, edad biológica e, 85
índice de maduración sexual, 87
índice de masa corporal, somatometría, en la, 76, 79
índice de Tanner y Marshall, edad biológica e, 85
Infancia, displasias identificadas durante la, 150-154
Infancia, velocidad de crecimiento e, 103
Infección vaginal, crecimiento fetal inadecuado e, 135
Infecciones congénitas, crecimiento intrauterino disarmónico e, 133
deficiencia orgánica de hormona de crecimiento e, 212
estatura baja al nacer e, 131
peso bajo al nacer e, 131
Infecciones crónicas, deficiencia de hormona de crecimiento
e, 209
Infecciones del tubo digestivo, talla baja e, 122
Infecciones entérales, patrón intrínseco de crecimiento e,
125
talla baja e, 124
Infecciones meningoencefálicas, talla baja e, 123
Infecciones sistémicas, talla baja e, 123
Infecciones, deficiencia orgánica de hormona de crecimiento e, 213
ingreso inadecuado e, 56
nivel educacional e, 53
patrón retrasado de crecimiento e, 172
talla baja familiar e, 160
Turner, síndrome de, en el, 205
Infestación por giardia, retrasos del crecimiento, en los,
181, 182
Infestaciones, deficiencia de hormona de crecimiento y,
209
patrón retrasado de crecimiento e, 172
talla baja e, 123
Infestaciones entérales, estatura baja e, 6
patrón intrínseco de crecimiento e, 125, 125
Información y comunidad, 4
Ingestión alimentaría, nefropatía crónica e, 193
Ingestión calórica, patrón retrasado de crecimiento e, 172,
173
Ingestión de alimentos, diarrea crónica e, 187
Ingestión materna, insulina fetal e, 99
Ingestión proteínica, patrón retrasado de crecimiento e, 173
placenta e, 137
249
Ingestión, trastornos de la nutrición e, 177
Ingreso inadecuado, factor orgánico del crecimiento, como,
55-56
Ingreso, pliegue tricipital e, 136
Insensibilidad primaria, resistencia a la hormona de
crecimiento, en la, 219
Insensibilidad secundaria, resistencia a la hormona de
crecimiento, en la, 219
Insuficiencia cardiaca materna, catecolaminas e, 99
Insuficiencia cardiaca, crecimiento intrauterino proporcionado e, 133
Insuficiencia hepática, detención del crecimiento e, 56
patrón retrasado de crecimiento e, 180
resistencia a la hormona de crecimiento e, 219
talla baja e, 123
Insuficiencia pancreática, displasias e, 150
patrón retrasado de crecimiento e, 182
retrasos del crecimiento, en los, 182
Insuficiencia renal crónica, cartílago de crecimiento e, 196,
197
hormona de crecimiento e, 196
velocidad de crecimiento en la, 196, 198, 199
Insuficiencia renal, detención del crecimiento e, 57
estatura final en la, 191
homeostasis hormonal e, 195
proteínas transportadoras de la hormona de crecimiento e.
34
talla baja e, 123
velocidad de crecimiento en la, 191
Insuficiencia respiratoria, resistencia a la hormona de
crecimiento e, 219
Insulina fetal, carbohidratos e, 98
catecolaminas e, 99
estatura baja neonatal e, 122
glucosa e, 98, 99
ingestión materna e, 100
nutrimentos e, 98, 99
oxígeno e, 99
perímetro cefálico e, 100
Insulina, alcalinización citoplásmica e, 67, 67
desnutrición crónica e, 178, 179
flujo sanguíneo renal e, 195
hipopituitarismo e, 214
hormona de crecimiento e, 29
nefropatía crónica e, 194
pubertad e, 111
recuperación de peso e, 137
resistencia total a hormona de crecimiento e, 223
retraso constitucional del crecimiento, en el, 167
talla baja familiar e, 156
Interacciones celulares, comunicación celular, 25
Intercambio gaseoso, pubertad e, 115
Interleucina-1, 45
Interleucina-7, gen de la, 219
receptor de la, receptor de hormona de crecimiento e.
219
Intestino corto, resistencia a la hormona de crecimiento e,
219
Invierno, variación diaria de hormona de crecimiento e,
236
Isoformas, receptor de hormona de crecimiento, del, 220
J
Jacob y Monod, teoría del operón de, 17
Jansen, condrodisplasia metafisiaria tipo, 152
Juego, deficiencia de hormona de crecimiento y, 214
250
Indice alfabético
K
Ketotifeno, hormona del crecimiento y, 58
Knemómetro, detención del crecimiento, en la, 226
Kniest, síndrome de, 150
L
L-asparaginasa, duplicación celular y, 230, 231
Labio leporino, deficiencia orgánica de hormona de
crecimiento y, 212
Lactasa, deficiencia de, talla baja y, 123
Lactasa, malabsorción y, 56
Lactógeno placentario. Véase Somatotropina coriónica.
Lactosa, absorción de, diarrea crónica y, 187
Latitud geográfica, crecimiento intrauterino y, 102
Leche, alergia a la, retrasos del crecimiento, en los, 181
Lesión intracraneal, deficiencia orgánica de hormona de
crecimiento y, 213
Lesiones hipóxicas, hormona liberadora de hormona de
crecimiento y, 122
Leucemia(s), factor de crecimiento tipo insulina-1 y, 35
hormona de crecimiento y, 231
Leucodistrofias, energética del crecimiento y, 60
Leydig, células de, factor de crecimiento tipo insulina-1 y,
-le
Linfangiectasia intestinal, patrón retrasado de crecimiento y,
180
Linfedema, síndrome de Turner, en el, 2O0
Linfocitos, síndrome de Turner, en el, 200
Lípidos, desnutrición crónica y, 178
Lipólisis, hormona de crecimiento y, 32
Lipoproteínas, hormona de crecimiento y, 32
Lisina, hormona de crecimiento y, 29
Litiasis renal, enfermedad de Crohn, en la, 185
Logan y Kronfeld, método de, 87
Longitud, al nacer, síndrome de Turner, en el, 200, 201
análisis del crecimiento y, 119
del antebrazo, somatometría. en la, 76
crecimiento intrauterino proporcionado y, 132
crecimiento prenatal y, 93
en decúbito, somatometría, en la, 75, 76
determinación de la, 119
de la mano, somatometría, en la, 76
del miembro inferior, somatometría, en la, 76
del miembro superior, somatometría, en la, 76
del muslo, somatometría, en la, 76
del pene, somatometría, en la, 76
del pie, somatometría, en la, 76
de la pierna, somatometría, en la, 76
M
Macromoléculas, regulación genética y, 15
Macrosomia, crecimiento fetal inadecuado y, 136
Madelung, deformidad de, síndrome de Turner, en el, 203
Madre diabética, catecolaminas y, 99
crecimiento fetal y, 99
Maduración biológica, enfermedad celiaca, en la, 180
retraso constitucional del crecimiento, en el, 167-168
síndrome de Turner, en el, 203
Maduración dental, edad biológica y, 85
retraso constitucional del crecimiento, en el, 168
Maduración esquelética, edad biológica y, 85
maduración dental y, 168
patrones generales de, 210
retraso constitucional del crecimiento, en el, 168
síndrome de Turner, en el, 202
Maduración genital, retraso constitucional del crecimiento,
en el, 168
Maduración de los genitales masculinos, 114
Maduración mamaria. Véase Mamas, maduración de las.
Maduración de la mano, secuencias de la, 210
Maduración púbica, andrógenos y, 113
crecimiento posnatal, en el, 113-114
estadios de la, 113-114
Maduración sexual, menarquia y, 114
retraso constitucional del crecimiento, en el, 169
Maduración somática, talla baja familiar y, 159, 160
Maduración, ajuste de, 166
crecimiento luego del, 167
crecimiento entre los dos primeros años y el inicio de la
pubertad y, 107
patrón intrínseco de crecimiento y, 124, 125
peso al nacer y, 107
ritmo de, retraso constitucional del crecimiento, en el,
163, 164
Maestros, monitorización del crecimiento y, 3
Magnesio, acidosis metabólica, en la, 192
Malabsorción, factor orgánico del crecimiento, como, 56
patrón retrasado de crecimiento y, 172
resistencia a la hormona de crecimiento y, 219
retrasos del crecimiento, en los, 179-182
Malabsorción intestinal, crecimiento fetal inadecuado y.
135
Malformaciones, deficiencia orgánica de hormona de
crecimiento y, 212
ingreso inadecuado y, 56
Malnutrición, edad ósea y, 211
Maltrato físico, patrón retrasado de crecimiento y, 173
Mamas, maduración de las, 112-113
etapas de la, 112
ginecomastia y, 116
población indígena, en la, 113
Turner, síndrome de, en el, 206
varones, en los, 113
Mamas, volumen de las, capacidad de maduración y, 113
características genéticas y, 113
estado nutricio y, 113
Manos, edad ósea en las, 86
resistencia total a hormona de crecimiento y, 223
Masa, crecimiento esquelético y, 189
desnutrición crónica y, 178
incremento de, 8
signo positivo del crecimiento y, 10
síntesis y, 8
talla baja familiar y, 158
Masa corporal, proteínas transportadoras de la hormona de
crecimiento y, 34
crecimiento prenatal y, 93
detención del crecimiento, en la, 226
signo negativo del crecimiento y, 10, 11
Masa crítica, menarquia y, 115
Masa muscular, nefropatía crónica y, 193
pubertad y, 115
Masa ocupativa, deficiencia orgánica de hormona de
crecimiento y, 212
Masa ósea, crecimiento entre los dos primeros años y el
inicio de la pubertad y, 110
desnutrición crónica y, 179
síndrome de Turner, en el, 203
Masa previa, recuperación del retraso de crecimiento
intrauterino y, 137
Masculino, gameto, alteración genética y, 94
Masticación, ingreso inadecuado y, 56
Indice alfabético
Material genético, plegamientos del, 25
talla al nacer y, 94
Maternas, alteraciones, en el retraso del crecimiento
intrauterino, 135-136
Matriz, mineral, difenilhidantoína y, 228
orgánica, difenilhidantoína y, 228
ósea, pubertad y, 111
McCall y Schour, método de, 87
McKusik, condrodisplasia metafisiaria tipo, 146c, 152, 153,
153
Mecanismos intracelulares, hormona de crecimiento, de la,
33-34, 33
Mediadores neuroendocrinos, factores de crecimiento y, 25, 26
Medicamentos, crecimiento fetal inadecuado y, 136
Medición de la estatura, variación de la, 210
velocidad de crecimiento y, 210
Medidas antropométricas de relación, 77c
Medidas asintóticas, pospubertad y, 116
Médula ósea, difenilhidantoína y, 228
velocidad de recambio y, 9
Meduloblastoma(s), deñciencia orgánica de hormona de
crecimiento y, 212
hormona de crecimiento y, 230
Melfalán, ácido desoxirríbonucleico y, 230
Membrana, expresión de los genes y, 16
Menarquía, edad cronológica y, 115
estatura y, 115
maduración sexual y, 114
masa crítica y, 115
mexicanas, en las, 114
nutrición y, 115
peso y, 115
proporcionalidad y, 115
retraso constitucional del crecimiento, en el, 169
tejido muscular y, 115
velocidad de crecimiento y, 115
Meningitis, resistencia total a hormona de crecimiento y, 223
Menstruación, primera, estatura y, 115
6-mercaptopurina, ácidos nucleicos y, 229
biosíntesis de purinas y, 229
síntesis proteínica y, 229
Metabolismo basal, gasto energético y, 62
mujeres, en las, 62
tasa metabólica y, 62, 63
temperatura crítica inferior y, 62 62c
Metabolismo energético, regulación genética y, 15
Metabolismo oxidativo, 63-67, 63
ciclo de la ubiquinona en el, 64, 64
iones hidrógeno en el, 65-67, 65
mitocondria y, 60, 61
movimientos iónicos en el, 65-67, 65
reacciones de oxidorreducción en el, 63, 64, 64
trifosfato de adenosina en el, 64, 65
Metabolismo, recuperación del retraso de crecimiento
intrauterino y, 141
Meteorismo, enfermedad de Crohn, en la, 184
Metotrexato, ácidos nucleicos y, 229
biosíntesis de purinas y, 229
síntesis proteínica y, 229
Microcitosis, talla baja familiar y, 160
Microcórnea, deficiencia orgánica de hormona de crecimiento y, 212
Micropene, deñciencia de hormona de crecimiento y, 214
resistencia total a hormona de crecimiento y, 223
Miembros inferiores, deficiencia de hormona de crecimiento
y, 214
pubertad y, 115
Miembros superiores, deficiencia de hormona de crecimiento y, 214
Migración, crecimiento y, 25
Minerales, síndrome de Turner, en el, 203
Mitocondria(s), acidosis metabólica, en la, 192
alcalinización citoplásmica y, 67, 67
células fetales y, 100
equilibrio termoenergético y, 60-67, 66
factores de crecimiento y, 26
metabolismo oxidativo y, 60, 61
Mitogénesis, hormona de crecimiento y, 33
Mitomicina, ácido desoxirribonucleico y, 230, 231
Modelos de referencia, cinemática del crecimiento, en la,
69-72
condicionantes de los, 69, 70
elaboración de los, 71, 72
estudios, longitudinales en los, 70
semilongitudinales en los, 70, 71
transversales en los, 70
Moléculas reguladoras, regulación genética y, 15
Momento, crecimiento óptimo, del, 4
Momento crítico, generación del gen y, 21
Monitorización del crecimiento, 3, 4
equipo médico y, 3
estrategia, como, 3, 4
maestros y, 3
padres y, 3
promoción de la salud y, 4
Monoaminooxidasa, inhibidores de la, detención del
crecimiento, en la, 228
Monosomía regular, estatura final en la, 203
Turner, síndrome de, en el, 200, 205
Monosomías, retraso de crecimiento intrauterino y, 137
Morbilidad, resistencia total a hormona de crecimiento y.
223
Mortalidad, resistencia total a hormona de crecimiento y,
223
Mosaico 45,XO/46,XX, estatura final en el, 203
Turner, síndrome de, en el, 200, 200
Mostaza nitrogenada, ácido desoxirribonucleico y, 230
Movilidad articular, displasias y, 150
Movimientos iónicos, 64-67, 64
Mucopolisacaridosis, energética del crecimiento y, 60
Mucoviscidosis, retrasos del crecimiento, en los, 182-184,
188c
Muerte celular programada, crecimiento y, 25
Muerte súbita, retraso del crecimiento intrauterino y, 132
Mujeres, acumulación de grasa en las, 116
crecimiento de los dos primeros años y, 107
crecimiento entre los dos primeros años y el inicio de la
pubertad y, 108
deficiencia idiopática de hormona de crecimiento y, 212
edad de la estatura definitiva en las, 170
estatura pospubertad y, 115, 116
predicción de la estatura para, 115
recuperación del retraso de crecimiento intrauterino, en
las, 138
resistencia total a hormona de crecimiento y, 222
Mujeres trabajadoras, hijos de, 100, 101
Músculo, deficiencia de hormona de crecimiento y, 214
Músculo estriado, factor de crecimiento tipo insulina-1 y,
36
Musculosquelético, hormonas tiroideas y, 100
Mutaciones del gen, resistencia a la hormona de crecimiento, en la, 221
Mutaciones funcionales, resistencia parcial a hormona de
crecimiento y, 224
251
252
Indice alfabético
Mutaciones, gen productor, del, 19
gen sensor integrado, del, 19
receptor de hormona de crecimiento, del, 220, 221
resistencia parcial a hormona de crecimiento y, 224
Mutaciones sin sentido, receptor de hormona de crecimiento, del, 220
N
Nacimiento, displasias identificables desde el, 145-150,
145, 146c
Narcóticos, crecimiento fetal inadecuado y, 136
Nariz pequeña, deficiencia de hormona de crecimiento y,
213
Nasión, somatometría, en la, 73
Náusea, ingreso inadecuado y, 55
nefropatía crónica y, 193
Necesidades higiénicas, nivel educacional y, 53
Nefropatía, crecimiento fetal inadecuado y, 135, 136
deficiencia de hormona de crecimiento y, 211
energética del crecimiento y, 60
patrón intrínseco de crecimiento y, 125, 125
Nefropatías crónicas, deficiencia de crecimiento y, 122
Nefrótico, síndrome, detención del crecimiento y, 57
velocidad de crecimiento en la, 191
Neonato, desarrollo del, deficiencia de hormona de
crecimiento y, 212
Neoplasias, ingreso inadecuado y, 56
Neumonía, crecimiento fetal inadecuado y, 135
resistencia total a hormona de crecimiento y, 223
Neumopatía crónica, talla baja y, 123
Neumopatía materna, catecolaminas y, 99
Neumopatía, energética del crecimiento y, 60
Neuroblastoma, energética del crecimiento y, 60
Neuroinfecciones, hormona liberadora de hormona de
crecimiento y, 122
Neuronas, factor de crecimiento tipo insulina-1 y, 36
genes de crecimiento y, 16
genes de diferenciación y, 16
genes de especialización y, 16
Neuropéptido Y, somatostatina y, 28
Neuropéptidos, hormona de crecimiento y,
Neurotensina, somatostatina y, 28
Neutropenia, displasias y, 150
Nicotina, resistencia vascular uterina y, 99
Nicturia, patrón retrasado de crecimiento y, 172
Niño(s), detención del crecimiento, en el, 226
signo negativo del crecimiento y, 10, 11
Nistagmo, deficiencia de hormona de crecimiento y, 214
Nivel académico, síndrome de Turner, en el, 205
Nivel cognoscitivo, nutrición y, 51, 52
Nivel del mar, altura sobre, crecimiento intrauterino y, 101,
102
Nivel educacional, factores socioeconómicos y culturales,
en los, 53-54, 54
nutrición y, 51, 52
Nivel socioeconómico, edad ósea y, 211
No historias, desoxirribonucleico, ácido y, 16
ribonucleico, ácido y, 16
selenoide y, 17
transcripción y, 17
Nolla, método de, 87
Noradrenalina, hipoxemia y, 99
hormona liberadora de hormona de crecimiento y, 27
somatostatina y, 27
Norma técnica para el control de la nutrición, del
crecimiento y del desarrollo del niño, 5
Núcleo de interfase, cronómero y, 17
selenoide y, 17
Núcleo ventromedial, hormona liberadora de hormona de
crecimiento y, 121
Núcleo, factores de crecimiento y, 26
Núcleos arqueados, hormona liberadora de hormona de
crecimiento y, 121
Núcleos de crecimiento, retraso constitucional del
crecimiento, en el, 168
Nucleosomas, constitución de los, 17
expresión genómica y, 17
histonas y, 17
selenoide y, 17
transcripción y, 17
Número de embarazo, retraso de crecimiento intrauterino y,
137, 138
talla baja familiar y, 155
Nutrición del niño, Norma técnica para el control del, 5
Nutrición materna, ingreso mensual y, 100
Nutrición, crecimiento y, 59
dieta de consumo y, 59
estado de, 59
estatura y peso y, 60
menarquía y, 115
nivel, cognoscitivo y, 51, 52
educacional y, 51, 52
peso y edad y, 60
sistema social y, 51
tecnología social y, 51, 52
Nutrición, alteraciones de la, 59
composición corporal en las, 59
proporcionalidad en las, 59
Nutrimentos intrauterinos, vida extrauterina y, 100
Nutrimentos, alteraciones de la absorción de, 140, 141
crecimiento fetal inadecuado y, 136
crecimiento intrauterino, disarmónico y, 133
proporcionado y, 132
deficiencia de hormona de crecimiento y, 211
excreción anormal de, 57
insulina fetal y, 98, 100
recuperación del retraso de crecimiento intrauterino y,
140, 141
talla baja y, 123
utilización de los, 141
O
Obesidad, hormona de crecimiento y, 29
Onfalión, somatometría, en la, 74
Onfalocele, retraso de crecimiento intrauterino y, 137
Opistocráneo, somatometría, en la, 74
Órganos blanco, capacidad de respuesta y, 219
resistencia a la hormona de crecimiento y, 219
Ornitina, retraso constitucional del crecimiento, en el, 174
Orquidómetro de Prader, 88
Oseas, displasias. Véase Displasias óseas.
Osmolaridad, recuperación del retraso de crecimiento
intrauterino y, 139
Osteoblasto(s), diferenciación y crecimiento óseos y,
45, 46, 46
factor de crecimiento tipo insulina-1 y, 35, 36, 37
factores de crecimiento de los, 44, 45
Osteocalcina, reparación de fracturas y, 48
Osteocitos, formación de las células precursoras de los,
44 Osteodistrofia renal, corrección de la, 197
crecimiento y, 195
Indice alfabético
Osteogénesis imperfecta, retraso de crecimiento intrauterino
y, 137
Osteonectina, reparación de fracturas y, 48
Ovario(s), factor de crecimiento tipo insulina-1 y, 35
genes de crecimiento y, 16
genes de diferenciación y, 16
genes de especialización y, 16
Óvulo, error genético y, 94
folículos reclutados y, 94
Oxandrolona, retraso constitucional del crecimiento, en el,
175
síndrome de Turner, en el, 206
Oxidativos, requerimientos de, 55
Oxidorreducción, reacciones de, 63, 64, 63
Oxigenación tisular, crecimiento de los dos primeros años y,
107
crecimiento intrauterino proporcionado y, 132, 133
Oxígeno, aporte de, crecimiento intrauterino disarmónico y,
133
Oxígeno intrauterino, vida extrauterina y, 100
P
Paciente con talla baja, 118-128, 124
bases del diagnóstico del, 118-120
causas y fisiopatología del, 120-124
condiciones sociales y ambientales en las, 124
enfermedades orgánicas en las, 122-124
factores, genéticos en las, 120-121
neuroendocrinos en las, 121-123
nutricios en las, 122-123
gabinete, pruebas de, en el, 127-128
laboratorio, pruebas de, en el, 127-128
manifestaciones clínicas en el, 124-127
patrón atenuado de crecimiento en las, 122, 126, 127
patrón intrínseco de crecimiento en las, 122, 124, 125
patrón retrasado del crecimiento en las, 122, 125-126
Pacientes, disfunción neuroendocrina de hormona de
crecimiento, con, 215
resistencia congénita a la hormona de crecimiento y, 220,
221
Padecimientos sistémicos, resistencia a la hormona de
crecimiento y, 219
Padres, crecimiento intrauterino disarmónico y, 133, 134
estatura de los, síndrome de Turner, en el, 201, 202
monitorización del crecimiento y, 3
resistencia parcial a hormona de crecimiento y, 224
resistencia total a la hormona de crecimiento y, 221
retraso constitucional del crecimiento, en el, 164
Paladar hendido, deficiencia orgánica de hormona de
crecimiento y, 212
Paludismo, retraso de crecimiento intrauterino y, 137
Páncreas, genes de crecimiento y, 16
genes de diferenciación y, 16
genes de especialización y, 16
Pancreatitis crónica, crecimiento fetal inadecuado y, 135
Panhipopituitarismo, hormona liberadora de hormona de
crecimiento y, 121
Panículo adiposo, crecimiento fetal y, 101
Papila óptica, deficiencia de hormona de crecimiento y.
214
Paracrina, comunicación celular, 25
Parálisis cerebral, talla baja y, 123
Parámetros para evaluar el retraso del crecimiento
intrauterino, 134c
Parasitosis, deficiencia de hormona de crecimiento, 211
malabsorción y, 56
253
Paratohormona, crecimiento de los dos primeros años y, 106
crecimiento posnatal y, 122
flujo sanguíneo renal y, 195
uremia y, 195
Parcial, resistencia, a la hormona de crecimiento, 223-225
Pareja sexual, síndrome de Turner, en el, 205
Parotiditis, retraso de crecimiento intrauterino y, 137
Patrón atenuado de crecimiento, 126, 127
enfermedad y, 165, 166
Patrón de crecimiento, pubertad y. Ill
síndrome de Turner, en el, 202
Patrón de maduración, crecimiento pubescente y, 111
Patrón genético de crecimiento, funciones renales y, 191
Patrón intrínseco de crecimiento, 124-125, 125
Patrón pulsátil, hormona de crecimiento, de la, 29, 30
Patrón retrasado de crecimiento, 125-126, 125
enfermedad celiaca, en la, 180
glucocorticoides y, 229
retraso constitucional del crecimiento, en el, 171, 171
situaciones que originan, 172-173
Patrones de secreción de hormona de crecimiento, 215, 216
Pelvis, anchura de la, pubertad y, 116
Péptido C, flujo sanguíneo renal y, 195
Péptido hipofisiario activador de adenilciclasa, hormona de
crecimiento y, 29
Péptido intestinal vasoactivo, somatostatina y, 28
Péptido señal, receptor de hormona de crecimiento, del, 220
Percentila familiar, crecimiento entre los dos primeros años
y el inicio de la pubertad y, 107
estatura actual y, 119
estatura final esperada y, 119
patrón intrínseco de crecimiento y, 124, 124
Percentila poblacional, crecimiento entre los dos primeros
años y el inicio de la pubertad y, 108
estatura final esperada y, 119
grupos raciales y, 109
velocidad de crecimiento y, 118
Pérdida de nutrimentos, talla baja y, 123
Pérdida de peso, colitis ulcerosa, en la, 185
Perímetro abdominal, crecimiento intrauterino disarmónico
y, 133
crecimiento intrauterino proporcionado y, 132
Perímetro cefálico, crecimiento intrauterino, disarmónico y, 133
proporcionado y, 132
daño prenatal y, 132
estatura y, 223
hipoxemia y, 99
pospubertad y, 116
resistencia total a hormona de crecimiento y, 223
somatometría, en la, 75, 79
Perímetro del brazo, somatometría, en la, 76, 77
Perímetro del muslo, somatometría, en la, 76, 77
Perímetro torácico, crecimiento intrauterino, disarmónico y,
133
proporcionado y, 132
somatometría, en la, 76, 77
Periodo intergestacional, crecimiento intrauterino y, 100,
101
embarazo y, 101
mínimo, 101
Peso al nacer, edad de placentación y, 97
fenotipo familiar y, 95
infecciones congénitas y, 131
infecciones maternas y, 100, 101
maduración y, 107
mujeres trabajadoras y, 100, 101
pliegue tricipital y, 136, 136c
254
Indice alfabético
Peso apropiado para la estatura, importancia del, 4
Peso bajo, deficiencia de hormona de crecimiento y, 211
infecciones congénitas y, 131
insulina fetal y, 99
Peso ideal para la edad, estado nutricio y, 4
importancia del, 4
Peso molecular, factores de crecimiento, de los, 26
Peso, crecimiento fetal inadecuado y, 136
crecimiento intrauterino, disarmónico y, 133
proporcionado y, 132
crecimiento prenatal y, 93
daño prenatal y, 132
desnutrición crónica y, 178
edad y, 59, 60
embarazo múltiple y, 137
estatura y, 59, 60
incremento de, en el crecimiento posnatal, 103-105,
madre diabética y, 99
menarquia y, 115
número de embarazo y, 138
pospubertad y, 116
proteínas transportadoras de la hormona de crecimiento y,
34
recuperación del retraso de crecimiento intrauterino y,
140
resistencia total a hormona de crecimiento y, 222
signo neutro del crecimiento y, 10
somatometría, en la, 75, 79
velocidad del crecimiento y, 95
Picnodisostosis, 153
Picos de secreción, disfunción neuroendocrina de hormona
de crecimiento y, 215-216
Piel, deficiencia de hormona de crecimiento y, 214
Pies, resistencia total a hormona de crecimiento y, 223
Pigmeo, síndrome de, 122
Pilosidad, poblaciones indígenas y, 114
pubertad y, 113, 114
Piuria, patrón retrasado de crecimiento y, 172
Placenta, alteración cromosómica y, 95
capacidad de nutrición de la, 137
carbohidratos y, 137
crecimiento prenatal, en el, 95-97
duración de la, 97
formación de la, 97
hormonas placentarias y masa de la, 96
ingestión proteínica y, 137
tamaño fetal y, 96
Plan de estudio, paciente, del, 4
Plan Nacional de Salud, estudios del crecimiento y, 4
Plásticos, requerimientos de, 55
Plegamientos del material genético, 28
Pliegue cutáneo, somatometría, en la, 76, 77
Pliegue subcutáneo, resistencia total a hormona de
crecimiento y, 222
Pliegue tricipital, crecimiento fetal inadecuado y, 136,
136c
Población indígena, maduración de las mamas y, 113
pilosidad corporal y, 114
Población infantil de México, estatura de la, 23, 23c
Pobreza, definición de, 52
Polaquiuria, crecimiento fetal inadecuado y, 135
patrón retrasado de crecimiento y, 172
Poliovirus, retraso de crecimiento intrauterino y, 137
Polipéptido, cambios postranscripcionales del, 19
gen productor y, 19
gen sensor-integrado y, 19
Pólipos nasales, patrón retrasado de crecimiento y, 172
Porción citoplásmica, receptor de hormona de crecimiento,
del, 220
Porción extracelular, receptor de hormona de crecimiento,
del, 221
resistencia parcial a hormona de crecimiento y, 223, 224
Porción intracelular, receptor de hormona de crecimiento,
del, 220
Porción transmembrana, receptor de hormona de crecimiento, del, 221
Posnatal, crecimiento. Véase Crecimiento posnatal.
Pospubertad, crecimiento posnatal en la, 115-116
signo de crecimiento y, 115
Potasio, acidosis metabólica, en la, 192
estatura baja y, 127
hormona de crecimiento y, 32
Potencia biológica, factores de crecimiento, de los, 26
Preadipocitos, hormona de crecimiento y, 33
Precondrocitos, hormona de crecimiento y, 33
Prednisona, crecimiento fetal inadecuado y, 136
hormona liberadora de hormona de crecimiento y, 231
Preeclampsia, crecimiento fetal inadecuado y, 135
Pregnenolona, placenta y, 97, 96
Prenatal, crecimiento. Véase Crecimiento prenatal.
Presentación, deficiencia idiopática de hormona de
crecimiento y, 212
Primeros meses, velocidad de crecimiento en los, 103
Privación emocional, patrón retrasado de crecimiento y, 173
síndrome de, detención del crecimiento y, 57
talla baja familiar y, 157
variación diaria de hormona de crecimiento y, 216
Privación proteínica, deficiencia de hormona de crecimiento
y, 209
Problemas mentales, síndrome de Turner, en el, 205
Problemas renales, detención del crecimiento y, 57
Proceso inflamatorio, patrón intrínseco de crecimiento y.
125
Programación genética, crecimiento de acuerdo con la, 177
Progresión de crecimiento, deficiencia de hormona de
crecimiento, 211
factor de crecimiento tipo insulina-1 y, 211
Proinsulina, flujo sanguíneo renal y, 195
Prolactina, flujo sanguíneo renal y, 195
gen de la, 219
receptor de la, receptor de hormona de crecimiento y,
219
Proliferación celular, pubertad y, 110
Promoción, estrategias de, 5, 6
Proporcionalidad corporal, pubertad y, 115
resistencia total a hormona de crecimiento y, 223
Proporcionalidad, condiciones de vida y, 12
menarquia y, 115
pospubertad y, 115
Proporciones corporales, armonía del crecimiento y, 119
deficiencia de hormona de crecimiento y, 211
estatura menor de la esperada y, 6
patrón atenuado de crecimiento y, 126
patrón intrínseco de crecimiento y, 124, 125
retraso constitucional del crecimiento, en el, 164, 169,
175
talla baja familiar y, 160
Proporciones infantiles, deficiencia de hormona de
crecimiento, 211
Proporciones transversales, pospubertad y, 116
Proteasas de proteína transportadora, 40, 40
Proteína anormal, receptor de hormona de crecimiento, del,
221
Proteína morfogénica ósea, reparación de fracturas y, 48
Indice alfabético
Proteína(s) transportadora(s) de factories) de crecimiento
tipo insulina, 38, 38
-1, 38, 39
-2,39
-3, 39-40
-4,40
-5,40
-6,40
proteasas de, 40, 40
Proteína(s) transportadora(s), afinidad de las, 34
albúmina y, 34
bilirrubinas séricas y, 34
cirrosis hepática y, 34
concentración de las, 34
desnutrición y, 34
estatura baja y, 34
estatura y, 34
estradiol y, 34
hormona de crecimiento y, 34
insensibilidad total a la hormona de crecimiento y, 220
insuficiencia renal y, 34
masa corporal y, 34
peso y, 34
resistencia a la hormona de crecimiento, en la, 221-222
resistencia parcial a hormona de crecimiento y, 223
resistencia total a hormona de crecimiento y, 223
testosterona y, 34
Proteínas STAT, hormona de crecimiento y, 33
Proteínas, absorción de, diarrea crónica y, 187
acidosis metabólica, en la, 192
desnutrición crónica y, 178
hormona de crecimiento y, 31
nefropatía crónica y, 193
regulación genética y, 15, 16
Proteinuria, patrón retrasado de crecimiento y, 172
velocidad de crecimiento en la, 191
Proteoglucanos, reparación de fracturas y, 48
Proximodistal, crecimiento, 79
Pruebas de estimulación, hormona de crecimiento, de la, 30,
31
Ptosis, resistencia total a hormona de crecimiento y, 223
Pubarquía, síndrome de Turner, en el, 206
Pubertad precoz, radioterapia y, 231, 232
Pubertad retrasada, deficiencia de hormona de crecimiento
y, 214
Pubertad, andrógenos, en la, 110
crecimiento de recuperación y, 188
crecimiento en la, 110-115, ///
deficiencia de hormona de crecimiento, 211
dietas y, 56
disfunción neurosecretora de hormona de crecimiento y, 216
edad ósea y, 211, 214
estímulos neuroendocrinos en la, 112
etapa de hiperplasia y, 8, 9
gónadas, maduración de las, en la, 114-116
hormona de crecimiento y, 30
maduración púbica en la, 113-114
mamas, maduración de las, en la, 112-113
patrón de crecimiento y, 111
patrón intrínseco de crecimiento y, 124, 125, 125
patrón retrasado de crecimiento y, 125, 125
pilosidad y, 113, 114
resistencia total a hormona de crecimiento y, 222
retraso constitucional del crecimiento hasta el inicio de
la, 167
signo positivo del crecimiento y, 10
velocidad de crecimiento y, 103
255
Puente nasal, deficiencia de hormona de crecimiento y, 213
resistencia total a hormona de crecimiento y, 223
Puntos somatométricos, 75
Purkinje, células de, factor de crecimiento tipo insulina-1 y,
36
Q
Quemaduras, detención del crecimiento y, 57
resistencia a la hormona de crecimiento y, 219
Química sanguínea, estatura baja y, 127
retraso constitucional del crecimiento, en el, 173
Quimioterapia, resistencia a la hormona de crecimiento y,
219
Quiste aracnoideo, deficiencia orgánica de hormona de
crecimiento y, 212
R
Radiación, disfunción neuroendocrina de hormona de
crecimiento y, 215
Radial, punto, somatometría, en la, 73
Radiografía de cráneo, estatura baja y, 127
Radiografías, retraso constitucional del crecimiento, en el,
173
Radioterapia, crecimiento espinal y, 230
desproporción corporal y, 231
hipotiroidismo y, 230
hormona de crecimiento y, 230-232, 230
hormona liberadora de hormona de crecimiento y, 230,
231
pubertad precoz y, 231, 232
segmento superior y, 231
Raquitismo, armonía corporal y, 120
detención del crecimiento y, 57, 122
patrón atenuado de crecimiento y, 126, 126
Reacciones metabólicas, regulación genética y, 16
Receptor de hormona de crecimiento, 32, 32
alteraciones teóricas del, 220
células indiferenciadas y, 32, 33
complejo del, 32, 220
concentración del, 32
cromosoma cinco y, 219
cromosoma del, 32
eritropoyetina y, 220
estructura tridimensional del, 220
exones del, 220, 221
factor ciliar neurotrófico y, 220
factor estimulador del crecimiento de granulocitos y, 219
factor leucémico inhibidor y, 220
gen del, 32, 219, 220
isoformas del, 220
mutaciones del, 220, 221, 222
porción extracelular del, 221
receptores prolactina-eritropoyetina y, 219
resistencia parcial a hormona de crecimiento y, 224
resistencia total a la hormona de crecimiento y, 221-222
secuencia primaría de aminoácidos del, 220
síntesis del, 219
síntesis primaria del, 220
transducción celular y, 220
variantes del, 220
Receptor, resistencia total a la hormona de crecimiento y.
221
Receptores, factores de crecimiento tipo insulina, para los.
37-38
Recién nacido, trastornos génicos y, 94
256
Indice alfabético
Recomendaciones alimentarias, 55c
Recuperación del crecimiento, vida extrauterina y, 100
Recuperación del retraso de crecimiento intrauterino, 137-141
agua en la, 139
alimentación en la, 139
aporte nutricio en la, 139
arterieesclerosis y, 139
desempeño escolar y, 139
diabetes mellitus y, 139
disfunción cerebelosa y, 139
hemoglobina en la, 139
hipertensión arterial y, 139
medidas para la, 138-139
osmolaridad en la, 139
temperatura corporal en la, 139
trimestre de gestación y, 139
Reflujo gastroesofágico, enfermedad de, patrón intrínseco
de crecimiento y, 125, 125
ingreso inadecuado y, 56
patrón retrasado de crecimiento y, 172
Reflujo vesicoureteral, crecimiento de recuperación y, 191
Turner, síndrome de, en el, 205
Regulación fetal del crecimiento prenatal, 97-100
Regulación genética, meta de la, 16
Regulación neuroendocrina, desnutrición crónica y, 178
Relación entre brazada y talla, determinación de la, 120
Relación entre segmentos superior e inferior, determinación
de la, 120
Rendimiento escolar, síndrome de Turner, en el, 205
Renina-angiotensina-aldosterona, placenta y, 97
sistema, hormona de crecimiento y, 32
Reparación tisular, factor de crecimiento tipo insulina-1 y,
35
signo positivo del crecimiento y, 10
Replicación, crecimiento y, 25
Requerimientos energéticos, diarrea crónica y, 187
Requerimientos nutricios, 58
Resistencia periférica, hormona de crecimiento, a la, 32, 33
Resistencia vascular umbilical, hipoxemia y, 99
Resistencia, a la hormona de crecimiento, 219-225
alteraciones del receptor en la, 220, 22!
clasificación de la, 219
congénita, 220, 221, 221
definición de la, 219
insensibilidad, parcial en la, 220, 221
primaria en la, 219
secundaria en la, 219
total en la, 220
parcial, 220, 223-225
características bioquímicas de la, 224-225
total, 220, 221-223
características típicas de la, 222-223
mutaciones del gen en la, 220
proteína transportadora en la, 221-222
Resorción glomerular, talla baja y, 123
Resorción tubular, talla baja y, 123
Respuesta celular, talla baja familiar y, 156, 157
Retención de minerales, síndrome de Turner, en el, 203
Retraso constitucional del crecimiento, 163-176, 166, 171c
antecedentes, heredofamiliares de, 164, 165
patológicos en el, 171-176
curva de crecimiento en el, 166
desarrollo de la pubertad en el, 169-170
diagnóstico del, 167, 168, 171, 174
estatura al nacer en el, 165
estatura final en el, 166, 170-171, 171c
estudios en el, 173
maduración biológica en el, 167-169
patrón atenuado de crecimiento en el, 165, 166
patrón intrínseco de crecimiento y, 125,
proporciones corporales en el, 169
pubertad, hasta el inicio de la, 167
retraso intrauterino de crecimiento en el, 165
ritmo de maduración en el, 163, 164, 166
secuencia del, 165-166
talla familiar en el, 171c
tratamiento del, 174-175
velocidad de crecimiento en el, 165-167, 166
Retraso mental, ingreso inadecuado y, 56
patrón retrasado de crecimiento y, 173
talla baja y, 123
Retraso psicomotriz, cromosoma sexual y, 94
deficiencia de hormona de crecimiento y, 214
talla baja y, 123
Retraso, del crecimiento intrauterino, 131-142, 131, 134c
armónico, 132-133
desproporcionado, 133-134
disarmónico, 133-134
factores que causan, 131
fetales, alteraciones, en el, 137-138
grupos sindromáticos de estudio del, 132-134
identificación del, 134-138, 134c
madre con antecedentes de, 132
maternas, alteraciones, en el, 134c, 135-136
número de embarazo y, 138
parámetros para evaluar el, 134c
patrón intrínseco de crecimiento y, 124, 125
proporcionado, 132-133
recuperación del, 137-140, 138
retraso constitucional del crecimiento, en el, 134c, 165,
169
uteroplacentarias, alteraciones, en el, 136, 137
vigilancia del, 134-138, 134c, 136c
Retrasos del crecimiento de origen alimentario, 177-190,
184c
alergia a las proteínas de la leche en los, 181
crecimiento de recuperación en los, 188-189
desnutrición crónica en los, 178-179
diarrea crónica en los, 187, 188
disacaridasas intestinales, deficiencia de, en los, 181, 182
enfermedad, celiaca en los, 179, 182,
intestinal en los, 184-187
fibrosis quística del páncreas en los, 182-184, 184c
infestación por giardia en los, 181, 182
insuficiencia pancreática en los, 182
malabsorción en los, 179-182
mucoviscidosis en los, 182-184, 184c
Ribonucleico mensajero, ácido, agente inductor y, 18
especificidad y, 18
genes productores y, 17
Ribonucleico, ácido, deficiencia genética de hormona de
crecimiento y, 213
genes sensor-integrados y, 17
histonas y, 16
no histonas y, 16
Ribosomas, factores de crecimiento y, 26
Rieger, síndrome de, deficiencia orgánica de hormona de
crecimiento y, 212
Rinitis alérgica, detención del crecimiento y, 56
patrón retrasado de crecimiento y, 172
Riñon ectópico, síndrome de Turner, en el, 205
Riñón(es), factor de crecimiento tipo insulina-1 y, 35
metabolismo basal y, 62
velocidad de recambio y, 9
Indice alfabético
Ritmo de maduración, crecimiento de los dos primeros años
y, 107
retraso constitucional del crecimiento, en el, 163, 164
Ritmo del crecimiento, condiciones de vida y, 12
genes y, 12
óptimo, 4
RNA mensajero, receptor de hormona de crecimiento, del,
221
RNA. Véase Ribonucleico, ácido.
Robles y Alvarez, método de, 88
Rubéola, deficiencia orgánica de hormona de crecimiento y,
212
retraso de crecimiento intrauterino y, 137
S
Saciedad, ingreso inadecuado y, 56
Schmid, condrodisplasia metafisaria tipo, 146c, 152
Schwachman, condrodisplasia metafisaria tipo, 153
Secreción de tejido, crecimiento y, 25
Secreción glomerular, talla baja y, 123
Secreción hipofisiaria, resistencia total a hormona de
crecimiento y, 223
Secreción tubular, talla baja y, 123
Secreción, hormona de crecimiento, de la, 26-30, 30
cantidad de la, 30
hormona liberadora y la, 26-29, 27
mediadores de la, 28
mediadores neuroendocrinos de la, 28, 28, 29
picos de, resistencia total a hormona de crecimiento y,
222
pruebas de estimulación de la, 30
pulsátil, 29-30
signo positivo de crecimiento y la, 27
somatostatina y la, 27-29
Segmento inferior, crecimiento intrauterino y, 211
desnutrición y, 211
estado nutricio y, 169
herencia africana y, 169
pospubertad y, 115-116
pubertad y, 115
somatometría, en la, 76
velocidad de crecimiento del, 211
Segmento superior, armonía corporal y, 120
crecimiento intrauterino y, 211
deficiencia de hormona de crecimiento y, 211
desnutrición y, 211
pospubertad y, 115-116
radioterapia y, 231
resistencia total a hormona de crecimiento y, 223
somatometría, en la, 76
velocidad de crecimiento del, 211
Segmentos corporales, talla baja familiar y, 160
Senectud, signo negativo del crecimiento y, 10, 11
Sepsis, factor de crecimiento tipo insulina-1 y, 35
resistencia a la hormona de crecimiento y, 219
Serie ósea, estatura baja y, 127
Serotonina, hormona liberadora de hormona de crecimiento
y, 28, 227
Sertoli, células, factor de crecimiento tipo insulina-1 y, 35
Seudoacondroplasia, 152
SIDA, resistencia a la hormona de crecimiento y, 219
Sífilis, retraso de crecimiento intrauterino y, 137
Signo, de crecimiento, 8, 27
desnutrición crónica y, 178
detención del crecimiento, en la, 226
fecundación y, 100
257
hormona de crecimiento y, 67
negativo, homeostasis en el, 10
masa corporal en el, 10
síntesis en el, 10
vida y, 10, 11
neutro, estatura en el, 10
peso en el, 10
presentación del, 10
síntesis en el, 10, 11
positivo, 10, 27
estudio del, 10
histología del, 10
regulación fisiológica del, 10
síntesis y, 10
pospubertad y, 115
regulación genética y, 16
Silver-Russell, síndrome de, detención del crecimiento en
el, 193, 197
Silla turca vacía, síndrome de, deficiencia orgánica de
hormona de crecimiento y, 212
Sinaptogénesis, crecimiento de los dos primeros años y,
106
hormonas tiroideas y, 106
Sincitiotrofoblasto, somatotropina coriónica y, 96
Síndrome nefrótico, materno, catecolaminas y, 99
talla baja y, 123
Síndromes dismórficos, retraso del crecimiento intrauterino
y, 131
Sinfisión, somatometría, en la, 74
Síntesis primaria, receptor de hormona de crecimiento, del,
220
Síntesis proteínica, insulina fetal y, 97
receptor de hormona de crecimiento, del, 221-222
Síntesis, capacidad de, 8
crecimiento y, 8
masa y, 8
signo negativo del crecimiento y, 10, 11
signo neutro del crecimiento y, 10
signo positivo del crecimiento y, 10
velocidad de, 8
vida y, 8
Síntesis, velocidad de, detención del crecimiento, en la, 226
Sinusitis, patrón retrasado de crecimiento y, 172
Sistema colinérgico, somatostatina y, 28
Sistema de la hormona del crecimiento, 26, 27
Sistema nervioso, factor de crecimiento tipo insulina-1 y, 36
Sistema social, nutrición y, 51
Sodio, estatura baja y, 127
Sol naciente, signo del, resistencia total a hormona de
crecimiento y, 223
Somatomedina(s), alcalinización citoplásmica, 67, 67
crecimiento de los dos primeros años y, 106
eliminación renal y, 196
Somatometría, 3
básica, población y, 4
crecimiento intrauterino disarmónico y, 133
deficiencia de hormona de crecimiento y, 211
displasias y, 143, 153
patrón intrínseco de crecimiento y, 125, 125
Somatometría, cinemática del crecimiento, en la, 73-77
análisis de la, 76-77, 77c
medidas más importantes para la, 74-76, 74
puntos de referencia, para la, 74, 74, 75
impares, 74
pares, 74, 75
Somatometría facial, deficiencia de hormona de crecimiento
y, 213, 214
258
Indice alfabético
Somatostatina, barbitúricos y, 228
bloqueadores beta y, 227
glucocorticoides y, 228
hormona de crecimiento y, 26-29
retraso constitucional del crecimiento, en el, 163
talla baja familiar y, 157, 158
Somatotropina coriónica, acciones de la, 96-97
estatura baja neonatal y, 122
Subnasal, punto, somatometría, en la, 73
Sudor, pubertad y, 114
Sueño, hormona de crecimiento y, 29
Superficie corporal, pospubertad y, 116
Supraesternal, punto, somatometría, en la, 74
Sustancia P, somatostatina y, 28
Sustrato, factores de crecimiento y, 26
T
Tabaquismo, catecolaminas y, 99
crecimiento fetal inadecuado y, 136
Talasemia, crecimiento fetal inadecuado y, 135
Talla al nacer, edad de placentación y, 97
estatura final y, 95
material genético y, 94
Talla baja familiar, 155-162
andrógenos en la, 161
antecedentes heredofamiliares en la, 155-158
armonía corporal, en la, 160
aumentos de estatura en la, 158
ausencia de enfermedad en la, 160-161
biológica, edad, en la, 159-160
composición corporal en la, 160
constantes biológicas de crecimiento en la, 155, 161
cronológica, edad, en la, 159-160
deprivación emocional en la, 157
factor de crecimiento tipo insulina-1 en la, 157
factor de crecimiento tipo insulina-3 en la, 157
familiares en la, 158
hormona de crecimiento en la, 156-157
maduración somática en la, 159, 160
resistencia parcial a hormona de crecimiento y, 223
respuesta celular en la, 156, 157
somatostatina en la, 157, 158
velocidad del crecimiento en la, 158-159, 159
Talla baja idiopática, exones y, 224
factor de crecimiento tipo insulina-1 y, 224
hormona de crecimiento y, 224
proteína transportadora y, 223
resistencia parcial a hormona de crecimiento y, 224
Talla baja prenatal, deficiencia de hormona de crecimiento
y, 209
Talla baja, crecimiento intrauterino proporcionado y, 133
deficiencia de hormona de crecimiento y, 208-210
estatura y peso y, 60
normalidad de la, 210
paciente con. Véase Paciente con talla baja.
resistencia total a hormona de crecimiento y, 222
Talla de pie, somatometría, en la, 75
Talla familiar, glucocorticoides y, 229
retraso constitucional del crecimiento, en la, 171c
Talla final, enfermedades inflamatorias intestinales y, 56
Talla media familiar, estatura mínima esperada y, 13-15
obtención de la, 119
síndrome de Turner, en el, 202
Talla sentado, somatometría, en la, 75
Talla, desviación estándar de la, 71
distribución percentilar de la, 72
edad ósea y, 170
factor de crecimiento tipo insulina-3 y, 221
madre diabética y, 99
recuperación del retraso de crecimiento intrauterino y,
140
Tamaño fetal, placenta y, 96
Tanner y Marshall, índice de maduración pubescente de, 85
método de, 87
Tanner y Whitehouse, método de, 159, 168
valoración esquelética de, 86
Tanner, método de, 13-15
TATA, región, coactivadores de la transcripción y, 19, 20
complejo basal de transcripción y, 20, 21
elementos, incrementadores y, 20
promotores proximales y, 20, 22
localization de la, 19
proteínas fijadoras de la, 19
reconocimiento de la, 19, 22
transcripción y, 19, 22
TBP. Véase TATA, región.
Tecnología social, factores socioeconómicos y culturales, en
los, 51, 52
Tejido adiposo pardo, 62
Tejido conjuntivo, glucocorticoides y, 229
Tejido graso, insulina fetal y, 98
Tejido intercelular, crecimiento y, 25
Tejido muscular, menarquia y, 115
metabolismo basal y, 62
velocidad de recambio y, 9-10
Tejido nervioso, hormonas tiroideas y, 106
velocidad de recambio y, 9-10
Tejido óseo, factores involucrados en la formación del, 41
Tejido subcutáneo, deficiencia de hormona de crecimiento
y, 214
Tejido(s), alteración de, 8
calificación de los, 9
crecimiento inicial de los, características del, 8
hiperplasia de los, 8
hipertrofia de los, 8
modificación de, 8
reemplazo de, 8
signo negativo del crecimiento y, 10, 11
sustitución de, 8
Telión, somatometría, en la, 74
Temperatura corporal, 61, 62
crecimiento intrauterino disarmónico y, 134
recuperación del retraso de crecimiento intrauterino y,
139
Temperatura crítica inferior, 62, 62c
Temperatura media, variación diaria de hormona de
crecimiento y, 216
Tenesmo, crecimiento fetal inadecuado y, 135
Tensión arterial, pubertad y, 115
Tercer molar, resistencia total a hormona de crecimiento y,
223
Termogénesis, desnutrición crónica y, 179
Termorregulación, 62
Testosterona, crecimiento de los caninos y, 114
hormona luteinizante y, 114
proteínas transportadoras de la hormona de crecimiento y,
34
retraso constitucional del crecimiento, en el, 175
Tibial punto, somatometría, en la, 74
Tiempo, signo negativo del crecimiento y, 10, 11
Timina, receptor de hormona de crecimiento, del, 221
Tipo celular, hormona de crecimiento y, 33
Tipo de crecimiento, vida intrauterina, en la, 100
Indice alfabético
Tipo IA, deficiencia genética de hormona de crecimiento,
de, 213
Tipo IB, deficiencia genética de hormona de crecimiento,
de, 213
Tipos de crecimiento posnatal, 103-105, 104
Tiroides, pruebas de funcionamiento de, estatura baja y, 127
Tiroiditis, patrón retrasado de crecimiento y, 173
síndrome de Turner, en el, 205
Tiroxina, desnutrición crónica y, 179
retraso constitucional del crecimiento, en el, 173
TMF. Véase Talla media familiar.
Tono vascular, placenta y, 97
Tórax, anchura del, pubertad y, 116
TORCH, síndrome de, crecimiento intrauterino disarmónico
y, 133
Tos, patrón retrasado de crecimiento y, 172
Total, resistencia, a la hormona de crecimiento, 221-223, 221
características típicas de la, 222-223
mutaciones del gen en la, 221
proteína transportadora en la, 221-222
Toxoplasmosis, deficiencia orgánica de hormona de
crecimiento y, 212
retraso de crecimiento intrauterino y, 137
Tragión, somatometría, en la, 74
Transcripción, expresión genética y, 17
nucleosoma y, 17
Transcripción, factores iniciadores de la, 17
activación de los, 17
agente inductor en los, 17, 18
desoxirribonucleico, ácido y, 17
gen, operador en los, 17
productor en los, 17
receptor en los, 17
represor en los, 17
sensor-integrado en los, 17
histonas en los, 14
no histonas y, 17
Transcripción, secuencia funcional de la, 19-21
aparato de Golgi en la, 21
modelo de la, 19-22
región TATA en la, 19-22
ribonucleico heteronuclear, ácido, en la, 20
Transducción de señal, resistencia a la hormona de
crecimiento y, 219
Transferrina, nefropatía crónica y, 193
talla baja familiar y, 160
Transplante renal, hormona de crecimiento y, 198
Trastornos adquiridos, resistencia a la hormona de
crecimiento y, 219
Tratamiento de los pacientes con patrón atenuado de
crecimiento, 127, 126
Tratamiento, deficiencia genética de hormona de crecimiento, de la, 213
TRH. Véase Hormona liberadora de hormona estimulante de
la tiroides.
Tricocefalosis, estatura baja y, 127
Trifosfato de adenosina, acidosis metabólica, en la, 192
calor y, 67
generación del, 65
iones hidrógeno y, 65-67
movimientos iónicos y, 64, 65, 64
regeneración del, 61, 65
tejido adiposo pardo y, 62
trabajo del, 61, 65
Triglicéridos, desnutrición crónica y, 178
Trimestre de gestación, recuperación del retraso de
crecimiento intrauterino y, 139
259
Trimetidiona, crecimiento fetal inadecuado y, 136
Triquión, somatometría, en la, 73
Triyodotironina, desnutrición crónica y, 179
retraso constitucional del crecimiento, en el, 173
Tronco, resistencia total a hormona de crecimiento y, 222
velocidad de crecimiento del, 211
Tumor(es) intracraneal(es), deficiencia orgánica de hormona
de crecimiento y, 212
patrón retrasado de crecimiento y, 173
Tumores orbitarios, hormona de crecimiento y, 231
Tumores suprasellares, hormona liberadora de hormona de
crecimiento y, 122
Turner, síndrome de, crecimiento en el, 200-207, 202c
edad ósea del, 203
estatura final del, 202-203, 202c
fases del, 200-202
masa ósea del, 203
entidades patológicas en el, 204-206
estatura baja y, 168
hormona de crecimiento, secreción de la, en el, 203, 204
retraso de crecimiento intrauterino y, 137
tratamiento del, 206
estrógenos en el, 206
hormona de crecimiento en el, 206
U
Ubiquinona, ciclo de la, 63, 63
Urea, estatura baja y, 127
Uremia, factor de crecimiento tipo insulina-1 y, 195
hormona de crecimiento y, 195
mecanismos de la detención del crecimiento en la, 194
paratohormona y, 195
resistencia a la hormona de crecimiento y, 219
Urocultivo, patrón retrasado de crecimiento y, 172
retraso constitucional del crecimiento, en el, 173
Uso anormal de nutrimentos, factor orgánico del
crecimiento, como, 56, 57
Uso continuo de fármacos, detención del crecimiento, en
la, 226
Uso intermitente de fármacos, detención del crecimiento,
en la, 226
Uteroplacentarias, alteraciones, en el retraso del
crecimiento intrauterino, 136, 137
V
Valores séricos, deficiencia genética de hormona de
crecimiento y, 213
resistencia total a hormona de crecimiento, en la, 213
Variación diurna, velocidad de crecimiento, de la, 210
Variación estacional, velocidad de crecimiento, de la, 210
Variación interensayo, medición de la estatura, de la, 210
Variaciones climáticas, crecimiento intrauterino y, 102
Variantes, receptor de hormona de crecimiento, del, 219
Varicela-zoster, retraso de crecimiento intrauterino y, 137
Varones, crecimiento de los dos primeros años, en los, 107
crecimiento entre los dos primeros años y el inicio de la
pubertad y, 108
deficiencia genética de hormona de crecimiento y, 213
deficiencia idiopática de hormona de crecimiento y, 212
edad de la estatura definitiva en los, 170
estatura pospubertad y, 115, 116
predicción de la estatura para, 115
recuperación del retraso de crecimiento intrauterino, en
los, 138
resistencia total a hormona de crecimiento y, 222
260
Indice alfabético
Vasculitis, crecimiento fetal inadecuado y, 135
Vasculopatía, talla baja y, 123
Velocidad de crecimiento subnormal, deficiencia de
hormona de crecimiento y, 208-210
Velocidad de crecimiento, acidosis tubular y, 191
ajuste de maduración y, 167
antes de los tres años de edad, 103
antihistamínicos y, 227
barbitúricos y, 228
bloqueadores beta y, 227
combinada, 108
condiciones de vida y, 12
crecimiento de recuperación y, 105, 106
deficiencia de hormona de crecimiento, 211
definición de la, 119, 120
desnutrición crónica y, 178
difenilhidantoína y, 229
disfunción neuroendocrina de hormona de crecimiento y,
215
disminuciones patológicas de la, 103
edad, cronológica y, 210
ósea y, 210
enfermedad celiaca, en la, 179-180
enfermedades crónicas y, 105
estudios, longitudinales y, 70
semilongitudinales y, 70
transversales y, 70
exactitud de la medición y, 210
extremidades, de las, 211
factores de la, 108
fibrosis quística del páncreas, en la, 182, 183
genes y, 12
genotipo familiar y, 105, 108
glomerulonefritis, en la, 191
glucocorticoides y, 228
gradiente de maduración y, 84
hidrocortisona y, 228, 229
infancia y, 103
insuficiencia renal crónica, en la, 198, 199
maduración mamaria y, 115
menarquía y, 115
miembros inferiores, de los, 115
normalidad de la, 210
patrón intrínseco de crecimiento y, 124, 125
percentilas de la, 84
percentilas poblacionales y, 118
peso y, 98
pies, de los, 115
primeros meses de vida posnatal y, 103
radiación y, 215
resistencia total a hormona de crecimiento y, 222
retraso constitucional del crecimiento, en el, 165-166,
170
subnormal, población con, 118
talla baja familiar y, 155, 158-159, 159
transplante renal y, 191
tronco, del, 211
Turner, síndrome de, en el, 201, 202
variación diurna de la, 210
variación estacional de la, 210
Velocidad de recambio, tejidos y, 9-10
Velocidad de, de la materia, destrucción, 8
producción, 8
síntesis, 8
Velocidad, crecimiento óptimo, del, 4
Vello corporal, características genéticas y, 114
efectos androgénicos y, 114
Vello púbico, estadios del, 113
Ventilación pulmonar, crecimiento intrauterino proporcionado y, 133
Ventrodorsal, crecimiento, 79
Verano, variación diaria de hormona de crecimiento y, 216
Vértice, somatometría, en la, 74
Viabilidad celular, factores de crecimiento y, 25
Viabilidad, alteraciones de la hipertrofia y, 93
Vida extrauterina, nutrimentos intrauterinos y, 160
oxígeno intrauterino y, 100
Vida intrauterina, tipo de crecimiento en la, 100
Vida prenatal, etapa de hiperplasia y, 8
Vida, signo negativo del crecimiento y, 10, 11
síntesis y, 8
Vigilancia del crecimiento, 3
Vigilancia del retraso del crecimiento intrauterino, 134-137,
134c
Vigilancia, estrategias de, 5, 6
Vinblastina, duplicación celular y, 230, 231
Vincristina, duplicación celular y, 230, 231
VIP. Véase Péptido intestinal vasoactivo.
Vitamina A, absorción de, diarrea crónica y, 187
Vitamina D, crecimiento posnatal y, 122
Vitamina D3, difenilhidantoína y, 228
Volumen cardiaco, pubertad y, 114
Volumen peneano, retraso constitucional del crecimiento,
169
Volumen pulmonar, pubertad y, 115
Volumen respiratorio, pubertad y, 115
Volumen testicular, cálculo del, 88
gradiente de maduración y, 88
hormona foliculoestimulante, 114
retraso constitucional del crecimiento, en el, 169, 175
somatometría, en la, 76
Volumen, incremento de, 8
Vómito, crecimiento fetal inadecuado y, 135
deficiencia orgánica de hormona de crecimiento y, 212
ingreso inadecuado y, 56
nefropatía crónica y, 193
talla baja y, 123
Voz, cambios en la, pubertad y, 114
deficiencia de hormona de crecimiento y, 214
resistencia total a hormona de crecimiento y, 223
Vulnerabilidad, intervalo de, etapa de hiperplasia y, 8
W
Watusi, estatura poblacional promedio de los, 109
Z
Zaire, pigmeos de, proteína transportadora y, 224
Zinc, absorción de, diarrea crónica y, 187
© Copyright 2026