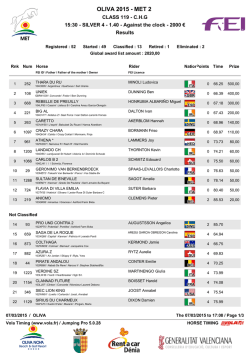
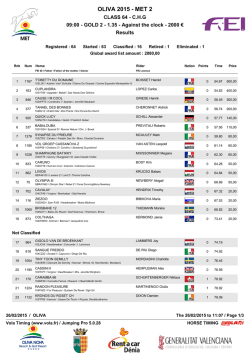
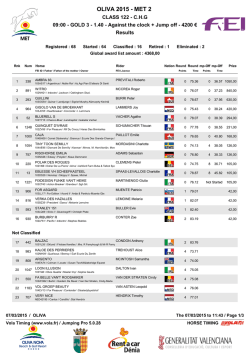
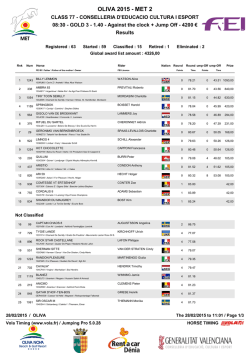
Uphold™ LITE - Boston Scientific
Uphold™ LITE w i t h C a p i o ™ S L IM Vaginal Support System Directions for Use 2 Instrucciones de uso 11 Mode d’emploi 20 Gebrauchsanweisung29 38 Gebruiksaanwijzing46 Instruções de Utilização 55 91033325-01 Rev. B 2015-12 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Istruzioni per l’uso Table of Contents WARNING............................................................................................ 3 INTENDED USE/INDICATIONS FOR USE........................................ 3 CONTRAINDICATIONS....................................................................... 3 DEVICE DESCRIPTION....................................................................... 4 Warnings/Potential Complications................................... 4 PRECAUTIONS.................................................................................... 5 ADVERSE EVENTS.............................................................................. 6 HOW SUPPLIED.................................................................................. 7 OPERATIONAL INSTRUCTIONS ...................................................... 7 Steps to PLACE SACROSPINOUS LIGAMENT LEGS Anteriorly........................................................................ 7 Steps to Adjust Mesh and Removal of Leg Assemblies......................................................................... 9 STEPS TO REMOVE A DEVICE FRAGMENT.............................. 9 REFERENCES....................................................................................... 9 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B WARRANTY....................................................................................... 10 2 Black (K) ∆E ≤5.0 U Uphold™ LITE with Capio™ SLIM Vaginal Support System ONLY Caution: Federal Law (USA) restricts this device to sale by or on the order of a physician trained in use of surgical mesh for transvaginal repair of pelvic organ prolapse. Physicians should be trained in the minimally-invasive placement of surgical mesh devices for treatment of pelvic floor disorders and in management of complications resulting from procedures. Read this document carefully. Failure to follow instructions may cause malfunction and/or cause patient injury. This document is not a training manual on transvaginal surgery to correct pelvic organ prolapse. Boston Scientific light-weight mesh systems should only be used by physicians instructed in the surgical correction of this pathology and in the use of this device. The safety and effectiveness of the Uphold LITE Vaginal Support System compared to conventional surgical repair for pelvic organ prolapse have not been demonstrated in randomized controlled clinical trials. In the United States, substantial equivalence of the Uphold LITE Vaginal Support System to synthetic mesh has been demonstrated through benchtop testing. WARNING For single use only. Do not reuse, reprocess or resterilize. Reuse, reprocessing or resterilization may compromise the structural integrity of the device and/or lead to device failure which, in turn, may result in patient injury, illness or death. Reuse, reprocessing or resterilization may also create a risk of contamination of the device and/or cause patient infection or cross-infection, including, but not limited to, the transmission of infectious disease(s) from one patient to another. Contamination of the device may lead to injury, illness or death of the patient. After use, dispose of product and packaging in accordance with hospital, administrative and/or local government policy. INTENDED USE/INDICATIONS FOR USE The Uphold LITE Vaginal Support System is indicated for tissue reinforcement in women with pelvic organ prolapse, for the transvaginal repair of anterior and apical vaginal wall prolapse. CONTRAINDICATIONS The Uphold LITE Vaginal Support System is contraindicated for use in any patient in whom soft tissue implants are contraindicated. In addition patients with: • Pathology of the soft tissue into which the Uphold LITE Synthetic Mesh is to be placed. • Pregnant patients, or patients that are considering future pregnancies. • The potential of future growth (e.g. infants, children). • Any pathology, including known or suspected uterine pathology, which would compromise placement (e.g. anatomical distortion or abnormalities). 3 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Contents supplied STERILE using an ethylene oxide (EO) process. Do not use if sterile barrier is damaged. If damage is found, call your Boston Scientific representative. • Any pathology that would limit blood supply and compromise healing (e.g. decreased blood supply to organs as a result of treatments such as radiation therapy, chemotherapy). • Presence of known or suspected cancer of the vagina, cervix, or uterus. • Blood coagulation disorder. • Autoimmune connective tissue disease. • Renal insufficiency and upper urinary tract obstruction. • Pre-existing local or systemic infection. Treat the infection with the appropriate antiseptics and/or antibiotics to eliminate the infection before placing the Uphold™ LITE Synthetic Mesh. DEVICE DESCRIPTION The Uphold LITE Vaginal Support System is a sterile, single use device for transvaginal placement, consisting of (1) one Uphold LITE Synthetic Mesh Assembly and (1) one Capio™ SLIM Suture Capturing Device. The mesh assembly is a light‑weight knitted mesh that consists of undyed and dyed polypropylene monofilament fiber (phthalocyanine blue, color index number 74160) with 2 integrated leg assemblies. The leg assemblies include a dart, lead, dilator, two leader loops and protective sleeve. The dart at the distal end of the leg assembly was designed to be placed into the carrier at the distal end of the Capio SLIM Suture Capturing Device. The leg assembly was designed to facilitate the passage of the Uphold LITE Synthetic Mesh Assembly through bodily tissues for placement through the sacrospinous ligament. One dilator is striped to differentiate each leg assembly (Left/Right). Figure 1 Uphold LITE Mesh Configuration Uphold LITE Mesh implant is configured for performing vaginal wall prolapse repair via an anterior approach to the SSL. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Center Line Mesh Leg Figure 2 Mesh Leg Assembly Protective Sleeve 2 Leader Loops Dilator Lead Dart Figure 3 Capio SLIM Suture Capturing Device Warnings/Potential Complications • Hysterectomy may be needed in the future; use of mesh may make future hysterectomies more difficult due to tissue in-growth and scarring. • Cervical length must be evaluated during the preoperative workup. Patients with cervical elongation may not be appropriate candidates for this prolapse repair procedure. Hysterectomy or cervical amputation may be considered for patients with cervical elongation who choose to undergo the procedure. • Continued screening and surveillance for cervical and uterine disease may be required. Regular pelvic exam, Pap test and endometrial biopsies should be continued as medically indicated. 4 Black (K) ∆E ≤5.0 • Performing apical repair for cases involving uterine enlargement, in the presence of benign disease, should be at the physician’s discretion. An enlarged uterus may compromise the effectiveness of the procedure in some cases. • Should dysuria, bleeding or other problems occur, the patient should be instructed to contact their physician immediately. • Patients should be counseled to refrain from heavy lifting, exercise and intercourse for a minimum of six (6) weeks after the procedure. Physician should determine when it is suitable for each patient to return to normal activities. • In the event that infection presents post procedure, the entire mesh may have to be removed or revised. • Like all foreign bodies, the mesh may potentiate an existing infection reaction or sepsis. • Tissue responses to the implant may include: local irritation at the wound site, erosion or exposure vaginally or through other surrounding tissue, migration of the device from the desired location, fistula formation, foreign body reaction, and inflammation. The occurrence of these responses may require removal or revision of the mesh. • Mesh is considered a permanent implant. Removal of mesh or correction of mesh-related complications may involve multiple surgeries. • Complete removal of mesh may not be possible and additional surgeries may not always fully correct the complications. • Mild to moderate incontinence may occur due to incomplete support. • Excess tension may cause temporary or permanent lower urinary tract obstruction and retention. • Known risks of surgical procedures for the treatment of prolapse include pain, infection, erosion/exposure, device migration, complete failure of the procedure resulting in recurrent or de Novo prolapse and/or incontinence. • A digital rectal exam should be performed to detect possible rectal perforation. • Cystoscopy is recommended to confirm bladder integrity or detect possible bladder or ureteral perforation. • Overweight women may be prone to intraoperative and postoperative complications (weight parameters to be determined by the physician). • Do not turn, rotate or torque the Capio™ SLIM Device during actuation. To do so may result in injury. PRECAUTIONS • Surgical treatment of female pelvic organ prolapse should be performed by clinicians with training and experience in the minimally-invasive placement of surgical mesh devices for treatment of pelvic floor disorders and in management of complications resulting from procedures. • Training on the use of the Uphold™ LITE Vaginal Support System is recommended and available. Contact your company sales representative to arrange for this training. • The physician is advised to consult this DFU and the medical literature regarding techniques, complications and hazards associated with the intended procedures. • As with all surgical procedures, certain risk factors are known to impact patient outcomes in the pelvic floor which include, but are not limited to, impaired vascularity (e.g. diabetes, smoking status, estrogen status, pelvic floor radiation exposure, etc.), age, pelvic floor myalgia, impaired wound healing (e.g. diabetes, steroid usage, etc.), or active infection in or near the surgical site. The above pathophysiologic conditions must be considered 5 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Perforations or lacerations of vessels, nerves, bladder, urethra, or bowel may occur during placement and may require surgical repair. when determining whether the patient is an appropriate candidate for mesh implantation, either by transvaginal or transabdominal route. • The use of polypropylene mesh in urogynecologic procedures such as the treatment of pelvic organ prolapse, regardless of the route of delivery (transvaginal or transabdominal), has been associated with cases of erosion. Erosion has been reported in bladder, vagina, urethra, ureter, and bowel. Treatment of the erosion may require surgical removal. • Individual patients’ anatomy may vary greatly, for each procedure it is important that the intended planes for mesh placement and the intended location for leg placement are planned and known for each individual patient. Employment of imaging methods before and after mesh placement may aid in proper mesh placement and confirm absence of injury to non-target anatomical structures. • Standard surgical practices should be followed for pelvic floor procedures as well as for the management of contaminated or infected wounds. • The procedure should be performed with care, using the Capio™ SLIM Suture Capturing Device provided with the system to reduce the risk of perforation or laceration of any vessels, nerves, bladder, urethra and bowel. • Avoid excessive tension on the mesh during handling and positioning to prevent damage to the device. • Do not remove the protective plastic sleeve covering mesh legs until proper position has been confirmed. • Avoid excess tensioning of the mesh when positioning to avoid over correction of the defect. • Take special care in cases of bladder prolapse because of anatomical distortion. • Use only size 0 Capio Sutures with the Capio SLIM Suture Capturing Device. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Do not affix mesh with any staples, clips, or clamps as mechanical damage to the mesh may occur. • Do not bend or alter the Capio SLIM Suture Capturing Device as this may result in mechanical damage to the device. ADVERSE EVENTS Potential adverse reactions that are associated with gynecological surgical mesh include: • Erosion/extrusion/exposure; • Pain, ongoing pain, discomfort, irritation; • Infection/sepsis potentiation/abscess formation; • Bleeding (bruising, hematoma, hemorrhage, post-operative bleeding); • Dyspareunia; • Organ perforation/fistula formation; • Ureteric injury; • Ureter obstruction; • Urinary incontinence; • Urinary retention; • Retained foreign body (foreign body reaction); • Neuro-muscular problems; • Vaginal shortening or stenosis, mesh and/or tissue contracture; • Recurrent prolapse; • Allergy, hypersensitivity or other immune reaction; • Adhesion formation; • Vessel/nerve injury/perforation; • Inflammation (acute or chronic); • Vaginal discharge; • Dehiscence and/or necrosis; 6 Black (K) ∆E ≤5.0 • Wound dehiscence; • Constipation/defecatory dysfunction; • Granulation tissue formation; • Surgical site wound irritation, erythema, edema; The occurrence of these events may require surgical intervention. In some instances the response to these event may persist as a permanent condition after the intervention. HOW SUPPLIED The Uphold™ LITE Vaginal Support System is supplied sterile and is intended for single patient use only. Store in a cool, dry, dark place. Do not expose to organic solvents, ionizing radiation or ultraviolet light. Rotate inventory so that products are used prior to the expiration date on package label. Do not use if package is opened or damaged. Do not use if labeling is incomplete or illegible. OPERATIONAL INSTRUCTIONS Prior to Use 1. Carefully examine the system to verify that neither the contents nor the sterilized package has been damaged in shipment. DO NOT USE if the sterile barrier on the product is damaged. Immediately return damaged product to Boston Scientific. 2. Prepare and drape the patient using standard surgical practice. CAUTION: Verify that the bladder is empty prior to initiating the use of this product. Ensure that the bladder, urethra and other important landmarks are properly identified to prevent punctures and/or lacerations during the procedure. Directions for Use The design of the Uphold LITE Vaginal Support System allows the operator a transvaginal approach for placing the Uphold LITE Mesh Assembly. • Steps to Place Sacrospinous Ligament Legs Anteriorly • Steps to Adjust Mesh and Removal of Leg Assemblies In the event the device breaks during the procedure, please refer to the Steps to Remove a Device Fragment following the Placement Steps. Steps to PLACE SACROSPINOUS LIGAMENT LEGS Anteriorly 1. The anterior vaginal wall is grasped in the midline using a series of Allis clamps. 2. For an anterior approach make a 2-3 cm semi-thickness incision typical of an anterior colporrhaphy dissection plane, leaving approximately 2 cm at the apex of the vagina undisturbed to avoid overlapping of mesh and suture line at the incision. 3. Sharply define this plane with scissors until the descending pubic rami are palpable on each side. Once accessed, use finger sweeps in a downward and medial motion to clean off the side wall and create a smooth tunnel toward the ischial spines bilaterally. 4. The sacrospinous ligaments are then carefully exposed by gently sweeping the index finger medially from the ischial spine. CAUTION: Ensure that the sacrospinous ligament is clear of any fibrous or fatty tissue. 5. Load the dart of the leg assembly into the carrier at the distal end of the Capio™ SLIM Suture Capturing Device. Engage the dart into the carrier by gently pulling down on the lead. Ensure that the shoulder of the dart is pulled completely into the carrier. (Refer to FIG 4.) 7 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B The following instructions are divided into the following placement steps: Figure 4 Loading Dart into Capio™ SLIM Carrier 6. The Capio SLIM Suture Capturing Device can be positioned directly in the surgical field for lead placement utilizing digital palpation/direct visual control. Position the device with the distal tip in the desired location against the sacrospinous ligament where the lead is to be placed as shown in FIG 5 and hold firmly in place. 7. As shown in FIG 6, the dart is driven through the sacrospinous ligament by pushing the button until it is fully depressed, driving the dart into the catch of the Capio SLIM Suture Capturing Device. Note: A finger may be applied to the head of the Capio SLIM Device for direct palpation/stabilization. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Figures 5 & 6 Position and Throw of Lead through Tissue 8. Release and pull the driver button back to allow the carrier to retract into the housing. Pull the lead through the sacrospinous ligament as shown in FIG 7. 9. Withdraw the Capio SLIM Device from the incision as shown in FIG 8. Figures 7 & 8 Capture and Withdrawal of Lead 10.Remove the dart from the catch by holding onto the lead and sliding the dart up toward the handle to the keyhole slot. Note: Between mesh leg placements, within a single patient procedure, place the distal head of the Capio SLIM Suture Capturing Device into a bowl of sterile saline solution and rinse thoroughly to remove blood and debris. If the catch is sluggish due to tissue and blood coagulation, pull the button to retract the carrier and rinse in sterile saline solution. Following mesh assembly placement discard the Capio SLIM Device according to hospital procedures. 8 Black (K) ∆E ≤5.0 11.Repeat steps 5 through 10 for the remaining sacrospinous ligament leg. 12.Leads may be pulled extracorporeally to position temporarily before final adjustment. Steps to Adjust Mesh and Removal of Leg Assemblies 1. Adjust the mesh placement by pulling outwards on the leg assemblies. The mesh should be centered above the cervix or vaginal cuff. Once in position, if desired by the physician, the mesh may be trimmed and/or additionally fixated into position. 2. Grasp an Uphold™ LITE Synthetic Mesh Assembly leg and cut the two leader loop sections located outside of the protective sleeve. Refer to FIG 9. Figure 9 Removal of Leg Assemblies 3. Gently pull the leg assembly to remove, leaving only the mesh in place. Appropriately discard leg assembly according to hospital procedures. 4. Repeat steps 2 and 3 on the contralateral side. 5. Ensure that both leg assemblies are removed from the patient. 6. Verify the position of the mesh and adjust as necessary. 7. Complete final adjustments and mesh placement per physician preference. CAUTION: Avoid excessive tensioning of the mesh when positioning to avoid over correction of the defect. STEPS TO REMOVE A DEVICE FRAGMENT 1. In the event the device breaks and a fragment is in the patient, assess to determine if it can be located and removed without damage to the surrounding anatomy. Use caution not to disturb the operative site until it is located to avoid pushing it further from view. 2. If the fragment is in direct view it should be grasped with a fine needle driver or forceps and returned to the manufacturer along with the device for investigation. 3. If the fragment is not in direct view, use of x-ray studies may help to localize its location. Radiologic assistance should be utilized to guide dissection and retrieve the fragment, minimizing injury to surrounding tissue. REFERENCES • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. 9 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 8. Close the anterior incision. WARRANTY Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Boston Scientific Corporation (BSC) warrants that reasonable care has been used in the design and manufacture of this instrument. This warranty is in lieu of and excludes all other warranties not expressly set forth herein, whether express or implied by operation of law or otherwise, including, but not limited to, any implied warranties of merchantability or fitness for a particular purpose. Handling, storage, cleaning and sterilization of this instrument as well as other factors relating to the patient, diagnosis, treatment, surgical procedures and other matters beyond BSC’s control directly affect the instrument and the results obtained from its use. BSC’s obligation under this warranty is limited to the repair or replacement of this instrument and BSC shall not be liable for any incidental or consequential loss, damage or expense directly or indirectly arising from the use of this instrument. BSC neither assumes, nor authorizes any other person to assume for it, any other or additional liability or responsibility in connection with this instrument. BSC assumes no liability with respect to instruments reused, reprocessed or resterilized and makes no warranties, express or implied, including but not limited to merchantability or fitness for a particular purpose, with respect to such instruments. luding but not limited to merchantability or fitness for a particular purpose, with respect to such instruments. 10 Black (K) ∆E ≤5.0 Contenido ADVERTENCIA................................................................................... 12 USO INDICADO/INDICACIONES DE USO..................................... 12 CONTRAINDICACIONES.................................................................. 12 DESCRIPCIÓN DEL DISPOSITIVO.................................................. 13 Advertencias/posibles complicaciones......................... 13 PRECAUCIONES................................................................................ 14 EPISODIOS ADVERSOS................................................................... 15 PRESENTACIÓN................................................................................ 15 INSTRUCCIONES DE FUNCIONAMIENTO.................................... 16 Pasos para colocar de manera anterior las EXTREMIDADES EN EL LIGAMENTO SACROESPINOSO..... 16 Pasos para ajustar la malla y retirar los conjuntos de extremidades........................................... 17 PASOS PARA RETIRAR FRAGMENTOS DEL DISPOSITIVO............................................................................... 18 REFERENCIAS.................................................................................... 18 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B GARANTÍA......................................................................................... 19 11 Black (K) ∆E ≤5.0 Uphold™ LITE with Capio™ SLIM Sistema de sujeción vaginal ONLY Precaución: las leyes federales de los Estados Unidos solo permiten la venta de este dispositivo bajo prescripción facultativa de un médico formado en el uso de malla quirúrgica para la reparación transvaginal del prolapso de órganos pélvicos. Los médicos deben estar formados en la colocación mínimamente invasiva de dispositivos de malla quirúrgica para el tratamiento de trastornos del suelo pélvico y en el control de las complicaciones que se producen como consecuencia de las intervenciones. Lea este documento atentamente. Si no se siguen las instrucciones, se puede ocasionar un fallo o provocar lesiones a la paciente. Este documento no es un manual de formación en cirugía transvaginal para corregir el prolapso de órganos pélvicos. Los sistemas de malla ligera de Boston Scientific solo deben utilizarlos médicos formados en la corrección quirúrgica de esta patología y en el uso de este dispositivo. No existen ensayos clínicos controlados aleatorizados que hayan demostrado la seguridad y eficacia del sistema de sujeción vaginal Uphold LITE en comparación con la reparación quirúrgica convencional del prolapso de órganos pélvicos. En Estados Unidos, se ha demostrado mediante pruebas de laboratorio una equivalencia sustancial entre el sistema de sujeción vaginal Uphold LITE y el uso de mallas sintéticas. ADVERTENCIA Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B El contenido se suministra ESTÉRIL mediante óxido de etileno (OE). No usar si la barrera estéril está dañada. Si se encuentran daños, llamar al representante de Boston Scientific. Para un solo uso. No reutilizar, reprocesar o reesterilizar. La reutilización, el reprocesamiento o la reesterilización pueden comprometer la integridad estructural del dispositivo y/o causar su fallo, lo que a su vez puede resultar en lesiones al paciente, enfermedad o la muerte. La reutilización, el reprocesamiento o la reesterilización pueden también crear el riesgo de contaminación del dispositivo y/o causar infección o infección cruzada al paciente, que incluye, entre otros, la transmisión de enfermedades infecciosas de un paciente a otro. La contaminación del dispositivo puede causar lesiones, enfermedad o la muerte del paciente. Después de su uso, desechar el producto y su envase de acuerdo a las normas del hospital, administrativas y/o de las autoridades locales. USO INDICADO/INDICACIONES DE USO El sistema de sujeción vaginal Uphold LITE está indicado para reforzar tejidos en mujeres con prolapso de órganos pélvicos, para la reparación transvaginal del prolapso de la pared vaginal anterior y apical. CONTRAINDICACIONES El sistema de sujeción vaginal Uphold LITE no está indicado en pacientes a las que se les han contraindicado los implantes de tejido blando. También está contraindicado en los casos siguientes: • Pacientes con alguna patología en los tejidos blandos de la zona donde se va a colocar la malla sintética Uphold LITE. • Pacientes embarazadas o que estén considerando la posibilidad de quedar embarazadas. • Pacientes que se encuentren en fase de crecimiento (por ejemplo, menores, niñas). • Cualquier patología, incluso una patología uterina conocida o probable, que pueda comprometer la colocación del implante (por ejemplo, deformidades o anomalías anatómicas). • Cualquier patología que limite el aporte sanguíneo y ponga en riesgo el proceso de cicatrización (por ejemplo, la disminución del riego sanguíneo en los órganos debido a tratamientos como la radioterapia o la quimioterapia). • Presencia confirmada o posible de cáncer de vagina, de útero o de cuello uterino. • Trastorno de la coagulación sanguínea. 12 Black (K) ∆E ≤5.0 • Enfermedad autoinmunitaria del tejido conjuntivo. • Insuficiencia renal y obstrucción de las vías urinarias superiores. • Infecciones locales o sistémicas ya existentes. Se deberá tratar la infección con los antisépticos o antibióticos adecuados para erradicarla antes de colocar la malla sintética Uphold™ LITE. DESCRIPCIÓN DEL DISPOSITIVO El sistema de sujeción vaginal Uphold LITE es un dispositivo estéril de colocación transvaginal para un solo uso, consistente en un (1) conjunto de malla sintética Uphold LITE y un (1) dispositivo de captura de suturas Capio™ SLIM. El conjunto incorpora una ligera malla tejida que consta de fibra monofilamento de polipropileno teñida y sin teñir (azul de ftalocianina, número 74160 del índice cromático) con dos conjuntos de extremidades integradas. Los conjuntos de extremidades incluyen dardo, conductor, dilatador, dos bucles de conductor y manguito protector. El dardo, situado en el extremo distal del conjunto de extremidades, está diseñado para situarse en el cargador, que se encuentra en el extremo distal del dispositivo de captura de sutura Capio SLIM. El conjunto de extremidades está diseñado para facilitar el paso del conjunto de malla sintética Uphold LITE a través de los tejidos corporales y la posterior colocación de éste a través del ligamento sacroespinoso. Uno de los dilatadores tiene rayas para diferenciar cada conjunto de extremidades (izquierda/derecha). Figura 1 Configuración de la malla Uphold LITE Este implante de malla Uphold LITE está diseñado para la reparación del prolapso de la pared vaginal mediante un abordaje anterior del ligamento sacroespinoso. Línea central Extremidad de la malla Figura 2 Conjunto de extremidad de malla Dos bucles de conductor Dilatador Conductor Dardo Figura 3 Dispositivo de captura de sutura Capio SLIM Advertencias/posibles complicaciones • En el futuro puede ser necesario practicar una histerectomía; el uso de mallas puede dificultar futuras histerectomías debido al crecimiento y la cicatrización tisular. • Es necesario evaluar la longitud del cuello uterino durante el estudio preoperatorio. Las pacientes con dilatación cervicouterina pueden ser inadecuadas para esta reparación de prolapso. Puede considerarse la histerectomía o la amputación cervicouterina para las pacientes con dilatación cervicouterina que decidan someterse al procedimiento. • Es posible que se necesiten pruebas de detección continuas y control de enfermedades cervicouterinas y uterinas. Se debe continuar con el examen pélvico regular, la prueba de Papanicolaou y las biopsias de endometrio según la indicación del médico. • En los casos en los que exista dilatación uterina en presencia de dolencias benignas, la decisión sobre la realización de la reparación apical quedará a juicio del médico. Un útero dilatado puede comprometer la eficacia del procedimiento en algunos casos. • Se debe informar a la paciente de la necesidad de llamar a su médico de inmediato en caso de disuria, hemorragia u otros problemas. • Debe recomendarse a las pacientes que eviten levantar grandes pesos, hacer ejercicio y mantener relaciones sexuales durante un periodo mínimo de seis (6) semanas después de la intervención. El médico debe determinar el momento en el que cada paciente puede volver a realizar una vida normal. 13 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Manguito protector • Si surgen infecciones posteriores a la intervención, es posible que haya que extraer o revisar toda la malla. • Como ocurre con todos los cuerpos extraños, es posible que la malla agrave una infección, reacción o septicemia existente. • La reacción de los tejidos al implante puede consistir en irritación local en el lugar de la herida, erosión o exposición a través de la vagina o de otros tejidos circundantes, desplazamiento del dispositivo de la ubicación deseada, formación de fístulas, rechazo de cuerpos extraños e inflamación. Es posible que la aparición de estas reacciones exija la extracción o revisión de la malla. • Se considera que la malla es un implante permanente. La extracción de la malla o la corrección de complicaciones relacionadas con la malla puede suponer varias intervenciones quirúrgicas. • Es posible que la malla no pueda extraerse por completo y que las nuevas intervenciones quirúrgicas no siempre corrijan totalmente las complicaciones. • Si la sujeción es incompleta, puede producirse una incontinencia de leve a moderada. • El exceso de tensión puede provocar una obstrucción temporal o permanente de las vías urinarias inferiores y retención de orina. • Los riesgos conocidos de las intervenciones quirúrgicas para el tratamiento del prolapso incluyen dolor, infecciones, erosión/ exposición, desplazamiento del dispositivo, fracaso total de la intervención que provoca prolapso recurrente o nuevo, o incontinencia. • Durante la colocación pueden producirse perforaciones o laceraciones que necesiten reparación quirúrgica en vasos, nervios, la vejiga, la uretra o el intestino. • Debe efectuarse una exploración rectal digital para detectar posibles perforaciones rectales. • Se recomienda realizar una cistoscopia para confirmar la integridad vesical o detectar posibles perforaciones en la vejiga o en los uréteres. • Las mujeres con sobrepeso pueden ser propensas a complicaciones intra o posoperatorias (el médico debe determinar los parámetros relativos al peso). • No se puede voltear, girar o torcer el dispositivo Capio™ SLIM durante la activación. De lo contrario, se podrían producir lesiones. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B PRECAUCIONES • La intervención quirúrgica de un prolapso del órgano pélvico femenino debe ser realizada únicamente por médicos con experiencia y formación en la colocación mínimamente invasiva de dispositivos de malla quirúrgica para el tratamiento de trastornos del suelo pélvico y en el control de las complicaciones que se producen como consecuencia de las intervenciones. • Se recomienda recibir formación disponible acerca del uso del sistema de sujeción vaginal Uphold™ LITE. Póngase en contacto con su representante comercial para solicitar dicha formación. • Se recomienda al médico que consulte estas Instrucciones de uso y la bibliografía médica sobre técnicas, complicaciones y riesgos asociados a estas intervenciones. • Como ocurre con todas las intervenciones quirúrgicas, existen ciertos factores de riesgo que afectan a los resultados en el suelo pélvico, que incluyen, entre otros, vascularidad limitada (p. ej., diabetes, tabaquismo, estado de los estrógenos, exposición a la radiación del suelo pélvico, etc.), edad, mialgia del suelo pélvico, mala cicatrización de las heridas (p. ej., diabetes, consumo de esteroides, etc.) o presencia de infecciones activas en el lugar de intervención o cerca del mismo. Deben tenerse en cuenta los trastornos patofisiológicos arriba indicados para determinar si la paciente es una candidata adecuada para la implantación de la malla, ya sea mediante vía transvaginal o transabdominal. • El uso de la malla de polipropileno en intervenciones uroginecológicas, como el tratamiento del prolapso de órganos pélvicos, independientemente de la vía de implantación (transvaginal o transabdominal), se ha asociado a casos de erosión. Se han detectado erosiones en la vejiga, la vagina, la uretra, el uréter y el intestino. El tratamiento de la erosión puede implicar la extracción quirúrgica. • Los aspectos anatómicos pueden variar considerablemente de una paciente a otra, por lo que es importante que en cada intervención se planifiquen y conozcan los planos previstos para la ubicación de la malla y el lugar de colocación de las extremidades en cada paciente. La obtención de imágenes médicas antes y después de implantar la malla puede facilitar su correcta colocación y confirmar la ausencia de lesiones en estructuras anatómicas ajenas a la intervención. 14 Black (K) ∆E ≤5.0 • Es necesario seguir las pautas quirúrgicas estándar tanto en las intervenciones que se realizan en el suelo pélvico como en el tratamiento de las heridas infectadas o contaminadas. • Esta intervención debe realizarse con cuidado mediante el uso del dispositivo de captura de sutura Capio™ SLIM incluido con el sistema, para reducir el riesgo de perforación o laceración en los vasos, los nervios, la vejiga, la uretra y el intestino. • Evite ejercer una tensión excesiva sobre la malla durante su manipulación y colocación para prevenir posibles daños en el dispositivo. • No retire el manguito protector de plástico que cubre las extremidades de la malla hasta que haya confirmado que se encuentra en la posición correcta. • No tense demasiado la malla durante su colocación para no excederse en la corrección del defecto. • Tome precauciones especiales en los casos de prolapso de vejiga debido a una deformación anatómica. • Utilice únicamente suturas Capio SLIM de tamaño 0 con el dispositivo de captura de sutura Capio. • No fije la malla con grapas, clips o pinzas, ya que pueden producir daños mecánicos en la malla. • No doble ni altere el dispositivo de captura de sutura Capio SLIM ya que esto puede causarle daños mecánicos. EPISODIOS ADVERSOS Entre las posibles reacciones adversas asociadas al uso de mallas quirúrgicas ginecológicas se incluyen las siguientes: • Erosión, extrusión o exposición • Dolores, dolor ininterrumpido, molestias o irritación • Infección, potenciación de septicemias o formación de abscesos • Hemorragia (hematoma, sangrado, hemorragia posoperatoria) • Dispareunia • Perforación de órganos o formación de fístulas • Lesión ureteral • Obstrucción ureteral • Incontinencia urinaria • Retención de orina • Problemas neuromusculares • Acortamiento o estenosis vaginal y contractura de la malla o de los tejidos • Prolapso recurrente • Alergia, hipersensibilidad u otro tipo de reacción inmunitaria • Formación de adherencias • Lesión o perforación de vasos o nervios • Inflamación (aguda o crónica) • Secreción vaginal • Dehiscencia o necrosis • Dehiscencia de la herida • Estreñimiento o problemas de defecación • Formación de tejido de granulación • Irritación, eritema o edema en la herida quirúrgica Es posible que la aparición de estos episodios exija una intervención quirúrgica. En algunos casos, la respuesta frente a estos episodios puede persistir como una enfermedad permanente tras la intervención. PRESENTACIÓN El sistema de sujeción vaginal Uphold™ LITE se suministra estéril para su uso con una sola paciente. Almacenar en un lugar oscuro, seco y fresco. No exponer a disolventes orgánicos, radiaciones ionizantes ni luz ultravioleta. Rotar los productos del inventario para utilizarlos antes de la fecha de caducidad que se indica en la etiqueta del envase. No utilizar si el envase está abierto o dañado. No utilizar si la etiqueta está incompleta o ilegible. 15 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Cuerpos extraños retenidos (reacción del organismo a un cuerpo extraño) INSTRUCCIONES DE FUNCIONAMIENTO Antes de su uso 1. Examine cuidadosamente el sistema para comprobar que ni el contenido ni el envase estéril se hayan deteriorado durante el envío. NO LO USE si está deteriorada la barrera estéril del producto. Devuelva inmediatamente el producto dañado a Boston Scientific. 2. Prepare y cubra a la paciente de acuerdo con las prácticas quirúrgicas estándar. PRECAUCIÓN: asegúrese de que la vejiga esté vacía antes de empezar a utilizar este producto. Compruebe que se han identificado debidamente la vejiga, la uretra y otros órganos importantes para evitar posibles punciones o laceraciones durante la intervención. Instrucciones de uso El diseño del sistema de sujeción vaginal Uphold™ LITE permite al cirujano emplear un abordaje transvaginal para la colocación del conjunto de malla Uphold LITE. Las instrucciones siguientes se dividen en estos pasos para la colocación del dispositivo: • Pasos para colocar de manera anterior las extremidades en el ligamento sacroespinoso • Pasos para ajustar la malla y retirar los conjuntos de las extremidades Si se rompe el dispositivo durante la intervención, consulte la sección Pasos para extraer fragmentos del dispositivo después de colocarlo. Pasos para colocar de manera anterior las EXTREMIDADES EN EL LIGAMENTO SACROESPINOSO 1. La pared vaginal anterior se sujeta en la línea media con una serie de pinzas Allis. 2. Para el abordaje anterior, practique una incisión de 2-3 cm de profundidad media, típica de un plano de disección de una colporrafia anterior, y deje aproximadamente 2 cm en el vértice vaginal sin ningún obstáculo para evitar la superposición de la malla y la línea de sutura en la incisión. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 3. Defina claramente este plano con unas tijeras hasta que las ramas descendentes del pubis puedan palparse a ambos lados. Una vez logrado el acceso, mueva los dedos en sentido descendente y medial para limpiar la pared lateral y crear un túnel liso hacia las espinas ciáticas en sentido bilateral. 4. Seguidamente, exponga con cuidado los ligamentos sacroespinosos desplazando suavemente el dedo índice en sentido medial desde la espina ciática. PRECAUCIÓN: asegúrese de que el ligamento sacroespinoso no contenga tejido fibroso ni adiposo. 5. Cargue el dardo del conjunto de las extremidades en el cargador situado en el extremo distal del dispositivo de captura de suturas Capio™ SLIM. Introduzca el dardo en el cargador tirando suavemente del conductor hacia abajo. Compruebe que el reborde del dardo se haya introducido completamente en el cargador. (Consulte la figura 4.) Figura 4 Colocación del dardo en el cargador Capio SLIM 6. El dispositivo de captura de sutura Capio SLIM puede situarse directamente en el campo quirúrgico para colocar el conductor mediante control visual directo o palpación. Coloque el dispositivo con el extremo distal en el lugar deseado contra el ligamento sacroespinoso en el que ha de colocarse el conductor, tal como se muestra en la figura 5, y manténgalo con firmeza en esa posición. 7. Como se muestra en la figura 6, se dirige el dardo a través del ligamento sacroespinoso presionando el botón hasta el fondo y llevando el dardo hasta el cierre del dispositivo de captura de sutura Capio SLIM. 16 Black (K) ∆E ≤5.0 Nota: se puede tocar el cabezal del dispositivo Capio™ SLIM con el dedo para la palpación/estabilización directa. Figuras 5 y 6 Colocación e introducción del conductor a través del tejido 8. Suelte el botón de control y tire de él para que el cargador vuelva al interior del dispositivo. Tire del conductor a través del ligamento sacroespinoso tal y como muestra la figura 7. 9. Retire de la incisión el dispositivo Capio SLIM tal y como se muestra en la figura 8. Figuras 7 y 8 Captura y extracción del conductor Nota: entre cada colocación de las extremidades de la malla, dentro de la misma intervención en la paciente, introduzca el cabezal distal del dispositivo de captura de sutura Capio SLIM en un recipiente con solución salina estéril y enjuáguelo bien para eliminar la sangre y otros residuos. Si el cierre del dardo es lento debido a los restos de tejidos y a la coagulación de la sangre, tire del botón para retraer el cargador y enjuáguelo con una solución salina estéril. Una vez colocado el dispositivo de malla, siga los procedimientos del hospital para desechar el dispositivo Capio SLIM. 11. Repita los pasos del 5 al 10 con la otra extremidad del ligamento sacroespinoso. 12. Se puede tirar de los conductores extracorpóreamente para colocarlos de manera temporal antes del ajuste final. Pasos para ajustar la malla y retirar los conjuntos de extremidades 1. Coloque la malla tirando hacia fuera de los conjuntos de extremidades. La malla debe centrarse sobre el cuello del útero o el manguito vaginal. Una vez situada, si el médico lo desea, la malla puede terminar de recortarse o fijarse para colocarla en la posición adecuada. 2. Sujete una de las extremidades del conjunto de la malla sintética Uphold™ LITE y corte las dos secciones de bucle del conductor situadas fuera del manguito protector. Consulte la figura 9. 17 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 10. Extraiga el dardo del cierre, sujetando el conductor y deslizando el dardo hacia arriba en dirección a la empuñadura hasta la ranura de chaveta. Figura 9 Extracción de los conjuntos de las extremidades 3. Tire suavemente del conjunto de las extremidades para extraerlas de modo que quede solo la malla. Deseche adecuadamente el conjunto de las extremidades como indiquen los procedimientos del hospital. 4. Repita los pasos 2 y 3 en el lado contrario. 5. Asegúrese de retirar los dos conjuntos de las extremidades del cuerpo de la paciente. 6. Compruebe la posición de la malla y ajústela según sea necesario. 7. Complete los ajustes finales y la colocación de la malla según el criterio médico. 8. Cierre la incisión anterior. PRECAUCIÓN: evite tensar demasiado la malla durante su colocación para no corregir en exceso el defecto. PASOS PARA RETIRAR FRAGMENTOS DEL DISPOSITIVO Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 1. Si el dispositivo se rompe y queda un fragmento dentro de la paciente, compruebe si se puede localizar y extraer sin dañar las estructuras anatómicas circundantes. Tenga cuidado de no alterar la zona quirúrgica hasta que se haya localizado el fragmento para evitar que penetre aún más y deje de verse. 2. Si el fragmento se ve directamente, retírelo con un portaagujas fino o con unas pinzas, y envíeselo al fabricante junto con el dispositivo para su estudio. 3. Si no se ve directamente, una radiografía puede facilitar su localización. Deben emplearse métodos radiológicos para orientar la disección y recuperar el fragmento, reduciendo al mínimo las lesiones en los tejidos circundantes. REFERENCIAS • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. 18 Black (K) ∆E ≤5.0 GARANTÍA Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Boston Scientific Corporation (BSC) garantiza que se ha puesto un cuidado razonable en el diseño y la fabricación de este instrumento. Esta garantía sustituye a cualquier otra que no se mencione expresamente en este documento, ya sea de forma explícita o implícita por ley o de otro modo, incluida, entre otras, cualquier garantía implícita de comerciabilidad o de adecuación para un fin concreto. La manipulación, el almacenamiento, la limpieza y la esterilización de este instrumento, así como otros aspectos relacionados con el paciente, el diagnóstico, el tratamiento, las intervenciones quirúrgicas y cualquier otro aspecto ajeno al control de BSC afectan directamente a este instrumento y a los resultados que puedan obtenerse de su uso. La responsabilidad de BSC en virtud de esta garantía se limita a la reparación o sustitución de este instrumento y BSC no asumirá responsabilidad alguna por pérdidas accidentales o consecuentes, por daños ni por gastos directos o indirectos que pueda ocasionar el uso de este instrumento. BSC tampoco asume ninguna otra obligación o responsabilidad relacionada con este instrumento ni autoriza a ninguna persona a que lo haga en su nombre. BSC rechaza cualquier responsabilidad con respecto a instrumentos reutilizados, reprocesados o reesterilizados y, respecto a los mismos, no ofrece garantía alguna, ya sea explícita o implícita, incluyendo entre otras la de comerciabilidad y adecuación para un fin concreto. 19 Black (K) ∆E ≤5.0 Table des matières MISE EN GARDE............................................................................... 21 UTILISATION/INDICATIONS........................................................... 21 CONTRE-INDICATIONS.................................................................... 21 DESCRIPTION DU DISPOSITIF....................................................... 22 Mises en garde/Complications possibles...................... 22 PRÉCAUTIONS.................................................................................. 23 ÉVÉNEMENTS INDÉSIRABLES....................................................... 24 PRÉSENTATION................................................................................. 25 INSTRUCTIONS D’UTILISATION.................................................... 25 Étapes de la MISE EN PLACE DES PATTES DE LIGAMENT SACRO-ÉPINEUX pour une approche antérieure................................................................................ 25 Étapes de la procédure d’ajustement de la bandelette et de retrait des systèmes de patte...................................................................................... 27 ÉTAPES DE RETRAIT D’UN FRAGMENT DU DISPOSITIF................................................................................... 27 RÉFÉRENCES..................................................................................... 27 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B GARANTIE.......................................................................................... 28 20 Black (K) ∆E ≤5.0 U Uphold™ LITE with Capio™ SLIM Système de soutènement vaginal ONLY Avertissement : Selon la loi fédérale américaine, ce dispositif ne peut être vendu que sur prescription d'un médecin formé à l'utilisation de bandelettes chirurgicales pour la réparation transvaginale d'un prolapsus d'organes pelviens. Les médecins doivent être formés à la mise en place mini-invasive de systèmes à bandelettes chirurgicales pour le traitement de troubles du plancher pelvien et à la prise en charge des complications consécutives aux procédures. Lire attentivement ce document. Le non-respect de ces instructions peut entraîner un dysfonctionnement et/ou des lésions pour la patiente. Ce document n'est pas un manuel de formation sur la chirurgie transvaginale pour corriger un prolapsus d'organe pelvien. Les systèmes de bandelettes légères Boston Scientific ne doivent être utilisés que par des médecins formés à la correction chirurgicale de cette pathologie et à l'utilisation de tels dispositifs. L’innocuité et l’efficacité du système de soutènement vaginal Uphold LITE, en comparaison avec la réparation chirurgicale traditionnelle d’un prolapsus d’organe pelvien n’ont, à ce jour, pas été démontrées dans le cadre d’essais cliniques contrôlés randomisés. Aux États-Unis, des tests sur banc d’essai ont démontré une équivalence substantielle entre le système de soutènement vaginal Uphold LITE et la bandelette synthétique. MISE EN GARDE À usage unique. Ne pas réutiliser, retraiter ou restériliser. La réutilisation, le retraitement ou la restérilisation de ce dispositif risquent de compromettre son intégrité structurelle et/ou d’entraîner son dysfonctionnement, risquant de provoquer des blessures, des maladies ou le décès du patient. De plus, une telle action risque d’entraîner la contamination du dispositif et/ou l’infection croisée du patient, y compris la transmission de maladies infectieuses d’un patient à un autre. La contamination du dispositif peut causer des blessures, des maladies ou le décès du patient. Après utilisation, éliminer le produit et l’emballage conformément au règlement de l’établissement, de l’administration et/ou du gouvernement local. UTILISATION/INDICATIONS Le système de soutènement vaginal Uphold LITE est indiqué pour le renforcement chez les femmes présentant un prolapsus des organes pelviens, pour la réparation transvaginale d’un prolapsus de la paroi vaginale antérieure et apicale. CONTRE-INDICATIONS Le système de soutènement vaginal Uphold LITE n’est pas recommandé chez les patientes pour lesquelles les implants dans les tissus mous sont contre-indiqués. Sont également concernées les patientes présentant : • une pathologie des tissus mous dans lesquels la bandelette synthétique Uphold LITE doit être mise en place ; • les patientes enceintes ou qui envisagent de le devenir ; • une possibilité de croissance future (par exemple, nourrissons, enfants) ; • toute pathologie, notamment une pathologie utérine connue ou suspectée, qui pourrait compromettre la mise en place de l’implant (par ex. distorsion ou anomalies anatomiques) ; • toute pathologie qui pourrait restreindre la circulation sanguine et compromettre la guérison (par ex. réduction de la circulation sanguine vers les organes causée par des traitements tels que la radiothérapie ou la chimiothérapie) ; • présence d’un cancer du vagin, du col de l’utérus ou de l’utérus connu ou suspecté ; • un trouble de la coagulation sanguine ; 21 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Contenu STÉRILISÉ à l’oxyde d’éthylène (OE). Ne pas utiliser si l’emballage stérile est endommagé. Si le produit est endommagé, contacter le représentant de Boston Scientific. • une maladie auto-immune des tissus conjonctifs ; • une insuffisance rénale et une obstruction du tractus urinaire supérieur ; • une infection systémique ou locale préexistante. Traiter l’infection à l’aide des antiseptiques et/ou antibiotiques appropriés, afin de l’éliminer avant de mettre en place la bandelette synthétique Uphold™ LITE. DESCRIPTION DU DISPOSITIF Le système de soutènement vaginal Uphold LITE est un dispositif stérile à usage unique destiné à être mis en place par voie intra-vaginale. Il se compose d’(1) un système de bandelette synthétique Uphold LITE et d’(1) un dispositif attrape-suture Capio™ SLIM. La bandelette tressée est constituée d’un tricot de fibres de polypropylène monofilament teinté et non teinté (bleu de phthalocyanine, indice de couleur numéro 74160) à 2 systèmes de pattes intégrées. Les systèmes de patte comprennent une aiguille, un fil, un dilatateur, deux boucles d’enfilage et un manchon de protection. L’aiguille située à l’extrémité distale du système de patte est destinée à être placée dans le support d’aiguille à l’extrémité distale du dispositif attrape-suture Capio SLIM. Le système de patte a été conçu pour faciliter le passage du dispositif de bandelette synthétique Uphold LITE à travers les tissus corporels, en vue d’une mise en place à travers le ligament sacro-épineux. Un dilatateur est pourvu de repères pour différencier chaque système de patte (gauche/droit). Figure 1 Configuration de bandelette Uphold LITE L’implantation d’une bandelette Uphold LITE a pour but de réparer un prolapsus des parois vaginales via une approche antérieure par fixation du ligament sacro-épineux. Ligne centrale Patte de bandelette Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Figure 2 Système de pattes pour bandelette Manchon de protection Dilatateur 2 boucles d’enfilage Fil Aiguille Figure 3 Dispositif attrape-suture Capio SLIM Mises en garde/Complications possibles • Une hystérectomie pourrait être nécessaire ultérieurement ; l’utilisation d’une bandelette rend plus difficiles les hystérectomies ultérieures en raison de la croissance tissulaire interne et de la cicatrisation des tissus. • La longueur cervicale doit être évaluée au cours de la préparation préopératoire ; les patientes présentant une élongation cervicale ne sont pas indiquées pour les procédures de réparation de prolapsus ; l’hystérectomie ou l’amputation cervicale doit être envisagée chez les patientes présentant une élongation cervicale mais choisissant d’effectuer la procédure. • Un dépistage et une surveillance continus des maladies cervicales et utérines peuvent être nécessaires ; procéder régulièrement à des examens pelviens, des frottis cervico-vaginaux et des biopsies de l’endomètre selon les indications des médecins. • La réparation apicale dans les cas impliquant un élargissement utérin, en présence d’une maladie bénigne, doit rester à la discrétion du médecin ; un utérus élargi risque dans certains cas de compromettre l’efficacité de la procédure dans certains cas. • Il doit être recommandé aux patientes de contacter immédiatement leur médecin en cas de dysurie, de saignement ou de tout autre problème. 22 Black (K) ∆E ≤5.0 • Il doit être recommandé aux patientes d’éviter le sport, le port de charges lourdes et les relations sexuelles pendant six (6) semaines au moins. Il incombe au médecin de déterminer le délai de retour à une activité normale approprié pour chaque patiente. • En cas d’infection après la procédure, la révision ou le retrait complet de la bandelette peut s’avérer nécessaire. • Comme tout corps étranger, la bandelette peut amplifier une réaction d’infection ou une septicémie existante. • Les réactions des tissus à l’implant peuvent inclure une irritation locale au niveau du site d’intervention, une érosion vaginale ou une exposition à travers le vagin ou un autre tissu voisin, la migration du dispositif depuis son emplacement prévu, la formation d’une fistule, une réaction au corps étranger et une inflammation. La survenue de ces réactions peut nécessiter le retrait ou la révision de la bandelette. • La bandelette est considérée comme étant un implant permanent. Le retrait de la bandelette ou la correction de complications associées à la bandelette peut nécessiter plusieurs interventions chirurgicales. • Il est possible que le retrait total de la bandelette ne soit pas possible et que des interventions chirurgicales supplémentaires n’arrivent pas toujours à corriger totalement les complications. • Une incontinence légère à modérée peut survenir en cas de soutènement inadéquat. • Une tension excessive de la bandelette peut provoquer la rétention ou l’obstruction du tractus urinaire inférieur, de manière temporaire ou permanente. • Parmi les risques connus des procédures chirurgicales pour le traitement du prolapsus figurent notamment : douleur, infection, lésion/exposition, migration du dispositif, échec complet de la procédure conduisant à un épisode récurrent ou nouveau de prolapsus et/ou d’incontinence. • Des perforations ou lacérations de vaisseaux, de nerfs, de la vessie, de l’urètre ou de l’intestin peuvent survenir lors de la mise en place et peuvent nécessiter une réparation chirurgicale. • Un toucher rectal devra être réalisé en vue de détecter les éventuelles perforations rectales. • Chez les femmes présentant un excès de poids, des complications peuvent être observées pendant ou après l’intervention (paramètres de poids à déterminer par le médecin). • Ne pas tourner, faire pivoter ni exercer une force sur le dispositif Capio™ SLIM, au risque de provoquer des lésions. PRÉCAUTIONS • Le traitement chirurgical du prolapsus d’organe pelvien chez la femme doit être exécuté par des médecins expérimentés et formés à la mise en place mini-invasive de systèmes de bandelettes chirurgicales pour le traitement de troubles du plancher pelvien et à la prise en charge des complications consécutives aux procédures. • Une formation relative à l’utilisation du système de soutènement vaginal Uphold™ LITE est recommandée et disponible. Contacter le représentant commercial de la société pour organiser cette formation. • Il est recommandé au médecin de consulter ce mode d’emploi et la littérature médicale consacrée aux techniques, aux complications et aux risques associés à cette procédure. • Comme pour toute intervention chirurgicale, certains facteurs de risque pouvant avoir des conséquences au niveau du plancher pelvien de la patiente existent ; ces derniers incluent notamment : troubles vasculaires (par ex. diabète, statut tabagique, statut œstrogénique, exposition du plancher pelvien aux rayonnements, etc.), âge, myalgie du plancher pelvien, altération de la cicatrisation (par ex. diabète, usage de stéroïdes, etc.) ou infection active au niveau ou à proximité du site chirurgical. Les conditions pathophysiologiques mentionnées ci-dessus doivent être prises en compte au moment de déterminer si la patiente est une candidate appropriée pour l’implantation, par voie vaginale ou transabdominale, d’une bandelette. • L’utilisation de bandelettes en polypropylène dans le cadre d’interventions uro-gynécologiques, telles que le traitement du prolapsus des organes pelviens, quelle que soit la voie utilisée pour la pose de la bandelette (transvaginale ou transabdominale), a été associée à des cas d’érosion. L’érosion a été signalée au niveau de la vessie, du vagin, de l’urètre, des uretères ou de l’intestin. Le traitement de l’érosion peut nécessiter un retrait chirurgical. 23 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Il est conseillé de pratiquer une cystoscopie afin de confirmer l’intégrité de la vessie ou de détecter toute éventuelle perforation de la vessie ou de l’uretère. • L’anatomie est susceptible de varier considérablement d’une patiente à une autre. Dès lors, pour chaque procédure comme pour chaque patiente, il est important de planifier et de connaître à l’avance la mise en place de la bandelette envisagée et l’emplacement prévu pour la mise en place des pattes de la bandelette. Le recours à des méthodes d’imagerie avant et après la mise en place de la bandelette peut s’avérer utile non seulement pour bien mettre en place la bandelette mais également pour confirmer que les structures anatomiques non visées ne présentent pas de lésions. • Les pratiques chirurgicales standard doivent être appliquées aux procédures de plancher pelvien, ainsi qu’à la prise en charge des plaies contaminées ou infectées. • La procédure doit être exécutée avec soin, en utilisant le dispositif attrape-suture Capio™ SLIM fourni avec le système, afin de réduire le risque de perforation ou de lacération des vaisseaux, des nerfs, de la vessie, de l’urètre et de l’intestin. • Pour éviter d’endommager le dispositif, ne pas exercer de tension excessive sur la bandelette en la manipulant. • Ne pas procéder pas au retrait du revêtement protecteur des pattes de la bandelette avant que la mise en place correcte de l’implant ait été confirmée. • Pour éviter une correction excessive du défaut, éviter d’exercer une tension trop importante sur la bandelette lors du positionnement. • Accorder une attention particulière aux cas de prolapsus de la vessie dû à une distorsion anatomique. • Utiliser uniquement des sutures Capio de taille 0 avec le dispositif attrape-suture Capio SLIM. • Ne pas fixer la bandelette à l’aide d’agrafes, de clips ou de clamps sous peine de dommages mécaniques de la bandelette. • Ne pas courber ni altérer le dispositif attrape-suture Capio SLIM, au risque d’entraîner des dommages mécaniques. ÉVÉNEMENTS INDÉSIRABLES Parmi les éventuelles réactions indésirables associées à la bandelette chirurgicale gynécologique figurent : • érosion/extrusion/exposition ; • douleur, douleur permanente, inconfort, irritation ; • infection/septicémie/abcès ; • saignement (contusions, hématome, hémorragie, saignement postopératoire) ; Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • dyspareunie ; • perforation d’organe/formation de fistule ; • lésion de l’uretère ; • obstruction de l’uretère ; • incontinence urinaire ; • rétention urinaire ; • rétention d’un corps étranger (réaction au corps étranger) ; • problèmes neuro-musculaires ; • raccourcissement vaginal ou sténose, contraction des tissus et/ou de la bandelette ; • prolapsus récurrent ; • allergie, hypersensibilité ou autre réaction immunitaire ; • formation d’une adhésion ; • lésion/perforation de vaisseau/nerf ; • inflammation (aiguë ou chronique) ; • écoulement vaginal ; • déhiscence et/ou nécrose ; • déhiscence de la plaie ; • constipation/trouble de la défécation ; • formation d’un bourgeon charnu ; • irritation de la plaie, érythème, œdème au niveau du site chirurgical. La survenue de ces événements peut nécessiter une intervention chirurgicale. Dans certains cas, la réponse à ces événements peut durer de manière permanente après l’intervention. 24 Black (K) ∆E ≤5.0 PRÉSENTATION Le système de soutènement vaginal Uphold™ LITE est fourni stérile ; son utilisation est prévue pour une seule patiente. Conserver dans un endroit sec, à l’abri de la lumière et de la chaleur. Ne pas exposer à des solvants organiques, des rayonnements ionisants ou des rayons ultraviolets. Effectuer une rotation des inventaires pour que les dispositifs soient utilisés avant la date de péremption indiquée sur l’emballage. Ne pas utiliser si l’emballage est ouvert ou endommagé. Ne pas utiliser si l’étiquetage est incomplet ou illisible. INSTRUCTIONS D’UTILISATION Avant l’utilisation 1. Examiner soigneusement le système afin de vérifier que le conditionnement stérile et son contenu n’ont pas été endommagés au cours de l’expédition. NE PAS UTILISER si l’emballage stérile est endommagé. Renvoyer immédiatement tout produit endommagé à Boston Scientific. 2. Préparer la patiente et installer un champ stérile conformément à la pratique chirurgicale standard. AVERTISSEMENT : Avant de commencer la procédure, s’assurer que la vessie de la patiente est vide. S’assurer également que la vessie, l’urètre et d’autres repères importants sont correctement identifiés afin d’éviter des perforations et/ou lacérations durant l’intervention. Mode d’emploi La conception du système de soutènement vaginal Uphold LITE permet à l’opérateur une approche transvaginale pour la mise en place du dispositif de bandelette synthétique Uphold LITE. Les instructions qui suivent se composent des étapes de mise en place suivantes : • Étapes de la mise en place des pattes de ligament sacro-épineux pour une approche antérieure • Étapes de la procédure d’ajustement de la bandelette et de retrait des systèmes de patte En cas de rupture du dispositif lors de la procédure, se reporter aux étapes de retrait d’un fragment du dispositif figurant à la suite des étapes de mise en place. 1. Saisir la paroi vaginale antérieure au niveau de la ligne médiane en utilisant une série de pinces d’Allis. 2. Pour une approche antérieure, réaliser une incision semi-épaisse de 2 à 3 cm typique d’un plan de dissection de colporraphie, en laissant 2 cm environ au sommet du vagin pour éviter tout chevauchement de la bandelette et de la ligne de suture au niveau de l’incision. 3. Pratiquer une dissection franche du plan avec des ciseaux jusqu’à ce que les branches ischio-pubiennes soient palpables bilatéralement. Une fois l’accès obtenu, procéder à un balayage des doigts selon un mouvement vers le bas et vers le milieu de sorte à nettoyer la paroi centrale et à créer bilatéralement un tunnel vers les épines ischiatiques. 4. Les ligaments sacro-épineux sont alors soigneusement exposés par un léger balayage de l’index dans la ligne médiane de l’épine schiatique. AVERTISSEMENT : Vérifier que le ligament sacro-épineux ne présente aucun tissu fibreux ou graisseux. 5. Charger l’aiguille située à l’extrémité distale du système de patte dans le support à l’extrémité distale du dispositif attrape-suture Capio™ SLIM. Insérer l’aiguille dans le support en tirant délicatement sur le fil. S’assurer que l’épaulement de l’aiguille est complètement inséré dans le support. (Voir la figure 4.) Figure 4 Chargement de l’aiguille dans le support Capio SLIM 25 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Étapes de la MISE EN PLACE DES PATTES DE LIGAMENT SACROÉPINEUX pour une approche antérieure 6. Le dispositif attrape-suture Capio™ SLIM peut être positionné directement dans le champ chirurgical pour mettre le fil en place par palpation ou sous contrôle visuel direct. Positionner le dispositif en plaçant la pointe distale à l’endroit désiré contre le ligament sacroépineux où le fil doit être placé, comme illustré à la figure 5, et le maintenir fermement en place. 7. Comme illustré à la figure 6, l’aiguille est enfoncée dans le ligament sacro-épineux en appuyant sur le bouton jusqu’à ce que ce dernier soit complètement enfoncé, faisant ainsi passer l’aiguille dans le bloc-aiguille du dispositif attrape-suture Capio SLIM. Remarque : Il est possible de placer un doigt sur la tête du dispositif Capio SLIM pour la palpation/stabilisation directe. Figures 5 et 6 Positionnement et pose du fil à travers le tissu 8. Libérer et tirer le bouton de commande pour permettre au support de fil de se rétracter dans le boîtier. Tirer le fil à travers le ligament sacro-épineux, comme illustré à la figure 7. 9. Retirer le dispositif Capio SLIM de l’incision, comme illustré à la Figure 8. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Figures 7 et 8 Capture et retrait du fil 10. Enlever l’aiguille du bloc-aiguille en maintenant le fil et en faisant glisser l’aiguille vers le haut en direction de la poignée jusqu’à la fente en forme de trou de serrure. Remarque : Entre les mises en place des pattes de la bandelette, au cours d’une même intervention sur une patiente, placer la tête distale du dispositif attrape-suture Capio SLIM dans un bol contenant du sérum physiologique stérile et rincer abondamment pour éliminer le sang et les débris. Si le bloc-aiguille n’est pas réactif en raison de la coagulation du sang et du tissu, tirer sur le bouton pour rétracter le support et le rincer dans le sérum physiologique stérile. Après la mise en place du dispositif de bandelette, éliminer le dispositif Capio SLIM conformément aux protocoles de l’établissement. 11. Répéter les étapes 5 à 10 pour la patte de ligament sacro-épineux restante. 12. Les fils peuvent être tirés à l’extérieur du corps, afin de les positionner temporairement avant l’ajustement final. 26 Black (K) ∆E ≤5.0 Étapes de la procédure d’ajustement de la bandelette et de retrait des systèmes de patte 1. Ajuster la mise en place de la bandelette en tirant vers l’extérieur sur les systèmes de patte. La bandelette doit être centrée au-dessus du col de l’utérus ou du dôme vaginal. Une fois mise en place, si le médecin le souhaite, la bandelette peut être raccourcie et/ou maintenue en place par une fixation supplémentaire. 2. Saisir un système de patte de la bandelette synthétique du système de soutènement vaginal Uphold™ LITE et couper les deux sections de boucle d’enfilage placées en dehors du manchon de protection. Voir figure 9. Figure 9 Retrait des systèmes de patte 3. Pour le retrait, tirer doucement sur le système de patte, afin de ne laisser que la bandelette. Éliminer le système de patte conformément aux protocoles de l’établissement. 4. Répéter les étapes 2 et 3 sur le côté opposé. 5. S’assurer que les deux systèmes de patte sont retirés de la patiente. 6. Vérifier la position de la bandelette et l’ajuster si nécessaire. 7. Effectuer les derniers ajustements et la mise en place finale de la bandelette conformément aux préférences du médecin. 8. Refermer l’incision antérieure. AVERTISSEMENT : Pour éviter une correction excessive du défaut, ne pas trop tendre la bandelette lors du positionnement. 1. Si le dispositif se rompt et qu’un fragment demeure dans la patiente, évaluer s’il peut être localisé et retiré sans endommager l’anatomie voisine. Veiller à ne pas perturber le site opératoire jusqu’à ce que le fragment soit localisé de manière à éviter de le perdre de vue. 2. Si le fragment est visible à l’œil nu, il devra être saisi à l’aide d’un porte-aiguille ou d’une pince adapté(e) et devra être renvoyé au fabricant accompagné du dispositif afin d’être étudié. 3. Si le fragment n’est pas visible à l’œil nu, des radiographies pourront être effectuées afin de le localiser. Utiliser une assistance radiologique pour guider la dissection et récupérer le fragment, afin de minimiser lésions des tissus avoisinants. RÉFÉRENCES • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. 27 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B ÉTAPES DE RETRAIT D’UN FRAGMENT DU DISPOSITIF GARANTIE Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Boston Scientific Corporation (BSC) garantit que cet instrument a été conçu et fabriqué avec un soin raisonnable. Cette garantie remplace et exclut toute autre garantie non expressément formulée dans le présent document, qu’elle soit explicite ou implicite en vertu de la loi ou de toute autre manière, y compris notamment toute garantie implicite de qualité marchande ou d’adaptation à un usage particulier. La manipulation, le stockage, le nettoyage et la stérilisation de cet instrument ainsi que les facteurs relatifs au patient, au diagnostic, au traitement, aux procédures chirurgicales et autres domaines hors du contrôle de BSC, affectent directement l’instrument et les résultats obtenus par son utilisation. Les obligations de BSC selon les termes de cette garantie sont limitées à la réparation ou au remplacement de cet instrument. BSC ne sera en aucun cas responsable des pertes, dommages ou frais accessoires ou indirects découlant de l’utilisation de cet instrument. BSC n’assume, ni n’autorise aucune tierce personne à assumer en son nom, aucune autre responsabilité ou obligation supplémentaire liée à cet instrument. BSC ne peut être tenu responsable en cas de réutilisation, de retraitement ou de restérilisation des instruments et n’assume aucune garantie, explicite ou implicite, y compris notamment toute garantie de qualité marchande ou d’adaptation à un usage particulier concernant ces instruments. 28 Black (K) ∆E ≤5.0 Inhaltsverzeichnis WARNHINWEIS................................................................................ 30 VERWENDUNGSZWECK/INDIKATIONEN..................................... 30 KONTRAINDIKATIONEN.................................................................. 30 BESCHREIBUNG DER VORRICHTUNG.......................................... 31 Warnhinweise/Mögliche Komplikationen..................... 31 VORSICHTSMASSNAHMEN........................................................... 32 UNERWÜNSCHTE EREIGNISSE..................................................... 33 LIEFERFORM...................................................................................... 34 BEDIENUNGSANLEITUNG.............................................................. 34 Schritte zur ANTERIOREN PLATZIERUNG DER STRÄNGE AM LIGAMENTUM SACROSPINALE.................... 34 Schritte zum Justieren des Netzgewebes und Entfernen der Strangeinheiten.................................... 36 SCHRITTE ZUM ENTFERNEN EINES VORRICHTUNGSFRAGMENTS.................................................. 36 LITERATURHINWEISE...................................................................... 36 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B GARANTIE.......................................................................................... 37 29 Black (K) ∆E ≤5.0 Uphold™ LITE with Capio™ SLIM Scheidenstützsystem ONLY Vorsicht: Laut Bundesgesetz der USA darf diese Vorrichtung ausschließlich an einen Arzt oder auf Anordnung eines Arztes verkauft werden, der im Umgang mit chirurgischem Netzgewebe zur transvaginalen Reparatur von Prolapsen von Beckenorganen geschult ist. Ärzte müssen in der minimalinvasiven Platzierung von chirurgischem Netzgewebe zur Behandlung von Störungen im Beckenbodenbereich und in der Handhabung von Komplikationen durch diese Verfahren geschult sein. Dieses Dokument sorgfältig durchlesen. Ein Nichtbefolgen dieser Anweisungen kann zu Fehlfunktionen und/oder zu Verletzungen der Patientin führen. Dieses Dokument ist kein Schulungshandbuch für transvaginale Chirurgie zur Korrektur von Prolapsen von Beckenorganen. Die leichten Netzgewebesysteme von Boston Scientific dürfen nur von Ärzten verwendet werden, die in der chirurgischen Korrektur dieser Symptomatik und in der Verwendung dieser Vorrichtung unterwiesen wurden. Die Sicherheit und Wirksamkeit des Scheidenstützsystems Uphold LITE im Vergleich zur konventionellen chirurgischen Reparatur von Prolapsen der Beckenorgane wurde nicht durch randomisierte, kontrollierte klinische Studien bestätigt. In den USA wurde die materielle Gleichwertigkeit des Scheidenstützsystems Uphold LITE zu synthetischem Netzgewebe durch Labortests bestätigt. WARNHINWEIS Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Der Inhalt wurde mit Ethylenoxid (EO) STERILISIERT. Bei beschädigtem sterilen Verpackungssiegel nicht verwenden. Im Falle von Beschädigungen Kontakt mit einem Vertreter von Boston Scientific aufnehmen. Für den einmaligen Gebrauch. Nicht wiederverwenden, wiederaufbereiten oder resterilisieren. Die Wiederverwendung, Wiederaufbereitung oder Resterilisation kann eine Beeinträchtigung der strukturellen Unversehrtheit der Vorrichtung und/oder ein Versagen der Vorrichtung zur Folge haben, was wiederum zu Erkrankungen, Verletzungen oder zum Tod des Patienten führen kann. Eine Wiederverwendung, Wiederaufbereitung oder Resterilisation der Vorrichtung erhöht ebenfalls das Kontaminationsrisiko bzw. das Risiko einer Infektion des Patienten oder einer Kreuzinfektion. Hierzu gehört u. a. die Übertragung von Infektionskrankheiten von Patient zu Patient. Eine Kontamination der Vorrichtung kann zu Verletzungen, Erkrankungen oder zum Tod des Patienten führen. Nach dem Gebrauch das Produkt und die Verpackung gemäß den Bestimmungen des Krankenhauses, administrativen und/oder örtlichen Regelungen entsorgen. VERWENDUNGSZWECK/INDIKATIONEN Das Scheidenstützsystem Uphold LITE ist bei Eingriffen zur Gewebeverstärkung bei Frauen mit einem Prolaps von Beckenorganen zur transvaginalen Reparatur eines Prolaps der anterioren und apikalen Scheidenwand vorgesehen. KONTRAINDIKATIONEN Der Einsatz des Scheidenstützsystems Uphold LITE ist bei allen Patientinnen kontraindiziert, bei denen Weichteilimplantate kontraindiziert sind. Dazu gehören auch Patientinnen mit folgenden Erkrankungen: • Pathologie der Weichteile, in denen das synthetische Uphold LITE Netzgewebe platziert werden soll. • Schwangere bzw. solche Patientinnen, die eine Schwangerschaft in Betracht ziehen. • Im Wachstum befindliche Patientinnen (z. B. Kleinkinder, Kinder). • Jede Erkrankung, einschließlich bekannter oder Verdacht auf Uteruspathologie, die die Platzierung des Implantats gefährden würde (z. B. anatomische Veränderungen oder Abnormalitäten). 30 Black (K) ∆E ≤5.0 • Jede Pathologie, die die Blutzufuhr einschränken und die Heilung gefährden würde (z. B. verringerte Blutzufuhr zu Organen aufgrund von Behandlungen wie Strahlen- oder Chemotherapie). • Patientinnen mit bekanntem oder vermutetem Vaginal-, Zervix- oder Uteruskrebs. • Blutgerinnungsstörungen. • Autoimmunerkrankungen des Bindegewebes. • Patientinnen mit Niereninsuffizienz und Obstruktionen der oberen Harnwege. • Vorliegende lokale oder systemische Infektion. Die Infektion muss mit den entsprechenden Antiseptika und/oder Antibiotika behandelt werden, um die Infektion zu beseitigen, bevor das synthetische Uphold™ LITE Netzgewebe eingesetzt wird. BESCHREIBUNG DER VORRICHTUNG Das Scheidenstützsystem Uphold LITE ist eine sterile Einwegvorrichtung für die transvaginale Platzierung, die aus einer (1) synthetischen Uphold LITE Netzgewebeeinheit und einem (1) Capio™ SLIM Nahtinstrument besteht. Die Netzgewebeeinheit ist ein leichtes gewobenes Netz aus ungefärbten und gefärbten Monofilament-Polypropylenfasern (phthalocyaninblau, Farbindexnummer 74160) mit 2 integrierten Strangeinheiten. Zu einer Strangeinheit gehören Nadelspitze, Faden, Dilatator, zwei Fadenschleifen und eine Schutzhülse. Die Nadelspitze am distalen Ende der Strangeinheit wird in den Nadelhalter am distalen Ende des Capio SLIM Nahtinstruments eingesetzt. Die Strangeinheit ist dazu vorgesehen, die Einführung des synthetischen Uphold LITE Netzgewebes durch Körpergewebe zur Platzierung durch das Ligamentum sacrospinale zu vereinfachen. Ein Dilatator ist gestreift, damit die beiden Strangeinheiten (links/rechts) unterschieden werden können. Abbildung 1: Konfiguration des Uphold LITE Netzgewebes Das Uphold LITE Netzgewebeimplantat ist für die Durchführung von Reparaturen eines Prolapses an der Scheidenwand über einen anterioren Ansatz zum SSL konfiguriert. Netzgewebestrang Abbildung 2: Netzgewebe-Strangeinheit Schutzhülse Dilatator 2 Fadenschleifen Faden Nadelspitze Abbildung 3: Capio SLIM Nahtinstrument Warnhinweise/Mögliche Komplikationen • Hysterektomie kann möglicherweise später erforderlich sein; die Verwendung des Netzgewebes kann künftige Hysterektomien durch Einwachsen des Gewebes und Vernarbung erschweren. • Die Zervikallänge muss während der voroperativen Abklärung bewertet werden. Patientinnen mit Zervikalverlängerung sind eventuell keine geeigneten Kandidatinnen für dieses Verfahren zur Reparatur eines Prolapses. Hysterektomie oder Zervixamputation muss bei Patientinnen mit Zervixverlängerung in Betracht gezogen werden, die sich dem Verfahren unterziehen möchten. • Eine fortlaufende Abklärung und Überwachung der Zervix- und Uteruserkrankung ist möglicherweise erforderlich. Regelmäßige Beckenuntersuchungen, Pap-Tests und Endometrialbiopsien sollten je nach medizinischer Indikation fortgeführt werden. 31 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Mittellinie • Die Durchführung apikaler Reparaturen bei Fällen mit Uterusvergrößerung und Vorhandensein von bösartigen Erkrankungen sollte nach Ermessen des Arztes erfolgen. Ein vergrößerter Uterus kann in einigen Fällen die Effektivität des Verfahrens gefährden. • Die Patientin muss angewiesen werden, bei Auftreten von Dysurie, Blutungen oder anderen Problemen unverzüglich den Arzt aufzusuchen. • Patientinnen müssen darüber informiert werden, dass sie nach dem Eingriff mindestens sechs (6) Wochen lang keine schweren Gegenstände heben, keinen Sport treiben und keinen Geschlechtsverkehr haben dürfen. Der Arzt muss bestimmen, wann die Patientin in der Lage ist, ihre normalen Aktivitäten wieder aufzunehmen. • Im Falle einer postprozeduralen Infektion muss das gesamte Netzgewebe entfernt oder anderweitig platziert werden. • Wie alle Fremdkörper kann das Netzgewebe bereits bestehende Infektionen oder Sepsis potenzieren. • Zu den möglichen Gewebereaktionen auf das Implantat gehören u. a.: lokale Reizungen der Wundstelle, Erosion oder Exposition durch die Vagina oder anderes umgebendes Gewebe, Migration der Vorrichtung von der vorgesehenen Stelle, Fistelbildung, Abstoßungsreaktionen und Entzündung. Das Auftreten dieser Reaktionen kann das Entfernen oder die Neuausrichtung des Netzgewebes erforderlich machen. • Netzgewebe ist ein permanentes Implantat. Die Entfernung des Netzgewebes oder Korrekturen von Komplikationen im Zusammenhang mit dem Netzgewebe erfordern u. U. mehrere chirurgische Eingriffe. • Eine vollständige Entfernung des Netzgewebes ist ggf. nicht möglich. Durch zusätzliche chirurgische Eingriffe werden Komplikationen nicht in jedem Fall vollständig behoben. • Bei unvollständiger Stützung kann leichte bis mittlere Inkontinenz auftreten. • Eine übermäßige Spannung kann zu temporärer oder permanenter Obstruktion und Retention der unteren Harnwege führen. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Zu den bekannten Risiken chirurgischer Verfahren zur Behandlung von Prolapsen gehören Schmerzen, Infektionen, Erosion/Exposition, Migration der Vorrichtung, vollständiges Fehlschlagen des Verfahrens mit der Folge von wiederholt auftretenden oder neuen Prolapsen und/ oder Inkontinenz. • Bei der Platzierung können Perforationen oder Lazerationen von Gefäßen, Nerven, Blase, Harnröhre und Eingeweiden auftreten, die u. U. eine chirurgische Reparatur erfordern. • Eine digitale Rektaluntersuchung sollte durchgeführt werden, um eine mögliche Perforation des Rektums zu erkennen. • Eine Zystoskopie sollte durchgeführt werden, um die Integrität der Blase zu bestätigen und eine mögliche Perforation von Blase bzw. Uterus zu erkennen. • Übergewichtige Frauen sind möglicherweise anfällig für intra- und postoperative Komplikationen (Gewichtsparameter müssen vom Arzt bestimmt werden). • Die Capio™ SLIM Vorrichtung während der Einführung nicht beugen, rotieren oder drehen. Andernfalls kann es zu Verletzungen kommen. VORSICHTSMASSNAHMEN • Chirurgische Eingriffe zur Behandlung von Prolapsen von Beckenorganen bei Frauen dürfen nur von Ärzten mit entsprechender Schulung und Erfahrung in der minimalinvasiven Platzierung von chirurgischem Netzgewebe zur Behandlung von Störungen im Beckenbodenbereich und in der Handhabung von Komplikationen im Zusammenhang mit diesen Verfahren durchgeführt werden. • Schulungen zur Verwendung des Scheidenstützsystems Uphold™ LITE werden empfohlen und werden von uns angeboten. Wenden Sie sich an Ihren Vertriebsmitarbeiter, um eine solche Schulung zu vereinbaren. • Dem Arzt wird empfohlen, bezüglich der mit den beabsichtigten Verfahren verbundenen Techniken, Komplikationen und Gefahren diese Gebrauchsanweisung und die entsprechende medizinische Literatur einzusehen. • Wie bei allen chirurgischen Eingriffen können bestimmte Risikofaktoren wie z. B. eine Beeinträchtigung der Blutgefäße (u. a. infolge von Diabetes, Rauchen, Östrogenstatus, Strahlenexposition des Beckenbodens), Alter, Myalgie des Beckenbodens, Beeinträchtigung der Wundheilung (u. a. infolge von Diabetes, Einnahme von Steroiden) oder aktive Infektionen an oder nahe der Eingriffsstelle das Patientenergebnis im Beckenbodenbereich 32 Black (K) ∆E ≤5.0 beeinflussen. Die o. g. Pathophysiologie muss bei der Entscheidung, ob die Patientin für eine transvaginale oder transabdominale Netzgewebeimplantation infrage kommt, unbedingt berücksichtigt werden. • Bei der Verwendung von Polypropylen-Netzgewebe bei urogynäkologischen Eingriffen wie z. B. zur chirurgischen Reparatur von Prolapsen der Beckenorgane (gleichgültig, ob transvaginal oder transabdominal) sind nachweislich Fälle von Erosion eingetreten. Erosion trat in Blase, Vagina, Urethra, Ureter und Darm auf. Die Behandlung der Erosion kann die chirurgische Entfernung des Implantats erforderlich machen. • Da sich die Anatomie von Patientin zu Patientin stark unterscheiden kann, ist es für jedes Verfahren wichtig, dass die gewünschten Ebenen für die Netzgewebe-Platzierung und die gewünschte Position der Strangplatzierung für jede einzelne Patientin geplant werden und bekannt sind. Die Anwendung von Bildgebungsmethoden vor und nach der Netzgewebe-Platzierung kann bei der korrekten Netzgewebe-Platzierung helfen und bestätigen, dass keine nicht anvisierten anatomischen Strukturen verletzt sind. • Bei der Ausführung von Beckenbodeneingriffen sowie bei der Versorgung von kontaminierten oder infizierten Wunden müssen chirurgische Standardpraktiken befolgt werden. • Das Verfahren muss sehr sorgfältig unter Einsatz des im Lieferumfang des Systems enthaltenen Capio™ SLIM Nahtinstruments durchgeführt werden, um das Risiko einer Perforation oder Lazeration von Gefäßen, Nerven, Blase, Harnröhre und Eingeweiden zu reduzieren. • Eine übermäßige Spannung des Netzgewebes bei der Handhabung und Platzierung ist zu vermeiden, um Beschädigungen vorzubeugen. • Die Kunststoff-Schutzhülle, die die Netzgewebestränge bedeckt, erst nach der richtigen Platzierung der Stränge entfernen. • Bei der Platzierung übermäßige Spannung am Netzgewebe vermeiden, um einer Hyperkorrektur des Defekts vorzubeugen. • Bei Blasenprolaps muss aufgrund der anatomischen Verformung mit besonderer Sorgfalt vorgegangen werden. • Ausschließlich Capio-Fäden Größe 0 mit dem Capio SLIM Nahtinstrument verwenden. • Das Netzgewebe nicht mit Klammern, Clips oder Klemmen befestigen, da dies zu mechanischen Schäden des Netzgewebes führen könnte. UNERWÜNSCHTE EREIGNISSE Zu den potenziellen unerwünschten Reaktionen, die aus Verfahren mit gynäkologischem chirurgischem Netzgewebe resultieren können, gehören u. a.: • Erosion/Extrusion/Exposition • Schmerzen, anhaltende Schmerzen, Unwohlsein, Reizung • Infektion/Sepsispotenzierung/Abszessbildung • Blutungen (Quetschung, Hämatom, Hämorrhagie, postoperative Blutungen) • Dyspareunie • Organperforation/Fistelbildung • Verletzung des Ureters • Ureterobstruktion • Harninkontinenz • Harnverhaltung • Fremdkörperreaktion • Neuromuskuläre Probleme • Vaginalverkürzung oder -stenose, Netzgewebe- und/oder Gewebekontraktur • Rezidivierender Prolaps • Allergie-, Überempfindlichkeits- oder andere Immunreaktion • Adhäsionsbildung • Gefäß-/Nervenverletzung/-perforation • Entzündung (akut oder chronisch) • Vaginaler Ausfluss • Dehiszenz und/oder Nekrose • Wunddehiszenz • Verstopfung/Defäkationsdysfunktion • Granulationsbildung • Reizung der Wundstelle, Erythem, Ödem 33 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Das Capio SLIM Nahtinstrument nicht biegen oder modifizieren, da dies zu einer mechanischen Beschädigung der Vorrichtung führen kann. Diese Ereignisse können einen chirurgischen Eingriff erfordern. In manchen Fällen kann die Reaktion auf das Ereignis auch nach dem Eingriff permanent bestehen bleiben. LIEFERFORM Das Scheidenstützsystem Uphold™ LITE wird steril geliefert und ist zum Gebrauch an einer einzigen Patientin bestimmt. Kühlen, trocken und vor Lichteinfall geschützt aufbewahren. Einwirkung organischer Lösungsmittel, ionisierender Strahlen oder ultravioletten Lichts vermeiden. Durch entsprechende Überwachung des Lagerbestands sicherstellen, dass die Produkte vor Ablauf des auf dem Verpackungsetikett angegebenen Verfallsdatums verwendet werden. Bei geöffneter oder beschädigter Verpackung nicht verwenden. Bei unvollständigem oder unleserlichem Etikett nicht verwenden. BEDIENUNGSANLEITUNG Vor der Verwendung 1. Das System sorgfältig überprüfen, um sicherzustellen, dass weder der Inhalt noch die sterile Verpackung während des Versands beschädigt wurden. Das Produkt NICHT VERWENDEN, wenn das sterile Verpackungssiegel beschädigt ist. Bei Beschädigungen das Produkt unverzüglich an Boston Scientific zurücksenden. 2. Die Patientin gemäß chirurgischer Standardpraxis vorbereiten und abdecken. VORSICHT: Dafür sorgen, dass die Blase leer ist, bevor dieses Produkt verwendet wird. Sicherstellen, dass Blase, Harnröhre und andere wichtige Orientierungspunkte richtig identifiziert worden sind, um Punktionen und/oder Lazerationen beim Eingriff zu vermeiden. Gebrauchsanweisung Das Scheidenstützsystem Uphold LITE ist so konzipiert, dass der Operateur das Uphold LITE Netzgewebe über einen transvaginalen Zugang einsetzen kann. Die folgenden Anweisungen gliedern sich in die folgenden Schritte zur Platzierung: • Schritte zur anterioren Platzierung der Stränge am Ligamentum sacrospinale • Schritte zum Justieren des Netzgewebes und Entfernen der Strangeinheiten Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Wenn die Vorrichtung während des Verfahrens bricht, die Anweisungen fragments“ im unter „Schritte zum Entfernen eines Vorrichtungs Anschluss an die Platzierungsschritte konsultieren. Schritte zur ANTERIOREN PLATZIERUNG DER STRÄNGE AM LIGAMENTUM SACROSPINALE 1. Die anteriore Scheidenwand in der Mittellinie mithilfe eines Satzes Allis-Klemmen fassen. 2. Für den anterioren Zugang eine für eine anteriore KolporrhaphieDissektionsebene typische 2-3 cm lange Inzision mit halber Tiefe anbringen. Dabei ca. 2 cm am Apex der Scheide unversehrt lassen, um ein Überlappen des Netzgewebes und des Fadens an der Inzision zu vermeiden. 3. Diese Ebene mit einer Schere spitz präparieren, bis die Rami inferior ossis pubis auf beiden Seiten fühlbar ist. Danach den Finger nach unten und zur Mitte bewegen, um die Seitenwand zu säubern, und einen glatten Tunnel beidseits zu den Spinae ischiadicae anlegen. 4. Danach das Ligamentum sacrospinale vorsichtig mithilfe des Zeigefingers medial von der Spina ischiadica freilegen. VORSICHT: Sicherstellen, dass das Ligamentum sacrospinale frei von Faser- oder Fettgewebe ist. 5. Die Nadelspitze der Strangeinheit in den Nadelhalter am distalen Ende des Capio™ SLIM Nahtinstruments einsetzen. Die Nadelspitze durch vorsichtiges Herunterziehen am Faden im Halter einrasten. Sicherstellen, dass der Ansatz der Nadelspitze vollständig in den Nadelhalter eingezogen ist. (Siehe Abb. 4.) 34 Black (K) ∆E ≤5.0 Abbildung 4: Einsetzen der Nadelspitze in den Capio™ SLIM Nadelhalter 6. Das Capio SLIM Nahtinstrument kann zur Platzierung unter digitalem Ertasten/direkter Sichtkontrolle direkt im Operationsgebiet positioniert werden. Die Vorrichtung mit der distalen Spitze an der Stelle, an der der Faden angebracht werden soll, am Ligamentum sacrospinale positionieren, wie in Abb. 5 gezeigt, und sicher festhalten. 7. Die Nadelspitze durch vollständiges Eindrücken des Knopfs durch das Ligamentum sacrospinale stechen (siehe Abb. 6), wobei die Nadelspitze vom Nadelfang des Capio SLIM Nahtinstruments erfasst wird. Hinweis: Zur Ertastung/Stabilisierung kann ein Finger gegen den Kopf der Capio SLIM Vorrichtung gehalten werden. 8. Den Führungsknopf freigeben und in die ausgefahrene Position zurückziehen, damit der Halter in das Gehäuse zurückgezogen wird. Den Faden wie in Abb. 7 dargestellt durch das Ligamentum sacrospinale ziehen. 9. Die Capio SLIM Vorrichtung wie in Abb. 8 gezeigt aus der Inzision herausziehen. Abbildung 7 und 8: Fassen und Herausziehen des Fadens 10. Die Nadelspitze aus dem Nadelfang entfernen. Hierzu den Nahtfaden festhalten und die Nadelspitze nach oben gegen den Griff zum Schlitz schieben. Hinweis: Den distalen Kopf des Capio SLIM Nahtinstruments zwischen der Platzierung der einzelnen Stränge während des Verfahrens an einer Patientin in eine Schale mit steriler Kochsalzlösung legen und gründlich spülen, um Blut und Verunreinigungen zu entfernen. Ist der Nadelfang aufgrund von Gewebe- und Blutkoagulation schwergängig, den Knopf ziehen, um den Nadelhalter einzufahren, und in steriler Kochsalzlösung spülen. Nach der Platzierung des Netzgewebes ist die Capio SLIM Vorrichtung gemäß den Krankenhausvorschriften zu entsorgen. 11. Schritte 5 bis 10 für den zweiten Strang des Ligamentum sacrospinale wiederholen. 35 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Abbildung 5 und 6: Platzieren und Durchziehen des Fadens durch das Gewebe 12. Zur temporären Platzierung vor der endgültigen Justierung können die Fäden extrakorporal gezogen werden. Schritte zum Justieren des Netzgewebes und Entfernen der Strangeinheiten 1. Das Netzgewebe durch Ziehen der Strangeinheiten nach außen justieren. Das Netzgewebe sollte oberhalb der Zervix oder des Scheidenendes zentriert sein. Wenn das Netzgewebe positioniert ist, kann es, sofern der Arzt dies wünscht, abgeschnitten und/oder zusätzlich fixiert werden. 2. Einen Strang der synthetischen Uphold™ LITE Netzgewebeeinheit greifen und die zwei sich außerhalb der Schutzhülse befindlichen Abschnitte der Fadenschleifen zerschneiden. Siehe Abb. 9. Abbildung 9: Entfernen der Strangeinheiten 3. Zum Entfernen vorsichtig an der Strangeinheit ziehen. Dabei muss das Netzgewebe an seinem Platz bleiben. Die Strangeinheit gemäß den Krankenhausvorschriften entsorgen. 4. Schritt 2 und 3 auf der kontralateralen Seite wiederholen. 5. Sicherstellen, dass beide Strangeinheiten aus der Patientin entfernt wurden. 6. Die Position des Netzgewebes prüfen und ggf. justieren. 7. Die Feinanpassung und endgültige Platzierung des Netzgewebes liegen im Ermessen des Arztes. 8. Die anteriore Inzision schließen. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B VORSICHT: Bei der Platzierung übermäßige Spannung am Netzgewebe vermeiden, um einer Hyperkorrektur des Defekts vorzubeugen. SCHRITTE ZUM ENTFERNEN EINES VORRICHTUNGSFRAGMENTS 1. Wenn die Vorrichtung bricht und sich ein Fragment in der Patientin befindet, muss beurteilt werden, ob es lokalisiert und entfernt werden kann, ohne die umliegende Anatomie zu beschädigen. Dabei darauf achten, dass der Operationssitus nicht gestört wird, bis das Fragment lokalisiert ist, um zu verhindern, dass es weiter aus dem Sichtbereich bewegt wird. 2. Wenn das Fragment direkt sichtbar ist, sollte es mit einer feinen Nadelführung oder Zange gegriffen und zusammen mit der Vorrichtung zur Untersuchung an den Hersteller geschickt werden. 3. Ist das Fragment nicht direkt sichtbar, Röntgenuntersuchungen verwenden, um die Position besser lokalisieren zu können. Radiologische Unterstützung sollte eingesetzt werden, um die Präparation zu führen und das Fragment zu entfernen, wodurch Verletzungen des umliegenden Gewebes minimiert werden. LITERATURHINWEISE • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. 36 Black (K) ∆E ≤5.0 GARANTIE Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Boston Scientific Corporation (BSC) garantiert, dass bei der Konstruktion und Herstellung dieses Instruments mit angemessener Sorgfalt vorgegangen wurde. Diese Garantie ersetzt alle anderen ausdrücklichen oder stillschweigenden gesetzlichen oder anderweitig implizierten Garantien, die hier nicht ausdrücklich erwähnt werden, und schließt diese aus, einschließlich, aber nicht beschränkt auf, jegliche implizierten Zusicherungen in Bezug auf marktgängige Qualität oder Eignung für einen bestimmten Zweck. Die Handhabung, Aufbewahrung, Reinigung und Sterilisation dieses Instruments sowie andere Faktoren, die sich auf den Patienten, die Diagnose, die Behandlung, chirurgische Verfahren und andere Umstände beziehen, die außerhalb der Kontrolle von BSC liegen, haben direkten Einfluss auf das Instrument und die Resultate aus seinem Einsatz. Die Verpflichtung von BSC im Rahmen dieser Garantie beschränkt sich auf die Reparatur oder den Ersatz des betreffenden Instruments; BSC ist nicht haftbar für beiläufige bzw. Folgeverluste, Schäden oder Kosten, die sich direkt oder indirekt aus der Verwendung dieses Instruments ergeben. BSC übernimmt keine weitere Haftung oder Verantwortung im Zusammenhang mit diesem Instrument und bevollmächtigt dazu auch keine anderen Personen. BSC übernimmt keine Haftung, weder ausdrücklich noch stillschweigend, für wiederverwendete, wiederaufbereitete oder resterilisierte Instrumente, einschließlich, aber nicht beschränkt auf, Garantien bezüglich ihrer marktgängigen Qualität oder ihrer Eignung für einen bestimmten Zweck. 37 Black (K) ∆E ≤5.0 Sommario AVVERTENZA..................................................................................... 39 USO PREVISTO/INDICAZIONI PER L’USO..................................... 39 CONTROINDICAZIONI...................................................................... 39 DESCRIZIONE DEL DISPOSITIVO................................................... 40 Avvertenze/Possibili complicanze..................................... 40 PRECAUZIONI.................................................................................... 41 EFFETTI INDESIDERATI.................................................................... 42 MODALITÀ DI FORNITURA.............................................................. 43 ISTRUZIONI PER IL FUNZIONAMENTO........................................ 43 Procedura di POSIZIONAMENTO anteriore DEI BRACCI PER IL LEGAMENTO SACROSPINALE...................... 43 Procedura di regolazione della rete e di rimozione dei bracci di posizionamento.................. 44 PROCEDURA DI RIMOZIONE DI UN FRAMMENTO DI DISPOSITIVO............................................................................... 45 BIBLIOGRAFIA................................................................................... 45 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B GARANZIA......................................................................................... 45 38 Black (K) ∆E ≤5.0 U Uphold™ LITE with Capio™ SLIM Sistema di supporto vaginale ONLY Attenzione: la legge federale degli Stati Uniti autorizza la vendita di questo prodotto esclusivamente su prescrizione di un medico addestrato all'uso delle rete chirurgica per la riparazione transvaginale del prolasso degli organi pelvici. I medici devono essere addestrati nel posizionamento con tecniche minimamente invasive di dispositivi di rete chirurgica per il trattamento delle patologie del pavimento pelvico e nella gestione delle complicanze derivanti da tali procedure. Leggere questo documento con attenzione. La mancata osservanza delle istruzioni potrebbe determinare un guasto e/o provocare lesioni alla paziente. Il presente documento non è un manuale di addestramento sulla chirurgia transvaginale per la correzione del prolasso degli organi pelvici. I sistemi di rete leggera di Boston Scientific devono essere utilizzati esclusivamente da medici esperti nella correzione chirurgica di questa patologia e nell'uso di questo dispositivo. La sicurezza e l’efficacia del sistema di supporto vaginale Uphold LITE rispetto alla riparazione chirurgica convenzionale per il prolasso degli organi pelvici non sono state dimostrate mediante sperimentazioni cliniche controllate randomizzate. Prove al banco condotte negli Stati Uniti hanno dimostrato l’equivalenza sostanziale tra il sistema di supporto vaginale Uphold LITE e la rete sintetica. AVVERTENZA Esclusivamente monouso. Non riutilizzare, ritrattare o risterilizzare. Tali processi potrebbero compromettere l’integrità strutturale del dispositivo e/o provocarne il guasto, con conseguente rischio di lesioni, malattia o morte del paziente. Potrebbero inoltre creare rischi di contaminazione del dispositivo e/o causare infezioni del paziente o infezioni crociate, inclusa, in modo non limitativo, la trasmissione di malattie infettive da un paziente all’altro. La contaminazione del dispositivo può inoltre provocare lesioni, malattia o la morte del paziente. Dopo l’uso, eliminare il prodotto e la confezione in conformità ai protocolli ospedalieri, alle normative amministrative e/o alle leggi locali vigenti. USO PREVISTO/INDICAZIONI PER L’USO Il sistema di supporto vaginale Uphold LITE è indicato per rinforzare i tessuti nelle donne affette da prolasso degli organi pelvici e per la riparazione transvaginale del prolasso della parete vaginale anteriore e apicale. CONTROINDICAZIONI Il sistema di supporto vaginale Uphold LITE è controindicato in pazienti per le quali non sono indicati gli impianti nei tessuti molli. È controindicato anche nei seguenti casi: • patologia del tessuto molle in cui la rete sintetica Uphold LITE deve essere posizionata; • pazienti in stato di gravidanza o che progettino future gravidanze; • pazienti in fase di crescita (es. neonate, bambine); • qualsiasi patologia, incluse patologie uterine note o sospette, che potrebbe compromettere il posizionamento (per es. distorsioni o anomalie anatomiche); • qualsiasi patologia che limiterebbe l’apporto di sangue e comprometterebbe la cicatrizzazione (per es. apporto di sangue ridotto agli organi a causa di precedenti trattamenti quali radioterapia o chemioterapia); • presenza accertata o sospetta di cancro alla vagina, alla cervice o all’utero; • problemi di coagulazione del sangue; 39 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Il contenuto è STERILIZZATO mediante ossido di etilene (EO). Non utilizzare se la barriera sterile è stata compromessa. In caso si rilevino danni, rivolgersi al rappresentante Boston Scientific. • patologia del tessuto connettivo di tipo autoimmune; • insufficienza renale e ostruzione del tratto urinario superiore; • infezioni locali o sistemiche pregresse. Prima di impiantare la rete sintetica Uphold™ LITE, trattare le eventuali infezioni con adeguati prodotti antisettici e/o antibiotici per eliminarle. DESCRIZIONE DEL DISPOSITIVO Il sistema di supporto vaginale Uphold LITE è un dispositivo sterile monouso per posizionamento transvaginale e comprende un (1) gruppo rete sintetica Uphold LITE e un (1) dispositivo per suture Capio™ SLIM. Il gruppo rete è costituito da una rete leggera a maglie in fibra monofilamento di polipropilene non tinta e tinta (blu ftalocianino, numero indice colore 74160) con 2 bracci di posizionamento integrati. I gruppi dei bracci di posizionamento comprendono una freccia, un filo di incanalamento, un dilatatore, due cappi di incanalamento e un manicotto di protezione. La freccia sull’estremità distale del gruppo braccio di posizionamento è progettata per essere posizionata nell’apposito supporto sull’estremità distale del dispositivo per suture Capio SLIM. Il gruppo braccio di posizionamento è stato progettato per facilitare il passaggio del gruppo rete sintetica Uphold LITE attraverso i tessuti corporei per il posizionamento nel legamento sacrospinale. Un dilatatore è rigato per distinguere i bracci di posizionamento sinistro e destro. Figura 1 - Configurazione della rete Uphold LITE L’impianto della rete Uphold LITE è configurato per la riparazione del prolasso della parete vaginale mediante approccio anteriore al legamento sacrospinale. Linea centrale Braccio di posizionamento della rete Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Figura 2 - Gruppo del braccio di posizionamento della rete Manicotto di protezione 2 cappi di incanalamento Filo di Dilatatore incanalamento Freccia Figura 3 - Dispositivo per suture Capio SLIM Avvertenze/Possibili complicanze • In futuro potrebbe rendersi necessaria un’isterectomia. L’uso della rete potrebbe rendere più difficili future isterectomie a causa della crescita interna e della cicatrizzazione del tessuto. • Durante la preparazione all’intervento è necessario valutare la lunghezza della cervice. Le pazienti che presentino un allungamento della cervice potrebbero non essere idonee a questa procedura di riparazione di prolassi. L’isterectomia o l’amputazione della cervice possono essere prese in considerazione per le pazienti che presentano un allungamento della cervice e che scelgono di sottoporsi alla procedura. • Potrebbe essere necessario ricorrere a screening e monitoraggio continuativi per rilevare eventuali patologie della cervice e dell’utero. L’esame regolare della pelvi, il Pap test e biopsie endometriali a scadenze regolari devono essere eseguiti in modo continuativo e a seconda delle indicazioni mediche. • La riparazione apicale in casi che presentano l’allargamento dell’utero in presenza di una patologia benigna deve essere eseguita a discrezione del medico. In alcuni casi un utero allargato può compromettere l’efficacia della procedura. 40 Black (K) ∆E ≤5.0 • Informare la paziente che in caso di disuria, emorragia o altri problemi dovrà contattare immediatamente il medico. • Informare la paziente che dovrà astenersi dal sollevare pesi, svolgere attività fisiche e avere rapporti sessuali per almeno sei (6) settimane dopo la procedura. Il medico dovrà stabilire quando la paziente potrà riprendere le normali attività. • Qualora dopo la procedura si manifestasse un’infezione, l’intera rete dovrà essere rimossa o riesaminata. • Come tutti i corpi estranei, la rete potrebbe potenziare un’infezione o una sepsi già esistente. • Le risposte tissutali all’impianto possono includere: irritazione locale in corrispondenza del sito dell’incisione chirurgica, erosione o esposizione vaginale o attraverso altro tessuto circostante, migrazione del dispositivo dalla posizione desiderata, formazione di fistola, reazione da corpo estraneo e infiammazione. Il manifestarsi di tali risposte può richiedere la rimozione o la revisione della rete. • La rete è considerata un impianto permanente. La rimozione della rete o la correzione di complicazioni correlate alla rete potrebbe comportare interventi chirurgici ripetuti. • La rimozione completa della rete potrebbe non essere possibile e gli interventi chirurgici aggiuntivi potrebbero non correggere completamente le complicazioni insorte. • È possibile che si verifichi incontinenza da lieve a moderata a causa di supporto non completo. • Una tensione eccessiva può provocare ostruzione o ritenzione temporanee o permanenti del tratto urinario inferiore. • I rischi noti delle procedure chirurgiche per il trattamento del prolasso comprendono: dolore, infezione, erosione/esposizione, migrazione del dispositivo, insuccesso totale della procedura con conseguente prolasso ricorrente o nuovo e/o incontinenza. • Durante la procedura di posizionamento possono verificarsi perforazioni o lacerazioni di vasi, nervi, vescica, uretra o intestino, che richiederanno una riparazione chirurgica. • Per il rilevamento di un’eventuale perforazione rettale procedere a esplorazione rettale. • Si consiglia di eseguire una cistoscopia per verificare l’integrità della vescica o rilevare una possibile perforazione vescicale o ureterale. • Non girare, ruotare o torcere il dispositivo Capio™ SLIM durante l’azionamento. Tali azioni possono causare lesioni. PRECAUZIONI • Il trattamento chirurgico del prolasso degli organi pelvici femminili deve essere eseguito da medici addestrati ed esperti nel posizionamento con tecniche minimamente invasive di dispositivi di rete chirurgica per il trattamento delle patologie del pavimento pelvico e nella gestione delle complicanze derivanti da tali procedure. • È disponibile e consigliato un corso di formazione sull’uso del sistema di supporto vaginale Uphold™ LITE. Contattare il rappresentante di vendita per concordare l’intervento formativo. • Si consiglia di consultare le presenti istruzioni per l’uso e la letteratura medica concernente le tecniche, le complicanze e i rischi associati alle procedure previste. • Come in tutti gli interventi chirurgici, sussistono alcuni fattori di rischio in grado di influire sui risultati per la paziente nel pavimento pelvico. Tali fattori di rischio comprendono, in modo non esaustivo: compromissione della vascolarità (ad es. diabete, paziente fumatrice, stato dell’estrogeno, esposizione del pavimento pelvico a radiazioni, ecc.), età, mialgia del pavimento pelvico, cicatrizzazione compromessa delle ferite (ad es. diabete, uso di steroidi, ecc.) oppure presenza di infezione in corso nel o presso il sito chirurgico. Le condizioni patologiche e fisiologiche riportate sopra vanno prese in considerazione in fase di valutazione dell’idoneità della paziente per l’impianto di rete, sia con accesso transvaginale che transaddominale. • L’uso di una rete in polipropilene nelle procedure uroginecologiche, come nel trattamento del prolasso degli organi pelvici, indipendentemente del metodo di inserimento prescelto (transvaginale o transaddominale), è stato associato a casi di erosione. L’erosione è stata riscontrata in vescica, vagina, uretra, uretere e intestino. Il trattamento dell’erosione potrebbe richiedere la rimozione chirurgica. 41 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Le donne in sovrappeso possono presentare più facilmente complicanze intra- e post-operatorie (i parametri di peso devono essere stabiliti dal medico). • L’anatomia delle singole pazienti può variare in misura considerevole: per ciascuna procedura è importante che i piani previsti per il posizionamento della rete e la posizione prevista per il posizionamento dei bracci siano programmati e noti per ciascuna paziente. L’utilizzo di metodi di imaging prima e dopo il posizionamento della rete può contribuire a stabilire il corretto posizionamento della rete e a confermare l’assenza di lesioni a strutture anatomiche non interessate. • Per le procedure relative al pavimento pelvico e per il trattamento di ferite contaminate o infette attenersi alle pratiche chirurgiche standard. • Eseguire la procedura con la massima attenzione e utilizzare il dispositivo per suture Capio™ SLIM, fornito con il sistema, per ridurre il rischio di perforazione o lacerazione di vasi, nervi, vescica, uretra o intestino. • Non tendere eccessivamente la rete durante la manipolazione e il posizionamento per non danneggiare il dispositivo. • Non rimuovere il manicotto di plastica protettivo che copre i bracci di posizionamento della rete prima di avere confermato il corretto posizionamento. • Non applicare una tensione eccessiva sulla rete durante il posizionamento per evitare di correggere eccessivamente il difetto. • In caso di prolasso vescicale prestare particolare attenzione a causa della deformità anatomica. • Utilizzare solo suture Capio di dimensione 0 con il dispositivo per suture Capio SLIM. • Non fissare la rete con graffette, clip o pinze, in quanto può derivarne un danno meccanico alla rete. • Non piegare o alterare il dispositivo per suture Capio SLIM per non provocare danni di natura meccanica al dispositivo. EFFETTI INDESIDERATI Fra gli eventuali effetti indesiderati associati all’uso della rete chirurgica in ginecologia: • Erosione/estrusione/esposizione; • Dolore, dolore prolungato, fastidio, irritazione; • infezione/potenziamento della sepsi/formazione di ascessi; • sanguinamento (ecchimosi, ematoma, emorragia, sanguinamento post-operatorio); • dispareunia; Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • perforazione di organi/formazione di fistole; • lesione all’uretere; • ostruzione dell’uretere; • incontinenza urinaria; • ritenzione urinaria; • ritenzione di corpo estraneo (reazione da corpo estraneo); • problemi neuromuscolari; • accorciamento o stenosi vaginale, contrattura della rete e/o del tessuto; • prolasso ricorrente; • reazione allergica, ipersensibilità o altra reazione immunitaria; • formazione di aderenze; • lesione/perforazione di vasi/nervi; • infiammazione (acuta o cronica); • secrezione vaginale; • deiscenza e/o necrosi; • deiscenza del sito di incisione; • costipazione/disturbi della defecazione; • formazione di tessuto di granulazione; • irritazione, eritema, edema in corrispondenza del sito d’incisione. Il verificarsi di tali effetti potrebbe richiedere l’intervento chirurgico. In alcuni casi la risposta a tali effetti indesiderati potrebbe persistere e trasformarsi in condizione permanente dopo l’intervento. 42 Black (K) ∆E ≤5.0 MODALITÀ DI FORNITURA Il sistema di supporto vaginale Uphold™ LITE è fornito sterile ed è inteso esclusivamente per l’uso su una sola paziente. Conservare in un luogo fresco e asciutto e al riparo dalla luce. Non esporre a solventi organici, radiazione ionizzante o luce ultravioletta. Sottoporre a rotazione l’inventario, in modo da utilizzare i prodotti prima della data di scadenza riportata sull’etichetta della confezione. Non usare il prodotto se la confezione è danneggiata o aperta. Non usare il prodotto se le etichette sono incomplete o illeggibili. ISTRUZIONI PER IL FUNZIONAMENTO Prima dell’uso 1. Ispezionare attentamente il sistema per verificare che né il contenuto né la confezione sterile siano stati danneggiati durante il trasporto. NON UTILIZZARE se la barriera sterile del prodotto è stata compromessa. Restituire immediatamente il prodotto danneggiato a Boston Scientific. 2. Preparare la paziente e avvolgerla nel telo sterile in conformità alle procedure chirurgiche standard. ATTENZIONE: prima di utilizzare il prodotto verificare che la vescica sia vuota. Accertarsi che la vescica, l’uretra e altri punti di riferimento importanti siano correttamente identificati per evitare perforazioni e/o lacerazioni durante la procedura. Istruzioni per l’uso La configurazione del sistema di supporto vaginale Uphold LITE consente un approccio transvaginale per il posizionamento del gruppo rete Uphold LITE. Le istruzioni che seguono sono suddivise nelle seguenti procedure di impianto: • Procedura di posizionamento anteriore dei bracci di posizionamento per il legamento sacrospinale • Procedura di regolazione della rete e di rimozione dei bracci di posizionamento In caso di rottura del dispositivo nel corso della procedura, fare riferimento alla Procedura di rimozione di un frammento di dispositivo, riportata dopo le procedure di posizionamento. 1. Fissare una serie di pinze di Allis alla linea centrale della parete vaginale anteriore. 2. Per approccio anteriore, praticare un’incisione di spessore medio di 2-3 cm tipica di un piano di dissezione per colporrafia anteriore, lasciando intatti circa 2 cm presso l’apice vaginale per evitare la sovrapposizione della rete e della linea di sutura presso l’incisione. 3. Definire in maniera netta questo piano con un paio di forbici fino a poter palpare i rami pubici discendenti su ciascun lato. Una volta ottenuto l’accesso, pulire la parete laterale con movimento delle dita verso il basso e il centro, quindi creare un tunnel liscio verso le spine ischiatiche su entrambi i lati. 4. Esporre con cautela i legamenti sacrospinali con un movimento mediale del dito indice dalla spina ischiatica. ATTENZIONE: verificare che il legamento sacrospinale sia privo di tessuto fibroso o adiposo. 5. Caricare la freccia del braccio di posizionamento nell’apposito supporto sull’estremità distale del dispositivo per suture Capio™ SLIM. Inserire la freccia nel supporto tirando delicatamente il filo di incanalamento verso il basso. Accertarsi che il bordo della freccia sia inserito completamente nel supporto (fare riferimento a FIG. 4). Figura 4 - Caricamento della freccia nel supporto Capio SLIM 43 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Procedura di POSIZIONAMENTO anteriore DEI BRACCI PER IL LEGAMENTO SACROSPINALE 6. Il dispositivo per suture Capio™ SLIM può essere posizionato direttamente nel campo chirurgico per il posizionamento del filo di incanalamento tramite palpazione digitale/controllo visivo diretto. Posizionare il dispositivo con la punta distale nella posizione di interesse contro il legamento sacrospinale in cui deve essere inserito il filo di incanalamento, come mostrato in FIG. 5, e tenerlo saldamente in posizione. 7. Come mostrato in FIG. 6, premere il pulsante fino a fine corsa per guidare la freccia attraverso il legamento sacrospinale e quindi nella presa del dispositivo per suture Capio SLIM. Nota: è possibile applicare un dito sulla testina del dispositivo Capio SLIM per effettuare la palpazione diretta/stabilizzazione. Figure 5 e 6 - Posizionamento e inserimento del filo di incanalamento nel tessuto 8. Rilasciare e tirare indietro il pulsante guida per consentire al supporto di rientrare nel suo alloggiamento. Tirare il filo di incanalamento attraverso il legamento sacrospinale come mostrato in FIG. 7. 9. Retrarre il dispositivo Capio SLIM dall’incisione come mostrato nella FIG 8. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Figure 7 e 8 - Cattura e recupero del filo di incanalamento 10. Rimuovere la freccia dalla presa tenendo in mano il filo di incanalamento e facendo scorrere la freccia in alto verso l’impugnatura fino alla fessura principale. Nota: fra il posizionamento di un braccio di posizionamento e l’altro durante una singola procedura immergere la testina distale del dispositivo per suture Capio SLIM in una bacinella con soluzione fisiologica sterile e sciacquare accuratamente per rimuovere sangue e residui. Se la presa è ostacolata da tessuto o coaguli di sangue, tirare il pulsante per retrarre il supporto e risciacquare in soluzione fisiologica sterile. Dopo il posizionamento del gruppo rete, smaltire il dispositivo Capio SLIM in conformità alle procedure ospedaliere. 11. Ripetere le fasi da 5 a 10 per l’altro braccio di posizionamento per il legamento sacrospinale. 12. I fili di incanalamento possono essere retratti in zona extracorporea per il posizionamento temporaneo prima della regolazione finale. Procedura di regolazione della rete e di rimozione dei bracci di posizionamento 1. Regolare il posizionamento della rete tirando i bracci di posizionamento verso l’esterno. La rete deve essere centrata sopra la cervice o il moncone vaginale. Una volta posizionata, la rete può essere tagliata e/o ulteriormente fissata in posizione, a discrezione del medico. 44 Black (K) ∆E ≤5.0 2. Afferrare uno dei bracci di posizionamento del gruppo rete sintetica Uphold™ LITE e tagliare le sezioni dei due cappi del filo di incanalamento che sporgono dal manicotto di protezione. Fare riferimento a FIG. 9. Figura 9 - Rimozione dei bracci di posizionamento 3. Tirare delicatamente il braccio di posizionamento per rimuoverlo, lasciando in sede solo la rete. Smaltire il braccio di posizionamento in conformità alle procedure ospedaliere. 4. Ripetere le fasi 2 e 3 sul lato controlaterale. 5. Accertarsi di rimuovere dalla paziente entrambi i bracci di posizionamento. 6. Controllare la posizione della rete e regolarla secondo necessità. 7. Completare le regolazioni finali e il posizionamento della rete in base alle preferenze del medico. 8. Chiudere l’incisione anteriore. ATTENZIONE: non applicare una tensione eccessiva sulla rete durante il posizionamento, per evitare di correggere eccessivamente il difetto. PROCEDURA DI RIMOZIONE DI UN FRAMMENTO DI DISPOSITIVO 1. Nel caso in cui il dispositivo si rompa e un frammento rimanga nella paziente, determinare se è possibile individuarlo e rimuoverlo senza danni all’anatomia circostante. Fare attenzione a non interferire sul sito d’intervento finché non si individua il frammento per evitare di allontanarlo ulteriormente dal campo visivo. 3. Se il frammento non è visibile direttamente, l’uso dei raggi X può aiutare a individuarne la posizione. Servirsi di assistenza radiologica per guidare la dissezione e recuperare il frammento, in modo da ridurre al minimo i danni ai tessuti circostanti. BIBLIOGRAFIA • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. GARANZIA Boston Scientific Corporation (BSC) garantisce che questo strumento è stato progettato e costruito con cura ragionevole. La presente garanzia sostituisce ed esclude tutte le altre garanzie non espressamente stabilite nella presente, siano esse esplicite o implicite ai sensi di legge o altrimenti, compresa, in modo non esclusivo, qualsiasi garanzia implicita di commerciabilità o idoneità a uno scopo particolare. Le condizioni di trattamento, conservazione, pulizia e sterilizzazione di questo strumento, nonché altri fattori relativi al paziente, alla diagnosi, al trattamento, agli interventi chirurgici e altri elementi al di là del controllo di BSC, influiscono direttamente sullo strumento stesso e sui risultati del suo impiego. L’obbligo di BSC in base alla presente garanzia è limitato alla riparazione o sostituzione di questo strumento. BSC non potrà essere ritenuta responsabile di perdite, spese o danni diretti o indiretti, derivanti direttamente o indirettamente dall’uso di questo strumento. BSC non si assume, né autorizza alcuno ad assumersi a suo nome, alcun altro tipo di obbligo o responsabilità in relazione a questo strumento. BSC non si assume alcuna responsabilità per strumenti riutilizzati, ritrattati o risterilizzati e non offre alcuna garanzia, né implicita né esplicita, inclusa, in modo non limitativo, ogni garanzia di commerciabilità o di idoneità a scopo particolare, per tali strumenti. 45 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 2. Se il frammento è visibile direttamente, afferrarlo con un guida ago sottile o delle pinze e restituire al produttore insieme al dispositivo, a fini di indagine. Inhoudsopgave WAARSCHUWING............................................................................ 47 BEOOGD GEBRUIK/INDICATIES VOOR GEBRUIK........................ 47 CONTRA-INDICATIES....................................................................... 47 BESCHRIJVING VAN HULPMIDDEL.............................................. 48 Waarschuwingen/mogelijke complicaties................... 48 VOORZORGSMAATREGELEN.......................................................... 49 COMPLICATIES................................................................................. 50 LEVERING........................................................................................... 50 BEDIENINGSINSTRUCTIES............................................................. 51 Stappen voor anterieure plaatsing van de poten voor het sacrospinale ligament.................... 51 Stappen voor aanpassing van net en verwijdering van pootconstructies......................... 52 Stappen voor het verwijderen van hulpmiddelfragmenten.................................................... 53 LITERATUUR...................................................................................... 53 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B GARANTIE.......................................................................................... 54 46 Black (K) ∆E ≤5.0 U Uphold™ LITE with Capio™ SLIM Vaginaal-steunsysteem ONLY Let op: De Amerikaanse federale wetgeving bepaalt dat dit hulpmiddel slechts kan worden gekocht door of namens een arts die is opgeleid in het gebruik van chirurgisch net voor de transvaginale reparatie van bekkenorgaanprolaps. Artsen dienen te zijn opgeleid in het minimaal invasief plaatsen van chirurgisch netmateriaal voor de behandeling van aandoeningen van de bekkenbodem en in het behandelen van complicaties ten gevolge van ingrepen. Lees dit document zorgvuldig door. Als u de instructies niet opvolgt, kan dit leiden tot defecten en/of tot letsel bij de patiënt. Dit document is geen trainingshandleiding voor transvaginale chirurgie ter correctie van prolaps van bekkenorganen. De lichtgewicht netsystemen van Boston Scientific mogen uitsluitend worden gebruikt door artsen die zijn onderwezen in de chirurgische correctie van deze aandoening en in het gebruik van dit hulpmiddel. De veiligheid en effectiviteit van het Uphold LITE vaginale-steunsysteem in vergelijking met conventioneel chirurgisch herstel van prolaps van het bekkenorgaan zijn niet bewezen in gerandomiseerde klinische onderzoeken met controlegroepen. In de Verenigde Staten is door middel van simulatieproeven bewezen dat het Uphold LITE vaginalesteunsysteem in essentie gelijkwaardig is aan een synthetisch net. WAARSCHUWING Uitsluitend bestemd voor eenmalig gebruik. Niet opnieuw gebruiken, verwerken of steriliseren. Opnieuw gebruiken, verwerken of steriliseren kan de structurele integriteit van het hulpmiddel aantasten en/of het defect raken van het hulpmiddel tot gevolg hebben, hetgeen kan resulteren in letsel, ziekte of de dood van de patiënt. Opnieuw gebruiken, verwerken of steriliseren brengt tevens het gevaar van verontreiniging van het hulpmiddel met zich mee en/of kan infectie of kruisinfectie van de patiënt veroorzaken, met inbegrip van, maar niet beperkt tot, overdracht van (een) besmettelijke ziekte(s) tussen patiënten. Verontreiniging van het hulpmiddel kan letsel, ziekte of de dood van de patiënt veroorzaken. Werp dit product en het verpakkingsmateriaal na gebruik weg volgens het hiervoor geldende beleid van de instelling en de overheid. BEOOGD GEBRUIK/INDICATIES VOOR GEBRUIK Het Uphold LITE vaginale-steunsysteem is geïndiceerd voor weefselversterking bij vrouwen met bekkenorgaanprolaps, voor de transvaginale reparatie van prolaps van de anterieure en apicale vaginakoepel. CONTRA-INDICATIES Er bestaat een contra-indicatie voor het gebruik van het Uphold LITE vaginale-steunsysteem bij patiënten met een contra-indicatie voor zachtweefselimplantaten. Overige contra-indicaties omvatten: • Aandoeningen van de weke delen waarin het Uphold LITE synthetisch net moet worden geplaatst. • Zwangerschap, of het voornemen zwanger te worden. • De mogelijkheid van toekomstige groei (zoals baby’s en kinderen). • Aandoeningen, waaronder een vermoede of bekende pathologie van de baarmoeder, waardoor het plaatsen van het implantaat niet mogelijk is (bijv. anatomische vervorming of afwijkingen). • Aandoeningen die de bloedtoevoer zouden beperken en de genezing zouden belemmeren (bijv. verminderde bloedtoevoer naar organen vanwege een behandeling zoals bestraling, chemotherapie). 47 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B De inhoud is gesteriliseerd volgens een ethyleenoxide(EO)-proces en wordt STERIEL geleverd. Niet gebruiken indien de steriele barrière is beschadigd. Neem contact op met uw Boston Scientificvertegenwoordiger als er schade wordt aangetroffen. • Aanwezigheid, of vermoeden, van kanker van de vagina, cervix of uterus. • Bloedstollingsstoornis. • Auto-immuunziekte van het bindweefsel. • Renale insufficiëntie of een verstopping van de bovenste urinewegen. • Bestaande lokale of systemische infecties. Behandel de infectie met het juiste antisepticum en/of antibiotica om de infectie te verwijderen voordat het Uphold™ LITE synthetisch net wordt gebruikt. BESCHRIJVING VAN HULPMIDDEL Het Uphold LITE vaginale-steunsysteem is een steriel hulpmiddel voor eenmalig gebruik voor transvaginale plaatsing en bestaat uit (1) één Uphold LITE synthetisch-netconstructie en (1) één Capio™ SLIMhechtdraadgrijper. De netconstructie bestaat uit een lichtgewicht gebreid net van ongeverfde en geverfde monofilamentvezel van polypropyleen (ftalocyanineblauw, kleurindexnummer 74160) met 2 geïntegreerde pootconstructies. De pootconstructies omvatten een pijlpunt, geleidingsdraad, dilatator, twee leidlussen en een beschermkoker. De pijlpunt aan het distale uiteinde van de pootconstructie is bedoeld voor plaatsing in de houder aan het distale uiteinde van de Capio SLIMhechtdraadgrijper. De pootconstructie is bedoeld ter vereenvoudiging van het inbrengen van de Uphold LITE synthetisch-netconstructie door lichaamsweefsels voor plaatsing door het sacrospinale ligament. Een van de dilatatoren is gestreept om de pootconstructies te kunnen onderscheiden (links/rechts). Afbeelding 1 De configuratie van het Uphold LITE-net Het Uphold LITE-netimplantaat is geconfigureerd voor herstel van prolaps van de vaginawand met behulp van een anterieure benadering van het sacrospinaal ligament. Middenlijn Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Poot van het net Afbeelding 2 De pootconstructie van het net Beschermkoker Dilatator 2 leidlussen Geleidingsdraad Pijlpunt Afbeelding 3 De Capio SLIM-hechtdraadgrijper Waarschuwingen/mogelijke complicaties • Mogelijk is in de toekomst hysterectomie noodzakelijk; door gebruik van het net kan hysterectomie in de toekomst worden bemoeilijkt door ingroei van weefsel en littekenweefsel. • De lengte van de cervix moet tijdens de preoperatieve voorbereidingen worden vastgesteld. Patiënten met een verlengde cervix zullen soms niet in aanmerking komen voor deze ingreep voor verzakkingsreparatie. Bij patiënten met een verlengde cervix die deze ingreep wensen te ondergaan, kan hysterectomie of cervixamputatie worden overwogen. • Voortdurende screening en controle op cervix- en uterusaandoeningen kan vereist zijn. Blijf regelmatige bekkenonderzoeken verrichten, uitstrijkjes nemen en biopsie verrichten volgens de medische indicaties. • Een ingreep voor apicaal herstel in gevallen waarbij sprake is van een vergrote uterus, veroorzaakt door een goedaardige aandoening, staat ter beoordeling van de arts. Een vergrote uterus kan de werkzaamheid van de ingreep in sommige gevallen verminderen. 48 Black (K) ∆E ≤5.0 • De patiënt dient te worden geïnstrueerd dat deze onmiddellijk de arts moet raadplegen wanneer zich pijn bij het urineren, bloedingen of andere problemen voordoen. • Patiënten dient te worden verteld dat ze zich minimaal zes (6) weken volgend op de ingreep dienen te onthouden van zwaar tilwerk, sport en geslachtsgemeenschap. De arts dient voor elke patiënt afzonderlijk vast te stellen wanneer de gewone activiteiten kunnen worden hervat. • Als er na de ingreep een infectie optreedt, moet mogelijk het gehele net worden verwijderd of gewijzigd. • Zoals alle vreemde lichamen kan het net een reactie op een bestaande infectie of sepsis verergeren. • Weefsel kan als volgt reageren op het implantaat: plaatselijke irritatie op de plaats van de wond, erosie of blootstelling door de vagina of ander aangrenzend weefsel, verplaatsing van het hulpmiddel van de gewenste plek af, fistelvorming, reactie op het vreemde lichaam en ontsteking. Indien een dergelijke reactie optreedt, kan het zijn dat het net moet worden verwijderd of gewijzigd. • Het net is een permanent implantaat. Verwijderen van het net of verhelpen van aan het net gerelateerde complicaties kan meerdere ingrepen vereisen. • Het kan voorkomen dat een volledige verwijdering van het net onmogelijk is en aanvullende ingrepen verhelpen de complicaties mogelijk niet in alle gevallen. • Milde tot matige incontinentie kan zich voordoen wegens onvolledige ondersteuning. • Een te grote spanning kan tijdelijke of permanente lage urinewegobstructie en vasthouden van urine veroorzaken. • De bekende risico’s van chirurgische ingrepen ter behandeling van prolaps omvatten pijn, infectie, erosie/blootstelling, verplaatsing van het hulpmiddel, volledig mislukken van de ingreep met als gevolg recidiverende of de novo-prolaps en/of -incontinentie. • Tijdens plaatsing kan punctie of scheuring van vaten, zenuwen, blaas, urethra of darmen worden veroorzaakt waardoor mogelijk chirurgisch herstel nodig is. • Er dient een digitaal rectaal onderzoek te worden uitgevoerd voor detectie van mogelijke rectale perforatie. • Vrouwen met overgewicht zijn mogelijk ontvankelijker voor intraoperatieve en postoperatieve complicaties (gewichtsparameters ter beoordeling van de arts). • Het Capio™ SLIM-hulpmiddel tijdens de activering niet (ver)draaien. Dat kan letsel veroorzaken. VOORZORGSMAATREGELEN • De operatieve behandeling van prolaps van vrouwelijke bekkenorganen dient te worden verricht door artsen met training en ervaring op het gebied van minimaal-invasieve plaatsing van chirurgisch netmateriaal ter behandeling van aandoeningen van de bekkenbodem, en het behandelen van complicaties ten gevolge van ingrepen. • Training in het gebruik van het Uphold™ LITE vaginale-steunsysteem is beschikbaar en wordt aanbevolen. Neem contact op met de verkoopvertegenwoordiger om een afspraak te maken voor deze training. • De arts wordt aangeraden deze gebruiksaanwijzing en de medische literatuur te raadplegen met betrekking tot technieken, complicaties en risico’s die zijn verbonden aan de beoogde ingrepen. • Zoals bij alle chirurgische procedures is van bepaalde risicofactoren bekend dat ze de uitkomst voor de patiënt in de bekkenbodem beïnvloeden, waaronder onder meer een verstoorde vasculariteit (bijv. diabetes, roken, oestrogeenstatus, blootstelling van de bekkenbodem aan straling, enz.), leeftijd, bekkenbodemspierpijn, gestoorde wondgenezing (bijv. diabetes, gebruik van steroïden, enz.) en actieve infectie op of in de buurt van de operatielocatie. Met de bovengenoemde pathofysiologische condities moet rekening worden gehouden bij het bepalen of de patiënt in aanmerking komt voor netimplantatie, via de vaginale of transabdominale route. • Het gebruik van polypropyleennet bij urogynaecologische procedures zoals die ter behandeling van bekkenorgaanprolaps wordt in verband gebracht met gevallen van erosie, ongeacht de plaatsingsroute (transvaginaal of transabdominaal). Erosie is gemeld van blaas, vagina, urethra, ureter en darm. Voor de behandeling van de erosie kan chirurgische verwijdering nodig zijn. 49 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Een cystoscopie wordt aanbevolen om de integriteit van de blaas te bevestigen of om mogelijke perforatie van de blaas of ureter te detecteren. • De anatomische bouw van patiënten kan zeer verschillen. Het is belangrijk dat de doelvlakken voor plaatsing van het net en de doellocatie voor plaatsing van de poten voorafgaand aan de ingreep voor elke afzonderlijke patiënt worden bepaald. Het gebruik van beeldvorming voor en na plaatsing van het net kan helpen om het net op de juiste wijze te plaatsen en om te controleren of er geen letsel is toegebracht aan omliggende anatomische structuren. • Zowel voor ingrepen aan de bekkenbodem als voor de behandeling van besmette of geïnfecteerde wonden dienen de standaard chirurgische methoden te worden aangehouden. • De ingreep dient met zorg te worden uitgevoerd met gebruikmaking van de Capio™ SLIM-hechtdraadgrijper, die met het systeem is meegeleverd, om perforatie of scheuring van vaten, zenuwen, blaas, urethra en darmen te voorkomen. • Vermijd overmatige spanning op het net tijdens het hanteren en plaatsen om beschadiging van het hulpmiddel te voorkomen. • Verwijder de kunststof beschermkoker om de poten van het net pas nadat de juiste positie is vastgesteld. • Vermijd overmatige spanning op het net bij plaatsing om overcorrectie van het defect te vermijden. • Wees extra voorzichtig bij patiënten met blaasprolaps in verband met de anatomische vervorming. • Gebruik bij de Capio SLIM-hechtdraadgrijper uitsluitend Capiohechtdraad van maat 0. • Maak het net niet vast met behulp van hechtnietjes, clips of klemmetjes, aangezien hierdoor mechanische schade aan het net kan ontstaan. • Het Capio SLIM-hulpmiddel mag niet worden gebogen of gewijzigd omdat dit mechanische schade aan het hulpmiddel kan toebrengen. COMPLICATIES Mogelijke complicaties die kunnen optreden bij gynaecologisch chirurgisch netmateriaal omvatten onder meer: • erosie/uitstoting/blootstelling; • pijn, aanhoudende pijn, ongemak, irritatie; • infectie/sepsispotentiëring/abcesvorming; • bloeding (blauwe plekken, hematoom, hemorragie, postoperatieve bloeding); • dyspareunie; • orgaanperforatie/fistelvorming; Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • ureterletsel; • ureterobstructie; • urine-incontinentie; • urineretentie; • corpus-alienumretentie (corpus-alienumreactie); • neuro-musculaire problemen; • vaginaverkorting of -stenose, samentrekken van net en/of weefsel; • recidiverende prolaps; • allergie, overgevoeligheid of andere reactie van het immuunsysteem; • adhesievorming; • beschadiging/perforatie van vaten/zenuwen; • ontsteking (acuut of chronisch); • vaginale afscheiding; • dehiscentie en/of necrose; • wonddehiscentie; • obstipatie/ontlastingsstoornissen; • vorming van granulatieweefsel; • irritatie op de plaats van de wond, erytheem, oedeem. Het optreden van deze voorvallen kan chirurgische interventie noodzakelijk maken. In sommige gevallen kan de respons op deze voorvallen permanent voortduren na de interventie. LEVERING Het Uphold™ LITE vaginale-steunsysteem wordt steriel geleverd en is uitsluitend bestemd voor gebruik bij één patiënt. Koel, droog en donker bewaren. Stel het product niet bloot aan organische oplosmiddelen, ioniserende straling of ultraviolet licht. Gebruik eerst de oude voorraad zodat de producten vóór de vervaldatum op de verpakking worden gebruikt. Niet gebruiken als de verpakking open of beschadigd is. Niet gebruiken als de etikettering onvolledig of onleesbaar is. 50 Black (K) ∆E ≤5.0 BEDIENINGSINSTRUCTIES Voorafgaand aan gebruik 1. Controleer het systeem zorgvuldig om na te gaan of de inhoud en de gesteriliseerde verpakking tijdens de verzending niet beschadigd zijn geraakt. NIET gebruiken indien de steriele barrière van het product is beschadigd. Stuur in dat geval het beschadigde product onmiddellijk terug naar Boston Scientific. 2. Bereid de patiënt voor en dek deze af volgens de standaard chirurgische methoden. LET OP: Controleer voordat u dit product gebruikt of de blaas leeg is. Zorg dat de blaas, urethra en andere belangrijke oriëntatiepunten duidelijk herkenbaar zijn om punctie en/of scheuring tijdens de ingreep te voorkomen. Gebruiksaanwijzing Het Uphold™ LITE vaginale-steunsysteem is zo ontworpen dat de Uphold LITE netconstructie transvaginaal kan worden geplaatst. De volgende instructies zijn opgesplitst in onderstaande stappen voor plaatsing: • Stappen voor anterieure plaatsing van de poten voor het sacrospinale ligament • Stappen om het net aan te passen en de pootconstructies te verwijderen Raadpleeg als het hulpmiddel tijdens de ingreep breekt de paragraaf ‘Stappen voor het verwijderen van hulpmiddelfragmenten’ na de stappen voor plaatsing. Stappen voor anterieure plaatsing van de poten voor het sacrospinale ligament 1. Zet de vaginawand anterieur vast in de middenlijn met een reeks weefselklemmen. 2. Maak voor een anterieure benadering een incisie van 2-3 cm van middelgrote dikte zoals doorgaans gebruikt wordt voor een dissectievlak voor anterieure colporrafie. Stop ongeveer 2 cm vóór de apex van de vagina om overlapping van het net en de hechtlijn op de incisieplaats te vermijden. 4. De sacrospinale ligamenten worden vervolgens voorzichtig blootgelegd door de wijsvinger behoedzaam mediaal vanaf de spina ischiadica te vegen. LET OP: Zorg dat het sacrospinaal ligament vrij is van vezelig bindweefsel of vetweefsel. 5. Plaats de pijlpunt van de pootconstructie in de houder op het distale uiteinde van de Capio™ SLIM-hechtdraadgrijper. Bevestig de pijlpunt in de houder door de geleidingsdraad voorzichtig omlaag te trekken. Zorg dat de verwijding van de pijlpunt volledig is teruggetrokken in de houder. (Zie afbeelding 4.) Afbeelding 4 Het laden van de pijlpunt in de Capio SLIM-houder 6. De Capio SLIM-hechtdraadgrijper kan direct in het chirurgische veld worden geplaatst om de geleidingsdraad via digitale palpatie of onder directe visuele controle te plaatsen. Plaats het hulpmiddel met de distale punt op de gewenste plaats tegen het sacrospinaal ligament waar de geleidingsdraad wordt geplaatst (zie afbeelding 5) en houd het stevig op zijn plaats. 7. Zoals getoond in afbeelding 6 wordt de pijlpunt door het sacrospinaal ligament gestoken door de knop helemaal in te drukken. Hierdoor wordt de pijlpunt in de vanger van de Capio SLIM-hechtdraadgrijper gedrukt. 51 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 3. Zorg voor een scherpe afbakening van dit vlak met een schaar tot u aan beide zijden de ramus pubicus kunt voelen. Na de benadering gebruikt veegt u met de vinger in een neerwaartse en mediale beweging langs de zijwand om deze te reinigen en bilateraal een gladde tunnel te maken richting de spinae ischiadicae. Opmerking: Voor directe palpatie/stabilisatie kunt u een vinger op de kop van het Capio™ SLIM-hulpmiddel plaatsen. Afbeelding 5 en 6 De geleidingsdraad door weefsel heen plaatsen en hechten 8. Laat de aandrijfknop los zodat de houder zich kan terugtrekken in de behuizing. Trek de geleidingsdraad door het sacrospinaal ligament heen (zie afbeelding 7). 9. Trek het Capio SLIM-hulpmiddel terug van de incisie (zie afbeelding 8). Afbeelding 7 en 8 De geleidingsdraad vastzetten en terugtrekken Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 10. Verwijder de pijlpunt uit de grijper door de hechtdraad vast te houden en de pijlpunt naar boven te laten glijden in de richting van de handgreep, tot aan de sleuf. Opmerking: Tussen het plaatsen van de poten van het net in een enkele ingreep bij één patiënt plaatst u het distale uiteinde van de Capio SLIM-hechtdraadgrijper in een bakje met steriele zoutoplossing en spoelt u het hulpmiddel grondig af om bloed en débris te verwijderen. Als de vanger traag werkt vanwege coagulatie van weefsel en bloed, trekt u aan de knop om de houder terug te trekken. Spoel deze af met steriele zoutoplossing. Na plaatsing van de netconstructie voert u het Capio SLIM-hulpmiddel af volgens het ziekenhuisbeleid. 11. Herhaal stap 5 tot en met 10 voor de andere poot voor het sacrospinale ligament. 12. Geleidingsdraden kunnen buiten het lichaam worden getrokken voor tijdelijke plaatsing voordat deze uiteindelijk worden bijgesteld. Stappen voor aanpassing van net en verwijdering van pootconstructies 1. Pas de plaatsing van het net aan door de pootconstructies uit elkaar te trekken. Het net dient boven de cervix of de vaginale manchet te zijn gecentreerd. Zodra het net is geplaatst, kan dit, indien de arts dit wenst, worden bijgesneden en/of extra worden vastgezet. 2. Pak een poot van de Uphold™ LITE synthetische-netconstructie beet en knip het buiten de beschermkoker uitstekende deel van elke leidlus af. Zie afbeelding 9. 52 Black (K) ∆E ≤5.0 Afbeelding 9 Het verwijderen van de pootconstructies 3. Verwijder de pootconstructie door er voorzichtig aan te trekken en laat alleen het net op zijn plaats. Voer de pootconstructie op de juiste wijze af volgens de binnen uw instelling geldende procedures. 4. Herhaal stap 2 en 3 aan de contralaterale kant. 5. Zorg dat beide pootconstructies uit de patiënt zijn verwijderd. 6. Controleer de positie van het net en pas deze zo nodig aan. 7. Voltooi de uiteindelijke aanpassingen en plaatsing van het net naar de voorkeur van de arts. 8. Sluit de anterieure incisie. LET OP: Vermijd overmatige spanning op het net bij plaatsing om overcorrectie van het defect te vermijden. Stappen voor het verwijderen van hulpmiddelfragmenten 1. Indien het hulpmiddel breekt en er een fragment in de patiënt achterblijft, dient u te bepalen of het fragment zonder schade aan de omliggende anatomische structuren kan worden gelokaliseerd en verwijderd. Ga voorzichtig te werk om het operatiegebied niet te verstoren tot het fragment is gelokaliseerd, zodat dit niet verder uit het zicht verdwijnt. 2. Indien het fragment direct zichtbaar is, moet het met een kleine naaldvoerder of tang worden vastgepakt en met het hulpmiddel worden geretourneerd aan de fabrikant om te worden onderzocht. LITERATUUR • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. 53 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 3. Indien het fragment niet direct zichtbaar is, kunt u röntgenopnamen gebruiken om de locatie vast te stellen. Bij dissectie en ophalen van het fragment moet radiologische ondersteuning worden gebruikt om letsel aan omliggend weefsel te minimaliseren. GARANTIE Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Boston Scientific Corporation (BSC) garandeert dat er redelijke zorg is betracht bij het ontwerpen en vervaardigen van dit instrument. Deze garantie vervangt en ontkracht alle andere garanties die hier niet worden vermeld, hetzij uitdrukkelijk, hetzij impliciet door de werking van de wet of anderszins, met inbegrip van, maar niet beperkt tot, geïmpliceerde garanties van verkoopbaarheid of geschiktheid voor een bepaald doel. Hanteren, opslag, schoonmaken en sterilisatie van dit instrument alsmede andere factoren in verband met de patiënt, diagnose, behandeling, chirurgische ingrepen en andere zaken die buiten de macht van BSC vallen, zijn direct van invloed op het instrument en de resultaten die ermee worden verkregen. De aansprakelijkheid van BSC volgens deze garantievoorwaarden is beperkt tot het repareren of vervangen van dit instrument; BSC aanvaardt geen aansprakelijkheid voor incidentele of bijkomende schade die direct dan wel indirect voortvloeit uit gebruik van dit instrument. BSC aanvaardt geen, en geeft niemand de bevoegdheid tot het in naam van BSC aanvaarden van, andere of aanvullende aansprakelijkheid of verantwoordelijkheid in verband met dit instrument. BSC aanvaardt geen aansprakelijkheid voor instrumenten die opnieuw zijn gebruikt, verwerkt of gesteriliseerd en biedt geen uitdrukkelijke dan wel impliciete garanties in verband met zulke instrumenten, met inbegrip van, maar niet beperkt tot, garanties van verkoopbaarheid of geschiktheid voor een bepaald doel. 54 Black (K) ∆E ≤5.0 ÍNDICE ADVERTÊNCIA................................................................................... 56 UTILIZAÇÃO PREVISTA/INDICAÇÕES DE UTILIZAÇÃO............. 56 CONTRA-INDICAÇÕES..................................................................... 56 DESCRIÇÃO DO DISPOSITIVO........................................................ 57 Advertências/Potenciais complicações......................... 57 PRECAUÇÕES.................................................................................... 58 EFEITOS INDESEJÁVEIS.................................................................. 59 FORMA DE APRESENTAÇÃO DO PRODUTO................................ 59 INSTRUÇÕES DE OPERAÇÃO ........................................................ 60 Passos para a COLOCAÇÃO ANTERIOR DOS TIRANTES DO LIGAMENTO SACROESPINHAL...................... 60 Passos para ajuste da rede e remoção dos tirantes..................................................................................... 61 PASSOS PARA REMOÇÃO DE UM FRAGMENTO DE DISPOSITIVO............................................................................... 62 REFERÊNCIAS.................................................................................... 62 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B GARANTIA......................................................................................... 63 55 Black (K) ∆E ≤5.0 Uphold™ LITE with Capio™ SLIM Sistema de Suporte Vaginal ONLY Cuidado: A lei federal (EUA) só permite a venda deste dispositivo sob receita de um médico com formação na utilização de rede cirúrgica para a reparação transvaginal do prolapso do órgão pélvico. Os médicos devem possuir formação adequada na colocação minimamente invasiva de dispositivos de rede cirúrgica para tratamento de problemas do pavimento pélvico e gestão de complicações resultantes dos procedimentos. Leia atentamente este documento. O não cumprimento das instruções pode causar um funcionamento incorrecto e/ou provocar lesões na paciente. Este documento não é um manual de formação sobre cirurgia transvaginal para correcção do prolapso do órgão pélvico. Os sistemas de rede leve da Boston Scientific apenas devem ser utilizados por médicos com formação adequada na correcção cirúrgica desta patologia e na utilização deste dispositivo. A segurança e a eficácia do Sistema de Suporte Vaginal Uphold LITE, em comparação com a reparação cirúrgica convencional do prolapso do órgão pélvico, não foram demonstradas em ensaios clínicos controlados aleatórios. Nos Estados Unidos, foi demonstrada equivalência substancial entre o Sistema de Suporte Vaginal Uphold LITE e a rede sintética através de testes comparativos de referência. ADVERTÊNCIA Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B O conteúdo é fornecido ESTERILIZADO por óxido de etileno (EO). Não utilize se o selo de esterilização estiver danificado. Se verificar a presença de quaisquer danos no produto, contacte o seu representante da Boston Scientific. Apenas para uma única utilização. Não reutilize, reprocesse nem reesterilize. A reutilização, o reprocessamento ou a reesterilização podem comprometer a integridade estrutural do dispositivo e/ou provocar a sua falha, o que, por sua vez, pode causar lesões, doença ou a morte do paciente. A reutilização, o reprocessamento ou a reesterilização também acarretam o risco de contaminação do dispositivo e/ou o risco de infecção no paciente ou infecção cruzada incluindo mas não se limitando à transmissão de doença(s) contagiosa(s) de um paciente para outro. A contaminação do dispositivo pode causar lesões, doença ou a morte do paciente. Depois de utilizar, deite fora o produto e a embalagem de acordo com a política do hospital, administrativa e/ou do governo local. UTILIZAÇÃO PREVISTA/INDICAÇÕES DE UTILIZAÇÃO O Sistema de Suporte Vaginal Uphold LITE está indicado para o reforço de tecidos em mulheres com prolapso do órgão pélvico, para a reparação transvaginal de prolapso da parede vaginal anterior e apical. CONTRA-INDICAÇÕES O Sistema de Suporte Vaginal Uphold LITE está contra-indicado para utilização em pacientes com contra-indicação de colocação de implantes em tecidos moles. E, adicionalmente, em pacientes com: • Patologia dos tecidos moles onde se pretende colocar a Rede Sintética Uphold LITE. • Grávidas ou pacientes que pretendam engravidar. • Potencial de crescimento futuro (por exemplo, crianças e adolescentes). • Qualquer patologia, incluindo patologia uterina conhecida ou suspeita, que comprometa a colocação do implante (por exemplo, distorções ou anomalias anatómicas). • Qualquer patologia que limitaria o aporte de sangue e comprometeria a cicatrização (por exemplo, diminuição do aporte de sangue para os órgãos como resultado dos tratamentos, como radioterapia, quimioterapia). 56 Black (K) ∆E ≤5.0 • Presença de cancro conhecido ou suspeita de cancro da vagina, colo ou útero. • Alterações ao nível da coagulação. • Doença auto-imune do tecido conjuntivo. • Pacientes com insuficiência renal e obstrução do tracto urinário superior. • Infecção local ou sistémica pré-existente. Trate a infecção com antisépticos e/ou antibióticos apropriados para eliminar a infecção antes de utilizar a Rede Sintética Uphold™ LITE. DESCRIÇÃO DO DISPOSITIVO O Sistema de Suporte Vaginal Uphold LITE é um dispositivo estéril de utilização numa única paciente para colocação transvaginal, constituído por (1) um Conjunto de Rede Sintética Uphold LITE e (1) um Dispositivo de Captura de Suturas Capio™ SLIM. A unidade de rede consiste numa rede de malha leve composta por fibra de monofilamento de polipropileno não tingida e tingida (azul ftalocianina, número do índice de cor 74160) com 2 conjuntos de tirantes integrados. Os conjuntos de tirantes incluem um dardo, ponta de avanço, dilatador, dois anéis guia e manga protectora. O dardo existente na ponta distal do conjunto de tirantes foi concebido para ser colocado no suporte, na ponta distal do Dispositivo de Captura de Suturas Capio SLIM. O conjunto de tirantes destina-se a facilitar a passagem da Unidade de Rede Sintética Uphold LITE através dos tecidos corporais para colocação através do ligamento sacroespinhal. Um dilatador apresenta um padrão às riscas para diferenciar cada conjunto de tirantes (Esquerdo/Direito). Figura 1 Configuração da Rede Uphold LITE O implante de Rede Uphold LITE está configurado para reparação do prolapso da parede vaginal por via de uma abordagem anterior ao ligamento sacroespinhal. Linha central Figura 2 Conjunto de tirantes da rede Manga protectora Dilatador 2 anéis guia Ponta de avanço Dardo Figura 3 Dispositivo de Captura de Suturas Capio SLIM Advertências/Potenciais complicações • Eventual necessidade de histerectomia no futuro. A utilização da rede poderá dificultar a histerectomia futura, devido ao crescimento dos tecidos e à cicatrização. • O comprimento cervical tem de ser avaliado durante o trabalho préoperatório. As pacientes com alongamento cervical poderão não ser candidatas adequadas a procedimentos de reparação de prolapsos. Poderá ser considerada a histerectomia ou amputação cervical em pacientes com alongamento cervical que optem por se submeter a este procedimento. • Poderá ser necessário um rastreio e vigilância continuados para detecção de eventuais doenças cervicais e uterinas. Deverão realizar-se regularmente exames pélvicos, teste de Papanicolau e biopsias do endométrio, de acordo com a indicação médica. • A realização de um procedimento de reparação apical em casos com dilatação uterina, e na presença de doença benigna, deverá ficar ao critério do médico. Em alguns casos, a dilatação do útero poderá comprometer a eficácia do procedimento. 57 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Tirante da rede • A paciente deve ser instruída no sentido de contactar o médico imediatamente em caso de disúria, hemorragia ou qualquer outro problema. • As pacientes devem ser aconselhadas a evitar levantar pesos, fazer exercício e ter relações sexuais durante, pelo menos, seis (6) semanas após o procedimento. O médico deve determinar o momento mais adequado para cada paciente regressar às actividades normais. • Na eventualidade de infecção pós-procedimento, será necessário remover ou rever integralmente a rede. • Tal como acontece com todos os corpos estranhos, a rede pode potenciar uma reacção infecciosa existente ou sepsia. • As reacções dos tecidos ao implante podem incluir: irritação no local da incisão, erosão ou exposição através da vagina ou outro tecido circundante, migração do dispositivo do local pretendido, formação de fístulas, reacção a corpos estranhos e inflamação. A ocorrência destas reacções pode exigir a remoção ou revisão da rede. • A rede é considerada um implante permanente. A remoção da rede ou a correcção de complicações relacionadas com a rede poderá implicar várias cirurgias. • A remoção completa da rede poderá não ser possível e as cirurgias adicionais poderão nem sempre corrigir totalmente as complicações. • Pode ocorrer incontinência ligeira a moderada devido a suporte incompleto. • Uma tensão excessiva pode causar obstrução e retenção, temporárias ou permanentes, do tracto urinário inferior. • Os riscos conhecidos dos procedimentos cirúrgicos para o tratamento do prolapso incluem dor, infecção, erosão/ exposição, migração do dispositivo, total insucesso do procedimento resultando num prolapso de novo ou recorrente e/ou incontinência. • Pode ocorrer a punção ou laceração dos vasos, nervos, bexiga, uretra ou intestinos durante a colocação, requerendo posterior reparação cirúrgica. • Deverá ser realizado um exame rectal digital para detecção de eventual perfuração rectal. • Recomenda-se cistoscopia para confirmação da integridade da bexiga ou detecção de eventual perfuração da bexiga ou ureteral. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Mulheres com excesso de peso podem ter tendência para ter complicações no operatório ou pós-operatório (os parâmetros de peso podem ser determinados pelo médico). • Não vire, rode nem torça o Dispositivo Capio™ SLIM durante a actuação. O não cumprimento destas instruções poderá causar lesões. PRECAUÇÕES • O tratamento cirúrgico do prolapso do órgão pélvico feminino deve ser realizado por médicos com formação e experiência na colocação minimamente invasiva de dispositivos de rede cirúrgica para tratamento de problemas do pavimento pélvico e gestão de complicações resultantes dos procedimentos. • Recomenda-se e está disponível a formação na utilização do Sistema de Suporte Vaginal Uphold™ LITE. Contacte o seu representante de vendas para providenciar esta formação. • É recomendável que o médico consulte este documento de instruções de utilização e literatura médica para obter informações sobre técnicas, complicações e perigos associados aos procedimentos previstos. • Tal como acontece em todos os procedimentos cirúrgicos, sabese que determinados factores de risco afectam os resultados das pacientes ao nível do pavimento pélvico que podem incluir, entre outros, vascularização comprometida (por exemplo, diabetes, hábitos tabágicos, estado ao nível do estrogénio, exposição do pavimento pélvico a radiação, etc.), idade, mialgia no pavimento pélvico, deficiência ao nível da cicatrização (por exemplo, diabetes, utilização de esteróides, etc.) ou infecção activa no ou próximo do local da cirurgia. As condições patofisiológicas acima têm de ser consideradas ao determinar se a paciente é uma candidata adequada para a implantação da rede, quer via transvaginal ou via transabdominal. • A utilização de uma rede em polipropileno em procedimentos uroginecológicos como o tratamento do prolapso do órgão pélvico, independentemente da via de colocação (transvaginal ou transabdominal), foi associada a casos de erosão. Foram relatados casos de erosão na bexiga, vagina, uretra, ureter e intestinos. O tratamento da erosão poderá exigir a remoção cirúrgica. 58 Black (K) ∆E ≤5.0 • Em cada caso, a anatomia da paciente pode variar substancialmente, pelo que é importante o planeamento e conhecimento dos planos pretendidos para a colocação da rede bem como a localização pretendida para colocação dos tirantes em cada paciente. O recurso a métodos de imagiologia antes e após a colocação da rede poderá auxiliar na correcta colocação da rede, bem como confirmar a ausência de lesões em estruturas anatómicas não-alvo. • Devem ser seguidas as práticas cirúrgicas padrão durante procedimentos no pavimento pélvico, assim como no controlo de incisões contaminadas ou infectadas. • O procedimento deve ser realizado cuidadosamente, utilizando o Dispositivo de Captura de Suturas Capio™ SLIM fornecido com o sistema, de forma a evitar a perfuração ou laceração de vasos, nervos, bexiga, uretra e intestinos. • Evite aplicar tensão excessiva sobre a rede durante a manipulação e posicionamento, de forma a evitar danificar o dispositivo. • Não remova a manga protectora de plástico que cobre os tirantes da rede enquanto não for confirmado o posicionamento apropriado. • Evite aplicar tensão excessiva sobre a rede durante o posicionamento, de forma a evitar a sobre-correcção do problema. • Tenha especial atenção aos casos de prolapso da bexiga devido a distorção anatómica. • Utilize apenas suturas Capio de tamanho 0 com o Dispositivo de Captura de Suturas Capio SLIM. • Não fixe a rede utilizando meios mecânicos como agrafos, clipes ou grampos, pois estes podem provocar danos mecânicos na rede. • Não dobre nem altere o Dispositivo de Captura de Suturas Capio SLIM, caso contrário, poderá provocar danos mecânicos no mesmo. EFEITOS INDESEJÁVEIS As potenciais reacções adversas associadas à rede cirúrgica ginecológica incluem: • Erosão/extrusão/exposição; • Dor, dor contínua, desconforto, irritação; • Potenciação de infecção/sepsia/formação de abcessos; • Sangramento (contusões, hematomas, hemorragias, hemorragia pós-operatória); • Dispareunia; • Perfuração dos órgãos/formação de fístulas; • Obstrução ureteral; • Incontinência urinária; • Retenção urinária; • Retenção de corpos estranhos (reacção a corpos estranhos); • Problemas neuromusculares; • Estenose ou encurtamento vaginal, contractura da rede e/ou do tecido; • Prolapso recorrente; • Reacções alérgicas, hipersensibilidade ou outras reacções do sistema imunitário; • Formação de aderências; • Perfuração/lesão dos vasos/nervos; • Inflamação (aguda ou crónica); • Corrimento vaginal; • Deiscência e/ou necrose; • Deiscência da incisão; • Obstipação/disfunção de defecação; • Formação de tecido de granulação; • Irritação, eritema ou edema no local da incisão cirúrgica. A ocorrência destes efeitos poderá exigir intervenção cirúrgica. Em alguns casos, a resposta a este evento poderá permanecer como condição permanente após a intervenção. FORMA DE APRESENTAÇÃO DO PRODUTO O Sistema de Suporte Vaginal Uphold™ LITE é fornecido esterilizado e destina-se a ser utilizado numa única paciente. Guarde num local fresco, seco e escuro. Não exponha a solventes orgânicos, radiação ionizante ou raios ultravioleta. Faça a rotação dos stocks de forma que os produtos sejam utilizados antes do final do prazo de validade indicado no rótulo da embalagem. Não utilize se a embalagem estiver aberta ou danificada. Não utilize se a etiquetagem estiver incompleta ou ilegível. 59 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B • Lesão ureteral; INSTRUÇÕES DE OPERAÇÃO Antes de Utilizar 1. Examine cuidadosamente o sistema para verificar se o conteúdo ou a embalagem esterilizada sofreram quaisquer danos durante o transporte. NÃO UTILIZE se o selo de esterilização do produto estiver danificado. Devolva imediatamente o produto danificado à Boston Scientific. 2. Prepare e cubra a paciente com as técnicas cirúrgicas habituais. CUIDADO: Verifique se a bexiga está vazia antes de iniciar a utilização deste produto. Verifique também se a bexiga, uretra e outros pontos anatómicos importantes estão correctamente identificados, de forma a evitar a perfuração e/ou laceração durante o procedimento. Instruções de Utilização O design do Sistema de Suporte Vaginal Uphold™ LITE permite ao operador realizar uma abordagem transvaginal para colocação da Unidade de Rede Uphold LITE. As instruções seguintes estão divididas nos seguintes passos de colocação: • Passos para a colocação anterior dos tirantes do ligamento sacroespinhal • Passos para ajuste da rede e remoção dos tirantes Na eventualidade de o dispositivo quebrar durante o procedimento, consulte os Passos para remoção de um fragmento de dispositivo, de acordo com o procedimento de colocação. Passos para a COLOCAÇÃO ANTERIOR DOS TIRANTES DO LIGAMENTO SACROESPINHAL 1. A parede vaginal anterior é fixada na linha média por meio de uma série de grampos Allis. 2. Para uma abordagem anterior, realize uma incisão de meia espessura e 2 a 3 cm típica num plano de dissecação de uma colporrafia anterior, deixando aproximadamente 2 cm intactos no ápice da vagina, para evitar a sobreposição da rede e da linha de sutura na incisão. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 3. Definir bem este plano com uma tesoura até que os ramos púbicos descendentes sejam palpáveis de cada lado. Depois de ganhar acesso, passe com o dedo utilizando um movimento descendente e mediano para limpar a parede lateral e criar um túnel liso na direcção das espinhas isquiáticas, bilateralmente. 4. Os ligamentos sacroespinhais são então cuidadosamente expostos passando-se o dedo indicador suavemente numa posição mediana a partir da espinha isquiática. CUIDADO: Certifique-se de que o ligamento sacroespinhal não apresenta tecidos fibrosos ou adiposos. 5. Carregue o dardo do conjunto de tirantes no suporte na ponta distal do Dispositivo de Captura de Suturas Capio™ SLIM. Engate o dardo no suporte empurrando-o cuidadosamente sobre a ponta de avanço. Certifique-se de que a saliência do dardo fica totalmente introduzida no suporte. (Consulte a FIG 4.) Figura 4 Carregamento do dardo no suporte do Capio SLIM 6. O Dispositivo de Captura de Suturas Capio SLIM pode ser posicionado directamente no campo cirúrgico para colocação da ponta de avanço, utilizando a palpação digital/controlo visual directo. Posicione o dispositivo com a ponta distal no local pretendido contra o ligamento sacroespinhal onde se pretende colocar a ponta de avanço, conforme apresentado na FIG 5, e segure com firmeza na respectiva posição. 7. Conforme ilustrado na FIG 6, o dardo é direccionado através do ligamento sacroespinhal pressionando o botão até estar totalmente pressionado, conduzindo o dardo para o interior do engate do Dispositivo de Captura de Suturas Capio SLIM. 60 Black (K) ∆E ≤5.0 Nota: Pode ser aplicado um dedo na cabeça do Dispositivo Capio™ SLIM para palpação/estabilização directa. Figuras 5 e 6 Posicionamento e laçada da ponta de avanço através do tecido 8. Solte e puxe o botão accionador para trás para permitir que o suporte se retraia para dentro do compartimento. Puxe a ponta de avanço através do ligamento sacroespinhal, conforme ilustrado na FIG 7. 9. Retire o Dispositivo Capio SLIM da incisão, conforme ilustrado na FIG 8. Figuras 7 e 8 Captura e remoção da ponta de avanço Nota: Entre os procedimentos de colocação dos tirantes da rede num procedimento numa única paciente, coloque a cabeça distal do Dispositivo de Captura de Suturas Capio SLIM numa bacia com solução de soro fisiológico esterilizado e lave minuciosamente para remover resíduos de sangue e detritos. Se o engate estiver perro devido a tecidos e coágulos de sangue, puxe o botão para retrair o suporte e lave em solução de soro fisiológico esterilizado. Após a colocação da rede, descarte o Dispositivo Capio SLIM em conformidade com os procedimentos hospitalares. 11. Repita os passos de 5 a 10 para o outro tirante do ligamento sacroespinhal. 12. As pontas de avanço poderão ser retiradas extracorporalmente para posicionamento temporário antes do ajuste final. Passos para ajuste da rede e remoção dos tirantes 1. Ajuste a colocação da rede puxando os tirantes para fora. A rede deverá ficar centrada sobre o colo do útero ou cuff vaginal. Uma vez posicionada, se o médico pretender, a rede poderá ser cortada e/ou adicionalmente fixada para colocação na posição correcta. 2. Segure um tirante da Unidade de Rede Sintética Uphold™ LITE e corte as duas secções do anel guia situadas fora da manga protectora. Consulte a FIG 9. 61 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 10. Retire o dardo do engate, segurando a ponta de avanço e fazendo deslizar o dardo para cima, em direcção ao punho e à ranhura de chaveta. Figura 9 Remoção dos tirantes 3. Puxe cuidadosamente o conjunto de tirantes de forma a removê-lo, deixando apenas a rede na respectiva posição. Elimine o conjunto de tirantes conforme adequado e em conformidade com os procedimentos hospitalares. 4. Repita os passos 2 e 3 no lado contrário. 5. Certifique-se de que ambos os tirantes são removidos da paciente. 6. Verifique a posição da rede e ajuste, se necessário. 7. Proceda aos ajustes finais e colocação da rede com base na preferência do médico. 8. Feche a incisão anterior. CUIDADO: Evite aplicar tensão excessiva sobre a rede durante o posicionamento, de forma a evitar a sobre-correcção do problema. PASSOS PARA REMOÇÃO DE UM FRAGMENTO DE DISPOSITIVO 1. Na eventualidade de o dispositivo quebrar e de um dos fragmentos ficar alojado na paciente, avalie a situação no sentido de determinar se é possível localizar e remover o fragmento sem danificar a anatomia envolvente. Tenha o cuidado de não interferir com a localização da intervenção até localizar o fragmento, de forma a evitar que este desapareça do seu campo de visão. Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 2. Se conseguir visualizar directamente o fragmento, retire-o com um accionador de agulha fino ou pinça e devolva-o ao fabricante juntamente com o dispositivo para ulterior investigação. 3. Se não conseguir visualizar directamente o fragmento, utilize raios-X para ajudar a determinar a respectiva localização. O recurso a radiologia deverá ser utilizado como guia na dissecção e recuperação do fragmento, minimizando assim eventuais lesões no tecido envolvente. REFERÊNCIAS • Huebner M, Hsu Y and Fenner DE. The use of graft materials in vaginal pelvic floor surgery. International Journal of Gynecology and Obstetrics 2006; 92:279-288. • Altman D, and Falconer C. Peri-operative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstetrics & Gynecology 2007; 109 (2, Part 1): 303-308. 62 Black (K) ∆E ≤5.0 GARANTIA Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B A Boston Scientific Corporation (BSC) garante que foram tomados todos os cuidados devidos na concepção e fabrico deste instrumento. Esta garantia substitui e exclui todas as outras aqui não expressamente mencionadas, explícitas ou implícitas por força de lei, ou de qualquer outra forma, incluindo, mas não se limitando a, quaisquer garantias implícitas de comercialização ou adequação para fins específicos. O manuseio, o armazenamento, a limpeza e a esterilização deste instrumento, bem como os factores relacionados com o paciente, diagnóstico, tratamento, procedimentos cirúrgicos e outros assuntos fora do controlo da BSC afectam directamente o instrumento e os resultados obtidos pela sua utilização. A responsabilidade da BSC, de acordo com esta garantia, limita-se à reparação ou substituição deste instrumento e a BSC não se responsabiliza por quaisquer perdas, danos ou despesas incidentais ou consequenciais resultantes, directa ou indirectamente, da utilização deste instrumento. A BSC não assume, nem autoriza qualquer outra pessoa a assumir em seu nome, qualquer outra obrigação ou responsabilidade adicional em relação a este instrumento. A BSC não assume nenhuma responsabilidade relativamente a instrumentos reutilizados, reprocessados ou reesterilizados e não estabelece quaisquer garantias, explícitas ou implícitas, incluindo mas não se limitando à comercialização ou adequação para fins específicos, em relação a estes instrumentos. 63 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 64 Black (K) ∆E ≤5.0 Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B 65 Black (K) ∆E ≤5.0 REF Catalog Number Número de catálogo Numéro de catalogue Bestell-Nr. Numero di catalogo Catalogusnummer Referência Consult instructions for use. Consultar las instrucciones de uso. Consulter le mode d’emploi. Gebrauchsanweisung beachten. Consultare le istruzioni per l'uso. Raadpleeg instructies voor gebruik. Consulte as Instruções de Utilização Contents Contenido Contenu Inhalt Contenuto Inhoud Conteúdo EC REP S EU Authorized Representative Representante autorizado en la UE Représentant agréé UE Autorisierter Vertreter in der EU Rappresentante autorizzato per l'UE Erkend vertegenwoordiger in EU Representante Autorizado na U.E. Legal Manufacturer Fabricante legal Fabricant légal Berechtigter Hersteller Fabbricante legale Wettelijke fabrikant Fabricante Legal Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B LOT Lot Lote Lot Charge Lotto Partij Lote Recyclable Package Envase reciclable Emballage recyclable Wiederverwertbare Verpackung Confezione riciclabile Recyclebare verpakking Embalagem Reciclável Use By Fecha de caducidad Date limite d’utilisation Verwendbar bis Usare entro Uiterste gebruiksdatum Validade AUS ARG Australian Sponsor Address Dirección del patrocinador australiano Adresse du promoteur australien Adresse des australischen Sponsors Indirizzo sponsor australiano Adres Australische sponsor Endereço do Patrocinador Australiano Argentina Local Contact Contacto local en Argentina Contact local en Argentine Lokaler Kontakt Argentinien Contatto locale per l'Argentina Contactpersoon Argentinië Contacto local na Argentina For single use only. Do not reuse. Para un solo uso. No reutilizar. À usage unique. Ne pas réutiliser. Für den einmaligen Gebrauch. Nicht wieder verwenden. Esclusivamente monouso. Non riutilizzare. Uitsluitend bestemd voor eenmalig gebruik. Niet opnieuw gebruiken. Apenas para uma única utilização. Não reutilize. 66 Black (K) ∆E ≤5.0 2 STERILIZE Do Not Resterilize No reesterilizar Ne pas restériliser Nicht erneut sterilisieren Non risterilizzare Niet opnieuw steriliseren Não reesterilize Do not use if package is damaged. No usar si el envase está dañado. Ne pas utiliser si l’emballage est endommagé. Bei beschädigter Verpackung nicht verwenden. Non usare il prodotto se la confezione è danneggiata. Niet gebruiken als de verpakking is beschadigd. Não utilize se a embalagem estiver danificada. BRA Sterilized using ethylene oxide. Esterilizado por óxido de etileno. Stérilisé à l’oxyde d’éthylène. Mit Ethylenoxid sterilisiert. Sterilizzato con ossido di etilene. Gesteriliseerd met ethyleenoxide. Esterilizado por óxido de etileno. Brazil Local Contact Contacto local en Brasil Contact local au Brésil Lokaler Kontakt Brasilien Contatto locale per il Brasile Contactpersoon Brazilië Contacto local no Brasil Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B STERILE EO 67 Black (K) ∆E ≤5.0 EC REP EU Authorized Representative Boston Scientific Limited Ballybrit Business Park Galway IRELAND AUS Australian Sponsor Address Boston Scientific (Australia) Pty Ltd PO Box 332 BOTANY NSW 1455 Australia Free Phone 1800 676 133 Free Fax 1800 836 666 ARG Argentina Local Contact Boston Scientific (Master Brand DFU Template 3in x 9in Global, 90106040AP), DFU, Uphold LITE, Global, 91033325-01B Para obtener información de contacto de Boston Scientific Argentina SA, por favor, acceda al link www.bostonscientific.com/arg BRA Brazil Local Contact Para informações de contato da Boston Scientific do Brasil Ltda, por favor, acesse o link www.bostonscientific.com/bra Legal Manufacturer Manufactured for: Boston Scientific Corporation 300 Boston Scientific Way Marlborough, MA 01752 USA USA Customer Service 888-272-1001 Do not use if package is damaged. Recyclable Package 0344 © 2015 Boston Scientific Corporation or its affiliates. All rights reserved. Black (K) ∆E ≤5.0
© Copyright 2026