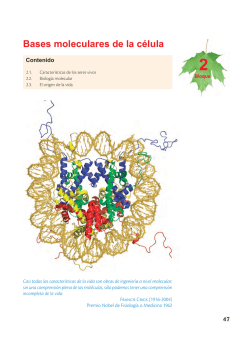
KARP_7a_c17_RESPUESTA_INMUNITARIA
BIOLOGÍA CELULAR Y MOLECULAR Capítulo 17. Respuesta inmunitaria Capítulo 17 Todos los derechos reservados. McGraw-Hill Interamericana Editores Respuesta inmunitaria 17.1 Sinopsis de la respuesta inmunitaria 17.2 Teoría de la selección clonal aplicada a los linfocitos B 17.3 Linfocitos T: activación y mecanismo de acción 17.4 Temas selectos sobre las bases celulares y moleculares de la inmunidad PERSPECTIVA HUMANA: Enfermedades autoinmunitarias VÍAS EXPERIMENTALES: La función del complejo mayor de histocompatibilidad en la presentación de antígenos BIOLOGÍA CELULAR Y MOLECULAR Figura 17.1 El sistema inmunitario de humanos incluye órganos linfoides como el timo, la médula ósea, el bazo, los ganglios linfáticos y células dispersas concentradas en placas en el interior del intestino delgado, el apéndice y las amígdalas. A menudo se han descrito al timo y a la médula ósea como el sistema inmunitario central por su participación fundamental en la diferenciación de los linfocitos. (Imagen tomada de Wessner, Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Microbiology, 1e, figura 20.4. John Wiley & Sons Publishers. Reimpresa con autorización de John Wiley & Sons, Inc.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.2 Sinopsis de algunos mecanismos por los cuales el sistema inmunitario elimina del cuerpo a los patógenos invasores. El panel izquierdo muestra varios tipos de inmunidad innata: (a) fagocitosis de una célula bacteriana; (b) destrucción de una célula bacteriana por el complemento; (c) apoptosis inducida en una célula infectada por un linfocito citolítico natural (NK), y (d) inducción de resistencia viral por el interferón α (IFN-α). El panel derecho muestra varios tipos de inmunidad adaptativa: (e) neutralización de una toxina bacteriana mediante un anticuerpo; (f ) célula bacteriana cubierta con anticuerpos (opsonizada), lo que la torna susceptible a fagocitosis o muerte inducida por el complemento, y (g) apoptosis inducida en una célula infectada por un linfocito T activado (célula T). Las respuestas inmunitarias innata y adaptativa están vinculadas entre sí (flecha verde horizontal) porque ciertas células, como las dendríticas y los macrófagos, que fagocitan patógenos utilizan las proteínas ajenas para estimular la producción de anticuerpos específicos y linfocitos T dirigidos contra el patógeno. Las células NK también producen sustancias (p. ej., IFN-γ) que influyen en la respuesta de una célula T. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.3 Micrografía electrónica de barrido de una mosca de la fruta mutante que murió por una infección micótica. El cuerpo está cubierto de hifas fúngicas en germinación. Esta mosca era susceptible a las infecciones porque carecía de un gen Toll funcional. (Imagen tomada de Bruno Lemaitre et al., Cell 86;978, 1996, con autorización de Elsevier. Cortesía de Jules A. Hoffmann.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.4 Modelo de un receptor de tipo Toll (TLR3) unido a una molécula de RNA bicatenario (dsRNA). Los dominios extracelulares para unión a ligando de los TLR contienen una superficie curva amplia compuesta sobre todo por repeticiones abundantes en leucina que brindan flexibilidad en la unión con el ligando. El ligando dsRNA (doble hélice azul y naranja) se une a un dímero de TLR cuyos dominios transmembrana y citoplásmico están en contacto estrecho, como se muestra en este modelo. El complejo está “listo” para enviar una señal intracelular que alerte a la célula sobre la presencia de una molécula de ácido nucleico extraña. (Imagen tomada de Lin Liu et al., cortesía de David R. Davies, Science 320:381, 2008; © 2008. Reimpresa con autorización de la AAAS.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.5 Inmunidad innata. Micrografía electrónica de barrido de un linfocito citolítico natural unido a una célula blanco (en este caso es una célula maligna de eritroleucemia). Los linfocitos NK destruyen sus blancos mediante el mismo mecanismo descrito para los linfocitos T citotóxicos en la página 709. (Imagen tomada de Blood Cells 17:165, 1991, con autorización de Elsevier. Cortesía de Giuseppe Arancia, Departamento de Ultraestructuras, Instituto Superiore Di Sanitá, Roma.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.6 Vías de diferenciación de una célula madre hematopoyética de la médula ósea. Una célula madre hematopoyética puede dar origen a dos células progenitoras diferentes: una mieloide que se diferencia en la mayoría de las células sanguíneas diversas (p. ej., eritrocitos, basófilos y neutrófilos), macrófagos o células dendríticas; o una linfoide que puede diferenciarse en cualquiera de los diversos tipos de linfocitos (NK, B o T). Las precursoras de linfocitos T migran al timo, donde se diferencian en dichas células. En cambio, los linfocitos B se diferencian en la médula ósea. Las células B y T en las diversas etapas de diferenciación pueden distinguirse por las especies de proteínas que hay en su superficie o los factores de transcripción que determinan los genes que se expresan, o ambos. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.7 Selección clonal de los linfocitos B por un antígeno independiente del timo. Los pasos se describen en la figura y también en el texto. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.8 Demostración experimental de que diferentes linfocitos B contienen un anticuerpo distinto unido a la membrana y de que estos anticuerpos se producen en ausencia de un antígeno. En este experimento se prepararon linfocitos B de un bazo de ratón (paso 1). En el paso 2, las células esplénicas se pasan por una columna que contiene cuentas cubiertas con un antígeno (antígeno A) al cual el ratón nunca se había expuesto. Una diminuta fracción de las células esplénicas se une a las cuentas, mientras que la mayor parte pasa de forma directa por la columna (mostrada en el paso 3). En el paso 4, las células esplénicas del experimento previo se pasan por una de dos columnas distintas: una tiene cuentas cubiertas con el antígeno A y la otra cuentas cubiertas con un antígeno no relacionado (antígeno B) al cual el ratón nunca se había expuesto. En el paso 4a, las células esplénicas probadas son las que se unieron a las cuentas en el paso previo. Se observa que estas células se unen otra vez a cuentas cubiertas con el antígeno A, pero no con las cubiertas con el antígeno B. En el paso 4b, las células esplénicas probadas son las que no se unen con las cuentas en el paso previo. Ninguna de estas células se une a cuentas cubiertas con el antígeno A, pero una fracción diminuta se adhiere a las cuentas cubiertas con el antígeno B. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.9 Comparación de la estructura de una célula B (a) y una célula plasmática (b). La célula plasmática tiene un compartimiento citoplásmico mucho más grande que la célula B, con más mitocondrias y un retículo endoplásmico rugoso muy desarrollado. Estas características reflejan la síntesis de grandes cantidades de moléculas de anticuerpo en la célula plasmática. (a-b: con autorización de Steve Gschmeissner/Photo Researchers, Inc.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.10 Células “profesionales” presentadoras de antígenos (APC). (a) Micrografía electrónica de barrido coloreada de una célula de Kupffer (un tipo de macrófago) penetrando los orificios del endotelio que recubren los vasos sinusoidales del hígado. Las células mencionadas pueden ingerir eritrocitos viejos y elementos patógenos y acumularse en sitios de infección o lesión. (b) Micrografía electrónica de barrido a color de una célula dendrítica. Dichas células de bordes irregulares se caracterizan por prolongaciones citoplásmicas largas (o dendríticas) y se concentran en tejidos que revisten las superficies corporales. (a: cortesía de Thomas Deerinck, NCMIR, University of California, San Diego; b: David Scharf/Photo Researchers, Inc.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.11 Imagen de células dendríticas y linfocitos T vivos, y sus interacciones, dentro de un ganglio linfático. Los linfocitos T viajan de un ganglio linfático a otro. Cuando entran a uno de ellos, migran dentro del tejido mientras su superficie es explorada por células dendríticas individuales con las que entran en contacto. (a) Se advierten numerosos linfocitos T marcados por fluorescencia (teñidos de verde, tres de los cuales están indicados por números y marcas) que se desplazan en el interior de un ganglio linfático y se ponen en contacto con DC individuales (en color rojo y señaladas por un asterisco) en un lapso de 2.5 minutos. (b) Trayectoria que siguen cada uno de los tres linfocitos T marcados y la DC indicada con un asterisco, que se incluyeron en la sección a. (c) Contacto dentro del ganglio linfático entre una sola DC (verde) y varios linfocitos T (naranja) en tres dimensiones. Los contactos entre las células son dinámicos y cambian rápidamente su tamaño en décimas de segundo. (a-b: imágenes tomadas de Philippe Bousso y Ellen Robey, Nature Immunol., 4:581, 2003. Reimpresas con autorización de Macmillan Publishers Ltd.; c: imagen tomada de Mark J. Miller et al., cortesía de Michael D. Cahalan, Proc. Nat’l. Acad. Sci. U.S.A. 101:1002, 2004 © 2004, National Academy of Sciences, U.S.A.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.12 Esquema muy simplificado que muestra la función de los linfocitos TH en la formación de anticuerpos. En el paso 1, el macrófago interactúa con el antígeno complejo. Éste se lleva al interior del macrófago y se divide en fragmentos, los cuales se presentan en la superficie celular. En el paso 2, el macrófago interactúa con una célula TH cuyo TCR se une a uno de los fragmentos del antígeno presentados (la proteína de membrana verde es una molécula de MHC, pág. 716). Esta interacción activa al linfocito T. En el paso 3, el linfocito TH activado interactúa con una célula B, cuyo receptor para antígenos está unido a un antígeno soluble intacto. La activación del linfocito B se estimula por citocinas (p. ej., IL-4, IL-5 e IL-6) liberadas por el linfocito TH hacia el espacio que lo separa del linfocito B adyacente. La interacción con el linfocito TH activa al linfocito B, lo que induce proliferación de este último (paso 4). La progenie del linfocito B activado se diferencia en células plasmáticas que sintetizan anticuerpos que pueden unirse al antígeno (paso 5). BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.13 Respuestas de anticuerpos primaria y secundaria. Una respuesta primaria, que se induce por la exposición inicial al antígeno, conduce primero a la producción de moléculas de anticuerpo IgM solubles, seguida de la producción de IgG solubles. Cuando el antígeno se introduce de nueva cuenta, se inicia una respuesta secundaria. En comparación con la reacción primaria, la secundaria comienza con la producción de moléculas de IgG (además de IgM), alcanza un nivel sanguíneo de anticuerpos mucho más alto y ocurre casi sin demora. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.14 Estructura de un anticuerpo. (a) Modelo de listones de una molécula de IgG. Contiene cuatro cadenas polipeptídicas: dos cadenas ligeras idénticas y dos cadenas pesadas iguales. Una de las cadenas pesadas se muestra en azul y la otra en amarillo, mientras que ambas cadenas ligeras se presentan en rojo. Son evidentes los dominios de cada cadena (dos por cada cadena ligera y cuatro por cada pesada). (b) Modelo esquemático que muestra la estructura de dominios de una molécula de IgG. La estructura terciaria de cada dominio de Ig se mantiene por un enlace disulfuro. Los dominios que comprenden una región constante de la cadena polipeptídica se indican con la letra C y los que tienen una región variable se señalan con la letra V. Cada cadena pesada contiene tres regiones CH (CH1, CH2, CH3) y una región VH en el extremo N del polipéptido. Cada cadena ligera posee una región CL y una VL en su extremo N. Las regiones variables de las cadenas ligera y pesada forman un sitio para la combinación de un antígeno. Cada molécula de IgG con forma de Y contiene dos de estos sitios y puede fragmentarse con un tratamiento proteolítico ligero en dos fragmentos Fab que contienen sitios para combinación con antígenos y un fragmento Fc, como se indica. (a: cortesía de Alexander Mcpherson.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.15 Dominios de los anticuerpos. Dibujo esquemático de una cadena ligera λ sintetizada por células de un paciente con mieloma múltiple. El polipéptido se pliega para que las porciones constantes y las variables se presenten en dominios separados. Las flechas gruesas representan cadenas β, que se ensamblan en láminas β. Cada dominio tiene dos de estas estructuras, las cuales se distinguen por los colores rojo y naranja. Los tres segmentos hipervariables (Hv) de la cadena se presentan como asas en un extremo del dominio variable, que forma parte del sitio para combinación con antígenos del anticuerpo. (Imagen reimpresa (adaptada) con autorización de Schiffer et al., Biochemistry 12:4628, 1973. copyright 1973. American Chemical Society.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.16 Interacción antígeno-anticuerpo. Modelo de espacios llenos basado en cristalografía por rayos X de un complejo entre una lisozima (verde) y la porción Fab de un anticuerpo (fig. 17.14). La cadena pesada del anticuerpo es azul y la ligera es amarilla. Un residuo de glutamina de la lisozima aparece en rojo. (Imagen tomada de G. Amit, R. A. Mariuzza, S. E. V. Phillips, y R. J. Poljak, Science 233:749, 1986; ©1986, reimpresa con autorización de la AAAS.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.17 Demostración experimental de que los genes que codifican las cadenas ligeras de los anticuerpos se forman por reordenamiento del DNA. Primero se extrae DNA de células embrionarias o células cancerosas productoras de anticuerpos y se fragmenta con una endonucleasa de restricción (paso 1) que divide ambas cadenas del DNA en una secuencia específica. Los fragmentos de ácido nucleico de las dos preparaciones se fraccionan por separado mediante electroforesis en gel; se preparan dos geles idénticos de cada muestra de DNA (paso 2). Después de la electroforesis, cada gel se incuba con una sonda marcada que contiene la secuencia genética variable (V) o la constante (C) (paso 3). La localización del DNA marcado y unido en el gel se revela por autorradiografía y se muestra en la parte inferior de la figura. En tanto las secuencias génicas V y C se localizan en fragmentos separados en el DNA de células embrionarias, las dos secuencias se localizan en el mismo fragmento pequeño de DNA en las células productoras de anticuerpos. Las secuencias génicas V y C se unen durante el desarrollo de los linfocitos B por un proceso de reordenamiento del DNA. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.18 Reordenamientos del DNA que conducen a la formación de un gen funcional que codifica una cadena _ de inmunoglobulina. La organización de las secuencias de DNA variable (V), de unión ( J) y constante (C) dentro del genoma se muestra en el paso 1. Los pasos que conducen a la síntesis del mRNA maduro que codifica el polipéptido de la cadena κ se describen en el texto. La unión aleatoria de un segmento V y uno J (pasos 2 y 3) determina la secuencia de aminoácidos del polipéptido. El espacio entre el segmento J “elegido” y el segmento C (que puede contener uno o más segmentos J, como se muestra en la figura) permanece como un intrón en el gen. La porción del transcrito primario (paso 4) que corresponde a este intrón se elimina durante el procesamiento del RNA (paso 5). El reordenamiento del DNA y la transcripción subsiguiente del gen “pegado” ocurre sólo en un alelo de cada célula, lo que asegura que la célula sólo expresará una cadena κ. El otro alelo en el cromosoma homólogo casi siempre permanece inalterado y no se transcribe. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.19 Ordenamiento de los genes C para las diversas cadenas pesadas humanas. En las personas, las cadenas pesadas de IgM, IgD e IgE las codifica un solo gen, mientras que las de IgG provienen de cuatro genes diferentes y las de IgA de dos genes distintos (véase la nota al pie de la pág. 711). BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.20 Estructura de los receptores de antígenos de un linfocito B y uno T. (a) El BCR de un linfocito B es una versión unida a la membrana de una inmunoglobulina relacionada con un par de cadenas α no variables y dos cadenas β no variables. Las cadenas α y las β también son miembros de la superfamilia de Ig. (b) El TCR de un linfocito T consiste en una cadena polipeptídica α y β unida por un puente disulfuro. Cada polipéptido contiene un dominio variable que forma el sitio de unión para el antígeno y un dominio constante. El TCR se relaciona con seis polipéptidos invariables más de la proteína CD3, como se indica en la ilustración. (Una pequeña fracción de los linfocitos T posee un tipo diferente de TCR formado por una subunidad λ y una δ. Estas células no se limitan al reconocimiento de los complejos MHC-péptido y su función aún no se conoce por completo.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.21 Las APC humanas pueden presentar una gran cantidad de péptidos. (a) Modelo esquemático de la variedad de moléculas de MHC clase I que puede tener un individuo. Esta molécula es codificada por diversos genes, tres de los cuales están representados por un gran número de alelos. Este individuo particular es heterocigoto en los loci HLA-A, HLA-B y HLA-C y homocigoto en los loci HLA-E, HLA-F y HLA-G, lo que permite generar un total de nueve moléculas de MHC clase I distintas. (La diferencia entre los MHC clases I y II se describe en la pág. 717.) (b) Modelo esquemático que ilustra la variedad de péptidos que pueden ser presentados por la proteína codificada por un solo alelo del MHC. (La abreviatura “HLA” significa en inglés “human leukocyte antigen” [antígeno leucocitario humano], lo cual refleja el descubrimiento de dichas proteínas en la superficie de los leucocitos.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.22 Interacción entre una APC y un linfocito T durante la presentación del antígeno. (a) Micrografía electrónica de los dos tipos de células durante su interacción. (b) Modelo esquemático que muestra algunas de las proteínas que intervienen en la interacción entre una APC y un linfocito T citotóxico (CTL) o una célula T cooperadora (TH). El reconocimiento del antígeno ocurre cuando el TCR del linfocito T identifica un fragmento peptídico del antígeno unido a una hendidura en una molécula de MHC de la APC. Como se explica en el texto, los CTL reconocen antígenos unidos a moléculas de MHC clase I, en tanto que los linfocitos TH identifican antígenos presentados por moléculas MHC clase II. CD8 y CD4 son proteínas integrales de membrana expresadas por los dos tipos de linfocitos T, que se unen a las moléculas de MHC de las clases I y II, respectivamente. CD8 y CD4 se describen como correceptores. (No se muestran otras muchas proteínas que aparecen en estas zonas de interacción intercelular; consúltese Nat. Revs. Immunol. 11:672, 2011.). (a: imagen tomada de Alan S. Rosenthal, Regulation of the Immune Response— Role of the Macrophage, New England Journal of Medicine, Noviembre 1980, vol. 303, #20, pág. 1154 © 1980 Massachusetts Medical Society; b: imagen tomada de L. Chatenoud, Mol. Med. Today 4:26, 1998. Molecular Medicine Today de Elsevier Trends Journals. Reproducida con autorización de Elsevier Trends Journals en el formato de libro de texto vía copyright Clearance Center.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.22 Interacción entre una APC y un linfocito T durante la presentación del antígeno. (Continuación) (c) Micrografía de fluorescencia que muestra la sinapsis inmunitaria entre una APC y un linfocito T. Los TCR de los linfocitos T se ven en color verde, y las moléculas de MHC clase II de la APC en rojo. La localización concomitante de los TCR y las moléculas de MHC genera la fluorescencia amarilla en la sinapsis inmunitaria. (c: imagen tomada de B. A. Cobb et al., Cell 117:683, 2004, fig. 6c. Reimpresa con autorización de Elsevier. Por cortesía de Dennis L. Kasper.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.23 Vías clásicas de procesamiento de antígenos que se relacionan con moléculas de MHC clases I y II. (a) Vía propuesta para el ensamble de un complejo MHC clase I-péptido. Esta vía ocurre en casi todos los tipos de células. En el paso 1, la cadena pesada de la proteína del MHC se sintetiza en un ribosoma unido a la membrana y se traslada a la membrana del ER. La cadena pesada del MHC se relaciona con calnexina (paso 2), una chaperona localizada en la membrana del ER, y el complejo dimérico se une con la cadena invariable _2m (paso 3). Luego, el complejo MHC se relaciona con otra proteína de la membrana del ER, llamada TAP (paso 4). Mientras tanto, los antígenos citosólicos son introducidos en proteasomas (paso A) y se degradan en péptidos pequeños (paso B). Los péptidos son transportados al interior del retículo endoplásmico por acción de la proteína TAP, sitio en el cual son “recortados” por una peptidasa del ER (que no se muestra) hasta alcanzar su longitud final. En este punto, los péptidos en cuestión quedan unidos al surco de la molécula de MHC (fase 5) con el auxilio de un gran complejo de chaperonas, que en la figura está señalado con las iniciales PLC. Éste y la calnexina se disocian del complejo MHC (paso 6), que se transporta por la vía biosintética/secretora a través del aparato de Golgi (paso 7) hasta la membrana plasmática, donde está listo para interactuar con el TCR de un linfocito T citotóxico. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.23 Vías clásicas de procesamiento de antígenos que se relacionan con moléculas de MHC clases I y II. (Continuación) (b) Una vía propuesta para el ensamble de un complejo MHC clase II-péptido. Esta vía ocurre en las células dendríticas y otras APC profesionales. En el paso 1, la proteína del MHC se sintetiza en un ribosoma unido a la membrana y se traslada al interior de la membrana del ER, donde se relaciona con Ii (paso 2), una proteína trimérica que bloquea el sitio de unión MHC-péptido. El complejo MHC-Ii pasa por el aparato de Golgi (paso 3) y al interior de una vesícula de transporte (paso 4). Mientras tanto, la APC capta un antígeno proteínico extracelular por endocitosis (paso A) y lo entrega a un lisosoma (paso B), donde el antígeno se fragmenta en péptidos. El lisosoma que contiene los fragmentos antigénicos se fusiona con la vesícula de transporte que contiene el complejo MHC-Ii (paso 5), lo que conduce a la degradación de la proteína Ii y la relación entre el fragmento peptídico antigénico y la molécula de MHC clase II (paso 6). El complejo MHC-péptido se transporta a la membrana plasmática (paso 7), donde está listo para interactuar con el TCR de un linfocito TH. (Nota: no todos los antígenos exógenos siguen la vía clásica del MHC clase II mostrada en la sección b. También existe una vía por la cual las APC captan antígenos exógenos por endocitosis y los degradan en péptidos, que luego se unen y presentan en moléculas de MCH de clase I. Esta vía de presentación cruzada, como se le llama, permite que los CTL se activen por un antígeno exógeno que de otra manera pasaría “desapercibido”.) (a-b: imagen tomada de D. B. Williams et al., Trends Cell Biol 6:271, 1996. Trends in Cell Biology de Elsevier Ltd. Reproducida con autorización de Elsevier Ltd en el formato de libro de texto vía copyright Clearance Center.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.24 Los péptidos producidos por el procesamiento de antígenos se unen dentro de una hendidura del MHC. Estos modelos ilustran la unión de péptidos a una molécula de MHC clase I (a) y a otra de clase II (b). Las superficies de las moléculas de MHC se muestran en blanco y el péptido en el sitio de unión en color. El péptido que se muestra en la figura a deriva de la proteína de la matriz del virus de la influenza, y el péptido de la imagen b proviene de la proteína hemaglutinina del virus de la influenza. El extremo N de cada péptido está a la izquierda. (a-b: cortesía de T. Jardetzky; Trends Biochem. Sci. 22:378, 1997, fig.1, con autorización de Elsevier Science.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.25 Determinación del destino de un linfocito T recién formado en el timo. En el timo se lleva a cabo un proceso de detección que selecciona linfocitos T con TCR apropiados. (a) Los linfocitos T cuyo TCR posee una gran afinidad por moléculas de MHC que llevan péptidos propios se eliminan por apoptosis (selección negativa). (b) Aquellos cuyo TCR no reconoce a las moléculas de MHC que llevan péptidos propios también mueren por apoptosis (muerte por abandono). (c) En cambio, los linfocitos T cuyo receptor muestra una débil afinidad por moléculas de MHC con péptidos propios sobreviven (selección positiva) para constituir la población de linfocitos T periféricos del cuerpo. BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Figura 17.26 Activación de los linfocitos. (a) Esquema de la inter acción entre una APC profesional, en este caso una célula dendrítica madura, y un linfocito TH. La especificidad en esta interacción entre células ocurre cuando el TCR de la célula TH identifica el complejo MHC clase II-péptido presentado en la superficie de la célula dendrítica. La interacción entre el CD28 del linfocito T y una proteína B7 de la célula dendrítica genera una señal coestimuladora inespecífica necesaria para la activación del linfocito T. (Recuadro) Micrografía electrónica de barrido de una célula dendrítica madura (naranja) que presenta antígenos a varios linfocitos T (verde). (b) Esquema de la interacción entre un linfocito TH activado y un linfocito B. La especificidad de esta interacción entre células se debe a que el TCR de la célula TH reconoce el complejo MHC clase IIpéptido presentado en la superficie del linfocito B. El péptido presentado por esta célula procede de las moléculas de proteína que al principio se unieron a los BCR en la superficie celular. Tales antígenos unidos se captan por endocitosis, se fragmentan en los lisosomas y se unen a moléculas de MHC clase II, como en la figura 17.23b. (a-b: imagen tomada de E. Lindhout et al., Immunol Today 18:574, 1997. Immunology Today de Elsevier Sci Ltd/U. K. Reproducida con autorización de Elsevier Sci Ltd/U. K., en formato de libro de texto vía copyright Clearance Center. Fotografía del recuadro; tomada de Peter Friedl, Nature Revs. Immunology 5:533, 2005, fig. 1a. Imagen central; reimpresa con autorización de Macmillan Publishers Limited.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Perspectiva Humana Figura 1 Exantema en forma de mariposa, un síntoma temprano común del lupus eritematoso sistémico. (Cortesía de la Lupus Foundation of America, Inc.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Vías Experimentales Figura 1 (a) Representación esquemática de una molécula de MHC clase I, en este caso la proteína humana HLA-A2. La molécula consiste en dos subunidades: una cadena pesada formada por tres dominios (α1, α2 y α3) y una cadena β2m. La porción de la cadena pesada que cruza la membrana se conectaría con el polipéptido en el sitio marcado con la letra C (por el carboxilo terminal). Los enlaces disulfuro se indican como dos esferas conectadas. La hendidura para unión con el péptido se muestra en la parte superior del dibujo, entre los segmentos helicoidales α de los dominios α1 y α2 de la cadena pesada. (b) Representación esquemática del saco para unión para péptidos de la proteína del MHC vista desde la parte superior. La región inferior del saco está recubierta por una lámina β (flechas naranja-púrpura) y las paredes por hélices α (verde). El dominio α1 se muestra en naranja y verde claro; el dominio α2 aparece en púrpura y verde oscuro. (Imagen tomada de Pamela J. Bjorkman et al., Nature 329:508, 509, 1987, fig. 2a, 2b; reimpresa con autorización de Macmillan Publishers Ltd.) BIOLOGÍA CELULAR Y MOLECULAR Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Vías Experimentales Figura 2 Modelos tridimensionales de un péptido (mostrado como estructura de esferas y varillas) adherido dentro del saco para unión con antígenos de un MHC clase I de ratón (H-2Kb). El péptido en la imagen a posee ocho residuos de aminoácidos; el péptido en b está formado por nueve residuos. Los péptidos se ven incrustados en la profundidad de la hendidura de unión del MHC. (Imagen tomada de Masazumi Matsumura, Daved H. Fremont, Per A. Peterson, e Ian A. Wilson, Science 257:932, 1992. © 1992. Reimpresa con autorización de la AAAS.) BIOLOGÍA CELULAR Y MOLECULAR Figura 3 Representación de la interacción entre un complejo MHC-péptido (en la parte inferior) y un TCR (en la parte superior). Las regiones hipervariables (CDR) del TCR se muestran como asas coloreadas que forman la interfase entre las dos proteínas. El péptido unido (P1-P8) se muestra en amarillo-verde situado dentro de la hendidura de unión de la molécula de MHC clase I. Las columnas de los péptidos se representan como tubos. (Imagen tomada de K. Todos los derechos reservados. McGraw-Hill Interamericana Editores Capítulo 17. Respuesta inmunitaria Christopher Garcia et al., cortesía de Ian Wilson, Science 274:217, 1996, fig. 9d, © 1996. Reimpresa con autorización de la AAAS.)
© Copyright 2026