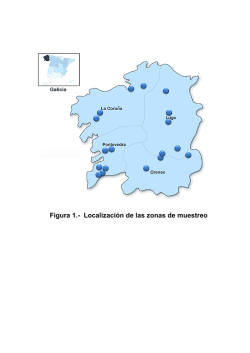
Calidad de Agua Superficial - Ministerio de Ecología y RNR
Proyecto Monitoreo de Calidad de Aguas Provincia de Misiones Plan Estandarizado de Muestreos de Calidad de Agua Superficial Director: Dr. Nahuel F. Schenone Grupo Técnico Asesor: Dr. Hernán Moscuzza Dr. Esteban Avigliano Dr. Juan José Rosso Dr. Ezequiel Mabragaña Plan Estandarizado de Muestreos de Calidad de Agua Superficial Proyecto Monitoreo de Calidad de Aguas - Provincia de Misiones Elaborado por: Ministerio de Ecología y Recursos Naturales Renovables de la Provincia de Misiones www.ecologia.misiones.gov.ar Fundación Bosques Nativos Argentinos para la Biodiversidad www.bosques.org.ar ISBN 978-987-33-5119-8 Edición Dr. Nahuel F. Schenone Contenidos Dr. Nahuel F. Schenone, Dr. Hernán Moscuzza, Dr. Esteban Avigliano, Dr. Juan José Rosso, Dr. Ezequiel Mabragaña Fotos Lic. Esteban Avigliano Esquemas Dr. Hernán Moscuzza Diseño Daniela Delceggio (www.danieladelceggio.com.ar) Impreso en Argentina 1ra Edición Permitida la reproducción total o parcial, almacenamiento o carga de esta publicación (en cualquier formato) citando fuente: Ministerio de Ecología y Recursos Naturales Renovables de la Provincia de Misiones, Fundación Bosques Nativos Argentinos para la Biodiversidad. 2014. Plan Estandarizado de Muestreos de Calidad de Agua Superficial. Primera Edición. Proyecto Monitoreo de Calidad de Aguas - Provincia de Misiones. Autoridades Provinciales Gobernador de la Provincia: Dr. MAURICE FABIAN CLOSS Vice Gobernador de la Provincia: Lic. HUGO MARIO PASSALACQUA Presidente de la Honorable Cámara de Representantes: Ing. CARLOS EDUARDO ROVIRA Ministra de Ecología y Recursos Naturales Renovables: Mgter. Arq.VIVIANA ROVIRA PRÓLOGO E l Ministerio de Ecología y Recursos Naturales Renovables es la autoridad de aplicación en materia de recursos naturales, entre ellos el agua, elemento vital y fundamental para la vida. La provincia de Misiones cuenta con una extensa red hidrográfica superficial que se muestra como una densa trama sobre el territorio, es la base de sustento no solo del desarrollo económico productivo y social de Misiones sino también es el elemento soporte que compartimos con el sustrato biológico que constituye la Selva Paranense, existente en forma contínua únicamente en Misiones y que contiene más del 50% de la biodiversidad de la República Argentina. Proyecto Monitoreo de Calidad de Aguas Provincia de Misiones Plan Estandarizado de Muestreos de Calidad de Agua Superficial Las aguas superficiales, cuando el escurrimiento de las mismas convergen hacia un mismo cauce, definen el espacio territorial que denominamos cuenca hidrográfica, esta delimitación natural del curso de un río y el espacio donde se colecta el agua es considerado como una unidad territorial en el Ordenamiento Territorial y la Planificación Estratégica. En este marco el ordenamiento integral y gestión de cuencas hidrográficas se inicia con el diagnóstico en los aspectos físicos, bióticos, e hidrológicos de la misma, utilizando la zonificación ambiental como herramienta para la planificación y uso racional de los recursos naturales y las medidas y tecnologías que son necesarias para abordar los escenarios de situaciones o problemas que se presentan a través de la prospectiva como parte de la ordenación de la Cuenca, en el contexto particular de la eco-región de la Selva Paranaense, recientemente la sanción de la Ley Provincial XVI Nº 105 de Ordenamiento Territorial de los Bosques Nativos en el año 2010, se ha constituido en el primer instrumento normativo de OT de la Provincia. Es nuestra responsabilidad desarrollar las medidas y acciones necesarias para asegurar la sostenibilidad del recurso natural agua, fuente de vida y de progreso. Sin embargo la gestión de un recurso tan estratégico demanda un conocimiento profundo de su naturaleza, sus procesos, y de cómo el accionar del hombre lo condiciona y afecta; y de cuan dependiente es de su disponiblidad. En este sentido las políticas provinciales, legislativas y ejecutivas, en un sentido prospectivo y visionario vienen implementando acciones concretas a favor de preservar este recurso; la creación del Corredor Verde, del Sistema de Áreas Naturales Protegidas, el impulso y apoyo a la conformación de los comites de cuencas son solo algunas de tantas acciones que como responsable de la gestión del agua y las cuencas hidrográficas, nos caben. Es en el marco de esta política de implementación de acciones concretas, que el Ministerio de Ecología y RNR lleva adelante trabajos de articulación y cooperación interinstitucional. En este caso el Plan Estandarizado de Muestreos de Calidad de Agua Superficial, elaborado por la Fundación Bosques Nativos Argentinos para la Biodiversidad se diseña pensando en generar una herramienta para la gestión ambiental, sumamente valiosa, con la cual se incorporarán conocimientos del recurso altamente demandados por la sociedad en su conjunto. Mgter. Arq.VIVIANA ROVIRA Ministra de Ecología y Recursos Naturales Renovables INDICE ALCANCES 6 DISEÑO DEL MUESTREO27 OBJETIVOS7 Área de Estudio27 MARCO TEÓRICO8 Puntos de Muestreo27 Características de los cuerpos de agua superficial 8 Duración28 Los Recursos Hídricos Superficiales de la Provincia de Misiones 9 Frecuencia28 El valor de los Recursos Hídricos 11 Parámetros29 La calidad del agua superficial 13 Logística previa 30 MONITOREO 16 Hoja de ruta 31 ¿Por qué monitoreamos? 16 Preparación de materiales 32 ¿Qué parámetros se monitorearán?17 Envases contenedores para muestras y métodos de conservación 33 Control de los equipos 34 Preparación de Blancos 35 Blancos de Campo (BC) 35 Blanco de Transporte (BT) 36 Blanco de Envases (BE) 36 Blanco de Equipamiento (BEq) 36 Preparación del Vehículo 37 Embarcaciones 37 CAMPAÑA DE MUESTREO 38 Detención del vehículo 38 Recolección de datos in situ 38 Toma de muestras en terreno 39 Acondicionamiento de las muestras 41 Rotulado 42 Preservación de las muestras 42 LOGÍSTICA POST-MUESTREO 43 Remisión de muestras al laboratorio 43 ¿Dónde se tomarán las muestras?17 ¿Cuándo muestreamos?17 ¿Cómo muestreamos?17 ¿Cómo utilizamos los datos? 18 PARÁMETROS QUE DEFINEN LA CALIDAD DEL AGUA 20 Temperatura 20 Conductividad Eléctrica 20 pH21 Oxígeno disuelto21 Salinidad21 Turbidez22 Sólidos totales en suspensión22 Sólidos totales disueltos22 Fósforo total 23 Fósforo Soluble 23 Nitrógeno en forma de amoníaco/amonio 23 Nitrógeno en forma de nitrato/nitrito 23 Mantenimiento de los equipos 43 Clorofila a 24 RESULTADOS 44 Demanda bioquímica de oxígeno (DBO) 24 Informatización de la información 44 Elementos traza 25 Confección del informe 45 Pesticidas 25 REFERENCIAS BIBLIOGRÁFICAS 46 Análisis microbiológicos 26 ANEXO 47 GLOSARIO 50 ALCANCES OBJETIVOS Promover el diseño de monitoreos estandarizados en la provincia de Misiones y sentar las bases para la generación de estrategias de monitoreo basados en las experiencias enmarcadas en el “Proyecto de Monitoreo de Calidad de Aguas, Provincia de Misiones”. El Plan Estandarizado de Muestreos de Calidad de Agua Superficial impulsa a la generación de líneas de base y monitoreo de la calidad de los recursos hídricos superficiales de la provincia de Misiones y surge de la necesidad de su preservación y de su gestión sustentable. Está basado en una recolección de datos precisos, fiables, imparciales, sistematizados y distribuidos estratégicamente en tiempo y espacio. Esta fuente de información es de utilidad para los tomadores de decisión y los sectores públicos y privados que intervienen como usuarios o gestores de estos recursos. La definición de una línea de base de la calidad del agua de los recursos hídricos superficiales surge del monitoreo y es el paso inicial para definir su estado actual, y en consecuencia, su uso aceptable para diferentes fines (consumo humano, consumo animal, recreación, riego, industrial, ) así como también para la protección de la biodiversidad asociada. El monitoreo periódico es de utilidad para evaluar variaciones en la calidad del recurso, y así de ser necesario, intervenir sobre las causas que lo estén afectando, de forma rápida y consistente con las cuestiones vinculadas a su solución. El Plan Estandarizado de Muestreos de Calidad de Agua Superficial está confeccionado bajo la premisa de un instrumento ameno, de fácil lectura para su aplicación, basado en un método científicamente sólido que incluye protocolos, procedimientos y prácticas recomendadas para la recolección de muestras, su remisión a laboratorios de referencia y la sistematización de la información. 6 Objetivos Específicos Proveer la información para generar el entendimiento y la relevancia de la importancia de los muestreos y planes de monitoreo. Definir las variables de calidad de agua consideradas de importancia estratégica para la provincia de Misiones. Generar una base de aplicación en terreno con los aspectos técnicos y científicos para consolidar muestreos estandarizados. Consolidar una línea de acción que impulse el uso estratégico de la información generada en monitoreos. 7 MARCO TEÓRICO Figura 1: Procesos que intervienen en la recarga de cuerpos de agua superficial Características de los cuerpos de agua superficial Para diseñar con eficacia y/o llevar a cabo un programa de muestreo de aguas superficiales deben considerarse una serie de conceptos de hidrología. Los ríos o cuerpos lóticos son ecosistemas continuos con organización longitudinal, regulados por la energía entrante. Se caracterizan por presentar una heterogeneidad espacio-temporal y son influidos por un gran número de factores, lo que dificulta su estudio. Las variaciones espacio-temporales de estos cuerpos de agua tienen influencia directa sobre la dinámica de nutrientes. Las propiedades físicas y biológicas de los sistemas lóticos reflejan las características del clima, de la geología, de las particularidades de la cuenca, de la vegetación circundante y de la acción antropogénica. El agua puede acceder a ríos y arroyos a través de diversas fuentes y mediante procesos diversos tales como: - precipitación directa sobre su superficie, - escorrentía superficial en episodios de precipitaciones copiosas con traslado de materiales de los estratos superficiales del suelo, - escorrentía subsuperficial desde la zona no saturada del suelo y - flujo desde cuerpos de agua subterránea, principalmente desde la capa freática o primera napa (Figura 1). 8 Precipitación ZONA NO SATURADA Escorrentía Superficial Escorrentía Subsuperficial AGUA SUPERFICIAL NIVEL FREÁTICO ZONA SATURADA O CAPA FREÁTICA Flujo subterráneo Los Recursos Hídricos Superficiales de la Provincia de Misiones La provincia de Misiones presenta características hidrológicas bien definidas, ya que incluso sus límites políticos se hallan prácticamente delimitados en su totalidad por cursos de aguas. Los grandes ríos Paraná (al oeste) y Uruguay (al este), prácticamente paralelos en el sentido de la mayor longitud (SO-NE), y el río Iguazú (al norte) conforman los colectores principales de este sistema fluvial. La región cubre de este modo dos vertientes principales, a ambos lados de un cordón serrano central cuya altimetría de la región oscila entre los 350 m y los 500 m. En total se conforman 62 cuencas hidrográficas, perteneciendo 27 a la cuenca del Paraná, 27 a la cuenca del Uruguay y 8 a la cuenca del Iguazú (Figura 2). 9 MARCO TEÓRICO Figura 2: Cuencas hidrográficas de Misiones (Adaptado de Min. Eco. y R.N.R.) PARAGUAY BRASIL Las ondulaciones propias de la provincia de Misiones que definen las cuencas de los ríos Paraná, Uruguay e Iguazú incluyen: al norte, las serranías conocidas con el nombre de Victoria, y en el centro, con dirección norestesudoeste, las sierras de San José, del Imán o Itacuará y de Misiones. La serie de cuencas de arroyos afluentes al Río Paraná se ubican sobre la ladera occidental de las sierras misioneras y llegan a incluir a una pequeña porción del noroeste correntino. Forman un rectángulo de unos 300 km de largo por 100 km de ancho (29.801 km2), entre los 25°38´ y 28°10´ latitud sur, y los 53°38` y 56°05´ longitud oeste. Las cuencas de los cuerpos de agua afluentes al Río Uruguay se generan en la ladera oriental de las sierras misioneras. La suma de las pequeñas cuencas de ríos y arroyos expresan un total de 9.752 km2, conformando un rectángulo de aproximadamente 280 Km de largo por 80 km de ancho. 10 Las cuencas de los cuerpos lóticos afluentes al río Iguazú (tributario del río Paraná), se localizan en el extremo noreste en la provincia de Misiones ocupando una superficie aproximada de 1.784 km2. La mayoría de las cuencas se emplazan íntegramente en el territorio provincial. Sólo 4 cuencas son compartidas con otras jurisdicciones: en la vertiente al Iguazú, la cuenca del arroyo San Antonio es compartida con Brasil; en la vertiente al Uruguay, la cuenca del Pepiri Guazú es compartida con Brasil, y la cuenca del arroyo Chimiray lo es con la provincia de Corrientes; finalmente, en la vertiente del Paraná, la cuenca del arroyo Itaembé también es compartida con Corrientes. La disposición hidrográfica, las características orográficas y edáficas, junto con las condiciones climáticas húmedas y el marcado régimen pluviométrico son muy favorables para el escurrimiento superficial y el transporte de partículas y contaminantes. La mayoría de las cuencas se emplazan íntegramente en el territorio provincial. El valor de los Recursos Hídricos El valor que tradicionalmente se le atribuye a los cuerpos de agua superficial radica en su factibilidad de uso como fuente de consumo humano, animal, recreativo e industrial, así como fuente de producción de energía y alimentos. Actualmente, se reconocen valores relacionados con el desarrollo y mantenimiento de la biodiversidad local y regional, el asentamiento de organismos migratorios, la capacidad de moderación de la amplitud del clima local y la atenuación de fenómenos de inundaciones. Históricamente en las márgenes de los ríos, en general, se han asentado los emplazamientos humanos y se han desarrollado las actividades agroindustriales. Esto puede llevar a que sus aguas se deterioren con los aportes de nutrientes y xenobióticos producidos por las actividades 11 MARCO TEÓRICO Figura 3: Efectos ambientales de las actividades antrópicas La calidad del agua superficial B G A C X XXX XXX X F E D H REFERENCIAS Deposición atmosférica de nutrientes Descarga de nutrientes y xenobióticos Retención de nutrientes y xenobióticos A Actividades agrícolas B Monte nativo C Áreas desmontadas D Núcleo urbano E Plantas de tratamiento de efluentes F Actividades industriales G Actividades ganaderas H Humedales desarrolladas en sus márgenes. Las masas boscosas y los humedales son áreas naturales de retención de nutrientes y xenobióticos (Figura 3). El desmonte y la habilitación de áreas naturales para fines agro-ganaderos, disminuye la capacidad de retención de nutrientes y xenobióticos, pudiendo acelerar potenciales procesos de contaminación de los cuerpos de agua. Además, los cursos de agua han experimentado cambios en el patrón de flujo debidos al drenaje de humedales y a las canalizaciones lo que ha llevado a modificaciones en la dinámica hidrológica, reduciendo significativamente la capacidad de retención y acelerando el transporte de nutrientes. Como resultado de la considerable entrada de nutrientes, la eutrofización de los cuerpos de agua constituye uno de los principales problemas en el planeta que afecta la calidad del agua y consecuentemente la biodiversidad de los ecosistemas acuáticos. 12 Las actividades realizadas por el hombre introducen modificaciones en los flujos del ciclo natural del agua, contribuyendo a su degradación, cuyas consecuencias son la pérdida de su calidad y la disminución del recurso disponible. El elevado poder de dilución, la capacidad termorreguladora y la absorción de determinadas radiaciones hacen del agua el vehículo natural de eliminación de los residuos generados por la acción antrópica. Las principales fuentes de contaminación de los cuerpos de agua superficial incluyen a las actividades agrícola-ganaderas, las actividades y vertederos industriales, y los residuos urbanos. Estas fuentes pueden clasificarse en puntuales y no puntuales. Una fuente puntual de contaminación de agua es única, identificable y localizada, su denominación se debe a que, en una modelación matemática, puede aproximarse a un punto para simplificar su análisis. Las fuentes no puntuales o difusas de contaminación del agua incluyen mayormente a escorrentías que transportan partículas, nutrientes y contaminantes desde áreas agrícolas y núcleos urbanos de considerables dimensiones hacia los cuerpos de agua superficial. Las aguas superficiales pueden recibir cantidades excesivas de nutrientes (nitrógeno y fósforo), por los vertidos urbanos e industriales y el arrastre de abonos agrícolas. El exceso de nutrientes provoca un crecimiento exponencial de algas unicelulares que consumen gran parte del oxígeno disuelto y de esta manera pueden afectar a la vida acuática y hasta producir la muerte por asfixia de la fauna y flora. Por otra parte, el proceso se ve agravado ya que estas algas aumentan la turbidez del agua, interfiriendo en el ingreso de los rayos solares en profundidad. La calidad del agua de los cuerpos superficiales se define a partir de sus características físicas, químicas y microbiológicas que se ven influenciadas por el propio ciclo del agua, las características del suelo, el relieve del terreno y de las actividades antrópicas relacionadas a los mismos. En la figura 4 se ejemplifican y resumen las aproximaciones teóricas vinculadas a los efectos de las actividades rurales (A) y urbanas (B) sobre los cuerpos de agua superficiales. Es importante resaltar que es un resumen y, que en cada caso en particular deben evaluarse de manera directa las fuentes puntuales de emisiones de contaminación de manera de poder abordar los monitoreos con mayor detalle técnico. Las actividades realizadas por el hombre introducen modificaciones en los flujos del ciclo natural del agua, cuyos efectos pueden afectar su calidad y la disminución del recurso disponible. 13 MARCO TEÓRICO MARCO TEÓRICO Figura 4A Identificación de usos del suelo en áreas rurales que pueden afectar a un cuerpo de agua superficial. DESMONTE Y LIMPIEZA DE TERRENOS - Conversión de áreas rurales por deforestación - Habilitación de erras para ac vidades agroganaderas EXISTENCIAS GANADERAS - Acceso de ganado al río para abrevar - Presencia de sistemas intensivos CONTROL DE PLAGAS Y MALEZAS - Fumigaciones de cul vos APLICACIÓN DE FERTILIZANTES - Mejoras en índices de cosechas - Mejoras en suelos Figura 4B. Identificación de fuentes puntuales de contaminación en áreas urbanas. DESMONTE Y LIMPIEZA DE TERRENOS - Conversión áreas rurales a residenciales - Construcción de viviendas Potencial movimiento desde el terreno hacia el río de Materia orgánica (vegetación en descomposición) Sedimento Materia orgánica (materia fecal) Pes cidas y herbicidas Nutrientes (nitrógeno y fósforo) - Exceso de nutrientes - Muerte de peces - Eutrofización - Exceso de nutrientes - Muerte de peces - Eutrofización - Degradación del hábitat - Pérdida de especies - Amenaza a la salud pública - Exceso de nutrientes - Eutrofización Determinaciones analícas indicadas para el monitoreo de los procesos definidos - Turbidez - Sólidos totales en suspensión - Conduc vidad eléctrica 14 - Oxígeno disuelto - Carbono orgánico disuelto - Demanda bioquímica de oxígeno - Nitrógeno total y fracciones solubles - Fósforo total y fracciones solubles - Clorofila a - Oxígeno disuelto - Carbono orgánico disuelto - Demanda bioquímica de oxígeno - Nitrógeno total y fracciones solubles - Fósforo total y fracciones solubles - Clorofila a - Análisis microbiológicos coliformes fecales - Demanda Biológica de Oxígeno - Pes cidas y herbicidas (organoclorados y organofosforados, atrazina, glifosato) - Nitrógeno total y fracciones solubles - Fósforo total y fracciones solubles - Clorofila a - Fer lizantes - Control de malezas QUÍMICOS PARA EL HOGAR Y AGUA SERVIDA INDUSTRIA LIGERA - Estaciones de servicio - Talleres de automóviles - Metalúrgicas - Control de plagas y malezas - Detergentes - Limpiadores Potencial movimiento desde el terreno hacia el río de Nutrientes (nitrógeno y fósforo) Sedimento Potencial efecto en el río - Degradación del hábitat - Pérdida de especies CUIDADO Y MANTENIMIENTO DE ESPACIOS VERDES Pes cidas y herbicidas Hidrocarburos Metales pesados Pes cidas y herbicidas - Degradación del hábitat - Pérdida de especies - Amenaza a la salud pública - Degradación del hábitat - Pérdida de especies - Amenaza a la salud pública Detergentes Drenaje de aguas domés cas Potencial efecto en el río - Degradación del hábitat - Reducción de la biodiversidad - Exceso de nutrientes - Eutrofización - Degradación del hábitat - Pérdida de especies - Amenaza a la salud pública - Degradación del hábitat - Pérdida de especies - Amenaza a la salud pública - Degradación del hábitat - Pérdida de especies - Amenaza a la salud pública Determinaciones analícas indicadas para el monitoreo de los procesos definidos - Turbidez - Sólidos totales en suspensión - Nitrógeno total y fracciones solubles - Fósforo total y fracciones solubles - Clorofila a - Herbicidas (principalmente glifosato y simazina) - Pes cidas - Aceites y grasas - Bencenos - Hidrocarburos poliaromá cos - Hidrocarburos recuperables totales - Hidrocarburos totales derivados del petróleo - Metales pesados (Aluminio, Arsénico, Cadmio, Cromo, Cobre, Hierro, Mercurio, Níquel, Plomo, Zinc) - Pes cidas y - Detergentes herbicidas ca ónicos, (organoclorados y aniónicos y organofosforados, no-iónicos glifosato) - Mismos parámetros que Figura 4A en Existencias Ganaderas(*) 15 MONITOREO temas de definición de prioridades y los límites que va a tener el monitoreo. Siguiendo con una línea de pensamiento constructivo surgen las siguientes preguntas vinculadas al Diseño del Monitoreo: MONITOREO Toda actividad de monitoreo implica una recolección o toma de muestras Dando respuesta a esta pregunta definimos los parámetros que están vinculados a las necesidades que impulsan la generación del monitoreo y cómo estos darán una solución a las inquietudes motivadas por la necesidad. de agua en la que se tienen que contemplar una gran cantidad de variables para poder minimizar los riesgos y errores que puedan ocurrir estando en terreno. Muchas de estas variables están relacionadas con factores ambientales, tipo de análisis de las muestras, logística de recolección y equipos, entre otras. La diagramación de las actividades de muestreo merece un análisis particular con el objetivo de optimizar los tiempos y los esfuerzos a fin de lograr la obtención de muestras de alta calidad que puedan satisfacer los estándares analíticos y las expectativas del estudio. Los monitoreos surgen de una necesidad de conocimiento o una pregunta a responder. Es muy importante tener en claro cuál es la pregunta o que conocimiento queremos generar para poder abordar las variables bajo esa premisa. Estas preguntas pueden seguir una línea sobre la cual podemos construir y guiarnos para la formulación de monitoreos. Con estas preguntas resueltas podemos proceder a pensar: Por ejemplo, para comenzar debemos preguntarnos Para contemplar la escala temporal de la - ¿Por qué monitoreamos? El por qué del monitoreo responde a una necesidad genuina de generación de información para un fin. Es la pregunta fundamental a la hora de emprender un plan de monitoreo ya que regirá a todas las demás etapas de planificación. Este interrogante debe permanecer siempre a la vista durante el proceso de construcción del plan de monitoreo para no perder nuestra línea estratégica conductora. Sobre esta pregunta se tratan los 16 - ¿Qué parámetros se monitorearán? y ¿Cómo ayudarán al propósito del monitoreo? ¿Dónde se tomarán las muestras? En esta etapa tomaremos dimensiones de terreno que nos llevarán a la identificación de las variables relacionadas a la logística general de la recolección de las muestras. Las distancias, los tiempos y los lugares pasarán a tomar un rol fundamental en la diagramación de la hoja de ruta de forma de optimizar los esfuerzos previos a la actividad en terreno. En este punto se consolidarán los criterios de selección de lugares en función de nuestra primera pregunta. obtención de las muestras nos preguntamos: ¿Cuándo muestreamos? Aquí definiremos un punto en el tiempo relacionado a la información que queremos recolectar. Por ejemplo, si queremos saber un dato que depende de la altura de un río, o de un evento en particular que nos interesa, debemos conocer las variaciones ambientales para poder definir en qué momento tomar las muestras de agua. A su vez, nos puede interesar como se mueven las variables que medimos en función del tiempo, de manera que la periodicidad entra a jugar un papel muy importante en la diagramación de nuestro esquema de monitoreo. La periodicidad va a estar sujeta a cuestiones intrínsecas a nuestra necesidad de obtener la información necesaria y a los recursos económicos disponibles. De esta forma, establecemos la frecuencia con la cual se tomarán las muestras para contar con la información necesaria. ¿Cómo muestreamos? Esta pregunta va encaminada a darnos las pautas sobres las cuales trabajaremos, considerando los métodos estandarizados de muestreo. La elección de cómo se realizará la toma de muestras necesariamente debe seguir los métodos estandarizados aplicables a la situación que enfrentemos dentro de los objetivos planteados de monitoreo (Ver secciones “Parámetros que definen la calidad del agua” y “Toma de muestras en terreno”). Siguiendo los métodos y protocolos estandarizados nos aseguramos que la calidad de la información que obtendremos es constante tanto en el tiempo como en el espacio. Los lineamientos sobre métodos y protocolos estandarizados mayormente utilizados a nivel mundial corresponden a los definidos por la Asociación Americana de Salud Pública (American Public Health Association, APHA) y la Agencia de Protección Ambiental de los Estados Unidos (Environmental Protection Agency, U.S. EPA) Esto permite generar información de alta calidad que puede ser comparada entre sí, ya sea entre 17 MONITOREO Este conjunto de preguntas pretende dar una orientación para la generación de planes o proyectos de monitoreos, impulsando a la participación de los actores locales para poder incluir en los diagramas de monitoreo a las problemáticas y consideraciones de interés socio-ambiental. A modo de resumen la figura 5 describe el proceso para la construcción de un plan de monitoreo estandarizado. Figura 5: Esquema conceptual para el armado de planes de monitoreo estandarizados. lugares que nos interesan o en función del tiempo (calidad del agua en época de lluvias, en época de sequía, por citar un ejemplo). Por supuesto que dependemos de las variables que nos rodean para poder definir cómo tomaremos las muestras. Sin embargo, para cada una de las circunstancias que surjan tendremos una alternativa de muestreo estandarizado que nos ayudará a mantener una constancia en la forma en la cual obtenemos las muestras. La información que generemos de esta forma tendrá un alto énfasis en la calidad, bajo premisas científicas y se podrá utilizar como insumo para el propósito del plan de monitoreo y como base para futuras alternativas de uso de información. ¿Cómo utilizamos los datos? El manejo de los datos es la etapa que valida todo el esfuerzo del monitoreo. La obtención de los resultados de alta calidad nos facilitará defender las decisiones que tomaremos con la información basándonos en altos estándares científicos y en la alta calidad de la información. Este tipo de datos nos permite generar bases que duren en el tiempo y puedan ser utilizadas en el largo plazo por diferentes tomadores de decisiones. Es importante resaltar que el manejo de los datos debe ser analizado previo a la realización del monitoreo, estandarizando la forma y los tiempos, designando a un responsable específico para tales fines. El mal manejo de los datos nos puede llevar a malos datos o de baja calidad lo cual se considera peor que el hecho de no tener datos. Es por esto que hacemos énfasis en la obtención, guardado y análisis de forma estandarizada. 18 Definición de Objetivos de Monitoreo Diseño del Estudio Programa de Muestreo a Campo Análisis de Laboratorio Análisis de Datos / Interpretación Reporte y Difusión de Información 19 PARÁMETROS QUE DEFINEN LA CALIDAD DEL AGUA Temperatura La temperatura de un cuerpo de agua superficial condiciona la solubilidad del oxígeno disuelto. El incremento en la temperatura del agua limita la disponibilidad de oxígeno disuelto para la vida acuática. Además, la temperatura del agua regula diversas reacciones bioquímicas que influyen en su calidad. La temperatura se puede medir usando un termómetro con un rango de 0-50 °C o un termómetro electrónico adecuado. La sonda (o el termómetro) se coloca en el cuerpo de agua a ser medido, aproximadamente a 10 cm de profundidad, con agitación suave y la medición se efectúa una vez que la lectura se haya estabilizado (Método 2550: APHA, 1998). La conductividad eléctrica (CE) es una medida definida por la capacidad del agua para conducir una corriente eléctrica y depende del número de iones o partículas cargadas en el agua. 20 Conductividad Eléctrica Las determinaciones de la conductividad eléctrica son útiles en estudios acuáticos, ya que proporcionan una medición directa de la materia iónica disuelta. Valores bajos de CE son característicos en aguas de alta calidad y bajo contenido de nutrientes. Los valores altos pueden ser indicativos de problemas de salinidad, aunque también se observan en los cursos de agua eutróficos con abundancia de nutrientes. Los valores muy altos son buenos indicadores de posibles sitios contaminados. Un cambio repentino en la conductividad eléctrica puede indicar una descarga directa u otra fuente de contaminación en el agua. Sin embargo, lecturas de conductividad eléctrica no proporcionan información específica sobre la composición iónica del agua. La conductividad electricidad se mide haciendo pasar una corriente eléctrica entre dos electrodos (separados por una distancia conocida) que se colocan en una muestra de agua. Los valores bajos se expresan en micro-Siemens por centímetro (µS/cm), y los valores altos en mili-Siemens por centímetro (mS/cm). Para efectuar una medición, el manejo de la sonda es similar al descripto para el parámetro temperatura. La conductividad se mide mediante una sonda (con o sin compensación de temperatura) que se calibra a partir de una solución standard de cloruro de potasio (Método 2510: APHA, 1998). pH El pH es la concentración de iones de hidrógeno de una solución, expresado como un logaritmo negativo. Refleja la acidez o alcalinidad de una solución. Adopta una escala de 1 a 14, considerándose como neutro al 7, valores alcalinos a aquellos que superen a 7 y ácidos a los menores a 7. Es importante tener en cuenta los efectos del pH en otros tóxicos potenciales, por ejemplo, la biodisponibilidad de los metales pesados. Para efectuar una medición, el manejo de la sonda es similar al descripto para el parámetro temperatura y es preferible su medición “in situ”. El pH se determina electroquímicamente mediante una combinación de electrodos (electrodos de vidrio y referencia) que se calibran con dos soluciones buffer comerciales (Método 4500-H+ B: APHA, 1998). Oxígeno disuelto El análisis de oxígeno disuelto (OD) define la cantidad de oxígeno gaseoso (O2) disuelto en una solución acuosa. El oxígeno se disuelve en el agua por difusión desde el aire circundante, por aireación (a través de fenómenos de turbulencia), y como producto de la fotosíntesis. La determinación analítica se debe realizar de inmediato y en el lugar de la toma de muestra (in situ). El oxígeno disuelto puede ser expresado ya sea como una concentración (en mg/L), que es un valor absoluto, o como porcentaje de saturación, que es una expresión de la proporción de oxígeno disuelto en el agua en relación con la concentración máxima que puede disolverse a una temperatura, presión, y salinidad particular. Para su medición se emplean electrodos con membranas permeables a oxígeno, las cuales se sumergen con leve agitación dentro del cuerpo de agua a analizar (Método 4500 O: APHA, 1998). Salinidad La salinidad del agua se define a partir de la concentración de sal disuelta en el cuerpo de agua. Las concentraciones se expresan habitualmente en partes por mil (‰). Los cuerpos de agua se clasifican según su salinidad en: agua fresca (menor al 5 ‰), agua salobre (del 5 ‰ al 25 ‰), agua salina (del 25 ‰ al 36 ‰) y agua hipersalina (mayor al 36 ‰). Las mediciones se efectúan con una sonda cuyo manejo es similar al descripto 21 Nitrógeno en forma de amoníaco/ amonio PARÁMETROS QUE DEFINEN LA CALIDAD DEL AGUA Fósforo total para el parámetro temperatura y es preferible su medición “in situ” (Método 2520: APHA, 1998). Turbidez La turbidez del agua es causada por la materia en suspensión y coloidal, que incluye partículas de arcilla y limo, materia orgánica e inorgánica finamente particulada, plancton y otros organismos microscópicos. La turbidez es una medida de la claridad de un cuerpo de agua. Es una medición óptica, comúnmente registrada en unidades nefelométricas de turbiedad (NTU), que compara la intensidad de la luz dispersada por una muestra de agua con la intensidad de la luz dispersada por una suspensión estándar de referencia. Esta medición se realiza con una sonda que emite un haz de luz en la muestra de agua y registra la intensidad (Método 2130: APHA, 1998). Sólidos totales en suspensión Para la determinación de los sólidos totales en suspensión (STS), la muestra se toma en botellas plásticas, pre-lavadas 3 veces con el agua a muestrear, antes de la colección final. Debe asegurarse de no incrementar la turbidez del agua muestreada cuando se colecta la muestra por 22 generar disturbios en el fondo del cuerpo de agua. Los STS se definen como la porción de sólidos totales de una muestra de agua que es retenida por un filtro de tamaño de poro de 0,45 µ. Una vez que el filtro ha sido secado a 103-105 ° C y pesado, la cantidad de sólidos totales en suspensión se registra en unidades de mg/L (Método 2540 D: APHA, 1998). Sólidos totales disueltos Los sólidos totales disueltos son indicativos de la salinidad y pueden afectar adversamente la calidad de un cuerpo de agua de varias formas. En el caso de las aguas para consumo humano, un alto contenido de sólidos disueltos, es por lo general de mal agrado para el paladar y puede inducir una reacción fisiológica adversa en el consumidor. Los Sólidos Totales Disueltos (STD) constituyen la porción de sólidos en una muestra de agua que pasa a través de un filtro de tamaño de poro de 0,45 µ. Los sólidos totales disueltos son el material residual resultante en un recipiente luego de la evaporación (180 °C) de una muestra y su subsecuente secamiento en un horno a temperatura definida y constante (Método 2540 C: APHA, 1998). El fósforo se encuentra en aguas naturales y residuales casi exclusivamente en forma de fosfatos. Éstos se encuentran en formas iónicas o ligados a la materia orgánica. Las fuentes que pueden enriquecer en fósforo a un cuerpo de agua incluyen algunos detergentes, fertilizantes inorgánicos, excretas animales, aguas residuales y algunos residuos industriales. Los altos niveles de fósforo y otros nutrientes esenciales pueden dar lugar a crecimientos exacerbados de algas (eutrofización). Para su determinación se requiere un volumen de 200 mL de muestra, colectada en botella plástica, refrigerada (1 a 4 °C) y mantenida en oscuridad. La determinación analítica incluye una digestión con persulfato (Método 4500-P B 5: APHA, 1998) y una colorimetría basada en una reducción con ácido ascórbico (Método 4500-P F: APHA, 1998). Fósforo soluble Los fosfatos disueltos u ortofosfatos (PO43-) se determinan mediante pruebas colorimétricas sin previa hidrólisis o digestión oxidativa de la muestra. Se requieren al menos 125 ml de muestra que puede ser colectada en botella plástica, transportada refrigerada, para luego ser filtrada en el laboratorio por una membrana de 0,45 µ. La determinación analítica se efectúa mediante una reducción con ácido ascórbico (Método 4500-P F: APHA, 1998). Especies de nitrógeno, tales como amoníaco y amonio, se determinan utilizando la misma metodología analítica. El amoníaco y el amonio pueden existir en equilibrio en solución acuosa. En soluciones alcalinas la especie predominante es el amoníaco (NH3), mientras que el amonio (NH4+) predomina a pH más bajo. Las fuentes de amoníaco que pueden acceder a un cuerpo de agua incluyen a los fertilizantes y a la mineralización de la materia orgánica. Para su determinación se requiere un volumen de 125 mL de muestra, colectada en botella plástica, refrigerada (1 a 4 °C) que es filtrada por una membrana de 0,45 µ y definida por una colorimetría de fenato (Método 4500-NH3 G: APHA, 1998). Nitrógeno en forma de nitrato/nitrito El nitrito es una forma intermedia de nitrógeno, generalmente de corta duración, ya que es rápidamente oxidado a nitrato. El nitrato es un nutriente esencial para las plantas y sus niveles en las vías fluviales naturales son típicamente bajos (< 1 mg/L). Las cantidades excesivas de nitratos pueden afectar la calidad del agua y acelerar la eutrofización. Algunas bacterias median la conversión de nitratos en nitrógeno gaseoso a través de un proceso conocido como desnitrificación, de utilidad para reducir los niveles de nitrato en las vías fluviales. El volumen de muestra necesario es de 125 mL, colectada en botella plástica, refrigerada (1 a 4 °C) y remitida al laboratorio en menos de 24 h. La misma es filtrada por una membrana de 0,45 µ y determinada mediante una reducción con cadmio (Método 4500-NO3 F: APHA, 1998). 23 PARÁMETROS QUE DEFINEN LA CALIDAD DEL AGUA Clorofila a La clorofila a es un pigmento fotosintético y su concentración en agua puede ser utilizada para estimar la biomasa de fitoplancton. La concentración es determinada a partir del residuo sólido remanente del filtrado de un volumen conocido de muestra. Factores naturales y antropogénicos, tales como nutrientes, luz y temperatura, pueden afectar la biomasa de una comunidad de fitoplancton y en consecuencia, las concentraciones de clorofila a. Altos niveles de clorofila a son frecuentemente indicativos de elevadas concentraciones de nutrientes. Se requiere un volumen de muestra de 1L en botella de plástico, previamente lavadas con detergente libre de fosfatos, refrigerada (1 a 4 °C), a oscuras y remitida al laboratorio en menos de 24 h (Método 10200 H: APHA, 1998). 24 Demanda bioquímica de oxígeno (DBO) La demanda bioquímica de oxígeno es una medida de la cantidad de material orgánico presente en el agua que puede ser degradado biológicamente. Se define a partir de la cantidad de oxígeno que los organismos acuáticos aeróbicos podrían potencialmente consumir en el proceso de metabolizar toda la materia orgánica disponible para ellos. Altos niveles de DBO en un cuerpo de agua son indicativos de bajos niveles de oxígeno disuelto que pueden provocan stress en los organismos acuáticos y en casos extremos, sofocación y muerte de los mismos. Se requiere un volumen de muestra de 1L en botella de vidrio color ámbar, refrigerada (1 a 4 °C) y remitida al laboratorio en menos de 24 h (Para 5 días, método 5210 B: APHA, 1998). Elementos traza Los elementos traza se clasifican en micronutrientes y microcontaminantes. Los microcontaminantes que más comúnmente pueden afectar cuerpos de agua son cromo (Cr), bromo (Br), cadmio (Cd), plomo (Pb) y arsénico (As), mientras que los micronutrientes son cobre (Cu), zinc (Zn), selenio (Se) y cobalto (Co). Niveles bajos de microcontaminantes y niveles elevados de micronutrientes pueden ser tóxicos para los organismos acuáticos. También pueden bioacumularse y transferirse a la cadena agroalimentaria, con implicancias para la salud humana y la calidad ambiental. Para su medición se utilizan equipos de espectrofotometría como ICPMS (Plasma de Acoplamiento InductivoEspectrometría de Masa) o ICPOES (Plasma de Acoplamiento Inductivo -Espectrometría de Emisión óptica). El volumen de muestra requerido es de 250 mL, excepto en casos de necesidad de realización de especiación donde el volumen asciende a 500 mL. Las muestras se colectan en botellas plásticas con tapa, con cubierta de teflón, y requieren de la adición de HNO3concentrado para una proporción final de 0,2%, llevando el pH a valores inferiores a 2. Las muestras para determinación de niveles totales no se filtran en membrana de 0,45 µ, pero deben preservarse de 1 a 4 °C (Tratamiento preliminar, método 3030 E-K: APHA, 1998; luego usar método 3111 B: APHA, 1998). Pesticidas El término agroquímico o pesticida se usa de forma general para describir un conjunto de productos químicos utilizados fundamentalmente en agricultura para eliminar organismos que pueden afectar la producción de cultivos y que pueden incluir insecticidas, herbicidas y fungicidas. Son sustancias orgánicas sintéticas que pueden presentar una apreciable complejidad química lo que hace que, normalmente, no se las identifique por sus estructuras químicas detalladas sino por sus nombres comerciales. Los grupos, químicamente similares, con potencial efecto nocivo sobre el ambiente y la salud humana, y que están clasificados, a su vez, según toxicidad son: organoclorados, organofosforados, tiazinas, carbamatos y otros (sin características comunes a un grupo) tales como el glifosato. Se requiere un volumen de muestra de 1 L, en botellas de vidrio color ámbar, con tapa con cubierta de teflón y debe remitirse refrigerada al laboratorio (1 a 4 °C). En el caso del glifosato la determinación analítica se realiza mediante el método 6651: APHA, 1998; los organoclorados por método 6410: APHA, 1998; los organofosforados por método 8270 C: USEPA, 1996 y método 8141 B: USEPA, 1998 (al igual que las tiazinas). 25 PARÁMETROS QUE DEFINEN LA CALIDAD DEL AGUA DISEÑO DEL MUESTREO 26 Análisis microbiológicos Área de Estudio Se puede definir el análisis microbiológico como el conjunto de operaciones para determinar los microorganismos patógenos presentes en una muestra de agua, ya sean bacterias, virus y protozoarios y que proceden de contaminaciones de tipo fecal. Las muestras de 500 mL deben recolectarse en frascos estériles. En todos los casos los envases se llenarán por completo para excluir el aire. Su análisis debe comenzar idealmente antes de que hayan transcurrido 6 h desde el momento de la toma de muestras. A los fines prácticos pueden mantenerse refrigeradas a 4 °C durante un período máximo de 24 h antes de su análisis. Las bacterias coliformes son ciertas especies bacterianas pertenecientes a la familia Enterobacteriaceae. El método de determinación de coliformes totales consiste en desarrollar una prueba presuntiva en el que una reacción negativa excluye la presencia del grupo coliforme. Si se observa crecimiento bacteriano con producción de gas a las 24h o antes, la presencia de bacterias coliformes se considerará confirmada, prosiguiendo con el método del filtro de membrana para conteo. Las bacterias coliformes de origen fecal son capaces de fermentar la lactosa, con producción de ácido y de gas a 44 °C, en un tiempo máximo de 24h. El método consiste en la determinación del nº de coliformes mediante filtración de volúmenes determinados del agua a analizar por filtros de membrana e incubación sobre medio de lactosa enriquecido. La densidad se estima como el total de coliformes totales cada 100 mL de muestra (Método 9221, 9222 y 9223: APHA, 1998). El área del estudio es el espacio físico definido para poder llevar adelante un monitoreo de calidad de agua. Este espacio puede ser amplio, cuando se pretende tener una aproximación general, o de menor tamaño para trabajar en escalas más pequeñas que permitan una mayor precisión de monitoreo específico. La definición del área de estudio está ligada a los objetivos que motivan el monitoreo y sentando los límites del mismo. El presente Plan está generado en base a las características de la provincia de Misiones, contemplando las variables características de la región para la planificación de monitoreos. Puntos de Muestreo Los puntos de muestreo deben considerarse para cada caso particular de monitoreo dependiendo de los objetivos propuestos. Estos puntos de toma de muestra deben responder a una decisión estratégica que contemple, dentro de los alcances del proyecto, los vacíos de información y la necesidad de conocimientos para la gestión del recurso hídrico. De esta forma, se generará una base de datos con las concentraciones de elementos de interés, que describan la situación del lugar donde se realizó la toma de muestra. Es importante definir qué efecto queremos medir para poder ubicar los puntos de muestreo de manera consistente. La ubicación de los puntos va a sentar las bases para el correcto análisis de los datos generados de calidad de agua y sus limitaciones. 27 DISEÑO DEL MUESTREO Duración La duración de los muestreos va a depender de las diferentes variables de peso y de los objetivos que se consideren necesarios. En el caso de un monitoreo, es deseable que la duración de los muestreos sea a largo plazo de forma de mantener constante en el tiempo la recolección de información, consolidando el entendimiento temporal de la calidad de agua. Se busca así una generación continua de herramientas para la toma de decisiones, promoviendo buenas prácticas de desarrollo sustentable que no afecten al recurso hídrico. Como premisa básica, la duración mínima de un monitoreo debe responder a los interrogantes que motivan su realización y a las variables ambientales consideradas de importancia como por ejemplo: los períodos de aguas bajas, los períodos de aguas altas y posibles eventos de lluvias copiosas característicos de la región en estudio. De esta forma se aborda el muestreo con una componente temporal que considera los factores ambientales como condicionantes de la calidad y fundamentales para poder generar líneas de base con escalas temporales y monitoreos planificados. A su vez, debe tenerse en cuenta el tiempo necesario para el análisis de los resultados de manera de poder concluir y reorientar, en caso de ser necesario, los diagramas estipulados de muestreo y análisis. Frecuencia La frecuencia de la toma de muestras va a depender del peso de las variables de calidad de agua que estemos analizando, sus características particulares y su relación con la variabilidad ambiental. A su vez, los objetivos específicos del monitoreo juegan un rol de importancia en la definición de la frecuencia. Si el ambiente presenta cambios en el tiempo (por ejemplo: sistemas de ríos en cuestión de minutos u horas y lagos en cuestión de días o semanas), 28 el patrón temporal de muestreo es de gran importancia. El programa de muestreo deberá tener en cuenta la resolución temporal prevista de los cambios en el ambiente. En los programas para el monitoreo de los tratamientos de efluentes de aguas residuales, el muestreo durante todo el día puede ser necesario para determinar si se han cumplido o superado las variables de control. Una única muestra sólo puede ser una foto instantánea en un sólo punto en el tiempo y puede no representar de manera fiable las condiciones típicas de un sistema que varía con el tiempo. En el caso de los ríos de la provincia de Misiones, estos tienen regímenes de fluctuación de caudales importantes, que varían en función de las condiciones climáticas imperantes y que modifican considerablemente muchas de las variables a analizar. Disponer de los relevamientos de la calidad de agua de la mayoría de los ríos de la provincia, suplirá los vacíos de información de base, y resultará esencial para planificar adecuadamente la frecuencia de los muestreos. Parámetros Como en las secciones anteriores, el punto central de la diagramación del monitoreo pasa por las definiciones estratégicas dentro de los objetivos planteados. Es muy importante prestar atención a las variables que se vinculan a las problemáticas a las cuales se les quiere dar solución con el plan de monitoreo. La definición de los parámetros a analizar es una de las variables de mayor peso a la hora de calcular el costo beneficio del plan de monitoreo. Los análisis químicos se encuentran dentro de las variables más costosas dentro de un plan de monitoreo. Es por eso que su importancia no es menor. Estas definiciones pueden ser conducidas con mayor facilidad cuando contamos con bibliografía o datos previos que nos ayuden a definir los parámetros. Es importante definir los alcances del monitoreo en relación a los parámetros que se tomarán en cuenta. Cabe resaltar que un sólo diseño de monitoreo no dará cuenta de todas las variables ambientales y problemáticas asociadas a responder sobre todo en grandes extensiones 29 DISEÑO DEL MUESTREO y con frecuencias reducidas. Es por eso que todos los conceptos que venimos analizando no sólo definen los alcances sino también los límites. Es importante contar también con los valores guía recomendados para el uso del recurso que estemos analizando. En el caso de un relevamiento de calidad de agua ambiental podemos aplicar niveles guía de Protección de la Biota Acuática. Sin embargo, si estamos analizando calidad de agua para recreación por ejemplo, debemos considerar los valores guía definidos para este uso. A su vez, existe la posibilidad de monitoreos sobre el vertido de efluentes líquidos a cuerpos receptores. En ese caso se seguirán los estándares provinciales en cuanto a los parámetros de medición y los niveles máximos permitidos de descarga, facilitando la definición dentro del espectro de parámetros generales. Para ejemplificar y generar una mejor compresión de este punto las figuras 4A y 4B sirven de guía para la definición de parámetros de importancia. Logística previa La diagramación de la logística va a depender en primer lugar de definiciones previas que describan qué y dónde queremos medir, y el alcance previsto de los datos a generar. De esta forma, podremos tener en cuenta a las variables de importancia al momento de la adquisición de equipamiento, del material para la recolección de muestras, de los insumos de mantenimiento de muestras, de los tiempos de mantenimiento de muestras y del tiempo de traslado entre las estaciones de muestreo y los puntos de entrega para análisis. Cabe destacar, como punto muy importante que limita la capacidad de acción en el terreno, a la accesibilidad a los lugares definidos a muestrear. Muchas veces se definen puntos de toma de muestra desde mapas o imágenes satelitales, desde donde sólo podemos tener una aproximación al lugar, careciendo de detalles. Es por eso, que es necesario para una correcta planificación de la toma de muestras, realizar visitas previas de 30 pre-muestreo para poder optimizar los detalles. En ese sentido, se opta por realizar los estudios sobre las líneas de acceso más factibles, las cuales incluyen rutas provinciales y nacionales que posibiliten el uso de puentes para poder realizar las tomas de muestras. Dentro de las variables que manejamos en la logística previa es de fundamental importancia el contacto con los laboratorios a los cuales se remitirán las muestras luego del muestreo. De este forma, se optimizan los tiempos para poder proceder al análisis de muestras dentro del rango del tiempo máximo definido para los parámetros de interés. Hoja de ruta Este es un instrumento fundamental que nos guía en la toma de muestras cuando se trata de un monitoreo que comprende varios sitios de muestreo. En este paso definimos la mejor forma que nos conduce a los puntos elegidos realizando un recorrido que culmine en el lugar de entrega de las muestras en el caso de requerirse análisis de laboratorios. Dentro de la definición de los parámetros que vamos a medir aparecen condiciones determinadas de entrega de las muestras, como por ejemplo el tiempo que transcurre desde la toma de muestra hasta su análisis. Estas definiciones son de suma importancia ya que limitan nuestra hoja de ruta a los tiempos impuestos por los estándares analíticos. Por lo general, se recomienda programar los monitoreos en bases diarias cuando se trata de muestras que tengan 24 h para su entrega en laboratorio. Otra variable de gran importancia es el tiempo que nos lleva tomar las muestras y realizar las mediciones en cada punto ya que estos tiempos condicionan la duración del proceso de toma de muestras. Una vez establecidos estos criterios, estamos en condiciones de generar nuestra hoja de ruta con un punto de partida con un horario tentativo, un recorrido con sus respectivos puntos de toma de muestra y un punto de llegada con su horario tentativo. De esta forma podemos decidir las mejores alternativas para generar la hoja de ruta. Para consolidar la hoja de ruta es importante contar con un equipo GPS (sigla en inglés que representa a Sistema de Posicionamiento Geográfico). Esta herramienta nos va a permitir tener definida la hoja de ruta en pantalla con los respectivos puntos de muestreo. A su vez, las aplicaciones del GPS nos permiten obtener información complementaria de tiempos aproximados entre puntos, distancias, y también una alarma de proximidad al punto de toma de muestra. Es por esto que el uso de estos equipos resulta de suma utilidad para poder estandarizar la hoja de ruta y retenerla en formato digital con las aplicaciones que surgen de estos equipos. 31 DISEÑO DEL MUESTREO Preparación de materiales En esta sección se tienen en cuenta todos los insumos necesarios para la recolección de muestras, los cuales parten de la base de lo que vamos a analizar y de las especificaciones del laboratorio al cual se remitirán las muestras colectadas. De esta forma tendremos definido según lo que vamos a medir, la naturaleza de los recipientes a emplear (botellas, frascos, tubos), la cantidad de recipientes en función de los puntos de muestreo, los equipos necesarios para la obtención de la muestra de agua (sogas, baldes, botellas Van Dorn, según corresponda) y los insumos para acondicionamiento y transporte de las muestras tales como conservadoras, refrigerantes, gradillas y reactivos, entre otros. Es aconsejable llevar dos repuestos de cada recipiente por cualquier eventualidad. Además de los insumos para la toma de muestras son importantes los materiales necesarios para el correcto etiquetado e identificación de las muestras. La preparación de rótulos se recomienda efectuarla previamente al momento del muestreo para optimizar los tiempos en el terreno. Las planillas de recolección de datos son parte importante de la preparación previa de materiales. Una planilla correctamente confeccionada que contenga un check-list (punteo o listado de todo lo necesario para cada punto de muestreo) es fundamental para estandarizar el control de la toma de muestras y, a su vez, funciona como un back-up (copia de seguridad) de la información generada en terreno (Ver Figura 6). Figura 6: Ejemplo de planilla de campo para el check list y data check estandarizado para cada punto de monitoreo. Envases contenedores para muestras y métodos de conservación Idealmente, las determinaciones analíticas de muestras de agua, deben realizarse in situ en el lugar de recolección. Sin embargo, como en la práctica la mayoría de las determinaciones analíticas se efectúan en condiciones de laboratorio, es esencial seguir correctos protocolos de recolección, preservación y transporte de las muestras a los laboratorios. Cada muestra debe ser colectada y almacenada en un contenedor apropiado a las condiciones requeridas por el parámetro de interés. El uso de apropiados contenedores y métodos de preservación permite disminuir los riesgos de contaminación de la muestra y/o las pérdidas de analitos de interés durante el almacenamiento y transporte previos al análisis de laboratorio. Los detalles de las características de los envases y los métodos de conservación se describen en la sección: “Parámetros que definen la calidad del agua”. Para cada muestra recolectada debe considerarse: • El material apropiado del contenedor y su tapa. • Los métodos de acondicionamiento de los contenedores antes de tomar las muestras. • La pertinente rotulación de los envases mediante etiquetas o marcadores a prueba de agua. • Los procesos de conservación y el tiempo máximo de remisión de las muestras. 32 33 DISEÑO DEL MUESTREO Control de los equipos Todos los equipos que se utilicen en la implementación del monitoreo deben ser revisados y calibrados en el caso que corresponda, previos a la salida, para poder contar con los equipos en su correcto estado operativo. Para la recolección de datos in situ (temp, oxígeno disuelto, pH, conductividad eléctrica, sólidos totales disueltos o STD, potencial de óxido reducción u ORP, turbidez, salinidad) se recomienda utilizar equipos multiparamétricos robustos que soporten ser manipulados intensivamente en campo, como los equipos tipo multiparamétrico Horiba© U52 (Figura 7). Figura 7: Equipo multiparamétrico Horiba© U52 de última generación para mediciones in situ Este equipo fue utilizado en el monitoreo para la generación de una línea de base de los ríos de la provincia de Misiones. Estos equipos, además de contar con una sonda robusta y con los electrodos respectivos para realizar las mediciones necesarias, poseen un sistema operativo digital que permite registrar los datos de manera segura, fijando previo al muestreo, los puntos contenidos en la hoja de ruta, a fin de poder tener una correlación entre los datos que se manejan en el monitoreo. A su vez, cuentan con su correspondiente software para poder acceder a los datos de forma ágil una vez concluido el monitoreo. Es muy importante destacar que la lista de campo para el data-check debe contener todas las mediciones registradas con los equipos electrónicos para tener un back-up de información en papel por cualquier eventualidad imprevista. De esta forma, nos aseguramos un correcto resguardo de los datos relevados en el monitoreo. Preparación de Blancos Los “blancos” son muestras limpias de agua destilada o ultrapura que se toman durante el muestreo (para todos los blancos se usa siempre la misma fuente de agua ultra-pura o destilada). Se busca con este procedimiento analizar posibles puntos de contaminación en los procedimientos de toma de muestras que realizamos en campo como resultado de maniobras incorrectas, problemas con los envases, con el equipamiento o con el transporte. Blancos de Campo (BC) Con este tipo de blancos buscamos verificar que no ocurran eventos de contaminación durante los procedimientos que realizamos en el terreno. Para ello debemos llevar en el vehículo un envase con agua destilada o ultrapura para poder generar el banco de campo. Durante el procedimiento de toma de muestras, procederemos a abrir y cerrar un envase con agua destilada siguiendo todos los pasos que seguimos cuando manipulamos y acondicionamos una muestra común. De esta forma, cualquier elemento que midamos en este blanco nos informará sobre los niveles de contaminación debidos al manejo y acondicionamiento. Idealmente, por lo menos un blanco de campo se debe tomar por salida de muestreo o por equipo de muestreo, para todos los parámetros que estamos analizando. 34 35 DISEÑO DEL MUESTREO Preparación del vehículo Blanco de Transporte (BT) En este caso se toma un blanco con agua destilada preparado en el laboratorio el cual acompañará todo el tiempo al total de las muestras, de esta forma analizamos la posible contaminación en el proceso de transporte de muestras. Idealmente un blanco de transporte es aconsejable en cada campaña de muestreo. Blanco de Envases (BE) Este blanco se genera en el laboratorio y nos sirve para analizar si existe algún tipo de contaminación debido al envase que estamos utilizando, como por ejemplo por las paredes internas del envase en su proceso de producción o por el enjuagado para su limpieza. Para este paso se procede a llenar con agua destilada o ultrapura (la misma utilizada para los blancos anteriores) y se deja en el laboratorio hasta regresar de la campaña de muestreos. Este blanco no se lleva al campo, permanece en el laboratorio. Blanco de Equipamiento (BEq) El blanco de equipamiento es uno de los más importantes, ya que define la contaminación de las muestras debida al uso de equipamiento (baldes, botellas Van Dorn, etc). Este blanco se toma cuando terminamos de tomar una muestra en un punto y ya hemos enjuagado de forma estandarizada a los equipos para proceder al próximo punto de muestreo. En ese momento, enjuagaremos una vez más el equipo con agua destilada o ultrapura y guardaremos esa muestra de agua en un envase como una muestra más. 36 En el caso de la movilidad para poder realizar el monitoreo se recomienda un vehículo tipo pick-up con plaza para 4 personas y capacidad de carga en la caja con cobertor para evitar el ingreso de variables no deseadas al espacio donde se transportarán las muestras. El vehículo debe cumplir con las condiciones óptimas para su uso en ruta. Este acondicionamiento consiste en las cuestiones mecánicas del vehículo y en las condiciones legales de tránsito como los seguros, impuestos y verificaciones técnicas correspondientes que lo habilitan a transitar. El correcto funcionamiento del vehículo es uno de los más importantes factores a considerar ya que todo el esfuerzo de monitoreo tiene como eje central el transporte de muestras de forma correcta, segura y estandarizada. A su vez, es altamente recomendable contar con un botiquín debidamente equipado para proceder ante cualquier eventualidad relacionada con la integridad de la salud de los encargados del muestreo. Embarcaciones Es indispensable contar con una embarcación en condiciones óptimas para proceder, de ser necesario, con la toma de muestras en el caso de grandes ríos. Las embarcaciones deben cumplir con todos los requisitos de seguridad requeridos por la Prefectura Naval Argentina (PNA), en caso de ser embarcaciones sujetas al registro correspondiente de PNA. En el caso de utilizar otro tipo de embarcación como canoas o kayaks, se recomienda ser utilizadas por personal capacitado siguiendo todas las reglas de seguridad acordes al tipo de empleo que se les da. A su vez, en el caso particular de la Provincia de Misiones, los puntos de toma de muestra en los grandes ríos se relacionan con la presencia de destacamentos de PNA, de esta forma se aconseja realizar una coordinación previa con las autoridades locales de PNA a fin de generar sinergismos en la toma de muestras de agua, mediante el apoyo técnico y logístico en el uso de embarcaciones. 37 CAMPAÑA DE MUESTREO La recolección de las muestras y los datos en terreno puede denominarse campaña de muestreo. Esta actividad consta de todos los pasos necesarios para la obtención de las muestras y la generación de los datos en los lugares determinados, así como su mantenimiento y transporte a los destinos finales de análisis. Detención del vehículo Las recomendaciones en esta sección son de altísima importancia para el desarrollo de las actividades. Siguiendo con los pasos planteados en el presente plan, la naturaleza de los puntos de muestreo corresponde en su mayoría a puentes sobre rutas nacionales y provinciales. Este factor influye sobre el procedimiento para la toma de muestras. En este punto pasa a tener importancia el uso del GPS para poder tener una anticipación al lugar de detención, de forma de proceder adecuadamente con la disminución de la velocidad y el encendido de balizas antes de pasar por el punto seleccionado. Se tomarán en cuenta los lugares óptimos para la detención del vehículo contemplando una distancia prudencial a la ruta. Una vez detenido el vehículo, los integrantes encargados de la toma de muestra y medición descienden con sus respectivos chalecos refractarios para colocar en primer lugar conos de atención para demarcar que se está realizando una actividad y alertar a los automovilistas que circulan por la ruta. Una vez establecidas las medidas de seguridad se procede a seleccionar los elementos de toma de muestras y equipos de medición. Este procedimiento debe ser estandarizado y practicado previo a la campaña de manera de adquirir la práctica necesaria para realizar la maniobra de detención y aseguramiento del espacio de trabajo. Recolección de datos in situ En el monitoreo planteamos la utilización de equipos multiparamétricos para la obtención de datos in situ. Estos equipos nos permiten tomar diferentes datos en simultáneo, disminuyendo los 38 tiempos de operación de equipos y de toma de muestras. Una aplicación de estos equipos permite crear las etiquetas de los puntos de muestreo previamente, de esta forma cuando se arriba a un punto de muestreo pre-establecido en la hoja de ruta, se selecciona el mismo punto en el equipo de forma sistemática y estandarizada. Así tendremos el equipo listo para tomar los datos con el correcto etiquetado en el punto indicado para mantener los procedimientos estandarizados. Se recomienda designar a una persona responsable y encargada del uso del equipo durante el muestreo, manteniendo estandarizado todo el procedimiento. Para la utilización del equipo se necesita una muestra de agua de por lo menos 500 mL. Para esto no se utilizan materiales sofisticados de muestreo como las botellas Van Dorn, se recomienda un balde de plástico sin uso de 5 litros, el cual debe ser previamente enjuagado con agua del lugar a analizar por triplicado. Una vez obtenida la muestra en el recipiente, se sumerge la sonda del equipo que posee los electros de medición de los distintos parámetros a analizar. Cuando se estabilizan las lecturas del equipo se procede a ingresar los datos en el soporte digital interno del equipo. Un asistente de campo simultáneamente tomará las anotaciones de los valores de las mediciones en soporte gráfico de forma de contar con un seguro de la información. De esta forma, se genera una toma de datos estandarizada contemplando cualquier eventualidad sobre el equipo utilizado. Una vez finalizada la medición, se retira la sonda de la muestra de agua y se enjuaga cuidadosamente con agua destilada o ultrapura, de forma de que no queden restos de la muestra en los electrodos. Finalizado este paso, se procede a guardar el equipo para poder ser utilizado en la siguiente estación de muestreo. La toma de imágenes fotográficas digitales (IFDs) genera otro set de información adicional que hacen al conjunto de información colectada en campo. La toma de IFDs debe ser también estandarizada en todos los puntos de muestreo, definiendo siempre un número de fotos por lugar. A modo de ejemplo, se toma un punto en un río donde las IFD deben corresponder a una toma río arriba del punto de muestreo y otra río abajo. La numeración de las IFDs debe ser incluida en la tabla de toma de datos, correspondiéndose con el lugar físico de toma de muestra. Toma de muestras en terreno En esta sección se exponen las pautas para proceder a la toma de muestras bajo las consideraciones de estándares de calidad. Es importante resaltar que cada toma de muestra responde a los parámetros que queremos analizar. En la sección “Parámetros que definen la calidad del agua” se detallan las especificaciones técnicas para el análisis de cada parámetro, el volumen de muestra a recolectar y la forma de preservación de la misma para que no pierda sus propiedades. 39 CAMPAÑA DE MUESTREO Cuando hablamos de toma de muestras en ríos o arroyos debemos buscar los lugares en los cuales el fluido esté bien mezclado (zonas con movimiento de agua). Una característica de los ríos de la provincia es la gran turbulencia que se genera, debido a la naturaleza geológica de los mismos. Dependiendo del tipo de estudio que queremos realizar, se podrán definir las pautas de lugares de toma de muestra con mayor claridad. Para el caso de determinaciones de calidad de agua en general, sin suponer fuentes de contaminación puntuales, se puede realizar la toma de muestra en el centro del cauce y a una profundidad media, dependiendo de la naturaleza del cuerpo de agua. Mientras mayor sea el cuerpo de agua, mayor será la cantidad de muestras que debamos colectar para describir su situación. Este punto está ligado a la capacidad de acción del monitoreo y al análisis de costo-beneficio del monitoreo. Siempre es mejor tomar las muestras directamente dentro del envase con el cual se transportarán, como el caso de tubos o botellas. Sin embargo, muchas veces es necesario utilizar un envase intermedio para poder colectar la muestra como por ejemplo baldes, vasos de precipitados, bombas, entre otros (Figura 8). Figura 8: Toma de muestras en terreno según la accesibilidad al cuerpo de agua. 40 La dificultad de acceso, hace que en muchos casos, se utilicen contenedores intermedios (baldes) que pueden utilizarse: (a) desde puentes con una soga prolongadora; desde la costa con un bastón prolongador. En ambos casos, además de trasvasar la muestra, se pueden medir con la sonda los parámetros in situ en el contenedor intermedio. Cuando la costa permite el acceso al cuerpo de agua (c), la muestra se toma con el envase definitivo a remitir al laboratorio, y se mide con la sonda multiparamétrica directamente sobre el cuerpo de agua. Cabe destacar, que en este último caso debe evitarse la generación de disturbios y turbulencias en la toma de muestra que trasporten sedimentos del fondo del cuerpo de agua. El uso de contenedores intermedios puede traer aparejados riesgos asociados a la contaminación por su uso en muestreos previos. Es por esto que hay que tener en cuenta esta consideración no menor, sobre todo cuando se está analizando elementos en concentraciones traza de ppb (µg/L) como en el caso de los metales pesados. En el caso de no poder evitar el uso de recipientes intermedios, se recomienda un correcto enjuague con agua ultrapura del recipiente y varios enjuagues con el agua de muestra previo a la colecta. Este puede resultar un caso típico cuando se toman muestras desde plataformas como puentes. El uso de blancos de campo es de ayuda para poder tener en cuenta el efecto del uso de recipientes intermedios. Se coloca un volumen de agua ultrapura en el recipiente intermedio y se coloca en el envase final para su análisis. Para poder tener un mejor alcance al centro de los arroyos, se puede utilizar un bastón con agarre para sostener botellas o tubos. Si sumergimos este equipo, también debemos enjuagarlo asegurándonos de que no queden restos de muestra. Para poder contar con un set de muestras por punto de muestreo que pueda darnos una base estadística confiable es recomendable tomar las muestras por triplicado. De esta forma, tendríamos la fuerza estadística para poder generar una medición media e informar sobre ese dato, con posibilidad de su comparación a futuro con otros datos. En el caso de no contar con la posibilidad del análisis de tres muestras por punto de muestreo, se realiza lo que se conoce como muestreas compuestas. Estas muestras pueden estar compuestas por espacios temporales o espaciales, siempre con un volumen igual. A modo de ejemplo, en un cauce de un río pueden tomarse tres puntos de colecta de agua (margen izquierda- centro-margen derecha) que aporten a una sóla muestra. Si se realiza en función del tiempo se pueden generar una muestra con volúmenes idénticos separados por lapsos de tiempo (ej: 10 minutos, 1 hora). Acondicionamiento de las muestras Es esencial la correcta estandarización de los procedimientos de rotulado y preservación de las muestras para su remisión a los laboratorios de análisis a fin de garantizar la confiabilidad de los datos obtenidos en terreno. 41 Rotulado Es extremadamente importante el adecuado rotulado de los envases de las muestras. Este procedimiento puede realizarse previo al muestreo o durante. Para evitar cualquier tipo de confusión entre muestras, cada muestra tendrá asignado un número exclusivo único en referencia a un código consensuado que tenga información de la campaña de monitoreo. A su vez, no puede faltar la siguiente información: - Lugar de muestra (código interno) - Fecha de la muestra - Encargado de la muestra (código interno) - Código de numeración de muestra. Preservación de las muestras Para mantener a las muestras correctamente a bajas temperaturas, deben ser transportadas en conservadoras térmicas, limpias y descontaminadas. Se mantiene el frío con la adición de hielo en bloque, conservadores términos, hielo picado, hielo seco u otra substancia similar. Las muestras que requieren refrigeración son generalmente empacadas con hielo triturado debido a la homogeneidad en la distribución del frío. Una combinación entre hielo triturado y bloques de huelo usualmente es lo más conveniente. El hielo seco se utiliza para muestras que deben ser congeladas inmediatamente de su colección. Se puede conseguir en pellets o en bloques. Es preferible la forma de pellets por la misma razón del hielo triturado. La combinación de pellets y bloques también es aconsejable, distribuyendo los pellets cerca de las muestras y luego los 42 bloques. En el caso de utilizar hielo seco es de suma importancia no transportar las muestras dentro de la cabina de conducción del vehículo con las ventanillas cerradas. En el caso de las muestras para metales pesados, es necesaria la adición de ácido nítrico concentrado ver sección “Parámetros que definen la calidad del agua”. Para minimizar inconvenientes con el uso de hielo es recomendable resguardar las botellas dentro de bolsas plásticas de forma tal de que no se borren los rótulos por el efecto del roce con el hielo y las demás botellas del muestreo. Es importante realizar un control visual del estado del hielo para poder realizar recambios acordes a su descongelamiento. En este punto es aconsejable utilizar conservadoras con válvula de drenaje de agua para evitar aperturas innecesarias y tener un mejor manejo del líquido. LOGÍSTICA POST-MUESTREO En esta sección se toman en cuenta los puntos de mayor importancia para proceder con el análisis de las muestras en los laboratorios, el almacenamiento de los datos, el análisis de los datos y la generación del informe de situación del monitoreo como insumo para la gestión del recurso hídrico. Remisión de muestras al laboratorio Una vez colectadas las muestras y acondicionadas, estas deben ser transportadas, para su análisis, al laboratorio de destino programado en la hoja de ruta. En este paso es fundamental mantener la integridad de las muestras, manteniéndolas bien acondicionadas para minimizar cualquier tipo de inconveniente (vuelco, pérdida, rotura). Esto se logra de manera concreta entregándolas personalmente por el director de la campaña de monitoreo o los colaboradores presentes en la campaña. De esta forma, nos aseguramos de primera mano la correcta recepción de las muestras por el laboratorio. A su vez, debemos asegurarnos de entregar al laboratorio la lista de muestras entregadas y chequear fehacientemente que las muestras entregadas coincidan con la cantidad definida por la planilla de campo con su correspondiente código de rótulo. Dentro de la información a brindar al técnico del laboratorio se encuentra, en primer lugar, el tiempo máximo para realizar el análisis, de lo contrario ésto pondrá en riesgo la rigurosidad de todo el esfuerzo de monitoreo para obtener datos altamente fiables. Cabe resaltar nuevamente que en la logística previa se debe tener en cuenta el aviso a los laboratorios sobre la fecha y horario de entrega de muestras para minimizar los tiempos entre la toma de muestras y los análisis de laboratorio. Mantenimiento de los equipos Una vez finalizado el muestreo, se debe proceder a la limpieza y guardado final de los equipos y elementos de campo utilizados. Los equipos de medición, como los multiparamétricos, deben ser enjuagados intensamente con agua ultrapura y secados a temperatura ambiente. Se deben chequear todos los componentes del equipo antes de guardarlo. Debido a la variedad de equipos existentes, no sería práctico proveer en este punto las recomendaciones técnicas de cada uno. Como regla general, se recomienda fuertemente que los equipos sean guardados, calibrados, mantenidos y utilizados según las especificaciones de cada marca y modelo. A su vez, se sugiere que el equipo sea calibrado antes, durante y luego de su uso en campo. 43 calidad de aguas. Las planillas deben ser de tipo Microsoft© Excel© o similar, para poder realizar los análisis estadísticos y concluir así con datos fiables, expresados en valores promedio con sus respectivos desvíos estándares, para sitio de muestreo. Confección del informe RESULTADOS En esta sección haremos mención a los resultados generados como datos, tanto en el campo como en los laboratorios de análisis. Tenemos que tener en cuenta la calidad de los datos generados y el origen de los mismos para poder evidenciar cualquier error en su cadena de generación. En cuanto a los resultados colectados in situ, se encuentran los datos de los parámetros fisicoquímicos recolectados por la sonda multiparamétrica, los cuales se encontrarán dentro de la memoria interna del equipo. A su vez, tendremos las planillas de campo con la misma información para poder chequear que sea correcta en ambos soportes de información. También tendremos, como información relevada en campo, a los datos de las IFDs (Imágenes fotográficas digitales) que estarán presentes en las memorias utilizadas. Por otro lado, tendremos los informes de los análisis realizados por los laboratorios. Estos informes se generan en soporte digital y también en una copia impresa con la firma de los responsables técnicos de las mediciones realizadas. Ambos sets de datos son de importancia para la base de datos del monitoreo. 44 Informatización de la información En este paso debemos tener mucho cuidado con no pasar por alto ninguna información y que el set de datos que estemos informatizando sea compatible con todos los códigos internos de toma de muestra. Debemos volcar toda la información con los mismos códigos, siguiendo los estándares establecidos en la logística previa de muestreo donde cada sitio del plan de monitoreo tiene un código con la información respectiva del evento de muestreo. La información generada en campo debe ser bajada de los soportes originales (sonda y cámara fotográfica digital) a una computadora y adosada a una planilla general con mayor información donde sean legibles todos los elementos del código de cada muestra (fecha, lugar, características, etc). El mismo procedimiento es aplicable a la información digital que nos será provista por el laboratorio prestador de los servicios de análisis. De esta forma consolidamos una base de datos estandarizada para el análisis del monitoreo de Si bien cada informe sigue líneas específicas, fundamentadas en los objetivos del monitoreo, en líneas generales debe contener la información relevada y su significancia tanto para el ambiente como para el ser humano. La presentación de los resultados debe estar plasmada de forma amena para su rápida interpretación con consideraciones y conclusiones claras que aborden cualquier problemática surgida de los resultados. En este punto, la comparación con los estándares de calidad de agua nacionales y provinciales debe ocupar un lugar de importancia mayor que las consideraciones de tipo cualitativas referentes al monitoreo. Es aconsejable cuando se maneja información de un área importante de superficie con diferentes cursos de agua, la contextualización de los resultados en mapas, con capas de colores en escala, con los valores encontrados y evidenciando los puntos en los cuales se superan los valores guía para diferentes usos. A modo de ejemplo se exponen algunas preguntas generales que deberían ser respondidas por el informe. - ¿La calidad de agua es la misma en todos los sitios? Si no es así, ¿cuáles son las razones (uso de suelo, variaciones climáticas, caudal) de la variación en la calidad del agua? - ¿Hay variación de la calidad de agua a lo largo del tiempo en los puntos de muestreo? ¿Existen tendencias a lo largo de los años o meses del monitoreo? - ¿Cómo se comparan los datos obtenidos con los niveles guía de calidad de agua para diferentes usos? A partir del análisis de los datos podremos mejorar, reorientar y optimizar las futuras campañas de muestreo. A su vez, con la generación de información podremos dar herramientas para la gestión integrada del recurso hídrico, brindando indicadores y puntos de interés. 45 REFERENCIAS BIBLIOGRÁFICAS ANEXO - Auge, M. (2004). Regiones Hidrogeológicas de la República Argentina. La Plata, Buenos Aires, 111 pp. - APHA. (1998). Standard Methods for the examination of Water and Wastewater. 20th Ed. Washington DC: American Public Health Association, - Atlas Digital de los Recursos Hídricos Superficiales de la República Argentina. (2002). Subsecretaría de Recursos Hídricos de la Nación – Instituto Nacional del Agua. CD-ROM, Buenos Aires. - Department of Environment and Heritage Protection. (2009). Monitoring and Sampling Manual 2009, Version 2, State of Queensland, Australia, Julio de 2013, 193 pp. - Department of Water. (2009) Surface water sampling methods and analysis – technical appendices. Standard operating procedures for water sampling - methods and analysis. Government of Western Australia, 66 pp. Listado de Residuos Peligrosos Decreto 831/93, Reglamentación de la Ley N° 24.051. Buenos Aires, 23/4/93 - Department of Water. (2009). Water quality monitoring program design. A guideline to the development of surface water quality monitoring programs. Government of Western Australia, 35 pp. - Environment Protection Authority. (2004). Approved Methods for the Sampling and Analysis of Water Pollutants in New South Wales. Department of Environment and Conservation, Australia, 59 pp. - Environmental Protection Agency, U.S. EPA. (2014). Water Sciencie. Science and Technology. Disponible en: http://www2.epa.gov/science-and-technology/waterscience - Mitchell, M. and Stapp, W. (2012). Red River Basin Water Quality Monitoring Volunteer Manual. USA, 48 pp. - Programa Desarrollo Institucional Ambiental. Control de Contaminación Industrial. (2002). Monitoreo de agua y sedimentos en cursos superficiales y de suelos afectados por contaminantes de origen industrial. Ministerio de Desarrollo Social y Medio Ambiente, Argentina, 174 pp. Niveles guía de calidad de agua para la protección de la biota acuática. Agua dulce superficial (en µg/L). Niveles guía de calidad de agua para fuentes de agua de bebida humana con tratamiento convencional (en µg/L). - Neiff, J. (2012). Los ambientes acuáticos del Litoral. Biodiversidad, 2 (3): 8-13. - U.S.D.A. Forest Service. (2001). Field guide for surface water sample and data collection. U.S.D.A., Washington, USA, 73 pp. - U.S. Geological Survey. (2010). National Field Manual for the Collection of WaterQuality Data. U.S. Department of the Interior, USA. 46 47 Listado de Residuos Peligrosos. Listado de Residuos Peligrosos. Decreto 831/93, Reglamentación de la Ley N° 24.051. Decreto 831/93, Reglamentación de la Ley N° 24.051. CONSTITUYENTE PELIGROSO (µg/L) Agua Agua D CONSTITUYENTE PELIGROSO C.Humano Biota Ac (µg/L) A 2 50 ACRILONITRILO ACROLEINA 542 ALDICARB Agua D C.Humano Biota Ac CONSTITUYENTE PELIGROSO (µg/L) D (2,4-) Agua Agua D CONSTITUYENTE PELIGROSO C.Humano Biota Ac (µg/L) H D ACENAFTILENO ACIDO NITRILO-TRIACETICO Agua HEXACLOROBUTADIENO 100 4,5 HEXACLOROCICLOHEXANO (ISOM) 0,01 1 DIAZINON 20 HEXACLOROCICLOPENTADIENO 1 0,05 0,2 DIBROMOCLOROPROPANO 0,2 HEXACLOROETANO 24 5 DIBROMOETILENO 0,05 HIDROCARB. AR. POLINUCLEARES DICAMBA 120 HIERRO (TOTAL) 3 ALUMINIO (TOTAL) 200 5 AMONIO (ug/1 NH4) 50 1370 0,004 DICLOFOP-METIL 200 2,5 ISOFORONE TEMEFOS TERBUFOS MALATION 190 0,1 TETRACLOROBENCENO (1,2,3,5-) 0,1 100 100 TETRACLOROBENCENO (1,2,4,5-) 0,15 0,1 TETRACLOROETANO (1,1,2,2-) 1,7 24 TETRACLOROETILENO 10 260 TETRACLOROFENOL (2,3,4,6-) 1 1 M 2,5 4 ATRAZINA 3 DICLOROETANO (1,2-) 10 200 MANGANESO (TOTAL) DICLOROETILENO (1,1-) 0,3 12 MERCURIO (TOTAL) 1 DICLOROETILENO (1,2-sis) 70 12 METIL PARATION 7 BENCENO 10 300 DICLOROETILENO (1,2-trans) 100 12 METIL AZINFOS (GUTION) 20 BENCIDINA 0,0015 2,5 DICLOROFENOL (2,4-) 0,03 4 METOLACLOR 50 METOXICLORO 30 METRIBUZINA 80 DICLOROPROPANO (1,2-) 5 BERILIO (TOTAL) 0,039 0,05 DICLOROPROPILENO (1,2-) BHC-ALFA 0,131 0,01 DIELDRIN BHC-BETA 0,232 0,01 DIFENIL HIDRAZINA (1,2) 0,01 DIMETILFENOL (2,4-) 400 0,01 DIMETOATO 20 BHC-DELTA BHC-GAMA (LINDANO) 3 BIS (2-CLOROETIL) ETER 3,85 BIS (CLOROMETIL) ETER 0,000038 BIS (2 CLOROISOPROP) ETER 57 87 2 0,03 0,004 0,3 DINITROFENOL (2,4-) 70 DINITROTOLUENO (2,4-) 1,1 2 DIQUAT 70 21400 DIURON 150 BORO (TOTAL) 1000 BROMETANO 2 ENDOSULFAN 138 0,02 BROMOXIMIL 5 ENDRIN 0,2 0,0023 E C ESTERES FTALICOS (DBP) NITRATO 10000 NITRITO 1000 30 NITROFENOLES PARATION 50 2 PCB - 1232 (AROCHLOR 1232) 2 PCB - 1242 (AROCHLOR 1242) 2 1 PCB - 1248 (AROCHLOR 1248) 2 4 PCB - 1254 (AROCHLOR 1254) 2 4 PCB - 1260 (AROCHLOR 1260) 2 CLORDANO 0,3 0,006 CLOROBENCENO 100 15 FLUORANTENO 190 CLOROFENOL (2-) 0,1 7 FLUORURO (TOTAL) 1500 CLOROFORMO 30 12 FORATO CLOROMETANO 1,9 CLORPIRIFOS 90 CLORURO DE VINILO 20 FENOXIHERBICIDAS (2,4-D) PENTACLOROBENCENO 280 H 100 20 V VANADIO (TOTAL) 100 X XILENOS (TOTALES) 10000 0,01 PENTACLOROFENOL 10 0,5 PLAGUICIDAS TOTALES 100 4 COBRE (TOTAL) 1000 2 HEPTACLORO 0,1 0,01 PLATA (TOTAL) 50 CROMO (TOTAL) 50 2 HEPTACLORO EPOXIDO 0,1 0,01 PLOMO (TOTAL) 50 CROMO (+6) 50 HEXACLOROBENCENO 0,01 0,0065 48 100 U 0,03 P-CLOROMETACRESOL 2 TRIHALOMETANOS URANIO TOTAL 572 PENTACLOROETANO G GLIFOSATO 0,04 0,00079 PCD (TOTAL) 2 18 TRICLOROFENOL (2,4,6-) PCB - 1221 (AROCHLOR 1221) 700 0,65 200 TRICLOROFLUORMETANO 40 2 TRICLOROETANO (1,1,1-) 10 CARBOFURANO FENOL TRICLOROBENCENO (1,3,5-) P 2 30 27 0,2 PARAQUAT PCB - 1016 (AROCHLOR 1016) 5000 0,5 18 PCB (TOTAL) CINC (TOTAL) 0,9 TRICLOROBENCENO (1,2,4-) 45 0,6 700 TRICLOROBENCENO (1,2,3-) 60 10 0,2 F 11 30 ESTERES FTALICOS (DEHP) ETILBENCENO 10 2 TRIBROMONETANO TRICLOROFENOL (2,3,4-) ESTERES FTALICOS (OTROS) 5 230 TRIALATO 25 1 0,2 10 0,008 ORGANOCLORADOS (NO PLAG.) 0,02 100 5 TRICLOROETANO (1,1,2-) 5 CIANAZINA TOXAFENO TRICLOROETILENO 90 CIANURO (TOTAL) 300 10 CADMIO (TOTAL) 100 35 1000 ORGANOCLORADOS TOTALES CARBARIL ESTIRENO 3 TOLUENO 6 O 5 BIS (ETILHELIX) FTALATO 750 TETRACLORURO DE CARBONO 0,03 TP (2,4,5-) 25 NITROBENCENO 2 0,005 N NAFTALENO NIQUEL (TOTAL) 1 TETRACLOROBENCENO (1,2,3,4-) 5 0,01 0,4 0,006 117 DICLOROBENCENO (1,3-) BENZO(A) PIRENO 2 5 DICLOROBENCENO (1,4-) 50 10 T 18 16 DICLOROMETANO SIMAZINE TDE 50 40 1 TALIO (TOTAL) 10 BENDIOCARB 10 300 50 1000 SELENIO (TOTAL ) 0,03 ANTIMONIO (TOTAL) B Biota Ac 280 I 9 DICLOROBENCENO (1,2-) C Humano T (2,4,5-) ARSENICO (TOTAL) BARIO (TOTAL) 1 DDT 0,03 Agua D S 26 ALDRIN 0,001 Agua 0,1 1 0,03 49 GLOSARIO Agua destilada: Agua que es sometida a un proceso de pureza, eliminando microorganismos, sales minerales y otros agentes extraños a la constitución del agua. Por ejemplo, es el líquido obtenido al condensar el vapor producido por el agua al hervir. Antrópico: Efectos, procesos, actividades o materiales que son el resultado de actividades humanas. Antropogénico: Relativo a antrópico. Biodiversidad: Diversidad de especies vegetales y animales que viven en un espacio determinado. Biomasa: Suma total de la materia de los seres que viven en un ecosistema determinado, expresada habitualmente en peso estimado por unidad de área o de volumen. Capa freática: Acumulación de agua subterránea que se encuentra a una profundidad relativamente pequeña bajo el nivel del suelo. Concretamente es un acuífero, con la diferencia de que los acuíferos pueden estar también a mayores profundidades. Edáfico: Relativo al suelo. El estrato edáfico está formado por el suelo y todos los organismos que en él se encuentran. Escorrentía: Agua de lluvia que circula libremente sobre la superficie de un terreno. Ejemplo: El monte reduce enormemente la erosión producida por el viento y la escorrentía. Eutrofización: Acumulación de residuos orgánicos en un cuerpo de agua que causa la proliferación de ciertas algas, entre otros efectos. Fitoplancton: Plancton constituido predominantemente por algas y otros organismos vegetales. 50 In situ: Medición que se realiza directamente en terreno. Ion: partícula cargada eléctricamente constituida por un átomo o molécula que no es eléctricamente neutra. Léntico: Cuerpos de agua cerrados como por ejemplo: Lagunas, lagos y embalses Contrario de Lótico (río). Lótico: Sistema hídrico con gran movimiento de agua como un río, arroyo o manantial. Contrario de Léntico (Laguna, lago, embalse). Mineralización: proceso de descomposición de la materia orgánica del suelo en el cual se libera nitrógeno inorgánico. La mineralización es la transformación del nitrógeno orgánico en amonio, mediante la acción de microorganismos del suelo. En general, el término “mineralización” indica el proceso global de conversión del nitrógeno orgánico en nitrógeno mineral, fundamentalmente nitrato y amonio. Orografía: Parte de la geografía física que describe el relieve. Plancton: Conjunto de seres minúsculos de origen animal (zooplancton) o vegetal (fitoplancton) presentes en aguas, principalmente marinas y de lagos, que constituyen el alimento básico de diversos animales superiores en la cadena trófica. Pluviometría: Estudio y tratamiento de los datos de precipitación que se obtienen en los pluviómetros. Xenobiótico: compuestos cuya estructura química en la naturaleza es poco frecuente o inexistente debido a que son compuestos sintetizados por el hombre en el laboratorio. La mayoría han aparecido en el medio ambiente durante los últimos 100 años.
© Copyright 2026