Manual de Operaciones de Sanidad de Yuca
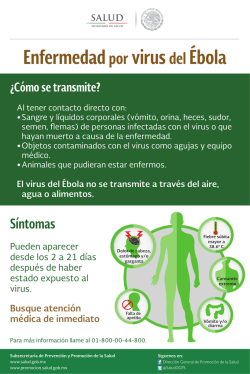
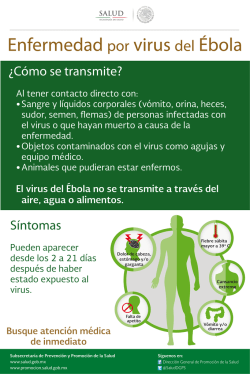
INDEXACIÓN DEL GERMOPLASMA DE YUCA LABORATORIO SANIDAD DE GERMOPLASMA UNIDAD DE RECURSOS GENETICOS Maritza Cuervo, Manuel Guillermo Moreno, Norma Flor, José Luis Ramírez La organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), entidad que mediante programas colaborativos (acuerdos y/ó tratados) entre los gobiernos de diferentes países del mundo, promueve el movimiento seguro de germoplasma siguiendo los mandatos de los planes cuarentenarios de cada país, estipuló que cada material de yuca que se distribuya desde CIAT debe estar evaluado para ciertos problemas de importancia cuarentenaria, que básicamente son agentes causales (hongos, bacterias, virus, etc.) de enfermedades que pueden causar grandes pérdidas economicas al cultivo. (Frison et Al. 1991) En el caso específico de yuca Manihot esculenta Crantz el material vegetativo para intercambio de germoplasma, es producido "in vitro"; por consiguiente las características fitosanitarias son inspeccionadas desde el momento de selección de plantas madres durante el proceso de introducción hasta antes de empacar los materiales para su distribución. Para la obtención de materiales "in vitro" disponibles para distribución se realiza termoterapia y cultivo de meristemos en el laboratorio de conservación in vitro, posteriormente en el laboratorio de sanidad se realiza la indexación de los materiales. Cuando el material a conservar proviene de estacas la indexación comienza con la selección de plantas madres en el campo, cuyas raíces son examinadas para determinar la ausencia de síntomas de la enfermedad "cuero de sapo", se seleccionan tallos de la planta y se siembran en suelo estéril. Al mismo tiempo se realiza la prueba de injerto en un material indicador para diagnosticar la presencia de la enfermedad de esta enfermedad. La planta a la cual se le realizan las pruebas es enviada a la Sección de Cultivo de Tejidos para ser sometida a termoterapia "in vivo" o "in vitro" según se requiera y obtener de los rebrotes meristemas que se cultivan según lo establecido para la especie. Se mantiene la identidad de cada meristema y antes de micropropagar se realiza un nuevo proceso de indexación, una vez certificada la sanidad el material está listo para exportación (Roca et al., 1991). El Laboratorio de Sanidad de Germoplasma (LSG) de la Unidad de Recursos Genéticos (URG) realiza el proceso de indexación para la detección del Virus Común de la Yuca (CsCMV), Virus X de la Yuca (CsXV) y la enfermedad del Cuero de Sapo (FSD) (Figura 1). Debido a que la Colección de yuca está conservada bajo condiciones asépticas en que se multiplica y conserva el material In Vitro, las probabilidades de contaminación por hongos y bacterias son casi nulas. DESCRIPCIÓN DE ALGUNAS ENFERMEDADES VIRALES DEL CULTIVO DE LA YUCA 1.1 Mosaico Común de la Yuca Inicialmente se reportó en el sur del Brasil. La enfermedad ha sido registrada en otros países de Sur América y hay un reporte del Africa y otro del Asia. Tiene mayor incidencia en el Sur del Brasil y Paraguay. No se conoce vector para esta enfermedad y su propagación en los cultivos se atribuye a transmisión mecánica. En general la enfermedad no reviste mayor importancia aunque su incidencia en algunas áreas hace necesario su control. La enfermedad del mosaico común de la yuca es causada por el virus del mosaico común perteneciente al género Potexvirus. Las hojas de la planta de yuca afectadas por CsCMD (por sus siglas en Ingles) desarrollan síntomas de mosaico y clorosis (Calvert et al 1996). En algunos casos, sobre algunas de las hojas afectadas se presentan manchas verdes claras y oscuras delimitadas por las nervaduras. Los síntomas son más severos cuanto más largos sean los periodos relativamente fríos, situación que es frecuente en zonas semitropicales de Sur América. Bajo estas condiciones las plantas afectadas son muchas veces más enanas y las pérdidas en el rendimiento pueden alcanzar hasta un 60 %. Figura 1. Diagrama de flujo indexación de yuca La eliminación de las plantas que expresan síntomas de CsCMV nos permite un control adecuado. La mejor oportunidad para identificar y eliminar las plantas afectadas es sobre los rebrotes, puesto que los síntomas en las hojas primarias son evidentes. Si esto no se lleva a cabo tempranamente, las plantas deben ser marcadas y los tallos quemados después de cosechar las raíces. 1.2 Virus X de la Yuca Es una enfermedad asintomática producida por el virus X de la Yuca. El CSXV no produce síntomas en las plantas infectadas, por lo que se considera de menor importancia, ya que no ocasiona una baja considerable en los rendimientos del cultivo. Fue reportada en la zona Norte de Colombia en 1983. Es transmitido por propagación vegetativa y por inoculación mecánica. Este virus es detectado por medio de la técnica de ELISA. 1.3 Enfermedad del Cuero de Sapo de la yuca La enfermedad denominada "cuero de sapo" fue reportada por primera vez, en 1971, en el Departamento del Cauca, al sur de Colombia (Pineda, 1983). Su origen, parece ser la región amazónica de Brasil o Colombia. Además de Colombia se ha reportado en Brasil, Costa Rica, Panamá, Perú y Venezuela. Entre las enfermedades de la yuca el "cuero de sapo" está considerado como una de las más perjudiciales para el cultivo, puesto que afecta directamente la producción de raíces, provocando pérdidas del 90% o más en el rendimiento. La expresión de síntomas es variable de acuerdo a la temperatura y al genotipo. En algunas variedades las plantas afectadas no presentan señales visibles en su parte aérea y, en algunos casos, hasta puede lucir sana y vigorosa (Lozano et al 1989). En las raíces, los síntomas varían desde muy suaves a severos, dependiendo de la edad de la planta y de factores climáticos. Las condiciones secas o calientes tienden a inhibir el desarrollo de los síntomas, mientras que condiciones más frescas favorecen el desarrollo de éstos. Aún en plantas afectadas levemente, las pérdidas económicas persisten debido a la menor acumulación de almidón. Los síntomas consisten en pequeñas fisuras longitudinales, localizadas cerca del callo donde se originan las raíces y, posteriormente, se prolongan a lo largo de ellas. A medida que las raicillas aumentan de diámetro, las fisuras tienden a cicatrizar, dando a las lesiones forma de labio. La cáscara o epidermis de las raíces presenta una apariencia corchosa que se desprende con facilidad. Según sea la severidad de los síntomas, la profundidad y número de las lesiones aumentan hasta deformar la raíz. En general, el sistema radical de las plantas afectadas no alcanza a tener el mismo desarrollo del que tienen las plantas sanas; las raíces permanecen delgadas, leñosas, de cáscara gruesa y corchosa y su contenido de almidón es muy bajo (Calvert et al, 2002) El agente causal de la enfermedad es aun desconocido pero se ha asociado un virus del grupo de los reovirus con esta enfermedad. La detección de la enfermedad se puede hacer mediante el examen visual de las raíces, observándolas cuidadosamente con el fin de detectar los síntomas característicos, ya sean de carácter leve o severo. Debido a que esta enfermedad es fácilmente transmitida por medio de injertos esta técnica se puede utilizar como otro método de diagnóstico (Calvert et al., 2001). La enfermedad puede ser eliminada por medio de termoterapia y cultivo in-vitro de meristemas (Mafla, 1984), siendo necesario que después de este proceso se realicen injertos a la variedad Secundina para confirmar la sanidad del material. DESCRIPCIÓN DEL PROCESO DE INDEXACIÓN EN LSG 1. Aclimatización de plántulas exvitro Las plántulas In Vitro procedentes del Laboratorio de conservación in vitro se siembran en invernadero, dándoles las condiciones requeridas para que la plántula se desarrolle y se conserve en buen estado agronómico y sanitario bajo condiciones controladas, para su posterior indexación o conservación como bonsái, según el caso de cada accesión. La forma de siembra de estas plántulas es la siguiente: A. En un matero plástico con capacidad de dos litros, se adicionan cuatro centímetros de granito y sobre éste, el sustrato compuesto por una relación de 2:1 de arena y suelo esterilizado al vapor a una temperatura de 150 oC por cuatro horas. (Figura 2 A,B). Figura 2 A. Matero con granito Figura 2 B. Granito y sustrato B. Se golpea la parte inferior del tubo de ensayo con la mano para desprender el medio de cultivo del tubo y se extrae la plántula con unas pinzas las cuales son desinfectadas en alcohol al 70% después de su uso (Figura 3 A,B). Figura 3 A. Desprendimiento de plántula Figura 3 B. Sacar plántula con pinzas C. Se lava la raíz de la plántula con agua destilada removiendo los residuos de medio de cultivo (Figura 4 A,B). Figura 4 A. Eliminación del agar en raíz. Figura 4 B. Eliminación de residuos. D. Con la base de un tubo de ensayo, se abre un hoyo en el sustrato, se introduce la plántula y se adiciona el sustrato de forma que la planta quede firme. En caso de que la planta por su tamaño quede inclinada, es necesario utilizar una pajilla plástica como guía o soporte para mantenerla derecha (Figura 5 A,B,C). Es indispensable desinfectar todos los utensilios y las manos con alcohol al 70% al pasar de una accesión a otra durante la siembra. Figura 5A. Siembra de plántula Figura 5B. Cubrimiento la raíz con sustrato Foto 5C. Soporte para la plántula E. Una vez que cada material es trasplantado, se cubre con un vaso de icopor (con orificios, para permitir el intercambio de aire) por un periodo de tres (3) semanas, hasta que se adapten a las nuevas condiciones ambientales del invernadero (Figura 6 A,B). Figura 6A. Tapar con vaso de icopor Foto 6B. Plántulas establecidas F. La planta se mantiene en invernadero de 3 a 5 meses, hasta alcanzar un tamaño que le permita ser utilizada como patrón para realizar el proceso de injertación (Figura 7). Las plantas se establecen y mantienen en invernadero en condiciones adecuadas para expresión de síntomas (20-30°C) y 2000-5000 lux de iluminación, y cuando hay tejido disponible se toman muestras para realizar pruebas pertinentes. Figura 7. Plantas con el tamaño esperado a 3 meses 2. Detección de la Enfermedad del Cuero de Sapo. Esta enfermedad es fácilmente transmitida por injertos, por este motivo esta técnica es utilizada para su diagnostico. El principio del injerto es trasmitir directamente savia, agua, nutrientes y agentes sistémicos que se pueden encontrar por los haces vasculares de una planta (patrón) a otra planta (injerto); teniendo en cuenta que el patrón son los materiales o variedades que se quieren evaluar y el injerto, es la variedad Col 2063 denominada secundina altamente susceptible a la enfermedad, donde se expresarán los síntomas de mosaico si la enfermedad esta presente. 2.1 Procedimiento de la técnica de injerto realizada. A. Cortar con bisturí dos esquejes del material a evaluar que contengan tres nudos y de igual forma de la variedad indicadora secundina (injerto) teniendo en cuenta que coincida con el diámetro del patrón (Figura 8). Figura 8. Implementos para injertación: Cuchillas desechables, Papel parafilm, esqueje de secundina y esqueje de material a evaluar. B. Realizar un corte de bisel (transversal) en la parte inferior de la Secundina (Figura 9) Figura 9. Corte bisel en la parte inferior de la secundina. C. Realizar un corte bisel (transversal) en la parte superior de los materiales y eliminar todas las yemas presentes, para evitar su desarrollo. En la parte inferior del material realizar un corte cerca de la yema (Figura 10). Figura 10. Corte bisel en la parte superior del material y eliminación de yemas. D. Unir el esqueje del material y la secundina, fijando fuertemente con cinta parafilm para asegurar la unión de las dos estacas. Las yemas deben quedar apuntando hacia arriba. Figura 11. Unión del esqueje del material y la secundina. E. Cubrir el injerto y sellar con cinta parafilm el extremo superior de la estaca del material indicador para evitar su deshidratación (Figura 12) Figura 12. Unión y cubrimiento del injerto con papel parafilm. F. Depositar el injerto en un frasco de vidrio estéril utilizando como sustrato agua destilada estéril (Figura 13). Figura 13. Injerto depositado en frasco de vidrio estéril con su identificación. G. Incubar en cuarto de crecimiento a temperatura entre 25 - 27 0C y un fotoperíodo de 12 horas luz y 12 horas oscuridad, cambiar el agua de los frascos cada dos a tres días. H. Observar y registrar periódicamente la aparición de síntomas característicos de FSD (Clorosis, enrollamiento en los bordes y mosaico) en las hojas de secundina de los injertos. Al cabo de 45 días de incubación evaluar la presencia ó ausencia de la presencia de mosaico en el follaje del injerto de secundina. Documentar todo los resultados como positivos a los que desarrollen los síntomas característicos y negativo a los que no presentan síntomas (Figura 14 A,B). Figura 14 A. Planta enferma con síntomas de FSD Figura 14 B. Plantas sanas sin síntomas de FSD Adicionalmente a esta prueba en este momento se está validando una técnica molecular par la detección de esta enfermedad. 3. Detección de los Virus CsXV y CsCMV Para la detección de CsCMV y CsXV se utiliza la técnica ELISA (Enzyme Linked Immunosorbent Assay), que es un método serológico rápido y eficiente para la detección de virus. Existen varias clases de ELISA, la que se realiza en el Laboratorio de Sanidad de Germoplasma URG para estos virus es la de doble emparedado de anticuerpos (DAS - ELISA) (Velasco et al., 1985) Es necesario aclarar que las gammaglobulinas utilizadas en estas pruebas fueron obtenidas en el laboratorio de Virologia del CIAT. En todas las pruebas se utilizan controles negativos (Plantas sanas) y positivos (plantas afectadas por cada enfermedad) mantenidas en condiciones aisladas. La descripción de la metodología utilizada para estas pruebas se describen en el anexo 1. 4. Documentación de resultados. Después de tener los datos obtenidos en las diferentes pruebas realizadas se procede a registrar en la base de datos todos los resultados obtenidos siguiendo el siguiente procedimiento: A. Ingresar a la base de datos de la URG introduciendo el Nombre de Usuario y Clave Personal, correspondiente al personal encargado, seleccionar la opción YUCA. Seleccione el icono SANIDAD para introducir los datos de los resultados de indexación obtenidos en el proceso (Figura 15). 1 2 3 4 Figura 15. Interfase de entrada a la base de dato de la URG. 1) Selección opción YUCA. 2) Distribución, 3) Invernadero Bonsái, 4) Sanidad. B. Introducir el número de accesión de la plántula analizada. C. Seleccionar la casilla NOMBRE (automáticamente aparecerá en forma abreviada los nombres de los virus de yuca) escoja la forma abreviada del virus al cual se le hizo la prueba, de la siguiente forma: CsXV para el Virus X de la Yuca, CsCMV para el Virus del Mosaico Común de la Yuca y FSD para el Virus Cuero de Sapo de la Yuca (Figura 16). D. Ingresar la fecha de la obtención del resultado. E. Ingresar el(los) resultado(s) obtenido(s) ya sean positivos o negativos de las pruebas realizadas para CsXV, CsCMV y FSD, según el caso. F. Ingresar en la casilla Método, el método utilizado para indexación ya sea INJERTO o RTPCR para FSD o ELISA para CsXV y CsCMV. G. Seleccionar en la casilla Responsable, la persona encargada en realizar la indexación H. Automáticamente el sistema da como disponible el material que tenga ingresados y negativos los resultados para los análisis de los tres virus (CsXV, CsCMV y FSD). Las accesiones no disponibles son todas aquellas que les hacen falta pruebas o que han resultados positivas para alguna de ellas. I. Guardar los datos almacenados. 8 3 2 1 4 5 6 7 Figura 16. Interfase de SANIDAD. Proceso de introducción de resultado en el banco de datos de sanidad de yuca, datos a introducir: 1) Numero de accesión, 2) Nombre virus, 3) Fecha de obtención de resultados, 4) Resultado obtenido (N/P), 5) Método de indexación (Elisa / Injerto), 6) Responsable de la prueba. 7) Casilla de chequeo que indica que accesión esta disponible con un visto bueno (√) o de lo contrario no disponible 8) Guardar J. Enviar una copia de los resultados obtenidos al personal encargado del Banco de Germoplasma de Yuca de URG. K. Documentar los resultados en tablas Excel en medio magnético e impreso. Conservar una copia física de los resultados obtenidos por el lector de ELISA para CsXV y CsCMV. Para el caso del virus FSD una documentación fotográfica donde se puedan observar los criterios de resultados. Cuando el material quede disponible o aceptado para todas las pruebas se prosigue a llevar las plantas a un invernadero específico en donde se tiene la colección Bonsái. Esta colección se mantiene con el objetivo de tener duplicado del banco in-vitro y tener disponibilidad inmediata de material vegetal en caso de ser requerido para trabajos de investigación. REFERENCIAS Calvert L. A., M. Cuervo, M.D. Ospina, C. Fauquet y B.C. Ramírez. Characterizatión of cassava common mosaic virus and a detective RNA species. Journal of General Virology (1996), 77, 525-530. Calvert L., M. Cuervo, B. Pineda. 2001. Cuero de Sapo, una enfermedad que ataca la yuca. Plegable, material para distribución. Calvert L. y M. Cuervo. Enfermedades Vírales de la Yuca en América del Sur. Capitulo 16 de la Obra “La Yuca en el tercer Milenio. Sistemas Modernos de Producción, procesamiento, Utilización y Comercialización”. Producida por el CIAT y el Consorcio Latinoamericano y del Caribe de Apoyo a la Investigación y Desarrollo de la Yuca (CLAYUCA), 2002. Frison E.A. and E. Feliu. 1991. FAO/IBPGR Technical guidelines for the SAFE Movement of Cassava Germplasm. Food and Agriculture Organization of the United Nations, Rome / International Board for plant Genetic Resources. Rome and Centro Internacional de Agricultura Tropical.- CIAT. Lozano, J. C. & Nolt, B. L. 1989. Pest and pathogens of cassava. Pages 174-175 in: Plant Protection and Quarantine: Selected Pests and Pathogens of Quarantine Significance Vol. 2 R.P. Kahn, ed., CRC Press, Pr. Inc., Boca Raton FL Maffla, G. Roa, J.C. & Roca, W.M. 1984. Erradicación de la enfermedad cuero de sapo de la yuca Manihot esculenta, pro medio del cultivo de meristemos. Efecto de la termoterapia, y del tamaño del explante sobre la tasa de saneamiento. In: Perea D. & Angarita, Z.A. eds. Congreso Nacional de Cultivo de Tejidos Vegetales, Bogotá, Colombia, 1984. Memorias. Bogotá, U. Nacional de Colombia. Pp. 171-175. Pineda, B., Jayasinghe, U., and Lozano, J. C. 1983. La enfermedad "Cuero de Sapo" en yuca (Manihot esculenta, Crantz). ASIAVA 4: 10-12. Roca W., Luis A. Mrogisnki. CIAT.1991. Cultivo de Tejidos en la Agricultura: Fundamentos y Aplicaciones. . Anexo 1. PRUEBA INMUNO-ENZIMÁTICA (ELISA) PARA LA DETECCIÓN DE LOS VIRUS CsXV y CCMV PROCEDIMIENTO : 1.- Diluir la gamma-globulina con el buffer de cubrimiento y agregar 100 ul de esta solución a cada uno de los pozos de una placa de microtitulación. Incubar a 37 C durante 3-4 horas. 2.- Lavar la placa con el buffer PBS-Tween por 4 veces usando un frasco lavador o el equipo mecanico de lavar platos de ELISA. En el lavado inicial, enjuagar los pozos y descartar el buffer de inmediato. En los lavados siguientes, dejar el buffer de cada lavado durante 3 minutos. 3.- Macerar las muestras a probar, en una dilucion 1/10, con el buffer para muestras y agregar 100 ul de cada muestra en dos pozos diferentes y separados. Incubar a 4-6 C durante toda la noche. Incluir muestras de controles conocidos: sano, enfermo y además el buffer para muestras solo, con el propósito de chequear la reacción. 4.- Lavar nuevamente la placa, de igual forma que en el paso 2, teniendo cuidado de remover todo residuo de las muestras. 5.- Diluir la gamma-globulina marcada con la enzima (conjugado) con el buffer para el conjugado y agregar 100 ul de la solución a cada pozo de la placa. Incubar a 37 C durante 3-4 horas. 6.- Lavar, muy bien, la placa como en el paso 2. 7.- Preparar una solución fresca de p-nitrofenil fosfato (substrato de color) a 0.6-1 mg/ml en buffer para el substrato y agregar 100 ul en cada pozo. Incubar a temperatura ambiente durante 20-60 minutos. La placa se puede guardar a 4-6 C durante toda la noche y leer otra vez. 9.- Obtención de resultados: a) Visualmente, usando preferiblemente un visor con luz. b) Por absorbancia a 450 nm usando un espectrofotómetro. Se considera "positivo" todo aquel valor mayor a 2 veces el valor del control sano. Durante los períodos de incubación la placa debe cubrirse. Es importante mantener una temperatura uniforme a través de toda la placa pare evitar los efectos de bordes Diluciones de Gammaglobulina y conjugados utilizadas: Virus Virus X de la Yuca (CsXV) Mosaico Común de la Yuca (CsCMV) Dilución Gamaglobulina 1/1600 1/2500 Dilución conjugado 1/1100 1/2000 REACTIVOS Y SOLUCIONES: Todas las soluciones buffers deben guardarse a 4-6 C. Buffer PBS (pH 7.4): Cloruro de sodio Fosfato de potasio monobásico Fosfato de sodio dibasico. 12 hidratado Cloruro de potasio Volumen final con agua destilada 8.0 gr 0.2 gr 2.9 gr 0.2 gr 1 litro Buffer PBS-Tween: es buffer PBS + 0.5 ml Tween-20 por litro. Buffer de cubrimiento (pH 9.6) Carbonato de sodio anhidro Bicarbonato de sodio Azida de sodio Volumen final con agua destilada 0.318 gr 0.586 gr 0.04 gr 200 ml. Buffer para muestras (antigeno): es buffer PBS-Tween conteniendo 2% polivinil-pirrolidona, P.M. 40.000(PVP-40). Preparar fresco cada vez que se vaya a usar. Buffer para el conjugado: es el buffer para muestras conteniendo 0.2% de albúmina de huevo (ovalbúmina) para inhibir las reacciones no especificas. Preparar fresco cada vez que se vaya a usar. Buffer para el substrato (pH 9.8): Dietanolamina Agua destilada Azida de sodio pH (con HC1) 9.8 Volumen final con agua destilada 9.7 ml 80.0 ml 0.02 gr 100.0 ml
© Copyright 2026