Esavi por Vacuna (, 5.93 Mb, 90 págs.)
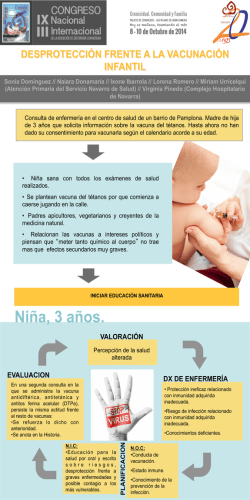
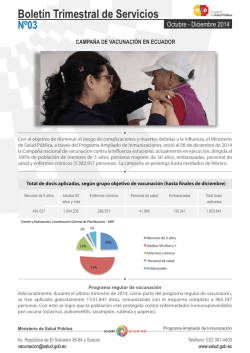
INSTITUTO DE SALUD DEL ESTADO DE MÉXICO SUBDIRECCIÓN DE EPIDEMIOLOGIA DEPARTAMENTO DE SALUD DEL NIÑO Y ADOLESCENTE DEPARTAMENTO DE VACUNACIÓN 26 de Agosto 2015 Quien administra una vacuna: EPV Tipos de vacunas Qué contiene Dosis (cantidad) Esquema Intervalos Vía y Sitio de administración Eventos Supuestamente Atribuibles a la Vacunación o Inmunización Contraindicaciones y Precauciones, evitar OPV BCG SRP SR VACUNAS ATENUADAS SABIN (POLIO ORAL) Rotavirus VARICELA PENTAVALENTE ACELULAR INFLUENZA TOXOIDES (Td) VACUNAS INACTIVADAS VPH Tdpa NEUMOCOCO CONJUGADA HEPATITIS B NEUMOCOCO 23 VALENTE HEPATITIS A Antibiótico Adyuvante Estabilizadores Conservadores Antígeno (s) Conservadores Fenol 2-Fenoxietanol Timerosal Adyuvantes Hidróxido de aluminio Fosfato de aluminio Sulfato de aluminio Inactivantes Antibióticos BNeomicina propiolactona Estreptomicina Glutaraldehído Polimixina B Formaldehído VACUNA Estabilizadores Lactosa Sacarosa Glicina Gelatina Seroalbúmina Nacimiento BCG 1ª Hep B 2 meses 4 meses 6 meses 7 meses 12 meses 1ª SRP 1ª 3ª 2ª Pentavalente Pentavalente Pentavalente Acelular Acelular Acelular 2ª Hep B 18 meses 4ª Pentavalente Acelular 4 años 6 años 11 años y 5° año DPT 2ª SRP VPH 3ª Hep B 1ª Rotavirus 2ª Rotavirus 1ª Neumo Conjugada 2ª Neumo Conjugada 3ª Rotavirus 3ª Neumo Conjugada 1ª Anti Influenza 2ª Anti Influenza Refuerzo anual Antiinfluenza, Octubre a Enero VOP (Sabin) en 1ª y 2ª Semanas Nacionales de Salud * (* después de 2 dosis previas de IPV) PROGRAMA DE VACUNACIÓN UNIVERSAL Y SEMANAS NACIONALES DE SALUD LINEAMIENTOS GENERALES 2015. Edad de vacunación Virulencia residual (VA) Respuesta inmunológica Dosis de vacuna y # Componentes de la vacuna Técnica de aplicación Criterios CIOSM de clasificación de las RAM Frecuencia Muy frecuente o muy común Frecuente o común Infrecuente (poco frecuente) o poco común Rara Muy rara Significado Frecuencia mayor o igual a 1 caso por cada 10 pacientes que entran en contacto con el medicamento. Se expresa ≥ 1/10 (≥ 10%) Frecuencia mayor o igual a 1 caso por cada 100 pacientes, pero menor a 1/10. Se expresa ≥1/100 (≥ 1 %) y < 1/10 (< 10%) Frecuencia mayor o igual a 1/1,000 pero menor de 1/100. Se expresa ≥ 1/1,000 (≥ 0.1%) y < 1/100 (< 1 %) Se producen con una frecuencia mayor o igual a 1/10,000 pero menor que 1/1,000. Se expresa ≥ 1/10,000 (≥ 0.01%) y < 1/1,000 (< 0.1%) Se producen con una frecuencia menor de 1/10,000. Se expresa <1/10,000 (<0.01%) CIOSM: Consejo de Organizaciones Internacionales de las Ciencias Médicas (entidad en la esfera de la Organización Mundial de la Salud) de la clasificación de las RAM (reacciones adversas a medicamentos) CASO DE VACUNACIÓN 1. A Juanito lo vacunaron con BCG y anti hepatitis B al nacimiento en el hospital donde usted trabaja, pero no le explicaron a la mamá qué eventos más frecuentes podría tener Juanito. Usted es acomedido y le explica lo siguiente a la mamá: A. Lo más frecuente que ocurre es que a Juanito le van a salir unas bolas en la axila o en el cuello del lado izquierdo que van a doler, se van a romper las lesiones y a supurar, por lo que lo debe llevar a revisión en cuatro semanas con su médico. Le puede salir también un absceso o tener lesiones en los huesos a causa de la vacuna. También aparece un nódulo en el sitio de la aplicación durante los primeros 10 días de aplicada la vacuna. Con vacuna contra la hepatitis B lo mas frecuente es que tenga nauseas, vómito, diarrea y mucha fiebre. CASO DE VACUNACIÓN 1. A Juanito lo vacunaron con BCG y anti hepatitis B al nacimiento en el hospital donde usted trabaja, pero no le explicaron a la mamá qué eventos más frecuentes podría tener Juanito. Usted es acomedido y le explica lo siguiente a la mamá: B. Aparecerá una lesión en la piel, primero como una pápula, luego una mancha o mácula roja, que se endurece y entre la 4ª y 6ª semana se forma un nódulo, que aumenta de tamaño y se forma un pequeño absceso, que se ulcera, sólo debe lavar con agua y jabón; luego se forma una costra entre la 6ª y 12ª semana de aplicación, se cae y deja una cicatriz de 10 mm o de menor tamaño. Con la vacuna vs Hepatitis B va a tener dolor, inflamación, enrojecimiento o irritabilidad en las primeras 48 hrs. Bacterias enteras atenuadas (vivas). Frasco Multidosis, requiere reconstitución. Tokio172 Liofilizado: estabilizador Glutamato de sodio monohidratado en polvo, Bacillus CalmetteGuerin vivos atenuados*. Disolvente: Solución isotónica de cloruro de sodio* Intradérmica. BD. 0.1 mL Fuente: *Inserto Tuvax CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Eventos locales 6 12 semanas* - 12 meses 4 Lesión local, 90-95% 6 meses* 2 6 semanas* semanas* Vacunación 3 Costra. Cicatriz 10 mm. 10-20% no la tienen. Nódulo Eritematoso. 1 a 2 semanas aumenta. Absceso que se Ulcera: ¡LAVAR AGUA y JABÓN! Nódulo precoz Mácula. 2-3 sem. Roja. Indura 3ª a 4ª semana. Pápula. 15-30 min *periodo de inicio Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 Normal and abnormal BCG reactions. NTI News Letter Vol. 15: 65 Local reaction in BCG vaccination. Bull. World Hlth Org. 1950, 2: 441-468 www.pediatriconcall.com/fordoctor/diseasesandcondition/print.aspx CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. 12 meses e m s 2 Linfadenitis no supurativa 6 meses* anas* Vacunación 3 1 y 6 % de los vacunados 1 ganglio linfático (axilar o cervical) >1 cm de diámetro Ipsilateral No supuración, no eritema, no dolor, no fiebre *periodo de inicio CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Linfadenitis no supurativa Linfadenitis no supurativa HK J Paediatr (New Series) 2011;16:85-94 http://www.hkjpaed.org/details.asp?id=782&show=1234 12 meses Linfadenitis supurativa meses* Vacunación 6 5 a 6 meses 3 meses* 387 casos por millón de personas vacunadas 25 a 387 casos por un millón de dosis 100 a 1000 por un millón de dosis Representa de 0.03% -0.05% de los vacunados 1 ganglio linfático >1.5 cm de tamaño/ trayecto fistuloso Axilar mismo lado de la aplicación. Inflamación fluctuante, edema y eritema en la piel subyacente. *periodo de inicio Vaccine, 2009 OPS/OMS Vacunación Segura Linfadenitis supurativa Linfadenitis Linfadenitis simple o no supurativa Tratamiento Recuperación espontánea Sólo hacer seguimiento Supuración 30% a 80% de los casos de linfadenitis por BCG No puncionar No es necesario usar medicamentos. Linfadenitis supurativa Tratamiento: Aspiración con aguja Manejo quirúrgico Isoniacida o eritromicina no modifican la evolución Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. BCG diseminada (BCGosis) 2 meses* 1 mes* Vacunación 1 <5 por cada millón de vacunados Fatal 1 de cada 1 millón de vacunaciones (0.19 a 2.0 casos por millón de dosis aplicadas) Inmunodeficiencia primaria 0.06-1.56 casos /millón de vacunados , mortalidad ~60% Clinical Infectious Diseases, 1997;24:1139– 46 Rev Chil Enf Respir 2009; 25: 29-38 Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. OPS/OMS Vacunación Segura *periodo de inicio Diseminación del BCG (BCGosis) Sx de inmunodeficiencia combinada severa, enfermedad granulomatosa crónica, Sx de Di George, deficiencia homocigota completa o parcial del receptor de interferón gamma "Síndrome de predisposición mendeliana a infecciones micobacterianas" (PMIM). Enviar a especialista para evaluación y tratamiento Clinical Infectious Diseases, 1997;24:1139– 46 Rev Chil Enf Respir 2009; 25: 29-38 CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Diseminación del BCG (BCGosis) Clinical Infectious Diseases, 1997;24:1139– 46 Rev Chil Enf Respir 2009; 25: 29-38 Braz J Infect Dis 2011; 15(1):83-86 Osteítis/osteomielitis por BCG (6-36 meses) 0.01 casos por millón de dosis aplicadas Epífisis de huesos largos Enviar a especialista para evaluación y tratamiento Tratamiento antituberculoso. Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 Lesiones osteolíticas por BCG Osteomielitis post vacunación con BCG Indian Pediatrics 2008; 45:930-932 J Bras Pneumol. 2009;35(3):285-289 Abscesos 25/1000 o <1/10000 Diámetro entre 11 y 20 mm en el 95% de los casos. Inadecuada técnica (exceso dosis) Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 Otras Lesiones granulomatosas y tuberculoides. Exantemas generalizados Meningitis tuberculosa Histiocitomas e infiltrados neumónicos por BCG Reacción lupoide limitada y el lupus tuberculoso real (1/200,000 dosis) Reacciones alérgicas: Muy raras. Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 The Eyes of Children around the World Recombinante, antígeno de superficie de HB Hidróxido de aluminio Tiomersal Formaldehído Intramuscular. MI. BD. 0.5 mL Fuente: Certificado de análisis de producto terminado. Archivo CeNSIA Inserto Vacuna de la Hepatitis B (rADN) (Serum Institute of India LTD) y Probivac-B CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Anafilaxia 2 días 1 día Eventos locales Eventos sistémicos 30 días Vacunación Dolor: niños 3-9% adultos 13-29% Eritema, induración. Fatiga, cefalea, irritabilidad. Adultos 11-17%, niños 20% Fiebre Adultos 1%, niños 0.4-6.4% 1/6000,000 dosis (VAERS, EEUU)* <1-2 casos /un millón de dosis 30 minutos-2 horas *OPS/OMS Vacunación Segura Postgrad Med J, 2002;78: 327-329 Vaccine, 2009 ESAVI Vacuna VS Hepatitis B Frecuencia* Frecuentes ≥1/100 y < 1/10 Eventos Dolor, enrojecimiento, induración, hinchazón en el lugar de inyección ≥ 1 % y < 10% Fatiga, fiebre, malestar, síntomas parecidos a gripe. Mareos, cefalea, parestesias Nauseas, vómito, diarrea, dolor abdominal Artralgia, mialgia, rash Exantema, prurito, urticaria Raras ≥ 1/10,000 y < 1/1,000 ≥ 0.01% y < 0.1% Muy raras <1/10,000 (<0.01%) **Resultados anormales en las pruebas de función hepática * Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud;de la clasificación de las RAM (reacciones adversas a medicamentos) **no se ha establecido relación causal con la vacuna, estudios post comercialización. Ficha técnica del producto Inserto Vacuna de la hepatitis B (rADN). Serum institute of India LTD CASO DE VACUNACIÓN 1. En su segundo mes de vida a Juanito le aplican la vacuna contra la difteria, tos ferina, tétanos, poliomielitis inactivada e infecciones por Haemophilus influenzae tipo b. Juanito podría tener los siguientes eventos más frecuentes en las primeras 48 hrs de la vacunación: A. Fiebre >39°C, enrojecimiento e hinchazón >5cm en el lugar de la inyección, llanto prolongado, inconsolable. B. Anafilaxia, reacciones hipotónicas o episodios de hipotonía-hiporrespuesta. C. Induración en el sitio de la vacunación/inflamación o eritema >7.0cm, llanto incontrolable y prolongado, convulsiones y urticaria. D. Enrojecimiento, dolor e inflamación en el lugar de la inyección, fiebre >38°C, disminución del apetito, irritabilidad, llanto anormal, somnolencia o vómito. E. Fiebre >40°C. Edema de una o ambas extremidades inferiores. The Eyes of Children around the World • En México desde 2007 • Combinada y conjugada (DPaT+VIP+Hib): Toxoide Diftérico Toxoide Tetánico adsorbida Antígenos de Bordetella pertussis: Hemaglutinina filamentosa purificada Toxoide pertússico purificado adsorbido Poliovirus tipo 1, 2 y 3 inactivados Polisacárido capsular Hib conjugado a la proteína tetánica. *OPS/OMS Vacunación Segura IPP del producto Liofilizado: polisacárido Hib conjugado a proteína tetánica Diluyente. Neomicina, estreptomicina y polimixina B Hidróxido o fostafo de aluminio Fenoxietanol Formaldehído Medio de Hanks, sacarosa, trometamol y agua. Intramuscular. MD.BI. 0.5 mL Fuente: Certificado de análisis de producto terminado. CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Inserto y/o IIP del producto Pentaxim 3 días 2 días 1 día 30 días Vacunación Anafilaxia Eventos Eventos locales s istémicos Enrojecimiento, dolor, inflamación. <1%-25% Induración >2cm en el lugar de la inyección Llanto persistente e incontrolable >3 horas, somnolencia y malestar general. Fiebre: <2%-10% Edema >5 cm de una o ambas extremidades inferiores. Raro. (3-5 días) Rara. Inicia 30 minutos-2 horas Southeast Asian J. Trop. Med. Public Health 2009; 40 (2): 282–294. Pediatrics 1999; 103 (1): 25-30. Southeast Asian J. Trop. Med. Public Health 2010; 41 (2): 450–462. Indian Pediatr 2009; 46 (11): 975–982. IIP Pentaxim ESAVI Vacuna DPaT+VIP+Hib Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Poco frecuentes ≥ 1/1000 a <1/100 ≥ 0.1% a < 1 % Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% No conocida o muy rara Eventos Enrojecimiento, dolor e inflamación en el lugar de la inyección. Fiebre 38°C Disminución o pérdida del apetito Nerviosismo, irritabilidad, llanto anormal Somnolencia Vómito Induración en el lugar de la inyección Diarrea Insomnio Fiebre 39°C, enrojecimiento e hinchazón 5cm en el lugar de la inyección Llanto prolongado, inconsolable Fiebre 40°C. Edema de una o ambas extremidades inferiores. **Eventos anafilácticos como edema facial, edema de Quincke o choque. Convulsiones con o sin fiebre Reacciones hipotónicas o episodios de hipotonía-hiporrespuesta. Erupción. Urticaria *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud;de la clasificación de las RAM (reacciones adversas a medicamentos) **Estudios post comercialización. Ficha técnica del producto CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. CASO DE VACUNACIÓN 1. Con la vacuna contra neumococo conjugada que tiene en su Centro de Salud, ¿usted qué eventos esperaría más frecuentes en los primeros dos días de aplicada la vacuna?: A. Urticaria, prurito, rubor, angioedema, hipotensión, choque, sibilancia, estridor laríngeo/edema laríngeo. B. Fiebre, eritema, induración/inflamación o dolor/sensibilidad en el sitio de la vacunación, eritema en el sitio de 2.5cm-7.0cm, disminución del apetito, irritabilidad o sueño. C. Induración en el sitio de la vacunación/inflamación o eritema > 7.0cm, con llanto y urticaria o rash parecido a urticaria. D. Ocurrirá un evento súbito dentro de las 48 horas, por lo general en menos de 12 horas de la vacunación y dura de un minuto a varias horas, con hipotonía, respuesta reducida a los estímulos y palidez o cianosis . E. Crisis convulsivas, asociados o no con fiebre. The Eyes of Children around the World Conjugadas (13v:CRM197) (10v: prot. D HiNT, toxoide tetánico y diftérico) Fosfato de aluminio Polisorbato 80, cloruro de sodio Intramuscular. MD.BD. 0.5 mL Inserto Prevenar 13 Inserto Synflorix 10 CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. 3 días 2 días 1 día 30 días Vacunación Anafilaxia Eventos Eventos sistémicos locales Dolor, inflamación, enrojecimiento e induración >2cm en el lugar de la inyección Somnolencia, pérdida del apetito Fiebre: (1/3), > 39°C (1/20) Malestar e irritabilidad Muy Rara IPP del producto MMWR, 2010; Morb Mortal Wkly Rep. 59 (9): 258–261. Pediatrics, 2010; 126: 186-190. Global Vaccine Safety, 2012. CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Poco frecuentes ≥ 1/1000 a <1/100 ≥ 0.1% a < 1 % Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% ESAVI Vacuna contra neumococo 13 valente Eventos Fiebre, eritema, induración/inflamación o dolor/sensibilidad en el sitio de la vacunación. Eritema en el sitio de la vacunación o induración/inflamación de 2.5cm-7.0 cm (dosis en lactantes y niños de 2 a 5 años). Disminución del apetito Irritabilidad Somnolencia/disminución del sueño Diarrea, vómito Rash Fiebre >39°C, eritema en el sitio de vacunación o induración/inflamación de 2.5-7.0 cm (después de 3 dosis); dolor en el sitio de vacunación/ sensibilidad que interfiere con el movimiento Induración en el sitio de la vacunación/inflamación o eritema > 7.0cm Llanto Convulsiones (incluye convulsiones febriles) Urticaria o rash parecido a urticaria Episodio hipotónico-hiporrespuesta Reacción de hipersensibilidad incluyendo edema facial, disnea, broncoespasmo. Apneas en prematuros < 28 semanas de gestación *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud; de la clasificación de las RAM (reacciones adversas a medicamentos). Ficha técnica del producto Prevenar 13 valente Polisacáridos capsulares purificados Fenol Tiomersal (una presentación) Intramuscular. BD. Eventos sistémicos 5 días 3 días 2 días 1 día Eventos locales Dolor (60%), eritema (16.4%), de la temperatura local, inflamación e induración (20.3%) Astenia y fatiga 13.2%, mialgia 6.1% Fiebre (≤38.8°C) 1% Muy Rara *OPS/OMS Vacunación Segura 30 días Anafilaxia 4 días Vacunación ESAVI Vacuna contra neumococo 23 valente Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Poco frecuentes ≥ 1/1000 a <1/100 ≥ 0.1% a < 1 % Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% Eventos Sensibilidad o dolor en el lugar de inyección, eritema, calor, induración e inflamación. Fiebre Irritabilidad, dolor de cabeza. Artralgias y mialgia. Rash, prurito. Escalofrío, malestar, fatiga Disminución del apetito, náuseas y vómito. Vértigo. Artritis. Linfadenopatía. Reacciones de hipersensibilidad, incluye reacciones anafilactoides. Urticaria, rash versículo buloso. Decoloración de la piel del lugar de inyección. *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud;de la clasificación de las RAM (reacciones adversas a medicamentos). Ficha técnica del producto CASO DE VACUNACIÓN 1. Acudió un niño de 8 meses de edad para aplicación de la última dosis de vacuna contra Rotavirus, cinco días después de la vacunación el niño presenta irritabilidad, dolor abdominal, llanto, evacuaciones sanguinolentas, vómito y distención abdominal. Usted determina que: A. La temporalidad de la aparición de los síntomas se considera relacionada con la aplicación de la vacuna, la edad de la administración no es correcta. B. Es un evento muy frecuente que se relaciona con la vacuna contra el rotavirus, por lo que inicia el estudio de caso. C. Estos síntomas No se relacionan con la vacuna. D. Definitivamente fue causado por la vacuna, ya que hasta el 0.1% de los vacunados pueden desarrollar estos síntomas. © Sally Watts RV1 Virus vivos atenuados. Derivado de cepa humana. RV5 Virus vivos. Recombinación genética (humano-bovino) RV1: sacarosa, adipato disódico, medio de Eagle modificado por Dulbecco (DMEM), agua estéril. RV5: sacarosa, citrato de sodio, hidróxido de sodio, polisorbato 80, medio de cultivo, dihidrógeno fosfato Vía oral 1.5 o 2 mL Fuente: Inserto Rotateq Rotarix CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Tiempo de excreción del virus vacunal Vacuna RV1 Vacuna RV5 Antígeno viral Antígeno viral # dosis Día post vacunación % de excreción en heces # dosis Día post vacunación % de excreción en heces 1ª 7 50-80 1ª 7 8.9 3 17.4 3ª 7 0.3 7 4 2ª * Excreción de 10 días en promedio, con un máximo de excreción alrededor del día 7 *Ruiz-Palacios GM, et al. N Engl J Med, 2006; 354(1):11-22. **Vesikari T, et al. N Engl J Med, 2006; 354:23-33 ** 1ª dosis, 4-6 días después: 17 de 134 receptores de vacuna ( 12.7%) 2ª dosis, 4-6 días después: 0/109 3ª dosis: 0/99 Vacunación Eventos Anafilaxi a sistémicos 42 días RV5 10 días 9 días 8 días 7 días 6 días 5 días 4 días 3 días 2 días 1 día Inv. Int. Fiebre ≥ 38.1°C (20.9%) Diarrea (17.6%) Vómitos (10.1%) Nasofaringitis (0.6%) Otitis media (0.3%) Broncoespasmo (<0.1%) Anafilaxia. Invaginación intestinal, 0.1% N Engl J Med 2006; 354 (1): 23-33. J Pediatr 2004; 144 (2): 184-90. Vaccine 2011; 29 (16): 3061-6 CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. ESAVI Vacuna contra Rotavirus RV5 Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Poco frecuentes ≥ 1/1000 a <1/100 ≥ 0.1% a < 1 % Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% Eventos Diarrea, vómitos Fiebre Somnolencia Regurgitación de alimentos Fatiga. Infección del tracto respiratorio superior Hematoquecia, dolor abdominal superior Erupción Nasofaringitis, otitis media Invaginación intestinal (dolor abdominal intenso, vómitos persistentes, sangre en las heces, distención abdominal y fiebre). Urticaria Broncoespasmo **Irritabilidad. Angioedema. Reacción anafiláctica. *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud; de la clasificación de las RAM (reacciones adversas a medicamentos). Ficha técnica del producto **Frecuencia no conocida, vigilancia post-comercialización CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. CASO DE VACUNACIÓN 1. El abuelito de Juanito, que es diabético y tiene 50 años, durante la temporada invernal lo vacunaron contra influenza, nunca antes lo habían vacunado, 2 horas después de la vacunación presentó fiebre de 40°C, dolor de garganta, cefalea, mal estado general, tos, coriza; usted determina que: A. La temporalidad de la aparición de los síntomas se considera relacionada con la aplicación de la vacuna, la vacuna es la que provocó los síntomas. B. La vacuna puede provocar influenza, y los síntomas son relacionados a esto. C. El abuelito de Juanito seguramente previo a la vacunación tuvo contacto con alguien enfermo, desarrollando síntomas de influenza. The Eyes of Children around the World Inactivada (Formaldehído), subunidad. Virus se cultivan en huevos de gallina embrionados. Timerosal (multidosis). Gelatina. Intramuscular. MI.BI. 0.5 mL IPP del producto. CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Eventos sistémicos 42 días Vacunación 42 1 2 días 3 Eventos locales Dolor, eritema, sensibilidad, inflamación e induración Febrícula, escalofríos, malestar general y mialgia Fatiga, dolor de cabeza y artralgia 1-2 días 2 días Reacciones alérgicas muy raras (hipersensibilidad a la proteína residual del huevo) Síndrome de Guillain-Barré 1caso/1,000,000 dosis. Sin relación causal. 6 semanas despues ESAVI de Vacuna anti Influenza Inactivada Eventos En el sitio de inyección Sensibilidad Eritema Inflamación Induración Equimosis Sistémicos Fiebre** Vómito Llanto anormal Somnolencia Pérdida del apetito Irritabilidad Niños de 6-35 meses de edad Frecuencia de eventos % Dosis 1 Dosis 2 (N*=90-92) (N*=86-87) Cual- Mode- Grave Cualquiera1 Moderado¥ § quiera1 rado¥ 47.3 8.8 0.0 56.3 3.4 29.3 0.0 0.0 32.2 1.1 16.7 0.0 0.0 14.9 0.0 14.4 0.0 0.0 16.1 0.0 14.4 1.1 0.0 14.9 2.3 11.0 6.6 31.9 26.4 23.1 42.9 4.4 1.1 11.0 1.1 8.8 19.8 0.0 0.0 0.0 0.0 0.0 1.1 10.3 8.1 18.6 26.7 19.8 34.9 3.4 5.8 7.0 4.7 4.7 5.8 Grave § 1.1 0.0 0.0 0.0 0.0 1.1 0.0 2.3 0.0 0.0 1.2 ESAVI de Vacuna anti Influenza Inactivada Adultos 18-64 años de edad Frecuencia de eventos % Dosis 1 Dosis 2 Eventos (N*=90-92) (N*=86-87) Frecuencia de eventos % 1 Evento (N*=1392-1394) En el sitio de la inyección Eritema 13.2 Induración 10.0 Inflamación 8.4 Dolor 53.7 Prurito 9.3 Equimosis 6.2 Sistémicos Cefalea 30.3 Malestar 22.2 Temblor 6.2 Fiebre¶ 2.6 La vacuna está hecha por subunidades del virus, por lo tanto NO CAUSA LA ENFERMEDAD Síndrome de Guillain Barré Es esperado 1 caso para cada 100,000 habitantes en E.E.U.U. Asociado con la vacuna de influenza: la gran mayoría de las investigaciones realizadas con la vacuna inactivada estacional no se ha comprobado esta asociación, a excepción de la vacuna aplicada en 1976. CDC H1N1 Flu/ General Questions and Answers on Guillain Barré síndrome (GBS) CASO DE VACUNACIÓN 1. Juanito ya cumplió un año, le administran en su Centro de Salud la vacuna triple viral, 8 días después de la vacunación presenta fiebre de 38.3°C, coriza y exantema maculopapular; usted piensa que: A. La temporalidad de la aparición de los síntomas se considera relacionada con la aplicación de la vacuna, explica a la mamá de Juanito que son eventos asociados a la vacuna. B. Juanito tiene datos de sarampión, por lo que inicia el estudio de caso, se pone en contacto con Epidemiología. C. Estos síntomas No se relacionan con la vacuna. D. Los síntomas son de rubeola, por lo que realiza un cerco vacunal. Virus vivos atenuados. Liofilizado. Monodosis, multidosis. Cultivos de embrión de pollo (SP) Sulfato de neomicina Lactoalbúmina, gelatina, sorbitol, maltosa Subcutánea. BI. 0.5mL IPP del producto. CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Vacunación Eventos locales Eventos sistémicos 35días Encefalopatía 21 días 15 días 12 días 11 días 10 días 9 días 8 días 7 días 6 días 5 días 4 días 3 días 2 días 1 día 35 Dolor leve y sensibilidad en el sitio de la inyección, enrojecimiento y eritema 3-8% Fiebre, coriza, conjuntivitis. 5-15% 1-2 días Exantema Púrpura trombocitopénica 2-3 días 2% 33/1,000,000 dosis Convulsiones febriles 333/1,000,000 dosis 1-2 días 3-6 semanas Encefalopatía 1/1millón d. Vacunación Fiebre, exantema 21 días 15 días 12 días 11 días 10 días 9 días 8 días 7 días 6 días 5 días 4 días 3 días 2 días 1 día 35 días Eventos sistémicos 5-15% 1-2 días Linfadenopatía Artralgias Artritis 0-3% (niños y hombres) 1 día-3 semanas 25% (mujeres adolescentes y adultas) 10% (mujeres adolescentes y adultas) Vacunación Anafilaxia días Eventos sistémicos 21 días 15 días 14 días 12 días 11 días 10 días 9 días 8 días 7 días 6 días 5 días 4 días 3 días 2 días 1 día 35 Fiebre 1-2% Inflamación de la glándula parótida 1-2% Meningitis aséptica 1/11,000 cepa Urabe AM9 Anafilaxia, 1/1 millón. Orquitis < 4 días ESAVI Vacuna SRP Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Poco frecuentes ≥ 1/1000 a <1/100 ≥ 0.1% a < 1 % Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% Muy raras: <1/10, 000 (<0.01%). Eventos Enrojecimiento en el lugar de la inyección, fiebre 38°C (rectal) o 37.5°C (axilar/oral) Dolor e inflamación en el lugar de la inyección, fiebre >39.5°C (rectal) o >39°C (axilar/oral) Infección del tracto respiratorio superior Aumento de tamaño de la glándula parótida, diarrea, vómitos Tos, bronquitis Conjuntivitis Anorexia Linfadenopatía Otitis media Convulsiones febriles Reacciones alérgicas Trombocitopenia Nerviosismo, llanto anormal, insomnio **Meningitis, epididimitis, síndrome atípico leve o atenuado similar al sarampión-paperas, mielitis transversa, síndrome de Guillain Barré, neuritis periférica, eritema multiforme, síndrome de Kawasaki. *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud; de la Autismo. clasificación de las RAM (reacciones adversas a medicamentos). Ficha técnica del producto PriorixTM **No se ha establecido relación causal CASO DE VACUNACIÓN 1. A la mamá de Juanito le toca su refuerzo de toxoide antitetánico y antidiftérico de cada 10 años, el servicio de enfermería del hospital a donde acudió le administró la vacuna en el glúteo derecho, cinco días después tiene dolor y equimosis de 15 cm en el sitio de la aplicación, con formación de una tumefacción blanda de 8x11cm, dolorosa a palpación, fluctuante, bien definida, y no puede mover la extremidad inferior derecha; usted considera que: A. La temporalidad de la aparición de los síntomas está relacionada con la aplicación de la vacuna, explica a la mamá de Juanito que son eventos asociados a la vacuna, recomienda masajes, ejercicios y valoración por médico. B. Tiene neuritis, que se puede presentar en 0.5-1 caso/100,000 dosis aplicadas, por lo que lo envía con el médico. C. Estos síntomas se relacionan con la inadecuada técnica de aplicación de vacuna. Toxoides. Formaldehído. Trazas de neomicina, estreptomicina y polimixina B Fosfato de aluminio. Hidróxido de aluminio. Mercurotiolato sódico (DPT) Timerosal Intramuscular. BI. 0.5 mL IPP del producto. CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Vacunación 1 2 sistémicos 3 28 TOXOIDE TETÁNICO 42 días Eventos 30 días Eventos locales días TOXOIDE DIFTÉRICO Dolor (25%), eritema (85%) Nódulo en el sitio de inyección 1-2 días Fiebre, malestar general, temblores, mialgias y cefalea. (0.5-10%) Absceso estéril 6-10 casos/1,000,000 dosis Rubor, dolor e induración (11 y 38%) 1-2 días Fiebre, malestar general, temblores, mialgias y estornudos (<1%) Anafilaxia 1-6casos/1,000,000 dosis Hipersensibilidad de tipo Arthus Neuritis braquial 0.5-1 caso/100,000 dosis Síndrome de Guillain-Barré 1caso/10,000 dosis • Respuesta cutánea inflamatoria localizada por el depósito de complejos inmunitarios en vasos sanguíneos dérmicos. • Edema}hemorragia • Necrosis tisular • En individuos sensibilizados • Respuesta inflamatoria aguda en el sitio donde se deposita en antígeno dentro del tejido 1 2 3 30 días Vacunación EventosEventos sistémicos locales días 7 Dolor, eritema, edema e induración Nódulo subcutáneo 1-2 días Semanas Fiebre >38°C, llanto, escalofríos, irritabilidad y malestar general:1-2 días Frecuencia de ESAVI Vacuna DPT ESAVI Tasa según vacunados Fiebre >39°C 1/20-1/16 Absceso estéril 1/67,000-1/1000 Shock 1/17,500-1/2000 Convulsiones 1/25,000-1/1500 Llanto persistente 1/14,000-1/50 1/750,000-1/30,000 (<10/millón Eencefalopatías 1 2 30 días Vacunación Evento s locales Eventos sistémicos días 3 Dolor sitio de inyección Inflamación Eritema 77.8% 20.9% 20.8% 65.7% 21.0% 24.7% Dolor de cabeza Cansancio Fiebre (38°C) 43.7% 30.2% 5% 33.9% 24.3% 1.4% Mialgias Artralgias, artritis Escalofríos Diarrea Náuseas 30.4% 11.3% 15.1% 10.3% 13.3% 21.9% 9.1% 8.1% 10.3% 9.2% Ficha técnica del producto AdacelBoostTM CASO DE VACUNACIÓN 1. En la escuela de la hermana de Juanito, aplicaron la vacuna bivalente contra el virus del papiloma humano a un grupo de 20 niñas de 5° grado de primaria; la hermana, estando de pie y antes de administrarle la vacuna, se encontraba ansiosa y al ver la aguja palideció un poco, posterior a la aplicación se desmayó; enfermería la asistió y se recuperó sin secuelas; usted advierte que: A. La temporalidad de la aparición de los síntomas está relacionada con la aplicación, es un evento muy frecuente con este tipo de vacuna, por lo que le diría a la mamá no aplicarle la segunda dosis. CASO DE VACUNACIÓN 1. En la escuela de la hermana de Juanito, aplicaron la vacuna bivalente contra el virus del papiloma humano a un grupo de 20 niñas de 5° grado de primaria; la hermana, estando de pie y antes de administrarle la vacuna, se encontraba ansiosa y al ver la aguja palideció un poco, posterior a la aplicación se desmayó; enfermería la asistió y se recuperó sin secuelas; usted advierte que: B. La presencia de este síntoma se relaciona con vacunación masiva, por miedo y angustia generalizada a la vacunación, es un evento raro, debe tomar precauciones antes de la aplicación. C. Estos síntomas se relacionan con la inadecuada técnica de aplicación de vacuna. Recombinante, VLP (Virus-Like Particles) principal proteína de la cápside L1. VPH2: AS04 [500 μg de hidróxido de aluminio hidratado y 50 μg de 3-O-desacil-4’-monofosforil lípido A (MPL)] VPH4: 225 g de hidroxifosfato sulfato de aluminio amorfo Intramuscular. B. 0.5 mL Fuente: Inserto e IPP CeNSIA. Manual de Eventos Supuestamente Atribuibles a la Vacunación o Inmunización. 2014. Secretaría de Salud. Vacunación ) 1 2 3 30 días Eventos locales 4 5 Dolor (78-80%), >5cm (6%) Inflamación (26%), enrojecimiento (30%) Fiebre (3%), erupción (1%), urticaria (0.46%) Fatiga (33%), cefalea (30%), mialgia (28%), Prurito (9%), artralgia (10%), Síntomas gastrointestinales (13%) Reacciones alérgicas muy raras (hipersensibilidad a la proteína residual del huevo) Einstein Mh; et al(2011). Hum Vaccine:7(12):1343-58 Einstein MH, et al.(2009). Human Vaccines:5(10):705-19. días ESAVI Vacuna Bivalente (VPH2) Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Poco frecuentes ≥ 1/1000 a <1/100 ≥ 0.1% a < 1 % Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% Muy raras: <1/10, 000 (<0.01%). Eventos Dolor, eritema, inflamación en el lugar de la inyección Fatiga, mialgia Dolor de cabeza Dolor articular Fiebre ≥ 38°C Náuseas, vómito, diarrea y dolor abdominal Prurito (comezón) Infección de vías respiratorias superiores Induración y parestesia local Mareo Desmayo a veces acompañado de temblores o rigidez Urticaria Erupción con prurito en las manos y los pies Inflamación de los ojos y la cara Dificultad para respirar o tragar Caída repentina en la presión arterial y pérdida del conocimiento Nerviosismo, llanto anormal, insomnio *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud;de la clasificación de las RAM (reacciones adversas a medicamentos). Ficha técnica del producto CervarixTM Vacunación 1 2 3 4 5 30 días Eventos Eventos sistémicos locales 15 Dolor (80-84%), eritema (25%), inflamación 25% > 5 cm (5.7%) Fiebre (10.1-13%), cefalea (26-28%), urticaria (3%) Mialgia (2%), disnea (4%), artralgia (1%) Síntomas gastrointestinales (17%) Nasofaringitis (5.8%), dolor en toda la extremidad (2.7%) Síncope: vacunación masiva en adolescentes 82/1 millón Anafilaxia (ambas vacunas) 1.7-2.6 casos/1 millón. Einstein Mh; et al(2011). Hum Vaccine:7(12):1343-58. Einstein MH, et al.(2009). Human Vaccines:5(10):705-19. Vacunación Segura OPS: días ESAVI Vacuna Tetravalente(VPH4) Frecuencia* Muy frecuentes ≥1/10 (≥ 10%) Eventos Enrojecimiento, dolor e inflamación en el lugar de la inyección. Dolor de cabeza Frecuentes ≥1/100 a < 1/10 ≥ 1 % a < 10% Raras ≥ 1/10,000 a < 1/1,000 ≥ 0.01% a < 0.1% Muy raras: <1/10, 000 (<0.01%). Fiebre. Prurito; hematoma en el lugar de la inyección. Dolor en la extremidad Urticaria Síndrome de Guillain-Barré Síncope acompañado algunas veces de movimientos tónicoclónicos. Artralgia, mialgia. Celulitis en el lugar de inyección Trastornos de la sangre y del sistema linfático Púrpura trombocitopénica idiopática, linfadenopatía Astenia, escalofríos, fatiga, malestar, vómitos *Frecuencia según CIOSM: (Consejo de Organizaciones Internacionales de las Ciencias Médicas , entidad en la esfera de la Organización Mundial de la Salud;de la clasificación de las RAM (reacciones adversas a medicamentos). Ficha técnica del producto GardasilTM No se ha establecido relación causal Es esperado 1 caso para cada 100,000 (habitantes en E.E.U.U.) Asociado con la vacuna vs VPH: aunque se han reportado o casos posterior a la aplicación de la vacuna, no ha habido ninguna indicación de que se ha aumentado la tasa de GBS por encima de la tasa esperada en la población general. General Questions and Answers on Guillain Barré síndrome (GBS) CASO DE VACUNACIÓN 1. Juanito ya cumplió dos años, no tiene enfermedades asociadas ni toma medicamentos inmunosupresores, ha cumplido con su esquema de vacunación en tiempo y forma; durante la Segunda Semana Nacional de Salud le administra dos gotas de vacuna oral contra la poliomielitis, usted considera que los eventos locales más frecuentes que le pueden ocurrir a Juanito con la vacuna aplicada son: A. B. C. D. Poliomielitis Paralítica Asociada con Vacuna o Postvacunal Poliomielitis Paralítica Derivada de la Vacuna o Postvacunal Diarrea, fiebre, vómito, mal estado general y escalofríos La vacuna antipoliomielítica oral no produce eventos locales asociados a la vacunación o inmunización, tampoco hay eventos sistémicos frecuentes. The Eyes of Children around the W orld ) Virus vivos; 1, 2 y 3. Estreptomicina, neomicina Vía oral. 0.1 ml Parálisis Caso receptor V O P días Vacunación 40 Vacunación 2 3 días 4 Riesgo 1 caso receptor 1 persona/1.5 millones dosis Riesgo 1 caso contacto 1 persona/2.2 millones dosis 1ª dosis eficiencias 3,200-6800 v. + alto Inmunod Parálisis Caso contacto V O P días -30 Bulletin of the World Health .66(6):739-746 (1998). 4 0 4 días 1 85 días http://www.who.int/wer POST ERRADICACION 1995 a 2009 PAIS Millones de Recién Nacidos Casos reportados de VAPP Casos VAPP por millón de RN Casos VAPP esperados en ese período * ARG 10345 4 0.4 41 BOL 3926 1 0.3 16 BRA 51801 17 0.3 207 CHI 3878 4 1.0 16 COL 13726 3 0.2 55 CUB 2005 1 0.5 8 ECU 4404 0 0.0 18 GUT 6338 0 0.0 25 HAI 4054 1 0.2 16 HON MEX 2980 2 0.7 12 32791 2 0.1 131 PAR 2264 1 0.4 9 PER 9354 2 0.2 37 URU 799 2 2.5 3 8742 2 0.2 VEN Casos VAPP esperados, asumiendo 4 casos por millón de RN. Según el Report of theTechnical Consultive Group, WHO/Geneva, Nov 2002 * 35 GRACIAS A QUE USTED APLICÓ LAS VACUNAS A TIEMPO, JUANITO ES UN NIÑO SANO Y TAMBIÉN FELIZ Jesus Fuentes. Santiago Pinotepa Nacional Oaxaca 88 Hay un tiempo para dejar que sucedan las cosas, y un tiempo para hacer que las cosas sucedan. Vacuna a tiempo Detecta, clasifica, notifica, investiga, evalúa y sigue los ESAVIS GRACI Todos los niños, ASlas vacunas, todas todos los días MIENTRAS TÚ LOS QUIERES, LAS VACUNAS LOS PROTEGEN The Eyes of Children around the World Niña con flores, Oaxaca, México
© Copyright 2026