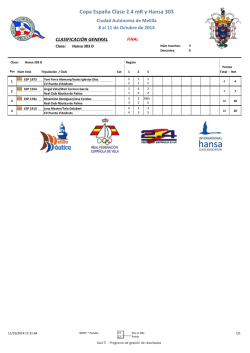
revista completa en pdf - Sociedad Española de Hidrología Médica
Boletín de la Sociedad Española de Hidrología Médica Vol. 30 Núm. 1 (Enero-Junio 2015) ISSN: 0214-2813 Boletín de la Sociedad Española de Hidrología Médica CUARTA ÉPOCA. AÑO 2015 (Enero-Junio). VOL. 30. Nº 1 BOLETÍN DE LA SOCIEDAD ESPAÑOLA DE HIDROLOGÍA MÉDICA Fundado en 1877 como “Anales de la Sociedad Española de Hidrología Médica”, con ISSN 0214-2813 y Depósito Legal: M. 15.724-1962 es la publicación oficial de la Sociedad Española de Hidrología Médica. Lagasca, 40 - 1º Izq. – 28001 Madrid Telf. 639 739 738 www.hidromed.org – [email protected] Presidente Vicepresidente Secretaria General Tesorero Vocales Juan Carlos San José Rodríguez Francisco Maraver Eyzaguirre Mª Ángeles Ceballos Hernansanz Miguel Ángel Colomer Rodríguez Francisco Armijo Castro Marta Arribas Rioja Juan Andrés Barroso Fernández Alberto Cerrada Fernández Pilar Diestro Sáncho Nuria Gonzalo García Inés Martínez Galán Luís Ovejero Ovejero Mª Jesús Pascual Segovia Manuel Andrés Perea Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1 Boletín de la Sociedad Española de Hidrología Médica Boletín de la Sociedad Española de Hidrología Médica órgano oficial de la Sociedad Española de Hidrología Médica, está dirigido y coordinado en la Cátedra de Hidrología Médica Facultad de Medicina - Universidad Complutense de Madrid Plaza Ramón y Cajal s/n 28040 Madrid Teléfono: +34 91 3941667 Fax: +3491 3941417 [email protected] http://www.hidromed.org/hm/ Directores Francisco Maraver. Universidad Complutense de Madrid Juan Carlos San José. Presidente SEHM Secretaria Francisco Armijo. Universidad Complutense de Madrid Iluminada Corvillo. Universidad Complutense de Madrid. Consejo de Redacción Lourdes Aguilera. Universidad Complutense de Madrid Alberto Cerrada. Centro de Talasoterapia Elba. Estepona, Málaga Pilar Diestro. Balneario de Baños de Montemayor, Cáceres Ana Isabel Martín-Megías. Servicio de Termalismo. IMSERSO, Madrid Carla Morer. Thalasso Center. San Pedro del Pinatar, Murcia Icíar Vázquez. Instituto Geológico Minero. Tres Cantos, Madrid Mª Lorena Vela. Balneario Cadas de Boí, Lérida Consejo Asesor Antonio Álvarez-Badillo. Universidad Complutense de Madrid Marta Arribas. Balneario Isla de La Toja, Pontevedra Juan Andrés Barroso. Balneario de Archena, Murcia Julio Cascallar. Gran Hotel La Toja, Pontevedra Mª Ángeles Ceballos. Universidad Europea de Madrid José Manuel Carbajo. Laboratorios Skinwine. Jerez de la Frontera Miguel Ángel Colomer. Balneario de Archena, Murcia Concepción Cuenca. HU Clínico San Carlos, Madrid Mª Dolores Fernández-Marcos. Balnearios de Caldaria Termal, Ourense Miguel Ángel Fernández-Torán. Hervideros de Cofrentes, Valencia Ramón Figuls. Termas Victoria. Caldas de Montbuy, Barcelona Antonio Freire. Gala Termal. Mondariz, Pontevedra Idoia Garaizabal. Balneario de Cestona, Guipuzcoa Nuria Gonzalo. HU Infanta Sofía. San Sebastián de los Reyes, Madrid Joaquín Guillén. Estación Termal Sicilia-Serón. Jaraba, Zaragoza Miguel Martín-Matali. Balneario de Retortillo, Salamanca Consejo Asesor Inés Martínez-Galán. Universidad de Castilla-La Mancha Rosa Meijide. Universidad de La Coruña Encarnación Montejo. Balneario de Ledesma, Salamanca Lourdes Mourelle. Universidad de Vigo Araceli Muela. Estación Termal La Roche-Posay, Francia Jaime Murillo. Baños de Fitero, Navarra Eduardo Navarro, Universidad de La Laguna Luís Ovejero. Balneario de Archena, Murcia Víctor Palencia. Termas Pallarés. Alhama de Aragón, Zaragoza Manuel Andrés Perea. Madrid Enrique Piedras. Talaso Louxo La Toja. Pontevedra Pilar Rodríguez-Espinosa. Balneario de Lanjarón, Granada Luís Rodríguez-Míguez. Universidad de Vigo Juan Antonio Rodríguez-Sánchez. Universidad de Salamanca Margarita Romero. Universidad Complutense de Madrid Carmen San José. Universidad de Sevilla Ascensión Sánchez-Carrión. Balneario Termas Romanas, Lugo Pablo Saz. Universidad de Zaragoza Concepción Serrano. Balneario de Alange, Badajoz Silvia Torres. Universidad de Extremadura Vasilio Varas. Balneario de La Hermida, Cantabria Boletín de la Sociedad Española de Hidrología Médica ISSN: 0214-2813 Vol. 30, Núm. 1 Enero-Junio 2015 ........................................................................................................................................................................................ Sumario Pág. Editorial ¿Quo vadis? Boletín F. MARAVER 9-11 Artículos Peloides naturales versus peloides diseñados y fabricados CSF. GOMES, JBP. SILVA, JHC. GOMES 15-36 El agua de mar en la alimentación y en la terapéutica DA. FLÓREZ, BV. BERNABÉ 37-55 Águas subterrâneas do setor norte de Portugal continental: Enquadramentos geográfico e geológico, tipologias e aproveitamentos A. SOUSA OLIVEIRA 57-71 El Canal de Isabel II C. FULGENCIO, E. BRIVIESCA 73-88 Contenido en Fe, Cu y Zn en las aguas mineromedicinales españolas F. ARMIJO, I. VÁZQUEZ, I. CORVILLO, D. TENAS, M. CAPDEVILA, F. MARAVER 89-98 Legislación Reseñas Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 3 3 Boletín de la Sociedad Española de Hidrología Médica ISSN: 0214-2813 Vol. 30, Núm. 1 January-June 2015 ........................................................................................................................................................................................ Contents Pag. Editorial Quo vadis? Boletin F. MARAVER 9-11 Articles Natural peloids versus designed and engineered peloids CSF. GOMES, JBP. SILVA, JHC. GOMES 15-36 Seawater in food and therapeutic DA. FLOREZ, BV. BERNABE 37-55 Groundwaters in northern of Portugal: geographical and geological settings, hydrochemical typologies and exploitations A. SOUSA OLIVEIRA 57-71 The Canal de Isabel II C. FULGENCIO, E. BRIVIESCA 73-88 The Fe, Cu and Zn content in Spanish mineral waters F. ARMIJO, I. VÁZQUEZ, I. CORVILLO, D. TENAS, M. CAPDEVILA, F. MARAVER 89-98 Legislation References Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 5 5 EDITORIAL Editorial ¿Quo vadis? Boletín Francisco MARAVER(1-2) (1) Escuela Profesional de Hidrología Médica, Facultad de Medicina, Universidad Complutense de Madrid, Madrid, España (2) Departamento de Medicina Física y Rehabilitación. Hidrología Médica, Facultad de Medicina, Universidad Complutense de Madrid, Madrid, España [email protected] Recibido: 09-12-14 Aceptado: 17-12-14 Hoy sale a la luz el volumen treinta de la cuarta época de nuestro Boletín. Y al iniciar la redacción de este editorial, no he podido menos que evocar otro día de diciembre, de hace 30 años, en que antes de marchar de vacaciones navideñas a Jerez, recogía en su domicilio a mi maestro el profesor Manuel Armijo para acompañarle a la calle Virgen de África del Parque de las Avenidas de Madrid, dónde tenía sus instalaciones Gráficas Zamora, la imprenta donde se comenzó a editar. Íbamos ilusionados pues llevabamos los manuscritos del primer número que vería la luz en enero de 1986; precisamente en su editorial podia leerse: “llegamos al momento presente y al inicio de la cuarta época del Boletín de la Sociedad Española de Hidrología Médica, y en su nueva singladura se pretende, con una periodicidad exquisita, llevar a sus lectores las noticias más sobresalientes de la Hidrología nacional y extranjera, haciédose el medio más adecuado para difundir los trabajos de la especialidad que, por su interés, pueden ser ventajosos para la práctica crenoterápica”1. Curiosamente, ése y no otro es el objetivo del actual equipo editorial del Boletín desde que la Junta Directiva nos confiara este año su dirección. Pero no hemos de olvidar de donde venimos. Desde que se creara la Sociedad Española de Hidrología Médica (SEHM) en 1877, su objetivo fue el estudio de las fuentes minerales de España y los progresos de la Hidrología Médica2, y para conseguir estos fines se acordó fundar un periódico que publicara los trabajos y discusiones de la Sociedad y propagara los conocimientos hidrológicos. Así el 5 de marzo del mismo año se presentó con el nombre de Anales de la Sociedad Española de Hidrología Médica3, siendo su ógano de expresion hasta el año 1936. Durante este período no todo fueron facilidades, apareciendo numerosas dificultades, sirvan de ejemplo, algunas de tipo económico que posibilitarón que durante el bienio 1886-87 fuera órgano oficial de la Sociedad El Genio “Médico-Quirúrgico”4, o disensiones de tipo interno entre los socios que provocaron a principio del siglo XX la aparición de la Revista Médico-Hidrológica Española publicación alternativa5 o la la supresión por decreto del Cuerpo de Médicos de Baños6. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 9-11 9 ISSN: 0214-2813 Maraver F ¿Quo vadis? Boletín Con la aparición el año 1950 del Boletín Español de Hidrología Médica y Climatología se cierra un parentesis de dieciocho años sin prensa hidrológica en nuestro país, jalonado por acontecimientos importantes como fueron: la disolución y rehabilitación del Cuerpo de Médicos de Baños en el período republicano; el conflicto civil y las convocatorias de las últimas oposiciones al Cuerpo de Baños en los años 45 y 47. El alma y director de la publicación fué Juan de Dios García Ayuso, secretario por entonces de la SEHM. Debido a los escasos medios, con que contaba el Boletín, se publicó como suplemento o publicación filial (como la llama su director) de la revista de medicina Domus Medici de la Asociación de la Prensa Médica Española7. En 1952 se creó el Instituto “Alfonso Limón Montero” de Hidrología y Climatología Médica bajo los auspicious del Consejo Superior de Investigaciones Científicas. Su director fué el profesor San Roman Rouyer, Catedrático de Hidrología y Climatología de la Facultad de Medicina de la Universidad Central, donde tambien radicaba el citado Instituto. Cómo órgano de difusion del mismo se editarón los Anales Hispanoamericanos de Hidrología Médica y Climatología. Concretamente vieron la luz tres volúmenes: el I, en 1954; el II, en 1955 y, el III, en 19588. La tercera época, en que la SEHM dispone de órgano de difusion coincide con la toma de poseción como presidente, por primera vez, del profesor Armijo, y dura tres años, precisamente el tiempo que permanence su Junta Directiva. Apareció cuatrimestralmente, durante tres años, en ocho ocasiones9-10-11. Con estas premisas y al dia de hoy, a la pregunta ¿quo vadis? Boletín, el equipo editorial no tiene más estrategia que seguir las directrices señaladas por la Fundación Española para la Ciencia y la Tecnología (FECYT) dependiente del Ministerio de Economía y Competitividad y recogidas en la Memoria titulada “La Edición de Revistas Científicas: Directrices, Criterios y Modelos de Evaluación” realizadas en la Universidad de Granada por Delgado et al12. REFERENCIA NORMALIZADA Maraver F. Editorial. ¿Quo vadis? Boletin. Bol Soc Esp Hidrol Med. 2015; 30(1): 9-11 BIBLIOGRAFIA 1. 2. 3. 4. 10 Editorial. Bol. Soc. Esp. Hidrol. Méd. 1986;1(1): 3-4. Maraver F, Covillo I. Historia de La Sociedad Española de Hidrología Médica. Siglo XIX. Madrid: Complutense. 2006, pp. 274. Corvillo I. Los Anales de la Sociedad Española de Hidrología Médica. Indización y juicio crítico (1877-1898). [Tesis Doctoral]. Madrid: Universidad Complutense, 1994. Maraver F. El Genio “Médico-Quirúrgico” órgano oficial de la Sociedad Española de Hidrología Médica (1886-1887). Bol. Soc. Esp. Hidrol. Méd. 1995;10(1): 56. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 9-11 Maraver F 5. 6. 7. 8. 9. 10. 11. 12. ¿Quo vadis? Boletín Rodríguez-Sánchez JA. La supresión del Cuerpo de Médicos de Baños (1932-1936). In: Castellanos Guerrero J et al. (coords.). La Medicina en el siglo XX. Málaga: Universidad de Málaga, 1997: 269-80. Rodríguez-Sánchez JA. Institucionalización de la Hidrología Médica en España. Balnea. 2006;1:25-40. Maraver F, Covillo I. La publicación científica especializada. En: Armijo M, Ceballos MA, Corvillo I, Maraver F, San Jose JC, San Martin J. Hidrología. Madrid: OMC. 1990, 43-56. Cuenca C. Los Anales Hispanoamericanos de Hidrología Médica y Climatología. Indización y juicio crítico (1954-1958) [Tesis Doctoral]. Madrid: Universidad Complutense, 2005. Garcia de Leaniz J. Sociedad Española de Hidrología Médica (Anales y Boletines). Bol. Soc. Esp. Hidrol. Méd. 1987;,2(1):5-7. Armijo F. Manuel Armijo Valenzuela. Balnea 2012; 7: 95-134. Rodríguez-Rodríguez LP. Discurso de precepto, en nombre de la Academia, a cargo del Excmo. Sr. D. … . Solemne Sesión Necrológica en memoria del Excmo. Sr. D. Manuel Armijo Valenzuela 19 de junio de 2012. An R Acad Nac Med (Madr) 2012;129(4):387-429. Delgado E, Ruiz-Pérez R, Jimenez E. La Edición de Revistas Científicas: Directrices, Criterios y Modelos de Evaluación. Granada FECYT. 2006, pp. 263 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 9-11 11 ARTICULOS Natural peloids versus designed and engineered peloids Gomes CSF(1), Silva JBP(1), Gomes JHC(1) (1) GeoBioTec, Research Unit of FCT (The Foundation for Science and Technology), University of Aveiro (Portugal) [email protected] Recibido: 20-11-14 Aceptado: 24-11-14 Abstract The present study pretends to show what distinguishes natural peloids from artificial peloids. The last peloids referred to although being based mainly on natural constituents too, since they undergo design, manipulation, refining, maturation and beneficiation in an artificial environment are hereafter called designed and engineered peloids. Natural peloids are being less and less used in Thermal spas or Health resorts of all countries where traditionally have been used, and the reasons for that will be herewith referred to. It will be shown that the designed and engineered peloids could advantageously replace the use of natural peloids in Thermal spas, the advantages being threefold: 1. Simple composition based on raw materials, such as the almost monomineralic commercial clays kaolin or bentonite of both therapeutic and cosmetic grades, and the natural mineral water from a particular Thermal spa also recognized by their medicinal properties; 2. Easy incorporation of pharmacologically and medically recognized functional active principles, natural or synthetic, and inorganic or organic, into the maturated paste prepared with kaolin/natural mineral water or bentonite/natural mineral water; 3. Simple and effective sanitary control. Therefore, the identification, the control and the assessment of the healing action particularly provided by both natural mineral water and functional active principles existing in a certain peloid would be much easier with the simple composition of a designed and engineered peloid than with the complex composition of a natural peloid. Key words: natural peloid, designed and engineered peloid, comparative advantages, peloid properties and functions, peloid functional additives Peloides naturales versus peloides diseñados y fabricados Resumen El presente estudio pretende mostrar lo que diferencia a los peloides naturales de los peloides artificiales. Los últimos, aunque se basan principalmente también de componentes naturales, ya que se someten a diseño, manipulación, depuración y maduración, se elaboran Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 15 ISSN: 0214-2813 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids en un ambiente artificial, en adelante son denominados aquí peloides diseñados y fabricados. Los peloides naturales están siendo cada vez menos empleados en los balnearios o centros termales de todos los países en los que tradicionalmente se han utilizado, las razones serán referidas. Se verá que los peloides diseñados y fabricados podrían reemplazar ventajosamente el uso de los peloides naturales en centros termales, siendo triples las ventajas: 1. Composición simple basada en materias primas, principalmente arcillas minerales comerciales caolín o bentonita, ambas con calidades terapéuticas y cosméticas, y el agua mineromedicinal de un centro termal concreto también reconocida por sus propiedades medicinales; 2. Fácil incorporación de principios activos funcionales reconocidos farmacológica y médicamente, naturales o sintéticos, y orgánicos o inorgánicos, en la pasta madurada preparada con caolín/agua mineromedicinal o bentonita/agua mineromedicinal; 3. Control sanitario simple y eficaz. Por lo tanto, la identificación, el control y la evaluación de la acción curativa, sobre todo proporcionado, tanto por el agua mineromedicinal como por los principios activos funcionales existentes en un determinado peloide sería mucho más fácil con la simple composición de un peloide diseñado y fabricados que con la compleja composición de un peloide natural. Palabras clave: peloide natural, peloide diseñado y fabricado, ventajas comparativas, peloide propiedades y funciones, peloide aditivos funcionales REFERENCIA NORMALIZADA Gomes CSF, Silva JBP, Gomes JHC. Natural peloids versus designed and engineered peloids. Bol Soc Esp Hidrol Med, 2015; 30(1): 15-36 INTRODUCTION Clay and mineral water are natural mineral resources which are considered as being major constituents of most natural peloids and artificial peloids. Clay and mineral water typologies are main conditioning factors of peloid properties and functions (Veniale, 1999; Tateo et al., 2006; Gomes & Silva, 2007; Fraioli et al., 2011; Gomes, 2013; Casás et al., 2013; Gomes & Rautureau, 2013; Pozo et al., 2013). On the one hand, the use by humans of clay for healing and wellness purposes is most probably as old as mankind (De Vos, 2010; Gomes, 2013). For medicinal purposes clays or clay minerals (the clay essential constituents) can be used internally or orally (e.g., the so-called edible clays) and externally or topically (e.g., the so-called peloids). Some types of clay are being used for therapeutic purposes, for instance as gastrointestinal ailments, as well as for nutritional and/or religious purposes (Bech, 1987, 1996; Robertson, 1996; Carretero, 2002; 16 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Reinbacher, 1999, 2003; Gomes & Silva, 2007; Carretero et al., 2006; Carretero & Pozo, 2007; Carretero & Pozo, 2009; Gomes et al., 2008; Ferrel, 2008; Kikouama et al., 2010). Also some types of clay, as is the case of the so-called green clays, have been the object of studies that demonstrate their bactericide character (Williams et al., 2004; Williams et al., 2008; Williams et al., 2010; Williams et al., 2011; Otto & Haydel, 2013). Clays such as kaolin, bentonite, palygorskite, sepiolite and talc are reported in Pharmacopoeias, and being considered medicines they could participate in pharmaceutical formulations as active principles and/or excipients (Viseras & LopezGalindo, 1999; Lopez-Galindo & Viseras, 2004; Lopez- Galindo et al., 2007; Viseras et al., 2007; Viseras et al., 2010). In particular, the use of kaolin and bentonite in human health, have been the object of significant research (Novelli, 1996, 1998, 2000; Cara et al., 2000; Viseras et al., 2006; Williams et al., 2009; Casás et al., 2011; Carretero et al., 2013; Williams et al., 2014). Kaolin and bentonite in order to be used as pharmaceutical and cosmetic raw materials must be chemically, microbiologically and mineralogically innocent, what means that no human toxic and carcinogenic elements (As, Pb, Cd, Hg,…) or compounds (crystalline silica), and no pathogenic microorganisms (Escherichia coli, Pseudomonas aeruginosa, Salmonella spp., and Staphylococcus aureus) should be present in the clay, unless in contents that fulfill the guidelines set forth by different Pharmacopoeias. For instance, according to US Pharmacopoeia (2007) and European Pharmacopoeia (2005), Pb and As contents in bentonite should not be higher than 40ppm and 5ppm, respectively. Also, according to Viseras et al., 2006, the content of crystalline silica in bentonite must not be higher than 2%. Microbiologically bentonite should not be contaminated with E. coli and the total viable aerobic count must not be greater than 103 microorganisms per gram (US Pharmacopoeia, 2007, and European Pharmacopoeia, 2005). Kaolin and bentonite are important commercial special clays showing distinct activities in terms of human health interaction, since their fundamental clay minerals, kaolinite and montmorillonite, respectively, significantly differ on structural, textural, physical and chemical properties. In comparative terms, montmorillonite is much more active, being characterized, for instance, for higher electric charge, higher specific surface area, higher ion exchange capacity and higher adsorption capacity. On the other hand the natural mineral water, used for both internal and external applications in Thermal spas, is considered a medicine too. Several diseases have been treated through the administration of natural mineral water, the health benefits mainly depend upon water chemical properties. Maraver (2008) and Arribas (2008) specify the benefits for human health of the chemical characteristics of natural mineral water that they call mineral medicinal water, classified into six categories: 1. Chlorinated (Cl-1 is the major anion); 2. Sulphated (SO4-2 is the major anion); 3. Bicarbonated (CO3H-1 is the major anion); Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 17 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids 4. Gasocarbonic (with more than 250mg/L of free CO2); 5. Sulfurous or “sulfúrea” (in Portuguese) (SH-1 and S-2 are the major anions); 6. Ferruginous (with more of 5mg/L of total Fe). In Portugal most natural mineral waters used in Thermal spas are of sulfurous or “sulfúrea” (in Portuguese) typology, mainly occurring in the central region of the country. Teixeira (2009; 2013b) enhances the physical and physical-chemical properties of Portuguese natural mineral waters, as well as the methodologies used for their application in “Crenotherapy” or Thermalism. BASIC CONCEPTS The official definition of peloid is still the one proposed by the Société Internationale d’ Hydrologie Médicale, and adopted during the IVe Conférence Scientifique Internationale, held in Dax, France, in 1949: “peloids are natural products composed of a mixture of mineral water (sea water, salt lake water, and natural mineral water included), with organic or organic matter, resulting from geologic or biologic processes, or from both geologic and biologic processes, which are utilized for therapeutic purposes under the form of packs or baths”. At the same meeting was adopted the Classification Hydrologique Internationale de Péloϊdes based on peloids origin, mineral water chemical nature and temperature, and maturation conditions. Recently Gomes et al., (2013) have proposed a classification of peloids into two major groups (Figure 1 and Figure 2) based on origin and maturation: 1. Natural peloids defined “as maturated in situ healing mud or muddy dispersion composed of a complex mixture of fine-grained materials, mineral water or sea water, and often organic compounds from biological metabolic activity”; 2. Artificial peloids or peloids s.s. (strictu sensu) herein also called designed and engineered peloids because it could undergo more or less complex manipulation involving refining, maturation, formulation and beneficiation, defined “as a healing mud or muddy dispersion resulting from the mixture clay/mineral water (natural mineral water or sea water) dressed and maturated in an artificial environment, more precisely in open or closed tanks with or without stirring”. To the therapeutic use of natural peloids and of artificial peloids the same authors proposed the designations mud therapy or mudtherapy and peloid therapy or pelotherapy, respectively. On the one hand, the natural peloids are being less and less used worldwide in Thermal spas, due to three principal characteristics and factors: 1. Complex mineralogical and physicochemical composition of peloid solid, liquid and gas phases, making difficult to determine qualitative and quantitatively their constituents, as well as the identification of the functional active principles; 2. Complex composi18 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids tion of the microbiota component, frequently bearing pathogenic microorganisms explained by peloid occurrence in natural open systems, hence easily contaminated; therefore the peloid requires a thorough and cautious sanitary safety control; 3. The increasingly difficult access to natural muds (volcanic, marine, fluvial,…) because, in general, the mud deposits are located in environmentally protected areas. Figure 1 – Peloids basic concepts (in Gomes, C. et al., 2013) Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 19 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Figure 2 – Peloids origin, composition and application (in Gomes, C. et al., 2013) Depending upon composition (relative content of inorganic and organic constituents) both natural peloids and artificial peloids could be classified into three main groups: essentially inorganic; essentially organic; and mixed inorganic/organic. Examples of essentially inorganic peloids are the popular mud packs and baths taken in the Bahrolmeyet Lake, in Palestina, the number one in the world in terms of salt concentration. The same happens in the Urumieh Lake, in Iran, the second lake in the world, in terms of salinity. Other example of essentially inorganic peloid used under medical counseling and supervision as mud-packs or mud baths, is the volcanic mud or thermal mud that occurs in the pool of Chancho, in Copahue (Argentina), the sulfur bearing warm mud (30-40ºC) being deposited on the pool bottom and with origin in thermal springs (Ubogui et al., 1991, 1998; Armijo et al., 2008; Monasterio, 2008, 2009). Another example of essentially inorganic peloid is the so-called “lodo del Mar Menor“, near to Murcia, in Spain, locally applied, either freely as mud baths, or as mud packs and mud baths in Thalassotherapy Centers. 20 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Peat is a mixed inorganic/organic peloid in which the solid component is composed of an inorganic or mineral part that may reach 40%, and of an organic part very abundant in decaying plants. Peat or turf should be sterilized before application in the form of peloid. Peat peloids are widely used in northern Germany, Austria (particularly famous is the Neydharting peat, exported to many countries to be used for rheumatologic treatments and traumatisms related to sport activities), Belgium, the Czech Republic, Finland and in other eastern European countries. The liquid component of peat or turf could be mostly lake water (chlorinated, or sulfidrated, or ferruginous, or of other chemical nature), and sometimes sea water or artificially mineralized freshwater. Biofilm or bioglea is an essentially organic peloid called muffe in Italy, and called barégine in France (due to first having been described in the thermal baths of Barèges), which is composed of algae and bacteria, and of a liquid component, generally reduced sulfur-bearing mineral water. Also with regard to their applications, both natural peloids and artificial peloids could be classified into two major groups: therapeutic or medical peloids and cosmetic peloids (Figure 2). On the other hand, the designed and engineered peloids, which really are artificial peloids or peloids s.s (strictu sensu), since maturation is carried out in an artificial environment, for instance inside the spas, could have very simple composition based on the mixture of one thoroughly analyzed (mineralogically, physicochemically and microbiologically) almost monomineralic commercial special clay (kaolin or bentonite) of pharmaceutical or cosmetic grade, hence considered a medicine, and of one thoroughly analyzed (chemically and microbiologically) specific natural mineral water recognized by medical hydrologists by its healing properties for internal and/or external applications, hence considered a medicine too. In such simple mixture additives, both natural or synthetic, and inorganic or organic, pharmacologically and medically recognized as medicines, could be then incorporated. Therefore, the active principles existing into the designed and engineered peloid could be more easily identified, and their functions and benefits could be better assessed. Both natural peloids and peloids s.s. require to be empirically or scientifically recognized by their properties, good for both therapeutic and cosmetic applications. Finally the topical use of peloids for therapeutic or cosmetic purposes is called pelotherapy (Veniale, 1999; Veniale et al., 2004). Presently no natural peloids or artificial peloids are used in Portuguese Thermal spas. Only “peloids” of the so-called extemporaneous peloids type are used in the Thermal spas of Alcafache and Caldas de Aregos. However, natural peloids occurring in certain natural sites of the littoral Atlantic (Praia da Consolação, Praia da Parede, Praia do Meco, Praia de Porto de Mós) are still empirically used, and in the past artificially maturated natural peloids have Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 21 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids been used in several Thermal spas (Caldas das Taipas, Termas de Vale de Cucos, Termas das Furnas). Teixeira (2010, 2013a) presents a historical synthesis of the use of peloids in Portugal up to the last decade of the XX century when the use was discontinued, suggesting sanitary reasons to explain that discontinuity. Then in the preparation of the artificial peloid, natural mineral water, as a rule sulfurous water or “água sulfúrea” (in Portuguese), of a specific Thermal spa, has been used. Naturally the peloids that incorporate this type of water will bear sulfur rich compounds recognized for their healing properties in case of respiratory, rheumatic and dermatologic diseases (Torresani, 1990; Costantino (2006); Baschini et al., 2010). STUDY GOALS To show how complex is the composition of natural peloids which are multiphase and multi-component systems. To show that, as a rule, when one natural peloid is used for a particular therapeutic purpose it is difficult to identify, either the functional active principles it contains, or to understand the health benefits it can provide. To show that it is feasible to develop designed and engineered peloids characterized by simple composition based on a maturated mixture of an almost monomineralic commercial special clay, such as kaolin or bentonite both reported in Pharmacopoeias, and of a specific mineral medicinal water, into which could be incorporated, either natural pharmaceutical phytoproducts (e.g., liquid extracts or dry powders of Equisetum arvense, Harpagophytum procumbens, and Filipendula ulmaria, three medicinal plants reckoned by their healing properties in rheumatic affections), as well as liquid extracts or lyophilized powders of plants (e.g. Arctium lappa), and algae species (e.g. Fucus spiralis, Fucus vesiculosus, Laminaria spp, and Ulva lactuca) reckoned by their healing properties in skin affections and skincare), or synthetic pharmaceutical products (e.g., Voltaren = Diclofenac sodic, liquid in ampoules) reckoned by their healing properties in rheumatic affections or by their beneficial effects in skincare. FUNDAMENTALS OF NATURAL PELOIDS Natural peloids are 3-phase systems: one solid phase (inorganic, organic or mixed inorganic/organic); one liquid phase (spring, river, lake or sea water); and one gas phase (H2S, CO2, NH4, CH4, Rn). 22 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids The inorganic component is mainly composed of a fine grained sediment called clay, itself a very complex system that consists of clay minerals and non-clay minerals. The organic component is still mysterious, since comparatively to its inorganic counterpart it has been rather deficiently studied so far. The liquid phase can also exhibit diverse and complex composition. The same happens with the gas phase. Peloid Properties Mean particle size, particle size distribution and particle aggregation are reflected on natural peloid or peloid s.s.(srictu sensu) thermophysical and rheological properties, such as: heat capacity, specific heat, heat diffusiveness, cooling rate, plasticity, viscosity, adhesivity, spreadability, impermeability, abrasivity. Clay minerals nature and proportion, solid/liquid ratio, liquid nature and associated organic matter are reflected on natural peloid or peloid s.s. thermal properties, such as: specific heat, heat conductivity and cooling rate. Chemical composition of solid, liquid and gas phases and total ion (cation and anion) exchange capacity and exchangeable ions are reflected on natural peloid or peloid s.s. chemical properties, such as: ion and molecule adsorption on a reversible way, and molecule absorption. Chemical properties will be reflected on the transfer of chemical elements and compounds between natural mineral water / clay minerals / organic matter of both natural peloid or peloid s.s., that is either natural sediment or artificial mixture, during maturation, as well as between the peloid and the human body along its application. Microbiological content, and pathogenic micro-organisms speciation, are very important properties of peloids, either natural peloids or peloids s.s.(srictu sensu). As much complex is a healing mud or peloid in terms of composition, more time is required to accomplish its maturation and stability, and more attention and care requires its sanitary control and safety. Peloid maturation is an important but complex process involving various physical and chemical parameters, and can provide physical, chemical, physicochemical and biological changes having consequences on peloid healing activity. Peloid Functions and Benefits Peloids are used under medical counseling and accompanying in Thermal spas and other Health Resort Medicine Centers, and their therapeutic effects are being particularly recognized in the fields of rheumatology and dermatology (Elkayam et al., 2000; Bellometti et al., 2005; Evcik et al., 2007; Fioravanti et al., 2007; Fioravanti et al., 2010; Forestier et al., 2010). Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 23 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Peloid health benefits are being attributed to a combination of effects, and within these, the mechanical, the thermal and the chemical effects are currently emphasized. Fioravanti et al. (2011) show and discuss the scientific evidences of the mechanisms of action on rheumatic diseases of the use of thermal natural mineral water and peloids. Clinical evidence based on epidemiological studies, and available on specialized literature, emphasizes the benefits, at least short-term benefits, of mudtherapy and pelotherapy on the degenerative rheumatism or osteoarthritis, the inflammatory rheumatism, the fibromyalgia, the spondilitis and the chronic back pain, within other rheumatic affections, taking advantage of peloids analgesic, antiinflammatory, anti-oxidant and antimicrobian action (Elkayam et al., 1991; Bellometti et al., 2005, 2007; Ceccarelli et al., 2010; Codish et al., 2005; Britschka et al., 2007; Giannitti et al., 2008; Constant et al., 1995; Strauss-Blasche et al., 2002). Also, there is evidence of the positive effects of peloids on dermatological affections, especially on psoriasis (Costantino et al., 2005, Clijsen et al., 2008) and acne and seborrhoea, as well as on skin care functions (cleansing, degreasing, exfoliating, hydrating, tonifying, and reaffirming) (Portugal-Cohen et al., 2009; Carbajo et al., 2010). Barros et al. (2010) and Pena Ferreira et al. (2010a, 2010b) have shown the effectiveness of several formulations involving bentonite from Porto Santo island, Madeira archipelago, either with cleansing and clarifying effects in facial masks, or with anti-cellulite effects. Also, Meijide et al. (2010) and Arribas et al. (2010a, 2010b) have studied and assessed respectively the effects on the mechanical and functional characteristics of skin of the application of extemporaneous peloids based on bentonite mixed with both sulfurous mineral medicinal water and sea water, and the clinical effects (expressed by scaling off and inflammation) on psoriasis of the thermal natural peloid from La Toja (Spain). Maraver (2013) discloses a very interesting and comprehensive review about the research being carried out in recent years on the relevant mechanisms of action (thermal, biologic and immunological) involved in pelotherapy. As a rule, clinical evidences do not identify the active principles responsible for therapeutic and dermatologic benefits, certainly due to the complex composition of both natural peloids and artificial peloids being used. The inorganic component of one peloid could be constituted by various clay minerals and non-clay minerals and the organic component could be constituted of up to few dozens of organic compounds (Suárez et al., 2011; Gomes et al., 2013a; Gomes et al., 2013b). Such complex composition could be demonstrated in the two examples of natural peloids described below. 24 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Examples of complex natural peloids 1.- Characteristics of the volcanic mud from Balneário da Coroa, S. Miguel island, the Azores (Figure 3, in: Gomes et al., 2013b). Figure 3 – Tank containing the volcanic mud used in Balneário da Coroa, São Miguel island Solid phase: Inorganic constituents: Clay minerals (kaolinite, illite, smectite), non-clay minerals (cryptocrystalline silica, feldspars, alunite, S). Organic constituents: Organic matter (~1.5% in weight) consists of several polar and non-polar compounds: long chain alkanes (C15-C29), long chain alkenes, esters, aldehydes, and biofilms. Microbiota: includes several pathogenic microorganisms. Liquid phase: Hydrothermal water: 95ºC, pH=3, Cl-1, F-1, CO3 -2, HCO3-1, SH-1, SO4-2, Na+1, K+1, Ca +2, Mg +2, Sr +2, and several trace elements. Gas phase: SO2, CO2, CH4, Rn. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 25 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids 2.- Characteristics of the salt pans saline mud from Santiago da Fonte, Aveiro, Portugal (Figure 4, in: Gomes et al., 2013a). Figure 4 – Salt pans and saline mud from Santiago da Fonte, Aveiro Solid phase: Inorganic constituents: Clay minerals (iliite, smectite, interstratified illitesmectite, kaolinite, chlorite), non-clay minerals (quartz, feldspars, micas, calcite) and sulfur compounds. Organic constituents: Organic matter (~4.5% in weight) consists of esters that might derive from fatty acids, long chain alkenes, cycloalkenes, and long chain alkanes and ketones being originated from plant degradation or being byproducts from microbiota action. Microbiota: includes several pathogenic microorganisms. Liquid phase: High saline sea water (density: 1.27). Gas phase: H2S, CO2, CH4, NH4 26 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids PELOIDS S.S. (STRICTU SENSU) OR DESIGNED AND ENGINEERED PELOIDES Natural peloids, in general, as was said before are complex mixtures of solid, liquid and gas phases, each one containing diverse and specific components. The complexity referred to makes difficult not only the identification of the healing active principles, but also the understanding of the healing process, and the control of both composition and sanitary state. Also the access to natural peloids is becoming more and more difficult due to environmental restrictions (the deposits are, as a rule, located in environmental protected areas). Peloids s.s. or designed and engineered peloids could be produced, either inside a specialized manufacture unit, or inside the spa facilities where they are applied. The mixture consisting of an almost monomineralic commercial special clay (e.g., kaolin or bentonite)/specific mineral medicinal water undergoes maturation, manipulation, and beneficiation with the incorporation of healing functional active additives (analgesic, anti-inflammatory, anti-oxidation, anti-cellulite, anti-psoriasis, anti-acne,…), either natural or synthetic, inorganic or organic. It is convenient to emphasize that the initial mixture clay/natural mineral water do not contains organic compounds, fact that could enable the easier identification of the active functional principles. Specific natural salts rich in bioessential chemical elements, for instance hydrous magnesium sulfates (epsomite and hexahydrite) derived from the evaporation of the sea water collected in salt pans, could be added as functional additives to the mixture. Also, organic compounds, such as some long-chain alkanes, long-chain esters and steroids being recognized by analgesic, anti-oxidant, anti-inflammatory and antineoplasic properties (Curri et al., 1997; Odabasi et al., 2007; Tserenpil et al., 2010; Suárez et al., 2011; Cavaleiro, 2013) could be used as functional additives. Also, organic compounds, such as some long-chain alkanes, long-chain esters and steroids being recognized by analgesic, anti-oxidant, anti-inflammatory and antineoplasic properties (Curri et al., 1997; Odabasi et al., 2007; Tserenpil et al., 2010; Suárez et al., 2011; Cavaleiro, 2013) could be used as functional additives. Figure 5 shows the processing flow sheet that includes the preparation stages of the designed and engineered peloid, involving fundamental analytical studies of both solid and liquid phases, and of the maturated mixture too. However, as a rule, the suppliers of both commercial therapeutic and cosmetic grades of kaolin and bentonite provide the corresponding relevant analytical data. Also, as a rule, the analytical data of the selected natural mineral water it is known and available too. To achieve the equilibrium in the mixture kaolin or bentonite/natural mineral water 2-3 weeks of maturation time are sufficient. Such equilibrium will be attained and identified when no significant changes are found in the results of microchemiBol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 27 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids cal analyses carried out, along maturation, in the liquid phase resulting from the interaction natural mineral water/kaolin or bentonite. When the solid phase is kaolin the maturation time is significantly less than when the solid phase is bentonite. Figure 5 – Flow sheet showing the preparation phases of designed and engineered peloids Depending on its nature, natural or synthetic, the healing functional additives could be incorporated during the paste maturation or just before its application. Carretero (2013) has proposed and recommended a methodology to be used in the preparation of artificial peloids of the type we have classified as designed and engineered peloids, starting with the mineralogical, chemical, physical and microbiological analyses of the solid phase (clay) and with the chemical, physicochemical and microbiological analyses of the liquid phase (mineral medicinal water). After the blending of clay with the mineral medicinal water the author enhances the importance of the analysis of the peloid interstitial liquid phase. Fernandez-González et al. (2013) following the study of one artificial peloid prepared with a blend of two clays (kaolin and bentonite) and one mineral medicinal water found that 1 month of maturation time would be sufficient to provide the optimum peloid. 28 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids The application of peloids s.s. always requires medical counseling and supervision. Also, periodical sanitary control (identification and quantification of pathogenic microorganisms) is always required. CONCLUSIONS Natural peloids, in general, are complex mixtures of solid, liquid and gas phases, each one containing diverse and specific components. The complexity referred to makes difficult not only the identification of the healing active principles, but also the understanding of the healing process and the control of both composition and sanitary state. Also the access to natural peloids is becoming more and more difficult due to environmental restrictions (the deposits are, as a rule, located in environmental protected areas). Natural peloids, in general, are complex mixtures of solid, liquid and gas phases, each one containing diverse and specific components. The complexity referred to makes difficult not only the identification of the healing active principles, but also the understanding of the healing process and the control of both composition and sanitary state. Also the access to natural peloids is becoming more and more difficult due to environmental restrictions (the deposits are, as a rule, located in environmental protected areas). Thermal spas could, either order and buy, or even design and develop genuine, specific and differentiated peloids s.s. for specific therapeutic and skincare uses. The manipulated peloids s.s. after getting their healing properties assessed and validated by medical hydrologists, could deserve the due approval as new medicines from the competent Institutions. If certain natural mineral waters used in Thermal spas for external and internal applications are being considered medicines by medical hydrologists; if certain clays, such as kaolin and bentonite reported in Pharmacopoeias as active principles and excipients are being considered medicines; if certain natural and synthetic chemicals, pharmacologically and medically recognized by their specific and functional health benefits are considered medicines too, even after their incorporation into the clay/water paste; naturally, the peloids s.s. or designed and engineered peloids which are based on controlled mixtures of the referred to materials should be considered medicines too. The simple composition of these peloids requires short-term maturation, and the maturated paste constituted of the mixture specific clay/specific natural mineral water could be kept in sanitary safe conditions. Whenever required for the topical treatment of one specific health affection, the medically indicated active and specific functional additive could be added to a well dimensioned sample of that mixture. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 29 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids The peloid activity will depend more on the chemistry of both the specific natural mineral water and the specific functional additives than on the physical, physicochemical and chemical characteristics of the clay. Clay will act mainly as an heat conservation and transfer agent, and as a delivery vehicle that facilitates the controlled liberation and the lasting action of part of the active healing principles (specific chemical elements and compounds existing both into the water and into the additives) which became fixed on a reversible way at the clay particle surfaces during the peloid preparation. In the authors opinion the future of peloids and pelotherapy would depend much on the manipulation and use of designed and engineered peloids that besides being applied in Thermal spas could well be also used in Thalassotherapy Centres, where sea water would take the place of natural mineral water. REFERENCES Armijo, F., Ubogui, J., Corvillo, I., Monasterio, A.M., Maraver, F. (2008). Estudio de los peloides de las termas de Copahue (Neuquén, Argentina): Características y propriedades. Balnea, 4, 143-150. Arribas, M., (2008). Cura hidropinica. Tribunatermal, 12, 46-48. Arribas, M., Meijide, R., Mourelle, M. L. (2010a). Evolución de la psoriasis tratada con peloides y agua mineromedicinal de la Toja, In: Maraver, F. Carretero M.I. (Eds.). Libro de Resúmenes del II Congreso Iberoamericano de Peloides. C.E.R.S-A., Madrid, pp. 75. Arribas, M., Meijide, R., Mourelle, M. L., Gómez, C. P., Legido, J. L. (2010b). Projecto de innovación para el desarrollo de un peloide termal para el balneario isla de la Toja, In: Maraver, F. Carretero M.I. (Eds.). Libro de Resúmenes del II Congreso Iberoamericano de Peloides. C.E.R.S-A., Madrid, pp. 76. Barros, M., Santos, D., Pena Ferreira, M. R., Silva, J. B. P., Amaral, M. H., Sousa Lobo, J.M., Gomes, J.H.A.C., Gomes, C.S.F. (2010) Estudos de pré-formulação de um pelóide anticelulítico com argila esmectítica da ilha do Porto Santo, In: Maraver, F. Carretero M.I. (Eds.). Libro de Resúmenes del II Congreso Iberoamericano de Peloides. C.E.R.S-A., Madrid, pp. 77-78. Baschini, M.T., Pettinari, G.R., Vallés, J.M., Aguzzi, C., Cerezo, P., López-Galindo, A., Setti, M., Viseras, C. (2010). Suitability of natural sulphur-rich muds from Copahue (Argentina) for use as semisolid health care products. Applied Clay Science, 49, 205212. Bech, J. (1987). Les Terres Medicinales. Discurs per Reial Academia de Farmàcia de Barcelona. Reial Acadèmia de Farmàcia de Barcelona-CIRIT (Generalitat de Calalunya), Barcelona, p. 105. Bech, J., (1996). Aspectos históricos y técnicos de las arcillas de uso medicinal. IX Simp. Grupo Especializado de Cristalografia, La Cristalografia y la Industria Farmacéutica. Real Soc.Esp. Física y Quimica (editor), Granada, 15-17. 30 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Bellometti, S., Richelmi, P., Tassoni, T., Berté, F. (2005). Production of matrix metalloproteinases and their inhibitors in osteoarthritic patients undergoing mud bath therapy. Int. J. clin.Pharmacol. Research, 25, 77-94. Bellometti, S., Gallotti, C., Pacileo, G., Rota, A., Tenconi, M.T. (2007). Evaluation of outcomes in SPA-treated osteoarthrosic patients. J Prev Med Hyg. 48(1):1-4.Britschka, Z.M., Teodoro, W.R., Velosa, A.P., de Mello, S.B. (2007). The efficacy of Brazilian black mud treatment in chronic experimental arthritis. Rheumatol Int, 28, 39-45. Cara, S., Carcangiu, G., Padalino, G., Palomba, M., Tamanini, M., 2000. The bentonites in pelotherapy: thermal properties of clay pastes from Sardinia (Italy). Appl. Clay Sci.16, 125–132. Carbajo, J.M., López-Delgado, M.I., Armijo, F., Maraver, F. (2010). Skin response to osmotic cosmetics elaborated with mud made from chlorided ferruginous mineral water. Presse Therm Clim, 147,153-154. Carretero, M.I., (2002). Clay Minerals and Their Beneficial Effects upon Human Health: A Review. Applied Clay Science, v.16, 155-163. Carretero, M.I., Gomes, C., Tateo, F., (2006). Clays and Human Health. In: Bergaya, F, Theng, B.K.G., Lagaly, G. (eds.), Handbook of Clay Science. Elsevier (The Netherlands, 711-741. Carretero, M.I., Pozo, M. (2007). Mineralogia Aplicada: Salud y Medio Ambiente, Thomson, Madrid, 464p. Carretero, M.I., Pozo, M. (2009). Clay and non-clay minerals in the pharmaceutical industry: Part I. Excipients and medical applications. Applied Clay Science, 46, 73-80. Carretero, M.I., Gomes, C., Tateo, F. (2013). Clays, Drugs and Human Health. In: Bergaya, F. & Lagaly, G. (eds.), Handbook of Clay Science, Second edition, Part B. Techniques and Applications. Elsevier (The Netherlands), Chapter 5.5, 711-764. Carretero, M.I. (2013). Metodologia aplicada a la determinación del peloid óptimo. Livro de Actas do III Congresso Iberoamericano de Peloides. Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 19-24. Casás, L. M., Legido, J. L., Pozo, M., Mourelle, L., Plantier, F., Bessieres, D. (2011). Specific heat of mixtures of bentonitic clay and sea water or distilled water for their use in thermotherapy, Thermochimica Acta, 524, 68-73. Casás, L.M., Pozo, M., Gómez, C.P., Bessieres, D., Plantier, F., Legido, J.L. (2013). Thermal behaviour of mixtures of bentonitic clay and saline solutions. Applied Clay Science, 72, 18-25. Cavaleiro, J. (2013). Organic constituents of Peloids: A contribution for a better knowledge. Livro de Actas do III Congresso Iberoamericano de Peloides. Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 58-63. Ceccarelli, F., Perricone, C., Alessandri, C., Modesti, M., Iagnocco, A., Croia, C., Di Franco, M., Valesini, G. (2010). Exploratory data analysis on the effects of non pharmacological treatment for knee osteoarthritis. Clin Exp Rheumatol, 28, 250-3. Clijsen, R., Taeymans, J., Duquet, W., Barel, A., Clarys, P. (2008). Changes of skin characteristics during and after local Parafango therapy as used in physiotherapy. Skin Res Technol. 2008 May; 14(2):237-42. Codish, S., Abu-Shakra, M., Flusser, D., Friger, M., Sukenik, S. (2005). Mud compress therapy for the hands of patients with rheumatoid arthritis. Rheumatol Int, 25, 49-54. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 31 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Constant, F., Collin, J.F., Guillemin, F., Boulangé, M. (1995). Effectiveness of spa therapy in chronic low back pain: a randomized clinical trial. J. Rheumatol., 22, 1315-20. Costantino, M. (2006). [Sulphur mud-bath treatment in osteoarthrosis: therapeutic activity and efficiency on the quality of life]. Clin. Ter, 157, 525-9. Costantino, M., Lampa, E. (2005). [Psoriasis and mud bath therapy: clinical-experimental study]. Clin. Ter, 156, 145-9. Curri, S.B., Bombardelli, E., Grossi, F. (1997). Observations on organic componentes of termal mud: Morphohistochemical and biochemical studies on lipid componentes of mud of the Terme dei Papi (Laghetto del Bagnaccio, Viterbo): Clinical bases of the interpretation of biological and therapeutic actions of thermal mud. Clin. Terapeut., 148, 637-654. De Vos, P. (2010). European material medica in historical texts: Longevity of a tradition and implications for future use. Journal of Ethnopharmacology, 176, 10-17. Elkayam O, Wigler I, Tishler M, Rosenblum I, Caspi D, Segal R, Fishel B, Yaron M. (1991). Effect of spa therapy in Tiberias on patients with rheumatoid arthritis and osteoarthritis. J Rheumatol. 18(12):1799-803. Elkayam, O., Ophir, J., Brener, S., Paran, D., Wigler, I., Efron, D., Even-Paz, Z., Politi, Y., Yaron, M. (2000). Immediate and delayed effects of treatment at the Dead Sea in patients with psoriatic arthritis. Rheumatol. Int., 19, 77-82. EPC. Bentonite (2005). In: European Pharmacopoeia, 5th edition, p. 1068. European Pharmacopoeia Convention, 2005, Strasbourg, France. Evcik, D., Kavuncu, V, Yeter, A., Yigit, I. (2007). The efficacy of balneotherapy and mudpack therapy in patients with knee osteoarthritis. Joint Bone Spine, 74, 60-65. Fernandez-González, M.V., Martin-Garcia, J.M., Delgado, G., Párrago, J., Carretero, M.I., Delgado, R. (2013). Una aproximación al estabelecimento de los tempos óptimos de maturación. Livro de Actas do III Congresso Iberoamericano de Peloides. Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 127-131. Ferrell, R.E. (2008). Medicinal clay and spiritual healing. Clays and Clay Minerals, 56, 751760. Fioravanti, A., Perpignano, G., Tirri, G., Cardinale, G., Gianniti, C., Lanza, C., Loi, A., Tirri, E., Sfriso, P., Cozzi, F. (2007). Effects of mud-balth treatment on fibromyalgia patients: a randomized clinical trial. Rheumatol. Int., 27, 1157-1162. Fioravanti, A., Iacoponi, F., Bellisai, B., Cantarini, L., Galeazzi, M. (2010). Short- and longterm effects of spa therapy in knee osteoarthritis. Am. J. Phys. Med. Rehabil., 89, 125-32. Fioravanti, A., Cantarini, L., Guidelli, G.M., Galeazzi, M. (2011). Mechanisms of action of spa therapies in rheumatic diseases: what scientific evidence is there? Rheumatol. Int., 31:1-8. Forestier, R., Desfour, H., Tessier, J., Françon, A., Foote, A., Genty, C., Rolland, C., Roques, C., Bosson, J. (2010). Spa therapy in the treatment of knee osteoarthritis: a large randomized multicentre trial. Ann. Rheum. Dis., 69-660-665. Fraioli, A., Serio, A., Mennuni, G., Cecarelli, F., Petraccia, L., Fontana, M., Grassi, M., Valesini, G. (2011). A study on the efficacy of treatment with mud packs and baths with Sillene mineral water (Chianciano spa, Italy) in patients suffering of knee osteoarthritis. Rheumatol. Int., 31, 1333-1340. 32 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Giannitti, C., Bellisai, B., Iacoponi, F., Petraglia, A., Fioravanti, A. (2008). New evidences on spa therapy in fibromialgia. Clin Ter, 159, 377-80. Gomes, A., Simões, M., Cavaleiro, J., Gomes, J., Silva, J., Gomes, C., Almeida, F., Santos, D., Amaral, H. (2013a). Study of the organic compounds existing in the mud from the salt pans of Santiago da Fonte, Aveiro, Portugal. Livro de Actas do III Congresso Iberoamericano de Peloids. Nunes, J., Gomes, C. Silva, J (editores), Ponta Delgada, São Miguel, Açores, 340-347. Gomes, A., Simões, M., Cavaleiro, J., Gomes, J., Gomes, C., Silva, J., Santos, D., Pontes, A. (2013b). Study of the organic constituents of the volcanic mud from the “blue pool” of the Balneário da Coroa, São Miguel Island, Azores, Portugal. Livro de Actas do III Congresso Iberoamericano de Peloids. Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 332-339. Gomes, C., Silva, J.B. (2007). Minerals and Clay Minerals in Medical Geology, Applied Clay Science, v.36, 4-21. Gomes, C., Hernandez, R., Sequeira, M.C.,Silva, J.B. (2008). Characterization of clays used for medicinal purposes in the archipelago of Cape Verde. Geochimica Brasiliensis, v.22, nº 3,315-331. Gomes, C. (2013). Naturotherapies based on minerals. Geomaterials, 3, 1-14. Gomes, C., Silva, J. B. (2013). Minerais e Peloides no Termalismo. In: Águas Minerais Naturais e de Nascente da Região Centro, Mare Liberum (editor), Simões Cortez, J. A. (coordenador) 302-379. Gomes, C., Rautureau, M. (2013). The role of clay and clay minerals in peloid properties. Livro de Actas do III Congresso Iberoamericano de Peloids, Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 86-93. Gomes, C., Carretero, M. I., Pozo, M., Maraver, F., Cantista, P., Armijo, F., Legido, J. L., Teixeira, F., Rautureau, M., Delgado, R. (2013). Peloids and Pelotherapy: Historical Evolution, Classification and Glossary. Applied Clay Science, 75-76, 28-38. Kikouama, J.R., Baldé, L. (2010). From edible clay to clay-containing formulation for optimization of the oral delivery of some trace elements: a review. Intern. Journal of Food Science and Nutrition, 1-21. Lopez-Galindo, A., Viseras, C. (2004). Pharmaceutical and cosmetic application of clays. In: “Clay surfaces: Fundamentals and Applications”, pp. 267-289, (F. Wypych & K.G. Satyanarayana, editors), Elsevier, Amsterdam. Lopez-Galindo, A., Viseras, C, Cerezo, P. (2007). Compositional, technical and safety specifications of clays to be used as pharmaceutical and cosmetic products. Applied Clay Science 36, 51-63. Maraver, F. (2008). El agua mineromedicinal: Una herramienta curative milenaria, Tribunatermal, 11, 54-57. Maraver, F. (2013). Mechanisms of Action of Pelotherapy: State of the Art. Livro de Actas do III Congresso Iberoamericano de Peloides. Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 9-18. Meijide, R., Salgado, T., Lianes, A. J., Legido, J. L., Mourelle, M. L., Gómez, C. (2010). Evaluación de los câmbios en la piel trás la aplicación de peloides mediante métodos de bioengenharia cutânea, In: Maraver, F. Carretero M.I. (Eds.), Libro de Resúmenes del II Congreso Iberoamericano de Peloides, C.E.R.S-A., Madrid, pp. 48-49. Monasterio, A. M. 2008. Termas de Copahue. Balnea 4, 143-150. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 33 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Monasterio, A. M. (2009). Termas de Copahue CPH “Lugar de Baños”. Patagónica, Neuquen. Novelli, G. (1996). Applicazion medicali e Igieniche delle bentoniti. Atti Conv. “Argille Curative”, Veniale, F. (editor), Gruppo Italiano AIPEA, Salice Terme (PV), Tipografia Trabella, Milano. Novelli, G. (1998). Applicazioni Cosmetiche e Medicaliu delle argille smectiche. Cosmetic News, 122, 350-357. Novelli, G. (2000). Bentonite: A clay over the centuries. Incontri Scentifici, V Corso di Formazione “Metodi di Analisi di Materiali Argillosi”. Gruppo Itaiano AIPEA, 263304. Odabasi, E., Gul, H., (2007). Lipophilic components of different therapeutic mud species. J. Altern. Complement. Med. (Mary Ann Liebert, Inc.), 13, 1115-1118. Otto, C. C., Haydel, S. E. (2013). Exchangeable ions are responsible for the in vitro antibacterial properties of natural clay mixtures. PLOS ONE/www.plosone, v.8, issue 5, 1-9. Pena Ferreira, M.R., Santos, D., Silva, J.B.P., Amaral, M.H., Sousa Lobo, J.M., Gomes, J.H.C.A., Gomes, C.S.F. (2010a). Aplicação de argilas esmectíticas da ilha do Porto Santo em máscaras faciais. In: Maraver, F. Carretero M.I. (Eds.), Libro de resúmenes del II Congreso Iberoamericano de Peloides, C.E.R.S-A., Madrid, pp. 30-31. Pena Ferreira, M.R., Santos, D., Silva, J.B.P., Amaral, M.H., Sousa Lobo, J.M., Gomes, J.H.C.A., Gomes, C.S.F. (2010b). Desenvolvimento de formulações contendo argila esmectítica e areia carbonatada biogénica da ilha do Porto Santo para aplicação em máscaras de limpeza e branqueadoras. In: Maraver, F. Carretero M.I. (Eds.), Libro de resúmenes del II Congreso Iberoamericano de Peloides, C.E.R.S-A., Madrid, pp. 99100. Portugal-Cohen, M., Soroka, Y., Ma'or, Z., Oron, M., Zioni, T., Brégégère, F.M., Neuman, R., Kohen, R., Milner, Y. (2009). Protective effects of a cream containing Dead Sea minerals against UVB-induced stress in human skin. Exp. Dermatol., 18, 781-8. Pozo, M., Carretero, I., Maraver, F., Pozo, E., Gómez, I., Armijo, F., Martin Rúbi, J.A. (2013). Composition and physico-chemical properties of peloids used in Spanish spas: A comparative study. Applied Clay Science, 83-84, 270-279. Reinbacher, W.R. (1999). Brief History of Clay in Medicine. Clay Minerals Society News, v.11, 22-23. Reinbacher, W.R. (2003). Healing Earths: The Third Leg of Medicine. 1st Books Library, Bloomington, 141-144. Robertson, R.H.S., (1996). Cadavers, Choleras and Clays. Bulletin Mineralogical Society, v.113, 3-7. Strauss-Blasche, G., Ekmekcioglu, C., Vacariu, G., Melchart, H., Fialka-Moser, V., Marktl, W. (2002). Contribution of individual spa therapies in the treatment of chronic pain. Clin J Pain, 18, 302-9. Suárez, M., González, P., Dominguez, R., Bravo, A., Melián, P., Herrera, I., Blanco,D.; Hernández, R.; Fagundo, J. R. (2011). Identification of Organic Compounds in San Diego de los Baños Peloid (Pinar del Río, Cuba). The Journal of Alternative and Complementary Medicine (Mary Ann Liebert, Inc.), 17, 155-165. Tateo, F., Summa, V., Gianossi, M.L., Ferraro, G. (2006). Healing Clays: Mineralogy and Geochemistry Constraints on the preparation of Clay/water suspension (“argillic water”). Applied Clay Science, 33,181-194. 34 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Teixeira, F. (2009). Água, Fonte de Vida. In: À Beira da Àgua. Comissão de Coordenação e Desenvolvimento Regional do Centro (editor), 108-139. Teixeira, F. (2010). La utilization de las lamas en Portugal: Passado y Presente. II Congreso Iberoamericano de Peloides, Balneário de Lanjarón, Libro de Resúmenes, Maraver, F. y Carretero, M.I. (editores), 14-15. Teixeira, F. (2013a). Da peloterapia tradicional à peloterapia científica. III Congresso Iberoamericano de Peloides. Nunes, J., Gomes, C., Silva, J. (editores), Ponta Delgada, São Miguel, Açores, 25-32. Teixeira, F. (2013b). O Termalismo na região Centro. In: Águas Minerais Naturais e de Nascente da região Centro, Mare Liberum (editor), Simões Cortez, J. A. (coordenador da edição), Capítulo XIII, 261-300. Torresani, C. (1990). Utilizzo del fango solfureo nel tratamento della cute seborroica. Cosmesi Dermatol., 30-59-71. Tserenpil, Sh., Dolmaa, G., Voronkov, M.G. (2010). Organic matters in healing muds from Mongolia. Applied Clay Science, 49: 55-63. Ubogui, J., Rodríguez-Lupo, L., Ficoseco, H., Sevinsky, L., Kien, K., Stengel, F. (1991). Terapéutica no convencional de la Psoriasis en las termas de Copahue (Neuquén Argentina). Experiencia preliminar. Arch Arg Dermatol, 41, 25-39. Ubogui, J., Stengel, F.M., Kien, M.C., Sevinsky, L., Rodríguez Lupo, L. (1998). Thermalism in Argentina: Alternative or complementary dermatologic therapy. Arch Dermatol. 134(11):1411-2. USPC. Bentonite. (2007). In: US Pharmacopoeia 30 and National Formulary 25, p. 1066. US Pharmacopoeial Convention, 2007, Rockville, MD, USA. USPC. Purified Bentonite (2007). In: US Pharmacopoeia 30 and National Formulary 25, p. 1067. US Pharmacopoeial Convention, 2007, Rockville, MD, USA. Veniale, F. (editor) (1999). Argille curative per fanghi peloidi termali e per trattamienti dermatologici e cosmetici. Symp.Gruppo Ital. AIPEA, Montecatini Terme/PT, Miner. Petrogr. Acta, v. XLII, 261-335. Veniale, F., Barberis, E., Carcangiu, G., Morandi, N., Setti, M., Tamanini, M., Tessier, D. (2004). Formulation of muds for pelotherapy: Effects of “maturation” by different mineral waters. Applied Clay Science, 25,135-148. Viseras, C., Lopez-Galindo. A. (1999). Pharmaceutical supplications of some Spanish clays (sepiolite, palygorskite, bentonite): Some preformulation studies. Applied Clay Science, 14, 69-82. Viseras, C., Cultrone, G., Cerezo, P., Aguzzi, C., Baschini, M., Valle, J., Lopez-Galindo, A. (2006). Characterization of northern Patagonian Bentonites for pharmaceutical uses. Applied Clay Science, 31, 272-281. Viseras, C., Aguzzi, C., Cerezo, P., Lopez-Galindo, A. (2007). Uses of clay minerals in semisolid health care and therapeutic products. Applied Clay Science, 36, 37-50. Viseras, C., Cerezo, P., Sanchez, R., Salcedo, I., Aguzzi, C. (2010). Current challenges in clay minerals for drug deliver. Applied Clay Science, 48, 291-295. Williams, L.B., Holland, M., Eberl, D.D., Brunet de Courrsou, L. (2004). Killer Clays! Natural antibacterial clay minerals, Mineralogical Society Bulletin, 139, 3-8. Williams, L.B, Haydel, S.E., Giese, R., Eberl, D. (2008). Chemical and mineralogical characteristics of French green clays used for healing. Clays an d clay Minerals, 56, 437-452. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 35 Gomes CSF, Silva JBP, Gomes JHC Natural peloids versus designed and engineered peloids Williams, L.B., Haydel, S.E., Ferrell, R. (2009). Bentonite, Bandaids and Borborygmi. Elements, 5, 99-104. Williams, L.B., Haydel, S.E. (2010). Evaluation of the medicinal use of clay minerals as antibacterial agents. Int.Geol,Rev., 52, 745-770. Williams, L.B, Metge, D., Eberl, D., Harvey, R., Turner, A., Prapaipong, P., Poret-Peterson, A. (2011). What makes a natural clay antibacterial? Environmental Science & Technology, 45, 3768-3773. Williams. L., Hillier, S. (2014). Kaolins and Health: From First Grade to First Aid. Elements, 10, 207-211. 36 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 15-36 El agua de mar en la alimentación y en la terapéutica Denise Antonella FLÓREZ(1), Blanca Valero BERNABÉ CALLE(1) (1) Estudiantes de Ciencia y Técnología de los Alimentos. Facultad de Veterinaria. Universidad Complutense de Madrid. 28040 Madrid (España). [email protected] Recibido: 02-09-14 Aceptado: 10-12-14 Resumen El mar es un valioso recurso que nos proporciona una elevada variedad de productos que podemos obtener: agua, sal, algas, krill, peces, sustancias de gran valor para medicamento y productos de cosmética, entre otros. Grandes descubrimientos se han llevado a cabo a lo largo de la historia y se siguen desarrollando. Desde los tiempos de René Quinton, se han estudiado las propiedades y componentes del agua de mar, con resultados significativos para la salud del ser humano. Actualmente, la actividad que desarrolla este sector tiene infinidad de aplicaciones, desde el embotellamiento del agua de mar como suplemento nutricional, hasta su uso en farmacoterapia y cosmética entre otros muchos. Palabras claves: agua de mar, agua de mar alimento, agua de mar terapia Seawater in food and therapeutic Abstract The sea is a precious resource that provides a high variety of products. We can obtain: water, salt, algae, krill, fish, substances of great value for medicine and cosmetics, among others. Great discoveries have been carried out throughout history and continue developing. Since the days of René Quinton, have been studied properties and components of seawater, significant for human health. Now, the activity that this sector has many applications, from sea water bottling as a nutritional supplement to use in pharmacotherapy and cosmetics among others. Key words: seawater, seawater food, seawater therapy REFERENCIA NORMALIZADA Flórez DA, Bernabé BV. El agua de mar en la alimentación y en la terapéutica. Bol Soc Esp Hidrol Med, 2015; 30(1): 37-55 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 37 ISSN: 0214-2813 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica INTRODUCCIÓN Desde hace siglos el ser humano ha utilizado el agua de mar con fines tanto pesqueros como de exploración. Pero el agua de mar se utiliza en otras aplicaciones principalmente relacionadas en su como alimento o fuente de productos alimenticios, desde la sal de mesa hasta fármacos, complementos nutricionales o cosméticos.Evolución del estudio de agua de mar El uso del agua de mar como hidratante y nutriente comenzó en 1904, época en la que René Quinton publicó su obra El Agua de Mar Medio Interno. En aquella época, Quinton fomentó la utilización de agua de mar isotónica, pero no divulgó los usos del agua de mar hipertónica, tal como se encuentra en los océanos hoy en día1. Descubrió la similitud entre el medio interno animal y el marino, y como consecuencia las posibilidades del agua marina para el cuerpo humano. Utilizando las virtudes del agua de mar, Quinton contribuyo grandemente a reducir la mortalidad infantil, salvando centenares de lactantes de la gastroenteritis o del cólera infantil2-3. Formuló una serie de leyes, denominadas “Leyes de la Constancia”: en las que postuló que la vida se originó en el mar, y que cada cuerpo humano es como un pequeño océano en el que flotan las células. Si este océano interior mantiene sus condiciones físicas (es decir, su PH, salinidad, temperatura, etc.) similares a las primigenias, el conjunto del cuerpo se mantiene en un estado de equilibrio natural, que es lo que llamamos salud., demostrando la identidad de nuestro medio interno con el agua de mar1-2. En 1905 nació el plasma de Quinton. Es agua de mar reducida a la isotonía con agua de manantial, preparado en frío por microfiltración. El uso del plasma de Quinton fue reconocido y usado por la sanidad francesa hasta 1982 momento en el que se cortó la prestación. El motivo fue que el laboratorio de Pessac, donde se fabricaba, no cumplía las normas del momento para la fabricación de inyectables. Actualmente, el laboratorio mundial de referencia productor de agua de mar isotonizada se encuentra en España. (Laboratories Quinton International, Almoradí, Alicante). A mediados del siglo XX, dos náufragos, entre ellos Bombard, que lo hizo voluntariamente, y Velasco, fueron los que inconscientemente salvaron sus vidas por beber el agua de mar. Contra todos los prejuicios y tabúes que, todavía, más de 50 años después siguen vigentes, se expuso la capacidad nutritiva e hidratante del agua hipertónica de cualquier océano. Ambos aportaron testimonios irrebatibles de los beneficios que aporta el agua de mar como agua bebible, con características nutritivas, preventivas y curativas4. Cada litro de agua de mar se compone por la “Sopa Marina”, que contiene: 965 cc de agua, ácidos nucleicos, ADN, aminoácidos esenciales, proteínas, grasas, vitaminas, minerales (118 elementos de la Tabla Periódica), fitoplancton, zooplancton (krill/omega3), huevos y larvas de peces, cadenas de carbono, además de millo38 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica nes de virus y bacterias, todo en un ambiente alcalino de pH 8’4. Por el mismo motivo, Bombard no tuvo problemas de salud en su viaje voluntario. COMPOSICIÓN DEL AGUA DE MAR Las dos propiedades físicas más importantes del agua de mar son, la temperatura y la salinidad, que determinan la densidad del agua. En el océano, la densidad suele aumentar con la profundidad, de modo que las capas de agua superiores se apoyan siempre en otras de mayor densidad. No obstante, esta situación de equilibrio puede verse rota por multitud de factores y, en un momento dado encontrarse aguas más densas sobre otras de una densidad ligeramente inferior5. Esto provoca una inestabilidad gravitacional que empuja al agua más "pesada" a hundirse mientras la capa subsiguiente, más "ligera", asciende para ocupar su lugar, estableciéndose una circulación en la vertical. La temperatura del agua varía con la latitud y la profundidad. En el Ártico puede tener en la superficie durante el verano cerca de 3ºC, mientras que el Mar Báltico y el Mar del Norte, entre 14-18ºC y en el Mediterráneo entre 22-27ºC. En Cuba, son comunes temperaturas medias del orden de 25ºC. En las zonas más profundas del océano las aguas pueden poseer unos 3ºC. Hoy en día, la temperatura del agua del mar se mide con termistores, que van midiendo y registrando los datos a medida que descienden en la columna de agua. Se observa que, en general, la temperatura del agua disminuye con la profundidad. Si miramos con detalle un perfil de temperatura podemos establecer claramente (de forma análoga ocurre con la salinidad) tres zonas con características bien definidas6: Capa de mezcla: Zona que abarca alrededor de los 100 primeros metros que corresponde a la zona de la columna de agua que se ve afectada por el estrés del viento. Se caracteriza por tener unos valores de temperatura casi inalterables. Termoclina: Inmediatamente por debajo de la capa de mezcla se produce un fuerte descenso de la temperatura hasta rondar los 5ºC en torno a los 1000m. Capa profunda: Cuando la temperatura se estabiliza y, aunque sigue disminuyendo, lo hace de forma muy suave y apenas perceptible. En cualquier caso, los espesores de estas capas son relativos y pueden variar sensiblemente de una localización a otra, e incluso, en un mismo lugar, varían estacionalmente. Se puede distinguir también un termoclina diurno debido al calentamiento rápido de los primeros 10 o 15 metros. Respecto de la salinidad resulta de la combinación de las diferentes sales que se encuentran disueltas en el agua oceánica; siendo las principales los cloruros, carbonatos y sulfatos. Se puede decir que el mar es una solución acuosa de sales. La salinidad es la cantidad total en gramos de las sustancias sólidas en un kilogramo de Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 39 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica agua de mar. Se representa en partes por mil y se encuentra en los océanos como salinidad media la de 35 partes por mil. Aunque lo cierto es que en distintas zonas del planeta este valor varía sensiblemente. Así la salinidad en zonas más cerradas como el Mediterráneo o el mar rojo es muy superior a este valor medio y en otras como el Mar Báltico, con gran aporte fluvial, desciende bastante por debajo del mismo. La sal más abundante es el cloruro sódico, que supone la mayor parte de la sal disuelta en el mar, pero existe gran cantidad de otros iones que se presentan en concentraciones menores pero muy significativas, por lo que suponen para el sustento de la vida en el mar. En general se acepta que, aunque el valor total de salinidad varíe de una zona a otra, las proporciones relativas entre estos iones permanecen prácticamente constantes, aunque existen multitud de casos particulares en que esto no se cumple6: Mares cerrados, estuarios y otras zonas con un considerable aporte fluvial que puede alterar las proporciones iónicas. Zonas profundas o de poca circulación en las que las condiciones puedan llegar a ser anóxicas, y en las que la acción bacteriana extrae del agua los iones sulfato para usarlo en lugar del oxígeno. Zonas de aguas cálidas y someras caracterizadas por una intensa precipitación química o biológica del carbonato de calcio, disminuyendo su presencia en disolución. Zonas de activo vulcanismo submarino (como las dorsales submarinas), en las que suele darse una intensa liberación de gases La salinidad en el océano, fuera de estos casos particulares, varía muy poco. En superficie el valor de la salinidad depende directamente de la relación entre la evaporación y la precipitación, y, por tanto, de las condiciones climáticas. Por debajo de los 1000 metros de profundidad, en cambio, la influencia de estas variaciones superficiales no es apreciable y la salinidad suele mantenerse entre 34.5 y 35 en cualquier latitud. Los valores de salinidad suelen ser bastante altos en los primeros metros en relación con las zonas más profundas. Tras una zona que varía entre los 30 y 100 metros de profundidad y que presenta un valor constante (capa de mezcla). Se produce un fuerte descenso hasta cerca de los 1000 m, en que se estabiliza en torno a 34.5 o 35, como ya se ha dicho. Esta zona de intenso gradiente es conocida como haloclima. En forma semejante proporcional varía la composición química, tal como se muestra en la Tabla 1. Los componentes mayoritarios del agua de mar son: Cl-,Na+, SO42--, Mg2+, Ca2+, K+, HCO3--, Br--, siguiéndole en ese orden Sr2+, I--, F-- y SiO2. El cloruro y el sodio son los constituyentes fundamentales del agua de mar y se encuentran en forma de cloruro de sodio que se conoce la sal común, representa el 40 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica 80% de las sales en la solución. Estas cantidades y la composición de cloruro y sodio en el agua de mar es muy semejante a la de los líquidos orgánicos como la sangre, los líquidos viscerales que forman el medio interno de los animales y que juegan un papel decisivo en la fisiología. Después del cloruro y el sodio, el magnesio es el elemento más abundante en el agua de mar, se encuentra en una relación constante respecto al cloro; se combina con otros elementos formando cloruros de magnesio, sulfato de magnesio y bromuro de magnesio y esta presenta en el esqueleto de algunos organismos marinos. Tabla 1 – Composición química del agua de mar (meq/l) El azufre se encuentra en forma de sulfatos, compuesto cuya concentración varia poco, aunque pueden cambiar notablemente sus proporciones en las aguas próximas al litoral debido a la influencia de las aguas fluviales, más ricas en sulfatos que las marinas. El calcio es menor que los anteriores, y su relación con el cloruroo permanece relativamente constante. Este, combinándose con los carbonatos constituyen la estructura del esqueleto calizo, interior o exterior, de un gran número de organismos, como los foraminíferos, pequeños animales de plancton marino, los corales y las algas marinas que viven en el fondo del mar y que forman el bencton; y también se encuentran en los caparazones de crustáceos y en la concha de los moluscos. Al morir estos organismos, sus esqueletos caen al fondo, en donde llegan a formar acumulaciones marinas de calcio de gran extensión. El calcio en el mar presenta una extraordinaria movilidad determinada por la abundancia y distribución de estos Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 41 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica organismos oceánicos, debido a que el calcio concentrado por los seres vivos para formar su esqueleto o caparazón se disuelve lentamente una vez muertos y de esta manera se mantiene constante la cantidad de calcio en el mar a causa de este comportamiento cíclico. El magnesio es más abundante en los vegetales marinos que en el medio líquido y su concentración alcanza 0’5 µg por litro. También se puede localizar en los nódulos localizados en los fondos marinos. Agua profunda El agua de mar profunda es la existente por debajo de los 300m de profundidad. El interés radica en que la composición del agua de mar profunda es muy similar a la superficial, y esta pequeña diferencia hace que manifieste propiedades distintas de gran interés terapéutico. Los hallazgos realizados hasta ahora en los ensayos clínicos nos hacen estar muy atentos a este nuevo agente terapéutico para una posible aplicación de mar profunda en la prevención de enfermedades7. La temperatura del agua profunda es constante a lo largo del año, a 300m está alrededor de los 12ºC y va decreciendo con la profundidad llegando a los 4ºC a los 1000m. El agua de mar profunda tiene menor temperatura, más densidad, mayor cantidad de fosfatos (4 veces más), silicatos (5 veces más), mayor presencia de una serie de microelementos (Al, V, Fe, Mn, Co, Cu, Zn) Tabla 2, y menor cantidad de bacterias UFC/ml, considerándose libre de patógenos7. Desde hace unos 9 años se comercializa agua profunda envasada. El agua una vez desalinizada por ósmosis inversa y electrolisis se desinfecta por un sistema mixto de microfiltración, luz ultravioleta y ozonización. Esta industria es floreciente, a pesar de los elevados costes de extracción de agua. Actualmente hay plantes embotelladoras en Japón y Hawai llegando a producir la mayor de estas envasadoras 200.000 botellas de 1,5l diarias colocando toda su producción. Es una de las más vendidas en el mercado Japonés. De las 10 aguas envasadas más vendidas en este mercado, 3 son de agua profunda, y además con un precio medio cinco veces superior al de una botella de agua mineral normal. Agua superficial En la zona costera, en las lagunas litorales y en las áreas donde los ríos se abren hacia el mar formando los esteros, la salinidad se presenta baja descendiendo desde la boca hasta su interior llegando a alcanzar concentraciones de cero partes por mil, sobre todo en aquellos lugares donde se deja de sentir el efecto de las mareas conociéndose sus aguas como salobres. En estas zonas la salinidad presenta una variación estacional notable. Generalmente disminuye en la época de lluvias y aumenta en la de sequía, pero en las altas latitudes la variación estacional se invierte siendo 42 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica en verano cuando se da el mínimo de salinidad, porque los ríos aumentan su caudal a consecuencia del deshielo. Tabla 2– Composición detallada de agua profunda; 3,5% de salinidad ppm: partes por millón=mg/litro=0,001g/kg (Karl K Turekian: Oceans. 1968. Prentice-Hall) En la superficie donde el agua está en contacto con la atmósfera, el contenido total de bióxido de carbono depende principalmente de la salinidad y de la temperatura tendiendo a mantener una situación de equilibrio entre la cantidad de bióxido de carbono atmosférico y el que se encuentra disuelto en el agua. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 43 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica En la zona superficial de las aguas, sobre todo en las próximas a la costa, suele decrecer la densidad debido a los aportes del agua de lluvia y ríos. Las aguas de más densidad se encuentran en altas latitudes (polares), por lo que tienden a hundirse y distribuirse por los fondos en zonas cada vez más amplias; esta es una de las causas de la baja temperatura de los fondos8. APLICACIONES Agua de mar como alimento La hidrosfera constituye un medio biológico que alberga numerosas formas de vida, muchas de ellas desconocidas aún. Todas ellas necesitan sustento para realizar sus funciones y completar su ciclo biológico, por lo tanto en este apartado explicaremos el agua de mar como alimento en sí. Plancton El conjunto de organismos que viven en suspensión dentro de la masa de agua constituyen el plancton. Cuando el agua se desplaza, traslada en ella a estos organismos. Dentro del agua existe una cantidad de organismos microscópicos como virus, arqueas y bacterias, entre los más pequeños; y las algas unicelulares, entre los organismos microscópicos más grandes. Podemos encontrar plancton en aguas más abiertas, en la zona que se denomina pelágica o en aguas costeras, en la zona denominada nerítica. En estos ambientes, el plancton vive en diferentes masas de agua separadas entre sí por unas diferencias de temperatura y salinidad que conforman barreras, a las que llamamos frentes. Cuando hay calma, el agua se estratifica en capas y aísla el plancton superficial de los nutrientes que hay en las capas inferiores; cuando el agua se agita, hace que estas capas se mezclen y que aumente la proliferación del plancton. Dentro del plancton hallamos los organismos responsables de la mayor parte de la producción primaria oceánica, que tienen una importancia capital en las redes tróficas marinas. Estos organismos actúan como secuestradores de parte del carbono atmosférico y producen casi el 50% del oxígeno de la atmósfera. La otra parte de los organismos planctónicos serán depredadores de estos productores marinos, o descomponedores, contribuyendo igualmente al funcionamiento de estas redes tróficas y del ecosistema marino en general. El plancton, es el alimento principal de los invertebrados, peces pequeños y peces tan grandes como el tiburón peregrino o ballenas con barbas9. La composición de las poblaciones de plancton y su distribución no son homogéneas porque varían en función de factores como la profundidad, la distancia de la cosa, la época del año, el momento del día, la disponibilidad de alimento y la temperatura del agua. Por ejemplo, la temperatura de las masas de agua condiciona la 44 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica presencia o ausencia del zooplancton, puesto que hay especies que solo pueden vivir dentro de unos rangos muy concretos de temperatura. Fitoplancton Todos los organismos fotosintéticos del plancton, sobre todo algas y algunas bacterias, constituyen el fitoplancton. Es decir, el fitoplancton está compuesto por organismos autótrofos unicelulares aislados o que forman cadenas o agregados y que se sitúan en aguas superficiales. Los grupos dominantes son diatomeas, dinoflagelados, cocolitoforales, silicoflagelados y cianofíceas, que se alternan tanto en el espacio como en el tiempo. Algunas de las algas del fitoplancton tienen la pared celular hecha de sustancias silícicas o de placas de carbonato de calcio, que les confieren protección y unas formas muy bellas observadas con un microscopio electrónico. Los organismos del fitoplancton contienen pigmentos fotosintéticos y por lo tanto realizan la fotosíntesis: son productores primarios. Esto requiere que estén siempre en la zona iluminada del mar, es decir, en las capas de agua más superficiales. Mediante la fotosíntesis, captan del agua una considerable cantidad de dióxido de carbono disuelto, que en gran medida procede de la atmosfera, y liberan al mar gran parte del oxígeno que los organismos marinos necesitan para vivir. Un alto porcentaje de este oxigeno irá a parar a la atmosfera; de hecho, se calcula que un 50% del oxígeno que hay a la atmosfera proviene de la actividad del fitoplancton. A pesar de tratarse de organismos microscópicos, su masa es muy importante, sobre todo en la zona donde llega luz solar con intensidad. En condiciones favorables de nutrientes y temperatura, pueden llegar a concentraciones de más de mil algas unicelulares por mililitro. De hecho, ser pequeños es la mejor estrategia que tienen estos organismos para evitar caer hacia el fondo y así poder permanecer en las aguas iluminadas, más superficiales. A pesar de este reducido tamaño, cuando estos organismos proliferan, se pueden llegar a observar desde el espacio porque tiñen zonas del océano con sus pigmentos9. Zooplancton En cualquier muestra de plancton marino fresca se observan pequeños animales, muchos de los cuales se mueven incesantemente. Los animales pertenecientes al plancton son los que lo forman. Así pues, el zooplancton está compuesto por organismos heterótrofos de un amplio espectro de medidas, que va desde unas micras hasta los 10cm. Tienen una limitada capacidad de movimiento, a pesar de que pueden migrar y agruparse. En general, la abundancia de zooplancton aumenta como respuesta a las proliferaciones de fitoplancton. Holoplancton y meroplancton En el zooplancton encontramos organismos que se desarrollan en todo su ciclo vital en la masa de agua y de los que decimos que forman parte del holoplancton. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 45 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica Por lo tanto, en las muestras de plancton podemos ver tanto individuos adultos como larvas y huevos de estos animales. Asimismo hay organismos que conforman el plancton solo durante una parte de su ciclo vital; en conjunto componen el meroplancton. Numerosos organismos tanto bentónicos como pelágicos tienen huevos, larvas, y juveniles que pasan parte de su vida en el plancton, donde se alimentan. Estas etapas tempranas del desarrollo son los momentos de mayor vulnerabilidad de estos organismos, porque es cuando son más fácilmente depredados por otros organismos planctónicos, invertebrados filtradores o peces. Los huevos y las larvas son dispersados por las corrientes, y se desarrollan en el medio planctónico hasta que tienen suficiente capacidad para nadar y vivir libremente o para bajar hacia el fondo del mar a fin de acabar formando parte del bentos9. Formación de enjambres Cuando en el mar hay gran cantidad de nutrientes y se dan las condiciones ambientales adecuadas, pueden producirse unas concentraciones enormes de organismo fitoplanctónicos que favorecen el desarrollo del zooplancton. Cuando se dan estas condiciones en determinados lugares, pueden aparecer grandes masas de crustáceos eufausiáceos: se trata de los organismos conocidos como krill. Su abundancia puede llegar a ser tan elevada que constituyen el alimento principal de las ballenas. El krill, como otros organismos planctónicos, forma grandes enjambres. Estas agrupaciones de miles de individuos son una estrategia que no solo favorece la reproducción, sino también la supervivencia de más individuos frente a los depredadores. Krill: Krill son pequeños crustáceos que se encuentran en el Océano Austral y el Océano Antártico que forman parte del plancton marino, cuyo aceite es rico en fosfolípidos. La extracción del aceite de krill es una tecnología relativamente nueva. El aceite de krill contiene ácidos grasos omega-3 EPA y DHA en la forma de fosfolípidos que es tan importante para las membranas celulares, sobre todo, en el tejido cerebral. Esto contribuye a la gran estabilidad del aceite, además de la gran riqueza de poderosos antioxidantes10. El Aceite de Krill es el único aceite marino que contiene una combinación de tres importantes sustancias: 1. Ácidos grasos omega 3 (EPA y DHA) 2. Fosfolípidos 3. Antioxidantes Algunas de las conclusiones obtenidas de los estudios clínicos recientes realizados con el Aceite de Krill NKO® se pueden apreciar en la Figura 1, sobre los efectos en dolores articulares, control del colesterol y triglicéridos y en el síndrome premenstrual11. El Aceite de Krill K-Real® 4225 se obtiene a partir de un proceso patentado denominado “MSO”, un proceso de Extracción del Aceite en Varias Etapas (Multi 46 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica Stage Oil Extraction). Este proceso asegura un aceite de Krill que cumple con los parámetros de los activos: % de fosfolípidos, % de EPA/DHA, Astaxantina. También asegura su bioactividad, estabilidad y el cumplimiento con todas las especificaciones de calidad en cuestión de impurezas y contaminantes11. Figura 1 – Conclusiones de estudios clínicos con aceite de krill Las personas que padecen alergias a crustáceos o productos de pescado pueden presentar una reacción después de consumir el aceite de krill, en esos casos se aconseja no utilizarlo. También puede influir sobre medicamentos y otros productos. Puesto que EPA y DHA en altas dosis, pueden influir sobre la coagulación sanguínea, se recomienda tener cuidado cuando además del aceite de krill, se utiliza medicación que influye sobre la coagulación sanguínea. PRODUCTOS OBTENIDOS DEL MAR Sal Analizada desde el punto de vista químico, la diferencia entre una sal marina y la moderna sal de mesa de uso corriente, resulta abismal. La simple evaporación del agua de mar, deja como consecuencia un residuo sólido, al cual llamamos sal. Este residuo está compuesto por los 84 elementos estables de la tabla periódica. Por Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 47 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica supuesto que el cloruro y el sodio son los principales elementos cuantitativos, representando casi el 90% de su composición. Pero la importancia cualitativa de ese 10% restante es verdaderamente extraordinaria12. La sal marina puede reducir la ingesta global de sodio, pues se necesita menos cantidad para dar sabor. Algunos tipos de sales obtenidas del mar13: Sal marina: La sal marina se extrae por evaporación del agua del mar en salinas y es la más apreciada gastronómicamente. En su estado natural presenta formas geométricas anguladas, grandes y limpias. Flor de sal: La flor de sal, considerada la reina de las sales, tiene un sabor muy sutil; es ligeramente húmeda y crujiente. Se aconseja añadirla en el momento de servir el plato, al final de la cocción. La flor de sal se recoge de manera tradicional al atardecer de los días de verano de la superficie del agua con un tipo de pala especial. En este momento la sal es de un color rosa pálido que, después de secarse al sol, adquiere una tonalidad más blanca. La recogida debe hacerse rápidamente porque una vez rota la capa de sal, ésta empieza el descenso. A continuación, la flor de sal se pone a secar hasta obtener una flor blanca, de textura crujiente que se disuelve en boca con facilidad y que está considerada una auténtica exquisitez. Sal de Guerande: Sal marina de la Bretaña francesa. Se distingue por su color grisáceo brillante, característico del fondo marino bajo los saladares. Es la sal integral por excelencia. Muy importante es tener en cuenta no cocinarla, por lo que se recomienda añadirla en el momento de presentar el plato a la mesa. Sal ahumada de Halen Môn: Procedente de la Isla de Anglesey, de las salinas del País de Gales, es de olor fuerte y sabor intenso de ahumado, que se obtiene al someterla al humo de madera natural. Se disuelve rápidamente a la temperatura del paladar. Sal Maldon: Tiene una forma plana, muy pura y de alto sabor. Procede de las salinas del condado de Essex (Inglaterra). No se recolecta todos los años, puesto que necesita unas condiciones climáticas apropiadas para ello. Su elaboración es totalmente artesanal y muy laboriosa. La gran particularidad de este producto es su gran pureza natural y su fuerte sabor salado. Al disolverse fácilmente, resulta perfecta para ser espolvoreada justo en el momento de servir el plato que vaya a condimentar. Sal de Murray River: Sal marina del estanque de Murray, Australia. Da un toque especial a todo tipo de platos tanto por su tono anaranjado como por su curioso sabor. Es una sal de lujo, difícil de encontrar y bastante cara. Sal Chardonnay: Se trata de una sal ahumada que se obtiene dejando reposar los cristales de flor de sal dentro de los mismos toneles que se utilizan para elaborar vino de la variedad Chardonnay. Esta práctica se está realizando en California. 48 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica Sal roja de Alae: Es una sal que se elabora tradicionalmente en Hawai. Se mezcla la sal con arcilla purificada de Alae, enriqueciendo la sal en minerales y otorgándole un ligero y agradable sabor. Algas marinas Las algas marinas se han utilizado como alimento humano desde la antigüedad, especialmente en China, la península de Corea y el Japón. Al emigrar a otras regiones, los naturales de esos países han llevado este uso de las algas marinas a sus nuevos países, por lo que pueden encontrarse productos a base de algas saladas, desecadas y frescas en casi todas las partes del mundo. Esta es la base comercial de la industria alimentaria de las algas marinas. Las poblaciones costeras de muchos países consumen también algas marinas, unas veces como parte de formas de vida basadas en una economía de subsistencia y otras como ingrediente habitual de ciertos tipos de ensalada, especialmente en Hawai y los países más cálidos del Asia sudoriental, como por ejemplo Indonesia, Malasia, Filipinas y Tailandia. Estos productos se recolectan y venden localmente, y no se conoce su volumen ni su valor14. Las tres algas marinas más importantes utilizadas como alimento humano son varias especies de Porphyra (cuyo nombre vulgar en el Japón es nori), Laminaria (kombu) y Undaria (wakame)15. El ciclo vital de Porphyra es complejo y sólo fue dilucidado en el decenio de 1950 por un ficólogo británico. Esto dio lugar a una rápida expansión de la industria del nori, primero en el Japón y más tarde en China y República de Corea. El nori se vende en paquetes (de unos 30 g) de hojas finas, de 10 a 12 cm2, normalmente sin cocer o ligeramente horneadas, y se utiliza para formar el envoltorio exterior del sushi. A veces se come cocido y salado como aperitivo o espolvoreado sobre el arroz o los fideos. Tiene un contenido elevado de valiosas proteínas comestibles. Las especies de Laminaria se cultivaron por vez primera en el Japón, pero en el decenio de 1950 científicos chinos lograron reducir el tiempo de cultivo de dos años a uno solo, y la producción china creció hasta superar 1,5 millones de toneladas anuales de algas frescas. La mayor parte de esta producción se deseca y se consume como kombu en las provincias costeras, y el resto se utiliza para producir alginato. El kombu se utiliza en una gran variedad de platos de sopas, como ingrediente de un estofado japonés, para hacer encurtidos y como té. La Undaria es especialmente apreciada en la República de Corea, donde se cultiva en una escala mayor que en otros países. Se trata de un alga menos gruesa y más delicada que el kombu. Suele prepararse y comercializarse en forma de un producto blanqueado y salado, que se almacena a -10 grados Celsius antes de su venta. Se consume desalándolo en agua y se utiliza sobre todo Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 49 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica en sopas; en la República de Corea se utiliza más wakame, con lo que se obtiene una sopa mucho más espesa que en el Japón. Algunos productos elaborados a base de wakame se comercializan como alimentos instantáneos15. La base principal de los usos industriales de las algas marinas es la obtención de alginato, agar y carragenina, que son espesantes y gelificantes que se extraen de éstas. La utilización de las algas marinas como fuente de esos hidrocoloides se remonta a 1658, cuando se descubrieron en el Japón las propiedades gelificantes del agar, extraído mediante agua caliente de un alga roja. Los extractos de musgo perlado, que es otra alga marina, contienen carragenina y fueron muy utilizados como espesantes en el siglo XIX; mientras que los extractos de algas pardas no empezaron a producirse comercialmente y a venderse como espesantes y gelificantes hasta el decenio de 1930. La producción de carragenina se basaba al principio en las algas marinas silvestres, en particular el musgo perlado, que es una pequeña alga que crece en aguas frías con una base de recursos limitada. Sin embargo, desde los primeros años del decenio de 1970 la industria ha crecido rápidamente a causa de la disponibilidad de otras algas que contienen carragenina, cultivadas con éxito en países de aguas templadas con bajos costos de mano de obra. En la actualidad, la mayor parte de las algas utilizadas para producir carragenina son cultivadas, aunque sigue habiendo una pequeña demanda de musgo perlado y de algunas otras especies silvestres de América del Sur14-15. Fármacos y productos de cosmética Fármacos El avance del conocimiento científico a escala molecular y celular ha ido variando esas estrategias hacia una búsqueda más competitiva, con el desarrollo de plataformas de alto rendimiento (high through put screening) y sistemas in vitro que permiten cribar miles de compuestos sintéticos en cuestión de horas atendiendo a la baja probabilidad de encontrar sustancias activas. Este cambio de actitud puso en entredicho la obsoleta disciplina de cribar organismos del suelo de forma empírica que tantos éxitos reportó en el pasado. Muchos autores calificaron de «casi exhausto» el arsenal de productos naturales. Durante los últimos años, la revolución científica surgida de la genómica y la proteómica ha variado sustancialmente el escenario de búsqueda de nuevos medicamentos. Conociendo mejor el ciclo celular se pueden describir reacciones bioquímicas claves para ser modificadas, obteniendo dianas o targets específicos en que se reduce enormemente los efectos secundarios. Aunque los océanos contienen una biodiversidad muy superior a la de la tierra, su exploración desde el punto de vista de búsqueda de nuevos compuestos químicos apenas se ha iniciado, y se conocen en la actualidad «únicamente» unos quince mil productos naturales de origen marino, una décima parte de los terrestres. La revisión del grupo neozelandés liderado por M. Munro16 recopila las nuevas moléculas 50 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica aisladas de organismos marinos. Este potencial se basa en que los océanos abarcan el 70 % de la extensión del globo y su diversidad biológica el 95 % de la biosfera. Un dato muy interesante aportado por el Nacional Cancer Institute es que el porcentaje de extractos activos de origen marino es muy superior al terrestre17. La bioprospección marina está reportando multitud de pequeñas moléculas que pueden ser aplicadas en la salud humana. Entre los quince mil metabolitos marinos conocidos, una treintena de ellos están siendo probados en fases clínicas, principalmente en oncología, y algunos ya han sido aprobados para su comercialización17. Si observamos dos esponjas compitiendo por un sustrato de fijación, o el empleo de defensas químicas en seres inmóviles para no ser depredados, nos daremos cuenta de que la estrategia evolutiva las ha dotado de sustancias capaces de detener el crecimiento de los rivales y ello puede aplicarse al cáncer, donde la división celular juega un papel determinante. Sin duda, es en el área del cáncer donde el arsenal metabólico marino juega el papel más determinante, aunque no el único. La biotecnología marina tiene mucho que aportar al respecto cuando la síntesis química no es eficiente. Ya tenemos varios ejemplos con compuestos encontrados inicialmente en esponjas, tunicados o briozoos, incluso en bacterias marinas de difícil industrialización. El futuro de las medicinas marinas debe venir del empleo de técnicas moleculares o genómicas y celulares, de la robótica y de la bioinformática. Los avances en biología molecular de la última década han pulverizado el concepto clásico de biodiversidad marina, entendida hasta ahora como mera clasificación de especies atendiendo a morfología. Se calculan en 3×1028 el número de formas de vida microscópicas existentes globalmente en océanos; para que lo entendamos, ello supone que hay cien millones de veces más microorganismos que estrellas en el universo visible. Pero el reto está en cómo poder cultivarlos en el laboratorio, pues más del 99 % de ellos sólo se conocen por técnicas moleculares. Además, estos organismos unicelulares son máquinas de expresar genes. Algunos de estos productos de expresión son los llamados metabolitos secundarios, que han sido seleccionados durante millones de años de evolución para ser útiles como defensa o ataque de depredadores. Existe un gran contenido de simbiontes marinos (microorganismos que viven en estrecha relación con invertebrados marinos) se abren eficaces vías de estudio para identificar nuevas moléculas con actividad en salud humana, además de atribuir a estos «invisibles» habitantes marinos la propiedad de producción de biocompuestos, que hasta ahora sólo se achacaban a invertebrados. En 1900 se comercializó el primer producto marino sensu stricto, el ácido kaínico, obtenido de extractos de algas pardas y empleado como insecticida y antihelmíntico. Pero no fue hasta cincuenta años más tarde cuando empezaron a identificarse los primeros fármacos encontrados en esponjas y microorganismos marinos. La AZT (zidovudina), que marcó un hito en la lucha contra el sida, fue inspirado a partir de los nucleósidos espongouridina, también conocida como Ara-C y espongotimidina o Ara-A, antivirales aislados de la esponja Crytotethya cripta. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 51 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica Asimismo a mediados de los años cincuenta, se descubrió la cefalosporina C a partir de un microorganismo marino, el hongo Cephalosporium, que actualmente sigue siendo muy utilizado como antibiótico. En 1966 se publicó otro antibiótico, la pentabromopseudilina, producido por una bacteria aislada del mar. Otro hecho significativo de aquella época fue el descubrimiento en grandes cantidades de prostaglandinas en el coral Plexauria homomalla. Estos compuestos son importantes mediadores en afecciones inflamatorias, fiebre y dolor, e incluso están descritos como anticonceptivos; se descubrieron en semen de carnero, y de ahí su nombre, al ser provenientes de líquidos prostáticos18. Desde entonces hasta nuestros días, se han descrito más de quince mil compuestos marinos; aunque la mayoría tienen su aplicación en el área del cáncer, es de destacar la reciente aprobación por parte de la FDA del Prialt (ziconotida), péptido neuroparalizante con aplicación en anestesia y que debe ser empleado a dosis mucho más bajas que la morfina. Fue aislado inicialmente del molusco Conus magnus19. De crustáceos planctónicos (neptune krill oil) una empresa canadiense está comprobando sus efectos en fase clínica II como atenuantes del ciclo menstrual. Otros metabolitos obtenidos de esponjas y corales están siendo probados como antiinflamatorios. Incluso el fármaco GTS21 de un gusano nemertino está mostrando potencialidad en el tratamiento del Alzheimer y la esquizofrenia. Otras familias de metabolitos con aplicación en salud humana: Conotoxinas (ziconotida, MVIIA o Prialt). La ziconotida es un péptido de veinticinco aminoácidos que ha sido recientemente autorizado por las autoridades americanas de la FDA para su comercialización para el tratamiento del dolor. Esta conotoxina, junto a otras ω-conotoxinas, que multiplican la eficacia de la morfina con mejor tolerancia. La manzamina A presenta efectos citotóxicos, insecticidas y antibacterianos. Las pseudopterosinas son diterpenos biclíclicos glicosilados, aislados de la gorgonia, o la peudopterogorgonia elisabethae, con potentes efectos antiinflamatorios. Por otro lado, las ecteinascidinas (ET-743, trabectedina, Yondelis) son potentes antitumorales. El conocimiento molecular de los genes responsables de la biosíntesis de metabolitos secundarios, especialmente relacionados con péptidos (non ribosomal peptide synthetases, o NRPS) y macrólidos policétidos (poliketide synthetases o PKS) y la posibilidad de silenciarlos o combinar distintos módulos para alterar estructuras definidas suponen un salto significativo en el actual descubrimiento de drogas a partir de productos marinos. En conclusión, ese universo de moléculas pequeñas, pero de extremada sutileza estructural encontradas en muestras marinas, forman un armamento tan fascinante que no es de extrañar que sean calificadas como las medicinas del futuro. Pero la mejor noticia es que la comunidad científica sólo ha explorado la punta del iceberg del potencial existente en la biodiversidad marina. 52 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica Cosmética Desde hace unos años, la preferencia por los productos que se asocian al concepto «natural» ha impulsado la investigación y la utilización de los ingredientes de origen marino. La cosmética, siempre atenta a las inquietudes de los consumidores, ha ido incorporando paulatinamente estos ingredientes en sustitución de los activos de origen animal20. La cosmética basada en activos de origen marino ha experimentado un notable auge en los últimos años: Algas: Las algas contienen oligoelementos, sales minerales, vitaminas y aminoácidos directamente asimilables por las células cutáneas. Un kilo de algas contiene tanto yodo como 10.000 litros de agua de mar y es 500 veces más rica en calcio y vitaminas que el agua de mar sola. Resulta de gran interés su capacidad para proporcionar iones negativos a la piel. Estos iones, almacenados en las algas y en el agua de mar, son atraídos por los iones positivos de las capas más profundas de la piel. Gracias a su composición y modo de actuación, poseen interesantes propiedades tonificantes, regeneradoras celulares, antiseborreicas, drenantes y suavizantes. Las algas se cultivan para su explotación cosmética, principalmente en la Bretaña francesa, donde numerosas industrias se han especializado en su extracción y purificación. Macromoléculas y aceites marinos: Las macromoléculas de origen marino han sustituido rápidamente a las de origen animal en las nuevas formulaciones. Características de las más empleadas: Quitosán: Es un derivado de la quitina, que es un polisacárido de Nacetilglucosamina. Obtenido a partir del caparazón de los crustáceos, forma una película fina y flexible sobre la piel que evita la pérdida de agua y proporciona elasticidad. Se incluye en cosméticos antiarrugas, calmantes, hidratantes y tensores. En cosmética capilar (0,1-0,5%), la película del quitosán protege el cabello de las agresiones externas, reduce la carga estática y confiere una fijación ligera del peinado, muy apreciada en espumas y geles. El quitosán también posee una actividad antimicrobiana que justifica su empleo en desodorantes. Glicosaminoglicanos: Como el condroitín sulfato, se extraen actualmente del cartílago de pescados. Una reciente novedad de los proveedores cosméticos es la obtención de aceites de pescados ricos en ácidos grasos poliinsaturados de la serie omega-3, como el ácido eicosapentanoico (EPA) y el ácido docosahexanoico (DHA). Fangos, barros y limos: La fangoterapia es un método de curación muy antiguo que ya conocían los egipcios hace 5.000 años. Desde entonces, los barros se han empleado para mejorar afecciones musculares, respiratorias, infecciosas, reumáticas y dermatológicas, entre otras. La cosmética tradicional también ha aprovechado sus propiedades para tratamientos corporales, en forma de caBol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 53 Flórez DA, Bernabé BV El agua de mar en la alimentación y en la terapéutica taplasmas y envolturas y, en la actualidad, se han incorporado a otros productos como mascarillas faciales y capilares. De ahí que posean unas excelentes propiedades purificantes y remineralizantes muy adecuadas para la formulación de cosméticos para la caspa, las pieles grasas, tratamientos reafirmantes, revitalizantes, etc. Los sedimentos marinos (INCI: maris limus) están constituidos por partículas extraordinariamente finas ricas en calcio y magnesio. También contienen otros oligoelementos (cinc, azufre, etc.) que les confieren demostradas propiedades terapéuticas superiores a las de las arcillas. Nuevos activos marinos: La riqueza biológica del mar es un valioso punto de partida para las investigaciones de las empresas cosméticas, siempre dispuestas a sorprendernos con nuevos ingredientes. Si hace unos años la tinta de calamar sirvió para la extracción de melanina5, con múltiples aplicaciones cosméticas, y los caparazones de los crustáceos finamente pulverizados se presentaron como una alternativa a los gránulos exfoliantes sintéticos, los nuevos descubrimientos se orientan hacia las especies menos conocidas que habitan el mar y las zonas costeras20. BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. 8. 9. 54 San José Rodríguez JC. René Quinton: Centenario de “L’eau de mer, milieu organique”. Bol Soc Esp Hidrol Med. 2004;19(1):17-21. San Martín J, Perea M. El Olimpo y el Mar. Bol Soc Esp Hidrol Med. 2003;18(2):6776. Llopis Orrego MM. Bajo la mirada de Heracles: los usos sociales del agua como fuente de salud y placer. Salamanca, Ed. Universidad Salamanca – Colección Vítor, 2010. García A. Manual del náufrago. Sobrevivencia en los océanos utilizando el agua de mar como hidratante y nutriente. Miami Florida, Resident Alien Books, 2007. Mouriño C, Fraga F. Determinación de nitratos en agua de mar. Investigación Pesquera. 1985;49(1):81-96. Disponible en: http://digital.csic.es/handle/10261/88848 Knauth PL. Temperature and salinity history of the Precambrian ocean: implications for the course of microbial evolution. Palaeogeography, Palaeoclimatology, Palaeoecology. 2005;219:53-69. Disponible en: http://www.sciencedirect.com/science/article/pii/S0031018204005905 San José Rodríguez JC. Agua de mar profunda. Bol Soc Esp Hidrol Med. 2007;22(1):22-26. Díaz-Fierros Viquieira F. Las aguas superficiales. Departamento de Edafología y Química agrícola. Facultad de Farmacia. Universidad de Santiago de Compostela. 2009. CSIC-Instituto de Ciencias del Mar. El mar a fondo. Guía didáctica. 2011. Disponible en: Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 Flórez DA, Bernabé BV 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. El agua de mar en la alimentación y en la terapéutica https://www.elmarafondo.com/documents/10180/15241/gu%C3%ADa+did%C3%A1c tica+el+plancton/29f8d6cf-fbe2-437f-acb1-1448c048e448 Anheller J E, Hellgren L, Karlstam B, Vincent J. Biochemical and biological profile of a new enzyme preparation from Antarctic krill Euphausia superba Dana suitable for debridement of ulcerative lesions. Arch. Dermatol. 1989;281:105-110. Cien por cien natural, S.L. Aceite de Krill NKO®. Madrid; 2011. (Aceite de krill) Carrasco Vayá JC, Hueso Kortekass K. Etnosal, un intento de recuperación de la memoria salinera de Castilla – La Mancha. Oppidum 2006;2:85-106. Lozano García CA. Adecuación y rediseño de un sistema de cristalización de sal. Colombia, Universidad del Valle. 1997. 114-156. McHugh DJ. Perspectivas para la producción de algas marinas en los países en desarrollo. FAO Circular de Pesca. No. 968. Roma, FAO. 2002. 30p. Cifuentes Lemus JL, Torres-García MP, Frías Mondragón M. El océano y sus recursos XI, Acuicultura. México: La Ciencia para Todos, 1997. Blunt JW, Copp BR, Hu WP, Munro MH, Northcote PT, Prinsep MR. Marine natural products. Nat Prod Rep. 2007;24:31-86. De La Calle, F. Fármacos de origen marino. Les biotecnologies. Treballs de la SCB. [Internet] 2007, nº 58. p.141-155. Disponible en: publicacions.iec.cat/repository/pdf/00000062%5C00000040.pdf Jain KK. An evaluation of intrathecal ziconotide for the treatment of chronic pain. Expert Opin Investig Drugs, 2000; 9:2403-10. Olivera BM. Conus venom peptides, receptor and ion channel targets and drug design: 50 million years of neuropharmacology. Mol Biol Cell. 1997;8:2101–9. Alcalde Pérez MT. Activos cosméticos de origen marino: Algas, macromoléculas y otros componentes. Offarm. 2004; 23. Disponible en: http://zl.elsevier.es/es/revista/offarm-4/activos-cosmeticos-origen-marino-13069607ambito_farmaceuticocosmetica-2004 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 37-55 55 Águas subterrâneas do setor norte de Portugal continental: Enquadramentos geográfico e geológico, tipologias e aproveitamentos Sousa Oliveira A(1-2-3) (1) Departamento de Geologia, Universidade de Trás-os-Montes e Alto Douro, Vila Real, (Portugal) (2) Centro de Geofísica da Universidade de Coimbra, (Portugal) (3) Diretor Técnico das Termas de Vimioso e das Caldas de Moledo (Portugal) [email protected] Recibido: 20-11-14 Aceptado: 05-12-14 Abstract La zona norte de Portugal es rica en aguas subterráneas, especialmente en aguas minerales y aguas juveniles. Esta es también el área donde es grande la diversidad de tipologías hidroquímicas. Estas tipologías son principalmente el resultado de factores geológicos. Hay aproximadamente 54 polos de fuentes de aguas subterráneas con relación a la configuración geológica: rocas ígneas, metasedimentarias y rocas metavulcanicas y complejo ofiolítico con rocas básicas y ultrabásicas. En este ámbito las surgencias de las aguas subterráneas están frecuentemente vinculadas a áreas de fracturas importantes en un contexto de terrenos profundos desde el punto de vista geomorfológico. En esta área es posible definir 9 familias hidroquímicas que caracterizan las aguas subterráneas en el norte de Portugal: F1 Bicarbonatadas, sodicas (ocasionalmente sódico / cálcicas o cálcico / sodicas), rico en CO2, fluoruros y normalmente ácidas F2 Bicarbonatadas (a veces bicarbonatadaa / cloruradas o cloruradas / bicarbonatadas), sodicas, sulfúreas, fluoradas, alcalinas F3 Bicarbonatadas / carbonatadas, sodicas, sulfúreas, silicatadas, hiperalcalinas F4 Bicarbonatadas, sodicas, sulfúreas, hiposilicatadas, alcalinas F5 Bicarbonatadas, sódicas, fluoruradas, alcalinas. Si hiposalinas no es el fluoruro, el ácido. F6 Bicarbonatadas, calcicas, sodicas, fluoruradas, alcalinas. Si hiposalinas no es el fluoruro, ácido, con un poco más sodio que de calcio F7 Bicarbonatadas, sodicas, sulfatadas, sulfúreas, hiposalinas, alcalinas F8 Cloruradas, sódicas, hiposalinas, ácidas. F9 Cloruradas / bicarbonatadas, sódicas, hiposalinas, ácidas Las principales familias hidroquímicas están representadas en las familias F1 y F2. Las aguas subterráneas han sido explotadas por el termalismo (terapéutico y de bienestar), el embotellado y la energía geotérmica, sin embargo, en la actualidad, en la mayoría de estos polos no hay explotación, alrededor del 50%. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 57 ISSN: 0214-2813 Sousa Oliveira A Águas subterrâneas do setor norte de Portugal continental… En el dominio de las aguas mineromedicinales son reconocidas las propiedades terapéuticas, principalmente en áreas tales como reumatología, locomotor, otorrinolaringología y dermatología. Las aguas subterráneas que se utilizan con mayor frecuencia en aplicaciones terapéuticas son las familias F1 y F2, mientras que en el dominio de embotellado las aguas de las familias F1 y F5 son los más relevantes. En paralelo con los usos más clásicos, hoy existe un creciente interés en los usos de estos recursos en áreas como la energía geotérmica, en productos dermocosméticos y en "peloides diseñados". El aprovechamiento integral de las aguas subterráneas se relaciona con posibles nuevas oportunidades económicas regionales de productos naturales asociados con áreas de ocurrencia. En el caso de las aguas minerales las oportunidades pueden pasar también por el turismo de salud, turismo termal y el turismo de naturaleza. Key words: aguas minerales, aguas juveniles, tipologias hidroquímicas, explotación de aguas subterráneas Groundwaters in northern of Portugal: geographical and geological settings, hydrochemical typologies and exploitations Abstract The northern Portugal area is rich in groundwaters, particularly in mineral waters and fresh waters. This is also the area where is great the diversity of hydrochemical typologies. This typologies are mainly the result of geological factors. There are approximately 54 poles of sources of groundwaters with relationship to geologic setting: igneous rocks, metasedimentary and metavulcanic rocks and ophiolitic complex with basic and ultrabasic rocks. In this domain the occurrences of groundwater are frequently linked to areas of major fractures in a context of deep terrains under geomorphologic point of view. In this area it is possible to define 9 hydrochemical families that characterize the groundwaters in northen Portugal: F1 Bicarbonated, sodium (occasionally sodium/calcium or calcium/sodium), CO2rich, fluoride and normally acid F2 Bicarbonated (sometimes bicarbonated/chlorinated or chlorinated/bicarbonated), sodium, sulphurous, fluoride, alkaline F3 Bicarbonated/carbonated, sodium, sulphurous, silicated, hiperalkaline F4 Bicarbonated, sodium, sulphurous, hiposilicated, alkaline. F5 Bicarbonated, sodium, fluoride, alkaline. If hyposaline is not fluoride, acid. F6 Bicarbonated, calcium, sodium, fluoride, alkaline. If hyposaline is not fluoride, acid, with a little more sodium than of calcium F7 Bicarbonated, sodium, sulphated, sulphurous, hyposaline, alkaline. F8 Chlorinated, sodium, hyposaline, acid. F9 Chlorinated/bicarbonated, sodium, hyposaline, acid. The main hydrochemical families are represented in F1 and F2 families. The groundwater has been exploited in thermalism (therapeutic and wellness thermalism), bottling and 58 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Águas subterrâneas do setor norte de Portugal continental… geothermal energy, however, currently, in the majority of these poles there is no exploitation, about 50 %. In the natural mineral waters domain are recognized therapeutic properties, mainly in the areas such as rheumatical, musculoskeletal, otorhinolaryngological and dermatological. The groundwaters that are used most often in therapeutic applications are F1 and F2 families, while at the bottling domain the waters of F1 and F5 families are the most relevant. In parallel with the more classic usages today there is a growing interest in the usages of these resources in areas such as geothermal energy, in dermocosmetic products and in “designed peloids”. The integrated exploitation of groundwater in articulation with regional natural products prospective new economic opportunities associated with areas of occurrence. In the case of mineral waters opportunities can pass also by health tourism, spa tourism and nature tourism. Key words: mineral waters, fresh waters, hydrochemical typologies, exploitation of groundwaters REFERENCIA NORMALIZADA Sousa Oliveira A. Águas subterrâneas do setor norte de Portugal continental: Enquadramentos geográfico e geológico, tipologias e aproveitamentos. Bol Soc Esp Hidrol Med, 2015; 30(1): 57-71 ENQUADRAMENTO No setor norte de Portugal continental, as ocorrências de polos de água subterrânea resultam da conjugação de fatores geomorfológicos, litológicos, estruturais e geotectónicos (figura 1). Em resultado, destacam-se as zonas geomorfologicamente depressionadas, os vales de fraturas extensas, as zonas de contacto entre rochas granitóides e metassedimentares, os domínios intra ou peribatolíticos e as áreas com litotipos de natureza básica e/ou ultrabásica. A emergência de algumas águas minerais situa-se em domínios intrametassedimentares, contudo a sua tipologia hidroquímica está geneticamente associada a ambientes granitóides ocorrentes em profundidade. As características físico-químicas das águas subterrâneas, como o pH, a temperatura, a mineralização total, a natureza dos componentes iónicos, entre outros, traduzidas na diversidade hidroquímica, dependem do contexto litoestrutural e tectónico enquadrante do circuito geohidráulico, da profundidade atingida, do tempo de residência, da velocidade de fluxo, dos fenómenos modificadores até à emergência, da comunidade microbiológica associada, etc. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 59 Sousa Oliveira A 60 Águas subterrâneas do setor norte de Portugal continental… Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Águas subterrâneas do setor norte de Portugal continental… CARACTERÍSTICAS GERAIS Os recursos hídricos subterrâneos da região norte de Portugal continental apresentam uma enorme diversidade hidroquímica que colocam esta região numa situação de riqueza hidrogeológica ímpar a nível nacional. As ocorrências integram nove famílias hidroquímicas principais (Quadro 1), distribuídas por cinquenta e quatro polos de emergência de águas subterrâneas (Quadro 2). Quadro 1 – Águas subterrâneas do norte de Portugal continental: Famílias hidroquímicas. Família Tipologia hidroquímica - designação geral F1 () Bicarbonatada, sódica (por vezes sódico/cálcica ou calco/sódica), gasocarbónica, fluoretada, frequentemente ferruginosa e normalmente ácida. F2 ( ) Bicarbonatada (por vezes bicarbonatada/cloretada da/bicarbonatada), sódica, sulfúrea, fluoretada, alcalina. F3 ( ) Bicarbonatada/carbonatada, sódica, sulfúrea, silicatada, hiperalcalina. F4 ( ) Bicarbonatada, sódica, sulfúrea, hipossilicatada, alcalina. F5 ( ) Bicarbonatada, sódica, fluoretada, alcalina. Se for hipossalina é não fluoretada, ácida. F6 ( ) Bicarbonatada, cálcica, sódica, fluoretada, alcalina. Se for hipossalina é não fluoretada, ácida, com uma tendência de concentração em sódio ligeiramente mais elevada do que a de cálcio. F7 ( ) Bicarbonatada, sódica, sulfatada, sulfúrea, hipossalina, alcalina. F8 ( ) Cloretada, sódica, hipossalina, ácida. F9 ( ) Cloretada/bicarbonatada, sódica, hipossalina, ácida. ou cloreta- Os polos de água subterrânea aqui considerados consagram áreas de emergência que se podem integrar em três domínios: água mineral natural, água mineral e água de nascente, exploradas em termalismo (terapêutico e de bem-estar), engarrafamento e geotermia. Atualmente na maioria destes polos não se associa qualquer tipo de aproveitamento. No entanto, é do conhecimento geral que, no passado, as águas minerais foram utilizadas pelas populações locais em práticas terapêuticas populares. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 61 Sousa Oliveira A 62 Águas subterrâneas do setor norte de Portugal continental… Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Águas subterrâneas do setor norte de Portugal continental… 63 Sousa Oliveira A 64 Águas subterrâneas do setor norte de Portugal continental… Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Águas subterrâneas do setor norte de Portugal continental… 65 Sousa Oliveira A 66 Águas subterrâneas do setor norte de Portugal continental… Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Águas subterrâneas do setor norte de Portugal continental… 67 Sousa Oliveira A 68 Águas subterrâneas do setor norte de Portugal continental… Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Águas subterrâneas do setor norte de Portugal continental… 69 Sousa Oliveira A Águas subterrâneas do setor norte de Portugal continental… No quadro 2 faz-se uma síntese dos parâmetros associados às águas subterrâneas do norte de Portugal, nomeadamente quanto ao ambiente geológico, a aspetos físico-químicos, à tipologia hidroquímica, ao tipo de água, às terapias reconhecidas e de uso popular e aos aproveitamentos atuais. CONSIDERAÇÕES FINAIS No setor norte de Portugal continental as ocorrências de água subterrânea são dominadas pelas tipologias hidroquímicas das famílias F2 e F1. Não obstante a exploração atualmente desenvolvida em alguns polos, em particular nos hidrominerais, e o facto de alguns se encontrarem em fase de préexploração, existe ainda um número bastante significativo, cerca de 50%, que se encontra em estado de desconhecimento ou, sendo conhecidos, nunca se promoveu devidamente o seu aproveitamento. Na maioria desses polos ocorrem águas minerais naturais ou minerais, com idêntica distribuição. No domínio das águas minerais naturais são reconhecidas diversas vocações terapêuticas, sendo que as mais importantes se encontram nos domínios reumático e músculo-esquelético, ORL e dermatológico. Os aproveitamentos situam-se principalmente ao nível do termalismo terapêutico, termalismo de bem-estar e engarrafamento. O aproveitamento geotérmico é ainda relativamente reduzido face ao potencial geotérmico disponível. Nos aproveitamentos terapêuticos destacam-se as águas das famílias F2 e F1 enquanto que ao nível do engarrafamento as águas das famílias F1 e F5 são as mais relevantes. A par dos aproveitamentos mais clássicos, o atual interesse tem sido dirigido para novos produtos ancorados em recentes técnicas de aproveitamento como o geotérmico, a exploração em dermocosmética e o desenho de pelóides. A exploração integrada destes recursos hídricos em articulação com a utilização de produtos naturais regionais perspetiva o eventual desenvolvimento de novas valências económicas associadas às águas destes polos. Em particular, as águas minerais, sentido lato, e as que apresentam características geotérmicas oferecem acrescidas valências nomeadamente no domínio do turismo de saúde, turismo termal e turismo de natureza. BIBLIOGRAFIA Acciaiuoli, L. Le Portugal hydromineral. Lisbonne, Direction Generale des Mines et des Services Geologiques Vol. I, 1952: 248p. 70 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 Sousa Oliveira A Águas subterrâneas do setor norte de Portugal continental… Almeida A, Almeida JD. Inventário hidrológico de Portugal: Trás-os-Montes e Alto Douro. Lisboa, Instituto de Hidrologia de Lisboa 2º Vol., 1970: 639p. Almeida A, Almeida JD. Inventário hidrológico de Portugal: Minho. Lisboa, Instituto de Hidrologia de Lisboa 4º vol., 1988: 505 p. Direcção-Geral de Geologia e Minas. Termas e águas engarrafadas em Portugal. Lisboa, Ministério da Indústria e Energia, 1992. Machado JMGS. Ocorrências hidrominerais do NE de Portugal Continental: inventariação, sistematização e aproveitamentos didácticos. Vila Real, Tese de mestrado em “Biologia e Geologia para o Ensino”. Universidade de Trás-os-Montes e Alto Douro, 2009, 469p. Pacheco FAL. Hidrogeologia em maciços de rochas cristalinas (Morais-Chacim-Macedo de Cavaleiros). Bases para a gestão integrada dos recursos hídricos da região. Vila Real, Tese de doutoramento, Universidade de Trás-os-Montes e Alto Douro, 2000: 395p. Portugal Ferreira ME, Sousa Oliveira A. (2000) - Lithologic and tectonic control of the mineral waters in the Hercynian Belt: Northeast Portugal. Procceding of 31st International geological congress & scientific exhibits- -geoexpo 2000. 6-17 Agosto 2000, Rio de Janeiro, Brasil. Serviços Geológicos de Portugal, Direcção-Geral de Geologia e Minas - Carta Geológica de Portugal, escala 1:500 000. 1992. Sousa Oliveira A. Hidrogeologia dos sistemas gasocarbónicos da Província Hidromineral Transmontana: Ribeirinha (Mirandela), Sandim (Vinhais), Segirei e Salgadela (Chaves). Vila Real, Tese de doutoramento, Universidade de Trás-os-Montes e Alto Douro, 2001: 442p. Sousa Oliveira A. Águas minerais naturais de Trás-os-Montes e Alto Douro: património legado pela natureza. Boletim Cultural, 2011; 17: 18-29. Sousa Oliveira A, Almeida SMS, Reis AR, Alencoão AMP, Sousa LMO, Lourenço JMM. Águas minerais de Trás-os-Montes e Alto Douro (NE de Portugal): sistematização e aproveitamentos. In: Quinta-Ferreira M, Barata MT, Lopes FC, Andrade AI, Henriques MH, Pena dos Reis R, Ivo Alves E. (Coords). Água: a seiva da Terra. Memórias e Notícias de Geociências no Espaço Lusófono. Coimbra, Imprensa da Universidade de Coimbra, 2012: 409-420. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 57-71 71 El Canal de Isabel II Cristina FULGENCIO DELGADO(1), Esther BRIVIESCA PEÑA(1) (1) Estudiantes de Ciencia y Técnología de los Alimentos. Facultad de Veterinaria. Universidad Complutense de Madrid. 28040 Madrid (España). [email protected] Recibido: 15-09-14 Aceptado: 20-11-14 Resumen El Canal de Isabel II es una de las redes de captación y distribución más importantes de España, abastecido por los ríos madrileños, garantiza el suministro de un agua de excelente calidad a prácticamente todos los municipios de Madrid. Con objeto de comprender la magnitud de dicha empresa presentamos los antecedentes que dieron lugar a su origen, así como un repaso a lo largo de toda la historia de su construcción y su situación en la actualidad. Además, se analizará la cuenca hidrográfica de la Comunidad de Madrid y las características químicas y físico-químicas que hacen del agua madrileña una de las mejores del país. Palabras claves: Canal de Isabel II, los viajes de agua; hidrografía de Madrid, embalse, acuífero, composición química del agua, historia de Madrid, legislación de aguas, legionella The Canal de Isabel II Abstract The Canal de Isabel II is one of the most important catchment and distribution networks in Spain. Supplied by the rivers of Madrid, this network guarantees the provision of high quality water to most of its municipalities. In order to better understand the magnitude of this mission, the history of its beginning, construction and actual state are included in this paper. Furthermore, the chemical and physicochemical properties of Madrid’s drainage basin, which have transformed its water into one of the best in Spain, will be analyzed. Key words: Canal de Isabel II, water qanats, Madrid's hydrography, dam, aquifer, water's chemical compound, Madrid's history, water's legislation, legionella. REFERENCIA NORMALIZADA Fulgencio C, Briviesca E. El Canal de Isabel II. Bol Soc Esp Hidrol Med, 2015; 30(1): 73-88 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 73 ISSN: 0214-2813 Fulgencio C, Briviesca E El Canal de Isabel II INTRODUCCIÓN A lo largo de la historia Madrid sufrió varios problemas relacionados con el abastecimiento de agua. Desde su aparición en el siglo IX, como ciudad fronteriza del reino de Toledo, el arroyo de las Fuentes de San Pedro era suficiente para el abastecimiento de agua, pero tras el traslado definitivo de la Corte a Madrid en 1606, el aumento de la población hizo que fuera necesaria la construcción de varios viajes de agua. Los viajes de agua consistían en una serie de galerías subterráneas, de entre 7 y 12 km de largo, cuyo objetivo era llevar agua desde zonas lejanas de la sierra a la capital. Esta se captaba a través de “los vexigones de tierra llena de agua, procedentes de la lluvia», hasta la ciudad”1. Una vez localizados se comprobaba el nivel freático y la solubilidad del agua. Si ésta era buena y con el suficiente desnivel para que discurriera por gravedad; se procedía a excavar una serie de pozos unidos entre sí por minas o galerías subterráneas de captación que a su vez drenaban el agua hasta las fuentes de la ciudad Figura 1. Figura 1 – Galería de viaje de agua En centro del suelo había una cañería que transportaba el agua y a uno o a ambos de la misma se construía un andén o andenes para que el maestro fontanero pudiera inspeccionar las minas y controlar que el agua fluyera clara y cristalina. 74 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II A lo largo de los viajes existían una serie de chimeneas colocados de forma regular, que permitían extraer la tierra excavada durante la construcción, el acceso del personal de mantenimiento y el oxígeno necesario para la respiración y la aireación del agua2. Estos pozos estaban cubiertos en la superficie por una losa de piedra o un “capirote” Figura 2. Figura 2 – Capirote Los viajes de agua eran propiedad del Concejo, de la Corona, de monasterios, hospitales y miembros de la nobleza. El máximo responsable del mantenimiento y conservación de los viajes era el Fontanero Mayor, a sus órdenes tenia maestros fontaneros, cuyo cometido era guardar las llaves de las arcas. La mayoría de los ciudadanos se proveían del agua a través de las fuentes públicas, pero había personas con la suficiente capacidad económica para pagar el traslado del agua a sus casas, surgiendo la profesión de los aguadores. Durante el reinado de Isabel II, volvieron a surgir nuevos problemas de abastecimiento de agua. Con el objetivo de solucionarlos, se propuso la captación del agua en los ríos Jarama, Guadalix y Manzanares, pero la propuesta resultó inviable. Posteriormente, se concluyó que la toma de agua debía realizarse en un caudal más lejano, en el río Lozoya. El proyecto se aprobó en 1851 y las obras se alargaron hasta 1858, año en el cual se inauguró el Canal de Isabel II. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 75 Fulgencio C, Briviesca E El Canal de Isabel II INICIO DEL CANAL DE ISABEL II Como ya se ha señalado anteriormente, la escasez de agua en Madrid hizo que se buscasen otras fuentes para traer agua a la ciudad a través de la construcción del Canal de Isabel II. Una vez elegido el río Lozoya y bajo la supervisión de Juan Bravo Murillo, comenzó la construcción de un canal que trajera agua a Madrid. Para la ejecución de los trabajos se formó un Consejo de Administración y un director de obras; inicialmente el primer director de obras fue José García Otero pero en 1855 fue sucedido por Lucio del Valle, el cual se considera el rector del Canal y quien dirigió los trabajos a pie de obra. Este ingeniero ya había construido la carretera de Cabrillas (camino de Valencia) y fue el primero que propuso la utilización de presidiarios como mano de obra. Para llevar a cabo la cartografía y las nivelaciones, de cara a establecer los planos topográficos, los desmontes y el diseño de proyectos como la presa del Pontón de la Oliva, la embocadura del canal y sus conducciones, etc.; se recurrió a acreditados profesionales como Juan Rafo y Juan de Rivera, entre otros. Para la financiación del proyecto se abrió un crédito extraordinario del Ministerio de Hacienda y una suscripción pública de acciones que rentaría según el capital aportado, siendo la reina la primera en encabezar la lista de suscriptores3. El proyecto se redactó y se construyó casi simultáneamente, en una extensión de 70 km y con unas comunicaciones muy difíciles. Entre unos frentes y otros había aproximadamente 5 horas a caballo, y esto planteaba dificultades en el traslado de los materiales que hacían falta para la obra, por lo que se decidió extraerlos en el lugar donde se iban a utilizar. Esto supuso el traslado de fábricas de unos parajes a otros. Además, en muchos tramos de la obra se desarrolló la llamada "telegrafía alada", que consistía en una comunicación mediante palomas mensajeras. La marcha de estas obras también se vio dificultada por la situación política inestable de la época, que ocasionó altibajos en la financiación del Canal e incluso obligó a suspender las obras temporalmente. Además, la naturaleza también ocasionó avenidas, inundaciones y epidemias de fiebres, que fueron una constante en los años que duró la obra y que retrasaba su construcción. Debido a los numerosos problemas que surgieron la construcción del Canal se prolongó de los 4 años previstos a 7 años. En 1851 se puso la primera piedra de la presa de El Pontón de la Oliva Figura 3, en el río Lozoya, Madrid, que contaba por ese entonces con unos 200.000 habitantes, inauguró el abastecimiento el 24 de junio de 1858. Se puso especial atención en atender las condiciones de la calidad del agua realizando análisis periódicos, revistiendo la conducción para evitar el calentamiento o las posibles contaminaciones y, además, se dispusieron filtros para eliminar las turbideces debidas a materiales en suspensión4. Dado que el crecimiento de la ciudad había estado limitado por la falta de agua, esta nueva presa hizo que la ciudad pudiese comenzar una expansión de su pobla- 76 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II ción. La red de distribución inicial, tomada como modelo durante mucho tiempo, permitió el crecimiento urbano durante casi un siglo. Figura 3 – Portón de la Oliva A finales de los años sesenta la empresa que llevaba a cabo la construcción de este nuevo sistema de abastecimiento atravesó una difícil situación económica, que desembocó en la disolución del Consejo de Administración y la incorporación del Canal de Isabel II al Ministerio de Fomento. La falta de recursos hizo que las obras de ampliación proyectadas se paralizaran, la red de distribución apenas alcanzaba para toda población y las reparaciones eran continuas. Pese a esta situación, en 1859 se propuso la construcción de la presa de El Villar. Su autor fue Elzeario Boix y fue construida en tan solo 3 años, de 1870 a 1873, siendo en su momento la presa más moderna de Europa por su altura, 50 metros, y tipología. Una vez terminada volvió a abastecer de agua durante décadas a Madrid, ya que aumentó la capacidad del embalse en 22 hm3 4. En el siglo XX, debido a diversas sequías severas, así como el enorme crecimiento de la ciudad de Madrid, se observó la necesidad de ampliar las instalaciones del Canal. Esta ampliación sufrió un importante parón en 1936 como consecuencia de la Guerra Civil, guerra durante la cual los directivos de la empresa se centraron Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 77 Fulgencio C, Briviesca E El Canal de Isabel II en la reorganización interna, el saneamiento económico y la defensa armada de las instalaciones para garantizar el agua a los madrileños. En la posguerra tuvo lugar un aumento importante en la inmigración en Madrid, lo que ocasionó una mayor necesidad de agua, necesidad que se vio incrementada con las sequías de los años 1944, 1948 y 1949. En estos tres momentos la demanda de agua superó a la capacidad de reserva del Canal, lo que implicó no solo una sequía sino también las restricciones correspondientes para permitir el desarrollo de las obras del Canal. En 1958 se inauguró la presa de Riosequillo, pero el suministro también se quedaba corto para la población que, en 1963, ya alcanzaba los 2.300.000 ciudadanos. La sequía de 1964 fue el detonante de la búsqueda de una solución para subsanar esta falta de agua, tomándose como medida urgente la construcción de la presa El Atazar Figura 4, capaz de embalsar 426 hm3 de agua. Esta presa entró en funcionamiento en 1972; en esos años se construyeron además otras presas como las de Puentes Viejas y Pinilla, en el río Lozoya; y la de El Vellón, en el Guadalix. Por lo tanto a Madrid llegaban ya aguas de varias cuencas: las del río Lozoya, las del río Manzanares, las del río Guadalix y las del río Jarama. Figura 4 – Presa de El Atazar en construcción Actualmente el Canal de Isabel II cuenta con catorce embalses y cuatro azudes que suponen una capacidad de embalse de 946 hm3, mientras que la red de distribución alcanza los 12.000 kilómetros. 78 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II La empresa Canal de Isabel II. Desarrollo y proyectos En el siglo XX el crecimiento de Madrid volvía a estar descontrolado por lo que en 1907 el Canal recuperó su condición de empresa dependiente del Gobierno pero no del Ministerio de Fomento, y con ello su autonomía en la gestión del agua. Fue necesario adoptar medidas urgentes de cara a la explotación de la red de distribución como la eliminación de las concesiones a caño libre, la instalación de contadores, la subida de tarifas, el control de las bocas de riego municipales y la vigilancia permanente de la red para evitar las frecuentes roturas por parte de los vecinos4. Además de estas medidas tomadas por la empresa, también comenzó una creciente preocupación sanitaria, lo que ocasionó la construcción de un laboratorio permanente para el análisis del agua de abastecimiento, contemplando igualmente la posibilidad de obtener ingresos extras del agua mediante la producción eléctrica. Pese a todos estos avances, se estimó que en 15 años sería imposible cubrir las demandas de agua de la ciudad debido al aumento del consumo, que había aumentado más del doble en los últimos 20 años. Esto hizo que se plantease tomar agua de las cuencas del Jarama y Sorbe. En 1920 Madrid alcanzó los 600.000 habitantes, con un consumo de 210.000 metros cúbicos de agua, distribuidos con una red de 230 kilómetros. Este suministro suponía un caudal de 2 m3/s y para que la conducción pudiera transportar un caudal mayor era necesario disponer de una segunda conducción, pudiendo abastecer así mismo a las zonas elevadas. Aparte de que esta nueva conducción permitiría abastecer a una demanda creciente, también permitiría llevar a cabo las reparaciones que eran necesarias en la conducción existente. Las grandes obras hidráulicas de Madrid en el siglo xx Las obras hidráulicas se dispusieron en diferentes planes de actuación, es decir, un plan a corto plazo o de urgencia para llevar agua a la capital de forma rápida, y otro plan a medio plazo para solucionar definitivamente el abastecimiento de Madrid con una mayor garantía de servicio. Para llevar a cabo el plan de urgencia se realizó una toma del embalse de Picadas, sobre el río Alberche, hecho que se consiguió en tan solo dos años. Durante esta época se construyeron más del 50% de las infraestructuras del Canal de Isabel II y el objetivo no era solo dar respuesta a la demanda diaria de agua, sino también contar con la suficiente capacidad de abastecimiento para afrontar posibles períodos de sequía. Entre las presas construidas en este período destaca la ya nombrada presa de El Atazar, que creó un gran embalse en el río Lozoya, consiguiendo que éste pasase a estar totalmente regulado. Entró en funcionamiento en 1972 y representa el 73% del total de la capacidad del embalse del río y cerca de la mitad del volumen de aducción a la capital. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 79 Fulgencio C, Briviesca E El Canal de Isabel II Aparte de la preocupación por esta garantía de servicio, comenzaron a manejarse nuevos conceptos como una mejor atención al cliente debido a la reestructuración interna de Canal de Isabel II. Pese a todo esto, aún tenía lugar un desequilibrio hidráulico que afectaba a toda la provincia, de modo que la producción se situaba en la zona norte, el transporte en la central y el consumo se realizaba en la ciudad, que vertía sus desechos hacia la zona sur. Esta situación cambió con la creación de la Comunidad Autónoma de Madrid en 1983. Esta nueva Comunidad Autónoma estableció dos pilares básicos en la política de aguas; por un lado estableció la consideración del ciclo integral del agua y por otro lado la necesaria conexión entre planificación hidráulica y territorial. Se diseñó el PIAM (Plan Integral del Agua en Madrid), cuyo objetivo era resolver el abastecimiento y saneamiento de las aguas en todo el territorio de la Comunidad. La dirección y gestión del plan se encomendó a Canal de Isabel II y de este modo se convirtió definitivamente en una empresa de servicios. EL CANAL DE ISABEL II EN LA ACTUALIDAD Zonas de captación de la Comunidad de Madrid La cuenca hidrográfica de la Comunidad de Madrid pertenece casi en su totalidad a la Cuenca del Tajo. Los arroyos situados en la ladera norte del Puerto de Somosierra pertenecen a la Cuenca del Duero, pero su importancia y extensión es muy limitada. Las precipitaciones son las que aportan la mayor parte del volumen hídrico, teniendo poca importancia las nevadas ya que su duración es escasa y solo destacan por encima de 1.000 metros. Por lo tanto, es más importante la alimentación pluvial que la nival en las aguas de Madrid, aunque las aguas de fusión generan una importante parte del caudal. Sin embargo, la irregularidad de las precipitaciones define el territorio de Madrid. En la Sierra de Guadarrama y Somosierra las precipitaciones totales son superiores a 700 mm, incluso superiores a 900 mm en la zona de cumbres; en Navacerrada hay un promedio de 1.211 mm, con un máximo de 2.009 mm (en 1996), en La Rampa las precipitaciones totales están entre los 500 y 700 mm; y en la Cuenca (integrada por la campiña, las vegas y los páramos) las precipitaciones totales son inferiores a los 500 mm pero superiores a los 400 mm5. Esta diferencia en las precipitaciones en los territorios de Madrid se manifiesta también en el ritmo de las lluvias anuales, ya que los periodos lluviosos pueden retrasarse o no aparecer, dando lugar a sequías prolongadas con los consiguientes problemas en el suministro urbano. El volumen de agua precipitada en un año medio es algo superior a los 4.000 hm3, de los cuales se pierden aproximadamente 80 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II el 75% directamente por evapotranspiración, por lo que la capacidad potencial de embalse se reduce a menos de 800 hm3 5. Los ríos que transcurren por la red fluvial de la Comunidad de Madrid y sus afluentes son el Jarama con el Lozoya, el Guadalix y el Manzanares, además, del Henares y el Tajuña que nacen en Guadalajara; el Guadarrama con el Aulencia; el Alberche con el Cofio (que nacen en Ávila) y el Perales. Las alteraciones hídricas de estos ríos, tanto en sus cursos como en el régimen hidrológico se deben a las grandes obras hidráulicas existentes (embalses, canales, trasvases, regadíos) que regulan sus caudales. Estas alteraciones, en ocasiones, hacen que el agua que queda en los ríos sea insuficiente para el mantenimiento de los ecosistemas terrestres y acuáticos de las riberas durante muchos periodos de tiempo. El Jarama es el río más importante de la Comunidad de Madrid. Tiene una cuenca de 11.597 km2 y un caudal de 999 hm3/año y su nacimiento se origina en la Peña Cebollera en Somosierra, atraviesa por la provincia de Guadalajara y, tras el embalse del Vado entra en la Comunidad de Madrid por la presa de Valdentales en Torrelaguna. Sus afluentes más destacados son el Lozoya, Guadalix y Manzanares; Henares/Sorbe y Tajuña. Por otro lado destaca el río Guadarrama, que nace en la zona central de la Sierra (Siete Picos, Puertos de la Fuenfría y Guadarrama). La superficie de la cuenca es de 1.708 km2 y un caudal medio total de 152 hm3/año. Tras pasar por Guadarrama atraviesa la Rampa y las Campiñas, hasta salir de la Comunidad en las proximidades de Batres. Al igual que en el caso del río Manzanares, a lo largo del curso del río Guadarrama se ha creado el Parque Regional del Guadarrama. Además, en su cuenca se encuentran los embalses de Los Arroyos La Jarosa y Valmayor, su principal afluente es el río Aulencia. En cuanto al río Alberche, éste nace en el Puerto de El Pico (Ávila) y entra en Madrid por el embalse de San Juan, constituyendo la cuenca del suroeste madrileño. Su cauce es de 182 km, 40 de los cuales recorren la Comunidad de Madrid; la superficie de su cuenca es de unos 4.108 km2 y su caudal total medio es de 802 hm3/año. Sus principales afluentes son el Cofio y el Perales; y embalsa las aguas de San Juan, Picadas, La Aceña y Los Morales. Por último hay que citar el río Tajo, ya que es el río más importante que transcurre por la región aunque su recorrido se limite de forma colateral en el sureste de la Comunidad, con un recorrido de 70 km. Se adentra en Madrid por Estremera hasta Aranjuez, abandonando la Comunidad por Algodor. A lo largo de su curso recibe las aguas de los ríos Guadarrama y Alberche Tabla 1. En la cabecera de los ríos se han construido una serie de embalses que constituyen la red hidrológica de la Comunidad de Madrid. Con la construcción de la presa de El Villar en 1879 y las posteriores en la primera mitad del siglo XX (Manzanares en 1912 y Puentes Viejas en 1939), así como con el canal de transporte al municipio madrileño, los depósitos reguladores y la red arterial de distribución urbana; se configura el Sistema Hidrológico del Canal de Isabel II. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 81 Fulgencio C, Briviesca E El Canal de Isabel II Tabla 1 - Aportaciones naturales de los ríos 2011-2013 (Hm3). Cuenca 2011 2012 2013 Lozoya 319,7 120,4 394,98 Jarama 142,7 48,6 177,53 Guadalix 51,7 12,8 41,28 Manzanares 115,7 38,4 112,78 Guadarrama -Aulencia 43,2 22,3 39,29 Alberche (Cofio -Morales) 23,2 6,5 22,07 Aportaciones naturales totales 696,2 248,8 787,93 Los embalses anteriormente citados del Canal se completan con cuatro azudes construidas en los ríos Lozoya, Guadalix, Sorbe y Guadarrama, que actúan derivando el agua para utilizarla posteriormente. Además de éstos existen también otros azudes en los ríos Jarama y Tajo (del Rey, Estremera, Buenamesón, La Adehuela, Villaverde, etc) que derivan el agua hacia canales de riego, destacando los de Valdajos y Embocador. Otros azudes se encuentran en la zona central de la Sierra de Guadarrama, en los valles, y aprovechan los caudales de las cabeceras de los ríos y arroyos, siendo el abastecimiento a localidades y urbanizaciones serranas su función principal. Entre los azudes más importantes de la Sierra de Guadarrama se encuentran Los Arroyos, El Batán, Las Lagunas, Las Berceas, en la cabecera del río Guadarrama; Maliciosa, La Barranca, Navalmedio, en la cabecera de la cuenca del Manzanares; y Miraflores en el Guadalix. En todo este sistema hidrológico el río Lozoya sigue siendo el principal proveedor de agua acumulada a la aglomeración urbana, ya que cuenta con 5 embalses en su cuenca (El Villar, Puentes Viejas, Riosequillo, Pinilla, El Atazar). En cuanto a las aguas subterráneas suponen aproximadamente un tercio de los recursos hídricos totales, aunque de cara al abastecimiento no suponen un recurso importante. Entre sus funciones destaca la garantía de abastecimiento a núcleos urbanos en períodos de sequía, ya que sirve como fuente complementaria cuando el volumen de agua en los embalses disminuye. Las sequías suelen producir una media de un año cada cuatro o cinco, de manera que el acuífero puede recuperarse en ese periodo y garantizar su sostenibilidad. Por lo otra lado, los acuíferos son una fuente alternativa en el suministro en los momentos críticos por incidencias en el sistema de distribución (ej.: averías) y son 82 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II el principal sistema de abastecimiento de pequeñas localidades o aisladas, a las cuales el Canal de Isabel II no puede acceder. El agua de los acuíferos discurre por formaciones de naturaleza geológicas diversas; El Plan Hidrológico del Tajo divide los acuíferos en 13 Unidades Hidrogeológicas (UH), de las cuales cuatro se sitúan en la Comunidad de Madrid: UH 03 Torrelaguna-Jadraque, UH 04 Guadalajara, UH 05 Madrid-Talavera y UH 06 La Alcarria, quedando fuera la mayor parte de la Sierra y los tramos bajos del Jarama, Manzanares y el Tajo. El resto del territorio está constituido por otros acuíferos locales o de baja transmisividad y almacenamiento; todos ellos se unen bajo la denominación de "99", y según la configuración fisiográfica regional, esto determina los acuíferos en función de sus componentes litológicos5. El volumen de agua subterránea captada en 2002 por el Canal de Isabel II fue de 59.6 hm3. De cara al futuro, para conseguir aumentar el aporte de las aguas subterráneas al abastecimiento urbano, se está construyendo un nuevo campo de pozos con 26 extracciones en el margen derecho del río Guadarrama, con unas previsiones de captación de 30 hm3/año. Tratamiento del agua Además de la red de embalses que ya hemos nombrado existen otras infraestructuras que completan la calidad y cantidad del abastecimiento y la distribución del agua a la aglomeración urbana madrileña. Destacan las conducciones de aguas, que son una importante red de tuberías que constituyen trasvases, canales, arterias y uniones que comunican las distintas cuencas que existen en la Comunidad de Madrid e infraestructuras del Sistema Hidrológico del Canal de Isabel II, con los que accede el abastecimiento a la mayoría de los municipios de Madrid. Actualmente la red de conducción cuenta con 22 grandes conducciones que llevan el agua bruta desde los embalses hasta Estaciones de Tratamiento de Agua Potable (ETAP) o potabilizadoras y de aquí a los depósitos reguladores de almacenamiento. De estas conducciones destaca la arteria principal del Sistema Hidrológico, formada por los canales Bajo, Alto y Atazar, que conecta los embalses del río Lozoya con los depósitos reguladores y estaciones de elevación de Madrid. El suministro de agua estuvo sin tratamiento alguno hasta los años 50, ya que cumplían con las normas de "transparencia-cristalina"; a partir de ahí se añadió cloro como desinfectante y ya en 1967 entró en servicio la primera estación potabilizadora (Torrelaguna). Esto se ocasionó como consecuencia de los vertidos contaminantes y el inicio de los procesos de eutrofización de las aguas embalsadas6. La potabilidad del agua se comprueba mediante análisis tanto en las propias plantas como en la red de distribución. Las ETAP se sitúan entre las instalaciones de captación de agua (embalses y pozos) y los depósitos y canalizaciones de la red Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 83 Fulgencio C, Briviesca E El Canal de Isabel II que distribuirán para el consumo. Actualmente el Canal de Isabel II cuenta con 12 ETAP, con una capacidad máxima de tratamiento de 3,752 hm3 al día. Controles oficiales y criterios microbiológicos Los controles oficiales y criterios microbiológicos permitidos en las aguas de consumo humano y, por extensión, permitidos en las aguas del Canal de Isabel II, están recogidos en el Real Decreto 140/2003 de 7 de Febrero, el cual establece los criterios sanitarios de la calidad del agua de consumo humano. En cada abastecimiento se controlarán una serie parámetros, tanto parámetros microbiológicos como parámetros químicos, otros parámetros indicadores y radiactividad. El control de la calidad del agua de consumo humano se lleva a cabo en varios niveles: un autocontrol en varios puntos de muestreo, una vigilancia sanitaria, responsabilidad de la autoridad sanitaria y un control del agua en el grifo del consumidor. CARACTERÍSTICAS DE LAS AGUAS DE MADRID El agua en la Comunidad de Madrid como ya se ha dicho anteriormente, se ve influenciada principalmente por el relieve y las precipitaciones de la zona de la cuenca del Tajo. Debido a ello es un agua que presenta unas características típicas de una región de terreno granítico con la consiguiente filtración natural, lo que hace que tenga un contenido en sales minerales muy bajo. Así mismo, su conductividad es muy baja ya que habitualmente oscila entre los 100-200 µS/cm a 20º y presenta un pH que suele estar comprendido como media entre 7-8,5 aproximadamente. Además, el Canal de Isabel II emplea cloraminas para desinfectar el agua en sus ETAP, por lo que el nivel de cloro libre residual en el agua del grifo es cero mientras que el cloro combinado residual oscila entre 1-1,5 mg/l7. Sin embargo, hay que señalar que el agua de la Comunidad de Madrid de la zona norte tiene unas características químicas distintas a la de la zona sur. Basándonos en un estudio realizado a través de diversos análisis químicos de 1995 de la zona norte y de 1999 de la zona sur se puede afirmar que, aunque ambas aguas subterráneas presentan una buena calidad para cualquier uso, presentan diferente composición química8 Tabla 2. Mientras que en la zona norte hay una importante presencia de calizas cretácicas y detríticos terciarios con abundantes niveles de yesos; en la zona sur hay un creciente contenido en sales, produciéndose un aumento en las concentraciones de elementos mayoritarios y en la conductividad. 84 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II Tabla 2 - Configuración química en los sondeos del Canal de Isabel II ZONA NORTE ZONA SUR (Primavera 1995, 37 sondeos) (Otoño 1999, 12 sondeos) CONSTITUYENTES MAYORITARIOS (mg/L) Constituyente Valores RANGOS Valores RANGOS extremos más frecuentes extremos más frecuentes Cl 6-244 0-20 10-46 10-30 SO4 1-713 0-100 13-81 0-100 HCO3 75-242 100-200 197-238 100-200 1-24 0-10 4-29 0-25 Na 2,7-181 0-50 21-81 0-50 Mg 1,5-40 0-10 3-16 0-10 Ca 6-295 0-50 3-64 0-60 K 0,6-3,6 0-2 1-2 0-2 Conductividad 175-1250 200-400 310-519 300-500 SiO2 9,9-69,2 20-60 11,2-37,6 10-40 NO3 CONSTITUYENTES MINORITARIOS DETECTADOS (mg/L) Constituyente Valores RANGOS Valores RANGOS extremos más frecuentes extremos más frecuentes NO2 0,04-0,18 0-0,1 0-0,05 0-0,06 PO43- 0,06-0,13 0,01-0,1 0,08-0,31 0-0,25 F 0,5-4 0-0,7 - - Fe 0,05-0,24 0-0,1 0,032-0,556 0-0,1 Zn 0,05-0,55 0-0,1 0,06-1,54 0-0,1 Cr 0,025-0,049 0-0,049 - - As 0,01-0,058 0-0,05 0,02-0,07 0-0,05 0,0005-0,001 0,0005-0,001 - - Fenoles Conductividad en µS/cm Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 85 Fulgencio C, Briviesca E El Canal de Isabel II En cuanto a la potabilidad del agua captada en los sondeos del Canal de Isabel II, se ha observado que de un total de más de 6.000 determinaciones de los elementos mayoritarios y minoritarios, solo un 1% de éstas sobrepasan los límites de la Reglamentación Técnico-Sanitaria. CONCLUSIONES Ha habido un enorme desarrollo de obras públicas en la Comunidad de Madrid comenzando por los "viajes de agua" y llegando a la construcción del Canal de Isabel II. Esta construcción no solo fue un adelanto en la época como red de abastecimiento sino que también supuso un adelanto en la sociedad. El Canal de Isabel II garantiza la calidad del agua, tanto realizando un estricto control de ésta en diferentes puntos de su captación como por la regulación normativa de sus instalaciones, que hace que se reduzca de manera considerable la probabilidad de una contaminación. Todo esto, junto con las características del relieve madrileño y las precipitaciones hacen que el agua presente unas características químicas y físico-químicas únicas que conforman su excelente calidad. Figura 5 – Canal de Isabel II 86 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Fulgencio C, Briviesca E El Canal de Isabel II Figura 6 – Depósito del Canal de Isabel II BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. Gea Ortigas MI. Los viajes de agua de Madrid. Madrid. La Librería, 2012. Guerra Chavarino E. Los viajes de agua y las fuentes de Madrid. Madrid. La Librería, 2011. Bonet Correa A. Aniversario del Canal de Isabel II. Revista de obras públicas. 2001;3.414:29-44. Martínez Vázquez de Parga R, Gómez MP. Primer depósito elevado de agua de Madrid: cien años haciendo historia. Madrid. Canal de Isabel II, 2010. Alcolea Moratilla MA, Gracía Alvarado JM. El agua en la Comunidad de Madrid. Observatorio Medioambiental. 2006;9:63-96. González Reglero JJ. Los inicios de la preocupación por la calidad de las aguas de abastecimiento y por la depuración de las aguas residuales en el Canal de Isabel II. En: I Congreso de Ingeniería Civil, Territorio y Medio Ambiente. Madrid, Colegio de In- Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 87 Fulgencio C, Briviesca E 7. 8. 88 El Canal de Isabel II genieros de Caminos, Canales y Puertos y Comisión de Medio Ambiente, 2002;I:917942. Ayuntamiento de Madrid. Seguridad alimentaria y control de aguas. El agua del grifo de Madrid. Available at: http://www.madrid.es (Seguridad Alimentaria: El agua de grifo de Madrid) Fernández Uría A, Iglesias Martín JA, López-Camacho B, Ruiz Hernández JM. Caracterización de la calidad de las aguas subterráneas en la zona de influencia del Canal de Isabel II (Madrid). En: Procceding del VII Simposio de Hidrogeología. Madrid, 2001;XXIII:623-634. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 73-88 Contenido en Fe, Cu y Zn en las aguas mineromedicinales españolas Francisco ARMIJO(1), Icíar VÁZQUEZ(1-2), Iluminada CORVILLO(1), Dolors TENAS(1), Montserrat CAPDEVILA(1), Francisco MARAVER(1) (1) Escuela Profesional de Hidrología Médica, Facultad de Medicina, Universidad Complutense de Madrid, Madrid, España (2) Instituto Geológico y Minero de España, Tres Cantos, Madrid, España [email protected] Recibido: 18-03-14 Aceptado: 29-04-14 Resumen El análisis de las aguas mineromedicinales es una de las líneas de trabajo de la Escuela profesional de Hidrología Médica de la Universidad Complutense de Madrid. En este caso se ha realizado el análisis completo, desde el punto de vista de la Hidrología Médica, de 99 manantiales de Balnearios españoles mostrando en este trabajo los resultados del análisis de la concentración de Fe, Cu y Zn en estas aguas. El análisis se ha realizado mediante espectrofotometría de absorción atómica con llama en el caso del hierro y con horno de grafito en el caso del obre y el cinc. Los resultados muestran que 7 de las aguas superan la concentración de 5mg/l de hierro clasificándose como ferruginosas, que ningún agua analizada tiene una concentración de cobre superior a 2 mg/L, concentración máxima admisible en el agua de consumo humano según Real decreto 140/2003 y que ninguna de las aguas supone una aportación significativa de cobre y cinc. Palabras claves: hierro, cobre, cinc, aguas mineromedicinales, oligoelementos esenciales The Fe, Cu and Zn content in Spanish mineral waters Abstract The analysis of the mineral medicinal waters is one of the lines of research of the Professional Medical Hydrology School of the Complutense University of Madrid. On this occasion, from the viewpoint of the Medical Hydrology, the total analysis of 99 spring waters from Spanish spas was performed and this paper show the obtained results of Fe, Cu and Zn concentrations in these waters. The analysis was performed by the atomic absorption spectrometry technique, using the flame in the case of iron and the graphite furnace in the case of copper and zinc. The results show that 7 waters exceed the concentration of 5 mg /L of iron being these waters classified as ferrous waters. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 89 ISSN: 0214-2813 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… None of tested waters has a concentration greater than 2 mg /L of copper, which is the maximum acceptable concentration in drinking water according to the Royal Decree 140/2003 and none of the waters represents a significant contribution of copper and zinc. Key words: iron, copper, zinc, mineral water, essential oligoelements REFERENCIA NORMALIZADA Armijo F, Vázquez I, Corvillo I, Tenas D, Capdevila M, Maraver F. Contenido en Fe, Cu y Zn en las aguas mineromedicinales españolas. Bol Soc Esp Hidrol Med, 2015; 30(1): 89-98 INTRODUCCIÓN Desde hace más de tres décadas la Cátedra de Hidrología Médica de la Facultad de Medicina de la Universidad Complutense de Madrid ha analizado y estudiado aguas de los balnearios españoles, envasadas minerales naturales, de manantial y preparadas, de consumo público y de muchos manantiales de varias comarcas1-2-3-4-56-7 . Los oligoelementos son componentes minoritarios de las aguas y salvo en el caso del hierro, que da lugar a las aguas ferruginosas y que es obligado valorarlo cuando se analizan las aguas mineromedicinales, no se cuantifica su concentración. En este caso, nos ha parecido interesante estudiar también la presencia del cobre y del cinc ya que los tres son considerados elementos esenciales para la vida. Nos dicen los astrofísicos que el Universo está formado por un 73 % de energía obscura, un 23 % de materia obscura, un 3,6 de gas interestelar y solo un 0,4 % es materia formadora de las estrellas, la parte material está compuesta por un 92,714 % de Hidrógeno y un 7,185 % de Helio y solo un 0,101% de otros elementos. Esta composición se explica ya que hidrógeno y helio fueron los elementos formados inicialmente, solo 380000 años después de la Gran Explosión, necesitándose que se generasen y murieran las estrellas para que se formaran otros elementos entre ellos el oxígeno necesario para formar agua8. Nuestra Tierra está formada por un 34,6 % de hierro, un 29,5 de oxígeno, un 15,2 % de silicio un 12,7 de magnesio y un 8 % de otros elementos, más asequible al hombre la Corteza terrestre, incluidos los océanos y la atmosfera, está compuesta principalmente de Oxígeno 49,5 % y Silicio 25,7% y contiene un 6,22 % de hierro, un 0,0076 % de cinc y un 0,0068 % de cobre, los elementos objeto de este trabajo9. El cuerpo humano se compone de un 60,988 % de oxigeno, un 23,125 % de carbono, un 9,893 % de hidrógeno, un 0,012 % de hierro, un 0,0003% de cobre, un 0,003 % de cinc y hasta un 5,977 % de otros elementos, nuestro suero contiene sólo 1,4 ppb de hierro, 1,1 ppb de cinc y 1,04 ppb de cobre10. 90 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… Fe, Cu y Zn como Oligoelementos Monique Simonoff, Director del CNRS en una revista tan afín a nuestra actividad como es la Presse Thermale et Climatique consideraba que hay 15 elementos, esenciales para la vida, entre los que se encuentran el cobre, el hierro y el cinc que juntos representan más del 99% del total de los oligoelementos11. De los 45 elementos identificados en el cuerpo humano los tres elementos citados quedan encuadrados en el grupo de los quince oligoelementos que son esenciales para el hombre y los animales, considerando como tales aquellos que12: Son elementos químicos presentes en el organismo en una proporción inferior al 0,01 % de la masa corporal. Son requeridos para el mantenimiento de la vida, resultando de su ausencia la muerte o una disfunción severa del organismo. Su déficit o depleción resulta en un síndrome carencial. El síndrome carencial desparece al añadir el oligoelemento a la dieta. Se les considera imprescindibles para el correcto funcionamiento del organismo puesto que intervienen en múltiples funciones metabólicas. Todos ellos son potencialmente tóxicos cuando sobrepasan los límites de exposición y rangos de seguridad determinados. De los tres oligoelementos estudiados el hierro y el cobre son elementos conocidos desde la antigüedad y utilizados para la fabricación de objetos tanto como metal más o menos puros, como en aleaciones. El óxido de cinc ya fue citado por Dioscórides en el primer siglo de nuestra era, y fue el alquimista Paracelso el primero en describir el cinc hacia el año 1450 con el nombre de zinckum y en 1746 el químico alemán Andreas Sigismund Marggraff preparó cinc puro y describió cuidadosamente sus propiedades13. Las características de los elementos Fe, Cu y Zn están recogidas en la Tabla 1. Tabla 1 - Características químicas de los elementos Fe, Cu y Zn14 ELEMENTO Hierro Cobre Cinc Número atómico Peso atómico Radio Atómico nm Radio iónico cristal pm Isotopos Naturales Estados de oxidación Configuración electrónica 26 55,847 0,116 76 54, 56, 57, 58 +2, +3 2-8-14-2 29 63,546 0,138 96 63, 65 +1, +2 2-8-18-1 30 65,38 0,131 74 64, 66, 67, 68, 70 +2 2-8-18-2 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 91 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… Estos tres metales se consideran elementos de transición, que la IUPAC define como los que tienen un átomo con la subcapa d incompleta o que puede dar lugar a cationes El hierro como elemento solo se encuentra en estado libre en los meteoritos y, como tal no tiene aplicaciones terapeuticas directas. Las sales ferrosas, como el sulfato ferroso, se utilizan en el tratamiento de anemias ferropénicas, las sales férricas como astringentes, y ciertos óxidos de hierro como pigmentos en cosmética. El cobre elemento puede encontrarse en estado libre en la naturaleza, y no tiene aplicaciones terapeuticas directas. El sulfato cúprico actúa como astringente y emético, también se utiliza para mejorar la acción del hierro, en preparados hematopoyéticos. En otros campos se usa como algicida, fungicida e insecticida. El isotopo artificial 64Cu se utiliza en estudios de metabolismo mineral El cinc no se encuentra en estado libre en la naturaleza. El elemento cinc no tiene aplicaciones terapeuticas directas, el cloruro de cinc se usa como astringente y desensibilizante. El sulfato de cinc es astringente oftálmico y los isotopos artificiales han sido utilizados en estudios de metabolismo mineral. Más del 85% del total de zinc presente en nuestro organismo se deposita en los músculos, huesos, testículos, cabellos, uñas y tejidos pigmentados del ojo. Se elimina principalmente en las heces a través de secreciones biliares, pancreáticas e intestinales15-16. La importancia del cinc como oligoelemento es relativa pues no fue hasta 1963 cuando el doctor Ananda Prasad, encontró en adolescentes y jóvenes con anemia por deficiencia de hierro, con retraso en el crecimiento y en la maduración sexual, que los pacientes respondían favorablemente ante la ingesta de suplementos de zinc. Por sus investigaciones pioneras sobre las acciones de cinc recibió el premio Mahidol de 2010 en el Campo de la Salud Pública17. Veinte años más tarde el doctor Aaron Klug recibió el PremioNobel de Química en el año 1982 por “el desarrollo de la microscopia cristalográfica, para descifrar los complejos proteínicos de los ácidos nucleicos”. Descubrió los llamados dedos de cinc que son pequeñas estructuras de proteínas que funcionan como módulos de interacción que unen el ADN, ARN proteínas y moléculas pequeñas. Consiste en una hélice alfa y una lámina beta antiparalela en la que el ion cinc está coordinado por dos histinas y dos cisteínas18. En la Tabla 2 resumimos las principales funciones de estos oligoelementos, y las consecuencias de su carencia y toxicidad15. Las necesidades diarias de hierro varían según el género y las circunstancias fisiológicas de la persona. La Recommended Dietary Allowances (RDA) es de 8 a 11 mg/día para los hombres, de 8 a 18 mg para las mujeres, llegando a 27 mg/día durante el embarazo, y, 270 μg/día en el recién nacido a término y tres veces más en el prematuro. De igual manera las necesidades diarias de cobre varían según las circunstancias fisiológicas de la persona aunque menos que en el caso del hierro. La RDA es de 92 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… 0,90 mg/día para los hombres y mujeres, que llega a 1g/día durante el embarazo, y hasta 1,3 g/día durante la lactancia, siendo de 200 μg//día en el recién nacido. En el caso del cinc las necesidades diarias también varían con las circunstancias de la persona. La RDA es de 11 mg/día para los hombres y 8 mg/día para las mujeres, con 3 mg/día adicionales durante el embarazo, y 4-6 mg/día adicionales durante la lactancia y, 100 μg/Kg/día en el recién nacido a término19. Tabla 2 - Funciones de los oligoelementos Fe, Cu y Zn ELEMENTO Hierro Cobre Cinc FUNCIONES Transporte O2 Hemoglobina Mioglobina Ceruloplasmina Tejido conectivo Integridad del SNC Síntesis proteínas Metabol. alcohol Insulina DEFICIT Anemia ferropénica Malformaciones fetales Menor resistencia física Anemia hipocrómica Neutropenia leucopenia Desmineralización ósea Retardo crecimiento Riesgo de aborto Ceguera nocturna TOXICIDAD Siderosis Hemocromatosis Cirrosis hepática Anemia hemocítica Gastroenteritis Enf. de Wilson Gastroenteritis Hipocupremia Pro. Inmunologicos La ingesta máxima diaria tolerable sin riesgo de efectos adversos es de 45mg/dia de hierro, de 10 mg/día de cobre y de 40 mg/día de cinc para hombres y mujeres19. Fe, Cu y Zn en las aguas Las aguas que contienen iones ferrosos son incoloras, si son diluidas y verdes, si concentradas. Expuestas al aire, se oxidan para formar sales férricas básicas, que tienen color pardo y son prácticamente insolubles en agua precipitando de forma instantánea a pH superior a 7,5. El ion ferroso se encuentra disuelto en aguas naturales subterráneas, de pH ácido y medio reductor, cuando aparece en cantidades importantes en las aguas su origen principal son las canalizaciones o depósitos. En el caso del cobre en las aguas está en forma inorgánica, iónica o coloidal como Cu+, Cu2+, Cu(OH)+ y Cu(NH3)X2+. Actúa sobre las paredes celulares de las algas impidiendo la llegada de oxígeno. Acción algicida a dosis de 0,1 a 2 mg/l, Cuando aparece en cantidades importantes en las aguas, su origen principal son las canalizaciones o depósitos, ya que es atacado por el agua acción favorecida por el oxígeno, la acidez y la temperatura. El cinc en las aguas está en forma inorgánica, iónica o coloidal como Zn2+, Zn(OH)+ y Zn(Cl3)-. La solubilidad del cinc está controlada en las aguas naturales Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 93 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… por su adsorción en las superficies minerales y por la formación de complejos orgánicos. Cuando aparece en cantidades importantes en las aguas su origen principal son las canalizaciones o depósitos20-21. El Real decreto 140/2003, de 7 de febrero, por el que se establecen los criterios sanitarios de la calidad del agua de consumo humano establece una concentración máxima admisible de 2 mg/l para el Cu y de 200 μg/l para el Fe. El Real Decreto 1798/2010, de 30 de diciembre, por el que se regula la explotación y comercialización de aguas minerales naturales y aguas de manantial envasadas para consumo humano, establece que las aguas minerales naturales tienen como valores paramétricos 1mg/l de Cu, y las de manantial 2 mg/l y ambas 200 μg/l de Fe como parámetro indicador. Real Decreto 1799/2010, de 30 de diciembre, por el que se regula el proceso de elaboración y comercialización de aguas preparadas envasadas para el consumo humano, establece que las aguas tienen como valor paramétricos 2 mg/l para el Cu y 200 μg/l de Fe como parámetro indicador. En ninguno de los decretos citados se hace mención del cinc. La United States Environmental Protection Agency (EPA) ha establecido las Normas Nacionales Secundarias de Agua Potable (National Secondary Drinking Water Standard.NSDWRs) que establecen normas no obligatorias de calidad del agua para 15 contaminantes entre los que se encuentran el Fe, el Cu y el Zn. Estos objetivos se establecen sólo como directrices para ayudar a los sistemas públicos en la gestión de agua potable y, estos contaminantes no se consideran que presenten un riesgo para la salud humana, Para el Fe la concentración máxima indicada es de 0,3 mg/l, para el Cu de 1,0 mg/l y para el Zn 5 mg/l. en este caso basada en consideraciones estéticas puesto que concentraciones superiores pueden causar un sabor amargo y una opalescencia en aguas alcalinas. Esto se debe a que los hidroxilos (OH)- producen un precipitado blanco gelatinoso de hidróxido de cinc. Zn ++ +2 OH- ↔ Zn(OH)2 Como el agua contiene iones OH- todas las soluciones acuosas de cinc deben contener, además del ion hidratado [Zn (H2O) 4]++ un poco de [Zn(OH)4]= según la ecuación [Zn (H2O) 4]+++4OH- ↔ [Zn(OH)4]= + 4 H2O Material Noventa y nueve muestras de aguas mineromedicinales españolas recogidas en su manantial2, en frascos de 2 litros de material polimérico dotados de cierre hermético, y estabilizadas con acido nítrico hasta pH inferior a 2 y conservadas a 4º C. La toma de muestra se realizó por personal de la Cátedra de hidrología médica para lo cual realizo desplazamientos programados a diferentes zonas de España que supusieron un total de 15056 km. Figura 1. 94 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… Figura 1 - Manantiales muestreados22 Método de análisis El análisis general de las aguas se ha realizado según lo indicado en el Vademécum II de aguas mineromedicinales españolas3, para el Cu y Zn se ha utilizado la espectrofotometría de absorción atómica con horno de grafito y para el Fe la misma técnica, pero con llama, con un equipo marca GBC modelo 932 AA con Horno de grafito modelo GF 3000. Los parámetros de trabajo del equipo se muestran en la Tabla 3 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 95 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… Tabla 3 - Parámetros de trabajo del equipo de Absorción atómica 23 Zn Cu Fe Temp. Calcinación Temp. Atomización Concentración Característica* Longitud de onda Rendija Corriente lámpara ºC 400 800 ºC 1800 2300 µg/L 0,01 0,13 50 nm 213,9 324,7 248,3 nm 0,5 0,5 0,2 mA 5 4 7 *Concentración que proporciona una absorbancia de 0,0044 en modo altura de pico y con 20 µL de muestra Resultados Los resultados de las concentraciones de hierro, cobre y cinc en las aguas mineromedicinales analizadas se muestran en la Tabla 4, debemos destacar que los rangos son muy amplios como debe esperarse en una población tan dispersa2-24-25. Tabla 4 - Resultados de los análisis de Fe, Cu y Zn en aguas mineromedicinales Hierro Cobre Cinc Rango <0,1 a 29 mg/l 0,1 a 100,4 μg/l 1 a 409 μg/l Media 1,3 mg/l 18,8 μg/l 81,4 µg/l Desviación estándar 4,3 mg/l 22,9 μg/l 72,9 µg/l Conclusiones De las aguas analizadas, 25 (26,3 %), tienen una concentración de hierro superior a 0,3 mg/L, concentración máxima admisible en el agua potable, según U S EPA. National Secondary Drinking Water Standard. Ningún agua analizada, tiene una concentración de cinc superior a 5 mg/L, concentración máxima admisible en el agua potable, según U S EPA. National Secondary Drinking Water Standard. Ningún agua analizada, tiene una concentración de cobre, superior a 1,0 mg/L, concentración máxima admisible en el agua potable, según U S EPA. National Secondary Drinking Water Standard. 96 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 Armijo F, Vázquez I, Corvillo I et al. Contenido en Fe, Cu y Zn en las aguas… De las aguas analizadas, 29 (30,5%), tienen una concentración de hierro superior a 0,2 mg/L, concentración máxima admisible en el agua de consumo humano según el Real decreto 140/2003. Ningún agua analizada, tiene una concentración de cobre, superior a 2 mg/L, concentración máxima admisible en el agua de consumo humano según el Real decreto 140/2003. Siete de las aguas analizadas pueden clasificarse como ferruginosas al tener más de 5 mg/l de hierro. Suponiendo una ingesta diaria de 1,5 l/día, y considerando solo las aguas analizadas con un residuo seco inferior a 1500 mg/L: Tres de las aguas analizadas proporcionan más de la DRA de hierro. Dos más de las aguas analizadas proporcionan el 50% de la DRA de hierro. Seis más de las aguas analizadas proporcionan el 10% DRA de hierro. Ninguna de las aguas analizadas, supone una aportación significativa de cobre. Ninguna de las aguas analizadas, supone una aportación significativa de cinc BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Armijo F. La Cátedra de Hidrología Médica y los análisis de aguas minerales. Bol Soc Esp Hidrol Méd. 2012;27(1):33-37. Maraver F, Aguilera L, Armijo F, Martín-Megías AI, Meijide R, Soto J. Vademécum de aguas mineromedicinales españolas. Madrid: ISCIII. 2003, 310 pp. Maraver F, Armijo F. Vademécum II de Aguas Mineromedicinales Españolas. Madrid: Complutense. 2010, 365 pp. Armijo F, Corvillo I, Vázquez I, Vitoria I, Maraver F. Nitrates in spanish waters: natura mineral wáter and tap wáter. Balnea.2006;6:220-222. Vitoria I, Maraver F, Ferreira-Pêgo C, Armijo F, Moreno Aznar L, Salas-Salvadó J. The calcium concentration of public drinking waters and bottled mineral waters in Spain and its contribution to satisfying nutritional needs. Nutr Hosp. 2014 Jul;30(1):188-199. Maraver F, Vitoria I, Almerich-Silla JM, Armijo F. Fluoruro en aguas minerales naturales envasadas en España y prevención de la caries dental. Aten Primaria. 2014 Jun 20. pii: S0212-6567(14)00150-4. doi: 10.1016/j.aprim.2014.04.003. San Martin J, Armijo F. Balnearios y manantiales de aguas minerales de la provincia de Teruel. Estudios histórico científicos y proyección social y turística. Teruel (C.S.I.C.). 1986;75:49-94. Turner MS. El origen del universo. Investigación y Ciencia. 2009;398: 18-25. Weast R.C. Handbook of Chemistry and Physics. Cleveland-Ohio: The Chemical Rubber. 1964. Blas L. Agenda del Quimico. Madrid: Aguilar. 1954. Simonov M. Oligo-éléments et thermalisme. Press. Thérm. Clim. 1988;125(4);193196. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 97 Armijo F, Vázquez I, Corvillo I et al. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 98 Contenido en Fe, Cu y Zn en las aguas… Lehninger AL. Bioquímica. Las bases moleculares de la estructura y función celular. Barcelona: Omega. 1972. Tríifonv DN, Tríifonv VD. Como fueron descubiertos los Elementos Químicos. Moscú: MIR. 1984. Hoover JE. (editor). Remingtons´s Pharmaceutical Sciences. Pennsylvania: Mack Publishing Company. 1970. Elizalde I, Zubia AR, Arribas MM, San Martín J. Resumen sinóptico de los oligoelementos esenciales en humanos. Legislación y recomendaciones dietéticas. Bol Soc Esp Hidrol Med. 2001;16(3):127-134. Vernetta C, Galmes JL, Sendrós S. El zinc en terapéutica. Drugs of today. 1988;24 (supl. 6):1-20. Prasad AS, Miale A, Farid Z, Sandstead HH, Schulert A. Zinc metabolism in patients with the syndrome of iron deficiency anemia, hepatosplenomegaly, dwarfism, and hypogonadism. J Lab Clin Med. 1963;61:537-549. Rhodes D, Klug A. Dedos de cinc. Investigación y ciencia. 1993;199:26-33. Trace elements in human nutrition and health. Geneva: WHO. 1996. Catalán Lafuente J. Madrid: Química del agua. 1981. Curtman LJ. Análisis Químico Cuantitativo. Barcelona: Marin. 1959. Maraver F. Maps. En: Maraver F, Aguilera L, Armijo F, et al. Vademecum of spanish mineral-medicinal waters. Madrid: ISCIII; 2003. p. 277-87. Chapple G. Athanasopoulos N. System 2000/3000 Graphite Furnace. DandenongAustralia: GBC Scientific Equipment. 1991. Tenas D. Estudio analítico del cobre en las aguas mineromedicinales españolas [DEA]. Madrid: Universidad Complutense, 2003. Capdevila M. El Zinc en las Aguas Minero-Medicinales [DEA]. Madrid: Universidad Complutense, 2003. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 89-98 LEGISLACIÓN Hidrología Médica y Legislación Juan Carlos SAN JOSÉ RODRÍGUEZ(1) (1) Presidente de la Sociedad Española de Hidrología Médica [email protected] Nueva agua mineromedicinal Anuncio sobre clasificación como “Minero Medicinal y Termal para uso por vía tópica”, el agua del sondeo denominado “Aguas de Dios”, ubicado en el término municipal de Alhama de Murcia (Murcia). BORM 27-1-2014. Se ha declarado el agua del sondeo denominado “Aguas de Dios”, ubicado en el término municipal de Alhama de Murcia (Murcia) como “Minero medicinal y termal para uso por vía tópica”. Asistencia sanitaria transfronteriza Real Decreto 81/2014, de 7 de febrero, por el que se establecen normas para garantizar la asistencia sanitaria transfronteriza, y por el que se modifica el Real Decreto 1718/2010, de 17 de diciembre, sobre receta médica y órdenes de dispensación. BOE 8-2-2014 Corrección de errores del Real Decreto 81/2014, de 7 de febrero, por el que se establecen normas para garantizar la asistencia sanitaria transfronteriza, y por el que se modifica el Real Decreto 1718/2010, de 17 de diciembre, sobre receta médica y órdenes de dispensación. BOE 17-4-2014 La entrada en vigor en España de la directiva europea sobre asistencia sanitaria transfronteriza va a facilitar a los nacionales de otros países de la Unión Europea la prestación de curas balnearias en España a cargo de los sistemas públicos de salud de los respectivos países donde la cura termal esté reconocida como prestación del sistema público. Sin embargo los españoles seguiremos sin tener derecho a las curas termales a cargo de la sanidad pública ni en España ni en el resto de la Unión Europea. El siguiente Real Decreto establece las normas al respecto. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 101-105 101 ISSN: 0214-2813 San José JC Hidrología Médica y Legislación Corrección de errores del "decreto de piscinas" Corrección de errores del Real Decreto 742/2013, de 27 de septiembre, por el que se establecen los criterios técnico-sanitarios de las piscinas. BOE 27-6-2014. Una nueva disposición establece la concentración máxima de CO2 en el aire del recinto de los vasos de las piscinas cubiertas en 500 ppm, corrigiendo el valor establecido en el Real Decreto 742/2013, de 27 de septiembre, por el que se establecen los criterios técnico-sanitarios de las piscinas. No se convocarán plazas MIR de Hidrología Médica a partir de 2015 -2016 Real Decreto 639/2014, de 25 de julio, por el que se regula la troncalidad, la reespecialización troncal y las áreas de capacitación específica, se establecen las normas aplicables a las pruebas anuales de acceso a plazas de formación y otros aspectos del sistema de formación sanitaria especializada en Ciencias de la Salud y se crean y modifican determinados títulos de especialista. BOE 06-08-2014. El conocido como "decreto de la troncalidad*" establece que no se convocarán plazas MIR de Hidrología Médica a partir de la convocatoria 2015 -2016. Por ahora la Administración no quiere financiar una especialidad que no es una prestación del Sistema Público de Salud. En palabras del Director General de Ordenación Profesional del Ministerio "la Hidrología Médica volverá a estar incluida en el listado de especialidades si aparece una alternativa viable." En la Junta Directiva, en colaboración con la Escuela Profesional de Hidrología Médica e Hidroterapia y con la Comisión Nacional de Hidrología Médica, seguimos trabajando en para que la Hidrología Médica vuelva a estar en el listado. Registro estatal de profesionales sanitarios Real Decreto 640/2014, de 25 de julio, por el que se regula el Registro Estatal de Profesionales Sanitarios. BOE 14-08-2014. Con la intención de facilitar la adecuada planificación de los recursos humanos sanitarios de todo el Estado y la coordinación de las políticas sanitarias en materia de recursos humanos en el Sistema Nacional de Salud se ha creado el Registro Estatal de Profesionales Sanitarios. 102 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 101-105 San José JC Hidrología Médica y Legislación Los profesionales a quienes se refiere esta normativa son los titulados universitarios en la rama de ciencias de la salud y los profesionales del área sanitaria de formación profesional. Están obligados a comunicar al registro los datos de los profesionales sanitarios que prestan sus servicios, entre otros, los centros sanitarios privados inscritos en el Registro general de centros, servicios y establecimientos sanitarios. La obligación de remitir estos datos recae sobre los organismos, entidades y corporaciones obligados, y no sobre el profesional sanitario. Además de la filiación y titulaciones, se incorporarán al registro datos como la la cobertura de responsabilidad civil o la suspensión o inhabilitación para el ejercicio profesional si la hubiere. De todos los datos tendrán carácter público los siguientes: nombre y apellidos, titulación, especialidad, lugar de ejercicio, categoría y función del profesional, Diploma de Área de Capacitación Específica y Diplomas de Acreditación y Acreditación Avanzada, si los hubiere, y las fechas de obtención y revalidación de cada uno de ellos. Registro de aguas minerales naturales y de manantial Real Decreto 682/2014, de 1 de agosto, por el que se modifica el Real Decreto 191/2011, de 18 de febrero, sobre registro general sanitario de empresas alimentarias y alimentos, y otros cuatro reglamentos sobre esta materia. BOE 27-08-2014. Se ha suprimido la exigencia de inscripción en el Registro General Sanitario de Empresas Alimentarias y Alimentos de las aguas minerales naturales y aguas de manantial. A efectos de mantener actualizada la lista de aguas minerales naturales reconocidas en España que debe comunicarse a la Comisión Europea para su publicación en el Diario Oficial de la Unión Europea, las autoridades sanitarias competentes de las comunidades autónomas notificarán a la Agencia Española de Consumo, Seguridad Alimentaria y Nutrición los casos en los que se haya procedido a otorgar o retirar el reconocimiento de aguas minerales naturales, así como cualquier modificación que afecte a las aguas incluidas en dicha lista. La Agencia Española de Consumo, Seguridad Alimentaria y Nutrición publicará esta lista en su página web. Plazas de Hidrología Médica en el MIR 2014-2015 Orden SSI/1674/2014, de 10 de septiembre, por la que se aprueba la oferta de plazas y la convocatoria de pruebas selectivas 2014 para el acceso en el año 2015, a plazas de formación sanitaria especializada para Médicos, Farmacéuticos, Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 101-105 103 San José JC Hidrología Médica y Legislación Enfermeros y otros graduados/licenciados universitarios del ámbito de la Psicología, la Química, la Biología y la Física. BOE 17-09-2014. Se ha convocado el MIR 2014-2015. Hay 10 plazas de formación médica especializada en Hidrología Médica de las 123 plazas para especialidades médicas, en las que la formación se recibirá como alumno de las Escuelas Profesionales de Especialización Médica. El periodo formativo es de 2 años y se llevará a cabo en la Escuela Profesional de Hidrología Médica e Hidroterapia de la Universidad Complutense de Madrid. El régimen jurídico de esta especialidad es el de alumnado por lo que los adjudicatarios de la misma, deberán abonar el importe de la matrícula. Plazo de presentación de solicitudes: Del día 24 de septiembre al 3 de octubre de 2014. Requisitos: Ser graduado o licenciado en Medicina o licenciado en Medicina y Cirugía. Cuando se trate de títulos extranjeros, deberá acreditarse su reconocimiento u homologación expedida por el Ministerio competente. Ser español o nacional de un Estado miembro de la Unión Europea, de otro Estado parte en el Acuerdo sobre el Espacio Económico Europeo, de la Confederación Suiza, o de Andorra, o ser cónyuge o descendiente directo menor de 21 años de las anteriores nacionalidades, o ser extranjero de otros países con convenio de cooperación cultural con España. Los ciudadanos extranjeros que participen en estas pruebas deberán tener en vigor o en situación de renovación la correspondiente situación que acredite su estancia legal en España. La oferta a nacionales de países extracomunitarios que no sean titulares de una autorización para residir en España, será del 4% del total). Los aspirantes de estados cuya lengua oficial no sea el castellano, solo serán admitidos a las presentes pruebas si acreditan un conocimiento suficiente del mismo. La prueba selectiva consistirá en la realización de un ejercicio de 225 preguntas de elección múltiple más diez de reserva. La puntuación total individual que se reconozca a cada participante en las pruebas, estará constituida por la suma de la que obtenga en el ejercicio de contestaciones múltiples que rinda y de la asignada, en su caso, a los méritos académicos, que se hayan acreditado en tiempo y forma. Modificaciones normativas en aguas minerales en las Illes Balears Ley 10/2014, de 1 de octubre, de ordenación minera de las Illes Balears. BOE 3110-2014. 104 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 101-105 San José JC Hidrología Médica y Legislación La Ley 10/2014, de 1 de octubre, de ordenación minera de las Illes Balears ha modificado algunas de las normas sobre aguas minerales y termales en esa autonomía. Entre ellas los requisitos para las modificaciones y ampliaciones de autorizaciones de aguas minerales y termales; y aspectos del perímetro de protección cuando se trate de aprovechamiento de recursos geotérmicos de baja entalpía. Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 101-105 105 RESEÑAS Hernández Torres A (coordinador). Peloterapia: Aplicaciones médicas y cosméticas de fangos termales. Madrid: Fundación Bílbilis. 2014, 319 pp. ISBN 978-84-616-8551-6 Como señala el propio doctor Antonio Hernández Torres al comienzo del libro el deseo manifiesto del mismo es “aportar conocimientos en la difusion de las técnicas y técnologías peloterápicas para beneficio de la salud y el bienestar poblacional”, así “en este informe quedan reflejadas las técnicas y tecnologías médicas que se utilizan en peloterapia, describiendo detalladamente sus indicaciones y aplicaciones según las afecciones de los diferentes sistemas y aparatos”, destacando tambien, que “su implantación podría producir un importante ahorro farmacéutico en el gasto sanitario, consiguiendo igual o mejor eficacia y efectividad que otros productos de la farmacopea, al combinar terapias físicas y farmacológicas. El estudio coste/efec-tividad de la técnica peloterápica es muy superior al obtenido con otros productos antiinflamartorios y analgésicos” La obra muy completa, viene a llenar un vacío con notable acierto. Es la primera de estas características en lengua española, y se organiza en veinticuatro capítulos que se ocupan de los aspectos más singulares de ésta técnica eminentemente termoterápica (conceptos, evidencia científica, antecedentes, componentes mineralógicos, propiedades físico-químicas, control de calidad, mecanismos de acción, aplicaciones clínicas y cosméticas, formas de aplicación, legislación…). Prologada por la Profesora Inés Martínez Galán, presidenta de la Comisión Nacional de la Especialidad de Hidrología Médica, el coordinador ha contado con un equipo de cuarenta y cuatro autores, profesionales todos de reconocido prestigio en el ámbito latinoamericano de la peloterapia, vinculados a siete Universidades y diferentes organismos asistenciales y de investigación. En definitiva, libro de referencia, tanto para alumnos y profesores, como para profesionales que quieran aproximarse y profundizar en el mundo de la Peloterapia. Francisco Maraver Eyzaguirre Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 109-110 ISSN: 0214-2813 Reseñas Gomez de Bedoya y Paredes P. Historia Universal de las fuentes minerales de España. Tomo Segundo qué comprende las letras C. D. E. y F. Santiago; Imp. Ignacio Aguayo. 1765: 383 pp. Editores de la presente edición: Legido Soto JL, Riágidos García MM. Santisago de Compostela; Tórculo Comunicación Gráficas SA. 2014 José Luis Legido y Mª Mercedes Riádigosa reeditan el Segundo tomo de la obra del doctor Pedro Gomez de Bedoya y Paredes, Historia Universal de las fuentes minerales de España, que imprimió inicialmente Ignacio Aguayo en el año 1765. Con este tomo culminan el trabajo de poner en manos de hidrólogos y coleccionistas una nueva y cuidada edición de una de las más importantes obras de la Hidrología Médica española, cuyo autor, desgraciadamente, solo pudo poner en la calle estos dos primeros tomos de los seis que pensaba publicar. Este Segundo tomo incluye los artículos dedicados a los manantiales cuyos nombres comienzan por las letras C, D, E y F, así como una dedicatoria al padre Manuel Benito Muro, abad del Real monasterio de San Martín de Santiago, unas advertencies precisas al que leyere, y una introduction a la Academia Septima. En las advertencies el autor se queja de la demora que causan a la publicación de su obra la obtención de las debidas aprobaciones, pues si hubieran sido más diligentes ya tendría impreso en aquellas fechas el tercer tomo. En las 381 páginas que dedica esta edición a los manantiales se recogen datos históricos, arqueologicos, médicos y analíticos de manantiales que todavía siguen proporcionando sus aguas a importantes establecimientos balnearios y de otros muchos de los que solo queda el recuerdo. El libro está prologado por Maria Lourdes Mourelle Mosqueira, que acertadamente sugiere la búsqueda del material que recogió el autor cuando preparaba su obra y que sería un verdadero regalo para la Hidrologia Médica. En definitiva, un libro de colección, imprescindible para los que gustamos de reunir los antecedents de la Hidrología médica española que, doscientos cincuenta años después de ver la primera luz, han reeditado personas amantes del conocimiento del agua, la sustancia que más estudia todavía la humanidad. Francisco Armijo Castro 110 Bol Soc Esp Hidrol Méd 2015, Vol. 30, Núm. 1, 109-110 Boletín Sociedad Española Hidrología Médica A los autores El Boletín de la Sociedad Española de Hidrología Médica (BSEHM) es una revista científica, dedicada a la medicina termal, balneología, crenobalneoterapia, cura balnearia, talasoterapia, hidroterapia, terapia acuática, peloterapia, hidrología y climatología médica; así como las ciencias auxiliares dedicadas a su conocimiento. Incluye todas las actividades médicas originadas y desarrolladas en Estaciones Termales que basadas en la evidencia científica tienen por objeto promover la salud, prevención, tratamiento y rehabilitación. También el estudio de las sustancias utilizadas por la medicina termal: las aguas (agua mineromedicinal, agua mineral natural, agua marina, agua de consumo humano), peloides, y gases naturales. BSEHM es la publicación oficial de la Sociedad Española de Hidrología Médica (SEHM). Publica artículos preferentemente en español o inglés. Incluye, de forma regular, artículos sobre investigación clínica o básica, revisiones, editoriales y cartas al editor Todas las contribuciones originales y revisiones serán evaluadas antes de ser aceptadas por revisores expertos designados por los Editores. El envío de un artículo al BSEHM implica que es original y que no ha sido previamente publicado ni está siendo evaluado para su publicación en otra revista. RESPONSABILIDADES ÉTICAS Los autores firmantes de los artículos aceptan la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (en www.icmje.org). Los trabajos que se envían al BSEHM y para su evaluación deben haberse elaborado respetando las recomendaciones internacionales sobre investigación clínica (Declaración de Helsinki de la Asociación Médica Mundial revisada recientemente [www.wma.net/e/policy]) y con animales de laboratorio (Sociedad Americana de Fisiología). Consentimiento informado Si se reproducen fotografías o datos de pacientes, éstos no deben permitir identificar al sujeto. En todos los casos, los autores deben haber obtenido el consenti- Bol Soc Esp Hidrol Méd ISSN: 0214-2813 A los autores miento informado escrito del paciente que autorice su publicación, reproducción y divulgación en soporte papel y en Internet en el BSEHM. Conflictos de intereses Los autores deben indicar cualquier relación financiera que pudiera dar lugar a un conflicto de intereses en relación con el artículo publicado. Incluso si los autores consideran que no los hay, deberán indicarlo Protección de datos Los datos de carácter personal que se solicitan van a ser tratados en un fichero automatizado del que es titular la SEHM con la finalidad de gestionar la publicación del artículo redactado por el autor/es en el BSEHM. Salvo que indique lo contrario, al enviar el artículo el autor, autoriza expresamente que sus datos relativos a nombre, apellidos, dirección profesional y correo electrónico sean publicados en el BSEHM, con la finalidad de que se conozca la autoría del artículo y de que los lectores se puedan comunicar con Vd. INSTRUCCIONES PARA LOS AUTORES Todos los manuscritos se adecuarán a las normas de publicación. Se entiende que el autor de correspondencia de la publicación se responsabiliza de la normativa y que el resto de los autores conocen, participan y están de acuerdo con el contenido del manuscrito. 1. Artículos originales Presentación del documento: A doble espacio, con márgenes de 2,5 cm y páginas numeradas. Tiene una extensión máxima de 5.000 palabras, contando desde la página frontal hasta el final y excluyendo únicamente las tablas. Consta de dos documentos: primera página y manuscrito El manuscrito sigue el siguiente orden: a) resumen estructurado y palabras clave; b) cuadro de abreviaturas; c) texto; d) bibliografía; e) pies de figuras; f) tablas (opcional), y g) figuras (opcional). Primera página Título completo (menos de 150 caracteres). Nombre y apellido de los autores en este orden: primer nombre, inicial del segundo nombre si lo hubiere, seguido del primer apellido. Se podrá incluir el segundo apellido separado con un guión. Bol Soc Esp Hidrol Méd A los autores Centro de procedencia (departamento, institución, ciudad y país) y fuente de financiación, en su caso. Dirección postal completa del autor a quien debe dirigirse la correspondencia, teléfono, fax y dirección electrónica. Se especifica el número total de palabras del manuscrito (excluyendo únicamente las tablas). Resumen estructurado El resumen, con una extensión máxima de 250 palabras, está estructurado en cuatro apartados: a) Introducción y objetivos; b) Métodos; c) Resultados, y d) Conclusiones. Es comprensible por sí mismo y no contiene citas bibliográficas ni abreviaturas (excepto las correspondientes a unidades de medida). Incluye al final entre 3 y 10 palabras clave. Que han sido seleccionadas preferentemente a partir del Medical Subject Headings (MeSH) de la National Library of Medicine. Disponible en: www.nlm.nih.gov/mesh/meshhome.html Texto Consta de los siguientes apartados: a) Introducción; b) Métodos; c) Resultados; d) Discusión, y e) Conclusiones, cada uno de ellos adecuadamente encabezado. Utilice subapartados adecuadamente subtitulados para organizar cada uno de los apartados. Se han utilizado abreviaturas, que han sido convenientemente explicadas. Asimismo, se indicarán la primera vez que aparezcan en el texto del artículo. Los agradecimientos figuran al final del texto. Bibliografía Las referencias bibliográficas se citan en secuencia numérica, en formato superíndice, de acuerdo con su orden de aparición en el texto. No se incluyen, entre las citas bibliográficas, comunicaciones personales, manuscritos o cualquier dato no publicado. Para la referencia a revistas médicas se utilizan las mismas abreviaturas que aparecen en el Index Medicus: List of Journals Indexed, tal y como se publican en el número de enero de cada año. Disponible en: www.ncbi.nlm.nih.gov/entrez/citmatch_help.html#JournaLists La bibliografía se remitirá como texto estándar, nunca como notas al pie. Se incluirán 40 referencias bibliográficas como máximo Ejemplos de citación Revista médica. Lista de todos los autores. Si el número de autores es superior a seis, se incluirán los seis primeros, añadiendo la partícula latina et al. Ejemplo: Forestier R, Desfour H, Tessier JM, Françon A, Foote AM, Genty C, et al. Spa therapy in the treatment of knee osteoarthritis: a large randomised multicentre trial. Ann Rheum Dis. 2010;69(4):660-5. Bol Soc Esp Hidrol Méd A los autores Libros y otras monografías Autor(es) personal(es). Ejemplo: Bruce BE, Cole AJ. Comprehensive aquatic therapy. 3rd ed. Washington: Washington State University Publishing; 2011. 558 pp. Capítulo de un libro. Ejemplo: Hattori I. Pelotherapy. In: Licht S, (Ed.). Medical Hydrology. Baltimore: Waverly Press; 1963: 273–90. Material electrónico. Artículo de revista en formato electrónico. Ejemplo: EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA). Scientific Opinion on Dietary reference values for water. EFSA Journal 2010; 8(3):1459. [48 pp.]. (accessed 12/04/2013). Available at: http://www.efsa.europa.eu/en/efsajournal/doc/1459.pdf Figuras Las figuras correspondientes a gráficos y dibujos se envían en formato TIFF o JPEG preferentemente, con una resolución no inferior a 300 dpi y utilizando el color negro para líneas y texto. Están ordenadas con números arábigos de acuerdo con su orden de aparición en el texto. Las gráficas, símbolos, letras, etc., son de tamaño suficiente para poderse identificar claramente al ser reducidas. Los detalles especiales se señalan con flechas, utilizando para estos y para cualquier otro tipo de símbolos el trazado de máximo contraste respecto a la figura. Los pies de figuras se incluyen en hoja aparte. Al final se identifican las abreviaturas empleadas, por orden alfabético. Las figuras no incluyen datos que permitan conocer la procedencia del trabajo o la identidad del paciente. Las fotografías de personas deben realizarse de manera que no sean identificables o se adjuntará el consentimiento de su uso por parte de la persona fotografiada. Tablas Se numeran con números arábigos de acuerdo con su orden de aparición en el texto. Cada tabla se escribirá a doble espacio en una hoja aparte. Incluyen un título en su parte superior y en la parte inferior se describen las abreviaturas empleadas por orden alfabético. El contenido se explica por sí mismo y los datos que incluyen no figuran en el texto ni en las figuras. 2. Revisiones Trabajo de revisión, preferiblemente sistemática, sobre temas relevantes y de actualidad para la medicina termal Bol Soc Esp Hidrol Méd A los autores A doble espacio, con márgenes de 2,5 cm. El título, los autores, centro de procedencia y dirección Extensión entre 3.000 y 9.000 palabras (10-15 páginas). Debe ir precedida de un resumen/abstract no estructurados con un máximo de 150 palabras. En la introducción se evitará una excesiva profundización histórica, insistiendo sin embargo en la problemática reciente. Se recomiendan subapartados para facilitar la lectura. En caso necesario puede acompañarse de tablas, figuras o esquemas personales adaptados a la normativa general de la revista. La bibliografía seguirá la norma general de la publicación. Se incluirán 55 referencias bibliográficas como máximo 3. Cartas al Editor Debe remitirse a este apartado la correspondencia sobre temas editoriales o relacionadas con artículos publicados en la Revista. Solo se admitirá para valoración las cartas recibidas en las 8 semanas posteriores a la publicación del artículo de referencia y que no incluyan datos originales. A doble espacio, con márgenes de 2,5 cm. El título, los autores (máximo cuatro), centro de procedencia, dirección y figura o tabla se especifican de acuerdo con las normas ya descritas para los artículos originales. Tiene una extensión máxima de 800 palabras. Contiene un máximo de una figura o una tabla. Se incluirán 10 referencias bibliográficas como máximo Bol Soc Esp Hidrol Méd
© Copyright 2026