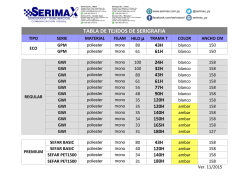
POTENCIALES NORMALES DE REDUCCIÓN Electrodo Reacción
POTENCIALES NORMALES DE REDUCCIÓN Electrodo – F /F2 Co3+/ Co2+ Pb4+/Pb2+ Au+/Au MnO4– /Mn2+ Au3+/Au Cl– /Cl2 Cr2O72–/ Cr3+ Tl3+/Tl+ H+/O2 Br–/Br2 Hg2+/Hg22+ Hg2+/Hg Ag+/Ag Hg22+/Hg Fe3+/Fe2+ I–/I2 Cu+/Cu OH–/O2 Cu2+/Cu Cu2+/Cu+ Sn4+/Sn2+ H+/H2 Fe3+/Fe Pb2+/Pb Sn2+/Sn Ni2+/Ni Co2+/Co Tl+/Tl Cd2+/Cd Cr3+/Cr2+ Fe2+/Fe S2–/S Zn2+/Zn OH–/H2 Mn2+/Mn Al3+/Al Mg2+/Mg Na+/Na Ca2+/Ca K+/K Li+/Li Reacción de reducción – F2 + 2e → 2F– Co3+ + e– → Co2+ Pb4+ + 2e– → Pb2+ Au+ + e– → Au MnO4– +8H+ + 5e– → Mn2+ + 4H2O Au3+ + 3e– → Au Cl2 + 2e– → 2Cl– Cr2O72– + 14 H+ + 6e– → 2Cr3+ + 7H2O Tl3+ + 2e– → Tl+ O2 + 4H+ + 4e– → 2H2O Br2 + 2e– →2Br– 2Hg2+ + 2e– → Hg22+ Hg2+ + 2e– → Hg Ag+ + e– → Ag Hg22+ + 2e–→ 2Hg Fe3+ + e– → Fe2+ I2 + 2e– → 2I– Cu+ + e– → Cu O2 + 2H2O + 4e– → 4OH– Cu2+ + 2e– → Cu Cu2+ + e– → Cu+ Sn4+ + 2e–→ Sn2+ 2H+ + 2e– → H2 Fe3+ + 3e– → Fe Pb2+ + 2e– → Pb Sn2+ + 2e– → Sn Ni2+ + 2e– → Ni Co2+ + 2e– → Co Tl+ + e– → Tl Cd2+ + 2e– → Cd Cr3+ + e– → Cr2+ Fe2+ + 2e– → Fe S + 2e– → S2– Zn2+ + 2e– → Zn 2H20 + 2e– → H2 + 2OH– Mn2+ + 2e– → Mn Al3+ + 3e– → Al Mg2+ + 2e– → Mg Na+ + e– → Na Ca2+ + 2e– → Ca K+ + e– → K Li + e– → Li Є0 (Voltios) +2,865 +1,808 +1,693 +1,691 +1,507 +1,497 +1,359 +1,333 +1,252 +1,229 +1,066 +0,919 +0,854 +0,799 +0,788 +0,770 +0,535 +0,520 +0,401 +0,336 +0,153 +0,150 0,000 -0,037 -0,126 -0,136 -0,250 -0,277 -0,336 -0,403 -0,408 -0,44 -0,479 -0,763 -0,828 -1,179 -1,662 -2,363 -2,714 -2,866 -2,925 -3,045
© Copyright 2026