Diseño de un Sistema Inteligente para la detección de
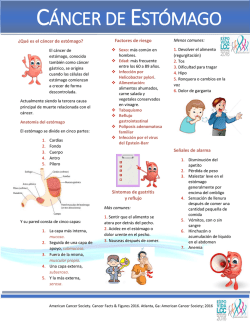
15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO Diseño de un Sistema Inteligente para la detección de Adenocarcinoma Gástrico J.L. Alcaide Juárez 1, M. Patiño Ortiz 2, J. Patiño Ortiz 3 (SIDAGET) by image processing, which yielded results that there are variations as to analyze the blue and green color image highs and lows, same values that are used to diagnose, considering that the value of the green color is the one who decides what kind of situation are: serious injury, slight injury or medium injury, these values range from 0 to 85, being that between the lower the value the injury is serious while if the higher mild or no. Resumen— Actualmente se considera al cáncer como el mayor problema de salud a nivel mundial. Uno de los canceres causantes de más de medio millón de muertes por año y considerado como el segundo lugar de mortalidad es el de estómago o adenocarcinoma gástrico. La incidencia que se tiene entre los diferentes países se debe principalmente a la invasión de la bacteria: Helicobacter pylori y a la alimentación de cada uno de ellos. Actualmente existen 6 métodos para su detección mediante procesamiento de imágenes: Radiografía seriada del tracto gastrointestinal superior, Ecografía endoscópica, Tomografía computarizada (CT), Biopsia con aguja guiada por CT, Tomografía por emisión de positrones (PET) y Laparoscopia. El objetivo de este artículo es dar a conocer el desarrollo del Sistema Inteligente para el Diagnóstico de Adenocarcinoma Gástrico en Etapa Temprana (SIDAGET) mediante procesamiento de imágenes, el cual arrojó como resultados que existen variaciones al analizar el color azul y el color verde de la imagen en sus valores máximos y mínimos, mismos que se usan para poder diagnosticar, tomando en cuenta que el valor del color verde es el que decide en qué tipo de situación se encuentra: lesión grave, lesión mediana o lesión leve, estos valores van desde el 0 hasta 85, siendo que entre más bajo es el valor, la lesión es grave, mientras que si es más alto será leve o nula. Keywords— diagnosis, imaging, early mortality. E I. INTRODUCCIÓN l adenocarcinoma gástrico o cáncer de estómago es considerado como una enfermedad neoplásica de gran frecuencia en el mundo, arrojando cifras de más de medio millón de muertes por año, ver Figura 1 [1]. Se tienen reportes de que en los hombres se registra el doble de número de casos y en su mayoría se presenta en personas de más de 55 años [2]. Entre la gran variedad que existen de canceres este ocupa el lugar número cuatro en incidencia y el segundo en mortalidad de todo el mundo [3]. Palabras Clave— Diagnóstico, procesamiento de imágenes, mortalidad. Abstract— Currently cancer is considered as a major health problem worldwide. One of the causes cancers of over half a million deaths per year and considered the second death is the stomach or gastric adenocarcinoma. The incidence which is between countries is mainly due to the invasion of the bacterium Helicobacter pylori and to feed each. Currently there are 6 methods of detection by image processing: serial radiography of the upper gastrointestinal tract, endoscopic ultrasound, computed tomography (CT) guided needle biopsy CT, positron emission tomography (PET) and laparoscopy. The aim of this article is to present the development of the Intelligent System for the Diagnosis of Early Stage Gastric Adenocarcinoma Figura 1 Cifras de cáncer en el mundo (CRUK, 2014). Juan Luis Alcaide Juárez estudiante de Doctorado en Ingeniería de Sistemas ESIME – Zacatenco, Instituto Politécnico Nacional, Distrito Federal, México (e-mail: [email protected]). Dr. Miguel Patiño Ortiz, SEPI ESIME Zac, IPN. [email protected] Dr. Julián Patiño Ortiz, SEPI ESIME Zac. IPN, [email protected] México D.F., 19 al 23 de octubre 2015 1 15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO gastritis crónica (inflamación de las paredes del estómago); originando ulceras de duodeno y de estómago como consecuencia de que la inflamación permite que el ácido del estómago penetre en la zona donde se protegen las paredes del mismo, ver Figura 2 [2]. La gran variabilidad de tasas de incidencia mundial y mortalidad se deben fundamentalmente a los distintos patrones de alimentación y a la prevalencia de infección por la bacteria denominada: Helicobacter pylori [4]. Por ello en la Unión Europea es el quinto cáncer por incidencia y el cuarto por mortalidad, con estimación de tasas de incidencia en 2008 de 18, 2 casos nuevos en hombres y 8,1 en mujeres anuales por cada 100 000 personas respectivamente [5]. Existen pruebas de detección rutinarias para diagnosticar, entre las cuales tenemos el Estudios por imágenes, el cual se basa en 6 métodos: Radiografía seriada del tracto gastrointestinal superior: Estudio no comúnmente usado podría no detectar áreas anormales, lo cual no permite a los médicos tomar muestras de biopsia. [7]. Ecografía endoscopia: Procedimiento utilizado para saber hasta qué zonas se propago el cáncer: pared del estómago, tejidos circundantes y ganglios linfáticos cercanos [7]. Figura 2 Ciclo de vida Adenocarcinoma Gástrico (Elaboración propia, 2015). Tomografía computarizada (CT): Estudio que se basa en radiografías que generan imágenes transversales a detalle del cuerpo [7]. Diagnóstico El cáncer de estómago en su etapa inicial en la minoría de las veces da a notar síntomas, por ello es una tarea difícil detectarlo en etapa temprana. Solo aproximadamente uno de cinco diagnósticos en los Estados Unidos se encuentra en etapa temprana, es decir, antes de su propagación a diversas áreas del cuerpo [7]. Biopsia con aguja guiada por CT: Se usan las tomografías por computadora (CT) para dirigir la aguja de una biopsia hacia el área en donde se sospecha que existe la propagación de cáncer [7] . Tomografía por emisión de positrones (PET): Este método se utiliza cuando el medico tiene la sospecha de que el cáncer se haya propagado, pero desconoce hacia donde [7]. En algunos casos en la etapa inicial el paciente puede sentir algunos síntomas: indigestión, malestar estomacal, sensación de llenura antes de comer, nauseas, pérdida de apetito y acidez; en avanzadas: sangrado en materia fecal, vomito, pérdida de peso y dolor abdominal [8]. Laparoscopia: Método que se utiliza solo si ya se ha encontrado el cáncer de estómago [7]. II. DESARROLLO Y/O CAMPO TEÓRICO Materiales y Métodos ¿Qué está detrás del cáncer de estómago? De acuerdo a los métodos de diagnóstico analizados se deduce que se tienen que crear y proponer formas no invasivas para el diagnóstico exacto, seguro y eficiente de adenocarcinoma gástrico. Hoy en día se sabe que existe una bacteria llamada: Helicobacter pylori (H. pylori) y que esta misma habita en la mucosa del estómago y el duodeno, por ende se asocia al cáncer de estómago, tiene forma de espiral y más del 80% de las personas infectadas no presenta síntomas [1]. En la Figura 3 se describe de manera gráfica la arquitectura del Sistema Inteligente para el Diagnóstico de Adenocarcinoma Gástrico en Etapa Temprana (SIDAGET). En ella se observa como el sistema tiene como punto inicial el conocimiento del experto que es depositado en una Base de Datos del Conocimiento que contiene símbolos, es decir, cadenas de caracteres con formas, contenidos y propiedades específicas: discreto, representativo y arbitrario [9], se Se adquiere a una edad temprana y el contagio entre individuos se cree que es a través de la saliva o la contaminación fecal [5]. La colonización del estómago de la bacteria se lleva a cabo cuando empieza a perforar en la mucosa, provoca entonces México D.F., 19 al 23 de octubre 2015 2 15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO considera entonces esta base como la parte principal que alimenta al sistema experto en donde se tiene la experiencia del especialista y del cual se obtienen resultados aproximados a la realidad[10]; por tanto une la ciencia y la ingeniería para comprender desde un punto de vista informático el comportamiento de la realidad para poder mostrarla en un sistema inteligente que da como resultado el uso de Inteligencia Artificial (IA) [11]. 2. En la pantalla principal aparecerá su historial clínico con respecto a los diagnósticos (Ver Figura 5) Figura 5 Pantalla que muestra las opciones y la fecha del último diagnóstico sistema SIDAGET (Elaboración propia, 2015). 3. En el botón diagnósticos verá su historial y la fecha en que se aplicó (Ver Figura 6) Figura 3 Arquitectura sistema SIDAGET (Elaboración propia, 2015). Cuando el paciente llega al centro de salud con síntomas específicos y con una endoscopia previamente tomada hace lo siguiente: 1. Ingresa su número de seguridad social al sistema, si el número es incorrecto no podrá entrar (Ver Figura 4) Figura 6 Pantalla que muestra los diagnósticos sistema SIDAGET (Elaboración propia, 2015). El diagrama a bloques de como el sistema hace el diagnóstico se observa en la Figura 7, el cual se describe a continuación: 1. 2. 3. 4. 5. Figura 4 Pantalla principal sistema SIDAGET (Elaboración propia, 2015). México D.F., 19 al 23 de octubre 2015 3 Carga un archivo valido de imagen(.jpg) Hace una conversión a tipo negativo de la imagen Extrae el valor de color de cada pixel Dibuja la lesión Arroja un diagnóstico. 15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO Tabla 1 Valores de colores R,G,B (Elaboración propia, 2015). MAXIMOS Figura 7 Proceso de detección y diagnóstico sistema SIDAGET (Elaboración propia, 2015). Resultados Para que se genere el diagnóstico automático se extrae el color de cada imagen procesada, y se toma el valor mínimo y máximo de la imagen, los resultados extraídos se muestran en la tabla 1, en donde se observa que los valores máximos del verde y azul no varían mientras que el mínimo rojo varia en tres ocasiones. México D.F., 19 al 23 de octubre 2015 4 MINIMOS RED Fuertes 87 99 99 96 96 98 71 GREEN BLUE RED GREEN BLUE 99 99 99 99 99 99 99 191 186 170 183 255 176 212 0 0 0 0 0 0 0 12 10 16 12 0 10 12 101 101 101 101 101 101 101 Medianas 99 99 99 87 92 96 99 98 97 99 99 99 99 97 97 97 99 98 99 93 96 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 99 140 182 167 167 152 197 165 171 131 146 128 160 182 148 157 148 173 143 130 138 139 158 144 251 0 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 43 27 34 38 49 59 33 22 58 49 73 42 27 43 39 43 55 57 65 59 63 55 64 37 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 101 Leves 99 98 98 99 99 99 99 99 137 118 124 120 0 0 15 43 66 80 85 74 101 101 101 101 15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO Para tomar un criterio de que colores se tomarían en cuenta para que se tuviera un diagnóstico automático se utilizaron los colores que tienen variación significativa, estos fueron el mínimo verde (ver Figura 8) y el máximo azul (ver Figura 9), las variaciones por tipo de lesión en cuanto a los valores mínimos del color verde se muestran en la tabla 2, mientras que en la tabla 3 se observan las variaciones de los colores máximos del color azul. Tabla 2 Valores mínimos de color verde (Elaboración propia, 2015). Graves Medianas 12 10 16 12 0 10 12 43 27 34 38 49 59 33 22 58 49 73 42 27 43 39 43 55 57 65 59 63 55 64 37 Leves 66 80 85 74 Figura 8 Valores mínimos de color verde sistema SIDAGET (Elaboración propia, 2015). Tabla 3 Valores máximos de color verde (Elaboración propia, 2015). Graves 191 186 170 183 255 176 212 México D.F., 19 al 23 de octubre 2015 5 Medianas 140 182 167 167 152 197 165 171 131 146 128 160 182 148 157 148 173 143 130 138 139 158 144 251 Leves 137 118 124 120 15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO Figura 9 Valores máximos de color azul sistema SIDAGET (Elaboración propia, 2015). Figura 10 Valores de color rojo sistema SIDAGET (Elaboración propia, 2015). La variación en el valor máximo del color rojo (Tabla 4) nos refleja que la imagen tiene otros factores adicionales, Figura10. III. CONCLUSIONES Un diagnóstico de una lesión grave se ubica entre el rango de 0 a 16 en el valor mínimo verde, mientras que en el máximo azul esta de 170 a 255; para una mediana se tienen los valores mínimos en verde de 22 a 73 y los máximos en azul de 128 a 251; por ultimo para las lesiones leves los rangos mínimos verdes son 66 a 85 y en el caso de los máximos azul están de 118 a 137. Tabla 4 Valores de color rojo (Elaboración propia, 2015). Graves Medianas 87 99 99 96 96 98 71 México D.F., 19 al 23 de octubre 2015 99 99 99 87 92 96 99 98 97 99 99 99 99 97 97 97 99 98 99 93 96 99 99 99 Leves 99 98 98 99 Se toma entonces el criterio de diagnóstico de acuerdo a los números de color extraídos (mínimos verde) quedando los rangos y clasificando el tipo de lesión de acuerdo a lo siguiente: - 0 a 21 Æ Lesión grave tratamiento riguroso 22 a 65 Æ Lesión mediana 66 a85 Æ Lesión leve Por lo tanto, se observa que entre menor sea el valor mínimo del color verde la lesión es más grave o fuerte, mientras que si es más alto la lesión es leve o incluso no podría haber lesión. IV. AGRADECIMIENTOS Agradezco al Instituto Politécnico Nacional, a la Secretaria de Investigación y Posgrado del IPN, a la Sección de Estudios de Posgrado e Investigación de la Escuela Superior de Ingeniería Mecánica y Eléctrica Unidad Zacatenco y al Consejo Nacional de Ciencia y Tecnología por el apoyo brindado. 6 15vo CONGRESO NACIONAL DE INGENIERÍA ELECTROMECÁNICA Y DE SISTEMAS (CNIES 2015) ARTÍCULO No. SIS06 ARTÍCULO ACEPTADO POR REFEREO V. REFERENCIAS Patiño Ortiz Miguel Egreso de la ESIME-Zacatenco del IPN como Ingeniero en Comunicaciones y Electrónica con especialidad en computación, Concluyo la maestría en ciencias en ingeniería de Sistemas y el Doctorado en Ciencias en Ingeniería Mecánica con mención honorifica, dentro de la Sección de Estudios de Posgrado e Investigación de la misma institución. Realizó un posdoctorado en la Universidad Autónoma Metropolitana en nanotecnología. Actualmente desarrolla investigación sobre sistemas complejos, es profesor investigador en el IPN y es miembro del Sistema Nacional de Investigadores Nivel 1. 1. Barboza Eduardo 1996. Cáncer de estómago. Revista médica herediana. Vol. 7 No. 2. 2. Classen Meinhard 2010. Protección contra las infecciones que provocan cáncer. Unión Internacional contra el Cáncer. 38p. 3. International Agency for Research on Cancer. World Cancer Report 2008. International Agency for Research on Cancer. 4. Jemal A. et al., 2011. Global cancer statistics. CA Cancer Journal for Cliricians. No. 61. 69p. 5. Ferlay J. et al., 2010. Estimates of cancer incidence and mortality in Europe 2008. Eur J Cancer. 46:765. 81p. 6. Marshall B. 1994. Helicobacter pylori. Am J Gastroenterol. 89. 116p. 7. American Cancer Society 2014. Cáncer de estómago. Guía detallada. American Cancer Society. 8. Instituto Nacional de Cancerología 2004. El cáncer. Aspectos básicos sobre su biología, clínica, prevención, diagnóstico y tratamiento. Ministerio de la protección social. Instituto Nacional de Cancerología E.S.E. 9. Vilarroya et al., 2006. Palabra de robot: Inteligencia artificial y comunicación. Publicaciones de la Universitat de Valencia. Valencia. 36p. 10. Ascolano et al., 2003. Inteligencia artificial: modelos, técnicas y áreas de aplicación. Editorial Paraninfo. 4p. 11. Diez et al., 2001. Introducción a la inteligencia artificial: sistemas expertos, redes neuronales artificiales y computación evolutiva. Universidad de Oviedo, Servicio de publicaciones. 1P. Patiño Ortiz Julian Egresado de la ENEP Acatlán de la UNAM como Ingeniero Civil con especialidad en estructuras, concluyo la Maestría en Ciencias en Ingeniería de Sistemas, el doctorado en Ciencias Administrativas y el Doctorado en Ciencias en Ingeniería Mecánica con Mención Honorifica en la Sección de Estudios de Posgrado e Investigación de la ESCA Santo Tomas y la ESIME Zacatenco del Instituto politécnico Nacional. Realizó estudios de Posdoctorado en la ESIME Zacatenco con patrocinio del Instituto de Ciencia y Tecnología del Distrito Federal (ICyTDF) en Sistemas Complejos, Sismicidad y Protección Civil. Actualmente desarrolla investigación sobre sistemas complejos, es profesor investigador en el IPN y es miembro del Sistema Nacional de Investigadores Nivel 1. VI. BIOGRAFÍA Alcaide Juan Luis. Nació en la ciudad de México D.F. en marzo de 1988. Egresado del CECYT. No. 1 “Gonzalo Vázquez Vela”. Realizo sus estudios de Licenciatura en Ingeniería en Informática la Unidad Profesional Interdisciplinaria de Ingeniería de Ciencias Sociales y Administrativas UPIICSA – IPN de 2007 a 2011.Curso la Maestría en Ciencias en Ingeniería de Sistemas en la Escuela Superior de Ingeniería Mecánica y Eléctrica IPN - ESIME – Zacatenco de 2012 a 2013. Actualmente es estudiante de Doctorado en Ingeniería de Sistemas en la misma institución. México D.F., 19 al 23 de octubre 2015 7
© Copyright 2026