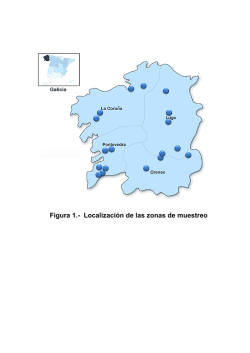
Bacterias y hongos en el aire interior de seis áreas de la
I. INTRODUCCIÓN En el aire interior de las edificaciones se presentan colonizaciones de diversos géneros de bacterias y hongos provenientes de poblaciones microbianas que pueden estar viviendo en forma permanente en las superficies de dichos ambientes o provenir del aire exterior (UNESCO, 2009). Según OSMAN (2011) se han documentado efectos de toxicidad aguda o crónica, en relación a la exposición a contaminantes del aire interior que van desde efectos leves en el tracto respiratorio alto, como la congestión nasal, estornudos, enfermedades respiratorias agudas, dificultades para respirar, y otros efectos como la conjuntivitis, hasta efectos sistémicos como dolor de cabeza, dificultad para concentrarse y otros. La calidad del aire en el interior se correlaciona con la composición cuantitativa y cualitativa de la población microbiana (según localización geográfica, urbanización, época estacional, confinamiento, etc.) y la emergencia de enfermedades respiratorias o alergias. Las Guías de Calidad del Aire de la OMS (OMS, 2011) constituyen el análisis más consensuado y actualizado sobre los efectos de la contaminación en la salud, y recogen los parámetros de calidad del aire que se recomiendan para reducir de modo significativo los riesgos sanitarios. 2 El control microbiológico del aire se integra como parte del proceso de aseguramiento de la calidad, que tiene en cuenta un riesgo de naturaleza microbiana, cualquiera sea el campo de actividad. Un punto crítico en la gestión de la calidad del aire es la inadecuada higiene y mantenimiento de la limpieza en el interior de instalaciones diversas, el cual genera el aumento de vectores biológicos y la proliferación de microorganismos dañinos (OMS 2004). Considerando lo mencionado, se requiere establecer la presencia de microorganismos que comúnmente pueden presentarse en el aire interno de los ambientes o áreas de la UNAS impulsando un seguimiento de la calidad del aire para determinar los niveles de contaminación microbiológica en la universidad; que es una de las líneas de investigación del Laboratorio de Microbiología General en el Área de Microbiología Ambiental y Tratamiento de la Contaminación Atmosférica de la Carrera de Ingeniería Ambiental, de la UNAS. En la presente práctica pre profesional sólo se desarrolló parte de esa labor, actividad estrictamente señalada y circunscrita en revelar la presencia genérica de bacterias y hongo de algunas áreas de la UNAS, este registro asimismo sería un instrumento preventivo para próximas investigaciones o futuros informes orientados a la conservación de la salud de la población estudiantil, y tomar medidas preventivas y correctivas con la finalidad de eliminar riesgos y peligros para la salud pública. 3 1.1. OBJETIVOS 1.1.1. Objetivo General Aislar y caracterizar los géneros de bacterias y hongos presentes en el aire interior de seis áreas de la Universidad Nacional Agraria de la Selva. 1.1.2. Objetivo específicos - Determinar las condiciones ambientales de temperatura y humedad en las áreas del pabellón central, servicio higiénico, granja zootecnia, pabellón gallitos, internado mujeres y modulo nuevo de la FRNR - Identificar a nivel de genero las bacterias y hongos en las áreas del pabellón central, Servicio higiénico, granja zootecnia, pabellón gallitos, internado mujeres y modulo nuevo de la FRNR de la UNAS. II. REVISIÓN BIBLIOGRÁFICA 2.1. Calidad del aire en interiores Los espacios interiores son microambientes importantes al abordar los riesgos de la contaminación del aire. La mayor parte de la exposición diaria de una persona a muchos de los contaminantes del aire proviene de la inhalación en interiores, tanto por la cantidad de tiempo que se pasa en estos ambientes como por los mayores niveles de contaminación que hay en ellos. La calidad del aire en interiores depende de varios factores. En un esfuerzo por conservar la energía, el diseño de los edificios modernos ha favorecido estructuras con menores tasas de ventilación. En contraste, en algunos lugares del mundo solo se usa ventilación natural, mientras que en otros es más común la ventilación mecánica. Mientras que en los países desarrollados, la mayoría de problemas se debe a las bajas tasas de ventilación en los edificios y a la presencia de productos y materiales que emiten una gran variedad de compuestos, en las naciones menos desarrolladas se afrontan problemas relacionados con los contaminantes generados por actividades humanas, principalmente por procesos de combustión. Si se consideran de manera exclusiva los efectos de salud de la contaminación del aire, no importa si el contaminante se inhala en exteriores o en interiores. Sin embargo, existen diferencias importantes en la composición 5 de los contaminantes en interiores y exteriores. Las emisiones generadas por el tráfico son un ejemplo de contaminación en exteriores. En interiores, las fuentes de contaminación incluyen el humo del tabaco y los productos de la combustión de biomasa. Al elaborar las Guías para la Calidad del Aire no se han considerado todas esas composiciones y es probable que no sean aplicables en todas las circunstancias (OMS, 2004). Contaminantes biológicos incluyen bacterias, mohos, hongos, virus, caspa de animales y saliva de los gatos, el polvo doméstico, ácaros, cucarachas, y el polen. Hay muchas fuentes de estos contaminantes. El polen se originan a partir de plantas; los virus se transmiten por la gente y los animales; bacterias son transportadas por las personas, los animales y el suelo y restos vegetales; y los animales domésticos son fuentes de la saliva y la caspa de los animales. La proteína en la orina de ratas y ratones es un potente alérgeno. Cuando se seca, se puede pasar al aire. Sistemas de tratamiento de aire centrales contaminados pueden convertirse en caldo de cultivo para el moho, y otras fuentes de contaminantes biológicos y pueden entonces distribuir estos contaminantes a través de la casa (EPA, 2012). Al controlar el nivel de humedad relativa en un hogar, el crecimiento de algunas fuentes de productos biológicos puede ser minimizado. Una humedad relativa de 30-50 por ciento en general se recomienda para los hogares. El agua estancada, los materiales dañados por el agua o superficies húmedas también sirven como caldo de cultivo para hongos, mohos, bacterias e insectos. Los ácaros del polvo doméstico, la fuente de uno 6 de los más poderosos alérgenos biológicos, crecen en ambientes húmedos y cálidos (EPA, 2012). 2.2. Seguimiento y evaluación de la calidad del aire Las tres herramientas principales para evaluar la calidad del aire son: i) monitoreo del ambiente; ii) modelos e iii) inventario o medición de emisiones. La finalidad última del monitoreo no es simplemente recopilar datos sino proporcionar la información necesaria para que los científicos, los encargados de formular políticas y los planificadores tomen decisiones fundamentadas sobre la gestión y mejoramiento del ambiente. El monitoreo cumple un papel central en este proceso, ya que brinda la base científica necesaria para el desarrollo de políticas y estrategias, el establecimiento de objetivos y la medición del cumplimiento de las metas y medidas coercitivas. No obstante, debe reconocerse que el monitoreo tiene limitaciones. Ningún programa de monitoreo, aunque esté bien fundamentado y diseñado, puede aspirar a cuantificar de manera integral los patrones de contaminación del aire en el espacio y en el tiempo. En muchas circunstancias, las mediciones por sí solas pueden ser insuficientes o impracticables para definir cabalmente la exposición de la población en una ciudad o país. Por ello, el monitoreo a menudo debe usarse conjuntamente con otras técnicas objetivas de evaluación, incluidas la elaboración de los modelos, la medición y la elaboración de inventarios de emisiones, la interpolación y elaboración de mapas. En el mejor de los casos, el monitoreo proporciona una figura incompleta, aunque útil, de la calidad actual del ambiente. 7 Del mismo modo, tampoco se puede confiar únicamente en la elaboración de modelos de simulación. Si bien estos pueden ser una herramienta poderosa para la interpolación, la predicción y la optimización de las estrategias de control, la posibilidad de usarlos efectivamente depende de la disponibilidad de datos de monitoreo reales y validados de forma apropiada. Además, es importante que los modelos usados sean apropiados para las condiciones, las fuentes y la topografía locales, y que sean compatibles con las bases de datos disponibles sobre las emisiones y la meteorología. Muchos modelos dependen de la disponibilidad de datos de emisiones confiables. Un inventario completo de emisiones para una ciudad o país puede requerir misiones de fuentes puntuales, de área y móviles. En algunos casos, se debe considerar si es necesario evaluar los contaminantes transportados al área en estudio. Los inventarios generalmente serán estimados con factores de emisión apropiados para los diferentes tipos de fuentes (verificados a través de la medición) y se usarán en conjunción con estadísticas de datos sustitutos como la densidad demográfica, el uso de combustibles, los kilómetros recorridos por los vehículos y la producción industrial. La medición de las emisiones generalmente estará disponible solo para fuentes puntuales grandes de tipo industrial o para tipos representativos de vehículos bajo condiciones estandarizadas de manejo. Las tres herramientas de evaluación son interdependientes en alcance y aplicación. Por lo tanto, el monitoreo, la elaboración de modelos de simulación y la evaluación de las emisiones deben ser concebidos como 8 componentes interrelacionados en todo enfoque integral para estudiar la exposición o determinar el cumplimiento de los criterios de calidad del aire. 2.3. Gestión de la calidad del aire en interiores Una gran parte de los seres humanos pasan la mayor parte de su tiempo en interiores, donde pueden estar expuestos a una deficiente calidad del aire. La contaminación y el deterioro del aire en interiores causan enfermedades, incrementan la mortalidad, disminuyen la productividad y tienen serias consecuencias económicas y sociales. Los efectos sobre la salud pueden incluir la elevación de las tasas de cáncer, enfermedades pulmonares, alergia y asma, así como condiciones mortales como el envenenamiento con monóxido de carbono. Los costos médicos y sociales asociados con estas enfermedades y la reducción consiguiente de la productividad humana conducen a pérdidas económicas asombrosas. Los problemas de la calidad del aire en interiores afectan a todos los tipos de construcciones, incluidas las viviendas, escuelas, oficinas, centros de salud y otros edificios públicos y comerciales. Los problemas del aire en interiores se pueden reducir a través de una mejor planificación urbana, diseño, operación y mantenimiento de edificios y el uso de materiales y equipos menos contaminantes en las construcciones. 2.4. Fuentes de contaminantes del aire En el aire interior se encuentra una mezcla de contaminantes procedentes de diferentes fuentes. La mayor parte de estas fuentes se 9 encuentran en el interior, pero es de destacar el hecho de que el aire exterior que entra en la vivienda, puede introducir contaminantes que no se originan en este ambiente, por lo que dicho aire exterior se encuentra reseñado como una de las fuentes de contaminación en el interior. El ambiente interior en cualquier clase de edificio, incluidas viviendas, es un resultado de la interacción entre el sistema del edificio (diseño original y las subsecuentes modificaciones en la estructura y los sistemas mecánicos), las técnicas de construcción, las fuentes de contaminación (materiales de construcción y mobiliario, humedad, procesos y actividades dentro del edificio), los ocupantes del edificio y las fuentes externas (OSMAN, 2011). 2.5. Microorganismos en el aire Los microorganismos son y siempre han sido un factor importante para la salud humana. Estos microorganismos han desarrollado una extraordinaria capacidad de supervivencia que les ha permitido colonizar prácticamente cualquier espacio natural de la tierra. La atmósfera no tiene una microbiota autóctona pero es un medio para la dispersión de muchos tipos de microorganismos (esporas, bacterias, virus y hongos), procedentes de otros ambientes. Algunos han creado adaptaciones especializadas que favorecen su supervivencia y permanencia. Los microorganismos dispersados por el aire tienen una gran importancia biológica y económica porque producen enfermedades en plantas, animales y humanos, causan alteraciones en los alimentos y materiales orgánicos y contribuyen al deterioro y corrosión de monumentos y metales. El transporte se realiza sobre partículas de polvo, 10 fragmentos de hojas secas, piel, fibras de la ropa, en gotas de agua o en gotas de saliva eliminadas al toser, estornudar o hablar. El número de microorganismos del aire en las zonas pobladas depende de la actividad en esa zona (tanto industrial o agrícola), la presencia de seres vivos y la cantidad de polvo (PASTOR, 2010). Con respecto a la caracterización de la microbiota del aire y la presencia de especies patógenas se destaca el trabajo de Palacios et al. (2006), quienes determinaron la concentración y tipo de microorganismos cultivables suspendidos en la atmósfera de la ciudad de Monterrey, N. L. México, los resultados muestran presencia de hongos de los géneros: Penicillium sp y Aspergillus sp. El trabajo concluye que las partículas de polvo suspendidas en el aire de la ciudad de Monterrey, son un vehículo de transporte microbiano de patógenos potenciales oportunistas para el hombre. 2.5.1. Tipos de microorganismos El aire contiene en suspensión diferentes tipos de microorganismos, especialmente bacterias y hongos. Algunos microorganismos se encuentran en forma de células vegetativas, pero lo más frecuente son las formas esporuladas, ya que las esporas son metabólicamente menos activas y sobreviven mejor en la atmósfera porque soportan la desecación. Las producen hongos, algas, líquenes, algunos protozoos y algunas bacterias. En el aire se aíslan frecuentemente bacterias esporuladas de los géneros Bacillus, Clostridium y Actinomices (UNDERWOOD, 1992). 11 Entre las bacterias también son muy frecuentes los bacilos pleomórficos grampositivos (Corynebacterium) y los cocos grampositivos (Micrococcus y Staphylococcus). Los bacilos gramnegativos (Flavobacterium, Alcaligenes) se encuentran en menor proporción y disminuyen con la altura (GREGORY, 1973). Cladosporium es el hongo que predomina en el aire, tanto sobre la tierra como sobre el mar, aunque también es frecuente encontrar otros mohos, como Aspergillus, Penicillium, Alternaria y Mucor (TAKAHASHI, 1997) y la levadura Rhodotorula (UNDERWOOD, 1992). - Bacterias Las bacterias son organismos complejos, capaces de vivir, en un medio adecuado, sin la necesidad de un huésped para completar su desarrollo. Es de destacar la capacidad de elaborar esporas que presentan algunas bacterias. Las esporas no son más que formas de vida resistentes acondiciones adversas. Pueden resistir, durante años incluso, altas temperaturas, sequedad, falta de nutrientes, etc., recuperando su estado normal y capacidad infectiva al entrar en contacto con un medio adecuado para su desarrollo (PASTOR, 2010). Las principales fuentes de bacterias en el aire son originadas por el hombre, siendo las más importantes las aguas negras y los desechos de origen animal. La degradación y digestión de los desechos produce aerosoles que contienen bacterias, algunas de las cuales pueden ser patógenas como es el caso de los estreptococos y las coliformes fecales. Un estudio realizado en la 12 ciudad de Marsella, mostró que el número de bacterias se incrementa con la temperatura y la velocidad del viento - Género Enterobacter Los microorganismos que pertenecen a este género raras veces causan infecciones en huéspedes sanos, pero son aislados nosocomiales frecuentes. Tres especies de Enterobacter, E. cloacae, E. aerogenes y E. sakazakii, son responsables de la amplia mayoría de infecciones por Enterobacter. Pantoea agglomerans, hasta hace poco conocida como Enterobacter agglomerans, es también un aislado frecuente que puede causar una amplia variedad de infecciones, entre ellas neumonía. Estas bacterias fermentan la lactosa, son móviles y forman colonias mucoides (MANDELL, 2006). - Genero Citrobacter y Escherichia Enterobacterias oportunistas, Son microorganismos que forman parte de la flora comensal del tubo digestivo o se encuentran como saprofitos en el medio externo, que normalmente no se comportan como patógenos, pero, cuando se presentan factores predisponentes, pueden dar lugar a cuadros clínicos diversos por lo general fuera del aparato digestivo (infecciones urinarias, supuraciones de diversa localización y sepsis). En su mayoria son cepas resistentes o multirresistentes a los antibioticos, que generalmente es necesario administrar para la curacion del proceso. 13 - Genero Klebsiella Son enterobacterias inmóviles, en su gran mayoría productoras de ureasa que se caracterizan por la Son enterobacterias comensales o saprofitas del medio ambiente, resistentes a los agentes externos, muy poco exigentes en sus necesidades nutritivas, capaces de crecer y desarrollarse en medios mínimos y producir infecciones en el hombre. Klebsiella puede producir en ocasiones infecciones en personas sanas, en su mayoría producen infecciones oportunistas, especialmente en los enfermos hospitalizados, caracterizadas por su resistencia a los antibióticos. - Hongos Los hongos son formas complejas de vida que presentan una estructura vegetativa denominada micelio que está formada por hifas (estructuras filiformes por las que circula el citoplasma plurinucleado. Esta estructura vegetativa surge de la germinación de sus células reproductoras o esporas. Su hábitat natural es el suelo, pero algunos componentes de este grupo son parásitos tanto de hombres y animales como de vegetales (PASTOR, 2010). En cuanto a su significado para la salud, la acción de los hongos unicelulares (levaduras) es muchas veces infectiva (Cándida albicans, Ceyptococcus neoformas, Blastomyces dermatiditis, etc.), mientras que el mayor problema originado por los mohos se refiere a su gran capacidad de elaboración de micotoxinas (Aspergillus sp, Penicillum sp, Fusarium sp, etc.). No obstante, ciertos mohos pueden ser tanto agentes de micosis como 14 responsables de intoxicaciones (p. ej., Aspergillus fumigatus) (PASCUAL y CALDERON, 2000). - Género Aspergillus Las especies del género Aspergillus son mayoritariamente ubicuas, aislándose de diferentes sustratos, aunque con mayor frecuencia de climas cálidos. Las colonias de este género se desarrollan en general de forma rápida y presentan diversas tonalidades: blanquecinas, amarillentas, marrón amarillentas, negruzcas, marrón-negruzcas o verdosas. Están formadas por densas agrupaciones de conidióforos sobre los que se encuentran las células conidiógenas que son las que originarán las esporas asexuales o conidios (SORIANO, 2007). Se sabe que Aspergillus fumigatus produce dos elastasas que incluyen una proteasa sérica y una metaloproteasa que pueden actuar sobre la elastina que constituye cerca del 30% del tejido pulmonar.Aspergillus flavus produce aflatoxina que es una hepatotoxina cancerígena conocida (FORBES, 2009). - Género Penicillium Los penicilios son mohos comunes que desarrollan sobre los más diversos substratos: granos, paja, cueros, frutas, etc. crecen sobre los alimentos preparados o sus materias primas, ya sean de origen vegetal o animal, si hallan la actividad del agua y los nutrientes necesarios. Este género se caracteriza por formar conidios en una estructura ramificada semejante a un pincel que termina en células conidiógenas llamadas fiálides (CARRILLO, s.d.). 15 - Género Geotrichum Hongo de distribución cosmopolita, produce geotricosis, que es una micosis oportunista producida por este hongo que está presente en el medio ambiente, la piel y mucosas del huésped humano. La infección puede ser de fuente endógena o exógena, las formas clínicas son varias y la más frecuente es la pulmonar, con manifestaciones muy similares a la tuberculosis. A nivel cutáneo produce lesiones nodulares y su tratamiento es a base de yoduro de potasio y violeta de genciana (ROMERO, 2007). - Género Trichophyton El género Trichophyton es uno de los agentes etiológicos principales de las dermatomicosis, capaces de invadir el pelo, la piel y las uñas. Los dermatrofitos degradan y utilizan la queratina como una fuente de nitrógeno pero suelen ser incapaces de penetrar en el tejido subcutáneo, salvo que el huésped esté inmunodeprimido. Los miembros de este género están ampliamente distribuidos y son las causas más importantes y comunes de infecciones de los pies y las uñas; son los causantes de la tiña del cuerpo, cuero cabelludo, uñas, entre otros (FORBES, 2009). - - Género Rizophos Es un género de hongos filamentosos hallados en el suelo, degradando frutos y vegetales, heces animales, y residuos. Son agentes oportunistas. Pueden causar serias (y con frecuencia mortales) infecciones en humanos y en animales debido a su rápido crecimiento a relativamente altas temperaturas. Algunas especies son patógenos vegetales. 16 - Genero Blastomyces Un hongo dimorfo que existe en forma de levadura con yemas en los tejidos y como micelo en el suelo y la madera. Afecta primariamente los pulmones, si ingresa al ser humano ocasionando infecciones respiratorias. 2.6. Factores ambientales que intervienen en el desarrollo de las bacterias y hongos microorganismos en el aire Las condiciones físico-químicas de la atmósfera no favorecen el crecimiento ni la supervivencia de los microorganismos por lo que la mayoría solo pueden sobrevivir en ella durante un breve período de tiempo. Las esporas son las formas de vida con mayor supervivencia y tienen varias propiedades que contribuyen a su capacidad para sobrevivir en la atmósfera, principalmente su metabolismo bajo, por lo que no requieren nutrientes externos ni agua para mantenerse durante largos períodos de tiempo. Además poseen otras adaptaciones que aumentan su capacidad de sobrevivir en este ambiente. Algunas esporas tienen paredes gruesas que las protegen de la desecación y otras son pigmentadas, lo que las ayuda contra las radiaciones ultravioleta. Su escasa densidad les permite permanecer suspendidas en el aire sin sedimentar. Algunas son muy ligeras e incluso contienen vacuolas de gas y otras tienen formas aerodinámicas que les permite viajar por la atmósfera (GREGORY, 1973). El tiempo de permanencia de los microorganismos en el aire depende de la forma, tamaño, peso del microorganismo y la existencia de la 17 potencia de las corrientes aéreas que lo sostenga y lo eleve. Son factores adversos los obstáculos, que al oponerse a los vientos, disminuyen su velocidad y su potencia de arrastre, y las precipitaciones, que arrastran al suelo las partículas suspendidas (DE LA ROSA et al., 1987). Además, las esporas se producen en número muy elevado y aunque muchas mueran en la atmósfera, el éxito de unas pocas asegura la supervivencia y dispersión de los microorganismos. La supervivencia de las bacterias es variable, debido a su diversidad estructural y metabólica. En general, las bacterias grampositivas son más resistentes que las gramnegativas ya que su pared celular es más gruesa. Por ejemplo, en aire seco algunas especies de Bacillus y Clostridium son capaces de sobrevivir más de 200 años, Mycobacterium un mes y Salmonella sólo diez minutos. Según POTTS (1994), los principales factores que intervienen, son: Humedad relativa, temperatura, oxígeno y materia orgánica. 2.6.1. Humedad relativa Es el factor más importante. Cuando la humedad relativa del aire decrece, disminuye el agua disponible para los microorganismos, lo que causa deshidratación y por tanto la inactivación de muchos de ellos. La desecación puede causar una pérdida de viabilidad en las capas más bajas de la atmósfera, especialmente durante el día. A mayores altitudes, las condiciones son más favorables por la evaporación y algunas esporas pueden germinar en las nubes. La humedad relativa de la atmósfera varía de un 10-20 % en las 18 regiones desérticas. El límite menor para el crecimiento de hongos es del 65 %. Las bacterias requieren una mayor humedad. Las gramnegativas resisten peor la desecación que las positivas; esto se refleja en que existe poca evidencia de transmisión por el aire de bacterias Gram negativas, con la excepción de Legionella (LIDWELL, 1990). 2.6.2. Temperatura Está muy relacionada con la humedad relativa, por lo que es difícil separarlos efectos que producen ambas. La temperatura en la troposfera varía de 40°C cerca de la superficie, a 80°C en las capas altas, alcanzándose temperaturas de congelación entre 3-5 Km. La congelación no destruye los microorganismos pero no pueden multiplicarse. Diversos estudios muestran que el incremento de la temperatura disminuye la viabilidad de los microorganismos (MOHR, 1997). 2.7. Agentes patógenos del aire La superficie de la Tierra (suelo y agua) es la fuente de los microorganismos en la atmósfera. El viento forma polvo del suelo y estas partículas de polvo transportan los microorganismos del suelo al aire. Además, las gotas de agua que se originan en la superficie de los océanos y otros cuerpos de agua naturales como consecuencia de la salida de burbujas de aire, pueden contener microorganismos que penetran en la atmósfera. Las esporas de hongos constituyen la mayor proporción de microorganismos en el aire. 19 El tiempo de permanencia de los microorganismos en el aire depende de la forma, tamaño, peso del microorganismo y la existencia de la potencia de las corrientes aéreas que lo sostenga y lo eleve. Son factores adversos los obstáculos, que al oponerse a los vientos, disminuyen su velocidad y su potencia de arrastre, y las precipitaciones, que arrastran al suelo las partículas suspendidas (DE LA ROSA et al., 1987). A menudo, tanto las esporas como los microorganismos vegetativos entran en la atmósfera como bioaerosoles, que pueden formarse por muchas causas: lluvia, movimiento del agua en los ríos y mar, tratamiento de aguas residuales, aspersores de riego, aire acondicionado o secreciones respiratorias del hombre y de los animales. Los microorganismos también pueden encontrarse en el aire sobre partículas de polvo o en el suelo (ATLAS Y BARTHA, 2002). La mayoría de los microorganismos soportan un corto desplazamiento, (pocos milímetros) muy pocos resisten largas distancias debido a la hostilidad del hábitat y según reportes, se pueden encontrar gran variedad de esporas de hongos donde los más comunes son Cladosporium, y Penicillium (ATLAS y BARTHA, 2002). 2.8. Enfermedades transmitidas por el aire Gran número de infecciones humanas y animales se trasmiten por el aire y causan enfermedad, principalmente, en el aparato respiratorio. Las enfermedades respiratorias tienen una gran importancia socio económica ya que se trasmiten fácilmente a través de las actividades normales del hombre. 20 Conviene recordar que la trasmisión aérea de enfermedades no es exclusiva de microorganismos que salen de las vías respiratorias. En algunos casos se forman bioaerosoles procedentes de animales y sus productos que se resuspenden en el aire y pueden ser inhaladas, como heces desecadas y plumas de aves (Chlamydophila psittaci, Cryptococcus neoformans, Histoplasma capsulatum), placenta (Coxiella burnetii) lana, piel y marfil (Bacillus anthracis).Casos especiales son: Legionella que se encuentra en el agua y se trasmite por los aerosoles que se forman en los distintos sistemas y aparatos Coccidioides immitis y Aspergillus fumigatus cuyas esporas, procedentes del suelo y estiércol, son diseminadas sobre el polvo y trasportadas por el viento (BENENSON, 1997). Hay numerosas enfermedades bacterianas trasmitidas por el aire que se resumen en el Cuadro 1, están producidas, principalmente, por bacterias grampositivas debido a su mayor supervivencia en el aire. Afectan al tracto respiratorio superior (faringitis, epiglotitis, difteria) e inferior (bronquitis, neumonías, tosferina, tuberculosis) o, desde éste pasan a sangre y otros órganos (meningitis, carbunco pulmonar, fiebre Q, peste). Cuadro 1. Enfermedades bacterianas transmitidas por el aire. Enfermedades Hongos Amigdalitis, faringitis bronquitis, escarlatina Streptococcus pyogenes Difteria Neumonía clásica Neumonía atípica, bronquitis Corynebacterium diphtheria Streptococcus pneumoniae Sthaphylococcus aureus Klebsiella pneumoniae Mycoplasma pneumoniae Chiamydophila pneumoniae Chiamydophila psittaci 21 Meningitis Neissria meningitidis Meningitis, epiglotis, neumonía Tosferina Heamophilusi nfluenzae Bordetellapertussis Tuberculosis Mycobacterium tuberculosis Legionelosis Legionella pneumophila Actinomicosis Actinomyces israelii Nocardiosis Nocardia asteroides Fiebre Q Coxiella burnetii Carbunco pulmonar Bacillus anthracis Peste Yersinia pestis Fuente: BENENSON (1997). Las enfermedades fúngicas trasmitidas por el aire. Ciertos hongos levaduriformes (Cryptococcus, Coccidioides, Blastomyces, Histoplasma) son responsables de enfermedades pulmonares, desde donde pueden invadir otros tejidos y producir una enfermedad sistémica. Por otra parte las esporas de varios mohos causan reacciones de hipersensibilidad que puede ser: inmediata o alergia que afecta al aparato respiratorio superior causando rinitis y asma, producida por partículas de 30µm como las esporas de Puccinia, Alternaria y Cladosporium y retardada, que afecta al aparato respiratorio inferior produciendo alveolitis y neumonitis, debida a partículas menores de 5µm, principalmente esporas de Aspergillus y Penicillium y de bacterias como los actinomicetos termófilos. Estudios epidemiológicos han demostrado que la inhalación de las esporas de algunos hongos es la causa de los problemas respiratorios asociados al «síndrome del edificio enfermo» y otras enfermedades ocupacionales bien conocidas de agricultores, vinateros, cerveceros y carpinteros. 22 Algunos hongos producen micotoxinas que afectan al hombre y a los animales cuando se ingieren, pero también se han producido casos de micotoxicosis por inhalación de esporas de hongos toxigénicos como Aspergillus, Fusarium y Stachybotrys, en ambientes cerrados (YANG y JOHANNING, 1997) Cuadro 2. Enfermedades Neumonías Micosis sistémicas Hipersensibilidad Micotoxicosis Enfermedades fúngicas Transmitidas por el aire Hongos Pneumocys tiscarinii Cryptococcus neoformans Blastomyces dermatitidis Histoplasma capsulatum Coccidioides immitis Aspergillus fumigatus Alternaria Botrytis Aspergillus Puccinia Penicillium Serpula Cladosporium.. Mucor Aspergillus Fusarium Stachybotrys Fuente: BENENSON (1997). III. 3.1. MATERIALES Y MÉTODOS Lugar de ejecución 3.1.1. Ubicación Política La presente práctica se realizó en seis áreas de la Universidad Nacional Agraria de la Selva (UNAS), los cuales fueron; Pabellón central, Servicio higiénico (cerca de los pabellones de laboratorios), oficina administrativa de Granja Zootecnia; Pabellón B (gallito de la roca), Internado de mujeres y el Módulo nuevo de la Facultad de Recursos Naturales Renovables (FRNR). La Universidad políticamente se encuentra ubicada en el distrito de RupaRupa, provincia Leoncio Prado, región Huánuco. Figura 1. Mapa de Ubicación de la UNAS 24 3.1.2. Ubicación Geográfica Los ambientes muestreados presentan una ubicación geográfica establecidas según su ocupación de las áreas como se muestra en el cuadro 3. Cuadro 3. Ubicación geográfica de los puntos de muestreo. Coordenadas UTM Puntos de Muestreo X (m) Y (m) 1.- Pabellón central 390603.19 8970239.67 2.- Servicio higiénico 390604.60 8970338.37 3.- Oficina administrativa de la Granja Zootecnia 390571.12 8970505.19 4.- Pabellón B 390410.44 8970522.09 5.- Internado de mujeres 390391.31 8970735.66 6.- Módulo nuevo de la F.R.N.R. 390281.74 8970834.73 FUENTE: Elaboración Propia 3.1.3. Clima El clima es tropical y húmedo caracterizado de acuerdo a su orografía y expresión regional de Selva Alta o Rupa Rupa, ubicado entre los 650 y 1,200 m.s.n.m., con precipitaciones que sobrepasan los 3,360 mm. En épocas de invierno. La temperatura media anual es de 22° y 25°C; las temperaturas máximas absolutas 33° y la mínima entre 15°C según la Estación Meteorológica José Abelardo Quiñones-Tingo María. 3.2. Materiales y equipos 3.2.1. Materiales Libreta de apuntes, mechero, jeringa, guantes quirúrgicos, mascarilla, guardapolvo, Matraces Erlenmeyer, placas Petri, tubos de ensayo, jeringas de 20 mL, algodón, pipetas, pinzas, varillas de vidrio, porta objetos, 25 cubre objetos, gradillas para tubos de ensayo, mechero de Bunsen, asa de siembra, anza micológica, agitadores, espátulas, papel mantequilla. - Medios de cultivo Agar Plate Count: Brain Heart infusión Broth (BHI) Agar cistina-lactosa deficiente en electrolitos (CLED): Es utilizado para el aislamiento, recuento e identificación presuntiva de microorganismos, pues permite el desarrollo de la mayoría de los patógenos urinarios y previene el desarrollo invasor de Proteus spp. Agar MacConkey: Este medio se utiliza para el aislamiento de bacilos Gram negativos de fácil desarrollo, aerobios y anaerobios facultativos. Permite diferenciar bacterias que utilizan o no, lactosa en muestras clínicas, de agua y alimentos. Todas las especies de la familia Enterobacteriaceae desarrollan en el mismo. Agar cetrimide: Medio utilizado para el aislamiento selectivo de Pseudomonas y de otras especies del género. Agar Manitol Salado: Medio de cultivo selectivo y diferencial, utilizado para el aislamiento y diferenciación de estafilococos a partir de diversas muestras. Agar Sabouraud: Medio utilizado para el aislamiento, identificación y conservación de hongos patógenos y saprófitos. También es útil para el cultivo de levaduras. 26 Agar Papa Dextrosa (PDA): Medio de cultivo utilizado para el aislamiento y recuento de hongos y levaduras en muestras clínicas, alimentos, cosméticos y otros materiales. Para diferencicaion Bioquimica: Caldo rojo de metilo y VogesProskauer (RMVP), Agar hierro-triple azúcar (TSI), Agar lisina hierro (LIA), Agar citrato de Simmons, Caldo malonato, Agar urea, Medio SIM. - Reactivos Cristal violeta, reactivo Lugol, Alcohol acetona, Safranina, Aceite de cedro, Azul de Amann, reactivo del Indol según Kovacs, rojo de metilo, hidróxido de sodio al 4% (NaOH), alfa naftol, antibiótico Ceftrioxona, Bálsamo de Canadá. - Equipo Termómetro digital, GPS, Higrómetro digital, Cámara fotográfica, Autoclave, balanza, baño maría, estufas, contador de colonias, microscopio. 3.3. Metodología 3.3.1. Toma de muestra Las muestras se tomaron en seis puntos establecidos en el cuadro 3, realizando un recorrido por todo el área evaluada. 27 3.3.2. Preparado de medios de cultivo 3.3.2.1. Para muestreo de Bacterias y Hongos Para los seis puntos de muestreo se prepararon doce matraces con BHI, se repartieron seis matraces para muestreo de bacterias y seis para muestreo de hongos para los cultivos, se colocó un tapón de algodón y papel kraft rotulando a cada muestra; se llevó a baño maría hasta que se disuelvan completamente los medios, luego se esterilizo en la autoclave a 121 ºC a 15 lbs de presión, por 15 minutos. Después del autoclavado se agregó el antibiótico (ceftriaxona), 0.25 g a cada matraz para restringir el crecimiento de bacterias (KONEMAN, 1999) y se plaqueo. 3.3.3. Muestreo de aire en los puntos establecidos Se realizaron dos muestreos, el primero se realizó el 07 de febrero a partir de las horas 10 a.m., con una temperatura promedio 25.5 ºC y una humedad relativa de 75 %; el segundo muestreo se realizó el 28 de febrero, en el mismo horario con una temperatura promedio de 30.6 ºC y humedad 65.8 %, teniendo como puntos de muestreos las siguientes áreas: Cuadro 4. Códigos establecidos para cada lugar de muestreo dentro de la UNAS. CODIGO P1 P2 P3 P4 P5 P6 LUGAR Pabellón Central Servicios Higiénicos Oficina administrativa de la Granja Zootecnia Pabellón B (gallito de la roca) Internado de mujeres Módulo nuevo de la F.R.N.R. 28 Se utilizó la metodología del Impinger o burbujeo, que consiste en tomar aire con un dispositivo automático o mecánico y depositarlo inmediatamente en un medio de cultivo líquido. (ROSAS et al., 2004) Para cada muestreo se realizaron aspiraciones del aire de cada punto de muestreo recorriendo toda el área de la instalación. Las aspiraciones se realizaron con una jeringa (esterilizada) de 20 mL aplicando 50 repeticiones, usando protección personal (guantes y mascarilla). Después de cada aspiración se descargó con asepsia el contenido de la jeringa dentro de dos matraces (una para conteo de bacterias y otra para hongos). Paralelo a la realización del muestreo se tomaron la Temperatura y humedad. 3.3.4. Aislamiento de microorganismos Los matraces con medio BHI para crecimiento de bacterias se incubaron a 37 ºC por un lapso de 24 a 48 horas; mientras que los matraces con medio BHI más antibióticos usados para el crecimiento de hongos se llevaron a incubar a temperatura ambiente por un tiempo de 3 a 5 días dependiendo del desarrollo (COLLINS,1995) . 3.3.4.1. Bacterias De los matraces con BHI y muestras de aire incubados a 37 ºC por 24 a 48 horas se retiró mediante un asa de siembra, un inóculo para luego sembrar por estrías y agotamiento en las placas Petri con medios de aislamiento (CLED, MacConkey, Cetrimide, Manitol Salado). Seguidamente las 29 placas Petri ya sembradas se llevaron a incubación de forma invertida por 24 a 48 horas a una temperatura de 37 ºC (COLLINS,1995) 3.3.4.2. Hongos Para la siembra de hongos, se retiró un inóculo de cada caldo BHI más antibiótico y se sembró realizado punturas en agar Sabouraud y en Agar Papa Dextrosa (PDA). Las placas se incubaron de forma invertida a temperatura ambiental por un tiempo de 3 a 5 días (KONEMAN, 1999). 3.3.5. Identificación de microorganismos A. Bacterias a. Tinción de Gram - Se seleccionó la muestra a identificar, se realizó un frotis fino del material de estudio y se déjela secar al aire. - Se fijó el material al portaobjetos pasándolo tres o cuatro veces a través de la llama de un mechero a gas, de manera que el material no se desprenda durante el lavado (tinción). - Se colocó el frotis en un soporte para tinción y recubrió la superficie con solución de cristal de violeta (2 o 3 gotas). - Luego de 1-3 minutos de exposición al colorante cristal de violeta, se lavó exhaustivamente con agua destilada. - Se cubrió el frotis con reactivo de lugol (2 o 3 gotas), durante 1 – 3 minutos. Nuevamente se lavó con agua - Se sujetó el frotis entre el pulgar y el dedo índice e impregno la superficie con 2 o 3 gotas de decolorante alcohol-acetona (realice 30 movimientos de vaivén), hasta que el lavado deje de tener color violeta. Esto suele tomar 10 segundos o menos. - Se lavó con agua corriente y coloco el frotis nuevamente en el soporte para tinción. Se cubrió la superficie con la tinción de safranina (2 o 3 gotas) durante 1 minuto. Se lavó con agua corriente - Se colocó el frotis en posición vertical en el soporte para tinción, para permitir que el exceso de agua drene y el frotis se seque. - Se examinó el frotis teñido bajo el objetivo de 100 × (de inmersión) de un microscopio. b. Diferenciación bioquímica Después de haber incubado las placas petri para el crecimiento de bacterias, se realizaron las pruebas bioquímicas de una cepa Las pruebas bioquímicas que se utilizaron para la identificación de bacterias está constituida por las siguientes pruebas: Indol, Rojo de metilo, Voges-Proskauer, utilización de citrato, utilización de azúcares en TSI, prueba de descarboxilaxión/desaminación en LIA, utilización de malonato, producción de ureasa, prueba de motilidad en SIM. La metodología es de la siguiente manera: - Prueba del Indol: Se vierte aproximadamente 9 mL de agua peptonada al 0.1% a un tubo de ensayo, se realiza la siembra de bacterias con el ansa de siembra por el método por inoculación o agitación en el centro del medio liquido sin tocar las paredes del tubo. Se incuba por 48 horas, para la determinación se usa el reactivo de Kovacs, de 2 – 3 gotas. Si da color o anillo rojo es positivo a Indol. 31 - Prueba del Rojo de metilo (RM): Se utiliza el caldo rojo de metilo y voges-proskauer (RMVP), aproximadamente 9 mL en cada tubo de ensayo, se siembra mediante el método de enjuague (PUMAROLA, 1995); se incuba por 48 horas y como reactivo se adiciona el rojo de metilo de 2 -3 gotas, si da color rojo es positivo a RM. - Prueba de Voges-Proskauer (VP): Se vertió en el tubo de ensayo el caldo RMVP, se siembra mediante el método de enjuague y se incuba por 72 horas; como reactivo se utiliza hidróxido de sodio (NaOH) al 4% de 2 - 3 gotas y se adiciona el reactivo de alfa naftol de 2 – 3 gotas, esperar entre 10 a 20 minutos. Una coloración rosada indica positivo a VP. - Utilización del Citrato: Se vierte el agar Citrato de Simmons en los tubos de ensayo y se deja enfriar en modo inclinado para luego sembrar por el método de estrías. Pasada las 24 horas de incubación, el cambio a color azul indica reacción positiva. - Utilización de azúcares: Se vierte el medio TSI a 45 ºC hasta la tercera parte de los tubos de ensayo, se deja enfriar en pico de flauta, luego se siembra con puntura y estrías, se incuba a 37 ºC por 24 horas; el tipo de reacción positivo o negativo se conoce por el cambio de color: pico y fondo rojos son lactosa, sacarosa y glucosa negativos, pico amarillo y fondo rojo es lactosa y sacarosa positivos y glucosa negativo, pico amarillo y fondo amarillo lactosa, sacarosa y glucosa positivos, pico rojo y fono amarillo es lactosa y sacarosa negativos y glucosa positivo. Además se puede comprobar si hay presencia o no de gas en la 32 profundidad del tubo y en la zona de la picadura la presencia de una coloración negruzca si hay H2S. - Prueba de descarboxilación/desaminación: Se vierte el medio LIA a los tubos de ensayo a una temperatura de 45º C y se deja enfriar en pico de flauta, para proceder a sembrar la colonia de bacteria seleccionada mediante el método de puntura y estrías; la reacción se muestra mediante el cambio de color: pico y fondo violetas es positivo a descarboxilación, pico rojo y fondo amarillo es positivo a desaminación. - Utilización de malonato: Se vierte el caldo Malonato en los tubos de ensayo y se realiza la siembra por el método de enjuague, después de incubar por 24 horas se observa si hubo o no reacción, es positivo si cambia a color azul. - Producción de ureasa: Se distribuye el medio de Christiansen con úrea en tubos de ensayo, se siembra la colonia de bacterias por el método de puntura, al cabo de las 24 horas el cambio de color amarillo a rojizo nos dirá si hubo reacción positiva (KONEMAN, 1995). B. Hongos a) Microcultivo para hongos y coloración Para los microcultivos se procedió de la siguiente manera: Se esterilizaron las placas Petri conteniendo: un soporte de vidrio en forma de herradura, un porta y un cubre objeto. 33 Se preparó una placa Petri con medio agar de Sabouraud glucosa 4%, dividido en cubitos de aproximadamente 20 × 20 × 10 mm. Cada cubito se coloca sobre la porta objeto dentro de la placa de microcultivo y sobre la varilla de vidrio. De los cultivos aislados de hongos se eligió diferentes tipos de colonias por cada placa de microcultivo. Elegida la colonia de hongo, con la ayuda de un ansa micológica, se toma un inoculo de la misma y se traslada sobre el cubito de medio de sabouraud que se ha colocado sobre el porta objeto dentro de la placa de microcultivo. Se coloca el cubre sobre el cubito de agar, luego se pone dentro de la placa un algodón húmedo para asegurar la humedad y el crecimiento del hongo. La placa de microcultivo se lleva a incubación a temperatura ambiente por un tiempo de 5 – 7 días. Al término de la incubación, se retira suavemente con ayuda de una pinza el cubre objeto de la placa de microcultivo y se coloca sobre un porta objeto limpio y desengrasado al que ha colocado previamente 1 – 2 gotas de azul AMAN. Con la ayuda de papel secante, se absorbe el exceso de colorante. Se sellan los lados laterales con esmalte de uñas transparente. Luego se elimina el cubito de medio sabouraud llevándolo a un recipiente conteniendo lejía diluida al 10 %, retirar el porta de la placa de microcultivo y agregarle de 1 – 2 gotas de azul AMAN (Azul de Algodón mas Lactofenol), añadir un cubre limpio y desengrasado. Con papel secante, absorber el exceso de colorante. Sellar los lados laterales con esmalte de uñas transparente. 34 Las muestras obtenidas, se observaran al microscopio utilizando un lente ocular de 10x y un lente objetivo de 40x, así el aumento total será de 10x40 = 400 aumentos. 3.3.6. Toma de datos de Temperatura y Humedad Para las lecturas se utilizó termómetro e higrómetro digital los cuales se configuraba de 5 a 10 minutos para su estabilización dentro de los ambientes internos y externos. IV. 4.1. RESULTADOS Determinación de las condiciones ambientales en las seis áreas de estudio. En el primer muestreo se determinó que el mayor nivel de temperatura fue de 27.3 °C en el área del pabellón Gallito y el nivel más alto de humedad (78 %) en el área del módulo nuevo de la FRNR. En la figura 3 se muestran los resultados de temperatura y humedad de los ambientes muestreados. 77 76 80 78 75 71 69 70 60 50 40 30 25.6 24.6 25.7 27.3 P1 P2 P3 P4 23.9 25.3 P5 P6 20 10 0 T(ºC) 1° Muestreo H (%) 1°Muestreo Figura 2. Comparación de la temperatura y humedad en las seis áreas de muestreo. 36 En el segundo muestreo se obtuvo que el mayor nivel de temperatura fue de 32.5 °C en el área del pabellón central y el nivel más alto de humedad, de 69%, en el área del servicio higiénico y en la oficina administrativa de granja zootecnia En la figura 4 se muestran estos resultados. 69 69 60 67 66 70 63.5 55 50 40 32.5 32 32 29.5 30 28 28.5 20 10 0 P1 P2 P3 T(ºC)2° Muestreo Figura 3. P4 P5 P6 H (%)2° Muestreo Comparación de la temperatura y humedad en las seis áreas de muestreo en el segundo horario. 4.2. Identificación de microorganismos presentes en las seis áreas 4.2.1. Identificación de Bacterias En los cuadros 5 y 6 se presentan los resultados respecto a la presencia o ausencia de desarrollo colonial de bacterias en el interior de las áreas muestreadas. 37 Cuadro 5. Presencia de colonias de bacterias en cuatro diferentes medios de cultivos en el primer muestreo para su posterior identificación bioquímica. Medios de cultivos Punto de muestreo CLED McConkey CETRIMIDE Pabellón central Servicio higiénico Oficina administrativa de la Granja Zootecnista Pabellón B (gallito de la roca) Internado de mujeres Módulo nuevo de la F.R.N.R. +: desarrollaron colonias; Cuadro 6. MANITOL SALADO + + + - - + + + - - - + + + + - - + - - : no desarrollaron colonias Presencia de colonias de bacterias en cuatro diferentes medios de cultivos en el segundo muestreo para su posterior identificación bioquímica. Medios de cultivos Punto de muestreo Pabellón central Servicio higiénico Oficina administrativa de la Granja Zootecnista Pabellón B (gallito de la roca) Internado de mujeres Módulo nuevo de la F.R.N.R. + : desarrollaron colonias; CLED McConkey CETRIMIDE MANITOL SALADO + + - - + + + - - + + + + + - + + + - : no desarrollaron colonias En los cuadros 7 y 8 se señalan las bacterias identificadas morfológicamente por medio de la tinción de Gram. 38 Cuadro 7. Morfología de bacterias identificadas en los puntos de muestreo por el método de coloración GRAM en el primer muestreo. Medios de cultivo Punto de muestreo CLED MANITOL SALADO Pabellón central Cocobacilos (Gram-) Estafilococos (Gram+) Servicio higiénico Cocobacilos (Gram-) Estafilococos (Gram+) Oficina administrativa de la Granja Zootecnista Cocobacilos (Gram-) Pabellón B (gallito de la roca) Bacilos (Gram+) Internado de mujeres Cocobacilos (Gram-) Módulo nuevo de la F.R.N.R. Bacilos (Gram+) Cuadro 8. Estafilococos (Gram+) Morfología de bacterias identificadas en los puntos de muestreo por el método de coloración GRAM en el segundo muestreo. Punto de muestreo Medios de cultivo CLED MANITOL SALADO Pabellón central Cocobacilos (Gram-) Estafilococos (Gram+) Servicio higiénico Cocobacilos (Gram-) Estafilococos (Gram+) Cocobacilos (Gram-) Estafilococos (Gram+) Pabellón B (gallito de la roca) Cocobacilos (Gram-) Estafilococos (Gram+) Internado de mujeres Cocobacilos (Gram -) Estafilococos (Gram+) Módulo nuevo de la F.R.N.R. Cocobacilos (Gram -) Estafilococos (Gram +) Oficina administrativa de la Granja Zootecnia En los cuadro del 9 al 14 se reportan los resultados de las pruebas bioquímicas diferenciales señalándose los géneros de bacterias presente. 39 Cuadro 9. Resultados de pruebas bioquímicas en el área del pabellón central de la UNAS, en el primer y segundo muestreo. Prueba INDOL RM VP CS TSI (H2S) UREA SIM LIA(K/K:DESCARBOXILACION) LIA (R/A:DESAMINACION) MALONATO TSI (…/A: GAS de glucosa) TSI (A/…: LACTOSA) TSI (A/….SACAROSA) Género encontrado Cuadro 10. Primer muestreo Colonias 1.CLED 2.CLED McConkey + + + + + +/+ + + + + - Segundo muestreo CLED + + + + Enterobacter Escherichia Citrobacter Enterobacter Resultados de pruebas bioquímicas en el área del servicio higiénico de la UNAS, en el primer y segundo muestreo. Prueba INDOL RM VP CS TSI (H2S) UREA SIM LIA(K/K:DESCARBOXILACION) LIA (R/A:DESAMINACION) MALONATO TSI (…/A: GAS de glucosa) TSI (A/…: LACTOSA) TSI (A/….SACAROSA) Género encontrada Primer muestreo CLED + + + + Escherichia sp Segundo muestreo CLED + + + + + Citrobacter 40 Cuadro 11. Resultados de pruebas bioquímicas en el área de la Oficina administrativa de la Granja Zootecnia en la UNAS, en el primer y segundo muestreo. Prueba INDOL RM VP CS TSI (H2S) UREA SIM LIA(K/K:DESCARBOXILACION) LIA (R/A:DESAMINACION) MALONATO TSI (…/A: GAS de glucosa) TSI (A/…: LACTOSA) TSI (A/….SACAROSA) Género encontrado Cuadro 12. Primer muestreo CLED + + + + Enterobacter Segundo muestreo Mac Conkey + + + + Enterobacter Resultados de pruebas bioquímicas en el área del pabellón gallitos de la UNAS, en el primer y segundo muestreo. Prueba INDOL RM VP CS TSI (H2S) UREA SIM LIA(K/K:DESCARBOXILACION) LIA (R/A:DESAMINACION) MALONATO TSI (…/A: GAS de glucosa) TSI (A/…: LACTOSA) TSI (A/….SACAROSA) Género encontrado Primer muestreo CLED + + +/+ Enterobacter Segundo muestreo McConkey + + + Enterobacter 41 Cuadro 13. Resultados de pruebas bioquímicas en el área del internado de mujeres de la UNAS, en el primer y segundo muestreo. Prueba Primer muestreo CLED INDOL RM + VP CS TSI (H2S) UREA SIM LIA(K/K:DESCARBOXILACION) LIA (R/A:DESAMINACION) + MALONATO TSI (…/A: GAS de glucosa) TSI (A/…: LACTOSA) + TSI (A/….SACAROSA) + Género encontrado Enterobacter Cuadro 14. CLED + + + + Klebsiella Segundo muestreo McConkey CLED + + + + + + + Escherichia Enterobacter Resultados de pruebas bioquímicas en el área del módulo nuevo de la FRNR de la UNAS, en el primer y segundo muestreo. Primer muestreo Segundo muestreo CLED CLED CLED McConkey INDOL RM + + VP + + CS + + + TSI (H2S) UREA SIM + LIA(K/K:DESCARBOXILACION) + + LIA (R/A:DESAMINACION) + MALONATO + TSI (…/A: GAS de glucosa) TSI (A/…: LACTOSA) + + TSI (A/….SACAROSA) + + + Género encontrado Enterobacter Klebsiella Arizona Enterobacter Prueba 42 4.2.2. Identificación de Hongos En los cuadros 15 y 16 se presentan los resultados respecto a la presencia o ausencia de desarrollo colonial de hongos en el interior de las áreas muestreadas. Cuadro 15. Selección de colonias fúngicas para su identificación en microcultivo en el primer muestreo. Medios de cultivo Área muestreada AS PDA Pabellón central + + Servicio higiénico + + Oficina administrativa de la Granja Zootecnia + + Pabellón B (gallito de la roca) + + Internado de mujeres + + Módulo nuevo de la F.R.N.R. + + +: desarrollaron colonias; Cuadro 16. - : no desarrollaron colonias Selección de colonias fúngicas para su identificación en microcultivo en el segundo muestreo. Medios de cultivo Área muestreada AS PDA Pabellón central + + Servicio higiénico + + Oficina administrativa de la Granja Zootecnia + + Pabellón B (gallito de la roca) + + Internado de mujeres + - Módulo nuevo de la F.R.N.R. + + +: desarrollaron colonias; - : no desarrollaron colonias 43 En los cuadros 17 y 18 se indican los resultados de la identificación morfológica de los hongos a partir de los microcultivos realizados. Cuadro 17. Hongos identificados en los puntos de muestreo por el método de coloración simple en el primer muestreo. Primer muestreo Punto de muestreo Hongos encontrados Pabellón central Geotrichum sp. Trichophyton sp Monilia sp. Servicio higiénico Aspergillus sp. Trichophyton sp Monilia sp. Oficina administrativa de la Granja Zootecnista Geotrichum sp. Aspergillus sp. Pabellón B (gallito de la roca) Penicillium sp. Blastomyces sp. Internado de mujeres Rizophos sp, Monilia sp. Módulo nuevo de la F.R.N.R. Penicillium sp. Monilia sp Geotrichum sp. Cuadro 18. Hongos identificados en los puntos de muestreo por el método de coloración simple en el segundo muestreo. Punto de muestreo segundo muestreo Hongos encontrados Pabellón central Monilia sp. Aspergillus sp. Servicio higiénico Monilia sp. Aspergillus sp. Oficina administrativa de la Granja Zootecnista Aspergillus sp. Penicillium sp. Pabellón B (gallito de la roca) Rizophos sp Internado de mujeres Rizophos sp Módulo nuevo de la F.R.N.R. Aspergillus sp. Monilia sp. Monilia sp. V. DISCUSIÓN Los géneros encontrados en el aire del interior de los ambientes muestreados de la UNAS, pertenecen a las de enterobacterias, que comúnmente se encuentran en las materias residuales de los seres vivos (heces), y tienen un promedio de temperatura óptima que está dentro del rango denominado mesófila, es decir de 20 °C hasta un poco más de 40 °C, y necesitan de una humedad relativa ideal para su desarrollo a partir de 60 % (OMS,2011), y como podemos observar en los resultados, la temperatura en la práctica ejecutada varió de 23.9 °C a 27.3 °C y la humedad registrada de 69 % a 78 % durante el primer muestreo, y la temperatura se incrementó entre 28.5 a 32.5 con una humedad de 55 a 69 % durante el segundo muestreo, indicándonos que los géneros aislados encontraron en dichas áreas las condiciones óptimas para su desarrollo en las superficies de esos ambientes y su presencia en el aire de los mismos. Refiriéndonos a los hongos, se advierte en la literatura que están considerados como los organismos más extremófilos dentro de los mesófilos, debido a que pueden desarrollar entre temperaturas que van desde las cercanas a 0 °C hasta pasados los 40 °C y con una humedad relativa que puede variar desde 45 % hasta más del 80 % (PUMAROLA, 1995). Las condiciones que presentan las instalaciones de la UNAS muestreadas en su 45 aire interior favorecen el desarrollo de los hongos, presentándose incluso géneros que podrían proceder de las áreas del exterior con vegetación o de residuos orgánicos. La diferencia de la presencia de los géneros de hongos entre el primer y segundo muestreo se debe a que las esporas de los microorganismos pueden variar como partículas contenidas en el aire de acuerdo a la velocidad del viento, la condición de humedad y temperatura y asimismo a la esporulación de individuos presentes sobre la vegetación aledaña o sobre la superficie de animales o vestimenta de las personas que concurren a dichos ambientes (EPA, 2012 y KONEMAN, 2006) La presencia de los géneros bacterianos y de hongos en el interior de los ambientes analizados de la UNAS, nos permiten asumir que ese ambiente interior es de mala calidad y que podría constituir en un riesgo para la salud de las personas que normalmente se ubican en dichos lugares, concordando con lo anotado por la OMS (2004) en el sentido que considerando a los microorganismos como contaminantes atmosféricos, concentraciones aún bajas de éstos se relacionan con efectos adversos para la salud. Asimismo, la EPA (2012) explica la contaminación interior biológica y los efectos en la salud de los contaminantes biológicos y cómo controlar su crecimiento y acumulación mencionando que un tercio de todas las estructuras tienen condiciones de humedad que pueden alentar el desarrollo de contaminantes como el moho y las bacterias, que pueden causar reacciones alérgicas, incluyendo el asma, y transmitir enfermedades infecciosas. Las 46 condiciones ambientales climatológicas de la zona donde se ubica la UNAS manifiesta las condiciones ideales de temperatura y humedad relativa que condicionan favorablemente la presencia de estos microorganismos en el aire. Se deben tomar las medidas correctivas para lograr el control de la humedad y la limpieza, de los interiores como es la utilización de humificadores y sistemas de aire acondicionado los que a su vez deberían ser mantenidos constantemente (EPA, 2012). Aún no están estipulados estándares o límites permisibles respecto a la calidad del aire de exteriores e interiores considerando la contaminación biológica ni de material particulado (PM2.4, PM10, etc.) solo se han oficializado estándares sobre gases tóxicos. Desde este punto de vista hay mucho que realizar respecto a las normas en nuestro país que aseguren una óptima calidad del aire respirable en los interiores de los edificios en general. VI. CONCLUSIÓN 1. Se logró determinar las condiciones ambientales en los seis ambientes muestreados; obteniéndose una temperatura promedio que va desde 25.5°C a los 30.6°C y la humedad promedio va desde los 65.8 a 75.0 %. 2. Las Bacterias que se logró aislar y caracterizar dentro de las seis áreas mediante la tinción de Gram: estafilococos, cocobacilo y bacilos y mediante las pruebas bioquímicas: Enterobacter sp, Escherichia sp, Citrobacter sp, Bacillus sp, Klebsiella y Arizona. 3. Los Hongos que se lograron aislar y caractrizar dentro de las seis áreas muestreadas fueron: Geotrichum sp, Trichophyton sp, Monilia sp, Aspergillus sp, Penicillium sp, Blastomyces sp y Rizophos sp VII. RECOMENDACIONES 1. Realizar la enumeración de los microorganismos presentes en el aire y compararlos con los límites establecidos para el aire de interiores, para comprobar si existe contaminación en los ambientes muestreados. 2. Para una rápida identificación de bacterias el uso de un microscopio de fluorescente da una mejor visión de bacterias Gram + color naranjas y Gram - color verdes 3. De acuerdo a los resultados obtenidos se recomienda usar otros medios diferentes a los evaluados con el objeto de comprobar la presencia de los géneros encontrados. 4. A partir de este estudio se recomienda realizar nuevos muestreos e investigaciones, en la búsqueda de otros posibles puntos de contaminación. 5. Se hace necesario un seguimiento más completo en el que incluya planes de seguimiento, evaluación y seguimiento periódicos de análisis microbiológicos, con el objeto de verificar la contaminación microbiológica en el lugar. VIII. REFERENCIAS BIBLIOGRAFICAS ATLAS, R. & BARTHA, R. 2002. Ecología microbiana y microbiología ambiental. Pearson Educación, Madrid BENENSON, A. S. 1997.Manual para el control de las enfermedades transmisibles.16º Edic. Edit.Organización Panamericana de la Salud, Washington. BOVALLIUS, A., BUTCH, B., ROFFEY, R., ANAS, P. 1978. three-year investigationof the natural airborne bacterial flora at four locations inSweden».Applied and Environmental Microbiology. 35:847-852. CARRILLO, L. s.l.,s.d. Los hongos de los alimentos y forrajes. P 61. COLLINS, C.H. 1995. Métodos Microbiológicos, Edit. Acribia S.A., España. COLLINS, C.H., LYNE, P. 1989. Métodos Microbiológicos, Edit. Acribia S.A., España. 523 p. DE LA ROSA, M.C., Mosso, M.A. &Ullán, C.2002. El aire: hábitatymediodetransmisióndemicroorganismos.Observatorio Medioambiental.5, 375-402. EPA, 2012, Introducción a la calidad del aire interior, United States Environmental Protection Agency. En línea: http://www.epa.gov/iaq/biologic.html, 21 de setiembre de 2014 FORBES, B. 2009. Diagnóstico microbiológico. Edit. Médica Panamericada. 1160 p. 50 GREGORY, P. H. 1973. The microbiology of the atmosphere. Edit JohnWilley andSons.New York. KONEMAN, E. ALLEN, S. 2006. Diagnóstico microbiológico: texto y atlas en color. 6 ed. Editorial Médica Panamericana. Madrid, España. LIDWELL, O. M. 1990. The microbiology of air». En: Linton, A. and Dick, H. M. (ed). Topley and Wilson’s. Principles of bacteriology, virology and inmunity, I. 8ºEdic. Edit.Edward Arnold. London MANDELL, G., BENNETT, J., DOLIN, R. 2006. Enfermedades infecciosas. Elsevier, España. MOHR, A. J. 1997. Fate and transport of microorganisms in air». En: Hurst, C. J. etal. (ed). Manual of environmental microbiology.Ed. American Society for Microbiology. Washington. OMS 2004. Guias de la Calidad del Aire. OPS/CEPIS/PUB/04.110, Traducción realizada por el Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente (CEPIS/OPS), Agencia especializada de la Organización Panamericana de la Salud (OPS/OMS), Lima, Perú OMS 2011. Calidad del Aire y Salud, Organismo Mundial de la Salud (OMS), Organización de las Naciones Unidas (ONU), Nota descriptiva 313, Setiembre 2011, Ginebra, Suiza. OSMAN. 2011. Calidad del aire interior: Observatorio de salud y medio ambiente de Andalucia. Europa. PASCUAL, M., CALDERON, V. 2000. MicrobiologíaAlimentaria: Metodología Analítica para Alimentos y Bebidas. Ed. Díaz de Santos. 441 p. PASTOR, P. 2010. Microbiología del aire. Editorial Velázquez. Madrid, 51 España. POTTS, M. 1994. Desiccation tolerance of prokaryotes.MicrobiologicalReviews. Páginas 58: 755 - 805. PUMAROLA, A., RODRÍGUEZ-TORRES, A., GARCÍA-RODRÍGUEZ, J.A. Y PIÉDROLA-ANGULO, G. 1995. Microbiología y Parasitología, 2ª ed. Masson-Salvat., España. RODRIGUEZ, E. GAMBOA C., HERNANDEZ CH., F. GARCIA H. 2006 Bacteriología general: Principios y prácticas de laboratorio. Editorial de la universidad de costa Rica, casa del libro, San Jose. Costa Rica. ROMERO, R. 2007. Microbiología y parasitología humana. Ed. Médica Panamericana. México. 1802 p. ROJAS M. A., 2010. Pruebas bioquímicas. Universidad Nacional Autónoma de México. Facultad de estudios superiores Zaragoza. Laboratorio de microbiología. México. 1651 p. ROMERO, R. 2007. Microbiología y parasitología humana. Ed. Médica Panamericana. México. 1802 p. SORIANO, J. 2007. Micotoxinas en alimentos. Ediciones Díaz de Santos. 396 p. UNDERWOOD, E. 1992. Ecology of microorganisms as it affects thepharmaceutical industry». En: Hugo, W. B. And Russell, A. D. (ed).Pharmaceuticalmicrobiology.5ºEdic.Edit.BlackwellScientificPublic ation. London. Yang C.H. and Johanning E.: 1997, Airborne fungi and mycotoxins: Manual of Environmental Microbiology. ASM Press, Washington, pp. 651–660. IX. ANEXOS Anexo A. cuadros Cuadro 19. Temperaturas y Humedad Relativa de los puntos de muestreo. Puntos de Muestreo P1 P2 P3 P4 P5 P6 Promedios FUENTE: Elaboración propia primer muestreo 10 am T(◦C) 25,6 24,6 25,7 27,3 23,9 25,3 25,5 H (%) 69 76 77 71 75 78 75,0 segundo muestreo 12 pm T(◦C) 32,5 32 32 29,5 28 28,5 30,6 H (%) 55 69 69 66 67 63,5 65,8 53 Anexo B. Panel fotográficos Figura 3. Medios de cultivo con crecimiento de Hongos después de su incubación. Figura 4. Siembra de hongos en Agar Sabouraud y en PDA, para su identificación. 54 Figura 5. Bacteria: Enterobacter hafniae como resultado de las pruebas Bioquímicas en medio CLED, del primer muestreo en el módulo nuevo de la FRNR. Figura 6. Bacteria: Arizona como resultado de las pruebas Bioquímicas en medio CLED, del segundo muestreo en el módulo nuevo de la FRNR. 55 Figura 7. Bacteria: Escherichia atípica como resultado de las pruebas Bioquímicas en medio CLED, del primer muestreo en el área del servicio higiénico de la UNAS Figura 8. Bacteria: Enterobactere como resultado de las pruebas Bioquímicas en medio Mac Conkey, del segundo muestreo en Oficina administrativa de la Granja Zootecnia en la UNAS 56 Figura 9. Colonias de Aspergillus sp en medio PDA en la Oficina administrativa de la Granja Zootecnista Figura 10. Presencia de Estafilococos en medio CLED en el área de muestreo Módulo nuevo de la F.R.N.R. 57 Figura 11. Presencia de Bacilos en medio CLED en el área de muestreo de Pabellón B (gallito de la roca) Figura 12. Observación en microscopio de Aspergillus sp 58 Figura 13. Observación en el microscopio de Penicillium sp. UNIVERSIDAD NACIONAL AGRARIA DE LA SELVA FACULTAD DE RECURSOS NATURALES RENOVABLES DEPARTAMENTO ACADEMICO DE CIENCIAS AMBIENTALES PRÁCTICA PRE PROFESIONAL BACTERIAS Y HONGOS EN EL AIRE INTERIOR DE SEIS AREAS DE LA UNIVERSIDAD NACIONAL AGRARIA DE LA SELVA EJECUTORA : LÓPEZ MOSCOSO, Bárbara Kíara ASESOR : Ing. BETETA ALVARADO, Víctor Manuel FECHA DE INICIO : 15 de enero FECHA DE TÉRMINO : 15 de abril LUGAR DE EJECUCIÓN : Laboratorio de Microbiología de la Universidad Nacional Agraria de la Selva. TINGO MARÍA – PERÚ 2014 ÍNDICE I. INTRODUCCIÓN ..................................................................................... 1 1.1. OBJETIVOS ............................................................................................ 3 1.1.1. Objetivo General............................................................................. 3 1.1.2. Objetivo específicos ....................................................................... 3 II. REVISIÓN BIBLIOGRÁFICA ................................................................... 4 2.1. Calidad del aire en interiores ................................................................... 4 2.2. Seguimiento y evaluación de la calidad del aire ...................................... 6 2.3. Gestión de la calidad del aire en interiores .............................................. 8 2.4. Fuentes de contaminantes del aire .......................................................... 8 2.5. Microorganismos en el aire...................................................................... 9 2.5.1. Tipos de microorganismos ........................................................... 10 2.6. Factores ambientales que intervienen en el desarrollo de las bacterias y hongos microorganismos en el aire ....................................................... 16 2.6.1. Humedad relativa......................................................................... 17 2.6.2. Temperatura ................................................................................ 18 2.7. Agentes patógenos del aire .................................................................... 18 2.8. Enfermedades transmitidas por el aire.................................................... 19 III. MATERIALES Y MÉTODOS ................................................................. 23 3.1. Lugar de ejecución ................................................................................ 23 3.1.1. Ubicación Política ......................................................................... 23 61 3.1.2. Ubicación Geográfica ................................................................... 24 3.1.3. Clima ............................................................................................ 24 3.2. Materiales y equipos .............................................................................. 24 3.2.1. Materiales ..................................................................................... 24 3.3. Metodología ........................................................................................... 26 3.3.1. Preparado de medios de cultivo ................................................... 26 3.3.2. Muestreo de aire en los puntos establecidos ............................... 27 3.3.3. Aislamiento de microorganismos .................................................. 28 3.3.4. Identificación de microorganismos ............................................... 29 3.3.5. Toma de datos de Temperatura y Humedad ................................ 34 IV. RESULTADOS ...................................................................................... 35 4.1. Determinación de las condiciones ambientales en las seis áreas de estudio. .................................................................................................. 35 4.2. Identificación de microorganismos presentes en las seis áreas ............ 36 4.2.1. Identificación de Bacterias ............................................................ 36 4.2.2. Identificación de Hongos .............................................................. 42 V. DISCUSIÓN........................................................................................... 44 VI. CONCLUSIÓN ....................................................................................... 47 VII. RECOMENDACIONES.......................................................................... 48 VIII. REFERENCIAS BIBLIOGRAFICAS ...................................................... 49 IX. ANEXOS................................................................................................ 52 ÍNDICE DE CUADROS Cuadro 1. Enfermedades bacterianas transmitidas por el aire................. 20 Cuadro 2. Enfermedades fúngicas Transmitidas por el aire..................... 22 Cuadro 3. Ubicación geográfica de los puntos de muestreo. .................. 24 Cuadro 4. Códigos establecidos para cada lugar de muestreo dentro de ...... la UNAS. ....................................................................................... 27 Cuadro 5. Presencia de colonias de bacterias en cuatro diferentes ...... medios de cultivos en el primer muestreo para su posterior ...... identificación bioquímica. .......................................................... 37 Cuadro 6. Presencia de colonias de bacterias en cuatro diferentes .... medios de cultivos en el segundo muestreo para su posterior ...... identificación bioquímica. .......................................................... 37 Cuadro 7. Morfología de bacterias identificadas en los puntos de ..... muestreo por el método de coloración GRAM en el ..... primer muestreo. ........................................................................ 38 Cuadro 8. Morfología de bacterias identificadas en los puntos de ...... muestreo por el método de coloración GRAM en el ....... segundo muestreo. ..................................................................... 38 Cuadro 9. Resultados de pruebas bioquímicas en el área del pabellón ....... central de la UNAS, en el primer y segundo muestreo. ................ 39 Cuadro 10. Resultados de pruebas bioquímicas en el área del .......... servicio higiénico de la UNAS, en el primer y segundo .......... muestreo. .................................................................................. 39 63 Cuadro 11. Resultados de pruebas bioquímicas en el área de la .......... Oficina administrativa de la Granja Zootecnia en la UNAS, ........ en el primer y segundo muestreo. ........................................ 40 Cuadro 12. Resultados de pruebas bioquímicas en el área del pabellón ........ gallitos de la UNAS, en el primer y segundo muestreo. .... 40 Cuadro 13. Resultados de pruebas bioquímicas en el área del internado ....... de mujeres de la UNAS, en el primer y segundo muestreo....... 41 Cuadro 14. Resultados de pruebas bioquímicas en el área del módulo .......... nuevo de la FRNR de la UNAS, en el primer y segundo ........... muestreo. .................................................................................. 41 Cuadro 15. Selección de colonias fúngicas para su identificación ........... en microcultivo en el primer muestreo.................................. 42 Cuadro 16. Selección de colonias fúngicas para su identificación en .......... microcultivo en el segundo muestreo. ................................... 42 Cuadro 17. Hongos identificados en los puntos de muestreo por el ......... método de coloracion simple en el simple en el primer ..muestreo . ................................................................................................. 43 Cuadro 18. Hongos identificados en los puntos de muestreo por el método de coloración simple en el segundo muestreo. ................................................ 43 Cuadro 19. Temperaturas y Humedad Relativa de los puntos de muestreo.52
© Copyright 2026