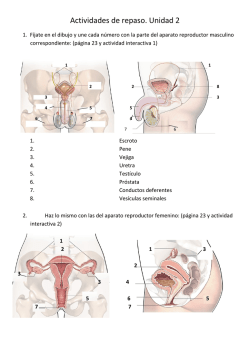
TITULACIÓN POR ACTIVIDAD DE APOYO A LA DOCENCIA
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN “MANUAL DE PRÁCTICAS DE LABORATORIO REPRODUCCIÓN E INSEMINACIÓN ARTIFICIAL” DE TITULACIÓN POR ACTIVIDAD DE APOYO A LA DOCENCIA QUE PARA OBTENER EL TITULO DE: MEDICA VETERINARIA ZOOTECNISTA P E N R ALICIA S E T A: ALCANTAR RODRÍGUEZ ASESOR: MC. ROSALBA SOTO GONZÁLEZ COASESOR : PhD. JOSÉ ALFREDO MEDRANO HERNÁNDEZ CUAUTITLÁN IZCALLI, ESTADO DE MÉXICO. 2008 1 DEDICATORIAS Es difícil dedicar este trabajo, comienzas a pensar a quien y por que, por lo que empezare de acuerdo al orden en que aparecieron en mi vida o yo en la vida de ustedes. A mi madre por darme la vida y apoyarme en medida de sus posibilidades, Elena por ser como mi segunda madre, Laura gracias por tu ternura y bondad para mi y los demás, Amanda mi t'suma la mas pequeña, akit paskiyan, hermanas las amo, a mis hermanos Juan y Pepe. A mis sobrinos, Víctor y Anita, espero darles un ejemplo para que sepan que se puede ser alguien, a pesar de muchas adversidades, los quiero. A mi amada FES Cuautitlán, por darme un lugar para mi formación y superación. A mi Alfonso, gracias por estar en mi vida, le has dado sentido, y sobre todo por tu gran apoyo, te amo, y a ti el mas grande tesoro de toda mi vida a la que soñé, añore y espere con todo mi corazón, Sofía, hija mía te amo. A todos mis amigos, Marisol, Erendira, Lydia, Alejandro, Hugo, Samuel, Carlos, Paulo, Martín, Mario y Oscar, gracias por ser mis cómplices en esta maravillosa aventura. Señora Bego, gracias por su apoyo y por formar al hombre que hoy es mi compañero. Admiro la fortaleza de una mujer, que sola lo logro. Juan Manuel y Lorenzo mis cuñados, por ser ya parte de mi familia, los quiero. Con amor Ale. 2 INDICE Practica I. Anatomía del aparato reproductor de los machos domésticos. 1 Práctica II. Anatomía de aparato reproductor de las hembras domésticas. 17 Practica III. Anatomía del aparato reproductor de machos y hembras. Práctica en vivo. (Bovino) 30 Practica IV. Identificación de las estructuras ováricas en las diferentes especies domésticas e identificación de ovocitos. 38 Práctica V. Endocrinología de la reproducción. Principales productos hormonales y su aplicación en las diversas especies domésticas. 47 Práctica VI. Endocrinología. Evaluación de la respuesta superovulatoria en ratas púberes tras la aplicación de Gonadotropina Coriónica equina (eCG). 56 Práctica VII. Citología vaginal en perras. 61 Práctica VIII. Diagnóstico de gestación por ultrasonido en ovinos, caprinos y caninos. 72 Práctica IX. Diagnóstico de gestación, por el método de palpación rectal en vacas. 81 Práctica X. Diagnóstico de gestación por ultrasonido en vacas. 87 Practica XI. Identificación de los diferentes tipos de placentas en las especies domésticas. 94 Práctica XII. Estudio de pelvimetría estática fetal, maniobras obstétricas. 105 Práctica XIII. Técnica de recolección de semen en bovinos, ovinos, caninos 114 y verracos. Práctica XIV. Técnica de evaluación de semen en ovinos. 123 Práctica XV. Técnicas de conservación de semen. Preparación de diluyentes. 133 Práctica XVI. Técnica de congelación de semen. 140 3 Práctica XVII. Técnica de Inseminación artificial en rumiantes. 148 Práctica XVIII. Recuperación, evaluación, clasificación y manipulación de embriones. 154 Práctica XIX. Transferencia de embriones. 163 170 REFERENCIAS 4 INDICE DE FIGURAS Figura 1. Anatomía de aparato reproductor del toro. 7 Figura 2. Anatomía del aparato reproductor del verraco. 8 Figura 3. Anatomía del aparato reproductor del garañón. 9 Figura 4. Anatomía del aparato reproductor del perro 10 Figura 5. Anatomía del aparato reproductor del gato. 11 Figura 6. Anatomía del aparato reproductor del carnero 12 Figura 7. Anatomía del pene en las diferentes especies domésticas 13 Figura 8. Aparato reproductor de la vaca. 21 Figura 9. Aparato reproductor de la yegua 22 Figura 10. Aparato reproductor de la cerda 23 Figura 11. Aparato reproductor de la perra 24 Figura 12. Aparato Reproductor de la coneja 25 Figura 13. Aparato Reproductor de la oveja y la cabra 26 Figura 14. Palpación de aparato reproductor de la vaca 32 Figura 15. Medición de circunferencia testicular 34 Figura 16. Estructuras ováricas. 41 Figura. 17. Técnica de recolección de ovocitos. 43 Figura 18. Aplicación de Gonadotropina Coriónica Equina (eCG) en ratas púberes. Figura 19. Colocación del hisopo para obtener la muestra de mucosa vaginal. Figura 20. Ecógrafo de tiempo real. 58 Figura 21. Tipos de transductores. Transabdominal y transrectal. 73 Figura 22. Esquema que muestra la colocación adecuada del transductor y fotografía que muestra la presencia de placentomas en una oveja. Figura 23. Introducción de la mano en el recto de la vaca. 77 Figura 24. Emisión y recepción de ondas de ultrasonido desde un transductor hacia los órganos reproductivos de la vaca. Figura 25. Clasificación anatómica de las diferentes placentas. 90 Figura 26. Clasificación histológica de los diferentes tipos de placenta. Figura 27. Presentación del producto antes del parto. Figura 28. Disposición normal del feto al momento del parto. Figura 29. Presentación anterior con posición dorsal y postura de miembro anterior flexionado 99 67 73 83 96 106 108 109 5 Figura 30. Presentación anterior con posición dorsal y postura de miembros anteriores flexionados Figura 31. Presentación transversal con posición lateral y postura de miembros extendidos. Figura 32. Presentación anterior con posición ventral y postura de miembro derecho flexionado. Figura 33. Presentación anterior con posición dorsal y postura de flexión de cabeza Figura 34. Presentación anterior con posición dorsal y postura de flexión dorsal de cabeza y cuello (hacia arriba). Figura 35. Presentación posterior con posición dorsal y postura de miembros flexionados (Perro sentado) Figura 36. Presentación transverso-dorsal. Figura 37. Vagina artificial para la recogida del semen de toro. Figura 38. Vagina artificial para ovinos. Figura 39. Recolección de semen de verraco Figura 40. Esquema comparativo de vivos y muertos con tinción de Eosina-Nigrosina. Figura 41. Cámara de Neubauer. Figura 42. Pajilla de envasado. Figura 43. Termo de nitrógeno liquido. Figura 44. Técnica de Inseminación Artificial en vacas. Figura 45. Forma de depositar el semen en el cuerpo del útero. Figura 46. Técnica de Inseminación Artificial en ovejas y cabras. 109 109 109 110 110 110 110 115 116 117 127 128 141 142 150 151 151 6 INDICE DE FIGURAS Figura 1. Anatomía de aparato reproductor del toro. 7 Figura 2. Anatomía del aparato reproductor del verraco. 8 Figura 3. Anatomía del aparato reproductor del garañón. 9 Figura 4. Anatomía del aparato reproductor del perro 10 Figura 5. Anatomía del aparato reproductor del gato. 11 Figura 6. Anatomía del aparato reproductor del carnero 12 Figura 7. Anatomía del pene en las diferentes especies domésticas 13 Figura 8. Aparato reproductor de la vaca. 21 Figura 9. Aparato reproductor de la yegua 22 Figura 10. Aparato reproductor de la cerda 23 Figura 11. Aparato reproductor de la perra 24 Figura 12. Aparato Reproductor de la coneja 25 Figura 13. Aparato Reproductor de la oveja y la cabra 26 Figura 14. Palpación de aparato reproductor de la vaca 32 Figura 15. Medición de circunferencia testicular 34 Figura 16. Estructuras ováricas. 41 Figura. 17. Técnica de recolección de ovocitos. 43 Figura 18. Aplicación de Gonadotropina Coriónica Equina (eCG) en ratas púberes. Figura 19. Colocación del hisopo para obtener la muestra de mucosa vaginal. Figura 20. Ecógrafo de tiempo real. 58 Figura 21. Tipos de transductores. Transabdominal y transrectal. 73 Figura 22. Esquema que muestra la colocación adecuada del transductor y fotografía que muestra la presencia de placentomas en una oveja. Figura 23. Introducción de la mano en el recto de la vaca. 77 Figura 24. Emisión y recepción de ondas de ultrasonido desde un transductor hacia los órganos reproductivos de la vaca. Figura 25. Clasificación anatómica de las diferentes placentas. 90 67 73 83 96 7 Figura Descripció Incineració Colocar Disección Depositar Fin de18. la en eCG SSF nen Aplicación de bolsas del las el Práctica n estructuras de recipiente amarillas material Gonadotro el rojo material los ováricas Biológico pina biológico desechos Coriónica punzo Equina cortantes (eCG) en ratas púberes. Figura 26. Clasificación histológica de los diferentes tipos de placenta. Figura 27. Presentación del producto antes del parto. Figura 28. Disposición normal del feto al momento del parto. Figura 29. Presentación anterior con posición dorsal y postura de miembro anterior flexionado Figura 30. Presentación anterior con posición dorsal y postura de miembros anteriores flexionados Figura 31. Presentación transversal con posición lateral y postura de miembros extendidos. Figura 32. Presentación anterior con posición ventral y postura de miembro derecho flexionado. Figura 33. Presentación anterior con posición dorsal y postura de flexión de cabeza Figura 34. Presentación anterior con posición dorsal y postura de flexión dorsal de cabeza y cuello (hacia arriba). Figura 35. Presentación posterior con posición dorsal y postura de miembros flexionados (Perro sentado) Figura 36. Presentación transverso-dorsal. Figura 37. Vagina artificial para la recogida del semen de toro. Figura 38. Vagina artificial para ovinos. Figura 39. Recolección de semen de verraco Figura 40. Esquema comparativo de vivos y muertos con tinción de Eosina-Nigrosina. Figura 41. Cámara de Neubauer. Figura 42. Pajilla de envasado. Figura 43. Termo de nitrógeno liquido. Figura 44. Técnica de Inseminación Artificial en vacas. Figura 45. Forma de depositar el semen en el cuerpo del útero. Figura 46. Técnica de Inseminación Artificial en ovejas y cabras. 99 106 108 109 109 109 109 110 110 110 110 115 116 117 127 128 141 142 150 151 151 8 INDICE DE CUADROS. Cuadro 1.Tamaño testicular aceptable en toros. Cuadro 2. Tipos celulares que pueden aparecer en un frotis vaginal. Cuadro 3. Calificación de motilidad masal. Cuadro 4. Tasa de dilución para la elaboración de diluyente. Cuadro 5. Diferentes estadios del desarrollo embrionario. 9 Práctica I. Anatomía del aparato reproductor de los machos domésticos. Duración: 4 horas. OBJETIVO. Que el alumno adquiera la capacidad de reconocer las diferentes estructuras del aparato reproductor del macho, así como las glándulas sexuales accesorias del aparato genital normal de macho. GENERALIDADES. El aparato reproductor de los machos domésticos esta integrado por dos gónadas, los epidídimos, los conductos deferentes, el pene y el prepucio, así como glándulas sexuales accesorias que forman el plasma seminal, importante para la viabilidad de los gametos masculinos (Climent, 2005; Páramo, 2006). ESCROTO. Es un saco cutáneo de tamaño, forma y situación que se adapta a los testículos que contiene. La piel del escroto es fina, plegable y casi sin pelo. Inmediatamente por debajo de la capa externa cutánea se encuentra otra de tejido fibroelástico, llamada túnica Dartos que pasa en el plano medio entre los dos testículos, de modo que el saco escrotal está dividido en dos departamentos. Se encuentran 2 capas más, la primera es la túnica vaginal común (parietal) localizada en la parte interna de la aponeurosis profunda del escroto y la túnica vaginal propia (visceral) muy ligada al testículo (Peter, 1976; Fradson, 1992). TESTÍCULOS. Son órganos pares, productores de espermatozoides y de hormonas masculinas, situados en el escroto, su forma es oval; en los rumiantes son alargados, en carnívoros esferoideos. Dada su forma oval presenta dos polos, el que se relaciona con la cabeza del epidídimo se denomina polo capital, el opuesto se relaciona con la cola y es el polo caudado. Tienen un borde epididimario y un borde libre, además de contar con dos 10 caras, lateral y medial. Dentro del escroto, la orientación del testículo varia con las especies, de forma que su polo caudado se encuentra ventralmente en rumiantes, caudalmente en el garañón y carnívoros (perro y gato); En el verraco apuntan dorsalmente (Asdown, 2000; Villar, 2004). EPIDÍDIMO. Consta de cabeza, cuerpo y cola. Su cola se une al polo caudado por el ligamento propio del testículo. La situación del epidídimo varía en las distintas especies: en el garañón, verraco y carnívoros se sitúa craneodorsalmente respecto al testículo; en el toro coincide con la línea media en dos mitades iguales, en el morueco es muy caudal y en el macho cabrio ocupa una posición intermedia (Köing, 1979; Ashdown, 2000; Climent, 2005). CONDUCTOS DEFERENTES. Conectan la cola del epidídimo con la uretra pélvica. La pared de la última porción de los conductos deferentes se engruesa por la presencia de glándulas ramificadas que constituye las ampollas. Pueden presentar dilataciones laterales de su luz denominadas divertículos de la ampolla. Pasada la ampolla, los conductos se adelgazan y en el garañón y rumiantes se unen al conducto excretor de las glándulas vesiculares, formando un conducto común denominado conducto eyaculador que desemboca en los orificios eyaculadores. La última porción del conducto deferente perfora la próstata en todas las especies (Köing, 1979; Dyce, 1999). GLÁNDULAS ACCESORIAS. Se agrupan alrededor de la uretra pélvica. Presentan variaciones según las especies. En el bovino, carnero, verraco, garañon, y caprino son: ámpulas, vesículas seminales, próstata y bulbouretrales. El gato carece de las vesículas seminales, en el perro solo hay próstata (Páramo, 2006). VESÍCULAS SEMINALES. Son pares y se sitúan dorsolateralmente al cuello de la vejiga, introduciéndose entre las dos hojas del pliegue genital pero lateralmente al conducto deferente. En el garañón 11 tienen el aspecto de bolsas largas y amplias; en rumiantes son compactas y de superficie lobulada, en el verraco son muy grandes y de forma piramidal. Los carnívoros carecen de vesículas seminales (Carvajal, 2000; Climent, 2005). PRÓSTATA. Existe en todos los animales, está íntimamente relacionada con la primera porción de la uretra. En los carnívoros presenta mayor tamaño relativo, decreciendo progresivamente en este orden: garañón, toro, verraco, pequeños rumiantes. Consta de un cuerpo y una porción diseminada. El primero consta de dos lóbulos, derecho e izquierdo (Dyce, 1999; Carvajal, 2000; Climent, 2005). GLANDULAS BULBOURETRALES. Son pares y se encuentran dorsalmente a la porción caudal de la uretra pélvica. Son pequeñas en el gato y están ausentes en el perro, en el verraco son cilíndricas y muy largas de aproximadamente 15cm; en el toro y el garañón son esféricas (Köing, 1979; Dyce, 1999). URETRA. La uretra es un conducto que se extiende desde la unión con la ampolla hasta la porción terminal del pene, es un conjunto mixto para los sistemas reproductor y urinario. Tiene una porción pélvica y otra peneana, ambas porciones tienen una mucosa constituida por un epitelio de transición y glándulas uretrales en la lámina propia a nivel del orificio uretral externo. La túnica muscular está constituida por fibras musculares lisas y tejido cavernoso (cuerpos cavernosos) presente en el tejido conjuntivo por debajo del epitelio (Köing, 1979; Habel, 1988; Dyce, 1999). 12 GENITALES EXTERNOS PENE. Es el órgano copulador del macho, está constituido de tejido eréctil y está unido a la arcada isquiática de la pelvis por los pilares del pene. En los carnívoros es cilíndrico y presenta hueso peneano, en el verraco y rumiantes es largo y delgado, de consistencia firme aun sin erección, se dobla sobre si mismo formando la flexura sigmoidea: preescrotal en el cerdo y retroescrotal en los rumiantes. La porción libre del pene del verraco es afilada y torcida en espiral. En los pequeños rumiantes hay un proceso uretral de aproximadamente unos 4cm. El pene cuenta consta de dos cuerpos cavernosos, la uretra envuelta por su cuerpo esponjoso y el glande (Habel, 1968; Habel, 1988; Climent, 2005). PREPUCIO. Es una vaina cutánea que cubre el glande y la porción libre del pene cuando no está en erección. En el verraco presenta un amplio divertículo dorsal en el cual se acumulan orina y desechos epiteliales. En el garañón es penduloso y con pigmentación oscura (Ashdown, 2000; Villar, 2004). 13 EQUIPO E INSTRUMENTOS: Charolas, pipetas Pasteur, cajas de Petri, vasos de precipitado, portaobjetos, cubreobjetos, microscopio estereoscópico y óptico. MATERIAL ALUMNO: Bata, estuche de disección, guantes de cirujano, hilo de algodón, etiquetas adheribles, solución salina, jeringas de 3cm3 e insulinicas, bisturí, pinzas, tijeras, agujas hipodérmicas de calibre 18. MATERIAL BIOLÓGICO: Aparato reproductor de diferentes especies de machos domésticos. REACTIVOS: Solución salina, colorante de Eosina-Nigrosina, tinción de Wright. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositar el material biológico en las charolas. 3. Para proceder a la disección del material biológico, se requiere la utilización de guantes de cirujano y el instrumental adecuado. Identificar, con ayuda de las figuras 1 a la 7, el mayor número de estructuras del aparato reproductor del macho. 4. Con ayuda de hilo y etiquetas señalar cada estructura que se identifique. 5. Se realizará un lavado del epidídimo con solución salina: se hará una serie de cortes en la cola del epidídimo con la hoja de bisturí, posteriormente se hace un lavado retrogrado desde el conducto deferente inyectando solución salina fisiológica con una jeringa, el lavado se colectará en cajas de Petri. Después, se pondrá una gota de este lavado en un portaobjetos y una gota de colorante Eosina-Nigrosina, se mezclaran perfectamente, se hace el frotis, se seca al aire y se observa al microscopio. 14 6. Realizar improntas comparativas, se hace una incisión a lo largo del testículo y el epidídimo, se sujeta un porta objetos con la mano y se coloca sobre la superficie del órgano presionando ligeramente, posteriormente se tiñe con la tinción de Wright o una tinción similar. 7. El material biológico así como los guantes de látex utilizados en esta práctica se depositarán en bolsas de plástico de color amarillo, para su destrucción por cremación. Es importante destacar que estas bolsas serán llevadas por los alumnos que se designen en el momento de la práctica por el profesor. 8. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará dentro de la estufa, que se localiza en el laboratorio. 9. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 10. La limpieza y desinfección del área de trabajo, por parte de los alumnos, es de suma importancia para mantener limpio el laboratorio. 11. Como punto final el profesor realizara la evaluación de la práctica. 15 Figura 1. Anatomía de aparato reproductor del toro.1 Recto Ampolla Vesícula Seminal Próstata Bulbouretrales Vejiga Flexura Sigmoidea Pene Glande Conducto deferente Plexo pampiniforme Epidídimo Testículo Prepucio 1 Adaptado de: Páramo, 2006. 16 Figura 2. Anatomía del aparato reproductor del verraco (McGlone, 2003).2 Recto Ampolla Vesícula Seminal Próstata Conducto deferente Bulbouretrales Vejiga Epidídimo Divertículo prepucial Testículo Flexura Sigmoidea Prepucio 2 Glande Pene Adaptado de: McGlone, J., Pond, W. 2003. 17 Figura 3. Anatomía del aparato reproductor del garañón.3 Ampolla Recto Vesícula Seminal Próstata Conducto deferente Bulbouretrales Vejiga Epidídimo Glande Testículo Pene Prepucio 3 Proceso uretral Adaptado de: Peter, C., Godoy, B. 1976. 18 Figura 4. Anatomía del aparato reproductor del perro4. Recto Próstata Conducto deferente Vejiga Pene Epidídimo Prepucio Bulbo del glande Testículo Glande 4 Adaptado de: Climent, S; Sarasa, M. 2005. 19 Figura 5. Anatomía del aparato reproductor del gato.5 Recto Próstata Bulbouretrales Epidídimo Testículo Vejiga Pene Prepucio Conducto deferente 5 Glande Adaptado de: Climent, S; Sarasa, M. 2005 20 Figura 6. Anatomía del aparato reproductor del carnero.6 Recto Ampolla Vesícula Seminal Próstata Vejiga Glande Bulbouretrales Pene Flexura Sigmoidea Conducto deferente Epidídimo Testículo Proceso uretral Prepucio 6 Adaptado de: Ashdown, R.R., Hafez, E.S.E. 2000. 21 Figura 7. Anatomía del pene en las diferentes especies domésticas.7 A. Pene de Toro. D. Pene de Garañon. B. Pene de Carnero. C. Pene de Verraco. 7 E. Pene de Gato. Adaptado de: Páramo, R. 2006 22 EVALUACIÓN PRÁCTICA I. Nombre del alumno: ______________________________________ Marca con una “x” si la especie cuenta con la estructura y llena los espacios vacíos para completar el cuadro. GLÁNDULAS ACCESORIAS ESPECIE AMPOLLA VESÍCULAS SEMINALES FLEXURA PRÓSTATA BULBOURETRALES SIGMOIDEA CARACTERISTICAS DEL PENE TORO GARAÑÓN VERRACO MORUECO MACHO CABRIO PERRO GATO 23 Diagrama Ecológico Práctica I. Anatomía de aparato reproductor de los machos domésticos. Disección del material Biológico Lavado del epidídimo con solución salina Realizar impronta Teñir con Writgh Realizar frotis El sobrante del lavado se desecha en la tarja Fin de la práctica Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas material biológico el Incineración 24 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACION ARTIFICIAL PRÁCTICA I ANATOMÍA DEL APARATO REPRODUCTOR DE LOS MACHOS DOMÉSTICOS Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 25 Práctica II Anatomía de aparato reproductor de las hembras domésticas. Duración: 4 horas. OBJETIVO. Que el alumno adquiera la capacidad de reconocer las diferentes estructuras donde se lleva a cabo el proceso de la reproducción así como los anexos del aparato genital normal de las hembras. GENERALIDADES. Conocer la anatomía de un aparato representa la base para su estudio, esto facilita la comprensión de su funcionamiento. El sistema reproductor de la hembra, está formado por un conjunto de órganos que tienen la función de producir, transportar y madurar los gametos para hacer posible la fecundación, el mantenimiento de la gestación y el parto, para perpetuar la especie. Las gónadas son un par de glándulas con doble secreción; La exocrina que está representada por la producción y liberación de gametos así como la endocrina por la síntesis y liberación de hormonas. Las estructuras tubulares son las responsables del transporte y maduración de los gametos, del proceso fisiológico de la fecundación y gestación, además de jugar un papel muy importante durante el parto. A partir de la pubertad, hay cambios cíclicos, controlados hormonalmente, con modificaciones reversibles e irreversibles de sus órganos (ciclo estral), cuya principal manifestación externa denominada celo o estro (Climent, 2005). El aparato reproductor de la hembra, está constituido por dos ovarios y las estructuras tubulares que constituyen los oviductos, útero, vagina y vulva (Hafez, 2000; Schwarze, 1984). A excepción de la vulva, todos los órganos genitales de la hembra son internos, es decir, se encuentran en el interior de las cavidades abdominal y pélvica (Dyce, 1999). OVARIOS. Son las gónadas femeninas; producen los óvulos que se liberan al oviducto. Son de consistencia firme y su forma varía entre las especies, en rumiantes son ovalados y pequeños, presentan una bolsa ovárica, cuya entrada es amplia y dirigida ventralmente; 26 en la yegua tiene una forma arriñonada, es importante destacar que en esta especie la zona parenquimatosa que alberga los folículos se dispone en el centro del órgano y la zona vascular en posición periférica; en la cerda tiene una forma oval con la apariencia de un racimo de uvas, por el relieve que forman los folículos en desarrollo, la bolsa ovárica es amplia, cónica y abierta ventralmente; en la perra y la gata son alargados y planos, en la primera el ovario está completamente encerrado, en la bolsa ovárica, de forma contraria en la gata esta parcialmente incluido en ella (Sisson, 1981; Climent, 2005). OVIDUCTO. Son tubos músculo-membranosos que transportan los óvulos hasta el útero. En el extremo ovárico del oviducto se dilata en forma de embudo, éste constituye el infundíbulo, su borde es dentado con una serie de eminencias puntiagudas denominadas fimbrias. Su porción más estrecha es el orificio abdominal, este último da paso a la ampolla, su luz se estrecha para dar paso al istmo, que termina a nivel de la porción uterina en el orificio uterino (Fradson, 1992; Dyce, 1999). ÚTERO. Su forma y estructura es variable. Consta de cuello, cuerpo y cuernos uterinos. El cuello uterino (cérvix) es la porción más caudal, conecta al útero con la vagina, su luz se denomina canal cervical que es característico en cada especie tanto por su morfología como por su longitud. En la coneja se presenta una característica muy particular, la presencia de dos cuellos uterinos (Fradson, 1992; Lebas, 1996). El cuerpo del útero es un simple tubo musculomembranoso situado cranealmente al cuello uterino y de longitud variable entre las diferentes especies (Fradson, 1992; Villar, 2004; Páramo, 2006). Los cuernos en los rumiantes tienen forma espiroidal y presentan en la mucosa, como carácter típico, los cotiledones uterinos. Éstos son eminencias ovales, en número aproximadamente de cien, que están distribuidas de modo irregular sobre la superficie o dispuestas en filas, unas doce, cabe señalar que el la vaca estos presentan una forma convexa y las ovejas y cabras tiene una forma concava. En la yegua son rectos y tan 27 largos como el cuerpo. En la perra y la gata son largos y rectos. En la cerda son largos y flexuosos, pudiéndose confundir con asas intestinales (Sisson, 1981; Villar, 2004). VAGINA. Es una formación tubular que junto con el vestíbulo y la vulva constituyen el órgano copulador de las hembras, la porción vaginal del cérvix hace relieve en la vagina, dando lugar a la formación de un receso anular, el fórnix vaginal, ausente en cerdas (Köing, 1979; Hafez, 2000). VESTÍBULO VAGINAL. Es una parte común a las vías urinaria y genital; se extiende desde el orificio uretral externo a los labios de la vulva. En la vaca y en la cerda presenta un divertículo suburetral inmediatamente caudal al orificio uretral (Habel, 1968). Las glándulas vestibulares mayores (de Bartholin) se encuentran en la vaca, gata y ocasionalmente en la oveja. Son dos masas glandulares compactas de unos 3 cm en la vaca. Las glándulas vestibulares menores son numerosas y se localizan en las paredes lateral y ventral del vestíbulo, en las especies restantes. En la perra y la yegua se encuentran los bulbos vestibulares uno a cada lado (Dyce, 1999; Climent, 2005). VULVA Y CLÍTORIS. Como se mencionó con anterioridad, la vulva es el único órgano externo del aparato genital. Consta de dos labios, derecho e izquierdo unidos dorsalmente por una comisura dorsal redondeada y ventralmente por la comisura ventral, puntiaguda en todas las especies domésticas excepto en la yegua, en la que ambas son redondeadas. La comisura ventral contiene el clítoris, homólogo del pene del macho, está unido a la arcada isquiática por dos pilares del clítoris los que confluyen el cuerpo del clítoris, compuesto de tejido eréctil, que termina en un glande del clítoris (Ciria, 2000; Páramo, 2006). 28 EQUIPO E INSTRUMENTOS: Charolas, porta objetos, cajas de petri, cubre objetos, microscopio estereoscópico y óptico. MATERIAL ALUMNO: Bata, estuche de disecciones, guantes de cirujano hilo de algodón, etiquetas, solución salina, bisturí, pinzas, tijeras, agujas hipodérmicas calíbre 18. MATERIAL BIOLÓGICO: Aparatos reproductores de diferentes especies de hembras domésticas. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositarán el material biológico en las charolas. 3. Para proceder a la disección del material biológico, se requiere la utilización de guantes de cirujano y el instrumental adecuado. 4. Identificar con ayuda de las figuras 8 a la 12, el mayor número posible de estructuras del aparato reproductor. 5. Con ayuda del hilo y las etiquetas mencionar la estructura que se está señalando. 6. El material biológico así como los guantes de látex resultante de esta práctica se depositara en bolsas de plástico color amarillo, para su destino final, la cremación. Es importante destacar que éste será llevado por los alumnos que se designen en el momento de la práctica por el profesor. 7. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 8. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 9. La limpieza y desinfección del área de trabajo por parte de los alumnos, es de suma importancia para mantener limpio el laboratorio. 10. Como punto final el profesor realizará la evaluación de la práctica. 29 Figura 8. Aparato reproductor de la vaca8. Ligamento intercornual dorsal Cuerno del útero Carúnculas Oviducto Ovario Cuerpo del útero Cuello del útero Fórnix vaginal Vagina Vejiga Orificio uretral externo con divertículo suburetral Vestíbulo vaginal Labio de la vulva Glándulas vestibulares mayores Clítoris 8 Adaptado de Sisson y Grossman. 1981. 30 Figura 9. Aparato reproductor de la yegua9. Cuerno del útero Oviducto Ovario Cuerpo del útero Mesometrio Cuello del útero Vejiga Vagina Glándulas vestibulares menores Vestíbulo vaginal Labio de la vulva Clítoris 9 Adaptado de Schwarze 1984. 31 Figura 10. Aparato reproductor de la cerda10. Oviducto Cuerno del útero Mesometrio Cuerpo del útero Ovario Bolsa ovárica Vejiga Cuello del útero Uréter Vagina Orificio uretral externo con divertículo suburetral Vestíbulo vaginal Labio de la vulva Clítoris 10 Adaptado de McGlone y Pond. 2003. 32 Figura 11. Aparato reproductor de la perra11. Bolsa ovárica Oviducto Ovario Cuerno del útero Cuerpo del útero Vejiga Cuello del útero Vagina Vestíbulo vaginal Labio de la vulva Clítoris 11 Adaptado de Villar y López. 2004. 33 Figura 12. Aparato Reproductor de la coneja.12 Ovario Oviducto Cuerno del útero Cuerno del útero Cuello del útero Cuello del útero Vagina Vejiga Meato urinario Vestíbulo vaginal Glándula de Bartholin Glándula prepucial Labio de la vulva Clítoris 12 Adaptado de: Lebas y Coudert. 1996. 34 Figura 13. Aparato Reproductor de la oveja y la cabra.13 Cuello del útero Ovario Labio de la vulva Cuerno del útero Vejiga 13 Clítoris Vagina Adaptado de: Delgadillo, J. A. 2005 35 EVALUACIÓN PRÁCTICA II. Nombre del alumno.______________________________________ 1. Llena los espacios vacíos con la información que se te pide. ESPECIE FORMA DEL OVARIO TIPO Y CARACTERÍSTICA DEL ÚTERO FORMA DEL CÉRVIX VACA YEGUA CERDA PERRA CONEJA 2. ¿Que es la fosa ovárica? 3. ¿En que estructura se lleva acabo la fecundación en las diferentes especies? 36 Diagrama Ecológico Práctica II. Anatomía de aparato reproductor de hembras domesticas. Disección del material Biológico Descripción de las estructuras ováricas Fin de la Práctica Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas el material biológico Incineración 37 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA II ANATOMÍA DEL APARATO REPRODUCTOR DE LAS HEMBRAS DOMÉSTICAS Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 38 Practica III Anatomía del aparato reproductor de machos y hembras. Práctica en vivo. Especie: Bovino. Duración: 4 horas OBJETIVO. Que el alumno adquiera la capacidad de evaluar aparatos genitales normales o sus anomalías mediante la manipulación en vivo de los machos y hembras de los módulos de producción de FES - Cuautitlán, así como el manejo adecuado de cada especie para evitar accidentes tanto para el estudiante como para la especie de que se trate durante el acceso al área genital. GENERALIDADES. Un arma importante para conocer el estado físico del aparato reproductor de los bovinos es la palpación rectal, en las vacas, aporta información útil para el médico veterinario, ya que se puede determinar la fase del ciclo estral en la que se encuentra, es posible diagnosticar la gestación, y el estado general del animal en su etapa reproductiva, la palpación es también empleada para la inseminación artificial, ya que el cuello se sujeta por vía rectal para dirigir el catéter de inseminación entre los anillos del cérvix y así introducirlo mas allá de éste, depositando de esta manera el semen directamente en el útero (Gordón, 2006). El aparato reproductor de la hembra puede ser examinado mediante la palpación rectal. El vestíbulo, la vagina y la abertura externa del cuello del útero pueden ser examinados mediante palpación manual o, visualmente con la ayuda de un vaginoscopio. Antes de emprender estos procedimientos es importante realizar una inspección cuidadosa de la vulva, perineo y superficies corporales (Noakes, 1999). Se debe estar familiarizado con la disposición del aparato reproductor de la hembra, la anatomía de los órganos abdominales y del esqueleto pélvico; el rumen se localiza de 39 lado izquierdo de la cavidad abdominal, los riñones son estructuras lobuladas del tamaño aproximado de una manzana situados a los lados de la línea media y en lo alto de la cavidad. El hueso pélvico es la mejor referencia, sobre todo el borde craneal (Sorencen, 1984). Es importante seguir una rutina regular observando la vulva para descubrir manifestaciones de secreciones o flujos durante todo el proceso. La vagina es difícil de identificar porque su pared es muy delgada y flácida, el cuello del útero es un elemento importante de referencia, su relación con respecto al borde de la pelvis, su tamaño, forma y el grado de movilidad. En novillas, el cuello del útero mide aproximadamente 2 a 3cm de diámetro y 5 a 6cm de longitud. La bifurcación de los cuernos uterinos se identifica justamente en posición craneal con respecto al cuello del útero especialmente si se comprime contra el borde pélvico, en forma de una fisura o hendidura antes de que se separen los cuernos, estos últimos se curvan inicialmente hacia abajo y adelante y después hacia atrás y arriba cerca de la punta que está situada de 5 a 6cm del cuello del útero. Por último, los ovarios se localizan más fácilmente siguiendo los cuernos uterinos alrededor de la curvatura mayor y después dirigiendo suavemente hacia atrás las puntas de los dedos en dirección al cuello del útero, se determinará su posición, tamaño y naturaleza de las estructuras presentes sobre el ovario, que pueden ser folículos, cuerpos lúteos, cuerpos albicans, folículos luteinizados y quistes (Noakes, 1999). En el toro se puede utilizar esta técnica, palpación rectal, para identificar las glándulas bulbouretrales; se puede estimular a este nivel con un masaje suave y se logra que el animal exteriorice el pene, entonces se puede explorar la mucosa. Una técnica que parece ser de gran utilidad para estimar la eficiencia reproductiva con base en la producción de espermatozoides, es la estimación del peso testicular a partir de medidas in vivo de los testículos. El largo de los testículos se ha empleado para estimar el peso de los mismos, pero presenta una limitante, ya que es difícil delimitar los bordes exactos de la glándula por efecto del cordón espermático en la parte superior y por el epidídimo en el extremo inferior. Otra medida es estimar el diámetro testicular a 40 través del escroto, ya que presenta una alta correlación con el peso de la glándula (r=0.92) y con el número de espermatozoides producidos por eyaculado (r=0.76) y (r=0.90). Sin embargo, esta medida puede verse afectada por la presencia de la lana en el escroto, la grasa subcutánea y el grosor de la piel escrotal (Trejo, 1990; Aguirre, 2004). Cuadro 1. Tamaño testicular aceptable en toros. Edad del toro en meses Circunferencia escrotal mínima Circunferencia escrotal buena 12-15 30 >34 15-18 31 >36 19-21 32 >37 22-24 33 >38 Mayor de 24 34 >39 Figura 14. Palpación de aparato reproductor de la vaca.14 14 Adaptado de Chagoya. 1990 41 EQUIPO E INSTRUMENTOS: Vaginoscopios, cubetas de 4 litros. MATERIAL ALUMNO: Cuerdas, botas, overol, guantes de palpación, guantes de látex, cubeta, jabón, toallas de papel, lámpara, espejo, cinta métrica. MATERIAL BIOLÓGICO: Bovinos hembras y machos del módulo de bovinos de leche del Centro de Producción Agropecuaria de la FES-Cuautitlán. SOLUCIONES ANTISÉPTICAS. Yodo al 5% PROCEDIMIENTO 1. Sujetar a la hembra, una por equipo de trabajo, asegurándose de que la manipulación sea segura tanto para el alumno como para la vaca. 2. Colocarse los guantes de palpación y látex, si así lo prefiere, recuerde que la mucosa de la hembra es una estructura muy delicada por lo que se pide tener cuidado de no introducir la mano con uñas largas, pulseras, reloj o anillos. 3. Lubricar el guante antes de introducir la mano en el recto. 4. Ya en el interior, desplazar la mano sobre el piso del recto para identificar el cérvix y las estructuras del aparto genital (Figura 15). 5. El siguiente paso será lavar con jabón y agua la vulva, secar con las toallas de papel. 6. El vaginoscopio se desinfectará previamente, se le aplicará un antiséptico con dos propósitos principales: lubricar y evitar un problema posterior de infección para el animal, la forma adecuada de introducir el aparato es colocarlo de forma vertical con el bisel hacia enfrente, se abren los labios de la vulva con una mano y con la otra se introduce lentamente inclinándolo poco a poco, hasta llegar a una posición horizontal, se introducirá con movimientos en semicírculo suaves, una vez dentro con ayuda de una lámpara o un espejo (para reflejar la luz solar) se revisara el cérvix y la mucosa vaginal. 42 7. Siguiendo las instrucciones de la primera parte, sujetar al toro, con el guante lubricado, se introduce la mano y se palpan las glándulas bulbo uretrales; con ayuda de un estimulo (masaje sobre las glándulas), el toro desvainará el pene. 8. La circunferencia testicular se mide utilizando una cinta métrica. Para facilitar la medición se bajan los testículos jalando suavemente con la mano para que se ubiquen en el fondo del escroto. Figura 15. Medición de la Circunferencia Testicular.15 9. El volumen testicular se mide introduciendo en la cubeta los testículos, la cantidad de agua sobrante en la cubeta se mide con una probeta, el cálculo se hace, restando esta cantidad al volumen inicial. 15 Realizado por Alcantar, UNAM. 2007. 43 EVALUACIÓN DE LA PRÁCTICA III. 1. Esquematiza el aparato reproductor de la vaca, señalando la relación anatómica con otros órganos. 2. Realiza un dibujo de cómo se observa el cérvix a través del vaginoscopio. 3. Menciona qué es el neumo-recto y cual es la causa que lo ocasiona. 44 Diagrama Ecológico Práctica III. Anatomía de machos y hembras. Práctica en vivo. Palpación del aparato reproductor de la hembra utilizando guante de palpación y/o guante de látex. Palpación del aparto reproductor del macho utilizando guante de palpación y/o guante de látex. Fin de la práctica Recolección de los guantes en bolsas de plástico Incineración 45 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA III ANATOMÍA DEL APARATO REPRODUCTOR DE MACHOS Y HEMBRAS. PRÁCTICA EN VIVO. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 46 Practica IV. Identificación de las estructuras ováricas en las diferentes especies domésticas e Identificación de ovocitos. Duración: 4 horas OBJETIVOS. Que los alumnos reconozcan las estructuras presentes en los ovarios de diferentes especies. Identificar ovocitos, recolectados de ovarios de diferentes especies, para desarrollar la habilidad de reconocer e identificar ovocitos. GENERALIDADES. El ovario se considera una glándula exocrina por la producción de ovocitos y endocrina por la producción de hormonas esteroides que mantienen el desarrollo del aparato reproductor. Las células germinales son las únicas estructuras del organismo que poseen la capacidad de dividirse por meiosis sufriendo una reducción del número de cromosomas, siendo responsables por la transmisión de la carga genética a los descendientes (Banks, 1986; Hafez, 2000; Mesquita, 2006). El ovario se constituye como un cuerpo ovoide en el que se puede distinguir una zona gruesa periférica denominada corteza y una zona interna o médula. Recordando que en la yegua presenta la disposición de forma inversa. La principal función del ovario es la formación de ovocitos maduros para su expulsión hacia las trompas y su unión con los espermatozoides (Banks, 1986; Moya, 2004). El establecimiento de la actividad cíclica del ovario durante la pubertad, es importante para la formación y liberación de los gametos, al igual que para el establecimiento de las características de la madurez sexual. En la hembra, el sistema hipotálamo-hipofisiario se desarrolla en ausencia de los estímulos hormonales. La producción de gametos se lleva a cabo en el ovario embrionario por medio de la división meiótica de las células 47 germinales primitivas, la mitosis cesa con el nacimiento y en este momento ya existe él número máximo de óvulos que la hembra tendrá en su vida; Cuando ocurre destrucción de los gametos, el animal queda estéril. La meiosis, se detiene durante la etapa de dictioteno (de reposo) y sólo se reanuda hasta que se presenta la pubertad (Hansel, 1981; Cunningham, 1999). Los folículos ováricos se desarrollan en la corteza del ovario de hembras sexualmente maduras y difieren entre sí por el tamaño de los ovocitos que contiene en su interior y por el grado de diferenciación (Figura 16). Los folículos primordiales están formados por una capa plana de células epiteliales, que en estadios más tardíos de su diferenciación, se transforman en células de la teca interna, estos folículos contienen en su interior la célula denominada ovocito. Tanto en las hembras prepúberes como las púberes, se presenta el fenómeno de reclutamiento, que consiste en que un grupo de folículos primordiales son activados para que sigan su desarrollo y se diferencien (Köning, 2005; Trejo, 2008). Los folículos secundarios (en crecimiento), también conocidos como antrales, se componen de un epitelio estratificado de células poliédricas de la granulosa folicular que rodean a un ovogonio. Todavía no se halla presente entre las células epiteliales una cavidad llena de líquido, el antro. Se desarrolla una capa de glicoproteínas que se denomina zona pelúcida que rodea a la membrana plasmática del ovogonio, cuando se completa la formación de esta estructura, el ovogonio se convierte en ovocito primario. Otra estructura que se forma en esta etapa es la corona radiada, ya que las células de la granulosa que rodean inmediatamente al ovocito, se hacen prismáticas. Conforme prosigue el desarrollo folicular, se forman pequeñas cavidades llenas de líquido (grietas) entre las células de la granulosa folicular, denominándose por esto como antro folicular (Priedkalns, 1980; Fernández, 2003; Trejo, 2008). El folículo terciario o de Graaf, está formado por varias capas celulares de las cuales la más interna es la capa granulosa, encargada de segregar el líquido folicular. Por fuera de ella, existe una capa celulovascular que constituye las tecas foliculares. El ovocito está situado en un cúmulo ovárico. El folículo de Graaf es el dispuesto para la ovulación. En 48 este momento, los componentes de las tecas han alcanzado su máximo desarrollo, la interna esta formada por células fusiformes, que se asemejan a los fibroblastos; sin embargo, son células productoras de estrógenos. La teca externa continúa con las mismas características (Gürtler, 1979; Moya, 2004). Una vez que el folículo ovárico ha alcanzado la madurez, el ovocito debe ser liberado para su encuentro con el espermatozoide. Al proceso de salida del ovocito con los componentes foliculares se le denomina ovulación, y para que ésta se produzca es necesaria la lisis del folículo de Graaf. Se forma un estigma sobre la superficie del ovario a modo de cono; posteriormente se rompe (cuerpo hemorrágico), dando lugar a la salida brusca del ovocito, acompañado de la corona radiada, y es captado por la fimbria del oviducto (Wittke, 1978; Moya, 2004). La formación del cuerpo lúteo, comienza cuando la secreción de la granulosa cambia de estrógenos a progesterona, conversión denominada luteinización de la granulosa, que se debe a la oleada preovulatoria de LH. En algunas especies, la teca también contribuye a la composición del cuerpo lúteo. Un coágulo de fibrina que se forma en la cavidad del folículo colapsado sirve como base para que se desarrollen las células luteas. La membrana que separa la granulosa de la teca se reorganiza y esto permite el crecimiento de vasos sanguíneos hacia el interior del remanente folicular y así se vascularizan las regiones tisulares que contiene las células de la granulosa y la teca. En muchas especies, la oleada preovulatoria de LH determinan la formación y el mantenimiento inicial del cuerpo lúteo (Hansel, 1981). En el caso de que el espermatozoide no fecunde el oocito, el cuerpo luteo involuciona rápidamente. Las células luteínicas se cargan de lípidos y degeneran, al igual que el resto de los componentes, y el cuerpo lúteo se transforma en un tejido cicatrizal blanco, conociéndose a partir de este momento como cuerpo albicans que con el paso del tiempo migra hacia el interior del ovario y desaparece progresivamente. Si el cuerpo luteo se mantiene por la fecundación y la anidación del embrión en el endometrio, las células luteinicas se mantienen durante toda la gestación, denominándose cuerpo luteo persistente (Moya, 2004). 49 Figura 16. Estructuras ováricas.16 Cuerpo albicans Folículo atresico Folículo de graaf Folículo terciario Folículo roto Folículo secundario Cuerpo luteo Folículo primario Cuerpo luteo en regresión 16 Adaptado de Fradson, R.D., Spurgeon, T.L. 1992. 50 EQUIPO E INSTRUMENTOS: Charolas, cajas de Petri, microscopio estereoscópico. MATERIAL ALUMNO: Bata, estuche de disección, guantes de cirujano, hilo de algodón, etiquetas, solución salina fisiológica, jeringas 3 cm3 e insulinicas, bisturí, pinzas, tijeras, agujas. MATERIAL BIOLÓGICO: Ovarios de diferentes especies de hembras domésticas. REACTIVOS: Solución salina fisiológica, colorante rosa de bengala. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositar el material biológico en las charolas 3. Para proceder a la identificación de las estructuras ováricas, se requiere la utilización de guantes de cirujano y el instrumental adecuado. 4. Con ayuda de hilo y etiquetas identificar la estructura que se está señalando. (Figura 15) 5. En una caja de petri con solución salina fisiológica, se verterá unas gotas de colorante rosa de bengala. Puncionar los folículos, con jeringa y aguja, y depositar el contenido en la caja de petri; con ayuda del microscopio estereoscopico identificar los ovocitos. (ver figura 17) 51 Figura. 17. Técnica de recolección de ovocitos. 6. El material biológico así como los guantes de látex resultantes de esta práctica, se depositarán en bolsas de plástico de color amarillo, para su destino final, la cremación. Es importante destacar que este material será llevado por los alumnos que se designen en el momento de la práctica por el profesor. 7. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 8. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 9. La limpieza y desinfección del área de trabajo es de suma importancia para mantener limpio el laboratorio. 10. Como punto final el profesor realizará la evaluación de la práctica. 52 EVALUACIÓN PRÁCTICA IV. 1. Esquematiza de forma detallada las estructuras que conforman el folículo de Graaf. 2. Define Gametogénesis. 3. Define Ovogénesis. 4. Define Foliculogénesis. 53 Diagrama Ecológico Práctica IV. Identificación de las estructuras ováricas en las diferentes especies domesticas e identificación de ovocitos. Depositar el material biológico en charolas Descripción de las estructuras Depositar en una caja de petri solución salina fisiológica con unas gotas de colorante rosa de bengala Punción de folículos de la corteza ovárica, vaciar el contenido folicular en la caja de Petri. Fin de la práctica El sobrante de las cajas de Petri se desecha en la tarja. Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas el material biológico Incineración 54 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA IV IDENTIFICACIÓN DE LAS ESTRUCTURAS OVÁRICAS EN LAS DIFERENTES ESPECIES DOMÉSTICAS E IDENTIFICACIÓN DE OVOCITOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 55 PRÁCTICA V. Endocrinología de la reproducción. Principales productos hormonales y su aplicación en las diversas especies domésticas. Duración: 4 horas. OBJETIVOS. El alumno aplicará su conocimiento sobre las hormonas y su uso en tratamientos para resolver entidades fisiológicas y patológicas del aparato reproductor de diferentes especies domésticas. Que el alumno pueda seleccionar el producto hormonal de mayor conveniencia para su práctica profesional, basándose en el conocimiento de los productos. GENERALIDADES. La endocrinología de la reproducción se refiere a la bioquímica, funcionamiento, farmacología y biología molecular de las hormonas y sus receptores. Las hormonas sintetizadas y secretadas por glándulas endocrinas son transportadas en el aparato circulatorio para estimular, inhibir o interactuar con la actividad funcional o el órgano blanco específico y producir una amplia variedad de respuestas (Hafez, 2000; Esperón, 2004). Para comprender los mecanismos que gobiernan las funciones de la reproducción, es necesario considerar la relación que existe entre la glándula pituitaria, el hipotálamo y los centros superiores del encéfalo. Las hormonas de la glándula pituitaria regulan las funciones de la reproducción y mediante el hipotálamo se consigue la integración global de la actividad de la pituitaria con el comportamiento y rendimiento del animal (Hunter, 1987). El hipotálamo forma la base del cerebro en la región del diencéfalo, una subdivisión del proencéfalo, esta limitado frontalmente por el quiasma óptico, caudalmente por los cuerpos mamilares y dorsalmente por el tálamo, la otra región que forma el diencéfalo; esta parte del cerebro esta rodeada por liquido cerebroespinal del tercer ventrículo. La 56 hipófisis o glándula pituitaria está localizada debajo del hipotálamo en un hueco en forma de nicho del hueso esfenoides conocido como “silla turca”, y se encuentra ligada al hipotálamo. La hipófisis está formada por dos lóbulos distintos, la hipófisis posterior o neurohipófisis y la hipófisis anterior o adenohipófisis. La hipófisis posterior es tejido nervioso que se desarrolla a partir del diencéfalo; recibe hormonas que han sido sintetizadas en las neuronas magnocelulares hipotalámicas, que son transportadas a lo largo de los axones hasta la hipófisis posterior. La hipófisis anterior es tejido glandular, subdividida en tres porciones conocidas como parte distal, parte tuberal y parte intermedia. Esta es la glándula principal que produce una gran cantidad de hormonas tróficas que estimulan la liberación de otras hormonas en varios tejidos diana (Hafez, 2000; Squires, 2006; Soto, 2008). Las dos hormonas liberadas desde la hipófisis posterior son la oxitocina y la vasopresina. La primera produce contracciones del músculo liso, incluyendo las células mioepiteliales para la bajada de la leche y por su parte la vasopresina estimula la reabsorción de agua del túbulo distal del riñón manteniendo la osmolaridad sanguínea. La hipófisis anterior segrega seis hormonas: la Somatotropina, hormona del crecimiento (GH); la hormona adrenocorticotropa (ACTH); la Tirotropina, hormona estimuladora de la tiroides (TSH); la hormona folículo estimulante (FSH); la hormona luteinizante (LH) y la hormona Prolactina (PRL) (Hunter, 1987; Squires, 2006). El encéfalo recibe información del medio ambiente externo e interno del animal mediante una gama completa de corrientes nerviosas sensitivas que llegan al mismo, posteriormente el hipotálamo recibe la información adecuada que le transmite el encéfalo, y la secuencia endocrina de respuestas tiene lugar desde el hipotálamo (Hunter, 1987; Ruckeebusch, 1994; Soto, 2008). 57 MATERIAL DEL ALUMNO: Bata, cajas de productos hormonales de cualquier laboratorio, vademécum veterinario. PROCEDIMIENTO. Los alumnos leerán las indicaciones de cada una de las cajas de medicamentos hormonales y lo complementarán con el vademécum veterinario, para resolver las siguientes entidades patológicas y fisiológicas, en los cuadros que continuación se presentan. La evaluación de esta práctica comprende el correcto llenado de estos cuadros. 58 Tabla 1. Diferentes entidades patológicas reproductivas. ENTIDADES PRINCIPIO PATOLÓGICAS ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 1. Quiste folicular luteinizado 2. Quiste folicular. 3. Ovarios estáticos. 4. Piómetra. 5. Metritis. 6. Quiste lúteo. 7. Ovulación retardada. 8. Tonificación e involución uterina. 59 Tabla 1. Continuación ENTIDADES PATOLÓGICAS PRINCIPIO ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 9. Endometritis. 10. Retención placentaria 11. Corrección del anestro. 12. Calor silencioso. 13. Mantenimiento de la preñez. 60 Tabla 2. Entidades Fisiológicas reproductivas. ENTIDADES FISIOLOGICAS PRINCIPIO ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 1. Sincronización de parto. 2. Sincronización de calores. 3. Superovulación. 4. Sincronización de la ovulación. 5. Inducción a la ovulación. 6 .Incrementar la fertilidad en las vacas. 61 Tabla 2. Continuación. ENTIDADES FISIOLOGICAS PRINCIPIO ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 7. Estimulación de la génesis y maduración del gameto 8. Inducción al aborto. 9. Control del celo en perros. 10. Maduración folicular. 11. Inducción de la lactación. 12. Tonificación e involución uterina. 62 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA V ENDOCRINOLOGÍA DE LA REPRODUCCIÓN. PRINCIPALES PRODUCTOS HORMONALES Y SU APLICACIÓN EN LAS DIVERSAS ESPECIES DOMÉSTICAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 63 Práctica VI. Endocrinología. Evaluación de la respuesta ovulatoria en ratas púberes tras la aplicación de Gonadotropina Coriónica equina (eCG). Duración: 4 horas OBJETIVOS. Observar el efecto de la Gonadotropina Coriónica Equina (eCG) en los ovarios de ratas en la etapa de pubertad. Que el alumno conozca el empleo de la eCG en medicina veterinaria, como una herramienta útil para el manejo reproductivo. GENERALIDADES. La yegua produce una gonadotropina llamada gonadotropina coriónica equina (eCG), antes denominada gonadotropina sérica de yegua gestante - PMSG (Swenson, 1999). El trofoblasto equino sintetiza esta hormona desde el día 35 hasta el 120 – 150 de la gestación, la eCG ayuda a mantener el cuerpo lúteo durante las primeras fases de la gestación porque su secreción empieza después de que se haya impedido la regresión del cuerpo luteo. Sin embargo, la eCG juega un importante papel de inmunoregulación durante la implantación que es el día 35 y en la formación de cuerpos luteos accesorios (Hafez, 2000; Engelhardt, 2002). La eCG fue descubierta por el profesor Harold Cole en 1930, cuando la sangre de yeguas preñadas produjo madurez sexual en ratas inmaduras. Es una glucoproteína con subunidades alfa y beta similares a las de LH y FSH pero con mayor contenido de carbohidratos, en especial ácido siálico al que se le atribuye la larga vida media de la eCG. Esta gonadotropina placentaria es secretada por el útero equino; las copas endometriales se forman hacia el día 40 de la preñez y persisten hasta el día 85. Se ha implicado a la eCG en el desarrollo folicular y la formación de folículos secundarios, pero evidencias recientes refutan este argumento. Ahora se sabe que la eCG no tiene 64 propiedades similares a la FSH en la yegua, aunque las tenga en otros animales domésticos, donde se utiliza para provocar una superovulación. Si es que tiene un papel en el desarrollo folicular, esto ocurre únicamente mediante su acción sinérgica con los pulsos naturales de FSH. La eCG sí que tiene efectos similares a la hormona LH actuando como factor luteinizante en la formación de los cuerpos luteos secundarios, y también podría estar implicada en parte en el mantenimiento del cuerpo luteo (Blanchard, 1998; Morel, 2005). No obstante, la gonadotropina del suero de la yegua preñada suele calificarse como una hormona de tipo “FSH”. El periodo de acción de esta hormona es bastante prolongado debido a que no pasa el filtro renal y permanece en la circulación del animal inyectado o en la sangre de la yegua gestante que la ha producido (McDonald, 1989). Esta práctica está encaminada a probar la acción de la eCG en ratas jóvenes, los alumnos tendrán un espacio para habilitarse en el campo experimental. EQUIPO E INSTRUMENTOS: Báscula granataria, microscopio estereoscópico, cajas de Petri. MATERIAL ALUMNO: Bata, estuche de disecciones, guantes de cirujano, jeringas 3cm3 e insulínicas, torundas impregnadas de alcohol, marcador permanente, torundas de algodón. MATERIAL BIOLÓGICO: 6 ratas hembras púberes, por cada 2 equipos de trabajo. REACTIVOS: Solución salina fisiológica, Gonadotropina Coriónica equina (Folligon), colorante Rosa de Bengala, cloroformo, xilacina, pentobarbital. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. 65 PROCEDIMIENTO. El procedimiento se divide en 2 etapas: Etapa 1: 1. Identificar y pesar cada una de las ratas con ayuda de la báscula granataria. 2. Inyectar dos ratas con 0.3 ml de solución salina por vía subcutánea, identificarlas con el número 1 y 2. Este será el grupo testigo. 3. Inyectar cuatro ratas con 0.3 ml de eCG por vía subcutánea (Folligon, 1000 UI/5ml), identificarlas con los números del 3 al 6. Este será el grupo experimental. Etapa 2: 1. Esperar de 48 a 72 horas para que actúe la eCG. 2. Al término de este tiempo se sacrifican las ratas aplicando un tranquilizante y posteriormente una sobredosis de anestésico o bien en un frasco de vidrio se pondrá una torunda impregnada con cloroformo. 3. A la necropsia, se identificarán los cambios a nivel de los ovarios comparándolos con los de los animales del grupo testigo. 4. Extraer el aparato reproductor y depositarlo en cajas de Petri. 5. Con ayuda del microscopio estereoscópico se observará el desarrollo folicular en los ovarios. 6. De ser posible, se hará la punción de los folículos para observar los ovocitos; se depositarán en una caja de Petri que contenga solución salina con colorante rosa de bengala y se observarán al microscopio estereoscópico para su identificación. 7. Recuerde hacer las anotaciones pertinentes para interpretar los resultados que se obtengan. 8. La práctica será evaluada al que presentar un reporte escrito que contenga: Titulo, objetivo, generalidades, material y procedimiento, interpretación de resultados, discusión, conclusión y referencias, este reporte se entregará en la próxima sección de laboratorio, por equipo. 66 Figura 18. Aplicación de Gonadotropina Coriónica Equina (eCG) en ratas púberes. eCG SSF Inyectar eCG Vía Subcutánea Inyectar Solución salina Vía Subcutánea 48 – 72 horas Sacrificar a las hembras A la necropsia revisar los cambios a nivel de aparato reproductor de las ratas 67 Diagrama Ecológico Práctica VI. Endocrinología. Respuesta ovulatoria en ratas púberes posterior a la aplicación de Gonadotropina Corionica Equina (eCG). Aplicación de la hormona Recolección de las jeringas, agujas y frascos vacíos Sacrificio de las ratas Incineración Necropsia, disección del aparato reproductor de la hembra Fin de la práctica Colocar en el recipiente rojo los desechos punzo-cortantes Depositar en bolsas amarillas los cadáveres y los guantes de látex. Incineración 68 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICAVI ENDOCRINOLOGÍA. EVALUACIÓN DE LA RESPUESTA OVULATORIA EN RATAS PÚBERES TRAS LA APLICACIÓN DE GONADOTROPINA CORIÓNICA EQUINA (ECG). Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 69 PRACTICA VII. Citología vaginal en perras. Duración: 4 horas. OBJETIVOS. El alumno aprenderá a realizar un frotis vaginal, utilizar la tinción de Wright y de Shorr, así como la interpretación de una citología vaginal en perra. Conocerá la utilidad de esta técnica para determinar las diferentes etapas del ciclo estral de las perras. GENERALIDADES. El ciclo estral es una secuencia coordinada de cambios ováricos, útero - vaginales y de comportamiento, que se ha desarrollado en los mamíferos para asegurar la producción y la fertilización de los gametos femeninos y el desarrollo intrauterino del feto (Jeffcoate, 2000). La influencia de las hormonas ováricas sobre el epitelio vaginal, ocasiona cambios citológicos característicos que permiten determinar la etapa del ciclo estral en la que se encuentra la hembra, por lo que es un método ampliamente utilizado en medicina veterinaria (De Buen, 2001). La citología vaginal proporciona información sobre la fase del ciclo estral, la presencia de inflamaciones de la vagina o en el útero, si el cérvix está abierto, y de tumor venéreo transmisible. La acción de los estrógenos sobre el epitelio vaginal provoca hiperplasia, hipertrofia, queratinización y exfoliación de las células (Hansel, 1981; Jeffcoate, 2000; Malcom, 1999). Considerando que el metaestro empieza cuando la proporción de la células superficiales en el frotis vaginal es de al menos el 20%, la ovulación tiene lugar unos 6 días antes del primer día del metaestro (Jeffcoate, 2000; Radostits, 2002). 70 En fases de acción estrogénica mínima como el anestro, metaestro y la pubertad, las células presentes en el frotis son las intermedias. Miden de 20 a 40 micras y varían de acuerdo a su grado de maduración. Son redondas o poligonales de contornos bien definidos, citoplasma abundante, éste dependiendo del pH celular, puede ser basófilo (morado) o eosinófilo (rosa). Núcleo redondo u oval, con membrana definida se observan cromócentros y cromatina sexual. Las parabasales son redondas u ovales de tamaño variable miden de 12 a 30µ. El núcleo ocupa casi toda la superficie celular, su citoplasma es escaso generalmente basófilo y ocasionalmente está vacuolado; puede haber la presencia de neutrófilos. Al iniciarse el proestro, las células se hacen mas diferenciadas y los tipos de células epiteliales que aparecen son las superficiales, son las más maduras del epitelio, de forma poligonal y miden de 35 a 45 micras. Tienen un citoplasma transparente y núcleo picnótico. Como la madurez del epitelio rara vez se lleva a cabo en ausencia de estrógenos, el núcleo picnótico es un dato de actividad estrogénica. En el citoplasma se pueden encontrar pequeños gránulos ácidofilos con localización perinuclear o periféricos, éstos contienen lípidos y su presencia es estrógeno-dependiente. También hay eritrocitos y durante los primeros días pueden verse neutrófilos. Hacia la mitad del proestro, los neutrófilos desaparecen, al igual de que las células parabasales y las intermedias. Al final del proestro solo aparecerán células superficiales, aunque todavía se pueden ver glóbulos rojos. La mitad del estro se caracteriza por la presencia de células superficiales, la mayoría de las cuales son anucledas con el fondo del frotis limpio y claro. Durante el estro puede o no haber presencia de eritrocitos. En el diestro hay numerosas células intermedias y parabasales, un fenómeno característico es el elevado número de neutrófilos al inicio de esta fase (Dellman, 1999; Jeffcoate, 2000; De Buen, 2001; Radostits, 2002). Las células basales o germinales son pequeñas, redondas u ovales, de tamaño uniforme 12 a 13 micras, con núcleo central de cromatina granular, a veces se observa un nucleolo evidente y ocasionalmente se puede observar mitosis; el citoplasma es basófilo 71 y escaso. A partir de estas células se lleva a cabo la regeneración del epitelio, suelen observarse en atrofia, vaginitis o cuando existen úlceras en la mucosa. Las células naviculares son alargadas con forma de barco, tienen importancia en la citología de hembras preñadas donde además tienen gran cantidad de glucógeno. Las escamas son células muertas por lo tanto carecen de núcleo, representan la etapa final de la maduración del epitelio vaginal. Otras células no epiteliales como los eosinófilos, leucocitos, macrófagos y espermatozoides se pueden encontrar normalmente en los frotis vaginales. Los cambios citológicos en un frotis vaginal puede utilizarse para: a) Monitorizar o detectar anomalías en las fases del ciclo estral. b) Determinar el periodo para la cubrición. c) Detectar cubriciones indeseadas. d) Determinar la etapa del ciclo estral que es el objetivo principal que se busca en esta práctica (Jeffcoate, 2000). 72 Cuadro 2. Tipos celulares que pueden aparecer en un frotis vaginal (Gadea, 2003). Células básales Son las células mas jóvenes del epitelio vaginal, precursoras de los otros tipos de células, raramente aparecen en el frotis. Son pequeñas, redondas, regulares con núcleo grande y esférico. Células parabasales Muy similares a las básales solo que más grandes, pueden tener vacuolas en su citoplasma, son uniformes en su tamaño y forma. Células intermedias Estas células varían en tamaño, generalmente son del doble, en comparación con las células parabasales, sus bordes van desde redondeados hasta angulares. El núcleo se observa ovalado y de menor tamaño. Células Son las más viejas del epitelio vaginal, Superficiales tienen el núcleo pequeño, ovalado y claramente picnótico. Su citoplasma es abundante y queratinizado, sus contornos son irregulares, plegándose hacia si mismos. 73 Escamas Estas células están muertas, por lo tanto carecen de núcleo, representan la etapa final de la maduración del epitelio vaginal. Células naviculares Son alargadas con forma de bote, tienen importancia en la citología de las hembras preñadas, donde además tienen gran cantidad de glucógeno. 74 EQUIPO E INSTRUMENTOS: Porta objetos, microscopio óptico, lápiz punta de diamante. MATERIAL ALUMNO: Bata, guantes de cirujano, hisopos de algodón largos. MATERIAL BIOLÓGICO: Perras prepúberes, púberes y en edad reproductiva. REACTIVOS: Solución salina fisiológica, Colorante de Wright, solución amortiguadora (Fosfato monopotásico, 6.63 g; fosfato di sódico, 2.56 g; agua c.b.p. 1000 ml), tren de tinción de Harri-Shorr. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Se pide al dueño o encargado de la paciente que la sujete, para colocarle un bozal, enseguida se sube en la mesa del trabajo, si el tamaño o el temperamento de la perra dificultaran la toma de la muestra se realizará, sin subirla. 2. La toma de la muestra se realiza con un hisopo de algodón estéril con una longitud mínima de 15 cm, humedecido previamente con solución salina fisiológica. 3. Los labios vulvares se separan con una mano y con la otra se introduce el hisopo, si la hembra es pequeña se introducirá aproximadamente 2 cm, en el caso de perras de talla mediana se introduce solo hasta la mitad del tamaño total del hisopo. Para evitar la fosa del clítoris se debe abrir un poco los labios bulbares para ver el clítoris esto servirá para como referencia para no colocar en este punto el hisopo. 75 4. Recoger la muestra mediante movimientos de rotación sobre la mucosa vaginal (Figura 19). 5. Tras retirar el hisopo, éste se gira sobre un portaobjetos, ya identificado con ayuda del lápiz punta de diamante, y se seca al aire si se utiliza la tinción de Wright; si la tinción empleada es la de Shorr se fijará el frotis con alcohol. Figura 19. Colocación del hisopo para obtener la muestra de mucosa vaginal.17 17 Adaptado de Sisson,1981 76 Tinción de Wright. 1. Se coloca el colorante sobre el frotis, cubriéndolo totalmente y se dejan pasar 2 minutos. 2. Se añade solución amortiguadora sobre el frotis, sin derramar el colorante previamente colocado, durante 7 minutos, se observará sobre la superficie una coloración metálica 3. Se decanta. 4. Se lava con agua de la llave por 30 segundos. 5. Se seca al aire. 6. Observar al microscopio. 7. Realizar la interpretación, para determinar la etapa del ciclo estral o alguna posible alteración. Tinción de Shorr (Gadea, 2003). 1. Hacer 10 inmersiones en Alcohol de 70º, cada inmersión dura 1 segundo. 2. Hacer 10 inmersiones en Alcohol de 50º 3. Hacer 10 inmersiones en agua destilada 4. Poner en Hematoxilina de Harris, durante 2 minutos 5. Se realizan 2 inmersiones en agua destilada(en dos recipientes diferentes) 6. 1 minuto en Alcohol amoniacal 7. Hacer una inmersión en agua destilada 8. Hacer una inmersión en Alcohol de 70º 9. 1 inmersión en Alcohol de 95º 10. Poner el frotis 2 minutos en colorante de Shorr 11. Hacer una inmersión en Alcohol 95º 12. Hacer una inmersión en Alcohol de 100º 13. Dejar secar y observar al microscopio. 77 EVALUACION DE PRACTICA VII. EVALUACIÓN VISUAL. 1. Identifica la tinción utilizada en la muestra que se te presenta. 2. Identifica el tipo de célula que se te muestra a continuación. 3. Con las imágenes que se te presentan a continuación, determina la etapa del ciclo estral en la que se encuentra la paciente. 4. Que recomendaciones darías al dueño de la paciente en caso de encontrar este tipo de células. 78 Diagrama Ecológico Práctica VII. Citología vaginal en perras. Toma de muestra vaginal con ayuda de un hisopo largo. Utilizar guantes de látex Girar el hisopo sobre un porta objetos y teñir. Fin de la práctica Depositar los frotis teñidos en el recipiente de punzo cortantes Depositar los guantes y los hisopos en una bolsa amarilla. Incineración 79 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA VII CITOLOGÍA VAGINAL EN PERRAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 80 PRACTICA VIII. Diagnóstico de gestación por ultrasonido en ovinos, caprinos caninos y felinos. Duración: 4 horas. OBJETIVO. Capacitar a los alumnos en la técnica de diagnóstico de gestación por ultrasonido en ovejas, cabras y perras, considerando la eficacia, seguridad y costo de este método. GENERALIDADES. La ecografía de tiempo real, se aplica actualmente en la práctica veterinaria para el diagnóstico precoz de la gestación, y para el reconocimiento y manejo de las gestaciones. La mayoría de los dispositivos para ecografía de uso común son lineales, es decir, emiten un rayo paralelo de ultrasonido que reproduce una imagen rectangular (Allen, 1994). La ecografía se basa en la capacidad de los tejidos y de las estructuras llenas de líquido para reflejar o propagar las ondas sonoras. Un transductor o sonda emite un rayo sonoro y la proporción del rayo que es reflejada hacia la sonda se transforma en impulsos eléctricos que se manifiestan sobre una pantalla en forma de una imagen en movimiento. Las estructuras llenas de líquido no reflejan las ondas sonoras y aparecen de color negro mientras que los tejidos densos como los huesos reflejan la mayor parte del rayo sonoro y aparecen blancos. Otros tejidos se observan con distintas tonalidades de gris dependiendo de su capacidad para reflejar los sonidos (Powell, 2000). 81 Figura 20. Ecógrafo de tiempo real. Los ultrasonidos son, sencillamente, sonidos de muy alta frecuencia, de aproximadamente 1. 5 - 7 (MHz), muy alejados de los que puede detectar el oído humano. En los instrumentos empleados para el diagnóstico de la gestación y determinación del número de fetos en el ganado ovino, los ultrasonidos se producen en un instrumento conocido como transductor, que contiene un cristal o cristales piezoelectrónicos, que convierten la energía eléctrica aplicada en energía ultrasónica, o bien, convierten la energía mecánica (vibraciones ultrasónicas) en energía eléctrica (Figura 21); por esto, el transductor puede utilizarse para transmitir ultrasonidos o para recibir el eco de retorno (Fayez, 1994). Figura 21. Tipos de transductores. Transabdominal (izquierda), transrectal (derecha) 82 En ovinos y caprinos, la ecografía, permite la visualización directa de los líquidos fetales, las carúnculas y el feto; además, es posible detectar el número y la viabilidad de los productos. El examen ultrasonografico en la oveja y la cabra puede realizarse de dos maneras: una es aplicando la sonda en la porción ventral del abdomen (ultrasonografía transcutánea), o introduciendo la sonda por vía rectal (ultrasonografía transrectal). En general, el examen transrectal es más seguro que el transcutáneo hasta el día 35 de la gestación, entre los días 35 a 70 ambos métodos son eficientes; el método transcutáneo se prefiere durante la segunda mitad de la gestación. Las sondas (“scanners”) de 5 MHz son las más apropiadas. La seguridad de un diagnóstico positivo de gestación al utilizar la ultrasonografía transrectal puede exceder el 95%, alrededor del día 25 de la gestación. El examen después del día 40 de gestación permite identificar correctamente a casi todos los animales no gestantes. La ultrasonografía transcutánea permite alcanzar una seguridad del 95%, para un diagnóstico positivo de gestación si se realiza entre los días 40 a 50, y después del día 50 está será del 99% (Ortega, 1999; Pérez, 2006). Las pruebas de gestación contribuyen a la eficiencia de los programas de Inseminación Artificial. Estas pruebas identifican a las hembras no gestantes, y permiten al productor decidir entre reinseminar o no a las hembras vacías, utilizarlas en monta directa o desecharlas. El uso de estas pruebas está frecuentemente relacionado con los costos y su facilidad de empleo (Arbiza, 1986; Delgadillo, 2005). El ultrasonido en escala gris y tiempo real es una herramienta diagnóstica invalorable en las perras y gatas. La ultrasonografía en términos generales es tolerada mucho mejor que la radiología, dado que rara vez es necesaria la inmovilización absoluta del animal. Es más segura que las placas radiográficas para el propietario debido a la ausencia de radiación ionizante. En perras, el ultrasonido permite efectuar el diagnóstico desde el día 29 de la gestación, se hace con la finalidad de revisar al mismo tiempo el estado de salud del útero y determinar si la gestación es normal o se está desarrollando una seudogestación o una piometra. El ultrasonido permite conocer si los fetos están vivos, el tamaño de los mismos o las dimensiones e integridad de la pelvis (Páramo, 2006). 83 En las gatas las pruebas hormonales no tienen valor, el diagnóstico se establece en función del examen clínico, radiográfico y más recientemente el ecográfico que permite diagnosticar la gestación a partir del día 21-25. Los movimientos del feto aparecen el día 28, a partir de la sexta semana, se perciben las diferentes partes del feto (Páramo, 2006; Valencia, 2006). EQUIPO E INSTRUMENTOS: Ultrasonido de tiempo real, transductores de 3.5 y 5 Mhz. MATERIAL ALUMNO: Bata, botas, overol, guantes desechables y guantes de látex. MATERIAL BIOLÓGICO: ovejas, cabras, perras y gatas. REACTIVOS: Gel para ultrasonido. MATERIAL DE DESINFECCIÓN: Desinfectante para la mesa de trabajo (hipoclorito al 1%), toallas de papel. 84 PROCEDIMIENTO En ovejas y cabras. 1. Conectar el aparato de ultrasonido en una toma de corriente adecuada para evitar daños, hay que tener la precaución de colocarlo en una base o mesa fija que soporte el peso de éste, colocar el transductor transrectal para diagnóstico de una gestación de poco tiempo o transabdominal para hembras con mas tiempo desde la monta o Inseminación Artificial. 2. Esta práctica se realizará en los módulos de producción de la FES-C. Se utilizarán las mangas de manejo de dichas instalaciones y se atenderán las indicaciones de manejo de los encargados del módulo correspondiente. 3. El primer examen se realiza con el transductor transrectal, lubricando con el gel para ultrasonido. 4. Se deberá identificar en el animal el lugar adecuado para la colocación del transductor de 3.5 MHz para el método transcutáneo. El transductor se coloca en la parte inferior del flanco derecho exactamente por un lado de la ubre, con 30º de inclinación. Observar en el monitor para emitir el diagnóstico. 5. Identificar la unión de caruncula-cotiledón, con ayuda del ultrasonido medir el diámetro de estas estructuras. 6. Identificación de estructuras como son: cabeza, columna, miembros anteriores o posteriores, latido cardiaco. 7. Posibilidad de realizar conteo fetal. 8. Percibir movimientos fetales. 9. Se reportan los resultados del examen identificando a la paciente con su número de registro, y solo se expresa como positivo (+), negativo (-), y en algunos casos en los que se tenga duda se puede registrar como sospechoso, posteriormente se realizará otro examen para dar un diagnostico más acertado. 85 Figura 22. Esquema que muestra la colocación adecuada del transductor (izquierda), Fotografía que muestra la presencia de placentomas en una oveja (derecha De Lucas, 2007).18 En perras y gatas. 1. Se pide al dueño o responsable de la paciente que la coloque sobre la mesa de exploración y que la sujete, si es necesario se le colocará un bozal para evitar que lastime a alguien. 2. Si la zona ventral de la perra está cubierta de pelo se recomienda rasurar para tener un mejor contacto, ya que el pelo dificulta el examen. 3. Se coloca el transductor de 3.5 MHz en la parte abdominal de la paciente, previamente se pondrá el gél en el transductor, que facilita el contacto y se observa en la pantalla del ae|arato la presencia de las vesículas amnióticas e incluso los movimientos fetales. 18 Adaptado de De Lucas, 2007. 86 EVALUACIÓN DE LA PRÁCTICA VIII. 1. Interpreta las siguientes fotografías que se representan a continuación. a) b) c) 2. Que estructura se esta señalando con la flecha. 3. Esquematiza las partes del ecógrafo, mencionando las partes que lo integran. 87 Diagrama ecológico Práctica VIII. Diagnostico de gestación por ultrasonido en ovinos, caprinos y caninos. Corrales Laboratorio Sujetar a la oveja o cabra Sujetar a la perra y ponerla en la mesa de trabajo Realizar el gestación Dx de Fin de la práctica Recoger cualquier desecho generado: guantes, toallas de papel, etc. Limpieza y desinfección de las mesas de trabajo Depósito de basura 88 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA VIII DIAGNÓSTICO DE GESTACIÓN POR ULTRASONIDO EN OVINOS, CAPRINOS, CANINOS Y FELINOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 89 Practica IX. Diagnóstico de gestación, por el método de palpación rectal en vacas. Duración: 2 horas. OBJETIVO. Que el alumno adquiera la capacidad de diagnosticar por medio de la técnica de palpación rectal las vacas gestantes. GENERALIDADES. El método mas popular y sencillo para la detección de la gestación, consiste en un examen interno del aparato reproductor de la hembra por vía rectal, que se conoce como palpación rectal. El diagnóstico precoz es de gran importancia en las especies de interés zootécnico, ya que en éstas, en general, se intenta intensificar al máximo el ciclo reproductivo limitando en la medida de lo posible los periodos de incertidumbre (Camacho, 1995; Phillips, 2003; Gordón, 2006). Palpación significa sentir y, obviamente, este método implica sentir el aparato reproductor de la vaca en busca de signos de la preñez. Los signos iniciales de la gestación pueden ser agrandamiento, desplazamiento, presencia de algún feto o de hallazgos secundarios como líquido, placentomas y modificación de la arteria uterina. La palpación rectal proporciona una exactitud superior al 95% siempre que como mínimo se identifique un signo positivo (Sorensen, 1984; Noakes, 1999). El cuerpo luteo de gestación, por palpación no es posible diferenciarlo de un cuerpo luteo cíclico, sino hasta 3 semanas después de la cubrición o inseminación artificial. Desde los 35-40 días de la gestación, es posible palpar la membrana del alantocorion; en el tipo de placenta cotiledonaria, característica de la vaca, el alantocorion es la única membrana unida al endometrio, por las carúnculas. Ésta se identifica como una banda de tejido deslizante del punto de fijación, inmediatamente antes de la pared del cuerpo uterino (Zemjanis, 1987; Gordón, 2006). 90 A los 45 días de preñez, la vesícula amniótica crece ya al tamaño de un huevo de gallina (4cm). El útero todavía está en posición alta, dentro de la cavidad; el tono del útero aumenta y los placentomas empiezan a formarse. Si se pone la mano por debajo del útero se facilita sentir la estructura. A los 60 días, el útero comienza a colgar sobre el borde pélvico a medida que el producto crece. Su forma es parecida a un plátano aplastado en el cuerno donde se encuentra el feto de unos 6cm, con un cuerno más pequeño y corto del otro lado, el cuello uterino se encuentra muy cerca del borde de la cavidad pélvica. En 90 días, el becerro y los líquidos siguen aumentando midiendo ya unos 15cm de largo, ya es posible palpar la cabeza, en esta fase el útero cuelga aun más hacia la cavidad abdominal y un cuerno es considerablemente mayor en el otro lado. Su forma es parecida a un guante de boxeo. A los 120 días, el feto ha crecido unos 25cm de longitud y su cabeza es del tamaño de una lima, los cotiledones son firmes y son ya palpables de unos 4cm con forma ovalada. Las primeras diferencias a partir de los 150 días y hasta el fin de la gestación se refieren al crecimiento del feto y al cambio de la proporción de los líquidos y el feto (Sorensen, 1984; Herman, 1996). Otra indicación de la gestación temprana, es el aumento considerable del flujo sanguíneo de la arteria media. En condiciones normales se pulsa como una arteria normal, pero cuando la gestación está avanzada, una ligera compresión revela una sensación vibrátil, característica, que se conoce con el término de frémitus (Zemjanis, 1987; Peters, 1991). Los falsos positivos se producen porque el útero es retraído para permitir una palpación detallada, por involución uterina incompleta, presencia de piómetra o mucometra. Asimismo, los falsos negativos se pueden producir porque los datos registrados sobre la cubrición son incorrectos o la vaca ha sido cubierta o inseminada con posterioridad a la fecha registrada (Noakes, 1999). 91 MATERIAL ALUMNO: Overol, botas, guantes de palpación, guantes de látex, lubricante, cuerdas. MATERIAL BIOLÓGICO: Vacas en etapa reproductiva del centro de producción bovina. PROCEDIMIENTO. 1. Inmovilizar a la hembra con ayuda de una manga de manejo o con cuerdas, colocar un bozal y fijarla en un lugar firme, puede ser un poste o tubo. 2. Colocarse el guante de palpación y de látex si así lo prefiere, se puede usar cualquier mano. Recuerde voltear el guante para evitar que las uniones laterales dañen la mucosa rectal. 3. Lubricar el guante de palpación, recuerde poner un poco de lubricante en la parte dorsal de la mano, en la palma no es de utilidad. 4. Se toma la cola con la mano libre y se levanta, los dedos de la otra mano se unen estrechamente adoptando una forma puntiaguda, de esta forma la mano se inserta en el ano y recto con un empujón suave y firme, el movimiento debe ser continuo hasta que llegue al codo, entonces se debe hacer un medio puño para seguir penetrando esto evitara una perforación intestinal, como se muestra en la figura 23. Figura 23. Introducción de la mano en el recto de la vaca. 5. Si hay demasiado contenido fecal, trate de sacarlo con la mano en forma de paleta para facilitar el proceso. 6. Identificar las estructuras del aparto reproductor, buscando signos de preñez: en ovarios se busca la presencia de cuerpo luteo, en cuernos, se realiza la 92 palpación de para identificar las membranas deslizantes en etapa temprana, mas avanzada la gestación se palparan las carúnculas o incluso el producto. 7. Inmediatamente después de realizado el diagnostico, se libera la hembra, colocándola en su corral. 8. Cuide que en la zona donde se realizó el manejo, no queden los guantes desechados o alguna basura. Estos desechos se colocaran en bolsas de color amarillo y se llevaran al incinerador para su eliminación. 9. Como punto final los alumnos por equipo, entregaran un reporte de las actividades realizadas, elaborando un formato, donde registren los datos del animal, de la explotación, examen clínico, etc. 93 Diagrama Ecológico Práctica IX. Diagnóstico de gestación, por el método de palpación rectal en en vacas. Sujeción de las hembras Palpación del aparato reproductor de la hembra utilizando guante de palpación con o sin guante de látex Fin de la práctica Recolectar y depositar los guantes en una bolsa amarilla. Incineración 94 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA IX DIAGNÓSTICO DE GESTACIÓN, POR EL MÉTODO DE PALPACIÓN RECTAL EN VACAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 95 Práctica X. Diagnóstico de gestación por ultrasonido en vacas. Duración: 4 horas. OBJETIVO El alumno aprenderá a realizar diagnóstico de gestación en vacas, con ayuda del ecógrafo. Conocerá las ventajas de la utilización del ecógrafo en su desempeño profesional. GENERALIDADES. La ultrasonografía o ecografía de ultrasonido en tiempo real es una valiosa tecnología ampliamente utilizada durante los últimos 25 años para estudiar y evaluar las estructuras anatómicas y el estado funcional del aparato reproductivo de los bovinos y de otras especies de interés zootécnico. Tiene la propiedad de permitir observar los órganos genitales en forma rápida, sin ocasionar daño alguno. Entre sus ventajas se encuentra la posibilidad de realizar una evaluación más exacta y objetiva del útero y ovarios que mediante la palpación rectal (Perea, 2000). La ecografía o ultrasonografía es una técnica en la que se emplea ondas de sonido de alta frecuencia para producir imágenes de los tejidos blandos y órganos internos, las cuales podemos visualizar a través de la pantalla del ecógrafo. La aplicación del ultrasonido en las especies bovina y equina corresponde a los años 80, sin embargo su desarrollo y perfeccionamiento para el estudio de los eventos reproductivos se ha acelerado en la presente década. La ecografía es una técnica de diagnóstico por imagen sobre la base de la emisión de ultrasonidos y la recepción de ecos. Estos ecos se producen por la reflexión de los ultrasonidos a nivel de los distintos tejidos. Cuanto mayor sea la reflexión, mayor intensidad tendrán los ecos, pero menor cantidad de ultrasonidos serán capaces de seguir avanzando y mandar información. En el formato de imagen llamado modo B, estos ecos van e ser presentados como puntos de brillo, que serán tanto más brillantes cuanto mayor sea la reflexión, y serán en una posición 96 proporcional al tiempo que han tardados en ser recibidos. La imagen ecográfica se corresponde con el conjunto de puntos de brillo, que representa un corte anatómico de la región examinada. Los órganos o tejidos serán hiper, hipo o anaecogénicos, según la cantidad de ultrasonidos que reflejen. Sin embargo, en la imagen aparecen puntos de brillo que no se corresponden con ecos producidos a nivel de estructuras reales del paciente, son los denominados artefactos, y es importante conocerlos y aprender a diferenciarlos de los ecos reales, para poder interpretar correctamente las imágenes (Sorencen, 1984; Herman, 1996; Tamayo, 2000). Es un excelente método que puede ser utilizado a partir del día 26 de gestación, en casos que el objetivo principal es el diagnóstico temprano, pero es más exacto entre los días 30 y 75. La reproducción bovina cuenta con esta prueba diagnóstica directa que provee información precisa de las estructuras del tracto reproductivo, lo que permite mejorar o confirmar el diagnóstico y aún monitorear un tratamiento. Mediante el ultrasonido pueden detectarse problemas reproductivos, ya que puede diferenciar pus y líquidos y hacer un diagnóstico definitivo (Fricke, 2000). En la práctica es importante determinar la presencia de un cuerpo lúteo funcional y la evaluación del embrión junto con la visualización de los latidos cardíacos. La frecuencia del corazón disminuye de 188 latidos/ minuto el día 20 de la preñez a 145 aproximadamente el día 26 y luego se mantiene prácticamente constante hasta los 2 meses. Es posible observar gestaciones de menos de 18 días con un transductor de 7. 5 MHz y de 18 a 20 o más con 5. 0 MHz; sin embargo, no es recomendable realizar diagnóstico de certeza antes de los 27 días. En estos casos la imagen no es ecogénica y corresponde al líquido amniótico y alantoideo. Alrededor de los días 25 - 27 se puede distinguir el embrión como un punto blanco (ecogénico) dentro de una zona negra (anecogénica). El líquido alantoideo se incrementa rápidamente después del día 28 y se extiende por todo el cuerno gestante. Por su parte, la membrana amniótica se distingue nítidamente en las imágenes ecográficas posteriores a los 30 días de preñez (Rodríguez, 2005; Gordón, 2006). El funcionamiento del ecógrafo se basa en la emisión y recepción de ondas sonoras de alta frecuencia (no audibles para el oído humano) desde un transductor de ultrasonido o sonda, que se introduce en el recto a través de cuyas paredes se examinan los órganos 97 reproductivos de la vaca (Figura 24). Los impulsos de ultrasonido son emitidos y dirigidos hacia el órgano evaluado gracias a los movimientos y variación del ángulo del transductor dirigidos por el operador. Estos impulsos viajan a través de los tejidos a una velocidad constante hasta encontrar un órgano en cuya superficie “rebotan” y regresan en forma de eco al transductor. Como resultado de este mecanismo se forma una imagen dinámica en la pantalla del monitor del equipo que muestra una delgada y profunda área, como si fuera una rebanada, de la estructura o tejido que se está evaluando. Esta imagen se observa en la pantalla de acuerdo a la densidad o dureza del tejido examinado, en una variedad de tonos que van desde el negro (color como se observan los líquidos) al blanco (los huesos y tejidos muy densos), incluyendo una amplísima gradación de tonos grises (cuerpo lúteo, estroma ovárico, etc.). Las frecuencias mas comúnmente usadas en la evaluación de los órganos reproductivos de grandes animales como la vaca son 3. 5, 5. 0 y 7. 5 MHz. Las estructuras relativamente pequeñas, como los folículos ováricos localizados más próximos del transductor se pueden estudiar con una frecuencia entre 5. 0 y 7. 5 MHz. Por el contrario, grandes estructuras localizadas cerca del transductor tales como fetos y úteros de mediana y avanzada gestación, se observan mejor con frecuencias de 3. 5 MHz. (Perea, 2000; Gordón, 2006). 98 Cuello uterino Recto Vagina Transductor de ultrasonido Ondas de ultrasonido Ecos de ultrasonido Cuernos uterinos Ovario Figura 24. Emisión y recepción de ondas de ultrasonido desde un transductor hacia los órganos reproductivos de la vaca (De Lucas, 2007).19 En el diagnóstico y valoración ecográfica del sistema reproductor de la vaca es imprescindible lograr imágenes de alta calidad, disminuyendo la proporción de artefactos, por lo que la preparación de la hembra a examinar y de las condiciones de trabajo y protección contribuyen notablemente a obtener una mayor precisión en la interpretación de dichas imágenes (Noakes, 1999; Tamayo, 2000). 19 Adaptada de De Lucas, 2007. Memorias de curso de ecografía. FESC. 99 MATERIAL DE LABORATORIO: Ultrasonido, transductor transrectal para bovinos. MATERIAL ALUMNO: Overol, botas, guantes de palpación, guantes de látex, lubricante, cuerdas. MATERIAL BIOLÓGICO: Vacas en etapa reproductiva del centro de producción bovina. DESINFECTANTE: Yodo. PROCEDIMIENTO. 1. En la práctica de rutina, la ecografía se realiza parecido a la exploración del sistema reproductor por vía rectal. 2. Generalmente no es necesario vaciar el recto de su contenido de heces. 3. Previo a la introducción de la sonda se debe efectuar una breve exploración rectal, con el propósito de conocer la ubicación del útero y de los ovarios, pues no es recomendable palpar y hacer la ecografía simultáneamente, ya que el ecografista debe concentrar su atención en la observación y valoración de las imágenes registradas en la pantalla del ecógrafo. 4. Se precisa un buen contacto del transductor con la mucosa rectal para obtener imágenes de mejor calidad. 5. La sonda se introduce por vía transrectal sujeta entre los dedos pulgar, índice y la palma. 6. Se sitúa sobre la localización del útero y ovarios, desplazándola suavemente; con movimientos controlados del transductor se logra una buena recepción de imágenes. 7. Un diagnostico positivo se determina con la presencia de estructuras tales como: vesícula amniótica, localización de placentomas o el feto. 8. Se retira el transductor del recto de manera cuidadosa. 9. Antes de ser usado en otra hembra se debe limpiar con toallas desechables y desinfectar con agua y yodo al 5%. 100 Diagrama Ecológico Práctica X. Diagnostico de gestación, por ultrasonido en vacas. Sujeción de las hembras Palpación del aparato reproductor de la hembra utilizando guante de palpación con o sin guante de látex, con ayuda de un transductor transrectal. Fin de la Práctica Recolectar y depositar los guantes y cualquier otro desecho en una bolsa amarilla Incineración 101 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA X DIAGNÓSTICO DE GESTACIÓN POR ULTRASONIDO EN VACAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 102 PRACTICA XI. Identificación de los diferentes tipos de placentas en las especies domésticas. Duración: 4 horas. OBJETIVO. Que el alumno adquiera la capacidad y habilidad para identificar las características anatómicas, histológicas y obstétricas de los tipos de placentas en las diferentes especies domésticas. GENERALIDADES. La clasificación de los mamíferos se basa en la naturaleza de las relaciones materno fetales: los mamíferos prototerianos o monotremas, incluyen al ornitorrinco y equidna, quienes son ovíparos; los mamíferos metaterianos o marsupiales incluyen animales como el canguro y la zarigüeya, estos animales forman un saco placentario vitelino transitorio, sin embargo, no hay contacto íntimo entre las membranas fetales y la mucosa uterina ya que no se trata de una placenta verdadera; el resto de los mamíferos incluye a la subclase euteriana, éstos son los verdaderos mamíferos placentados. Las membranas fetales (corion, amnios, saco vitelino y alantoides) y el endometrio, contribuyen a la formación de la placenta, esto se lleva a cabo de modo particular o en combinaciones específicas (Banks, 1988). El aparato reproductor de las hembras mamíferas está constituido de tal modo que se facilite la fertilización. El aparato permite el desarrollo del huevo fertilizado dentro del útero; ahí, se desarrollan relaciones complejas entre los tejidos fetales y maternales. La placenta es una edificación que tiene por misión realizar un estrecho contacto, de naturaleza vascular, entre una parte específica de las membranas fetales y la superficie endometrial en razón de permitir cambios nutritivos entre la madre y el feto. Además de su función metabólica, la placenta constituye en cierta medida, y en función de su estructura, un órgano de protección más o menos eficaz, según las especies, y está provisto de una función secretora de naturaleza endocrina. En los animales domésticos 103 se emplea indistintamente los términos placenta y membranas fetales aunque en forma estricta éstas forman parte de la placenta fetal (Banks, 1988; Fradson, 1992; Osnaya, 2008). La placenta de acuerdo con la posición que el embrión ocupa con respecto a las paredes del útero, puede ser: 1) central, en ésta el feto ocupará durante toda la gestación la cavidad natural de la luz uterina, el sitio o sitios de adhesión pueden ser difusos, cotiledonarios o zonarios; 2) excéntrica, en ésta el feto erosiona e invade la mucosa uterina en un sitio especial, pero mantiene contacto con la luz uterina y sus fluidos a través del saco vitelino; 3) intersticial, se caracteriza por la invasión completa del blastocisto en la mucosa uterina perdiendo contacto con el lumen, la expansión de las membranas fetales provoca que el lumen se oblitere durante la gestación (Ferrugem, 2006). La clasificación anatómica de las placentas se basa en la forma del área o la distribución de las vellosidades coriónicas en la superficie endometrial o las membranas fetales, se conocen cuatro placentas principales: 1) difusa, en donde la mayor parte de la superficie coriónica se cubre con pequeñas vellosidades o pliegues que corresponden a depresiones o surcos del endometrio como es en el caso de yeguas y cerdas; 2) cotiledonaria o múltiple, ésta tiene vellosidades coriónicas restringidas a cierto número de áreas ovales o circulares bien definidas, llamadas cotiledones, que se sobreponen en áreas uterinas especializadas similares, conocidas como carúnculas. Los placentomas son unidades placentarias formadas por la unión de cotiledones fetales y carúnculas uterinas, características que se presentan las vacas, ovejas y cabras; 3) zonal, tiene vellosidades agregadas a una banda, que rodea por completo (en perras y gatas) o de manera incompleta (en hurón) la mitad del saco coriónico; 4) discoidal, se presenta en roedores y primates, la placenta forma un disco oval en el corióalantoides por medio del que se une con el endometrio, la conexión tiene lugar en una zona o zonas de forma oval (De Alba, 1985; Banks, 1988; Ruckebusch, 2000; Ferrugem, 2006). 104 Figura 25. Clasificación anatómica de las diferentes placentas. Placenta Difusa. Placenta Zonal Placenta Cotiledonaria. Placenta Discoide. Groosser en 1927, considerando las condiciones histológicas, por las que se realiza el contacto entre la placenta fetal y la placenta materna por las vellosidades implantadas sobre el alantocórion, diferenció los siguientes tipos: 1) La placenta epiteliocorial es muy rudimentaria y el intercambio de sustancias se realiza con dificultad, los anticuerpos de la madre no puede pasar al feto, el cual adquirirá la inmunidad pasiva después del nacimiento al tomar el calostro de la madre. En este tipo de placenta únicamente existe una aposición entre las estructuras maternas intactas y las estructuras fetales. El corion se adhiere contra el epitelio de la mucosa uterina. Entre la sangre materna y la fetal existen seis estratos tisulares, de los que tres pertenecen a la madre: endotelio vascular, tejido conjuntivo, epitelio del útero materno; los otros tres pertenecen a la placenta fetal: epitelio del corion (trofoblasto), tejido 105 conjuntivo, endotelio de los vasos fetales. Esta placenta es característica de la cerda y la yegua (Hunter, 1987; Banks, 1988; Vatti, 1992; Buxadé, 1995; Climent, 2005). 2) La placenta sincitiocorial (antes llamada sindesmocorial) se caracteriza porque el trofoblasto provoca localmente la erosión del epitelio uterino, poniéndose en contacto con el tejido conjuntivo de la mucosa uterina. Los intercambios se realizan aquí entre las mismas capas, a excepción del epitelio uterino. Este tipo de placenta se observa en la oveja, la cabra y la cierva, así como en algunas partes de la vaca (De Alba, 1985; Geoffrey, 1990; Bowen, 2000; Igwbuike, 2006; Osnaya, 2008). Durante el periodo de formación de las membranas la placenta crece rápidamente y desarrolla muchos cotiledones. La placenta de ovejas o vacas puede formar hasta 150 cotiledones y son únicos para los animales en los que la unión de la placenta se limita a las carúnculas. La placenta bovina esta constituida por muchas y pequeñas unidades funcionales llamadas placentomas, cada una constituida por un cotiledón fetal y una carúncula materna (Hill, 2001). 3) La placenta endoteliocorial, se presenta en los carnívoros, la erosión local provocada por el epitelio del corion (trofoblasto) afecta al epitelio y al tejido conjuntivo uterino, de manera que el contacto se establece entre el trofoblasto y el endotelio vascular materno. Aquí el intercambio se realiza con mayor facilidad registrándose ya el paso de algunos anticuerpos a través de la barrera placentaria, que en este caso consta de 4 capas (Hunter, 1987; Banks, 1988; Vatti, 1992; Buxadé, 1995; Climent, 2005). 4) La placenta hemocorial, es característica de los primates y roedores e incluso en este tipo de placenta se incluye al conejo. La erosión llega a destruir incluso el endotelio vascular, poniéndose el corion en contacto directo con la sangre materna, extravasada de los capilares para formar amplias lagunas sanguíneas, limitadas por el propio trofoblasto, en las que se bañan las vellosidades coriales (Hunter,1987; Banks,1988; Vatti, 1992; Buxadé, 1995; Climent, 2005). 106 Se tiene la clasificación de un tipo más de placentación, la placenta hemoendotelial, Grosser menciona que en alguna zona circunscrita de la placenta de los roedores, hay una unión aún más intima, por desaparición del epitelio y el mesenquima del corion, entrando casi en contacto el endotelio vascular embrionario con la sangre materna, hay que considerar que siempre existe una capa de células trofoblásticas entre el endotelio del feto y la sangre materna (Climent, 2005). De acuerdo a las modificaciones del endometrio, las placentas se clasifican en: semiplacenta o adeciduas, cuando el endometrio se mantiene casi intacto en la unión feto útero materno y en el parto no genera perdidas tisulares importantes ni grandes hemorragias, (yegua, cerda, vaca, oveja y cabra) y placenta completa o decidua, cuando existe una amplia penetración de las vellosidades del corion con la consecuente destrucción del endometrio ( carnivoros, primates y roedores) (Osnaya, 2008). 107 A. Placenta Epitelio-corial. C. Placenta Endotelio-corial. B. Placenta Sincitio-corial. D. Placenta Hemo-corial. Figura 26. Clasificación histológica de los diferentes tipos de placenta. 1. Endotelio de los vasos fetales. 2. Tejido conjuntivo del corion. 3. Epitelio del corion 4. Epitelio del útero. 5. Tejido conjuntivo del útero. 6. Endotelio de los vasos del útero. 7. Sangre materna. 8. Células trofoblasticas. 108 EQUIPO E INSTRUMENTOS: Charolas. MATERIAL ALUMNO: Bata, estuche de disección, guantes de cirujano, hilo de algodón, etiquetas, bisturí, pinzas, tijeras, aguja curva para sutura. MATERIAL BIOLÓGICO: Aparato reproductor de diferentes especies de hembras domésticas con gestación temprana. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositar el material biológico en las charolas. 3. Para proceder a la disección del material biológico, se requiere la utilización de guantes de cirujano y el instrumental adecuado. Identificar el mayor número de estructuras del aparato reproductor con gestación temprana. 4. Con ayuda de hilo y etiquetas anotar el nombre de la estructura que se está señalando. 5. Cada equipo explicará, las estructuras que identifique en el material biológico, al profesor y a todo el grupo. 6. El material biológico así como los guantes de látex resultante de esta práctica se, depositarán en bolsas de plástico color amarillo, para su destino final, la cremación. Es importante destacar que éste será llevado por los alumnos que se designen en el momento de la práctica por el profesor. 7. El material utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuagará con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 8. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 109 9. La limpieza y desinfección del área de trabajo es de suma importancia para mantener limpio el laboratorio. Las mesas se desinfectarán y secarán con toallas de papel. 10. Como último punto se realizará la evaluación de la práctica mediante el llenado del siguiente cuadro. 110 EVALUACIÓN PRÁCTICA XI Completa el cuadro que a continuación se presenta, señalando con una “x” los tejidos. Clasificación Tipo Especies Número de capas Epitelio del útero ÚTERO Tejido conjuntivo FETO Endotelio Corion Tejido conjuntivo Endotelio Epitelio- Corial Sincitio – Corial Endotelio- Corial Hemo- Corial 111 Diagrama Ecológico Práctica XI. Identificación de los diferentes tipos de placentas en las especies domésticas Depositar el material biológico en charolas Disección del material Biológico Descripción de los diferentes tipos de placentas Fin de la Práctica Limpiar y desinfectar las charolas y mesas de trabajo Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas material biológico el Incinerar 112 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XI IDENTIFICACIÓN DE LOS DIFERENTES TIPOS DE PLACENTAS EN LAS ESPECIES DOMÉSTICAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 113 Práctica XII. Estudio de pelvimetría estática fetal, maniobras obstétricas. OBJETIVO. Capacitar a los alumnos en la atención y resolución de partos distócicos en las hembras domésticas, con el fin de continuar con la vida productiva de una hembra y la viabilidad de su o sus productos. GENERALIDADES. La Obstetricia es la rama de la medicina que trata del embarazo, el parto y el puerperio, que tiene como objetivo el nacimiento de un producto vivo con prevención de daño a la madre. La Obstetricia animal nació de la necesidad del hombre de servirse de los animales como productores de alimentos (carne y leche) y como animales de trabajo. Las pérdidas que los trastornos del parto provocaban llevaron a los pueblos pastores a intervenir para disminuir estas pérdidas y aliviar el sufrimiento de los animales. Por ejemplo, ya en Antiguo Egipto, 300 años a C, se encuentran referencias de intervenciones obstétricas mediante tracción. Ningún otro proceso vital tiene tantas posibilidades de crisis como el nacimiento, pues significa para la madre y el feto un gran esfuerzo (Ebert, 1990). La fertilidad se refiere a que la hembra debe tener una gestación, un parto y puerperio normal y dar una cría viva, además debe ser capaz de protegerla y alimentarla hasta que ésta pueda valerse por sí misma. Esta definición recalca la importancia que tiene la gestación, el parto y el puerperio, lo que indica lo indispensable que es cuidar de estas etapas si se desea mantener la fertilidad en el rebaño (Weisbach, 1993) El parto o la parición, se define como el nacimiento de un producto seguido de la expulsión de la placenta. En la posición normal de nacimiento, el feto descansa en su abdomen con las patas anteriores dirigidas hacia la abertura uterina (el cérvix) y su cabeza descansando entre sus patas delanteras (figura 27). Solo el 5% de los partos presentan una posición anormal, es decir solo un parto de 20 ( Peters, 1991). El parto abarca los diferentes procesos fisiológicos por los cuales el útero expulsa el o los 114 productos. Para que el parto pueda ocurrir, es necesario que ocurran cambios, tanto en la madre como en el feto (Cavestany, 2006). Figura 27. Presentación del producto antes del parto.20 La atención del parto comienza con conocer la historia clínica de la paciente, como datos importantes podemos señalar la edad y número de partos de la hembra, historia del parto previo , estado de salud en la última etapa de gestación, datos del servicio y fecha esperada del parto, antecedentes del macho utilizado (Barberán,1981). Las fases del parto se dividen en tres (Peters, 1991; Cunningham, 2003; Cavestany, 2006): 1. PREPARACIÓN. Es el tiempo necesario para la presentación del feto en el canal de parto, así como la dilatación del cérvix. La presentación del feto se debe a las contracciones uterinas de ligera intensidad, por otro lado, la dilatación es causa de la presión que ejerce el feto y sus membranas una vez colocados en el canal. 20 Adaptado de Peters, 1995. 115 2. EXPULSIÓN DEL FETO. Las contracciones uterinas continúan; así como las contracciones abdominales, el feto pasa por el canal de parto y por ultimo se da la expulsión. En esta etapa, el producto puede encontrarse aún en la segunda "bolsa de agua" (fluido amniótico). Luego de que la cabeza ha pasado a lo largo del canal del parto, el resto del cuerpo demanda generalmente poco esfuerzo extra para ser expulsado. 3. EXPULSIÓN DE PLACENTA. En esta etapa las contracciones continúan para que la placenta sea expulsada del útero. Se debe de reconocer por medio de la palpación, la forma en que se presenta el feto en el canal obstétrico o la estática fetal; esta estática se identifica como: presentación posición, actitud o postura que son los términos descriptivos del producto (Grunert, 1976; Stephen, 1979; Cavestany, 2006) 1. PRESENTACIÓN. Esta es la dirección del feto con respecto a la pelvis de la madre, con tres variantes, la anterior que presenta, manos y cabeza, la posterior que presenta patas y cadera y la transversal que puede presentar vientre, lomo o un costado. 2. POSICIÓN. Es la orientación longitudinal del feto respecto del sacro de la madre, con tres variantes, ventral el producto está boca arriba, dorsal aquí está boca abajo y lateral donde el feto está de lado. 3. POSTURA. Es la posición de las patas cabeza y cuello, se determina como extendidos o flexionados. La disposición normal comprende, presentación anterior con posición dorsal y postura de miembros extendidos. 116 Figura 28. Disposición normal del feto al momento del parto.21 Distocia significa etimológicamente “parto difícil”; y en el lenguaje obstétrico se usa para designar que no puede realizarse con las fuerzas de la madre solamente, por este motivo es sinónimo de parto artificial o en otras palabras el parto que tiene lugar con intervención manual o instrumental del obstétrico (Vatti, 1981; Sloss, 1987;Noakes, 1997; Estrada, 2006). Las consecuencias de una distocia pueden llevar a la muerte fetal, reducción de la fertilidad, esterilidad, incluso muerte de la hembra. Las causas de distocia pueden ser maternas o fetales (Stephen, 1979; Estrada, 2006). MATERNAS. 1. Defectos del miometrio, hipocalcemia, torsión o ruptura uterina 2. Torsión o ruptura uterina 3. Inercia uterina primaria o secundaria 4. Canal pélvico inadecuado 5. Dilatación insuficiente del cuello 6. Estreches vulvar o vaginal 21 Adaptado de Peters, 1995. 117 FETALES. 1. Inmadurez fetal, presenta baja concentración de corticosteroides. 2. Fetos de gran tamaño 3. Presentación anormal 4. Muerte fetal 5. Deformaciones del producto conocidos también como monstruos Presentaciones anormales del producto causantes de distocia.22 22 Figura 29. Presentación anterior con posición dorsal y postura de miembro anterior flexionado Figura 30. Presentación anterior con posición dorsal y postura de miembros anteriores flexionados Figura 31. Presentación transversal con posición lateral y postura de miembros extendidos. Figura 32. Presentación anterior con posición ventral y postura de miembro derecho flexionado. Imágenes adaptadas de Estrada, S. 2006. 118 Figura 33. Presentación anterior con posición dorsal y postura de flexión de cabeza Figura 35. Presentación posterior con posición dorsal y postura de miembros flexionados (Perro sentado) Figura 34. Presentación anterior con posición dorsal y postura de flexión dorsal de cabeza y cuello (hacia arriba) Figura 36. Presentación transversodorsal. MANIOBRAS OBSTÉTRICAS TRACCIÓN. Es la acción de jalar el feto en forma rítmica, hasta lograr su expulsión, esta tracción se puede lograr con cadenas obstétricas, con lazos obstétricos, de forma manual o utilizando extractores mecánicos (Sloss, 1987; Noakes, 1997). MUTACIÓN. Es la manipulación necesaria para colocar en presentación, posición y actitud normales al feto. Los movimientos incluidos en esta división son (Vatti, 1981): a) Retropulsión: Hay que empujar al feto en la cavidad uterina en dirección al diafragma, a fin de que se tenga espacio para maniobras de rectificación. 119 b) Rotación: Consiste hacer girar al feto sobre su eje longitudinal hasta la posición dorso-sacra o lumbo-sacra y luego efectuar la extracción. c) Versión: Es la rotación del feto de la presentación transversal sobre su eje hasta la presentación anterior o posterior. d) Reposición de las extremidades: Esta maniobra es necesaria siempre que los miembros del feto obstaculicen el parto. CESAREA (Barberán, 1981; Vatti, 1981). Esta operación consiste en seccionar el útero mediante una incisión de la pared abdominal para extraer los fetos, esta intervención quirúrgica, es utilizada como último recurso cuando se presenta una distocia para tratar de salvar a la madre y a la cría. FETOTOMÍA: Es la reducción del tamaño del feto seccionándolo, con el objeto de permitir la extracción, esto en el caso de un producto no viable o muerto, que no puede ser expulsado por la madre y que pone en peligro la vida de ésta (Sloss, 1987; Noakes, 1997). PUERPERIO Es el espacio de tiempo entre la expulsión de la placenta y la involución del aparato reproductor a su estado anatómico y funcional previo a la gestación. Estos cambios son el cierre del cérvix, aumenta el tono uterino, se reduce de tamaño y peso, se da la involución del cuerpo luteo, reiniciándose la actividad ovárica. Uno de los principales problemas del puerperio es la retención placentaria y las infecciones uterinas que siguen casi siempre a un parto distócico y son una de las principales causas del aumento del parámetro reproductivo de días abiertos (Olivera, 2006). MATERIAL: Videos de obstetricia. PROCEDIMIENTO. 1. Los alumnos acudirán a la sala de audio-visual a observar videos relacionados con la práctica. 2. Al término de la práctica se comentará la información de cada uno de los videos 120 EVALUACIÓN PRÁCTICA XII. 1. Escribe la técnica de fetotomía que se presenta en el video. 2. Escribe una de las técnicas de cesárea que se presentan en el video de obstetricia. 3. Realiza un cuadro sinóptico con todas las causas maternas y fetales de distocia. 121 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XII MANEJO OBSTÉTRICO. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 122 Práctica XIII. Técnica de recolección de semen en bovinos, ovinos, caninos y verracos. Duración 4 horas OBJETIVO. Que el alumno adquiera la habilidad de recolectar semen de las diferentes especies domésticas. Recolección de semen de bovino. GENERALIDADES. En la producción de bovinos de leche y carne, el método de recolección en la vagina artificial es de los más difundidos en la actualidad. El método consiste en permitir que un toro monte a una vaca o un maniquí y que eyacule en la vagina artificial dirigiendo el pene hacia dentro de ella. La vagina artificial consiste en un tubo cilíndrico rígido, con un revestimiento de goma de una delgada pared, que forma una cámara que se llena de agua a 42º C. Un extremo del cilindro va sujeto a un embudo de goma que sostiene el receptáculo recolector (Salisbury, 1978). Para aumentar el volumen del eyaculado y el número de espermatozoides eyaculados, los toros suelen ser estimulados antes de la recogida (Sorensen, 1984; Noakes, 1999). Antes de colectar el semen se deben tener en cuenta dos aspectos muy importantes, la higiene y el estimulo del semental. Con anterioridad de la monta deberá bañarse al semental o por lo menos lavar con agua y secar perfectamente el vientre y la zona del prepucio; el mechón de pelos del orificio prepucial debe estar limpio y los pelos se cortarán a una longitud de aproximadamente 2cm. Para estimular al toro se le permite montar sobre el maniquí desviando el pene, tomando con la palma de la mano la piel del prepucio sin ofrecerle la vagina artificial. La monta falsa aumenta la calidad del semen con relación al volumen, la concentración espermática y la motilidad. En el toro y otros rumiantes, la temperatura de la vagina es el estimulo más importante para la eyaculación (Bayard, 2006). 123 La mayor parte del semen es recogido mediante la inducción a que el semental eyacule en el interior de la vagina artificial, que se construye de tal forma que simula la sensación de la vagina de la vaca (Peters, 1991). Figura 37. Vagina artificial para la recogida del semen de toro. En los ovinos y caprinos, la vagina artificial es una imitación de la vagina de la oveja y de la cabra. El estimulo térmico (temperatura) es necesario para producir la eyaculación. La hembra maniquí se debe sujetar a lo que se llama potro. La hembra no debe tener el pelo o la lana muy largo, ni suciedad en la parte trasera. El operario se coloca en el lado derecho del maniquí, agachado o en cuclillas y coloca la vagina artificial en el flanco de ese mismo lado sujetándolo con la mano derecha, de tal forma de que el extremo abierto quede mirando hacia el macho y abajo, con un ángulo de 45° aproximadamente. La espita de la vagina artificial debe dirigirse hacia abajo para evitar su contacto con el macho. El tubo recolector debe mantenerse firme y caliente sujetándolo parcialmente con la mano. Cuando el semental entre en el recinto puede que muestre un comportamiento cortés hacia la hembra, pero el operario siempre debe estar prevenido a que el semental de inmediato pueda montar al maniquí. Cuando esto ocurra, el pene erecto se dirige al extremo libre de la vagina artificial. Los movimientos vigorosos hacia arriba y hacia delante significan que el macho ha eyaculado. Se debe permitir que el macho retire el pene de la vagina antes de retirar ésta. Inmediatamente después de la 124 recogida la vagina artificial se cambia de posición, quedando el tubo en la parte inferior a la vez que se sujeta con la mano (Sorensen, 1984; Evans, 1990). Figura 38. Vagina artificial para ovinos. La recolección de semen por estimulo eléctrico, se realiza con ayuda de un estimulador accionado con baterías que proporciona una salida de 10 o 15 voltios. Cuando el recto del macho está seco, se recomienda utilizar los 15 voltios. El macho se coloca de cubito lateral, sobre el suelo, el prepucio se debe limpiar perfectamente, la sonda se lubrica con vaselina y se introduce en el recto a una profundidad de 15 a 20cm. Cuidando no lesionar la mucosa. En los caninos, la extracción debe realizarse en un ambiente tranquilo colocando al perro sobre una superficie donde no pueda resbalar (Laurence, 2000). El semen, se recolecta aplicando un masaje manual sobre la porción caudal del bulbo del glande. Para recolectar el semen se introduce la mano enguantada desde la parte posterior entre las patas del perro, mientras que la parte caudal del bulbo del glande se estimula aplicando un masaje manual a través del prepucio. Cuando se logra la erección parcial, la vaina prepucial se desliza hacia atrás liberando el bulbo del glande y el pene se da vuelta, tal como ocurre durante el apareamiento natural (Allen, 1992; Farstad, 2000; LindeForsberg, 2006). 125 En los verracos cuando están habituados a saltar, la extracción del semen se puede realizar en un potro fijo en un sitio específico o una sala de recolección. El ritmo de colección comienza una vez a la semana y posteriormente se realiza con un intervalo de 4 y 7 días. Todo el material que se que entre en contacto con el semen debe estar limpio y esterilizado y a una temperatura de 37º C. El eyaculado se recogerá directamente en un vaso de precipitado o en recipientes desechables (vaso o bolsa de plástico) situados dentro de un termo para mantener la temperatura cercana a los 37º C. A la vez, sobre el termo se coloca una gasa, que actúa como filtro para que durante la recolección se impida la mezcla de la fracción espermática del eyaculado con el gel y la tapioca. Cuando el verraco está sobre el potro y extrovierte el pene, se fija con la mano el tirabuzón, manteniéndose así procurando que el eyaculado caiga sobre el recipiente, durante toda la eyaculación (Martín, 2000). Otra forma de recolectar semen de verraco es también la utilización de un maniquí que lleva montada una vagina artificial con el recipiente colector de semen (König, 1979). Figura 39. Recolección de semen de verraco23 23 Adaptado de: Köing, I. 1979. 126 EQUIPO E INSTRUMENTOS: Vaginas artificiales para bovinos, ovinos y caprinos, tubos colectores graduado, termo, termómetro de altas, potro para verracos, potro para ovinos. MATERIAL ALUMNO: Botas, overol, gasas, ligas. MATERIAL BIOLÓGICO: Sementales de bovino, ovino, caprino, canino y cerdo. PROCEDIMIENTO. Bovino. 1. Colocar al maniquí en el área asignada, sujetándola. 2. Lavar con agua y secar perfectamente el vientre y la zona del prepucio. 3. Se cortará el mechón de pelos del orificio prepucial a una longitud de aproximadamente 2cm. 4. Estimular al toro, permitiéndole que monte al maniquí, desviando el pene tomando con la palma de la mano la piel del prepucio sin ofrecerle la vagina artificial. 5. Previamente preparar la vagina artificial, con agua caliente aproximadamente a 43 a 46°C, colocar en un extremo el tubo colector y protegerlo con la funda. 6. Después de la monta falsa, el manejador recolectará con ayuda de la vagina artificial el eyaculado, desviando el pene a la entrada de la vagina. Ovino y Caprino. 1. Se prepara el potro y el maniquí (una hembra). 2. Se prepara la vagina artificial, vertiendo agua a 43 a 46ºC y se coloca el tubo colector graduado con ayuda de un cono de plástico, se fija bien. 3. Se suelta al semental para que monte, ya preparado del lado derecho se encuentra la persona que manejara la vagina, que tendrá que tener la habilidad de que al momento que el macho monte, desvíe el pene al interior de la vagina, 127 se debe tener en cuenta que esto es muy rápido y un descuido puede hacer perder el eyaculado. 4. El macho es separado y conducido a su corral. 5. La hembra si no se utiliza más, se suelta con cuidado y se conduce a su corral. Canino. 1. La extracción debe realizarse en un ambiente tranquilo colocando al perro sobre una superficie donde no pueda resbalar. 2. Se aplica un masaje manual sobre la porción caudal del bulbo del glande. 3. Para recolectar el semen se introduce la mano enguantada desde la parte posterior entre las patas del perro, mientras que la parte caudal del bulbo del glande se estimula aplicando un masaje manual a través del prepucio. 4. Cuando se logra una erección parcial, la vaina prepucial se desliza hacia atrás liberando el bulbo del glande y el pene se da vuelta, tal como ocurre durante el apareamiento natural. 5. Posterior a esto, se llevara a cabo la eyaculación, que se recolecta un vaso de precipitado o en un tubo colector. Verraco. 1. La extracción del semen debe realizar en un potro fijo en la sala de recolección. 2. Todo el material que vaya a estar en contacto con el semen, debe estar limpio y esterilizado además de a una temperatura de 37º C. 3. El eyaculado se recogerá directamente en un vaso de precipitado u otros recipientes desechables (vaso o bolsa de plástico) situados dentro de un termo para mantener la temperatura cercana a los 37º C. 4. A la vez, sobre el termo se coloca una gasa, que actúa como filtro para que durante la recolección se impida la mezcla de la fracción espermática del eyaculado con el gel y la tapioca. 5. Cuando el verraco esta sobre el potro y extrovierte el pene, se fija con la mano el tirabuzón, procurando que el eyaculado caiga sobre el recipiente. Manteniéndose así durante toda la eyaculación. 128 EVALUACIÓN DE LA PRÁCTICA XIII. Llena el siguiente cuadro con la información que se te pide. Especie Método utilizado para recolectar semen Volumen de eyaculado Concentración espermática. Requisitos para que se lleve a cabo la eyaculación. Bovino Ovino Caprino Verraco Canino Felino 129 Diagrama Ecológico Práctica XIII. Técnica de recolección de semen en bovinos, ovinos, caninos y verracos. Corrales Laboratorio Sujetar al semental (Canino) Sujetar a l semental (Bovino, ovino, verraco) Recolectar la muestra de semen. Fin de la práctica Recoger cualquier desecho generado: guantes, toallas de papel, etc. La muestra de semen se desechara en la tarja adicionándole agua con hipoclorito al 1%. Limpieza y desinfección de las mesas de trabajo Depósito de basura 130 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XIII TÉCNICA DE RECOLECCIÓN DE SEMEN EN BOVINOS, OVINOS, CANINOS Y VERRACOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 131 PRÁCTICA XIV. Técnica de evaluación de semen. Duración 4 horas OBJETIVO. El alumno conocerá las técnicas empleadas en el laboratorio, para determinar si el semen recolectado en diferentes especies domésticas es de óptima calidad para ser utilizado posteriormente en Inseminación Artificial. GENERALIDADES. El macho juega un papel relativamente importante en la reproducción, ya que dependiendo del método utilizado para dar los servicios, la relación macho-hembra puede variar de 1 a 30 hasta 1 a 1000 y cuando se utiliza inseminación artificial (IA). El éxito o fracaso de la participación del macho, en la eficiencia reproductiva, dependerá de su estado de salud, de su libido, de su capacidad de detectar, montar y servir a las hembras en celo, así como de la cantidad y la calidad de los espermatozoides producidos. La producción de espermatozoides depende del volumen testicular y, fundamentalmente de la edad de los machos, la estación del año y la alimentación que reciben (Pérez, 2006). Después de recogido el semen y antes de usarlo se debe determinar, cuidadosamente la cantidad y la calidad del eyaculado. Para manejar el semen se precisa hacerlo con sumo cuidado par que no se afecte la viabilidad de los espermatozoides (Salomón, 1990). La técnica ideal para la evaluación de la calidad del semen debe ser objetiva, repetible fidedigno y económico. La valoración macroscópica y microscópica del eyaculado permite determinar la calidad, viabilidad y fertilidad de los espermatozoides. No se dispone de una técnica única para determinar con exactitud la fertilidad, pero al combinar varios estudios, se pueden seleccionar los eyaculados que tengan un potencial de fecundación mas elevado (Aisen, 2004). 132 Características del eyaculado. La evaluación del eyaculado comprende de un examen macroscópico que esta integrado por el volumen, color, olor y consistencia; y del examen microscópico que evalúa la motilidad masal, motilidad progresiva, vivos y muertos, morfología y concentración espermática. El volumen del eyaculado se mide directamente en el tubo de recogida ya que este es calibrado y nos permite hacerlo inmediatamente después de la recolección. Este va desde 0.3 a 1.5ml con un promedio de 1 ml, esto depende de la raza edad, estado general del macho y destreza del operario (Salomón, 1990; Aisen, 2004). El color del semen de carnero es lechoso o crema pálido. Un color rosa indica la presencia de sangre, probablemente a causa de lesión en pene, un color gris o pardo sugiere contaminación o infección en el aparato reproductivo, un color amarillo y diluido es por la presencia de orina (Aspron, 1985). La consistencia del semen depende de la relación del contenido de sus dos constituyentes, espermatozoides y plasma seminal. Las muestras de alta consistencia contiene más cantidad de células que las que son acuosas (Salomón, 1990). La motilidad del semen se valora mediante una onda característica de movimiento, cuando se mira al microscopio ésta se denomina motilidad masal. Para evaluar la motilidad progresiva, se observa el porcentaje de espermatozoides que avanzan en forma rectilínea en el campo del microscópico. Los espermatozoides que giran sobre si mismos, pueden estar indicando que sufrieron choque térmico o que el medio no es isotónico con el semen (Aspron, 1985). Para el examen morfológico de los espermatozoides y la cantidad de vivos y muertos se utiliza la tinción de Eosina-Nigrosina. La determinación del porcentaje de espermatozoides vivos, de acuerdo a la integridad de la membrana acrosómica de la cabeza puede realizarse por medio de esta tinción que sólo tiñe a los espermatozoides muertos (Pérez, 2006). 133 La morfología espermática no presenta valores elevados de espermatozoides anormales, salvo en condiciones patológicas. Se consideran valores normales por debajo de 20% de anormalidades totales. La conservación del semen a temperaturas reducidas provoca importantes daños especialmente en los acrosomas (Pérez, 2006). La concentración espermática es el número de espermatozoides por unidad de volumen, normalmente expresado en ml. El semen de carnero de buena calidad contiene 3.5-6 mil millones (3.5-6 X109 de espermatozoides / ml). EQUIPO E INSTRUMENTOS: Baño Maria, Termómetro de altas, platina térmica, 2 rejillas, 3 pipetas de 10 ml, 3 pipetas de 1ml, 5 tubos de ensayo, porta objetos, cubre objetos, pipetas Pasteur, chupones propipeta. Microscopio de contraste de fases, parafilm, Microscopio óptico, contador. MATERIAL ALUMNO: bata, guantes de exploración, toallas de papel. MATERIAL BIOLÓGICO: Muestras de semen de carnero. REACTIVOS: Solución salina fisiológica, solución de Hancock, Tinción de EosinaNigrosina. PROCEDIMIENTO. 1. Se prepara previamente el baño maría a una temperatura de 32 a 34º, esto se puede regular con ayuda de un termómetro de altas, se coloca una gradilla en el interior para colocar los tubos de ensayo con 9.9 ml de solución salina fisiológica (para medir utilizar las pipetas de 10 ml), la tinción de eosinanigrosina y las muestras de semen (Tubos colectores). 2. En la platina térmica se colocaran porta objetos, cubre objetos, pipetas Pasteur, pipetas de 1 ml para que se mantengan a una temperatura promedio de entre 32 a 34ºC. 3. Recolectar el semen de machos adultos, como se describe en la práctica de recolección de semen. 4. Medir el volumen del eyaculado directamente en el tubo colector. 134 5. Determinar el color y consistencia del eyaculado. 6. Para evaluar la motilidad masal se deposita una gota de semen fresco, en un porta objetos y se observa en microscopio de contraste de fases con platina térmica en el objetivo de 10x. Se observan movimientos en forma de torbellino o en ondas, esta se califica de la siguiente manera: Cuadro 3. Calificación de motilidad masal. VALOR CLASE DESCRIPCIÓN 3 Muy buena Ondas densas de movimiento, muy rápidas 2 Buena Ondas y remolinos vigorosos pero no tan rápidas 1 Regular Ondas de movimiento lento 0 Muertos Sin movimiento 7. Para la motilidad progresiva se realiza una dilución 1:100 es decir, en un tubo de ensayo con 9.9 ml de solución salina a 32º C se vierte 0.1 ml de semen fresco y se homogeniza. Se coloca una gota de esta dilución en un porta objetos y se le coloca un cubre objetos se observa al microscopio con el objetivo de 10 x. Se expresa en porcentaje, 0 a 100%. Se debe estimar visualmente que porcentaje de células se mueven hacia delante. 8. Para evaluar vivos y muertos, sobre la platina térmica se coloca un portaobjetos en este se pone una gota de la dilución 1:100 y al lado una gota de EosinaNigrosina, se mezclan con ayuda de otro porta objetos, se corre para hacer el frotis, se seca. En el campo se cuentan los blancos y rosas hasta llegar a 100 células, se expresa en porcentaje. 135 Figura 40. Esquema comparativo de vivos y muertos con tinción de Eosina-Nigrosina.24 9. El frotis se utiliza para evaluar la morfología de las células espermáticas, se cuentan todos los espermatozoides del campo, los normales y anormales hasta llegar a 100 y se expresa en porcentaje. 10. Para evaluar la concentración se utiliza la cámara de Neubauer, para llenarla se realiza una dilución de 1: 200 esta se hace mezclando 1 ml de la dilución 1:100 con 1ml de una solución formulada. Se espera 5 minutos para que las células se sedimenten. Se realiza el conteo de la siguiente manera: a) Se localiza el cuadro central que esta dividido en 25 cuadros, que a su vez están divididos en 16 cuadros cada uno. b) Se realiza el conteo de los cuadros de las esquinas y central, se suman las células y se multiplica por 10,000 000. c) Los espermatozoides que tocan las líneas de arriba e izquierda se cuentan, los de abajo y derecha no se contabilizan. 24 Realizado por Alcantar , UNAM. 2007. 136 Figura 41. Cámara de Neubauer. CANAL TRANSVERSAL CANALES LONGITUDINALES 25 CUADROS DIVIDIDOS CADA UNO EN 16. EL RECUENTO SE EFECTÚA EN EL ÁNGULO SUPERIOR IZQUIERDO EN DIRECCIÓN DE LA FLECHA. 137 11. Para determinar el número de dosis por eyaculado se utiliza la siguiente formula: Número de dosis = progresiva Volumen x Concentración x % de Motilidad Concentración espermática por dosis 12. Al finalizar se limpiará todo el material que se utilizó y se limpiara y desinfectaran las mesas, se entregara el material de laboratorio. 13. Al final de la práctica, se entregará la hoja de control de calidad de semen y un reporte que incluya los datos con cada uno de los puntos de la evaluación que se le realizo a la muestra, que además contenga: a) Número de dosis que se obtiene del eyaculado. b) Cuanto se necesita de diluyente si se requiere llenar pajillas de 0.25ml y de 0.5ml. 138 HOJA DE CONTROL DE CALIDAD DE SEMEN Universidad Nacional Autónoma de México. Laboratorio de Reproducción e Inseminación Artificial. Nombre:____________________________ Fecha:________________ Calidad del Semen. Información del eyaculado: Especie:____________________ Nombre/Arete:_______________ Volumen (ml):_______________ Color:______________________ Consistencia:________________ Aspecto:____________________ Motilidad Masal (%):__________ Motilidad Progresiva (%):______ Concentración (x106):_________ Vivos (%):___________ Morfología (%): Normal:_______ Muertos (%):_____________ Anorm. Primarias:________ Anorm. Secundarias:_______ Observaciones: 139 Diagrama Ecológico Práctica XIV. Técnica de evaluación de semen en ovinos. Recolectar ovino. el semen de Realizar la evaluación del material biológico (semen) Fin de la Práctica El sobrante del material biológico se desecha en la tarja adicionando agua con hipoclorito al 1%. Limpiar y desinfectar la mesa de trabajo Recoger cualquier desecho generado: guantes, toallas de papel, etc. Colocar en el recipiente rojo los desechos punzo cortantes (Frotis). Depósito de basura 140 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XIV TÉCNICA DE EVALUACIÓN DE SEMEN EN OVINOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 141 Práctica XV. Técnicas de conservación de semen. Preparación de diluyentes. Duración: 2 horas OBJETIVO. El alumno conocerá los distintos tipos de diluyentes para la conservación de semen en las diferentes especies domésticas. Realizar un tipo de diluyente para semen de ovino. GENERALIDADES. El semen obtenido y evaluado como apto, requiere un procesamiento adecuado para garantizar la capacidad fecundante de los espermatozoides, durante el tiempo entre la eyaculación y su utilización para la inseminación artificial. El esperma eyaculado no sobrevive durante largos periodos, a menos que se hayan añadido agentes protectores (Aisen, 2004). Los espermatozoides viven fuera del organismo solamente durante un tiempo limitado, la capacidad de síntesis lipídica y proteica de estos es muy reducida dado que no cuentan con aparato de Golgi y solo contiene cantidades muy pequeñas de RNA. Precisamente por esto, cuando el semen colectado se va ha utilizar para inseminar se deberá usar lo mas pronto posible ó proceder a su dilución y conservación (Bayard, 2006). Los diluyentes son sustancias que se agregan al eyaculado para conservar su metabolismo, viabilidad y fertilidad. De un diluyente se espera: Que sea capaz de preservar la capacidad fecundante de los espermatozoides; además de su motilidad. 142 Evitar la acidificación del medio, consecuencia del metabolismo de los espermatozoides. Aportar nutrientes esenciales (de tipo energéticos), sustancias protectoras y amortiguadoras. Aumentar el volumen para poder inseminar un gran número de hembras. Restringir el crecimiento de microorganismos mediante la adición de antibióticos, sulfas, antimicóticos y otras sustancias. Reducir el metabolismo de los espermatozoides al mínimo al descender la temperatura del semen diluido. Capacidad de preparar al espermatozoide para la, congelación. Existen gran cantidad de diluyentes, desde los químicos, constituidos por soluciones salinas isotónicas, hasta aquellos que contienen sustancias orgánicas como yema de huevo, leche o agua de coco. Cuando se usa leche, ésta deberá ser calentada previamente en baño María a 96º C durante 10 minutos. La leche ultra pasteurizada ya no necesita inactivarse por calor, es estéril, barata y se puede mantener por cierto tiempo (Aspron, 1985; Aisen, 2004). Deben emplearse sustancias puras y equipo limpio a fin de excluir materiales tóxicos del ambiente espermático. Los diluyentes deben prepararse en forma aséptica y almacenarse por menos de una semana, a menos que se congelen. Suele agregarse un carbohidrato simple, como glucosa, como fuente de energía para los espermatozoides. Se utilizan tanto yema de huevo como leche para proteger a las células espermáticas contra el choque térmico cuando son enfriadas desde la temperatura corporal hasta 5º C. Dichas sustancias también contiene nutrimentos usados por los espermatozoides. Pueden emplearse diversos amortiguadores para mantener un pH cercano al neutro y una presión osmótica aproximada de 300mOsm, equivalente a los del semen, plasma sanguíneo y leche. Para inhibir la proliferación de microorganismos en el semen, se agregan penicilina, estreptomicina, polimixina B, u otras combinaciones antibióticas (Sorensen, 1984). 143 Los diluyentes para conservar el semen o temperatura ambiental, conservan el semen a una temperatura fija dentro del rango de 15 a 25ºC durante varios días. Los diluyentes para conservar el semen en refrigeración (4ºC) pueden ser leche, el diluyente base de citrato de sodio-yema de huevo, Tris-yema de huevo y preparaciones que conserven el semen hasta por 3 días (Sorensen, 1984). Los diluyentes para congelamiento básicamente son los mismos a los que se les agrega glicerol que es un anticongelante. Si el espermatozoide se congela en ausencia de un anticongelante, las células se lisan y mueren, ya que las formaciones cristalinas del hielo son como agujas que punzan al espermatozoide. El anticongelante produce un cambio en la formación los cristales de hielo, de modo que estos forman capas en vez de agujas. Los espermatozoides son capaces de soportar el proceso y permanecen viables. Una dilución excesiva provoca una disminución de la motilidad y de la capacidad fecundante de los espermatozoides, por tanto, la tasa de dilución debe ser adecuada para asegurar la eficacia del diluyente pero no excesiva. Como norma general, se considera que el nivel óptimo de dilución debe ser entre ½ y 1/3 (Sorensen, 1984). EQUIPO E INSTRUMENTOS: Probetas, jeringas de 3 y 5 ml, vaso de precipitado, filtros, bascula granataria, Parafilm, cucharillas. MATERIAL ALUMNO: Bata, 1 huevo, jeringas 3cm3. REACTIVOS: TRIS Hidroximetil-aminometano, Glucosa, ácido cítrico, yema de huevo, glicerol, agua destilada. ANTIBIÓTICOS: Penicilina, Estreptomicina. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. 144 PROCEDIMIENTO. Utilizando el cuadro de tasa de dilución, seleccionar el que se requiera para la realización de la práctica, hay que tener especial atención en el momento del pesaje. 1. Depositar en una probeta el TRIS, Glucosa y el ácido cítrico. 2. Aforar con agua destilada a ¾ del total a preparar. Homogenizar. 3. Agregar la yema de huevo, mezclando perfectamente. 4. Agregar el glicerol. 5. Agregar Antibióticos. 6. Aforar hasta la marca de 100 ml, homogenizar perfectamente. 7. conservar a 4° C 8. Observar cada 12 hrs. Para observar posibles cambios en el diluyente. (La contaminación produce cambios de color) Cuadro 4. Tasa de dilución para la elaboración de diluyente. Tasa de dilución 1: 2 1:3 1:4 5.814 4.361 3.876 3.634 Glucosa (g) 0.800 0.600 0.533 0.500 Ácido cítrico ( g) 3.184 2.388 2.123 1.990 Yema de huevo (ml) 24 18 16 15 Glicerol (ml) 8 6 5.3 5 Penicilina ( UI ) 100,000 100,000 100,000 100,000 Estreptomicina (MG) 100 100 100 100 Agua destilada (ml) 100 100 100 100 TRIS (g) 1: 1 Hidroximetil-aminometano 145 EVALUACION DE PRÁCTICA XV. 1. Elabora 200ml de diluyente, anotando cada uno de los pasos a seguir, recuerda que se tiene que calcular los constituyentes. Ya realizado el diluyente, se conserva en refrigeración, observando cada 12 horas durante 2 días y reportar si hay cambios de la coloración. Al entregar el ejercicio se evaluara la práctica. La distribución será la siguiente para los equipos: Equipo Tasa de Dilución 1 1:1 2 1:2 3 1:3 4 1:4 5 1:1 6 1:4 146 Diagrama Ecológico Práctica XV. Técnicas de conservación de semen. Preparación de diluyentes. Preparación del Diluyente Fin de la práctica Recoger cualquier desecho generado: papeles, toallas de papel, etc. Depósito de basura Conservar en refrigeración el preparado. Observar cada 12 hrs. posibles cambios en el diluyente, por 2 días. Pasado este tiempo se desecha el diluyente en la tarja. 147 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÒN ARTIFICIAL PRÁCTICA XV TÉCNICAS DE CONSERVACIÓN DE SEMEN. PREPARACIÓN DE DILUYENTES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 148 Práctica XVI. Técnica de congelación de semen. Duración: 4 horas OBJETIVOS El alumno conocerá la técnica de conservación de semen por congelación. El alumno realizará la técnica de congelación con semen de ovino. GENERALIDADES Las ventajas del semen congelado sobre el fresco o el refrigerado se fundamentan en el tiempo de conservación. Mientras que el semen refrigerado solo puede ser conservado por un corto periodo de tiempo, menor de 5 a 7 días, el semen congelado tiene un periodo ilimitado de conservación mientras permanezca sumergido en nitrógeno líquido (Evans y Maxwell, 1987). El procesamiento del semen para su preservación por congelación y conservación en nitrógeno líquido involucra los siguientes pasos (Aisen, 2004): 1) Dilución Con el fin de reducir al mínimo las lesiones asociadas con el choque por frío y con el proceso de congelado-descongelado, los espermatozoides se diluyen en medios especiales, éstos poseen azucares, amortiguadores del pH, lípidos (yema de huevo), crioprotectores (el mas utilizado es el glicerol) y otros aditivos como los antibióticos (Linde-Forsberg, 2006). 2) Enfriado Para lograr una preservación adecuada de los espermatozoides, es necesario el descenso cuidadoso de la temperatura; esto es, ir de 30ºC hasta 5ºC en aproximadamente 2-3 horas. Una vez alcanzada esta temperatura (5ºC) se lleva a cabo el periodo de equilibrio, es decir es la etapa en la que se adiciona la fracción del diluyente que contiene el glicerol y éste penetra al interior del espermatozoide estableciendóse un equilibrio entre 149 las concentraciones intra y extracelulares, este periodo puede variar de 30 a 120 minutos (Aisen, 2004). 3) Envasado Los recipientes mas utilizados para la congelación de semen son las pajillas de PVC (Cloruro de polivinilo) de tipo francés. Estas pajillas están disponibles en dos presentaciones: de 0.25 y 0.5ml, ésta última es la más comúnmente utilizada. Estas pajillas miden 13.5mm de longitud y 3 ó 1.5mm de diámetro interno. La pajilla en uno de sus extremos, contiene un tapón integrado por un par de cilindros fibrosos y una pequeña cantidad de polvo de acetato de polivinilo encerrado entre ellos, esto permite sacar el aire para meter por succión el semen diluido al interior del recipiente. Una vez lleno, la humedad moja el polvo, formando un sello (Sorensen, 1984; Aisen, 2004). Figura 42. Pajilla de envasado. 4) Congelación Después del periodo de equilibrio, las pajillas se exponen a los vapores de nitrógeno a una altura determinada sobre el nivel del nitrógeno líquido, a aproximadamente una temperatura de -80 y -100ºC durante un periodo variable de tiempo, en promedio 10 minutos; después, las pajillas se sumergen en el nitrógeno líquido (Salamon y Maxwell, 2000). 5) Almacenamiento Una vez congeladas, las pajillas se trasladan a un termo con nitrógeno líquido, donde se conservan por largo tiempo. Este termo conserva el semen congelado a una temperatura 150 de -196ºC en nitrógeno líquido; estos equipos se construyen con aleaciones metálicas resistentes (Sorensen, 1984). Figura 43. Termo de nitrógeno liquido.25 EQUIPO E INSTRUMENTOS: Termo para nitrógeno liquido, caja de poliestireno (unicel), pajillas, rejilla, pinzas largas, acetato de polivinil (PVA) en polvo. MATERIAL ALUMNO: Bata, plumones de tinta indeleble de punto fino. REACTIVOS: Diluyente para semen de ovino, semen de ovino, nitrógeno liquido. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. 25 Termos utilizados en el Laboratorio de Reproducción e Inseminacion Artificial de FES Cuautitlán , El de la Izquierda es un termo en uso, el de la derecha es un termo utilizado para mostrar las partes que lo componen a los estudiantes. 151 PROCEDIMIENTO 1. Se realiza la obtención y evaluación macro y microscópica del semen. 2. Se realiza la dilución del semen: en primer lugar se agrega la mitad del volumen final semen+diluyente, la segunda parte se agrega a 5ºC, esta segunda fracción contiene el glicerol necesario para la crioprotección. Para conocer la cantidad de diluyente que se agregará al semen se utilizará la siguiente formula: Volumen (ml del eyaculado) X Concentración (miles de millones de células por ml) X Células móviles (%) Número recomendado de espermatozoides por dosis de IA Ejemplo: 1.3 (volumen) X 3800 (concentración) X 0. 80 (% Motilidad progresiva) 200 = 20 dosis de 200 millones de espermatozoides móviles Si se van a envasar en pajillas de 0.25ml, el volumen requerido semen+diluyente es 5.0ml . Si se tiene 1.3ml de semen, el volumen de diluyente a agregar es 3.7ml (5.0 – 1.2) Entonces, en la primera parte de la dilución se agrega diluyente al semen hasta completar 2.5ml entre ambos. En la segunda parte de la dilución se agrega 2.5ml de diluyente que contiene glicerol (el doble de la concentración final: si la concentración final es de 4%, esta fracción contendrá 8% de glicerol). 3. Se realiza el envasado de las pajillas, succionando con la boca o con una jeringa conectada a un cilindro de látex en el extremo donde se encuentra el tapón, para llenar el interior con el semen diluido. Previamente, se identificará cada pajilla con el plumón de tinta indeleble. Con una jeringa de insulina se saca el líquido excedente de la pajilla de forma que se deje un espacio de aproximadamente 0.5ml para sellar; con la ayuda del PVA se sella el lado opuesto de la pajilla. 152 4. Se procede a la congelación, en la caja de unicel se vierte el nitrógeno líquido, colocando las pajillas sobre una rejilla para que la congelación se efectué sobre los vapores de nitrógeno líquido. Después de unos minutos se sumergen las pajillas en el nitrógeno líquido. 5. Por ultimo, las pajillas se trasladan a un termo con nitrógeno líquido donde se mantendrán hasta su utilización en la Inseminación Artificial. 6. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 7. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 8. La limpieza y desinfección del área de trabajo por parte de los alumnos, es de suma importancia para mantener limpio el laboratorio. 9. Como punto final el profesor realizará la evaluación de la práctica. 153 EVALUACIÓN DE LA PRÁCTICA XVI. 1.- ¿Cuál es la concentración espermática necesaria en las pajillas de semen ovino, para que se cubra a la hembra? 2.- Realiza el siguiente ejercicio: Macho Ovino (arete 360) En el examen macroscópico presentó las siguientes características: Volumen del eyaculado 1.1ml Color blanco lechoso Consistencia cremosa, sin presencia de partículas extrañas. En el examen macroscópico presentó los siguientes datos: Motilidad masal con un valor de 2 (escala de 0-3) Motilidad progresiva 75% Vivos (membrana intacta) 85% Normales 73 Concentración espermática de 4356 X106 a) Menciona el número de dosis que se obtiene de este eyaculado b) ¿Cuál es el volumen requerido si se envasan en pajillas de 0.25ml o de 0.5ml? c) ¿Cuál es el volumen de diluyente requerido para cada caso? d) Da tu opinión de este eyaculado 154 Diagrama Ecológico Práctica XVI. Técnica de Congelación de Semen. Recolección de semen Evaluación de semen Dilución Enfriado y envasado Congelación Fin de la práctica Limpiar y desinfectar la mesa de trabajo El sobrante del material biológico (semen, yema de huevo, diluyente) se desecha en la tarja adicionando agua con hipoclorito al 1%. Recoger cualquier desecho generado: pajillas, guantes, toallas de papel, etc. Colocar en el recipiente rojo los desechos punzo cortantes (Frotis) Depósito de basura Incineración 155 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVI TÉCNICA DE CONGELACION DE SEMEN Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 156 Práctica XVII. Técnica de Inseminación Artificial en rumiantes. Duración 4 horas OBJETIVO. Capacitar a los alumnos para que adquieran la habilidad en la aplicación de técnicas de inseminación artificial en rumiantes. GENERALIDADES. Entendemos por inseminación el acto mediante el cual el macho deposita el semen dentro del aparto reproductor de la hembra. Dependiendo de la especie animal que se trate, y del sistema de explotación al que se vean sometidos los animales, las hembras se pueden inseminar de forma natural o artificial. Es importante practicar cualquiera de los dos métodos, pero en esta ocasión nos enfocaremos en la Inseminación Artificial (IA) que no es otra cosa que la introducción de semen dentro del sistema reproductor femenino sin que exista contacto entre el macho y la hembra (Verdeen, 2000). La IA es una técnica que permite un mejor uso del material genético de los machos cuyas características zootécnicas son superiores a la mayoría de los animales de su especie. Desde el punto de vista productivo, representa una posibilidad para aumentar la eficiencia en la producción de las especies domésticas (Días, 2006). En los últimos años ha aumentado el interés en el uso de la IA en rumiantes, con el fin de mejorar los sistemas de explotación, así como la calidad genética de la especie. Los métodos tradicionales de la IA con semen fresco en ovinos tienen la limitante de utilizar un carnero que se encuentra en lugares apartado, lo que reduce el número de ovejas por inseminar. Además, el estrés que se produce con el transporte, tanto del macho como de las hembras, disminuye el porcentaje de fertilidad. Con el semen congelado es más sencillo y práctico manejar animales a grandes distancias y con excelentes resultados (Aspron, 1985; Angulo, 1999). 157 La Inseminación Artificial de la oveja y la cabra puede ser vaginal, cervical o intrauterina. En las vacas la Inseminación Artificial se realiza a nivel intrauterino. Los métodos difieren en cuanto a su complejidad y expectativas de éxito. La Inseminación Artificial vaginal es el método más simple y mas rápido (Salomón, 1990). Las ventajas de la Inseminación Artificial, son la utilización de machos con características superiores en cuanto a genética, se puede almacenar el semen, tras ser congelado, durante mucho tiempo, incluso si el macho llegara a morir, Se pueden controlar enfermedades venéreas con un adecuado examen previo al procedimiento de IA, no es necesario tener un semental reduciendo los costos de mantenimiento. Las desventajas son que para alcanzar tasas de gestación es necesario detectar con exactitud el momento de la IA, la consanguinidad dentro del hato, propagación de enfermedades si los sementales no son controlados en lo que a enfermedades venéreas se refiere, si no se tiene un control de gastos esto puede desfavorecer la utilización de la IA (Salomón, 1990; Delgadillo 2005; Días, 2006). EQUIPO E INSTRUMENTOS: Vaginoscopios para ovejas, cabras y vacas, pipetas de inseminación, pajillas con semen para inseminar ovejas, cabras y vacas. MATERIAL ALUMNO: Botas, overol, cuerdas, piolas, marcador de ganado, toallas de papel. MATERIAL BIOLÓGICO: Hembras de bovinos, ovinos y caprinos. PROCEDIMIENTO. Técnica de inseminación artificial en vacas (Noakes, 1999): 1. El proceso de inseminación inicia con la inmovilización de la hembra que será inseminada, es necesario cuidar que el inseminador este protegido de algún accidente y que la paciente no sea lastimada en el procedimiento. 2. Es recomendable que se use la mano izquierda en el recto para manipular el aparato reproductor, y la mano derecha para manipular la pistola de inseminación (Figura 37). 158 3. Levantar la cola con la mano derecha y suavemente aplicar masaje al ano con la mano izquierda, usando siempre un guante lubricado. 4. Juntar la punta de los dedos e insertar la mano hasta la muñeca. 5. Limpiar suavemente la vulva con una toalla de papel, para quitar el exceso de estiércol. 6. Con la mano izquierda, formar un puño, se hace presión vertical sobre la vulva. Esto abrirá los labios de la vulva y permitirá insertar la pistola de inseminación varios centímetros, antes de tocar las paredes de la vagina. 7. Insertar la pistola en un ángulo ascendente de 30 grados, para así evitar penetrar a la uretra y a la vejiga. 8. Una vez que la punta de la pistola haya entrado unos 15 a 20cm en la vagina levantar la parte trasera de la pistola hasta una posición casi horizontal, avanzar la pistola hasta hacerla tocar la parte posterior del cérvix. Esta puede localizarse mediante suave presión con el extremo del dedo índice. 9. Para depositar el semen, empuje el émbolo de la pistola para que el semen se deposite en el cuerpo uterino. Si la punta de la pistola se encuentra a una pulgada adelante del cérvix al momento de depositar el semen, este será depositado en un solo cuerno. 10. La pipeta será retirada cuidadosamente. Figura 44. Técnica de Inseminación Artificial en vacas.26 26 Realizado por Alcantar , UNAM. 2007. 159 Figura 45. Forma de depositar el semen en el cuerpo del útero.27 Técnica de inseminación vaginal en ovejas y cabras. 1. Se sujeta a la hembra, colocándola sobre una caja, paca o tubos, para que la parte posterior de la paciente que en alto. 2. La vulva de la hembra se limpia con una toalla de papel. 3. Se introduce un vaginoscopio desinfectado y lubricado, con suavidad y extremo cuidado, el cérvix es localizado con facilidad manipulando el vaginoscopio. 4. La pipeta de inseminación debe ser cargada por un ayudante. 5. Se introduce la pipeta, cerca del cérvix, se deposita el semen empujando el embolo de la pistola. 6. Se retira con cuidado la pajilla, y se retira con cuidado el vaginoscopio. 7. La hembra se baja con cuidado de la superficie en la que se encuentra Figura 46. Técnica de Inseminación Artificial en ovejas y cabras.28 27 28 Realizado por Alcantar, UNAM. 2007. Adaptado de Delgadillo, J. A.; 2005. 160 Diagrama Ecológico Práctica XVII. Técnica de Inseminación Artificial en rumiantes. Sujeción de las hembras VACA OVEJA Y CABRA Localización del cérvix por palpación utilizando guante de palpación con o sin guante de látex Se localiza el cérvix con ayuda de un vaginoscopio. Introducir la pipeta de inseminación, depositar el semen en el cuerpo del útero Introducir la pipeta inseminación, depositar semen cerca del cérvix. de el Fin de la práctica Recolectar y depositar los guantes y pipetas de inseminación en una bolsa amarilla. Incineración 161 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVII TÉCNICA DE INSEMINACIÓN ARTIFICIAL EN RUMIANTES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 162 PRACTICA XVIII. Recuperación, evaluación, clasificación y manipulación de embriones. Duración: 4 horas OBJETIVO. El alumno adquirirá la habilidad de recuperar, evaluar, clasificar y manipular los embriones de coneja. GENERALIDADES. RECUPERACIÓN DE EMBRIONES. Consiste en recolectar del aparato reproductor de la hembra donante los huevos fecundados después que descienden al útero y antes que comience el proceso de anidación o fijación su definitiva. En circunstancias especiales la recolección de embriones se realiza postmortem (después de sacrificar a la hembra donadora para aislar el aparato reproductor y obtener con toda comodidad los embriones; sin embargo, esta técnica cae dentro del campo experimental y como es lógico, no es utilizada desde el punto práctico (Pérez, 1985; Noden, 1990; Ruchebuch, 1991). EVALUACIÓN DEL HUEVO Y DEL EMBRIÓN (Illera, 1994; Tribulo, 2006). La valoración de los embriones permite seleccionar aquellos hipotéticamente mejores para transferirlos a las mejores receptoras. Algunas de las características que se analizan para calificar a los embriones se describen a continuación: 1. Comprensión de las células o blastómeros 2. Regularidad en la forma del embrión 3. Variación del tamaño celular 4. Color y textura del citoplasma 5. Presencia de grandes vesículas 6. Presencia de células extruidas 7. Diámetro 163 8. Regularidad de la zona pelúcida 9. Presencia de restos celulares Los blastómeros siempre deberán tener el mismo tamaño, una coloración similar y una textura parecida, no deben ser ni transparentes ni opacos. El citoplasma es granular, desigualmente distribuido y contiene vesículas de tamaño moderado. El espacio previtelino está vacío con un diámetro regular la zona pelúcida será lisa, sin arrugas y no estará colapsada. No deben existir restos celulares (Martín, 1994). CLASIFICACION DE EMBRIONES (Görlach, 1999). Los embriones recolectados se clasifican según su edad y su estadio de desarrollo de la siguiente manera: M= Mórula temprana MM= Mórula compacta. BB= Blastocisto inicial. UE= Ovocito no fecundado DE= Embrión total o mayoritariamente degenerado. 164 Cuadro 5. Diferentes estadios del desarrollo embrionario. Según se descripción cualitativa se dará la clasificación de los embriones de la siguiente manera: Mórula Temprana Mórula compacta Blastocisto inicial Blastocisto maduro Blastocisto expandido Blastocisto en eclosión 165 Según se descripción cualitativa siguiente manera (Cuadro 6): se dará la clasificación de los embriones de la Clase 1 Calidad excelente. Embrión esférico, zona pelúcida intacta, cúmulo celular perfectamente estructurado con células del mismo tamaño color y textura. Clase 2 Calidad buena Embrión esférico o ligeramente elipsoidal, zona pelúcida intacta algún blastómero suelto, cúmulo celular perfecto. Clase 3 Calidad regular Zona pelúcida intacta o dañada, blastómeros de diferentes tamaños, cúmulo celular con un 30 hasta un 60% de blastómeros intactos, ligero retraso en el desarrollo Estadio de 32 células. Clase 4 Calidad mala Zona pelúcida intacta o dañada, blastómeros degenerados y sueltos en número considerable, cúmulo celular suelto y con menos del 30% de blastómeros intactos, desarrollo retardado con estadios embrionarios de blastómeros grandes (32,16 células). Clase 5 Embrión degenerado Zona pelúcida normalmente intacta, cúmulo celular con aspecto desorganizado y suelto ,blastómeros de diferentes tamaños y pignóticos en muchos casos , estadios de desarrollo ya paralizado ( 2,4,8 hasta 16 células) Clase 6 Ovocito no dividido Ovocito fertilizado o no, pero no dividido, rodeado de una zona pelúcida intacta o no, perfectamente esférica. 166 MANIPULACIÓN DE EMBRIONES. La micromanipulación de embriones se puede definir como el manejo aplicado a los embriones entre los que se incluyen la sección de sus tejidos, la agregación de sustancias o células de su interior, así como la separación de alguna de sus partes, entre las que se puede incluir la zona pelúcida, que, de alguna manera, van a modificar su morfología, pero manteniendo su funcionalidad (Peters, 1991; Wilmut, 1994). MATERIAL DE LABORATORIO: 1 Bandeja , 3 cajas de Petri de 1000mm, 2 Bisturí con navaja, 1 pinzas, aguja 18G, 2 jeringas de 10ml , Guantes de látex estériles, toallas de papel. MATERIAL BIOLÓGICO: 2 conejas y 1 macho REACTIVOS: Gonadotropina coriónica equina (Folligon 1000UI), GnRH 1 frasco, 1litro de Solución Ringer. PROCEDIMIENTO. 1. Las conejas serán superovuladas con eGC (Folligon), con el siguiente protocolo: Servicio (68 h) + GnRH Inyec. eGC -4 -3 -2 -1 0 72 h. Recuperación de embriones 1 2 3 4 5 2. En el día cero se les dará monta. 3. Las hembras serán sacrificadas 72 horas posteriores al servicio. 167 4. Los embriones se recuperan a través de un lavado del oviducto y útero. Se utilizará como medio de lavado 40 ml de solución Ringer suplementada con 5% de suero bovino que será vertida por el infundíbulo con la jeringa de 20 cc y aguja punta roma de 18G de 1½ pulgadas. 5. El líquido resultado del lavado se deposita directamente en la caja de Petri. 6. El líquido recuperado será revisado bajo un estereoscopio a 20X para buscar embriones. 7. Ya localizados se procederá a evaluarlos morfológicamente a 40X. 8. Clasificar los embriones de acuerdo a criterios establecidos por Gölarch (1999). 168 EVALUACION DE LA PRÁCTICA XVIII. Evaluación Visual de la práctica XVII. 1. Mencione lo que observa en las diapositivas: a) b) c) 2. Esquematiza los diferentes estadios embrionarios. 3. Califique y clasifique el siguiente grupo de embriones. 169 Diagrama Ecológico Práctica XVIII. Recuperación, evaluación, clasificación y manipulación de embriones. Superovulación y monta a las 68 h Recolección de las jeringas, agujas y frascos vacíos Sacrificio de las conejas Incineración Necropsia, disección del aparato reproductor de la hembra, lavado del oviducto y útero. Recuperación, manipulación y clasificación de embriones Fin de la Práctica Colocar en el recipiente rojo los desechos punzo-cortantes El sobrante del lavado se desecha en la tarja. Depositar en bolsas amarillas los cadáveres y los guantes de látex. Incineración 170 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVIII. RECUPERACIÓN, EVALUACIÓN, CLASIFICACIÓN Y MANIPULACIÓN DE EMBRIONES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 171 PRACTICA XIX. Transferencia de embriones. Duración: 4 horas OBJETIVO. El alumno conocerá las técnicas de superovulación y transferencia embrionaria y será capaz de aplicar uno de los métodos de transferencia en la coneja, a nivel experimental. GENERALIDADES. El transplante de embriones es un método de reproducción artificial basado en la transferencia de embriones producidos por una hembra donante (madre genética superior) a hembras receptoras (madres portadoras) que lo gestan hasta su nacimiento. La producción de embriones ha sido propuesta como una metodología tendiente a la preservación de especies en peligro de extinción, que brinda la posibilidad de disponer de bancos genéticos para su conservación y un seguro sanitario para evitar la transmisión de enfermedades. A su vez, el incremento en la eficiencia de la producción y congelamiento de embriones podrá ser utilizado para constituir rebaños con el mínimo riesgo de ser portadores de enfermedades y permitir una amplia difusión mundial de animales con alto mérito genético. Los tratamientos hormonales para inducir la ovulación múltiple y la transferencia de embriones permiten utilizar de manera intensiva a las hembras genéticamente superiores, en forma similar al aprovechamiento que se realiza con los machos por medio de la inseminación artificial (Gibbons, 1995). Los primeros intentos de la transferencia de embriones, fueron enfocados más hacia la experimentación que hacia la práctica. En 1980 Heape consiguió transferir embriones de coneja, esto ocurrió casi 50 años antes de que Warwick, Berry y Horlacher experimentaran con ovejas, ya en 1940 esta técnica era de gran interés para los investigadores. La transferencia de embriones, al igual que la inseminación artificial, es una técnica que bien puede clasificarse como manipulación genética. La principal 172 ventaja es aumentar la capacidad reproductora de las hembras que poseen un gran valor genético (Warwick, 1980; Sorensen, 1982; Illera, 1994). La transferencia de embriones consiste en recoger embriones de alta calidad genética del aparato del aparato genital de una hembra donante y depositarlos en el de otra hembra receptora, por lo general de inferior condición genética, siendo ésta la que mantiene la gestación a término (Sorensen, 1982; Noden, 1990; Illera, 1994). VACAS DONADORAS. El valor de la donadora puede ser definido de acuerdo a diferentes criterios según los beneficiarios. Sin embargo, en el caso de la aplicación práctica de la técnica para el mejoramiento genético del ganado, debemos escoger a las vacas más productivas como donadoras. No deben presentar enfermedades hereditarias, tener excelente historial reproductivo y salud, alto valor en el mercado, ciclos estrales regulares, no tener enfermedades que afecten la fertilidad, no ser demasiado viejas (Illera, 1994). VACAS RECEPTORAS. La receptora ideal es una vaca joven, libre de enfermedades, de probada fertilidad y habilidad materna. Además, debe tener un tamaño adecuado para no presentar problemas al parto. Aunque la raza no es un factor importante, generalmente se acepta que las vacas cruzadas tienen mayor fertilidad (Hafez, 1993). La Transferencia de Embriones incluye varias etapas, desde la selección de donadoras hasta la transferencia del embrión. Las principales etapas relacionadas son (Ruchebusch, 1991; Tribulo, 2006): Inducción de la superovulación (donadora). Fertilización Sincronización del ciclo estral (receptoras). Recolección de los embriones (donadora). Clasificación de los embriones. Almacenamiento por corto plazo y cultivo. Criopreservación. Transferencia de los embriones (receptoras). 173 La superovulación es proceso mediante el cual los ovarios son estimulados para producir mayor numero que el normal de folículos ovulatorios y, por lo tanto, liberación de ovocitos (Peters, 1991). EQUIPO E INSTRUMENTOS: Material de cirugía. Dos jeringas desechables de 20 ml. una caja de Petri de 200 ml., 8 cajas de Petri de 100 ml. cuadriculadas, 3 equipos Venoset para terapia de fluidos, agujas calibre 22, catéter endovenoso (punzocat) de calibre 17 ó 18, 2 matraces de Erlenmeyer de 100 ml., 2 matraces de Erlenmeyer de 250 ml., 2 microscopios estereoscópicos, un microscopio óptico, un portaobjeto cóncavo, 2 jeringas insulínicas con agujas, 5 pipetas Pasteur, una estufa bacteriológica (37º C), un baño maría (37° C), una mesa de cirugía, una tabla de madera, tres paños de algodón. MATERIAL BIOLÓGICO: 2 conejas adultas con ciclos estrales regulares, 1 conejo adulto REACTIVOS: Un frasco de 1000 UI de PMSG, un frasco de 2500 UI de HCG, un litro de solución Hartman, 3600 ó 400 ml. de suero sanguíneo de conejo o bovino inactivado, un frasco de propiopromazina, 1 frasco de pentobarbital sódico, 2 frascos con 800 UI de penicilina G sódica, SOLUCIONES ANTISÉPTICAS. Yodo 5%, benzal, jabón quirúrgico. 174 PROCEDIMIENTO. Por razones de recursos y tiempo, esta práctica será demostrativa, realizándola únicamente un equipo de alumnos voluntarios asesorados por el maestro. La metodología que se seguirá es según el modelo didáctico-teórico experimental elaborado por Villegas, por lo cual sólo se enumeran los pasos (para ampliar la metodología ase sugiere consultar el modelo del autor antes citado como complemento de esta práctica: Plática general explicativa. Selección de donadoras y receptoras. Superovulación. Detección de celos. Fertilización. Sincronización estral. Recolección de embriones. Identificación y evaluación de embriones. Transferencia de embriones. 175 EVALUACIÓN DE LA PRÁCTICA XIX. Los alumnos entregaran un trabajo escrito de la técnica de transferencia de embriones, por equipo, donde se describa la técnica. El trabajo deberá contener: Portada (Con el nombre de los alumnos de cada equipo) Índice Generalidades Comentarios Bibliografía. 176 Diagrama Ecológico Práctica XIX. Transferencia de embriones. Selección de donadoras y receptoras. Recolección de las jeringas, agujas y frascos vacíos Superovulación. Incineración Detección de celos y Fertilización Recuperación, manipulación y clasificación de embriones Transferencia de embriones El sobrante del lavado se desecha en la tarja. Fin de la Práctica Colocar en el recipiente rojo los desechos punzo-cortantes Depositar en bolsas amarillas los cadáveres y los guantes de látex. Incineración 177 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVIII. TRANSFERENCIA DE EMBRIONES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 178 REFERENCIAS 1. Aguirre, F.V. 2004. Efectos de la estacionalidad, frecuencia de colección y jerarquías en algunas variables reproductivas de carneros pelibuey (Ovis aries). Tesis de doctorado, Universidad de Colima, México. 2. Aisen, E.G.,Venturino, A. 2004. Recolección y evaluación del semen. En: Reproducción ovina y caprina, Inter-México, Buenos aires, Argentina. 55-71 3. Aisen, E.G. 2004. Procesamiento y conservación del material seminal. En: Reproducción ovina y caprina, Inter-México, Buenos aires, Argentina. 73-85 4. Angulo, M.R.B., Ortiz, H.A., Berruecos, V.J.M., Feldman, S.D., Valencia, M.J. 1999. Motilidad y fertilidad del semen de carnero, descongelado a dos diferentes ritmos de temperatura. Veterinaria México, 30 (3): 265-268 5. Allen, E.W. 1994. Diagnostico de la gestación. En: Fertilidad y obstetricia equina. Acribia, España. 53-58 6. Allen, W.E. 1992. Semen evaluation. En: Fertility and Obstetrics in the dog. Blackwell Scientific Publications. London. 43-55 7. Allen, E.W. 1994. Diagnostico de la gestación. En: Fertilidad y obstetricia equina. Acribia, España. 8. Arbiza, A.S. 1986. Producción de caprinos. AGT Editores. México. 222-225 9. Ashdown, R.R., Hafez, E.S.E. 2000. Anatomía del aparato reproductor masculino. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E. y Hafez, B. (Eds). McGraw-Hill Interamericana, México. 179 10. Aspron, P.M.A. 1985. Manual de Inseminación Artificial en ovinos. Universidad Nacional Autónoma de México. 11. Banks, W.J. 1986. Aparato reproductor de la hembra. En: Histología Veterinaria aplicada. El manual moderno. México. 629-640 12. Barberán, M. 1981. Parto natural. En: Parto de la vaca y manejo del ternero. Aedos. Barcelona, España. 13. Barberán, M. 1981. Operación o sección cesárea. En: Parto de la vaca y manejo del ternero. Aedos. Barcelona, España. 14. Bearden, H.J., Fuquay, J. 2000. Insemination Thechniques. En: Applied Animal Reproduction. Prentice-Hall, USA. 208-215 15. Blanchard T.L., Vainer D.D., Schumacher J. 1998. Manual of equine reproduction. Mosby, USA. 16. Bowen, J.A., Hunt, J. S. 2000. The Role of Integrins In Reproduction. Society For Experimental Biology And Medicine. (223): 331-343. 17. Camacho, P. A., Mata, G. J., Martín, T. B. 1995. Fecundación y gestación. En: Zootecnia bases de producción animal. Tomo II: Reproducción y alimentación. Buxadé, C. C. Mundi-prensa, Barcelona, España. 58-59 18. Carvajal, R. J. L. 2000. Anatomía del aparato genital masculino. En: Zootecnia bases de producción animal. Tomo I: Estructura, Etnología, Anatomía y Fisiología. Acribia, Zaragoza, España. 137-148 19. Cavestany, D. 2006. Parto. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México.175-186 180 20. Ciria, C. J. 2000. Anatomía del aparato genital Femenino. En: Zootecnia bases de producción animal. Tomo I: Estructura, Etnología, Anatomía y Fisiología. Acribia, Zaragoza, España. 149-160 21. Climent, S., Sarasa, M. 2005. Órganos genitales del macho. En: Manual de Anatomía y Embriología de los Animales Domésticos, Conceptos Básicos y Aplicativos. Acribia, Zaragoza España. 329-361 22. Climent, S; Sarasa, M. 2005. Órganos genitales de la hembra. En: Manual de anatomía y embriología de los animales domésticos, conceptos básicos y aplicativos. Acribia, Zaragoza España. 367-388 23. Cunningham, J.G. 1999. Control del desarrollo gonadal y de los gametos. En: Fisiología Veterinaria. McGraw-Hill Interamericana. México. 510-517 24. Cunningham, J.G. 2003. Gestación y Parto. En: Fisiología Veterinaria. Elsevier. España. 398-521 25. De Buen, A. N. 2001. Citología de mucosas. En: Citología diagnóstica veterinaria. Manual moderno. México. 19-22 26. Días, C. P., Valencia, J. 2006. Inseminación Artificial. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México. 215-230 27. De Alba, J. 1985. Reproducción Animal. Ediciones Científicas, México. 28. Delgadillo, J. A. 2005. Pruebas de diagnóstico de gestación. En: Inseminación Artificial en caprinos. Trillas, México. 79-80 29. Dellmann, H.D., Carithers, J.R. 1999. Aparato reproductor femenino. En: Citología e Histología. Intermédica, Argentina. 311-313 181 30. Dyce, K.M., D.V.M. 1999. Anatomía Veterinaria. McGraw-Hill Interamericana, México. 31. Derivaux, J.1976.Dilución y conservación del esperma fresco. En: Reproducción de los animales domésticos. Acribia. Zaragoza, España. 184-201 32. Derivaux, J., Ectors, F. 1997. Fisiopatología de la gestación y obstetricia veterinaria, Acribia, Zaragoza, España. 33. Estrada, S. 2006. Distocia. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México. 249-260 34. Engelhardt, W., Breves G. 2002. Fisiología veterinaria. Acribia, España. 35. Evans, G., Maxwell, W.M.C. 1990. Introducción a la Inseminación Artificial. En: Inseminación Artificial de ovejas y cabras. Acribia. Zaragoza, España. 1-7 36. Evans, G., Maxwell, W.M.C. 1990. Recogida del semen. En: Inseminación Artificial de ovejas y cabras. Acribia. Zaragoza, España. 85-92 37. Evans, G., Maxwell, W.M.C. 1990. Iseminacion. En: Inseminación Artificial de ovejas y cabras. Acribia. Zaragoza, España. 143-161 38. Farstad, W. 2000. Cubrición e inseminación artificial en el perro. En:. Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., Harvey, M.(Eds). Harcourt. México. 39. Fayez, M. I. 1994. Diagnóstico de gestación y determinación del número de fetos. En: Nuevas técnicas de reproducción ovina. Marai, Zaragoza, España. 227-231 182 40. Fernández, B., Suárez, I., Rubio, M., Muñiz, E., Bodega, G. 2003. Sistema reproductor femenino. En: Organografía microscópica animal comparada. Editorial Síntesis, España. 41. Ferrugem, M. J. C. 2006. Implantación y placentación. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México. 153-162 42. Fradson, R. D., Spurgeon, T.L. 1992. Anatomía del sistema reproductor del macho. En: Anatomía y Fisiología de los animales domésticos. Interamericana McGraw-Hill, México. 43. Fradson, R. D., Spurgeon, T.L. 1992. Anatomía del sistema reproductor de la hembra. En: Anatomía y Fisiología de los animales domésticos. Interamericana McGraw-Hill. México. 410-419 44. Fradson, R. D., Spurgeon, T.L. 1992. Gestación y parto. En: Anatomía y Fisiología de los animales domésticos. Interamericana McGraw-Hill. México. 45. Gadea, M.J., Matás, P.C., Ruiz, L.S., Coy, F.P. 2003. Citologia vaginal en la perra. En: Prácticas de Fisiología veterinaria. ICE, Universidad de Murcia.115120 46. Geoffrey H. A., Noakes, D. E., Pearson, H. 1990. Veterinary Reproductión and Obstetrics, Bailliere Tindall, Canada. 47. Gibbons, A., Cueto, M. 1995. Transferencia de Embriones en Ovinos. NTA Bariloche, Río negro. 79- 82 48. Gordón, I. 2006. Diagnóstico de gestación Reproducción controlada del ganado vacuno. En: del ganado vacuno y búfalos. Acribia, Zaragoza, España. 178-181 183 49. Gordón, I. 2006. Tecnología de las pruebas de detección de la gestación. En: Tecnología de la reproducción de los animales de granja. Acribia, Zaragoza, España. 300-310 50. Görlach, A. 1999. Recogida de embriones. En: Transferencia de embriones en el ganado vacuno. Acribia. Zaragoza, España. 44-56 51. Grunert, E., Bove, S., Stopiglia, A.V. 1976. Guía de obstetricia veterinaria. Editorial Universitaria de Buenos Aires. Argentina. 52. Gürtler, H., Ketz, A., Kolb, E., Schöder, L., Seidel, H. 1979. Fisiología de la reproducción. En: Fisiología Veterinaria. Acribia. Zaragoza, España. 758-763 53. Habel, R. E. 1968. Genitales femeninos. En: Anatomía y Manual de disección de los rumiantes domésticos. Acribia, Zaragoza, España. 85-94 54. Habel, R. E. 1988. Pene, glándulas accesorias y fosa isquiorrectal. En: Anatomía Veterinaria aplicada. Acribia, Zaragoza, España. 287-296 55. Hafez, E.S.E. 1993. Tecnología reproductiva asistida, manipulación de ovulación, fecundación in vitro y transferencia de embriones. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B. (Eds).McGrawHill Interamericana, México. 56. Hafez, E.S.E. 2000. Anatomía del aparato reproductor femenino. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B. (Eds).McGraw-Hill Interamericana, México. 57. Hafez, E.S.E. 2000. Reproducción, hormonas y factores de crecimiento. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B. (Eds) McGraw-Hill Interamericana, México. 184 58. Hafez, E.S.E. 2000. Foliculogénesis, maduración del óvulo y ovulación. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B.(Eds). McGraw-Hill Interamericana, México, 2000. 108-120 59. Hansel, W., McEntee, K. 1981. Procesos reproductivos en la hembra. En: Fisiología de los animales domésticos. Funciones de la Integración y Reproducción. Tomo II. Dukes, H.H., Swenson, M.J (Eds). Aguilar. México. 1608-1621 60. Hernández, M., Bolarín, A., Gil, M.A., Almiñana, C., Cuello, C., Parrilla, I., García, E., Caballero, I., Sánchez-Osorio, J, Lucas, X., Vázquez, J.M., Martínez, E.A. y Roca, J. 2006. Criopreservación espermática. En: Biotecnología de la reproducción porcina. Manual de técnicas de reproducción asistida en porcino. Bonet, S., Martínez, E., Rodríguez, J.E. y Barrera, X. (Eds). Universidad de Girona. 185-200 61. Herman, H.A. 1996. Pregnancy Determination in the Cow. En: The artificial insemination and embryotransfer of dairy and catte; a handbook and laboratory manual. Interstate publishers. 185-195 62. Hill, J., Andrews, A. 2001. Cuidados de la vaca lechera gestante. Acribia, España 63. Hunter, R.H.F. 1987. La hembra, pubertad y ciclo estral. En: Reproducción de los animales de granja. Acribia. Zaragoza, España. 64. Hunter, R.H.F. 1987. Reproducción de los animales de granja, Acribia, Zaragoza España. 65. Igwebuike, U.M. 2006. Trophoblast cells of ruminant placentas a minireview. Animal Reproduction Science, 93: 185–198 185 66. Illera, M.M. 1994. Transferencia de embriones. Reproducción de los animales domésticos. Aedos. Barcelona, España. 241-281 67. Jainuden, M.R., Hafez, E.S.E. 2000. Gestación, fisiología prenatal y parto. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B.(Eds). McGraw-Hill Interamericana, México. 68. Jeffcoate, I. 2000. Fisiología y endocrinología de la reproducción en la perra. En: Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., England, G.C.W., Harvey, M.J. (Eds). Harcourt. México. 1-12 69. Jeffcoate, I. 2000. Infertilidad en la hembra. En: Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., England, G.C.W., Harvey, M.J. (Eds). Harcourt. México. 39-41 70. Köing, I. 1979. Biología de la reproducción del cerdo. En: Inseminación de la cerda. Biología, Técnica, Organización. Acribia, Zaragoza, España. 27-89 71. Köing, I. 1979. Producción de esperma. En: Inseminación de la cerda. Biología, Técnica, Organización. Acribia, Zaragoza, España. 72. König, H.E., Liebich, H.G. 2005. Órganos genitales femeninos (Organa genitalia feminina).En: Anatomía de los animales domésticos. Editorial medica Panamericana. México. 135-142 73. Laurence, R.J. 2000. Infertilidad en el macho. En: Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., Harvey, M.(Eds). Harcourt. México.114-119 74. Lebas, F. Coudert, P. 1996. El conejo. Cría y patología. FAO, México. 186 75. Linde-Forsberg, C. 2006. Inseminación Artificial. En: Caninos y felinos domésticos. Wanke, M.M., Gobello, C.R. (Eds). Inter-médica. Buenos Aires. Argentina. 175-193 76. Noakes, D.E. 1997. Dystocia. En: Fertility and obstetrics in cattle. Blackwell. University ot London. 86-98 77. Noakes, D.E. 1999. Animal normal no gestante. En: Fertilidad y obstetricia del ganado vacuno. Acribia, Zaragoza, España. 17-31 78. Noakes, D.E. 1999. Gestación normal. En: Fertilidad y obstetricia del ganado vacuno. Acribia, Zaragoza, España. 33-42 79. Noakes, D.E. 1999. Inseminación Artificial. En: Fertilidad y obstetricia del ganado vacuno. Acribia, Zaragoza, España. 157-161 80. Noden, D.M., De lahta, A. 1990. Estadios iniciales del desarrollo en aves y mamíferos. En: Embriología de los animales domésticos. Acribia, Zaragoza, España. 36-37 81. Malcolm, D., Roderick, E. 1999. Reproductive system. En: Manual of Small animal clinical pathology. Bristish small animal veterinary association. 339-340 82. Martín, R.S. 2000. Inseminación Artificial porcina. En: Porcicultura intensiva y extensiva. En: Tomo VI en: Zootecnia animal. Acribia, Zaragoza, España. 135147 83. McDonald, L.E. 1989. Veterinary Endocrinology and Reproduction; Lea and Febiger. U.S.A. 84. McGlone, J. Pond, W. 2003. Pig producction: Biological principles and applications. Thomson learning, Australia. 187 85. Medway, W. 1973. Patología Clínica Veterinaria. Unión Tipográfica editorial. México. 489-491 86. Mesquita, H.M., Fritsch, M. 2006. Gametogénesis. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds) Limusa, México. 87. Morel, D. 2005. Fisiología de la reproducción de los équidos, cría y manejo de la yegua; Acribia, España. 88. Moya, J.L., Vidal R.S. 2004. Aparato genital femenino. En: Tratado de Histología Veterinaria. Gazquez, O.A., Blanco, R.A.(Eds) Masson. Barcelona, España. 381-390 89. Olivera, M. 2006. Puerperio y establecimiento de la dinámica folicular postparto. En: Reproducción de animales domésticos. Galina, C. Valencia, J.(Eds). Limusa, México. 189-200 90. Ortega, A., Pacheco, R., Montes, P.J.F., Torres, A.A., Aguilar, C.E., Avalos, B.1999. Diagnóstico de gestación en cabras criollas (Capra hircus) mediante determinación de los niveles sanguíneos de progesterona y ultrasonografía de tiempo real. Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Yucatán. Mérida, Yucatán México. Revista biomédica, 10: 229234. 91. Páramo, R.M. 2006. Morfofisiología de los órganos genitales del macho y de la hembra. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 27-42 92. Páramo, R.M. 2006. Aspectos reproductivos del perro domestico (Canis familiaris). En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 469-495 188 93. Páramo, R.M. 2006. Aspectos reproductivos de los felinos. En: Reproducción de animales domésticos. Galina, C. Valencia, J.(Eds). Limusa, México. 511-519 94. Paul M. Fricke, Ph.D. 2000. Aplicaciones prácticas del ultrasonido para el manejo reproductivo en ganado lechero. Departamento de Ciencia Lechera, Universidad de Wisconsin - Mádison, Mádison, WI, USA, 53 :706-1284 95. Perea G.F. 2005. Ecografía reproductiva. En: Manual de Ganadería Doble Propósito. Núcleo Universitario Rafael Rangel, Universidad de Los Andes, Venezuela. 96. Pérez, F., Pérez, G.J.F. 1985. Tecnología de la recolección de embriones. En: Reproducción animal: Inseminación Artificial y Transplante de embriones. Científico-médica. España. 726-757 97. Pérez, C.R., Porras, A.A. 2006. Reproducción de ovinos. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 439-465 98. Peter, C., Godoy, B. 1976. Vísceras torácicas, abdominales y pelvianas del macho plano superficial derecho. En: Anatomía del caballo. Acribia, Zaragoza, España. 70-71 99. Peter, C., Godoy, B. 1976. Vísceras torácicas abdominales y pélvicas. Hembra plano profundo izquierdo. En: Anatomía del caballo. Acribia, Zaragoza, España. 67-69 100. Peters, A.R., Ball, P.J.H. 1991. Fisiología especial del sistema nervioso. En: Reproducción del ganado vacuno. Acribia. Zaragoza, España. 189 101. Peters, A. R., Ball, P.J.H. 1991. Inseminación Artificial. En: Reproducción del ganado vacuno. Acribia. Zaragoza, España. 73-86 102. Peters, A. R., Ball, P. J. H. 1991. Fertilización, concepción, gestación y su diagnostico. En: Reproducción del ganado vacuno. Acribia, Zaragoza, España. 116-118 103. Peters, A. R., Ball, P. J. H. 1991. Parto y lactación. En: Reproducción del ganado vacuno. Acribia, Zaragoza, España. 125-135 104. Peters, A. R., Ball, P. J. H. 1991. Transferencia de embriones y técnicas relacionadas. En: Reproducción del ganado vacuno. Acribia, Zaragoza, España. 173-185 105. Phillips, C.J.C. 2003. Cría y reproducción. En: Principios de producción bovina, Acribia, Zaragoza, España. 168-169 106. Powell, D.G. 2000. Manejo de la reproducción en las explotaciones equinas. En: El caballo, salud y cuidados. Acribia. Zaragoza, España. 184-185 107. Priedkalns, J. 1980. Sistema Reproductor Femenino. En: Histología Veterinaria. Dellmann, D.H., Brown, E.M.(Eds).Acribia. Zaragoza, España. 347-358 108. Radostits, O.M., Mayhem, I. G., Houston, D.M. 2002.Examen y diagnostico clínico en veterinaria. Harcourt. Madrid, España. 669-670 109. Rodríguez, M.J.M. 2005. Diagnóstico precoz de gestación. En: Manual de Ganadería Doble Propósito. Unidad de Investigaciones en Ciencias Morfológicas. Facultad de Ciencias Veterinarias. Universidad del Zulia. Estado Zulia. Venezuela 190 110. Ruckebusch, Y., Phaneuf, L.P., Dunlop, R. 1991. Periodos de gestación de cigoto y embrión; transferencia de embriones. En: Fisiología de pequeñas y grandes especies, El manual moderno, México. 733-741 111. Ruckebusch, Y. 1994. Unidad fetomaterna de gestación. En: Fisiología de pequeñas y grandes especies. El manual moderno, México. 752-753 112. Ruckebusch, Y., Phaneuf, L.P., Dunlop, R. 2000. Fisiología de pequeñas y grandes especies, El manual moderno, México. 113. Salomón, S. 1990. Manejo y valoración del semen. En: Inseminación artificial de ovejas y cabras. Acribia, Zaragoza, España. 95-105 114. Salisbury, G.W., VanDemark, N.L., Lodge, J.R. 1978. Recogida de semen. En: Fisiología de la reproducción e Inseminación Artificial de los Bóvidos. Acribia Zaragoza, España. 403-409 115. Schwarze, E. Et al. 1984. Compendio de anatomía veterinaria. En: El sistema visceral. Acribia, Zaragoza, España. 116. Sloss, V., Dufty, J.H. 1987. Procedimientos sobre el feto. E: Manual de obstetricia bovina. Continental. México. 205-225 117. Sisson, S., Grossman, J.D. 1981.Órganos genitales de la vaca. En: Anatomía de los animales domésticos. Salvat Editores. México. 594-599 118. Sisson, S., Grossman, J.D. 1981.Órganos genitales de la perra. En: Anatomía de los animales domésticos. Salvat Editores. México. 604-605 119. Sorensen, A.M. 1982. Fecundación y transplante de embriones. En: Reproducción animal principios y practicas. McGraw-Hill, México. 359-380 191 120. Sorensen, A.M. 1984. Eyaculación y recolección de semen. En: Reproducción animal principios y practicas. McGraw-Hill, México. 97-115 121. Sorensen, A.M. 1984. P procesamiento y almacenaje del semen. En: Reproducción animal principios y practicas. McGraw-Hill, México. 157-185 122. Sorensen, A.M. 1984. Gestación y diagnostico de la preñez. En: Reproducción animal principios y practicas. McGraw-Hill, México. 414-435 123. Squires, J.E. 2006. Hormona y receptor. Estructura y función. En: Endocrinología animal aplicada. Acribia. Zaragoza, España. 124. Stabenfeldt, G.H., Edqvist, L.E. 1999. Procesos de la reproducción de la hembra. En: Fisiología de los animales domésticos de Dukes. Swenson, M.J., Reece, W.O. (Eds). Noriega Editores. México. 681-689 125. Stephen, J.R. 1979. Distocia: Sus causas. En: Obstetricia veterinaria y patología de la reproducción Teriogenelogia. Hemisferio Sur. Argentina. 299311 126. Swenson M. J. 1999. Fisiología de los animales domésticos de Dukes. Uteha, México. 127. Tamayo, T. M., 2000. La ecografía como medio diagnostico y evaluación de los procesos reproductivos en el bovino. Departamento de Clínica, Facultad de Medicina Veterinaria, Universidad Agraria de La Habana. San José, La Habana. 128. Trejo, G.A., 1990. Variación estacional de la libido y calidad del semen en cinco razas ovinas del estado de México. UNAM. Tesis de maestría. Cuautitlán Izcalli. Estado de México. 9-13 192 129. Tribulo, H., Bo, G. 2006. Biotecnologías Reproductivas. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 539-565 130. Vatti, G.1981. El Parto patológico. En: Ginecología y Obstetricia Veterinaria. Hispano-americana. México. 350-434 131. Vatti, G. 1992. Ginecología y Obstetricia Veterinarias, Grupo Noriega Editores, México. 132. Villar, S.V. López, M.F. 2004. Protocolos de anatomía veterinaria. Bellisco, Madrid, España. 390-400 133. Warwick, E.J., Legates, J.E. 1980. Proceso reproductivo. En: Cria y mejoramiento del ganado. Mc Graw-Hill. México. 82-84 134. Weisbasch, H.S.A. 1993. Tratado de obstetricia veterinaria comparada. Celsus. Santa Fe de Bogotá. Colombia. 135. Wilmut, I. 1994. Transferencia de embriones. En: Nuevas técnicas de producción ovina. Fayez, M.M., Owen, J.B.(Eds). Acribia. Zaragoza, España. 89-111 136. Wittke, G. 1978. Fisiología de los animales domésticos. Hemisferio sur. Buenos Aires, Argentina. 141-148 137. Zemjanis, R. 1987. Examen del embarazo. En: Reproducción animal, Diagnostico y técnicas terapéuticas. Limusa. México. 43-59 193 Práctica I. Anatomía del aparato reproductor de los machos domésticos. Duración: 4 horas. OBJETIVO. Que el alumno adquiera la capacidad de reconocer las diferentes estructuras del aparato reproductor del macho, así como las glándulas sexuales accesorias del aparato genital normal de macho. GENERALIDADES. El aparato reproductor de los machos domésticos esta integrado por dos gónadas, los epidídimos, los conductos deferentes, el pene y el prepucio, así como glándulas sexuales accesorias que forman el plasma seminal, importante para la viabilidad de los gametos masculinos (Climent, 2005; Páramo, 2006). ESCROTO. Es un saco cutáneo de tamaño, forma y situación que se adapta a los testículos que contiene. La piel del escroto es fina, plegable y casi sin pelo. Inmediatamente por debajo de la capa externa cutánea se encuentra otra de tejido fibroelástico, llamada túnica Dartos que pasa en el plano medio entre los dos testículos, de modo que el saco escrotal está dividido en dos departamentos. Se encuentran 2 capas más, la primera es la túnica vaginal común (parietal) localizada en la parte interna de la aponeurosis profunda del escroto y la túnica vaginal propia (visceral) muy ligada al testículo (Peter, 1976; Fradson, 1992). TESTÍCULOS. Son órganos pares, productores de espermatozoides y de hormonas masculinas, situados en el escroto, su forma es oval; en los rumiantes son alargados, en carnívoros esferoideos. Dada su forma oval presenta dos polos, el que se relaciona con la cabeza del epidídimo se denomina polo capital, el opuesto se relaciona con la cola y es el polo caudado. Tienen un borde epididimario y un borde libre, además de contar con dos 1 caras, lateral y medial. Dentro del escroto, la orientación del testículo varia con las especies, de forma que su polo caudado se encuentra ventralmente en rumiantes, caudalmente en el garañón y carnívoros (perro y gato); En el verraco apuntan dorsalmente (Asdown, 2000; Villar, 2004). EPIDÍDIMO. Consta de cabeza, cuerpo y cola. Su cola se une al polo caudado por el ligamento propio del testículo. La situación del epidídimo varía en las distintas especies: en el garañón, verraco y carnívoros se sitúa craneodorsalmente respecto al testículo; en el toro coincide con la línea media en dos mitades iguales, en el morueco es muy caudal y en el macho cabrio ocupa una posición intermedia (Köing, 1979; Ashdown, 2000; Climent, 2005). CONDUCTOS DEFERENTES. Conectan la cola del epidídimo con la uretra pélvica. La pared de la última porción de los conductos deferentes se engruesa por la presencia de glándulas ramificadas que constituye las ampollas. Pueden presentar dilataciones laterales de su luz denominadas divertículos de la ampolla. Pasada la ampolla, los conductos se adelgazan y en el garañón y rumiantes se unen al conducto excretor de las glándulas vesiculares, formando un conducto común denominado conducto eyaculador que desemboca en los orificios eyaculadores. La última porción del conducto deferente perfora la próstata en todas las especies (Köing, 1979; Dyce, 1999). GLÁNDULAS ACCESORIAS. Se agrupan alrededor de la uretra pélvica. Presentan variaciones según las especies. En el bovino, carnero, verraco, garañon, y caprino son: ámpulas, vesículas seminales, próstata y bulbouretrales. El gato carece de las vesículas seminales, en el perro solo hay próstata (Páramo, 2006). VESÍCULAS SEMINALES. Son pares y se sitúan dorsolateralmente al cuello de la vejiga, introduciéndose entre las dos hojas del pliegue genital pero lateralmente al conducto deferente. En el garañón 2 tienen el aspecto de bolsas largas y amplias; en rumiantes son compactas y de superficie lobulada, en el verraco son muy grandes y de forma piramidal. Los carnívoros carecen de vesículas seminales (Carvajal, 2000; Climent, 2005). PRÓSTATA. Existe en todos los animales, está íntimamente relacionada con la primera porción de la uretra. En los carnívoros presenta mayor tamaño relativo, decreciendo progresivamente en este orden: garañón, toro, verraco, pequeños rumiantes. Consta de un cuerpo y una porción diseminada. El primero consta de dos lóbulos, derecho e izquierdo (Dyce, 1999; Carvajal, 2000; Climent, 2005). GLANDULAS BULBOURETRALES. Son pares y se encuentran dorsalmente a la porción caudal de la uretra pélvica. Son pequeñas en el gato y están ausentes en el perro, en el verraco son cilíndricas y muy largas de aproximadamente 15cm; en el toro y el garañón son esféricas (Köing, 1979; Dyce, 1999). URETRA. La uretra es un conducto que se extiende desde la unión con la ampolla hasta la porción terminal del pene, es un conjunto mixto para los sistemas reproductor y urinario. Tiene una porción pélvica y otra peneana, ambas porciones tienen una mucosa constituida por un epitelio de transición y glándulas uretrales en la lámina propia a nivel del orificio uretral externo. La túnica muscular está constituida por fibras musculares lisas y tejido cavernoso (cuerpos cavernosos) presente en el tejido conjuntivo por debajo del epitelio (Köing, 1979; Habel, 1988; Dyce, 1999). 3 GENITALES EXTERNOS PENE. Es el órgano copulador del macho, está constituido de tejido eréctil y está unido a la arcada isquiática de la pelvis por los pilares del pene. En los carnívoros es cilíndrico y presenta hueso peneano, en el verraco y rumiantes es largo y delgado, de consistencia firme aun sin erección, se dobla sobre si mismo formando la flexura sigmoidea: preescrotal en el cerdo y retroescrotal en los rumiantes. La porción libre del pene del verraco es afilada y torcida en espiral. En los pequeños rumiantes hay un proceso uretral de aproximadamente unos 4cm. El pene cuenta consta de dos cuerpos cavernosos, la uretra envuelta por su cuerpo esponjoso y el glande (Habel, 1968; Habel, 1988; Climent, 2005). PREPUCIO. Es una vaina cutánea que cubre el glande y la porción libre del pene cuando no está en erección. En el verraco presenta un amplio divertículo dorsal en el cual se acumulan orina y desechos epiteliales. En el garañón es penduloso y con pigmentación oscura (Ashdown, 2000; Villar, 2004). 4 EQUIPO E INSTRUMENTOS: Charolas, pipetas Pasteur, cajas de Petri, vasos de precipitado, portaobjetos, cubreobjetos, microscopio estereoscópico y óptico. MATERIAL ALUMNO: Bata, estuche de disección, guantes de cirujano, hilo de algodón, etiquetas adheribles, solución salina, jeringas de 3cm3 e insulinicas, bisturí, pinzas, tijeras, agujas hipodérmicas de calibre 18. MATERIAL BIOLÓGICO: Aparato reproductor de diferentes especies de machos domésticos. REACTIVOS: Solución salina, colorante de Eosina-Nigrosina, tinción de Wright. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositar el material biológico en las charolas. 3. Para proceder a la disección del material biológico, se requiere la utilización de guantes de cirujano y el instrumental adecuado. Identificar, con ayuda de las figuras 1 a la 7, el mayor número de estructuras del aparato reproductor del macho. 4. Con ayuda de hilo y etiquetas señalar cada estructura que se identifique. 5. Se realizará un lavado del epidídimo con solución salina: se hará una serie de cortes en la cola del epidídimo con la hoja de bisturí, posteriormente se hace un lavado retrogrado desde el conducto deferente inyectando solución salina fisiológica con una jeringa, el lavado se colectará en cajas de Petri. Después, se pondrá una gota de este lavado en un portaobjetos y una gota de colorante Eosina-Nigrosina, se mezclaran perfectamente, se hace el frotis, se seca al aire y se observa al microscopio. 5 6. Realizar improntas comparativas, se hace una incisión a lo largo del testículo y el epidídimo, se sujeta un porta objetos con la mano y se coloca sobre la superficie del órgano presionando ligeramente, posteriormente se tiñe con la tinción de Wright o una tinción similar. 7. El material biológico así como los guantes de látex utilizados en esta práctica se depositarán en bolsas de plástico de color amarillo, para su destrucción por cremación. Es importante destacar que estas bolsas serán llevadas por los alumnos que se designen en el momento de la práctica por el profesor. 8. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará dentro de la estufa, que se localiza en el laboratorio. 9. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 10. La limpieza y desinfección del área de trabajo, por parte de los alumnos, es de suma importancia para mantener limpio el laboratorio. 11. Como punto final el profesor realizara la evaluación de la práctica. 6 Figura 1. Anatomía de aparato reproductor del toro.1 Recto Ampolla Vesícula Seminal Próstata Bulbouretrales Vejiga Flexura Sigmoidea Pene Glande Conducto deferente Plexo pampiniforme Epidídimo Testículo Prepucio 1 Adaptado de: Páramo, 2006. 7 Figura 2. Anatomía del aparato reproductor del verraco (McGlone, 2003).2 Ampolla Recto Vesícula Seminal Próstata Conducto deferente Bulbouretrales Vejiga Epidídimo Divertículo prepucial Testículo Flexura Sigmoidea Prepucio 2 Glande Pene Adaptado de: McGlone, J., Pond, W. 2003. 8 Figura 3. Anatomía del aparato reproductor del garañón.3 Ampolla Recto Vesícula Seminal Próstata Conducto deferente Bulbouretrales Vejiga Epidídimo Glande Testículo Pene Prepucio 3 Proceso uretral Adaptado de: Peter, C., Godoy, B. 1976. 9 Figura 4. Anatomía del aparato reproductor del perro4. Recto Próstata Conducto deferente Vejiga Pene Epidídimo Prepucio Bulbo del glande Testículo Glande 4 Adaptado de: Climent, S; Sarasa, M. 2005. 10 Figura 5. Anatomía del aparato reproductor del gato.5 Recto Próstata Bulbouretrales Epidídimo Testículo Vejiga Pene Prepucio Conducto deferente 5 Glande Adaptado de: Climent, S; Sarasa, M. 2005 11 Figura 6. Anatomía del aparato reproductor del carnero.6 Recto Ampolla Vesícula Seminal Próstata Vejiga Glande Bulbouretrales Pene Flexura Sigmoidea Conducto deferente Epidídimo Testículo Proceso uretral Prepucio 6 Adaptado de: Ashdown, R.R., Hafez, E.S.E. 2000. 12 Figura 7. Anatomía del pene en las diferentes especies domésticas.7 A. Pene de Toro. D. Pene de Garañon. B. Pene de Carnero. C. Pene de Verraco. 7 E. Pene de Gato. Adaptado de: Páramo, R. 2006 13 EVALUACIÓN PRÁCTICA I. Nombre del alumno: ______________________________________ Marca con una “x” si la especie cuenta con la estructura y llena los espacios vacíos para completar el cuadro. GLÁNDULAS ACCESORIAS ESPECIE AMPOLLA VESÍCULAS SEMINALES FLEXURA PRÓSTATA BULBOURETRALES SIGMOIDEA CARACTERISTICAS DEL PENE TORO GARAÑÓN VERRACO MORUECO MACHO CABRIO PERRO GATO 14 Diagrama Ecológico Práctica I. Anatomía de aparato reproductor de los machos domésticos. Disección del material Biológico Lavado del epidídimo con solución salina Realizar impronta Teñir con Writgh Realizar frotis El sobrante del lavado se desecha en la tarja Fin de la práctica Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas material biológico el Incineración 15 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACION ARTIFICIAL PRÁCTICA I ANATOMÍA DEL APARATO REPRODUCTOR DE LOS MACHOS DOMÉSTICOS Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 16 Práctica II Anatomía de aparato reproductor de las hembras domésticas. Duración: 4 horas. OBJETIVO. Que el alumno adquiera la capacidad de reconocer las diferentes estructuras donde se lleva a cabo el proceso de la reproducción así como los anexos del aparato genital normal de las hembras. GENERALIDADES. Conocer la anatomía de un aparato representa la base para su estudio, esto facilita la comprensión de su funcionamiento. El sistema reproductor de la hembra, está formado por un conjunto de órganos que tienen la función de producir, transportar y madurar los gametos para hacer posible la fecundación, el mantenimiento de la gestación y el parto, para perpetuar la especie. Las gónadas son un par de glándulas con doble secreción; La exocrina que está representada por la producción y liberación de gametos así como la endocrina por la síntesis y liberación de hormonas. Las estructuras tubulares son las responsables del transporte y maduración de los gametos, del proceso fisiológico de la fecundación y gestación, además de jugar un papel muy importante durante el parto. A partir de la pubertad, hay cambios cíclicos, controlados hormonalmente, con modificaciones reversibles e irreversibles de sus órganos (ciclo estral), cuya principal manifestación externa denominada celo o estro (Climent, 2005). El aparato reproductor de la hembra, está constituido por dos ovarios y las estructuras tubulares que constituyen los oviductos, útero, vagina y vulva (Hafez, 2000; Schwarze, 1984). A excepción de la vulva, todos los órganos genitales de la hembra son internos, es decir, se encuentran en el interior de las cavidades abdominal y pélvica (Dyce, 1999). OVARIOS. Son las gónadas femeninas; producen los óvulos que se liberan al oviducto. Son de consistencia firme y su forma varía entre las especies, en rumiantes son ovalados y pequeños, presentan una bolsa ovárica, cuya entrada es amplia y dirigida ventralmente; 17 en la yegua tiene una forma arriñonada, es importante destacar que en esta especie la zona parenquimatosa que alberga los folículos se dispone en el centro del órgano y la zona vascular en posición periférica; en la cerda tiene una forma oval con la apariencia de un racimo de uvas, por el relieve que forman los folículos en desarrollo, la bolsa ovárica es amplia, cónica y abierta ventralmente; en la perra y la gata son alargados y planos, en la primera el ovario está completamente encerrado, en la bolsa ovárica, de forma contraria en la gata esta parcialmente incluido en ella (Sisson, 1981; Climent, 2005). OVIDUCTO. Son tubos músculo-membranosos que transportan los óvulos hasta el útero. En el extremo ovárico del oviducto se dilata en forma de embudo, éste constituye el infundíbulo, su borde es dentado con una serie de eminencias puntiagudas denominadas fimbrias. Su porción más estrecha es el orificio abdominal, este último da paso a la ampolla, su luz se estrecha para dar paso al istmo, que termina a nivel de la porción uterina en el orificio uterino (Fradson, 1992; Dyce, 1999). ÚTERO. Su forma y estructura es variable. Consta de cuello, cuerpo y cuernos uterinos. El cuello uterino (cérvix) es la porción más caudal, conecta al útero con la vagina, su luz se denomina canal cervical que es característico en cada especie tanto por su morfología como por su longitud. En la coneja se presenta una característica muy particular, la presencia de dos cuellos uterinos (Fradson, 1992; Lebas, 1996). El cuerpo del útero es un simple tubo musculomembranoso situado cranealmente al cuello uterino y de longitud variable entre las diferentes especies (Fradson, 1992; Villar, 2004; Páramo, 2006). Los cuernos en los rumiantes tienen forma espiroidal y presentan en la mucosa, como carácter típico, los cotiledones uterinos. Éstos son eminencias ovales, en número aproximadamente de cien, que están distribuidas de modo irregular sobre la superficie o dispuestas en filas, unas doce, cabe señalar que el la vaca estos presentan una forma convexa y las ovejas y cabras tiene una forma concava. En la yegua son rectos y tan 18 largos como el cuerpo. En la perra y la gata son largos y rectos. En la cerda son largos y flexuosos, pudiéndose confundir con asas intestinales (Sisson, 1981; Villar, 2004). VAGINA. Es una formación tubular que junto con el vestíbulo y la vulva constituyen el órgano copulador de las hembras, la porción vaginal del cérvix hace relieve en la vagina, dando lugar a la formación de un receso anular, el fórnix vaginal, ausente en cerdas (Köing, 1979; Hafez, 2000). VESTÍBULO VAGINAL. Es una parte común a las vías urinaria y genital; se extiende desde el orificio uretral externo a los labios de la vulva. En la vaca y en la cerda presenta un divertículo suburetral inmediatamente caudal al orificio uretral (Habel, 1968). Las glándulas vestibulares mayores (de Bartholin) se encuentran en la vaca, gata y ocasionalmente en la oveja. Son dos masas glandulares compactas de unos 3 cm en la vaca. Las glándulas vestibulares menores son numerosas y se localizan en las paredes lateral y ventral del vestíbulo, en las especies restantes. En la perra y la yegua se encuentran los bulbos vestibulares uno a cada lado (Dyce, 1999; Climent, 2005). VULVA Y CLÍTORIS. Como se mencionó con anterioridad, la vulva es el único órgano externo del aparato genital. Consta de dos labios, derecho e izquierdo unidos dorsalmente por una comisura dorsal redondeada y ventralmente por la comisura ventral, puntiaguda en todas las especies domésticas excepto en la yegua, en la que ambas son redondeadas. La comisura ventral contiene el clítoris, homólogo del pene del macho, está unido a la arcada isquiática por dos pilares del clítoris los que confluyen el cuerpo del clítoris, compuesto de tejido eréctil, que termina en un glande del clítoris (Ciria, 2000; Páramo, 2006). 19 EQUIPO E INSTRUMENTOS: Charolas, porta objetos, cajas de petri, cubre objetos, microscopio estereoscópico y óptico. MATERIAL ALUMNO: Bata, estuche de disecciones, guantes de cirujano hilo de algodón, etiquetas, solución salina, bisturí, pinzas, tijeras, agujas hipodérmicas calíbre 18. MATERIAL BIOLÓGICO: Aparatos reproductores de diferentes especies de hembras domésticas. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositarán el material biológico en las charolas. 3. Para proceder a la disección del material biológico, se requiere la utilización de guantes de cirujano y el instrumental adecuado. 4. Identificar con ayuda de las figuras 8 a la 12, el mayor número posible de estructuras del aparato reproductor. 5. Con ayuda del hilo y las etiquetas mencionar la estructura que se está señalando. 6. El material biológico así como los guantes de látex resultante de esta práctica se depositara en bolsas de plástico color amarillo, para su destino final, la cremación. Es importante destacar que éste será llevado por los alumnos que se designen en el momento de la práctica por el profesor. 7. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 8. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 9. La limpieza y desinfección del área de trabajo por parte de los alumnos, es de suma importancia para mantener limpio el laboratorio. 10. Como punto final el profesor realizará la evaluación de la práctica. 20 Figura 8. Aparato reproductor de la vaca8. Ligamento intercornual dorsal Cuerno del útero Carúnculas Oviducto Ovario Cuerpo del útero Cuello del útero Fórnix vaginal Vagina Vejiga Orificio uretral externo con divertículo suburetral Vestíbulo vaginal Labio de la vulva Glándulas vestibulares mayores Clítoris 8 Adaptado de Sisson y Grossman. 1981. 21 Figura 9. Aparato reproductor de la yegua9. Cuerno del útero Oviducto Ovario Cuerpo del útero Mesometrio Cuello del útero Vejiga Vagina Glándulas vestibulares menores Vestíbulo vaginal Labio de la vulva Clítoris 9 Adaptado de Schwarze 1984. 22 Figura 10. Aparato reproductor de la cerda10. Oviducto Cuerno del útero Mesometrio Cuerpo del útero Ovario Bolsa ovárica Vejiga Cuello del útero Uréter Vagina Orificio uretral externo con divertículo suburetral Vestíbulo vaginal Labio de la vulva Clítoris 10 Adaptado de McGlone y Pond. 2003. 23 Figura 11. Aparato reproductor de la perra11. Bolsa ovárica Oviducto Ovario Cuerno del útero Cuerpo del útero Vejiga Cuello del útero Vagina Vestíbulo vaginal Labio de la vulva Clítoris 11 Adaptado de Villar y López. 2004. 24 Figura 12. Aparato Reproductor de la coneja.12 Ovario Oviducto Cuerno del útero Cuerno del útero Cuello del útero Cuello del útero Vagina Vejiga Meato urinario Vestíbulo vaginal Glándula de Bartholin Glándula prepucial Labio de la vulva Clítoris 12 Adaptado de: Lebas y Coudert. 1996. 25 Figura 13. Aparato Reproductor de la oveja y la cabra.13 Cuello del útero Ovario Labio de la vulva Cuerno del útero Vejiga 13 Clítoris Vagina Adaptado de: Delgadillo, J. A. 2005 26 EVALUACIÓN PRÁCTICA II. Nombre del alumno.______________________________________ 1. Llena los espacios vacíos con la información que se te pide. ESPECIE FORMA DEL OVARIO TIPO Y CARACTERÍSTICA DEL ÚTERO FORMA DEL CÉRVIX VACA YEGUA CERDA PERRA CONEJA 2. ¿Que es la fosa ovárica? 3. ¿En que estructura se lleva acabo la fecundación en las diferentes especies? 27 Diagrama Ecológico Práctica II. Anatomía de aparato reproductor de hembras domesticas. Disección del material Biológico Descripción de las estructuras ováricas Fin de la Práctica Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas el material biológico Incineración 28 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA II ANATOMÍA DEL APARATO REPRODUCTOR DE LAS HEMBRAS DOMÉSTICAS Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 29 Practica III Anatomía del aparato reproductor de machos y hembras. Práctica en vivo. Especie: Bovino. Duración: 4 horas OBJETIVO. Que el alumno adquiera la capacidad de evaluar aparatos genitales normales o sus anomalías mediante la manipulación en vivo de los machos y hembras de los módulos de producción de FES - Cuautitlán, así como el manejo adecuado de cada especie para evitar accidentes tanto para el estudiante como para la especie de que se trate durante el acceso al área genital. GENERALIDADES. Un arma importante para conocer el estado físico del aparato reproductor de los bovinos es la palpación rectal, en las vacas, aporta información útil para el médico veterinario, ya que se puede determinar la fase del ciclo estral en la que se encuentra, es posible diagnosticar la gestación, y el estado general del animal en su etapa reproductiva, la palpación es también empleada para la inseminación artificial, ya que el cuello se sujeta por vía rectal para dirigir el catéter de inseminación entre los anillos del cérvix y así introducirlo mas allá de éste, depositando de esta manera el semen directamente en el útero (Gordón, 2006). El aparato reproductor de la hembra puede ser examinado mediante la palpación rectal. El vestíbulo, la vagina y la abertura externa del cuello del útero pueden ser examinados mediante palpación manual o, visualmente con la ayuda de un vaginoscopio. Antes de emprender estos procedimientos es importante realizar una inspección cuidadosa de la vulva, perineo y superficies corporales (Noakes, 1999). Se debe estar familiarizado con la disposición del aparato reproductor de la hembra, la anatomía de los órganos abdominales y del esqueleto pélvico; el rumen se localiza de 30 lado izquierdo de la cavidad abdominal, los riñones son estructuras lobuladas del tamaño aproximado de una manzana situados a los lados de la línea media y en lo alto de la cavidad. El hueso pélvico es la mejor referencia, sobre todo el borde craneal (Sorencen, 1984). Es importante seguir una rutina regular observando la vulva para descubrir manifestaciones de secreciones o flujos durante todo el proceso. La vagina es difícil de identificar porque su pared es muy delgada y flácida, el cuello del útero es un elemento importante de referencia, su relación con respecto al borde de la pelvis, su tamaño, forma y el grado de movilidad. En novillas, el cuello del útero mide aproximadamente 2 a 3cm de diámetro y 5 a 6cm de longitud. La bifurcación de los cuernos uterinos se identifica justamente en posición craneal con respecto al cuello del útero especialmente si se comprime contra el borde pélvico, en forma de una fisura o hendidura antes de que se separen los cuernos, estos últimos se curvan inicialmente hacia abajo y adelante y después hacia atrás y arriba cerca de la punta que está situada de 5 a 6cm del cuello del útero. Por último, los ovarios se localizan más fácilmente siguiendo los cuernos uterinos alrededor de la curvatura mayor y después dirigiendo suavemente hacia atrás las puntas de los dedos en dirección al cuello del útero, se determinará su posición, tamaño y naturaleza de las estructuras presentes sobre el ovario, que pueden ser folículos, cuerpos lúteos, cuerpos albicans, folículos luteinizados y quistes (Noakes, 1999). En el toro se puede utilizar esta técnica, palpación rectal, para identificar las glándulas bulbouretrales; se puede estimular a este nivel con un masaje suave y se logra que el animal exteriorice el pene, entonces se puede explorar la mucosa. Una técnica que parece ser de gran utilidad para estimar la eficiencia reproductiva con base en la producción de espermatozoides, es la estimación del peso testicular a partir de medidas in vivo de los testículos. El largo de los testículos se ha empleado para estimar el peso de los mismos, pero presenta una limitante, ya que es difícil delimitar los bordes exactos de la glándula por efecto del cordón espermático en la parte superior y por el epidídimo en el extremo inferior. Otra medida es estimar el diámetro testicular a 31 través del escroto, ya que presenta una alta correlación con el peso de la glándula (r=0.92) y con el número de espermatozoides producidos por eyaculado (r=0.76) y (r=0.90). Sin embargo, esta medida puede verse afectada por la presencia de la lana en el escroto, la grasa subcutánea y el grosor de la piel escrotal (Trejo, 1990; Aguirre, 2004). Cuadro 1. Tamaño testicular aceptable en toros. Edad del toro en meses Circunferencia escrotal mínima Circunferencia escrotal buena 12-15 30 >34 15-18 31 >36 19-21 32 >37 22-24 33 >38 Mayor de 24 34 >39 Figura 14. Palpación de aparato reproductor de la vaca.14 14 Adaptado de Chagoya. 1990 32 EQUIPO E INSTRUMENTOS: Vaginoscopios, cubetas de 4 litros. MATERIAL ALUMNO: Cuerdas, botas, overol, guantes de palpación, guantes de látex, cubeta, jabón, toallas de papel, lámpara, espejo, cinta métrica. MATERIAL BIOLÓGICO: Bovinos hembras y machos del módulo de bovinos de leche del Centro de Producción Agropecuaria de la FES-Cuautitlán. SOLUCIONES ANTISÉPTICAS. Yodo al 5% PROCEDIMIENTO 1. Sujetar a la hembra, una por equipo de trabajo, asegurándose de que la manipulación sea segura tanto para el alumno como para la vaca. 2. Colocarse los guantes de palpación y látex, si así lo prefiere, recuerde que la mucosa de la hembra es una estructura muy delicada por lo que se pide tener cuidado de no introducir la mano con uñas largas, pulseras, reloj o anillos. 3. Lubricar el guante antes de introducir la mano en el recto. 4. Ya en el interior, desplazar la mano sobre el piso del recto para identificar el cérvix y las estructuras del aparto genital (Figura 15). 5. El siguiente paso será lavar con jabón y agua la vulva, secar con las toallas de papel. 6. El vaginoscopio se desinfectará previamente, se le aplicará un antiséptico con dos propósitos principales: lubricar y evitar un problema posterior de infección para el animal, la forma adecuada de introducir el aparato es colocarlo de forma vertical con el bisel hacia enfrente, se abren los labios de la vulva con una mano y con la otra se introduce lentamente inclinándolo poco a poco, hasta llegar a una posición horizontal, se introducirá con movimientos en semicírculo suaves, una vez dentro con ayuda de una lámpara o un espejo (para reflejar la luz solar) se revisara el cérvix y la mucosa vaginal. 33 7. Siguiendo las instrucciones de la primera parte, sujetar al toro, con el guante lubricado, se introduce la mano y se palpan las glándulas bulbo uretrales; con ayuda de un estimulo (masaje sobre las glándulas), el toro desvainará el pene. 8. La circunferencia testicular se mide utilizando una cinta métrica. Para facilitar la medición se bajan los testículos jalando suavemente con la mano para que se ubiquen en el fondo del escroto. Figura 15. Medición de la Circunferencia Testicular.15 9. El volumen testicular se mide introduciendo en la cubeta los testículos, la cantidad de agua sobrante en la cubeta se mide con una probeta, el cálculo se hace, restando esta cantidad al volumen inicial. 15 Realizado por Alcantar, UNAM. 2007. 34 EVALUACIÓN DE LA PRÁCTICA III. 1. Esquematiza el aparato reproductor de la vaca, señalando la relación anatómica con otros órganos. 2. Realiza un dibujo de cómo se observa el cérvix a través del vaginoscopio. 3. Menciona qué es el neumo-recto y cual es la causa que lo ocasiona. 35 Diagrama Ecológico Práctica III. Anatomía de machos y hembras. Práctica en vivo. Palpación del aparato reproductor de la hembra utilizando guante de palpación y/o guante de látex. Palpación del aparto reproductor del macho utilizando guante de palpación y/o guante de látex. Fin de la práctica Recolección de los guantes en bolsas de plástico Incineración 36 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA III ANATOMÍA DEL APARATO REPRODUCTOR DE MACHOS Y HEMBRAS. PRÁCTICA EN VIVO. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 37 Practica IV. Identificación de las estructuras ováricas en las diferentes especies domésticas e Identificación de ovocitos. Duración: 4 horas OBJETIVOS. Que los alumnos reconozcan las estructuras presentes en los ovarios de diferentes especies. Identificar ovocitos, recolectados de ovarios de diferentes especies, para desarrollar la habilidad de reconocer e identificar ovocitos. GENERALIDADES. El ovario se considera una glándula exocrina por la producción de ovocitos y endocrina por la producción de hormonas esteroides que mantienen el desarrollo del aparato reproductor. Las células germinales son las únicas estructuras del organismo que poseen la capacidad de dividirse por meiosis sufriendo una reducción del número de cromosomas, siendo responsables por la transmisión de la carga genética a los descendientes (Banks, 1986; Hafez, 2000; Mesquita, 2006). El ovario se constituye como un cuerpo ovoide en el que se puede distinguir una zona gruesa periférica denominada corteza y una zona interna o médula. Recordando que en la yegua presenta la disposición de forma inversa. La principal función del ovario es la formación de ovocitos maduros para su expulsión hacia las trompas y su unión con los espermatozoides (Banks, 1986; Moya, 2004). El establecimiento de la actividad cíclica del ovario durante la pubertad, es importante para la formación y liberación de los gametos, al igual que para el establecimiento de las características de la madurez sexual. En la hembra, el sistema hipotálamo-hipofisiario se desarrolla en ausencia de los estímulos hormonales. La producción de gametos se lleva a cabo en el ovario embrionario por medio de la división meiótica de las células 38 germinales primitivas, la mitosis cesa con el nacimiento y en este momento ya existe él número máximo de óvulos que la hembra tendrá en su vida; Cuando ocurre destrucción de los gametos, el animal queda estéril. La meiosis, se detiene durante la etapa de dictioteno (de reposo) y sólo se reanuda hasta que se presenta la pubertad (Hansel, 1981; Cunningham, 1999). Los folículos ováricos se desarrollan en la corteza del ovario de hembras sexualmente maduras y difieren entre sí por el tamaño de los ovocitos que contiene en su interior y por el grado de diferenciación (Figura 16). Los folículos primordiales están formados por una capa plana de células epiteliales, que en estadios más tardíos de su diferenciación, se transforman en células de la teca interna, estos folículos contienen en su interior la célula denominada ovocito. Tanto en las hembras prepúberes como las púberes, se presenta el fenómeno de reclutamiento, que consiste en que un grupo de folículos primordiales son activados para que sigan su desarrollo y se diferencien (Köning, 2005; Trejo, 2008). Los folículos secundarios (en crecimiento), también conocidos como antrales, se componen de un epitelio estratificado de células poliédricas de la granulosa folicular que rodean a un ovogonio. Todavía no se halla presente entre las células epiteliales una cavidad llena de líquido, el antro. Se desarrolla una capa de glicoproteínas que se denomina zona pelúcida que rodea a la membrana plasmática del ovogonio, cuando se completa la formación de esta estructura, el ovogonio se convierte en ovocito primario. Otra estructura que se forma en esta etapa es la corona radiada, ya que las células de la granulosa que rodean inmediatamente al ovocito, se hacen prismáticas. Conforme prosigue el desarrollo folicular, se forman pequeñas cavidades llenas de líquido (grietas) entre las células de la granulosa folicular, denominándose por esto como antro folicular (Priedkalns, 1980; Fernández, 2003; Trejo, 2008). El folículo terciario o de Graaf, está formado por varias capas celulares de las cuales la más interna es la capa granulosa, encargada de segregar el líquido folicular. Por fuera de ella, existe una capa celulovascular que constituye las tecas foliculares. El ovocito está situado en un cúmulo ovárico. El folículo de Graaf es el dispuesto para la ovulación. En 39 este momento, los componentes de las tecas han alcanzado su máximo desarrollo, la interna esta formada por células fusiformes, que se asemejan a los fibroblastos; sin embargo, son células productoras de estrógenos. La teca externa continúa con las mismas características (Gürtler, 1979; Moya, 2004). Una vez que el folículo ovárico ha alcanzado la madurez, el ovocito debe ser liberado para su encuentro con el espermatozoide. Al proceso de salida del ovocito con los componentes foliculares se le denomina ovulación, y para que ésta se produzca es necesaria la lisis del folículo de Graaf. Se forma un estigma sobre la superficie del ovario a modo de cono; posteriormente se rompe (cuerpo hemorrágico), dando lugar a la salida brusca del ovocito, acompañado de la corona radiada, y es captado por la fimbria del oviducto (Wittke, 1978; Moya, 2004). La formación del cuerpo lúteo, comienza cuando la secreción de la granulosa cambia de estrógenos a progesterona, conversión denominada luteinización de la granulosa, que se debe a la oleada preovulatoria de LH. En algunas especies, la teca también contribuye a la composición del cuerpo lúteo. Un coágulo de fibrina que se forma en la cavidad del folículo colapsado sirve como base para que se desarrollen las células luteas. La membrana que separa la granulosa de la teca se reorganiza y esto permite el crecimiento de vasos sanguíneos hacia el interior del remanente folicular y así se vascularizan las regiones tisulares que contiene las células de la granulosa y la teca. En muchas especies, la oleada preovulatoria de LH determinan la formación y el mantenimiento inicial del cuerpo lúteo (Hansel, 1981). En el caso de que el espermatozoide no fecunde el oocito, el cuerpo luteo involuciona rápidamente. Las células luteínicas se cargan de lípidos y degeneran, al igual que el resto de los componentes, y el cuerpo lúteo se transforma en un tejido cicatrizal blanco, conociéndose a partir de este momento como cuerpo albicans que con el paso del tiempo migra hacia el interior del ovario y desaparece progresivamente. Si el cuerpo luteo se mantiene por la fecundación y la anidación del embrión en el endometrio, las células luteinicas se mantienen durante toda la gestación, denominándose cuerpo luteo persistente (Moya, 2004). 40 Figura 16. Estructuras ováricas.16 Cuerpo albicans Folículo atresico Folículo de graaf Folículo terciario Folículo roto Folículo secundario Cuerpo luteo Folículo primario Cuerpo luteo en regresión 16 Adaptado de Fradson, R.D., Spurgeon, T.L. 1992. 41 EQUIPO E INSTRUMENTOS: Charolas, cajas de Petri, microscopio estereoscópico. MATERIAL ALUMNO: Bata, estuche de disección, guantes de cirujano, hilo de algodón, etiquetas, solución salina fisiológica, jeringas 3 cm3 e insulinicas, bisturí, pinzas, tijeras, agujas. MATERIAL BIOLÓGICO: Ovarios de diferentes especies de hembras domésticas. REACTIVOS: Solución salina fisiológica, colorante rosa de bengala. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositar el material biológico en las charolas 3. Para proceder a la identificación de las estructuras ováricas, se requiere la utilización de guantes de cirujano y el instrumental adecuado. 4. Con ayuda de hilo y etiquetas identificar la estructura que se está señalando. (Figura 15) 5. En una caja de petri con solución salina fisiológica, se verterá unas gotas de colorante rosa de bengala. Puncionar los folículos, con jeringa y aguja, y depositar el contenido en la caja de petri; con ayuda del microscopio estereoscopico identificar los ovocitos. (ver figura 17) 42 Figura. 17. Técnica de recolección de ovocitos. 6. El material biológico así como los guantes de látex resultantes de esta práctica, se depositarán en bolsas de plástico de color amarillo, para su destino final, la cremación. Es importante destacar que este material será llevado por los alumnos que se designen en el momento de la práctica por el profesor. 7. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 8. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 9. La limpieza y desinfección del área de trabajo es de suma importancia para mantener limpio el laboratorio. 10. Como punto final el profesor realizará la evaluación de la práctica. 43 EVALUACIÓN PRÁCTICA IV. 1. Esquematiza de forma detallada las estructuras que conforman el folículo de Graaf. 2. Define Gametogénesis. 3. Define Ovogénesis. 4. Define Foliculogénesis. 44 Diagrama Ecológico Práctica IV. Identificación de las estructuras ováricas en las diferentes especies domesticas e identificación de ovocitos. Depositar el material biológico en charolas Descripción de las estructuras Depositar en una caja de petri solución salina fisiológica con unas gotas de colorante rosa de bengala Punción de folículos de la corteza ovárica, vaciar el contenido folicular en la caja de Petri. Fin de la práctica El sobrante de las cajas de Petri se desecha en la tarja. Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas el material biológico Incineración 45 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA IV IDENTIFICACIÓN DE LAS ESTRUCTURAS OVÁRICAS EN LAS DIFERENTES ESPECIES DOMÉSTICAS E IDENTIFICACIÓN DE OVOCITOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 46 PRÁCTICA V. Endocrinología de la reproducción. Principales productos hormonales y su aplicación en las diversas especies domésticas. Duración: 4 horas. OBJETIVOS. El alumno aplicará su conocimiento sobre las hormonas y su uso en tratamientos para resolver entidades fisiológicas y patológicas del aparato reproductor de diferentes especies domésticas. Que el alumno pueda seleccionar el producto hormonal de mayor conveniencia para su práctica profesional, basándose en el conocimiento de los productos. GENERALIDADES. La endocrinología de la reproducción se refiere a la bioquímica, funcionamiento, farmacología y biología molecular de las hormonas y sus receptores. Las hormonas sintetizadas y secretadas por glándulas endocrinas son transportadas en el aparato circulatorio para estimular, inhibir o interactuar con la actividad funcional o el órgano blanco específico y producir una amplia variedad de respuestas (Hafez, 2000; Esperón, 2004). Para comprender los mecanismos que gobiernan las funciones de la reproducción, es necesario considerar la relación que existe entre la glándula pituitaria, el hipotálamo y los centros superiores del encéfalo. Las hormonas de la glándula pituitaria regulan las funciones de la reproducción y mediante el hipotálamo se consigue la integración global de la actividad de la pituitaria con el comportamiento y rendimiento del animal (Hunter, 1987). El hipotálamo forma la base del cerebro en la región del diencéfalo, una subdivisión del proencéfalo, esta limitado frontalmente por el quiasma óptico, caudalmente por los cuerpos mamilares y dorsalmente por el tálamo, la otra región que forma el diencéfalo; esta parte del cerebro esta rodeada por liquido cerebroespinal del tercer ventrículo. La 47 hipófisis o glándula pituitaria está localizada debajo del hipotálamo en un hueco en forma de nicho del hueso esfenoides conocido como “silla turca”, y se encuentra ligada al hipotálamo. La hipófisis está formada por dos lóbulos distintos, la hipófisis posterior o neurohipófisis y la hipófisis anterior o adenohipófisis. La hipófisis posterior es tejido nervioso que se desarrolla a partir del diencéfalo; recibe hormonas que han sido sintetizadas en las neuronas magnocelulares hipotalámicas, que son transportadas a lo largo de los axones hasta la hipófisis posterior. La hipófisis anterior es tejido glandular, subdividida en tres porciones conocidas como parte distal, parte tuberal y parte intermedia. Esta es la glándula principal que produce una gran cantidad de hormonas tróficas que estimulan la liberación de otras hormonas en varios tejidos diana (Hafez, 2000; Squires, 2006; Soto, 2008). Las dos hormonas liberadas desde la hipófisis posterior son la oxitocina y la vasopresina. La primera produce contracciones del músculo liso, incluyendo las células mioepiteliales para la bajada de la leche y por su parte la vasopresina estimula la reabsorción de agua del túbulo distal del riñón manteniendo la osmolaridad sanguínea. La hipófisis anterior segrega seis hormonas: la Somatotropina, hormona del crecimiento (GH); la hormona adrenocorticotropa (ACTH); la Tirotropina, hormona estimuladora de la tiroides (TSH); la hormona folículo estimulante (FSH); la hormona luteinizante (LH) y la hormona Prolactina (PRL) (Hunter, 1987; Squires, 2006). El encéfalo recibe información del medio ambiente externo e interno del animal mediante una gama completa de corrientes nerviosas sensitivas que llegan al mismo, posteriormente el hipotálamo recibe la información adecuada que le transmite el encéfalo, y la secuencia endocrina de respuestas tiene lugar desde el hipotálamo (Hunter, 1987; Ruckeebusch, 1994; Soto, 2008). 48 MATERIAL DEL ALUMNO: Bata, cajas de productos hormonales de cualquier laboratorio, vademécum veterinario. PROCEDIMIENTO. Los alumnos leerán las indicaciones de cada una de las cajas de medicamentos hormonales y lo complementarán con el vademécum veterinario, para resolver las siguientes entidades patológicas y fisiológicas, en los cuadros que continuación se presentan. La evaluación de esta práctica comprende el correcto llenado de estos cuadros. 49 Tabla 1. Diferentes entidades patológicas reproductivas. ENTIDADES PRINCIPIO PATOLÓGICAS ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 1. Quiste folicular luteinizado 2. Quiste folicular. 3. Ovarios estáticos. 4. Piómetra. 5. Metritis. 6. Quiste lúteo. 7. Ovulación retardada. 8. Tonificación e involución uterina. 50 Tabla 1. Continuación ENTIDADES PATOLÓGICAS PRINCIPIO ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 9. Endometritis. 10. Retención placentaria 11. Corrección del anestro. 12. Calor silencioso. 13. Mantenimiento de la preñez. 51 Tabla 2. Entidades Fisiológicas reproductivas. ENTIDADES FISIOLOGICAS PRINCIPIO ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 1. Sincronización de parto. 2. Sincronización de calores. 3. Superovulación. 4. Sincronización de la ovulación. 5. Inducción a la ovulación. 6 .Incrementar la fertilidad en las vacas. 52 Tabla 2. Continuación. ENTIDADES FISIOLOGICAS PRINCIPIO ACTIVO PRODUCTO COMERCIAL DOSIS TERAPÉUTICA LABORATORIO OBSERVACIONES 7. Estimulación de la génesis y maduración del gameto 8. Inducción al aborto. 9. Control del celo en perros. 10. Maduración folicular. 11. Inducción de la lactación. 12. Tonificación e involución uterina. 53 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA V ENDOCRINOLOGÍA DE LA REPRODUCCIÓN. PRINCIPALES PRODUCTOS HORMONALES Y SU APLICACIÓN EN LAS DIVERSAS ESPECIES DOMÉSTICAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 54 Práctica VI. Endocrinología. Evaluación de la respuesta ovulatoria en ratas púberes tras la aplicación de Gonadotropina Coriónica equina (eCG). Duración: 4 horas OBJETIVOS. Observar el efecto de la Gonadotropina Coriónica Equina (eCG) en los ovarios de ratas en la etapa de pubertad. Que el alumno conozca el empleo de la eCG en medicina veterinaria, como una herramienta útil para el manejo reproductivo. GENERALIDADES. La yegua produce una gonadotropina llamada gonadotropina coriónica equina (eCG), antes denominada gonadotropina sérica de yegua gestante - PMSG (Swenson, 1999). El trofoblasto equino sintetiza esta hormona desde el día 35 hasta el 120 – 150 de la gestación, la eCG ayuda a mantener el cuerpo lúteo durante las primeras fases de la gestación porque su secreción empieza después de que se haya impedido la regresión del cuerpo luteo. Sin embargo, la eCG juega un importante papel de inmunoregulación durante la implantación que es el día 35 y en la formación de cuerpos luteos accesorios (Hafez, 2000; Engelhardt, 2002). La eCG fue descubierta por el profesor Harold Cole en 1930, cuando la sangre de yeguas preñadas produjo madurez sexual en ratas inmaduras. Es una glucoproteína con subunidades alfa y beta similares a las de LH y FSH pero con mayor contenido de carbohidratos, en especial ácido siálico al que se le atribuye la larga vida media de la eCG. Esta gonadotropina placentaria es secretada por el útero equino; las copas endometriales se forman hacia el día 40 de la preñez y persisten hasta el día 85. Se ha implicado a la eCG en el desarrollo folicular y la formación de folículos secundarios, pero evidencias recientes refutan este argumento. Ahora se sabe que la eCG no tiene 55 propiedades similares a la FSH en la yegua, aunque las tenga en otros animales domésticos, donde se utiliza para provocar una superovulación. Si es que tiene un papel en el desarrollo folicular, esto ocurre únicamente mediante su acción sinérgica con los pulsos naturales de FSH. La eCG sí que tiene efectos similares a la hormona LH actuando como factor luteinizante en la formación de los cuerpos luteos secundarios, y también podría estar implicada en parte en el mantenimiento del cuerpo luteo (Blanchard, 1998; Morel, 2005). No obstante, la gonadotropina del suero de la yegua preñada suele calificarse como una hormona de tipo “FSH”. El periodo de acción de esta hormona es bastante prolongado debido a que no pasa el filtro renal y permanece en la circulación del animal inyectado o en la sangre de la yegua gestante que la ha producido (McDonald, 1989). Esta práctica está encaminada a probar la acción de la eCG en ratas jóvenes, los alumnos tendrán un espacio para habilitarse en el campo experimental. EQUIPO E INSTRUMENTOS: Báscula granataria, microscopio estereoscópico, cajas de Petri. MATERIAL ALUMNO: Bata, estuche de disecciones, guantes de cirujano, jeringas 3cm3 e insulínicas, torundas impregnadas de alcohol, marcador permanente, torundas de algodón. MATERIAL BIOLÓGICO: 6 ratas hembras púberes, por cada 2 equipos de trabajo. REACTIVOS: Solución salina fisiológica, Gonadotropina Coriónica equina (Folligon), colorante Rosa de Bengala, cloroformo, xilacina, pentobarbital. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. 56 PROCEDIMIENTO. El procedimiento se divide en 2 etapas: Etapa 1: 1. Identificar y pesar cada una de las ratas con ayuda de la báscula granataria. 2. Inyectar dos ratas con 0.3 ml de solución salina por vía subcutánea, identificarlas con el número 1 y 2. Este será el grupo testigo. 3. Inyectar cuatro ratas con 0.3 ml de eCG por vía subcutánea (Folligon, 1000 UI/5ml), identificarlas con los números del 3 al 6. Este será el grupo experimental. Etapa 2: 1. Esperar de 48 a 72 horas para que actúe la eCG. 2. Al término de este tiempo se sacrifican las ratas aplicando un tranquilizante y posteriormente una sobredosis de anestésico o bien en un frasco de vidrio se pondrá una torunda impregnada con cloroformo. 3. A la necropsia, se identificarán los cambios a nivel de los ovarios comparándolos con los de los animales del grupo testigo. 4. Extraer el aparato reproductor y depositarlo en cajas de Petri. 5. Con ayuda del microscopio estereoscópico se observará el desarrollo folicular en los ovarios. 6. De ser posible, se hará la punción de los folículos para observar los ovocitos; se depositarán en una caja de Petri que contenga solución salina con colorante rosa de bengala y se observarán al microscopio estereoscópico para su identificación. 7. Recuerde hacer las anotaciones pertinentes para interpretar los resultados que se obtengan. 8. La práctica será evaluada al que presentar un reporte escrito que contenga: Titulo, objetivo, generalidades, material y procedimiento, interpretación de resultados, discusión, conclusión y referencias, este reporte se entregará en la próxima sección de laboratorio, por equipo. 57 Figura 18. Aplicación de Gonadotropina Coriónica Equina (eCG) en ratas púberes. SSF eCG Inyectar eCG Vía Subcutánea Inyectar Solución salina Vía Subcutánea 48 – 72 horas Sacrificar a las hembras A la necropsia revisar los cambios a nivel de aparato reproductor de las ratas 58 Diagrama Ecológico Práctica VI. Endocrinología. Respuesta ovulatoria en ratas púberes posterior a la aplicación de Gonadotropina Corionica Equina (eCG). Aplicación de la hormona Recolección de las jeringas, agujas y frascos vacíos Sacrificio de las ratas Incineración Necropsia, disección del aparato reproductor de la hembra Fin de la práctica Colocar en el recipiente rojo los desechos punzo-cortantes Depositar en bolsas amarillas los cadáveres y los guantes de látex. Incineración 59 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICAVI ENDOCRINOLOGÍA. EVALUACIÓN DE LA RESPUESTA OVULATORIA EN RATAS PÚBERES TRAS LA APLICACIÓN DE GONADOTROPINA CORIÓNICA EQUINA (ECG). Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 60 PRACTICA VII. Citología vaginal en perras. Duración: 4 horas. OBJETIVOS. El alumno aprenderá a realizar un frotis vaginal, utilizar la tinción de Wright y de Shorr, así como la interpretación de una citología vaginal en perra. Conocerá la utilidad de esta técnica para determinar las diferentes etapas del ciclo estral de las perras. GENERALIDADES. El ciclo estral es una secuencia coordinada de cambios ováricos, útero - vaginales y de comportamiento, que se ha desarrollado en los mamíferos para asegurar la producción y la fertilización de los gametos femeninos y el desarrollo intrauterino del feto (Jeffcoate, 2000). La influencia de las hormonas ováricas sobre el epitelio vaginal, ocasiona cambios citológicos característicos que permiten determinar la etapa del ciclo estral en la que se encuentra la hembra, por lo que es un método ampliamente utilizado en medicina veterinaria (De Buen, 2001). La citología vaginal proporciona información sobre la fase del ciclo estral, la presencia de inflamaciones de la vagina o en el útero, si el cérvix está abierto, y de tumor venéreo transmisible. La acción de los estrógenos sobre el epitelio vaginal provoca hiperplasia, hipertrofia, queratinización y exfoliación de las células (Hansel, 1981; Jeffcoate, 2000; Malcom, 1999). Considerando que el metaestro empieza cuando la proporción de la células superficiales en el frotis vaginal es de al menos el 20%, la ovulación tiene lugar unos 6 días antes del primer día del metaestro (Jeffcoate, 2000; Radostits, 2002). 61 En fases de acción estrogénica mínima como el anestro, metaestro y la pubertad, las células presentes en el frotis son las intermedias. Miden de 20 a 40 micras y varían de acuerdo a su grado de maduración. Son redondas o poligonales de contornos bien definidos, citoplasma abundante, éste dependiendo del pH celular, puede ser basófilo (morado) o eosinófilo (rosa). Núcleo redondo u oval, con membrana definida se observan cromócentros y cromatina sexual. Las parabasales son redondas u ovales de tamaño variable miden de 12 a 30µ. El núcleo ocupa casi toda la superficie celular, su citoplasma es escaso generalmente basófilo y ocasionalmente está vacuolado; puede haber la presencia de neutrófilos. Al iniciarse el proestro, las células se hacen mas diferenciadas y los tipos de células epiteliales que aparecen son las superficiales, son las más maduras del epitelio, de forma poligonal y miden de 35 a 45 micras. Tienen un citoplasma transparente y núcleo picnótico. Como la madurez del epitelio rara vez se lleva a cabo en ausencia de estrógenos, el núcleo picnótico es un dato de actividad estrogénica. En el citoplasma se pueden encontrar pequeños gránulos ácidofilos con localización perinuclear o periféricos, éstos contienen lípidos y su presencia es estrógeno-dependiente. También hay eritrocitos y durante los primeros días pueden verse neutrófilos. Hacia la mitad del proestro, los neutrófilos desaparecen, al igual de que las células parabasales y las intermedias. Al final del proestro solo aparecerán células superficiales, aunque todavía se pueden ver glóbulos rojos. La mitad del estro se caracteriza por la presencia de células superficiales, la mayoría de las cuales son anucledas con el fondo del frotis limpio y claro. Durante el estro puede o no haber presencia de eritrocitos. En el diestro hay numerosas células intermedias y parabasales, un fenómeno característico es el elevado número de neutrófilos al inicio de esta fase (Dellman, 1999; Jeffcoate, 2000; De Buen, 2001; Radostits, 2002). Las células basales o germinales son pequeñas, redondas u ovales, de tamaño uniforme 12 a 13 micras, con núcleo central de cromatina granular, a veces se observa un nucleolo evidente y ocasionalmente se puede observar mitosis; el citoplasma es basófilo 62 y escaso. A partir de estas células se lleva a cabo la regeneración del epitelio, suelen observarse en atrofia, vaginitis o cuando existen úlceras en la mucosa. Las células naviculares son alargadas con forma de barco, tienen importancia en la citología de hembras preñadas donde además tienen gran cantidad de glucógeno. Las escamas son células muertas por lo tanto carecen de núcleo, representan la etapa final de la maduración del epitelio vaginal. Otras células no epiteliales como los eosinófilos, leucocitos, macrófagos y espermatozoides se pueden encontrar normalmente en los frotis vaginales. Los cambios citológicos en un frotis vaginal puede utilizarse para: a) Monitorizar o detectar anomalías en las fases del ciclo estral. b) Determinar el periodo para la cubrición. c) Detectar cubriciones indeseadas. d) Determinar la etapa del ciclo estral que es el objetivo principal que se busca en esta práctica (Jeffcoate, 2000). 63 Cuadro 2. Tipos celulares que pueden aparecer en un frotis vaginal (Gadea, 2003). Células básales Son las células mas jóvenes del epitelio vaginal, precursoras de los otros tipos de células, raramente aparecen en el frotis. Son pequeñas, redondas, regulares con núcleo grande y esférico. Células parabasales Muy similares a las básales solo que más grandes, pueden tener vacuolas en su citoplasma, son uniformes en su tamaño y forma. Células intermedias Estas células varían en tamaño, generalmente son del doble, en comparación con las células parabasales, sus bordes van desde redondeados hasta angulares. El núcleo se observa ovalado y de menor tamaño. Son las más viejas del epitelio vaginal, Células Superficiales tienen el núcleo pequeño, ovalado y claramente picnótico. Su citoplasma es abundante y queratinizado, sus contornos son irregulares, plegándose hacia si mismos. 64 Escamas Estas células están muertas, por lo tanto carecen de núcleo, representan la etapa final de la maduración del epitelio vaginal. Células naviculares Son alargadas con forma de bote, tienen importancia en la citología de las hembras preñadas, donde además tienen gran cantidad de glucógeno. 65 EQUIPO E INSTRUMENTOS: Porta objetos, microscopio óptico, lápiz punta de diamante. MATERIAL ALUMNO: Bata, guantes de cirujano, hisopos de algodón largos. MATERIAL BIOLÓGICO: Perras prepúberes, púberes y en edad reproductiva. REACTIVOS: Solución salina fisiológica, Colorante de Wright, solución amortiguadora (Fosfato monopotásico, 6.63 g; fosfato di sódico, 2.56 g; agua c.b.p. 1000 ml), tren de tinción de Harri-Shorr. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Se pide al dueño o encargado de la paciente que la sujete, para colocarle un bozal, enseguida se sube en la mesa del trabajo, si el tamaño o el temperamento de la perra dificultaran la toma de la muestra se realizará, sin subirla. 2. La toma de la muestra se realiza con un hisopo de algodón estéril con una longitud mínima de 15 cm, humedecido previamente con solución salina fisiológica. 3. Los labios vulvares se separan con una mano y con la otra se introduce el hisopo, si la hembra es pequeña se introducirá aproximadamente 2 cm, en el caso de perras de talla mediana se introduce solo hasta la mitad del tamaño total del hisopo. Para evitar la fosa del clítoris se debe abrir un poco los labios bulbares para ver el clítoris esto servirá para como referencia para no colocar en este punto el hisopo. 66 4. Recoger la muestra mediante movimientos de rotación sobre la mucosa vaginal (Figura 19). 5. Tras retirar el hisopo, éste se gira sobre un portaobjetos, ya identificado con ayuda del lápiz punta de diamante, y se seca al aire si se utiliza la tinción de Wright; si la tinción empleada es la de Shorr se fijará el frotis con alcohol. Figura 19. Colocación del hisopo para obtener la muestra de mucosa vaginal.17 17 Adaptado de Sisson,1981 67 Tinción de Wright. 1. Se coloca el colorante sobre el frotis, cubriéndolo totalmente y se dejan pasar 2 minutos. 2. Se añade solución amortiguadora sobre el frotis, sin derramar el colorante previamente colocado, durante 7 minutos, se observará sobre la superficie una coloración metálica 3. Se decanta. 4. Se lava con agua de la llave por 30 segundos. 5. Se seca al aire. 6. Observar al microscopio. 7. Realizar la interpretación, para determinar la etapa del ciclo estral o alguna posible alteración. Tinción de Shorr (Gadea, 2003). 1. Hacer 10 inmersiones en Alcohol de 70º, cada inmersión dura 1 segundo. 2. Hacer 10 inmersiones en Alcohol de 50º 3. Hacer 10 inmersiones en agua destilada 4. Poner en Hematoxilina de Harris, durante 2 minutos 5. Se realizan 2 inmersiones en agua destilada(en dos recipientes diferentes) 6. 1 minuto en Alcohol amoniacal 7. Hacer una inmersión en agua destilada 8. Hacer una inmersión en Alcohol de 70º 9. 1 inmersión en Alcohol de 95º 10. Poner el frotis 2 minutos en colorante de Shorr 11. Hacer una inmersión en Alcohol 95º 12. Hacer una inmersión en Alcohol de 100º 13. Dejar secar y observar al microscopio. 68 EVALUACION DE PRACTICA VII. EVALUACIÓN VISUAL. 1. Identifica la tinción utilizada en la muestra que se te presenta. 2. Identifica el tipo de célula que se te muestra a continuación. 3. Con las imágenes que se te presentan a continuación, determina la etapa del ciclo estral en la que se encuentra la paciente. 4. Que recomendaciones darías al dueño de la paciente en caso de encontrar este tipo de células. 69 Diagrama Ecológico Práctica VII. Citología vaginal en perras. Toma de muestra vaginal con ayuda de un hisopo largo. Utilizar guantes de látex Girar el hisopo sobre un porta objetos y teñir. Fin de la práctica Depositar los frotis teñidos en el recipiente de punzo cortantes Depositar los guantes y los hisopos en una bolsa amarilla. Incineración 70 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA VII CITOLOGÍA VAGINAL EN PERRAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 71 PRACTICA VIII. Diagnóstico de gestación por ultrasonido en ovinos, caprinos caninos y felinos. Duración: 4 horas. OBJETIVO. Capacitar a los alumnos en la técnica de diagnóstico de gestación por ultrasonido en ovejas, cabras y perras, considerando la eficacia, seguridad y costo de este método. GENERALIDADES. La ecografía de tiempo real, se aplica actualmente en la práctica veterinaria para el diagnóstico precoz de la gestación, y para el reconocimiento y manejo de las gestaciones. La mayoría de los dispositivos para ecografía de uso común son lineales, es decir, emiten un rayo paralelo de ultrasonido que reproduce una imagen rectangular (Allen, 1994). La ecografía se basa en la capacidad de los tejidos y de las estructuras llenas de líquido para reflejar o propagar las ondas sonoras. Un transductor o sonda emite un rayo sonoro y la proporción del rayo que es reflejada hacia la sonda se transforma en impulsos eléctricos que se manifiestan sobre una pantalla en forma de una imagen en movimiento. Las estructuras llenas de líquido no reflejan las ondas sonoras y aparecen de color negro mientras que los tejidos densos como los huesos reflejan la mayor parte del rayo sonoro y aparecen blancos. Otros tejidos se observan con distintas tonalidades de gris dependiendo de su capacidad para reflejar los sonidos (Powell, 2000). 72 Figura 20. Ecógrafo de tiempo real. Los ultrasonidos son, sencillamente, sonidos de muy alta frecuencia, de aproximadamente 1. 5 - 7 (MHz), muy alejados de los que puede detectar el oído humano. En los instrumentos empleados para el diagnóstico de la gestación y determinación del número de fetos en el ganado ovino, los ultrasonidos se producen en un instrumento conocido como transductor, que contiene un cristal o cristales piezoelectrónicos, que convierten la energía eléctrica aplicada en energía ultrasónica, o bien, convierten la energía mecánica (vibraciones ultrasónicas) en energía eléctrica (Figura 21); por esto, el transductor puede utilizarse para transmitir ultrasonidos o para recibir el eco de retorno (Fayez, 1994). Figura 21. Tipos de transductores. Transabdominal (izquierda), transrectal (derecha) 73 En ovinos y caprinos, la ecografía, permite la visualización directa de los líquidos fetales, las carúnculas y el feto; además, es posible detectar el número y la viabilidad de los productos. El examen ultrasonografico en la oveja y la cabra puede realizarse de dos maneras: una es aplicando la sonda en la porción ventral del abdomen (ultrasonografía transcutánea), o introduciendo la sonda por vía rectal (ultrasonografía transrectal). En general, el examen transrectal es más seguro que el transcutáneo hasta el día 35 de la gestación, entre los días 35 a 70 ambos métodos son eficientes; el método transcutáneo se prefiere durante la segunda mitad de la gestación. Las sondas (“scanners”) de 5 MHz son las más apropiadas. La seguridad de un diagnóstico positivo de gestación al utilizar la ultrasonografía transrectal puede exceder el 95%, alrededor del día 25 de la gestación. El examen después del día 40 de gestación permite identificar correctamente a casi todos los animales no gestantes. La ultrasonografía transcutánea permite alcanzar una seguridad del 95%, para un diagnóstico positivo de gestación si se realiza entre los días 40 a 50, y después del día 50 está será del 99% (Ortega, 1999; Pérez, 2006). Las pruebas de gestación contribuyen a la eficiencia de los programas de Inseminación Artificial. Estas pruebas identifican a las hembras no gestantes, y permiten al productor decidir entre reinseminar o no a las hembras vacías, utilizarlas en monta directa o desecharlas. El uso de estas pruebas está frecuentemente relacionado con los costos y su facilidad de empleo (Arbiza, 1986; Delgadillo, 2005). El ultrasonido en escala gris y tiempo real es una herramienta diagnóstica invalorable en las perras y gatas. La ultrasonografía en términos generales es tolerada mucho mejor que la radiología, dado que rara vez es necesaria la inmovilización absoluta del animal. Es más segura que las placas radiográficas para el propietario debido a la ausencia de radiación ionizante. En perras, el ultrasonido permite efectuar el diagnóstico desde el día 29 de la gestación, se hace con la finalidad de revisar al mismo tiempo el estado de salud del útero y determinar si la gestación es normal o se está desarrollando una seudogestación o una piometra. El ultrasonido permite conocer si los fetos están vivos, el tamaño de los mismos o las dimensiones e integridad de la pelvis (Páramo, 2006). 74 En las gatas las pruebas hormonales no tienen valor, el diagnóstico se establece en función del examen clínico, radiográfico y más recientemente el ecográfico que permite diagnosticar la gestación a partir del día 21-25. Los movimientos del feto aparecen el día 28, a partir de la sexta semana, se perciben las diferentes partes del feto (Páramo, 2006; Valencia, 2006). EQUIPO E INSTRUMENTOS: Ultrasonido de tiempo real, transductores de 3.5 y 5 Mhz. MATERIAL ALUMNO: Bata, botas, overol, guantes desechables y guantes de látex. MATERIAL BIOLÓGICO: ovejas, cabras, perras y gatas. REACTIVOS: Gel para ultrasonido. MATERIAL DE DESINFECCIÓN: Desinfectante para la mesa de trabajo (hipoclorito al 1%), toallas de papel. 75 PROCEDIMIENTO En ovejas y cabras. 1. Conectar el aparato de ultrasonido en una toma de corriente adecuada para evitar daños, hay que tener la precaución de colocarlo en una base o mesa fija que soporte el peso de éste, colocar el transductor transrectal para diagnóstico de una gestación de poco tiempo o transabdominal para hembras con mas tiempo desde la monta o Inseminación Artificial. 2. Esta práctica se realizará en los módulos de producción de la FES-C. Se utilizarán las mangas de manejo de dichas instalaciones y se atenderán las indicaciones de manejo de los encargados del módulo correspondiente. 3. El primer examen se realiza con el transductor transrectal, lubricando con el gel para ultrasonido. 4. Se deberá identificar en el animal el lugar adecuado para la colocación del transductor de 3.5 MHz para el método transcutáneo. El transductor se coloca en la parte inferior del flanco derecho exactamente por un lado de la ubre, con 30º de inclinación. Observar en el monitor para emitir el diagnóstico. 5. Identificar la unión de caruncula-cotiledón, con ayuda del ultrasonido medir el diámetro de estas estructuras. 6. Identificación de estructuras como son: cabeza, columna, miembros anteriores o posteriores, latido cardiaco. 7. Posibilidad de realizar conteo fetal. 8. Percibir movimientos fetales. 9. Se reportan los resultados del examen identificando a la paciente con su número de registro, y solo se expresa como positivo (+), negativo (-), y en algunos casos en los que se tenga duda se puede registrar como sospechoso, posteriormente se realizará otro examen para dar un diagnostico más acertado. 76 Figura 22. Esquema que muestra la colocación adecuada del transductor (izquierda), Fotografía que muestra la presencia de placentomas en una oveja (derecha De Lucas, 2007).18 En perras y gatas. 1. Se pide al dueño o responsable de la paciente que la coloque sobre la mesa de exploración y que la sujete, si es necesario se le colocará un bozal para evitar que lastime a alguien. 2. Si la zona ventral de la perra está cubierta de pelo se recomienda rasurar para tener un mejor contacto, ya que el pelo dificulta el examen. 3. Se coloca el transductor de 3.5 MHz en la parte abdominal de la paciente, previamente se pondrá el gél en el transductor, que facilita el contacto y se observa en la pantalla del ae|arato la presencia de las vesículas amnióticas e incluso los movimientos fetales. 18 Adaptado de De Lucas, 2007. 77 EVALUACIÓN DE LA PRÁCTICA VIII. 1. Interpreta las siguientes fotografías que se representan a continuación. a) b) c) 2. Que estructura se esta señalando con la flecha. 3. Esquematiza las partes del ecógrafo, mencionando las partes que lo integran. 78 Diagrama ecológico Práctica VIII. Diagnostico de gestación por ultrasonido en ovinos, caprinos y caninos. Corrales Laboratorio Sujetar a la oveja o cabra Sujetar a la perra y ponerla en la mesa de trabajo Realizar el gestación Dx de Fin de la práctica Recoger cualquier desecho generado: guantes, toallas de papel, etc. Limpieza y desinfección de las mesas de trabajo Depósito de basura 79 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA VIII DIAGNÓSTICO DE GESTACIÓN POR ULTRASONIDO EN OVINOS, CAPRINOS, CANINOS Y FELINOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 80 Practica IX. Diagnóstico de gestación, por el método de palpación rectal en vacas. Duración: 2 horas. OBJETIVO. Que el alumno adquiera la capacidad de diagnosticar por medio de la técnica de palpación rectal las vacas gestantes. GENERALIDADES. El método mas popular y sencillo para la detección de la gestación, consiste en un examen interno del aparato reproductor de la hembra por vía rectal, que se conoce como palpación rectal. El diagnóstico precoz es de gran importancia en las especies de interés zootécnico, ya que en éstas, en general, se intenta intensificar al máximo el ciclo reproductivo limitando en la medida de lo posible los periodos de incertidumbre (Camacho, 1995; Phillips, 2003; Gordón, 2006). Palpación significa sentir y, obviamente, este método implica sentir el aparato reproductor de la vaca en busca de signos de la preñez. Los signos iniciales de la gestación pueden ser agrandamiento, desplazamiento, presencia de algún feto o de hallazgos secundarios como líquido, placentomas y modificación de la arteria uterina. La palpación rectal proporciona una exactitud superior al 95% siempre que como mínimo se identifique un signo positivo (Sorensen, 1984; Noakes, 1999). El cuerpo luteo de gestación, por palpación no es posible diferenciarlo de un cuerpo luteo cíclico, sino hasta 3 semanas después de la cubrición o inseminación artificial. Desde los 35-40 días de la gestación, es posible palpar la membrana del alantocorion; en el tipo de placenta cotiledonaria, característica de la vaca, el alantocorion es la única membrana unida al endometrio, por las carúnculas. Ésta se identifica como una banda de tejido deslizante del punto de fijación, inmediatamente antes de la pared del cuerpo uterino (Zemjanis, 1987; Gordón, 2006). 81 A los 45 días de preñez, la vesícula amniótica crece ya al tamaño de un huevo de gallina (4cm). El útero todavía está en posición alta, dentro de la cavidad; el tono del útero aumenta y los placentomas empiezan a formarse. Si se pone la mano por debajo del útero se facilita sentir la estructura. A los 60 días, el útero comienza a colgar sobre el borde pélvico a medida que el producto crece. Su forma es parecida a un plátano aplastado en el cuerno donde se encuentra el feto de unos 6cm, con un cuerno más pequeño y corto del otro lado, el cuello uterino se encuentra muy cerca del borde de la cavidad pélvica. En 90 días, el becerro y los líquidos siguen aumentando midiendo ya unos 15cm de largo, ya es posible palpar la cabeza, en esta fase el útero cuelga aun más hacia la cavidad abdominal y un cuerno es considerablemente mayor en el otro lado. Su forma es parecida a un guante de boxeo. A los 120 días, el feto ha crecido unos 25cm de longitud y su cabeza es del tamaño de una lima, los cotiledones son firmes y son ya palpables de unos 4cm con forma ovalada. Las primeras diferencias a partir de los 150 días y hasta el fin de la gestación se refieren al crecimiento del feto y al cambio de la proporción de los líquidos y el feto (Sorensen, 1984; Herman, 1996). Otra indicación de la gestación temprana, es el aumento considerable del flujo sanguíneo de la arteria media. En condiciones normales se pulsa como una arteria normal, pero cuando la gestación está avanzada, una ligera compresión revela una sensación vibrátil, característica, que se conoce con el término de frémitus (Zemjanis, 1987; Peters, 1991). Los falsos positivos se producen porque el útero es retraído para permitir una palpación detallada, por involución uterina incompleta, presencia de piómetra o mucometra. Asimismo, los falsos negativos se pueden producir porque los datos registrados sobre la cubrición son incorrectos o la vaca ha sido cubierta o inseminada con posterioridad a la fecha registrada (Noakes, 1999). 82 MATERIAL ALUMNO: Overol, botas, guantes de palpación, guantes de látex, lubricante, cuerdas. MATERIAL BIOLÓGICO: Vacas en etapa reproductiva del centro de producción bovina. PROCEDIMIENTO. 1. Inmovilizar a la hembra con ayuda de una manga de manejo o con cuerdas, colocar un bozal y fijarla en un lugar firme, puede ser un poste o tubo. 2. Colocarse el guante de palpación y de látex si así lo prefiere, se puede usar cualquier mano. Recuerde voltear el guante para evitar que las uniones laterales dañen la mucosa rectal. 3. Lubricar el guante de palpación, recuerde poner un poco de lubricante en la parte dorsal de la mano, en la palma no es de utilidad. 4. Se toma la cola con la mano libre y se levanta, los dedos de la otra mano se unen estrechamente adoptando una forma puntiaguda, de esta forma la mano se inserta en el ano y recto con un empujón suave y firme, el movimiento debe ser continuo hasta que llegue al codo, entonces se debe hacer un medio puño para seguir penetrando esto evitara una perforación intestinal, como se muestra en la figura 23. Figura 23. Introducción de la mano en el recto de la vaca. 5. Si hay demasiado contenido fecal, trate de sacarlo con la mano en forma de paleta para facilitar el proceso. 6. Identificar las estructuras del aparto reproductor, buscando signos de preñez: en ovarios se busca la presencia de cuerpo luteo, en cuernos, se realiza la 83 palpación de para identificar las membranas deslizantes en etapa temprana, mas avanzada la gestación se palparan las carúnculas o incluso el producto. 7. Inmediatamente después de realizado el diagnostico, se libera la hembra, colocándola en su corral. 8. Cuide que en la zona donde se realizó el manejo, no queden los guantes desechados o alguna basura. Estos desechos se colocaran en bolsas de color amarillo y se llevaran al incinerador para su eliminación. 9. Como punto final los alumnos por equipo, entregaran un reporte de las actividades realizadas, elaborando un formato, donde registren los datos del animal, de la explotación, examen clínico, etc. 84 Diagrama Ecológico Práctica IX. Diagnóstico de gestación, por el método de palpación rectal en en vacas. Sujeción de las hembras Palpación del aparato reproductor de la hembra utilizando guante de palpación con o sin guante de látex Fin de la práctica Recolectar y depositar los guantes en una bolsa amarilla. Incineración 85 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA IX DIAGNÓSTICO DE GESTACIÓN, POR EL MÉTODO DE PALPACIÓN RECTAL EN VACAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 86 Práctica X. Diagnóstico de gestación por ultrasonido en vacas. Duración: 4 horas. OBJETIVO El alumno aprenderá a realizar diagnóstico de gestación en vacas, con ayuda del ecógrafo. Conocerá las ventajas de la utilización del ecógrafo en su desempeño profesional. GENERALIDADES. La ultrasonografía o ecografía de ultrasonido en tiempo real es una valiosa tecnología ampliamente utilizada durante los últimos 25 años para estudiar y evaluar las estructuras anatómicas y el estado funcional del aparato reproductivo de los bovinos y de otras especies de interés zootécnico. Tiene la propiedad de permitir observar los órganos genitales en forma rápida, sin ocasionar daño alguno. Entre sus ventajas se encuentra la posibilidad de realizar una evaluación más exacta y objetiva del útero y ovarios que mediante la palpación rectal (Perea, 2000). La ecografía o ultrasonografía es una técnica en la que se emplea ondas de sonido de alta frecuencia para producir imágenes de los tejidos blandos y órganos internos, las cuales podemos visualizar a través de la pantalla del ecógrafo. La aplicación del ultrasonido en las especies bovina y equina corresponde a los años 80, sin embargo su desarrollo y perfeccionamiento para el estudio de los eventos reproductivos se ha acelerado en la presente década. La ecografía es una técnica de diagnóstico por imagen sobre la base de la emisión de ultrasonidos y la recepción de ecos. Estos ecos se producen por la reflexión de los ultrasonidos a nivel de los distintos tejidos. Cuanto mayor sea la reflexión, mayor intensidad tendrán los ecos, pero menor cantidad de ultrasonidos serán capaces de seguir avanzando y mandar información. En el formato de imagen llamado modo B, estos ecos van e ser presentados como puntos de brillo, que serán tanto más brillantes cuanto mayor sea la reflexión, y serán en una posición 87 proporcional al tiempo que han tardados en ser recibidos. La imagen ecográfica se corresponde con el conjunto de puntos de brillo, que representa un corte anatómico de la región examinada. Los órganos o tejidos serán hiper, hipo o anaecogénicos, según la cantidad de ultrasonidos que reflejen. Sin embargo, en la imagen aparecen puntos de brillo que no se corresponden con ecos producidos a nivel de estructuras reales del paciente, son los denominados artefactos, y es importante conocerlos y aprender a diferenciarlos de los ecos reales, para poder interpretar correctamente las imágenes (Sorencen, 1984; Herman, 1996; Tamayo, 2000). Es un excelente método que puede ser utilizado a partir del día 26 de gestación, en casos que el objetivo principal es el diagnóstico temprano, pero es más exacto entre los días 30 y 75. La reproducción bovina cuenta con esta prueba diagnóstica directa que provee información precisa de las estructuras del tracto reproductivo, lo que permite mejorar o confirmar el diagnóstico y aún monitorear un tratamiento. Mediante el ultrasonido pueden detectarse problemas reproductivos, ya que puede diferenciar pus y líquidos y hacer un diagnóstico definitivo (Fricke, 2000). En la práctica es importante determinar la presencia de un cuerpo lúteo funcional y la evaluación del embrión junto con la visualización de los latidos cardíacos. La frecuencia del corazón disminuye de 188 latidos/ minuto el día 20 de la preñez a 145 aproximadamente el día 26 y luego se mantiene prácticamente constante hasta los 2 meses. Es posible observar gestaciones de menos de 18 días con un transductor de 7. 5 MHz y de 18 a 20 o más con 5. 0 MHz; sin embargo, no es recomendable realizar diagnóstico de certeza antes de los 27 días. En estos casos la imagen no es ecogénica y corresponde al líquido amniótico y alantoideo. Alrededor de los días 25 - 27 se puede distinguir el embrión como un punto blanco (ecogénico) dentro de una zona negra (anecogénica). El líquido alantoideo se incrementa rápidamente después del día 28 y se extiende por todo el cuerno gestante. Por su parte, la membrana amniótica se distingue nítidamente en las imágenes ecográficas posteriores a los 30 días de preñez (Rodríguez, 2005; Gordón, 2006). El funcionamiento del ecógrafo se basa en la emisión y recepción de ondas sonoras de alta frecuencia (no audibles para el oído humano) desde un transductor de ultrasonido o sonda, que se introduce en el recto a través de cuyas paredes se examinan los órganos 88 reproductivos de la vaca (Figura 24). Los impulsos de ultrasonido son emitidos y dirigidos hacia el órgano evaluado gracias a los movimientos y variación del ángulo del transductor dirigidos por el operador. Estos impulsos viajan a través de los tejidos a una velocidad constante hasta encontrar un órgano en cuya superficie “rebotan” y regresan en forma de eco al transductor. Como resultado de este mecanismo se forma una imagen dinámica en la pantalla del monitor del equipo que muestra una delgada y profunda área, como si fuera una rebanada, de la estructura o tejido que se está evaluando. Esta imagen se observa en la pantalla de acuerdo a la densidad o dureza del tejido examinado, en una variedad de tonos que van desde el negro (color como se observan los líquidos) al blanco (los huesos y tejidos muy densos), incluyendo una amplísima gradación de tonos grises (cuerpo lúteo, estroma ovárico, etc.). Las frecuencias mas comúnmente usadas en la evaluación de los órganos reproductivos de grandes animales como la vaca son 3. 5, 5. 0 y 7. 5 MHz. Las estructuras relativamente pequeñas, como los folículos ováricos localizados más próximos del transductor se pueden estudiar con una frecuencia entre 5. 0 y 7. 5 MHz. Por el contrario, grandes estructuras localizadas cerca del transductor tales como fetos y úteros de mediana y avanzada gestación, se observan mejor con frecuencias de 3. 5 MHz. (Perea, 2000; Gordón, 2006). 89 Cuello uterino Recto Vagina Transductor de ultrasonido Ondas de ultrasonido Ecos de ultrasonido Cuernos uterinos Ovario Figura 24. Emisión y recepción de ondas de ultrasonido desde un transductor hacia los órganos reproductivos de la vaca (De Lucas, 2007).19 En el diagnóstico y valoración ecográfica del sistema reproductor de la vaca es imprescindible lograr imágenes de alta calidad, disminuyendo la proporción de artefactos, por lo que la preparación de la hembra a examinar y de las condiciones de trabajo y protección contribuyen notablemente a obtener una mayor precisión en la interpretación de dichas imágenes (Noakes, 1999; Tamayo, 2000). 19 Adaptada de De Lucas, 2007. Memorias de curso de ecografía. FESC. 90 MATERIAL DE LABORATORIO: Ultrasonido, transductor transrectal para bovinos. MATERIAL ALUMNO: Overol, botas, guantes de palpación, guantes de látex, lubricante, cuerdas. MATERIAL BIOLÓGICO: Vacas en etapa reproductiva del centro de producción bovina. DESINFECTANTE: Yodo. PROCEDIMIENTO. 1. En la práctica de rutina, la ecografía se realiza parecido a la exploración del sistema reproductor por vía rectal. 2. Generalmente no es necesario vaciar el recto de su contenido de heces. 3. Previo a la introducción de la sonda se debe efectuar una breve exploración rectal, con el propósito de conocer la ubicación del útero y de los ovarios, pues no es recomendable palpar y hacer la ecografía simultáneamente, ya que el ecografista debe concentrar su atención en la observación y valoración de las imágenes registradas en la pantalla del ecógrafo. 4. Se precisa un buen contacto del transductor con la mucosa rectal para obtener imágenes de mejor calidad. 5. La sonda se introduce por vía transrectal sujeta entre los dedos pulgar, índice y la palma. 6. Se sitúa sobre la localización del útero y ovarios, desplazándola suavemente; con movimientos controlados del transductor se logra una buena recepción de imágenes. 7. Un diagnostico positivo se determina con la presencia de estructuras tales como: vesícula amniótica, localización de placentomas o el feto. 8. Se retira el transductor del recto de manera cuidadosa. 9. Antes de ser usado en otra hembra se debe limpiar con toallas desechables y desinfectar con agua y yodo al 5%. 91 Diagrama Ecológico Práctica X. Diagnostico de gestación, por ultrasonido en vacas. Sujeción de las hembras Palpación del aparato reproductor de la hembra utilizando guante de palpación con o sin guante de látex, con ayuda de un transductor transrectal. Fin de la Práctica Recolectar y depositar los guantes y cualquier otro desecho en una bolsa amarilla Incineración 92 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA X DIAGNÓSTICO DE GESTACIÓN POR ULTRASONIDO EN VACAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 93 PRACTICA XI. Identificación de los diferentes tipos de placentas en las especies domésticas. Duración: 4 horas. OBJETIVO. Que el alumno adquiera la capacidad y habilidad para identificar las características anatómicas, histológicas y obstétricas de los tipos de placentas en las diferentes especies domésticas. GENERALIDADES. La clasificación de los mamíferos se basa en la naturaleza de las relaciones materno fetales: los mamíferos prototerianos o monotremas, incluyen al ornitorrinco y equidna, quienes son ovíparos; los mamíferos metaterianos o marsupiales incluyen animales como el canguro y la zarigüeya, estos animales forman un saco placentario vitelino transitorio, sin embargo, no hay contacto íntimo entre las membranas fetales y la mucosa uterina ya que no se trata de una placenta verdadera; el resto de los mamíferos incluye a la subclase euteriana, éstos son los verdaderos mamíferos placentados. Las membranas fetales (corion, amnios, saco vitelino y alantoides) y el endometrio, contribuyen a la formación de la placenta, esto se lleva a cabo de modo particular o en combinaciones específicas (Banks, 1988). El aparato reproductor de las hembras mamíferas está constituido de tal modo que se facilite la fertilización. El aparato permite el desarrollo del huevo fertilizado dentro del útero; ahí, se desarrollan relaciones complejas entre los tejidos fetales y maternales. La placenta es una edificación que tiene por misión realizar un estrecho contacto, de naturaleza vascular, entre una parte específica de las membranas fetales y la superficie endometrial en razón de permitir cambios nutritivos entre la madre y el feto. Además de su función metabólica, la placenta constituye en cierta medida, y en función de su estructura, un órgano de protección más o menos eficaz, según las especies, y está provisto de una función secretora de naturaleza endocrina. En los animales domésticos 94 se emplea indistintamente los términos placenta y membranas fetales aunque en forma estricta éstas forman parte de la placenta fetal (Banks, 1988; Fradson, 1992; Osnaya, 2008). La placenta de acuerdo con la posición que el embrión ocupa con respecto a las paredes del útero, puede ser: 1) central, en ésta el feto ocupará durante toda la gestación la cavidad natural de la luz uterina, el sitio o sitios de adhesión pueden ser difusos, cotiledonarios o zonarios; 2) excéntrica, en ésta el feto erosiona e invade la mucosa uterina en un sitio especial, pero mantiene contacto con la luz uterina y sus fluidos a través del saco vitelino; 3) intersticial, se caracteriza por la invasión completa del blastocisto en la mucosa uterina perdiendo contacto con el lumen, la expansión de las membranas fetales provoca que el lumen se oblitere durante la gestación (Ferrugem, 2006). La clasificación anatómica de las placentas se basa en la forma del área o la distribución de las vellosidades coriónicas en la superficie endometrial o las membranas fetales, se conocen cuatro placentas principales: 1) difusa, en donde la mayor parte de la superficie coriónica se cubre con pequeñas vellosidades o pliegues que corresponden a depresiones o surcos del endometrio como es en el caso de yeguas y cerdas; 2) cotiledonaria o múltiple, ésta tiene vellosidades coriónicas restringidas a cierto número de áreas ovales o circulares bien definidas, llamadas cotiledones, que se sobreponen en áreas uterinas especializadas similares, conocidas como carúnculas. Los placentomas son unidades placentarias formadas por la unión de cotiledones fetales y carúnculas uterinas, características que se presentan las vacas, ovejas y cabras; 3) zonal, tiene vellosidades agregadas a una banda, que rodea por completo (en perras y gatas) o de manera incompleta (en hurón) la mitad del saco coriónico; 4) discoidal, se presenta en roedores y primates, la placenta forma un disco oval en el corióalantoides por medio del que se une con el endometrio, la conexión tiene lugar en una zona o zonas de forma oval (De Alba, 1985; Banks, 1988; Ruckebusch, 2000; Ferrugem, 2006). 95 Figura 25. Clasificación anatómica de las diferentes placentas. Placenta Difusa. Placenta Zonal Placenta Cotiledonaria. Placenta Discoide. Groosser en 1927, considerando las condiciones histológicas, por las que se realiza el contacto entre la placenta fetal y la placenta materna por las vellosidades implantadas sobre el alantocórion, diferenció los siguientes tipos: 1) La placenta epiteliocorial es muy rudimentaria y el intercambio de sustancias se realiza con dificultad, los anticuerpos de la madre no puede pasar al feto, el cual adquirirá la inmunidad pasiva después del nacimiento al tomar el calostro de la madre. En este tipo de placenta únicamente existe una aposición entre las estructuras maternas intactas y las estructuras fetales. El corion se adhiere contra el epitelio de la mucosa uterina. Entre la sangre materna y la fetal existen seis estratos tisulares, de los que tres pertenecen a la madre: endotelio vascular, tejido conjuntivo, epitelio del útero materno; los otros tres pertenecen a la placenta fetal: epitelio del corion (trofoblasto), tejido 96 conjuntivo, endotelio de los vasos fetales. Esta placenta es característica de la cerda y la yegua (Hunter, 1987; Banks, 1988; Vatti, 1992; Buxadé, 1995; Climent, 2005). 2) La placenta sincitiocorial (antes llamada sindesmocorial) se caracteriza porque el trofoblasto provoca localmente la erosión del epitelio uterino, poniéndose en contacto con el tejido conjuntivo de la mucosa uterina. Los intercambios se realizan aquí entre las mismas capas, a excepción del epitelio uterino. Este tipo de placenta se observa en la oveja, la cabra y la cierva, así como en algunas partes de la vaca (De Alba, 1985; Geoffrey, 1990; Bowen, 2000; Igwbuike, 2006; Osnaya, 2008). Durante el periodo de formación de las membranas la placenta crece rápidamente y desarrolla muchos cotiledones. La placenta de ovejas o vacas puede formar hasta 150 cotiledones y son únicos para los animales en los que la unión de la placenta se limita a las carúnculas. La placenta bovina esta constituida por muchas y pequeñas unidades funcionales llamadas placentomas, cada una constituida por un cotiledón fetal y una carúncula materna (Hill, 2001). 3) La placenta endoteliocorial, se presenta en los carnívoros, la erosión local provocada por el epitelio del corion (trofoblasto) afecta al epitelio y al tejido conjuntivo uterino, de manera que el contacto se establece entre el trofoblasto y el endotelio vascular materno. Aquí el intercambio se realiza con mayor facilidad registrándose ya el paso de algunos anticuerpos a través de la barrera placentaria, que en este caso consta de 4 capas (Hunter, 1987; Banks, 1988; Vatti, 1992; Buxadé, 1995; Climent, 2005). 4) La placenta hemocorial, es característica de los primates y roedores e incluso en este tipo de placenta se incluye al conejo. La erosión llega a destruir incluso el endotelio vascular, poniéndose el corion en contacto directo con la sangre materna, extravasada de los capilares para formar amplias lagunas sanguíneas, limitadas por el propio trofoblasto, en las que se bañan las vellosidades coriales (Hunter,1987; Banks,1988; Vatti, 1992; Buxadé, 1995; Climent, 2005). 97 Se tiene la clasificación de un tipo más de placentación, la placenta hemoendotelial, Grosser menciona que en alguna zona circunscrita de la placenta de los roedores, hay una unión aún más intima, por desaparición del epitelio y el mesenquima del corion, entrando casi en contacto el endotelio vascular embrionario con la sangre materna, hay que considerar que siempre existe una capa de células trofoblásticas entre el endotelio del feto y la sangre materna (Climent, 2005). De acuerdo a las modificaciones del endometrio, las placentas se clasifican en: semiplacenta o adeciduas, cuando el endometrio se mantiene casi intacto en la unión feto útero materno y en el parto no genera perdidas tisulares importantes ni grandes hemorragias, (yegua, cerda, vaca, oveja y cabra) y placenta completa o decidua, cuando existe una amplia penetración de las vellosidades del corion con la consecuente destrucción del endometrio ( carnivoros, primates y roedores) (Osnaya, 2008). 98 A. Placenta Epitelio-corial. C. Placenta Endotelio-corial. B. Placenta Sincitio-corial. D. Placenta Hemo-corial. Figura 26. Clasificación histológica de los diferentes tipos de placenta. 1. Endotelio de los vasos fetales. 2. Tejido conjuntivo del corion. 3. Epitelio del corion 4. Epitelio del útero. 5. Tejido conjuntivo del útero. 6. Endotelio de los vasos del útero. 7. Sangre materna. 8. Células trofoblasticas. 99 EQUIPO E INSTRUMENTOS: Charolas. MATERIAL ALUMNO: Bata, estuche de disección, guantes de cirujano, hilo de algodón, etiquetas, bisturí, pinzas, tijeras, aguja curva para sutura. MATERIAL BIOLÓGICO: Aparato reproductor de diferentes especies de hembras domésticas con gestación temprana. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. PROCEDIMIENTO. 1. Solicitar el material de laboratorio llenando el vale de préstamo. 2. Depositar el material biológico en las charolas. 3. Para proceder a la disección del material biológico, se requiere la utilización de guantes de cirujano y el instrumental adecuado. Identificar el mayor número de estructuras del aparato reproductor con gestación temprana. 4. Con ayuda de hilo y etiquetas anotar el nombre de la estructura que se está señalando. 5. Cada equipo explicará, las estructuras que identifique en el material biológico, al profesor y a todo el grupo. 6. El material biológico así como los guantes de látex resultante de esta práctica se, depositarán en bolsas de plástico color amarillo, para su destino final, la cremación. Es importante destacar que éste será llevado por los alumnos que se designen en el momento de la práctica por el profesor. 7. El material utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuagará con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 8. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 100 9. La limpieza y desinfección del área de trabajo es de suma importancia para mantener limpio el laboratorio. Las mesas se desinfectarán y secarán con toallas de papel. 10. Como último punto se realizará la evaluación de la práctica mediante el llenado del siguiente cuadro. 101 EVALUACIÓN PRÁCTICA XI Completa el cuadro que a continuación se presenta, señalando con una “x” los tejidos. Clasificación Tipo Especies Número de capas Epitelio del útero ÚTERO Tejido conjuntivo FETO Endotelio Corion Tejido conjuntivo Endotelio Epitelio- Corial Sincitio – Corial Endotelio- Corial Hemo- Corial 102 Diagrama Ecológico Práctica XI. Identificación de los diferentes tipos de placentas en las especies domésticas Depositar el material biológico en charolas Disección del material Biológico Descripción de los diferentes tipos de placentas Fin de la Práctica Limpiar y desinfectar las charolas y mesas de trabajo Colocar en el recipiente rojo los desechos punzo cortantes Depositar en bolsas amarillas material biológico el Incinerar 103 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XI IDENTIFICACIÓN DE LOS DIFERENTES TIPOS DE PLACENTAS EN LAS ESPECIES DOMÉSTICAS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 104 Práctica XII. Estudio de pelvimetría estática fetal, maniobras obstétricas. OBJETIVO. Capacitar a los alumnos en la atención y resolución de partos distócicos en las hembras domésticas, con el fin de continuar con la vida productiva de una hembra y la viabilidad de su o sus productos. GENERALIDADES. La Obstetricia es la rama de la medicina que trata del embarazo, el parto y el puerperio, que tiene como objetivo el nacimiento de un producto vivo con prevención de daño a la madre. La Obstetricia animal nació de la necesidad del hombre de servirse de los animales como productores de alimentos (carne y leche) y como animales de trabajo. Las pérdidas que los trastornos del parto provocaban llevaron a los pueblos pastores a intervenir para disminuir estas pérdidas y aliviar el sufrimiento de los animales. Por ejemplo, ya en Antiguo Egipto, 300 años a C, se encuentran referencias de intervenciones obstétricas mediante tracción. Ningún otro proceso vital tiene tantas posibilidades de crisis como el nacimiento, pues significa para la madre y el feto un gran esfuerzo (Ebert, 1990). La fertilidad se refiere a que la hembra debe tener una gestación, un parto y puerperio normal y dar una cría viva, además debe ser capaz de protegerla y alimentarla hasta que ésta pueda valerse por sí misma. Esta definición recalca la importancia que tiene la gestación, el parto y el puerperio, lo que indica lo indispensable que es cuidar de estas etapas si se desea mantener la fertilidad en el rebaño (Weisbach, 1993) El parto o la parición, se define como el nacimiento de un producto seguido de la expulsión de la placenta. En la posición normal de nacimiento, el feto descansa en su abdomen con las patas anteriores dirigidas hacia la abertura uterina (el cérvix) y su cabeza descansando entre sus patas delanteras (figura 27). Solo el 5% de los partos presentan una posición anormal, es decir solo un parto de 20 ( Peters, 1991). El parto abarca los diferentes procesos fisiológicos por los cuales el útero expulsa el o los 105 productos. Para que el parto pueda ocurrir, es necesario que ocurran cambios, tanto en la madre como en el feto (Cavestany, 2006). Figura 27. Presentación del producto antes del parto.20 La atención del parto comienza con conocer la historia clínica de la paciente, como datos importantes podemos señalar la edad y número de partos de la hembra, historia del parto previo , estado de salud en la última etapa de gestación, datos del servicio y fecha esperada del parto, antecedentes del macho utilizado (Barberán,1981). Las fases del parto se dividen en tres (Peters, 1991; Cunningham, 2003; Cavestany, 2006): 1. PREPARACIÓN. Es el tiempo necesario para la presentación del feto en el canal de parto, así como la dilatación del cérvix. La presentación del feto se debe a las contracciones uterinas de ligera intensidad, por otro lado, la dilatación es causa de la presión que ejerce el feto y sus membranas una vez colocados en el canal. 20 Adaptado de Peters, 1995. 106 2. EXPULSIÓN DEL FETO. Las contracciones uterinas continúan; así como las contracciones abdominales, el feto pasa por el canal de parto y por ultimo se da la expulsión. En esta etapa, el producto puede encontrarse aún en la segunda "bolsa de agua" (fluido amniótico). Luego de que la cabeza ha pasado a lo largo del canal del parto, el resto del cuerpo demanda generalmente poco esfuerzo extra para ser expulsado. 3. EXPULSIÓN DE PLACENTA. En esta etapa las contracciones continúan para que la placenta sea expulsada del útero. Se debe de reconocer por medio de la palpación, la forma en que se presenta el feto en el canal obstétrico o la estática fetal; esta estática se identifica como: presentación posición, actitud o postura que son los términos descriptivos del producto (Grunert, 1976; Stephen, 1979; Cavestany, 2006) 1. PRESENTACIÓN. Esta es la dirección del feto con respecto a la pelvis de la madre, con tres variantes, la anterior que presenta, manos y cabeza, la posterior que presenta patas y cadera y la transversal que puede presentar vientre, lomo o un costado. 2. POSICIÓN. Es la orientación longitudinal del feto respecto del sacro de la madre, con tres variantes, ventral el producto está boca arriba, dorsal aquí está boca abajo y lateral donde el feto está de lado. 3. POSTURA. Es la posición de las patas cabeza y cuello, se determina como extendidos o flexionados. La disposición normal comprende, presentación anterior con posición dorsal y postura de miembros extendidos. 107 Figura 28. Disposición normal del feto al momento del parto.21 Distocia significa etimológicamente “parto difícil”; y en el lenguaje obstétrico se usa para designar que no puede realizarse con las fuerzas de la madre solamente, por este motivo es sinónimo de parto artificial o en otras palabras el parto que tiene lugar con intervención manual o instrumental del obstétrico (Vatti, 1981; Sloss, 1987;Noakes, 1997; Estrada, 2006). Las consecuencias de una distocia pueden llevar a la muerte fetal, reducción de la fertilidad, esterilidad, incluso muerte de la hembra. Las causas de distocia pueden ser maternas o fetales (Stephen, 1979; Estrada, 2006). MATERNAS. 1. Defectos del miometrio, hipocalcemia, torsión o ruptura uterina 2. Torsión o ruptura uterina 3. Inercia uterina primaria o secundaria 4. Canal pélvico inadecuado 5. Dilatación insuficiente del cuello 6. Estreches vulvar o vaginal 21 Adaptado de Peters, 1995. 108 FETALES. 1. Inmadurez fetal, presenta baja concentración de corticosteroides. 2. Fetos de gran tamaño 3. Presentación anormal 4. Muerte fetal 5. Deformaciones del producto conocidos también como monstruos Presentaciones anormales del producto causantes de distocia.22 22 Figura 29. Presentación anterior con posición dorsal y postura de miembro anterior flexionado Figura 30. Presentación anterior con posición dorsal y postura de miembros anteriores flexionados Figura 31. Presentación transversal con posición lateral y postura de miembros extendidos. Figura 32. Presentación anterior con posición ventral y postura de miembro derecho flexionado. Imágenes adaptadas de Estrada, S. 2006. 109 Figura 33. Presentación anterior con posición dorsal y postura de flexión de cabeza Figura 35. Presentación posterior con posición dorsal y postura de miembros flexionados (Perro sentado) Figura 34. Presentación anterior con posición dorsal y postura de flexión dorsal de cabeza y cuello (hacia arriba) Figura 36. Presentación transversodorsal. MANIOBRAS OBSTÉTRICAS TRACCIÓN. Es la acción de jalar el feto en forma rítmica, hasta lograr su expulsión, esta tracción se puede lograr con cadenas obstétricas, con lazos obstétricos, de forma manual o utilizando extractores mecánicos (Sloss, 1987; Noakes, 1997). MUTACIÓN. Es la manipulación necesaria para colocar en presentación, posición y actitud normales al feto. Los movimientos incluidos en esta división son (Vatti, 1981): a) Retropulsión: Hay que empujar al feto en la cavidad uterina en dirección al diafragma, a fin de que se tenga espacio para maniobras de rectificación. 110 b) Rotación: Consiste hacer girar al feto sobre su eje longitudinal hasta la posición dorso-sacra o lumbo-sacra y luego efectuar la extracción. c) Versión: Es la rotación del feto de la presentación transversal sobre su eje hasta la presentación anterior o posterior. d) Reposición de las extremidades: Esta maniobra es necesaria siempre que los miembros del feto obstaculicen el parto. CESAREA (Barberán, 1981; Vatti, 1981). Esta operación consiste en seccionar el útero mediante una incisión de la pared abdominal para extraer los fetos, esta intervención quirúrgica, es utilizada como último recurso cuando se presenta una distocia para tratar de salvar a la madre y a la cría. FETOTOMÍA: Es la reducción del tamaño del feto seccionándolo, con el objeto de permitir la extracción, esto en el caso de un producto no viable o muerto, que no puede ser expulsado por la madre y que pone en peligro la vida de ésta (Sloss, 1987; Noakes, 1997). PUERPERIO Es el espacio de tiempo entre la expulsión de la placenta y la involución del aparato reproductor a su estado anatómico y funcional previo a la gestación. Estos cambios son el cierre del cérvix, aumenta el tono uterino, se reduce de tamaño y peso, se da la involución del cuerpo luteo, reiniciándose la actividad ovárica. Uno de los principales problemas del puerperio es la retención placentaria y las infecciones uterinas que siguen casi siempre a un parto distócico y son una de las principales causas del aumento del parámetro reproductivo de días abiertos (Olivera, 2006). MATERIAL: Videos de obstetricia. PROCEDIMIENTO. 1. Los alumnos acudirán a la sala de audio-visual a observar videos relacionados con la práctica. 2. Al término de la práctica se comentará la información de cada uno de los videos 111 EVALUACIÓN PRÁCTICA XII. 1. Escribe la técnica de fetotomía que se presenta en el video. 2. Escribe una de las técnicas de cesárea que se presentan en el video de obstetricia. 3. Realiza un cuadro sinóptico con todas las causas maternas y fetales de distocia. 112 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XII MANEJO OBSTÉTRICO. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 113 Práctica XIII. Técnica de recolección de semen en bovinos, ovinos, caninos y verracos. Duración 4 horas OBJETIVO. Que el alumno adquiera la habilidad de recolectar semen de las diferentes especies domésticas. Recolección de semen de bovino. GENERALIDADES. En la producción de bovinos de leche y carne, el método de recolección en la vagina artificial es de los más difundidos en la actualidad. El método consiste en permitir que un toro monte a una vaca o un maniquí y que eyacule en la vagina artificial dirigiendo el pene hacia dentro de ella. La vagina artificial consiste en un tubo cilíndrico rígido, con un revestimiento de goma de una delgada pared, que forma una cámara que se llena de agua a 42º C. Un extremo del cilindro va sujeto a un embudo de goma que sostiene el receptáculo recolector (Salisbury, 1978). Para aumentar el volumen del eyaculado y el número de espermatozoides eyaculados, los toros suelen ser estimulados antes de la recogida (Sorensen, 1984; Noakes, 1999). Antes de colectar el semen se deben tener en cuenta dos aspectos muy importantes, la higiene y el estimulo del semental. Con anterioridad de la monta deberá bañarse al semental o por lo menos lavar con agua y secar perfectamente el vientre y la zona del prepucio; el mechón de pelos del orificio prepucial debe estar limpio y los pelos se cortarán a una longitud de aproximadamente 2cm. Para estimular al toro se le permite montar sobre el maniquí desviando el pene, tomando con la palma de la mano la piel del prepucio sin ofrecerle la vagina artificial. La monta falsa aumenta la calidad del semen con relación al volumen, la concentración espermática y la motilidad. En el toro y otros rumiantes, la temperatura de la vagina es el estimulo más importante para la eyaculación (Bayard, 2006). 114 La mayor parte del semen es recogido mediante la inducción a que el semental eyacule en el interior de la vagina artificial, que se construye de tal forma que simula la sensación de la vagina de la vaca (Peters, 1991). Figura 37. Vagina artificial para la recogida del semen de toro. En los ovinos y caprinos, la vagina artificial es una imitación de la vagina de la oveja y de la cabra. El estimulo térmico (temperatura) es necesario para producir la eyaculación. La hembra maniquí se debe sujetar a lo que se llama potro. La hembra no debe tener el pelo o la lana muy largo, ni suciedad en la parte trasera. El operario se coloca en el lado derecho del maniquí, agachado o en cuclillas y coloca la vagina artificial en el flanco de ese mismo lado sujetándolo con la mano derecha, de tal forma de que el extremo abierto quede mirando hacia el macho y abajo, con un ángulo de 45° aproximadamente. La espita de la vagina artificial debe dirigirse hacia abajo para evitar su contacto con el macho. El tubo recolector debe mantenerse firme y caliente sujetándolo parcialmente con la mano. Cuando el semental entre en el recinto puede que muestre un comportamiento cortés hacia la hembra, pero el operario siempre debe estar prevenido a que el semental de inmediato pueda montar al maniquí. Cuando esto ocurra, el pene erecto se dirige al extremo libre de la vagina artificial. Los movimientos vigorosos hacia arriba y hacia delante significan que el macho ha eyaculado. Se debe permitir que el macho retire el pene de la vagina antes de retirar ésta. Inmediatamente después de la 115 recogida la vagina artificial se cambia de posición, quedando el tubo en la parte inferior a la vez que se sujeta con la mano (Sorensen, 1984; Evans, 1990). Figura 38. Vagina artificial para ovinos. La recolección de semen por estimulo eléctrico, se realiza con ayuda de un estimulador accionado con baterías que proporciona una salida de 10 o 15 voltios. Cuando el recto del macho está seco, se recomienda utilizar los 15 voltios. El macho se coloca de cubito lateral, sobre el suelo, el prepucio se debe limpiar perfectamente, la sonda se lubrica con vaselina y se introduce en el recto a una profundidad de 15 a 20cm. Cuidando no lesionar la mucosa. En los caninos, la extracción debe realizarse en un ambiente tranquilo colocando al perro sobre una superficie donde no pueda resbalar (Laurence, 2000). El semen, se recolecta aplicando un masaje manual sobre la porción caudal del bulbo del glande. Para recolectar el semen se introduce la mano enguantada desde la parte posterior entre las patas del perro, mientras que la parte caudal del bulbo del glande se estimula aplicando un masaje manual a través del prepucio. Cuando se logra la erección parcial, la vaina prepucial se desliza hacia atrás liberando el bulbo del glande y el pene se da vuelta, tal como ocurre durante el apareamiento natural (Allen, 1992; Farstad, 2000; LindeForsberg, 2006). 116 En los verracos cuando están habituados a saltar, la extracción del semen se puede realizar en un potro fijo en un sitio específico o una sala de recolección. El ritmo de colección comienza una vez a la semana y posteriormente se realiza con un intervalo de 4 y 7 días. Todo el material que se que entre en contacto con el semen debe estar limpio y esterilizado y a una temperatura de 37º C. El eyaculado se recogerá directamente en un vaso de precipitado o en recipientes desechables (vaso o bolsa de plástico) situados dentro de un termo para mantener la temperatura cercana a los 37º C. A la vez, sobre el termo se coloca una gasa, que actúa como filtro para que durante la recolección se impida la mezcla de la fracción espermática del eyaculado con el gel y la tapioca. Cuando el verraco está sobre el potro y extrovierte el pene, se fija con la mano el tirabuzón, manteniéndose así procurando que el eyaculado caiga sobre el recipiente, durante toda la eyaculación (Martín, 2000). Otra forma de recolectar semen de verraco es también la utilización de un maniquí que lleva montada una vagina artificial con el recipiente colector de semen (König, 1979). Figura 39. Recolección de semen de verraco23 23 Adaptado de: Köing, I. 1979. 117 EQUIPO E INSTRUMENTOS: Vaginas artificiales para bovinos, ovinos y caprinos, tubos colectores graduado, termo, termómetro de altas, potro para verracos, potro para ovinos. MATERIAL ALUMNO: Botas, overol, gasas, ligas. MATERIAL BIOLÓGICO: Sementales de bovino, ovino, caprino, canino y cerdo. PROCEDIMIENTO. Bovino. 1. Colocar al maniquí en el área asignada, sujetándola. 2. Lavar con agua y secar perfectamente el vientre y la zona del prepucio. 3. Se cortará el mechón de pelos del orificio prepucial a una longitud de aproximadamente 2cm. 4. Estimular al toro, permitiéndole que monte al maniquí, desviando el pene tomando con la palma de la mano la piel del prepucio sin ofrecerle la vagina artificial. 5. Previamente preparar la vagina artificial, con agua caliente aproximadamente a 43 a 46°C, colocar en un extremo el tubo colector y protegerlo con la funda. 6. Después de la monta falsa, el manejador recolectará con ayuda de la vagina artificial el eyaculado, desviando el pene a la entrada de la vagina. Ovino y Caprino. 1. Se prepara el potro y el maniquí (una hembra). 2. Se prepara la vagina artificial, vertiendo agua a 43 a 46ºC y se coloca el tubo colector graduado con ayuda de un cono de plástico, se fija bien. 3. Se suelta al semental para que monte, ya preparado del lado derecho se encuentra la persona que manejara la vagina, que tendrá que tener la habilidad de que al momento que el macho monte, desvíe el pene al interior de la vagina, 118 se debe tener en cuenta que esto es muy rápido y un descuido puede hacer perder el eyaculado. 4. El macho es separado y conducido a su corral. 5. La hembra si no se utiliza más, se suelta con cuidado y se conduce a su corral. Canino. 1. La extracción debe realizarse en un ambiente tranquilo colocando al perro sobre una superficie donde no pueda resbalar. 2. Se aplica un masaje manual sobre la porción caudal del bulbo del glande. 3. Para recolectar el semen se introduce la mano enguantada desde la parte posterior entre las patas del perro, mientras que la parte caudal del bulbo del glande se estimula aplicando un masaje manual a través del prepucio. 4. Cuando se logra una erección parcial, la vaina prepucial se desliza hacia atrás liberando el bulbo del glande y el pene se da vuelta, tal como ocurre durante el apareamiento natural. 5. Posterior a esto, se llevara a cabo la eyaculación, que se recolecta un vaso de precipitado o en un tubo colector. Verraco. 1. La extracción del semen debe realizar en un potro fijo en la sala de recolección. 2. Todo el material que vaya a estar en contacto con el semen, debe estar limpio y esterilizado además de a una temperatura de 37º C. 3. El eyaculado se recogerá directamente en un vaso de precipitado u otros recipientes desechables (vaso o bolsa de plástico) situados dentro de un termo para mantener la temperatura cercana a los 37º C. 4. A la vez, sobre el termo se coloca una gasa, que actúa como filtro para que durante la recolección se impida la mezcla de la fracción espermática del eyaculado con el gel y la tapioca. 5. Cuando el verraco esta sobre el potro y extrovierte el pene, se fija con la mano el tirabuzón, procurando que el eyaculado caiga sobre el recipiente. Manteniéndose así durante toda la eyaculación. 119 EVALUACIÓN DE LA PRÁCTICA XIII. Llena el siguiente cuadro con la información que se te pide. Especie Método utilizado para recolectar semen Volumen de eyaculado Concentración espermática. Requisitos para que se lleve a cabo la eyaculación. Bovino Ovino Caprino Verraco Canino Felino 120 Diagrama Ecológico Práctica XIII. Técnica de recolección de semen en bovinos, ovinos, caninos y verracos. Corrales Laboratorio Sujetar al semental (Canino) Sujetar a l semental (Bovino, ovino, verraco) Recolectar la muestra de semen. Fin de la práctica Recoger cualquier desecho generado: guantes, toallas de papel, etc. La muestra de semen se desechara en la tarja adicionándole agua con hipoclorito al 1%. Limpieza y desinfección de las mesas de trabajo Depósito de basura 121 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XIII TÉCNICA DE RECOLECCIÓN DE SEMEN EN BOVINOS, OVINOS, CANINOS Y VERRACOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 122 PRÁCTICA XIV. Técnica de evaluación de semen. Duración 4 horas OBJETIVO. El alumno conocerá las técnicas empleadas en el laboratorio, para determinar si el semen recolectado en diferentes especies domésticas es de óptima calidad para ser utilizado posteriormente en Inseminación Artificial. GENERALIDADES. El macho juega un papel relativamente importante en la reproducción, ya que dependiendo del método utilizado para dar los servicios, la relación macho-hembra puede variar de 1 a 30 hasta 1 a 1000 y cuando se utiliza inseminación artificial (IA). El éxito o fracaso de la participación del macho, en la eficiencia reproductiva, dependerá de su estado de salud, de su libido, de su capacidad de detectar, montar y servir a las hembras en celo, así como de la cantidad y la calidad de los espermatozoides producidos. La producción de espermatozoides depende del volumen testicular y, fundamentalmente de la edad de los machos, la estación del año y la alimentación que reciben (Pérez, 2006). Después de recogido el semen y antes de usarlo se debe determinar, cuidadosamente la cantidad y la calidad del eyaculado. Para manejar el semen se precisa hacerlo con sumo cuidado par que no se afecte la viabilidad de los espermatozoides (Salomón, 1990). La técnica ideal para la evaluación de la calidad del semen debe ser objetiva, repetible fidedigno y económico. La valoración macroscópica y microscópica del eyaculado permite determinar la calidad, viabilidad y fertilidad de los espermatozoides. No se dispone de una técnica única para determinar con exactitud la fertilidad, pero al combinar varios estudios, se pueden seleccionar los eyaculados que tengan un potencial de fecundación mas elevado (Aisen, 2004). 123 Características del eyaculado. La evaluación del eyaculado comprende de un examen macroscópico que esta integrado por el volumen, color, olor y consistencia; y del examen microscópico que evalúa la motilidad masal, motilidad progresiva, vivos y muertos, morfología y concentración espermática. El volumen del eyaculado se mide directamente en el tubo de recogida ya que este es calibrado y nos permite hacerlo inmediatamente después de la recolección. Este va desde 0.3 a 1.5ml con un promedio de 1 ml, esto depende de la raza edad, estado general del macho y destreza del operario (Salomón, 1990; Aisen, 2004). El color del semen de carnero es lechoso o crema pálido. Un color rosa indica la presencia de sangre, probablemente a causa de lesión en pene, un color gris o pardo sugiere contaminación o infección en el aparato reproductivo, un color amarillo y diluido es por la presencia de orina (Aspron, 1985). La consistencia del semen depende de la relación del contenido de sus dos constituyentes, espermatozoides y plasma seminal. Las muestras de alta consistencia contiene más cantidad de células que las que son acuosas (Salomón, 1990). La motilidad del semen se valora mediante una onda característica de movimiento, cuando se mira al microscopio ésta se denomina motilidad masal. Para evaluar la motilidad progresiva, se observa el porcentaje de espermatozoides que avanzan en forma rectilínea en el campo del microscópico. Los espermatozoides que giran sobre si mismos, pueden estar indicando que sufrieron choque térmico o que el medio no es isotónico con el semen (Aspron, 1985). Para el examen morfológico de los espermatozoides y la cantidad de vivos y muertos se utiliza la tinción de Eosina-Nigrosina. La determinación del porcentaje de espermatozoides vivos, de acuerdo a la integridad de la membrana acrosómica de la cabeza puede realizarse por medio de esta tinción que sólo tiñe a los espermatozoides muertos (Pérez, 2006). 124 La morfología espermática no presenta valores elevados de espermatozoides anormales, salvo en condiciones patológicas. Se consideran valores normales por debajo de 20% de anormalidades totales. La conservación del semen a temperaturas reducidas provoca importantes daños especialmente en los acrosomas (Pérez, 2006). La concentración espermática es el número de espermatozoides por unidad de volumen, normalmente expresado en ml. El semen de carnero de buena calidad contiene 3.5-6 mil millones (3.5-6 X109 de espermatozoides / ml). EQUIPO E INSTRUMENTOS: Baño Maria, Termómetro de altas, platina térmica, 2 rejillas, 3 pipetas de 10 ml, 3 pipetas de 1ml, 5 tubos de ensayo, porta objetos, cubre objetos, pipetas Pasteur, chupones propipeta. Microscopio de contraste de fases, parafilm, Microscopio óptico, contador. MATERIAL ALUMNO: bata, guantes de exploración, toallas de papel. MATERIAL BIOLÓGICO: Muestras de semen de carnero. REACTIVOS: Solución salina fisiológica, solución de Hancock, Tinción de EosinaNigrosina. PROCEDIMIENTO. 1. Se prepara previamente el baño maría a una temperatura de 32 a 34º, esto se puede regular con ayuda de un termómetro de altas, se coloca una gradilla en el interior para colocar los tubos de ensayo con 9.9 ml de solución salina fisiológica (para medir utilizar las pipetas de 10 ml), la tinción de eosinanigrosina y las muestras de semen (Tubos colectores). 2. En la platina térmica se colocaran porta objetos, cubre objetos, pipetas Pasteur, pipetas de 1 ml para que se mantengan a una temperatura promedio de entre 32 a 34ºC. 3. Recolectar el semen de machos adultos, como se describe en la práctica de recolección de semen. 4. Medir el volumen del eyaculado directamente en el tubo colector. 125 5. Determinar el color y consistencia del eyaculado. 6. Para evaluar la motilidad masal se deposita una gota de semen fresco, en un porta objetos y se observa en microscopio de contraste de fases con platina térmica en el objetivo de 10x. Se observan movimientos en forma de torbellino o en ondas, esta se califica de la siguiente manera: Cuadro 3. Calificación de motilidad masal. VALOR CLASE DESCRIPCIÓN 3 Muy buena Ondas densas de movimiento, muy rápidas 2 Buena Ondas y remolinos vigorosos pero no tan rápidas 1 Regular Ondas de movimiento lento 0 Muertos Sin movimiento 7. Para la motilidad progresiva se realiza una dilución 1:100 es decir, en un tubo de ensayo con 9.9 ml de solución salina a 32º C se vierte 0.1 ml de semen fresco y se homogeniza. Se coloca una gota de esta dilución en un porta objetos y se le coloca un cubre objetos se observa al microscopio con el objetivo de 10 x. Se expresa en porcentaje, 0 a 100%. Se debe estimar visualmente que porcentaje de células se mueven hacia delante. 8. Para evaluar vivos y muertos, sobre la platina térmica se coloca un portaobjetos en este se pone una gota de la dilución 1:100 y al lado una gota de EosinaNigrosina, se mezclan con ayuda de otro porta objetos, se corre para hacer el frotis, se seca. En el campo se cuentan los blancos y rosas hasta llegar a 100 células, se expresa en porcentaje. 126 Figura 40. Esquema comparativo de vivos y muertos con tinción de Eosina-Nigrosina.24 9. El frotis se utiliza para evaluar la morfología de las células espermáticas, se cuentan todos los espermatozoides del campo, los normales y anormales hasta llegar a 100 y se expresa en porcentaje. 10. Para evaluar la concentración se utiliza la cámara de Neubauer, para llenarla se realiza una dilución de 1: 200 esta se hace mezclando 1 ml de la dilución 1:100 con 1ml de una solución formulada. Se espera 5 minutos para que las células se sedimenten. Se realiza el conteo de la siguiente manera: a) Se localiza el cuadro central que esta dividido en 25 cuadros, que a su vez están divididos en 16 cuadros cada uno. b) Se realiza el conteo de los cuadros de las esquinas y central, se suman las células y se multiplica por 10,000 000. c) Los espermatozoides que tocan las líneas de arriba e izquierda se cuentan, los de abajo y derecha no se contabilizan. 24 Realizado por Alcantar , UNAM. 2007. 127 Figura 41. Cámara de Neubauer. CANAL TRANSVERSAL CANALES LONGITUDINALES 25 CUADROS DIVIDIDOS CADA UNO EN 16. EL RECUENTO SE EFECTÚA EN EL ÁNGULO SUPERIOR IZQUIERDO EN DIRECCIÓN DE LA FLECHA. 128 11. Para determinar el número de dosis por eyaculado se utiliza la siguiente formula: Número de dosis = progresiva Volumen x Concentración x % de Motilidad Concentración espermática por dosis 12. Al finalizar se limpiará todo el material que se utilizó y se limpiara y desinfectaran las mesas, se entregara el material de laboratorio. 13. Al final de la práctica, se entregará la hoja de control de calidad de semen y un reporte que incluya los datos con cada uno de los puntos de la evaluación que se le realizo a la muestra, que además contenga: a) Número de dosis que se obtiene del eyaculado. b) Cuanto se necesita de diluyente si se requiere llenar pajillas de 0.25ml y de 0.5ml. 129 HOJA DE CONTROL DE CALIDAD DE SEMEN Universidad Nacional Autónoma de México. Laboratorio de Reproducción e Inseminación Artificial. Nombre:____________________________ Fecha:________________ Calidad del Semen. Información del eyaculado: Especie:____________________ Nombre/Arete:_______________ Volumen (ml):_______________ Color:______________________ Consistencia:________________ Aspecto:____________________ Motilidad Masal (%):__________ Motilidad Progresiva (%):______ Concentración (x106):_________ Vivos (%):___________ Morfología (%): Normal:_______ Muertos (%):_____________ Anorm. Primarias:________ Anorm. Secundarias:_______ Observaciones: 130 Diagrama Ecológico Práctica XIV. Técnica de evaluación de semen en ovinos. Recolectar ovino. el semen de Realizar la evaluación del material biológico (semen) Fin de la Práctica El sobrante del material biológico se desecha en la tarja adicionando agua con hipoclorito al 1%. Limpiar y desinfectar la mesa de trabajo Recoger cualquier desecho generado: guantes, toallas de papel, etc. Colocar en el recipiente rojo los desechos punzo cortantes (Frotis). Depósito de basura 131 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XIV TÉCNICA DE EVALUACIÓN DE SEMEN EN OVINOS. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio. 132 Práctica XV. Técnicas de conservación de semen. Preparación de diluyentes. Duración: 2 horas OBJETIVO. El alumno conocerá los distintos tipos de diluyentes para la conservación de semen en las diferentes especies domésticas. Realizar un tipo de diluyente para semen de ovino. GENERALIDADES. El semen obtenido y evaluado como apto, requiere un procesamiento adecuado para garantizar la capacidad fecundante de los espermatozoides, durante el tiempo entre la eyaculación y su utilización para la inseminación artificial. El esperma eyaculado no sobrevive durante largos periodos, a menos que se hayan añadido agentes protectores (Aisen, 2004). Los espermatozoides viven fuera del organismo solamente durante un tiempo limitado, la capacidad de síntesis lipídica y proteica de estos es muy reducida dado que no cuentan con aparato de Golgi y solo contiene cantidades muy pequeñas de RNA. Precisamente por esto, cuando el semen colectado se va ha utilizar para inseminar se deberá usar lo mas pronto posible ó proceder a su dilución y conservación (Bayard, 2006). Los diluyentes son sustancias que se agregan al eyaculado para conservar su metabolismo, viabilidad y fertilidad. De un diluyente se espera: Que sea capaz de preservar la capacidad fecundante de los espermatozoides; además de su motilidad. 133 Evitar la acidificación del medio, consecuencia del metabolismo de los espermatozoides. Aportar nutrientes esenciales (de tipo energéticos), sustancias protectoras y amortiguadoras. Aumentar el volumen para poder inseminar un gran número de hembras. Restringir el crecimiento de microorganismos mediante la adición de antibióticos, sulfas, antimicóticos y otras sustancias. Reducir el metabolismo de los espermatozoides al mínimo al descender la temperatura del semen diluido. Capacidad de preparar al espermatozoide para la, congelación. Existen gran cantidad de diluyentes, desde los químicos, constituidos por soluciones salinas isotónicas, hasta aquellos que contienen sustancias orgánicas como yema de huevo, leche o agua de coco. Cuando se usa leche, ésta deberá ser calentada previamente en baño María a 96º C durante 10 minutos. La leche ultra pasteurizada ya no necesita inactivarse por calor, es estéril, barata y se puede mantener por cierto tiempo (Aspron, 1985; Aisen, 2004). Deben emplearse sustancias puras y equipo limpio a fin de excluir materiales tóxicos del ambiente espermático. Los diluyentes deben prepararse en forma aséptica y almacenarse por menos de una semana, a menos que se congelen. Suele agregarse un carbohidrato simple, como glucosa, como fuente de energía para los espermatozoides. Se utilizan tanto yema de huevo como leche para proteger a las células espermáticas contra el choque térmico cuando son enfriadas desde la temperatura corporal hasta 5º C. Dichas sustancias también contiene nutrimentos usados por los espermatozoides. Pueden emplearse diversos amortiguadores para mantener un pH cercano al neutro y una presión osmótica aproximada de 300mOsm, equivalente a los del semen, plasma sanguíneo y leche. Para inhibir la proliferación de microorganismos en el semen, se agregan penicilina, estreptomicina, polimixina B, u otras combinaciones antibióticas (Sorensen, 1984). 134 Los diluyentes para conservar el semen o temperatura ambiental, conservan el semen a una temperatura fija dentro del rango de 15 a 25ºC durante varios días. Los diluyentes para conservar el semen en refrigeración (4ºC) pueden ser leche, el diluyente base de citrato de sodio-yema de huevo, Tris-yema de huevo y preparaciones que conserven el semen hasta por 3 días (Sorensen, 1984). Los diluyentes para congelamiento básicamente son los mismos a los que se les agrega glicerol que es un anticongelante. Si el espermatozoide se congela en ausencia de un anticongelante, las células se lisan y mueren, ya que las formaciones cristalinas del hielo son como agujas que punzan al espermatozoide. El anticongelante produce un cambio en la formación los cristales de hielo, de modo que estos forman capas en vez de agujas. Los espermatozoides son capaces de soportar el proceso y permanecen viables. Una dilución excesiva provoca una disminución de la motilidad y de la capacidad fecundante de los espermatozoides, por tanto, la tasa de dilución debe ser adecuada para asegurar la eficacia del diluyente pero no excesiva. Como norma general, se considera que el nivel óptimo de dilución debe ser entre ½ y 1/3 (Sorensen, 1984). EQUIPO E INSTRUMENTOS: Probetas, jeringas de 3 y 5 ml, vaso de precipitado, filtros, bascula granataria, Parafilm, cucharillas. MATERIAL ALUMNO: Bata, 1 huevo, jeringas 3cm3. REACTIVOS: TRIS Hidroximetil-aminometano, Glucosa, ácido cítrico, yema de huevo, glicerol, agua destilada. ANTIBIÓTICOS: Penicilina, Estreptomicina. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. 135 PROCEDIMIENTO. Utilizando el cuadro de tasa de dilución, seleccionar el que se requiera para la realización de la práctica, hay que tener especial atención en el momento del pesaje. 1. Depositar en una probeta el TRIS, Glucosa y el ácido cítrico. 2. Aforar con agua destilada a ¾ del total a preparar. Homogenizar. 3. Agregar la yema de huevo, mezclando perfectamente. 4. Agregar el glicerol. 5. Agregar Antibióticos. 6. Aforar hasta la marca de 100 ml, homogenizar perfectamente. 7. conservar a 4° C 8. Observar cada 12 hrs. Para observar posibles cambios en el diluyente. (La contaminación produce cambios de color) Cuadro 4. Tasa de dilución para la elaboración de diluyente. Tasa de dilución 1: 2 1:3 1:4 5.814 4.361 3.876 3.634 Glucosa (g) 0.800 0.600 0.533 0.500 Ácido cítrico ( g) 3.184 2.388 2.123 1.990 Yema de huevo (ml) 24 18 16 15 Glicerol (ml) 8 6 5.3 5 Penicilina ( UI ) 100,000 100,000 100,000 100,000 Estreptomicina (MG) 100 100 100 100 Agua destilada (ml) 100 100 100 100 TRIS (g) 1: 1 Hidroximetil-aminometano 136 EVALUACION DE PRÁCTICA XV. 1. Elabora 200ml de diluyente, anotando cada uno de los pasos a seguir, recuerda que se tiene que calcular los constituyentes. Ya realizado el diluyente, se conserva en refrigeración, observando cada 12 horas durante 2 días y reportar si hay cambios de la coloración. Al entregar el ejercicio se evaluara la práctica. La distribución será la siguiente para los equipos: Equipo Tasa de Dilución 1 1:1 2 1:2 3 1:3 4 1:4 5 1:1 6 1:4 137 Diagrama Ecológico Práctica XV. Técnicas de conservación de semen. Preparación de diluyentes. Preparación del Diluyente Fin de la práctica Recoger cualquier desecho generado: papeles, toallas de papel, etc. Depósito de basura Conservar en refrigeración el preparado. Observar cada 12 hrs. posibles cambios en el diluyente, por 2 días. Pasado este tiempo se desecha el diluyente en la tarja. 138 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÒN ARTIFICIAL PRÁCTICA XV TÉCNICAS DE CONSERVACIÓN DE SEMEN. PREPARACIÓN DE DILUYENTES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 139 Práctica XVI. Técnica de congelación de semen. Duración: 4 horas OBJETIVOS El alumno conocerá la técnica de conservación de semen por congelación. El alumno realizará la técnica de congelación con semen de ovino. GENERALIDADES Las ventajas del semen congelado sobre el fresco o el refrigerado se fundamentan en el tiempo de conservación. Mientras que el semen refrigerado solo puede ser conservado por un corto periodo de tiempo, menor de 5 a 7 días, el semen congelado tiene un periodo ilimitado de conservación mientras permanezca sumergido en nitrógeno líquido (Evans y Maxwell, 1987). El procesamiento del semen para su preservación por congelación y conservación en nitrógeno líquido involucra los siguientes pasos (Aisen, 2004): 1) Dilución Con el fin de reducir al mínimo las lesiones asociadas con el choque por frío y con el proceso de congelado-descongelado, los espermatozoides se diluyen en medios especiales, éstos poseen azucares, amortiguadores del pH, lípidos (yema de huevo), crioprotectores (el mas utilizado es el glicerol) y otros aditivos como los antibióticos (Linde-Forsberg, 2006). 2) Enfriado Para lograr una preservación adecuada de los espermatozoides, es necesario el descenso cuidadoso de la temperatura; esto es, ir de 30ºC hasta 5ºC en aproximadamente 2-3 horas. Una vez alcanzada esta temperatura (5ºC) se lleva a cabo el periodo de equilibrio, es decir es la etapa en la que se adiciona la fracción del diluyente que contiene el glicerol y éste penetra al interior del espermatozoide estableciendóse un equilibrio entre 140 las concentraciones intra y extracelulares, este periodo puede variar de 30 a 120 minutos (Aisen, 2004). 3) Envasado Los recipientes mas utilizados para la congelación de semen son las pajillas de PVC (Cloruro de polivinilo) de tipo francés. Estas pajillas están disponibles en dos presentaciones: de 0.25 y 0.5ml, ésta última es la más comúnmente utilizada. Estas pajillas miden 13.5mm de longitud y 3 ó 1.5mm de diámetro interno. La pajilla en uno de sus extremos, contiene un tapón integrado por un par de cilindros fibrosos y una pequeña cantidad de polvo de acetato de polivinilo encerrado entre ellos, esto permite sacar el aire para meter por succión el semen diluido al interior del recipiente. Una vez lleno, la humedad moja el polvo, formando un sello (Sorensen, 1984; Aisen, 2004). Figura 42. Pajilla de envasado. 4) Congelación Después del periodo de equilibrio, las pajillas se exponen a los vapores de nitrógeno a una altura determinada sobre el nivel del nitrógeno líquido, a aproximadamente una temperatura de -80 y -100ºC durante un periodo variable de tiempo, en promedio 10 minutos; después, las pajillas se sumergen en el nitrógeno líquido (Salamon y Maxwell, 2000). 5) Almacenamiento Una vez congeladas, las pajillas se trasladan a un termo con nitrógeno líquido, donde se conservan por largo tiempo. Este termo conserva el semen congelado a una temperatura 141 de -196ºC en nitrógeno líquido; estos equipos se construyen con aleaciones metálicas resistentes (Sorensen, 1984). Figura 43. Termo de nitrógeno liquido.25 EQUIPO E INSTRUMENTOS: Termo para nitrógeno liquido, caja de poliestireno (unicel), pajillas, rejilla, pinzas largas, acetato de polivinil (PVA) en polvo. MATERIAL ALUMNO: Bata, plumones de tinta indeleble de punto fino. REACTIVOS: Diluyente para semen de ovino, semen de ovino, nitrógeno liquido. MATERIAL DE DESINFECCIÓN: Desinfectante (hipoclorito al 1%), toallas de papel. 25 Termos utilizados en el Laboratorio de Reproducción e Inseminacion Artificial de FES Cuautitlán , El de la Izquierda es un termo en uso, el de la derecha es un termo utilizado para mostrar las partes que lo componen a los estudiantes. 142 PROCEDIMIENTO 1. Se realiza la obtención y evaluación macro y microscópica del semen. 2. Se realiza la dilución del semen: en primer lugar se agrega la mitad del volumen final semen+diluyente, la segunda parte se agrega a 5ºC, esta segunda fracción contiene el glicerol necesario para la crioprotección. Para conocer la cantidad de diluyente que se agregará al semen se utilizará la siguiente formula: Volumen (ml del eyaculado) X Concentración (miles de millones de células por ml) X Células móviles (%) Número recomendado de espermatozoides por dosis de IA Ejemplo: 1.3 (volumen) X 3800 (concentración) X 0. 80 (% Motilidad progresiva) 200 = 20 dosis de 200 millones de espermatozoides móviles Si se van a envasar en pajillas de 0.25ml, el volumen requerido semen+diluyente es 5.0ml . Si se tiene 1.3ml de semen, el volumen de diluyente a agregar es 3.7ml (5.0 – 1.2) Entonces, en la primera parte de la dilución se agrega diluyente al semen hasta completar 2.5ml entre ambos. En la segunda parte de la dilución se agrega 2.5ml de diluyente que contiene glicerol (el doble de la concentración final: si la concentración final es de 4%, esta fracción contendrá 8% de glicerol). 3. Se realiza el envasado de las pajillas, succionando con la boca o con una jeringa conectada a un cilindro de látex en el extremo donde se encuentra el tapón, para llenar el interior con el semen diluido. Previamente, se identificará cada pajilla con el plumón de tinta indeleble. Con una jeringa de insulina se saca el líquido excedente de la pajilla de forma que se deje un espacio de aproximadamente 0.5ml para sellar; con la ayuda del PVA se sella el lado opuesto de la pajilla. 143 4. Se procede a la congelación, en la caja de unicel se vierte el nitrógeno líquido, colocando las pajillas sobre una rejilla para que la congelación se efectué sobre los vapores de nitrógeno líquido. Después de unos minutos se sumergen las pajillas en el nitrógeno líquido. 5. Por ultimo, las pajillas se trasladan a un termo con nitrógeno líquido donde se mantendrán hasta su utilización en la Inseminación Artificial. 6. El material de cristalería utilizado en la práctica se lavará con agua y jabón, inmediatamente después se enjuaga con agua destilada y se colocará en la estufa, que se localiza en el laboratorio. 7. El material punzo-cortante se depositará en el contenedor rojo que se localiza en el laboratorio. 8. La limpieza y desinfección del área de trabajo por parte de los alumnos, es de suma importancia para mantener limpio el laboratorio. 9. Como punto final el profesor realizará la evaluación de la práctica. 144 EVALUACIÓN DE LA PRÁCTICA XVI. 1.- ¿Cuál es la concentración espermática necesaria en las pajillas de semen ovino, para que se cubra a la hembra? 2.- Realiza el siguiente ejercicio: Macho Ovino (arete 360) En el examen macroscópico presentó las siguientes características: Volumen del eyaculado 1.1ml Color blanco lechoso Consistencia cremosa, sin presencia de partículas extrañas. En el examen macroscópico presentó los siguientes datos: Motilidad masal con un valor de 2 (escala de 0-3) Motilidad progresiva 75% Vivos (membrana intacta) 85% Normales 73 Concentración espermática de 4356 X106 a) Menciona el número de dosis que se obtiene de este eyaculado b) ¿Cuál es el volumen requerido si se envasan en pajillas de 0.25ml o de 0.5ml? c) ¿Cuál es el volumen de diluyente requerido para cada caso? d) Da tu opinión de este eyaculado 145 Diagrama Ecológico Práctica XVI. Técnica de Congelación de Semen. Recolección de semen Evaluación de semen Dilución Enfriado y envasado Congelación Fin de la práctica Limpiar y desinfectar la mesa de trabajo El sobrante del material biológico (semen, yema de huevo, diluyente) se desecha en la tarja adicionando agua con hipoclorito al 1%. Recoger cualquier desecho generado: pajillas, guantes, toallas de papel, etc. Colocar en el recipiente rojo los desechos punzo cortantes (Frotis) Depósito de basura Incineración 146 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVI TÉCNICA DE CONGELACION DE SEMEN Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 147 Práctica XVII. Técnica de Inseminación Artificial en rumiantes. Duración 4 horas OBJETIVO. Capacitar a los alumnos para que adquieran la habilidad en la aplicación de técnicas de inseminación artificial en rumiantes. GENERALIDADES. Entendemos por inseminación el acto mediante el cual el macho deposita el semen dentro del aparto reproductor de la hembra. Dependiendo de la especie animal que se trate, y del sistema de explotación al que se vean sometidos los animales, las hembras se pueden inseminar de forma natural o artificial. Es importante practicar cualquiera de los dos métodos, pero en esta ocasión nos enfocaremos en la Inseminación Artificial (IA) que no es otra cosa que la introducción de semen dentro del sistema reproductor femenino sin que exista contacto entre el macho y la hembra (Verdeen, 2000). La IA es una técnica que permite un mejor uso del material genético de los machos cuyas características zootécnicas son superiores a la mayoría de los animales de su especie. Desde el punto de vista productivo, representa una posibilidad para aumentar la eficiencia en la producción de las especies domésticas (Días, 2006). En los últimos años ha aumentado el interés en el uso de la IA en rumiantes, con el fin de mejorar los sistemas de explotación, así como la calidad genética de la especie. Los métodos tradicionales de la IA con semen fresco en ovinos tienen la limitante de utilizar un carnero que se encuentra en lugares apartado, lo que reduce el número de ovejas por inseminar. Además, el estrés que se produce con el transporte, tanto del macho como de las hembras, disminuye el porcentaje de fertilidad. Con el semen congelado es más sencillo y práctico manejar animales a grandes distancias y con excelentes resultados (Aspron, 1985; Angulo, 1999). 148 La Inseminación Artificial de la oveja y la cabra puede ser vaginal, cervical o intrauterina. En las vacas la Inseminación Artificial se realiza a nivel intrauterino. Los métodos difieren en cuanto a su complejidad y expectativas de éxito. La Inseminación Artificial vaginal es el método más simple y mas rápido (Salomón, 1990). Las ventajas de la Inseminación Artificial, son la utilización de machos con características superiores en cuanto a genética, se puede almacenar el semen, tras ser congelado, durante mucho tiempo, incluso si el macho llegara a morir, Se pueden controlar enfermedades venéreas con un adecuado examen previo al procedimiento de IA, no es necesario tener un semental reduciendo los costos de mantenimiento. Las desventajas son que para alcanzar tasas de gestación es necesario detectar con exactitud el momento de la IA, la consanguinidad dentro del hato, propagación de enfermedades si los sementales no son controlados en lo que a enfermedades venéreas se refiere, si no se tiene un control de gastos esto puede desfavorecer la utilización de la IA (Salomón, 1990; Delgadillo 2005; Días, 2006). EQUIPO E INSTRUMENTOS: Vaginoscopios para ovejas, cabras y vacas, pipetas de inseminación, pajillas con semen para inseminar ovejas, cabras y vacas. MATERIAL ALUMNO: Botas, overol, cuerdas, piolas, marcador de ganado, toallas de papel. MATERIAL BIOLÓGICO: Hembras de bovinos, ovinos y caprinos. PROCEDIMIENTO. Técnica de inseminación artificial en vacas (Noakes, 1999): 1. El proceso de inseminación inicia con la inmovilización de la hembra que será inseminada, es necesario cuidar que el inseminador este protegido de algún accidente y que la paciente no sea lastimada en el procedimiento. 2. Es recomendable que se use la mano izquierda en el recto para manipular el aparato reproductor, y la mano derecha para manipular la pistola de inseminación (Figura 37). 149 3. Levantar la cola con la mano derecha y suavemente aplicar masaje al ano con la mano izquierda, usando siempre un guante lubricado. 4. Juntar la punta de los dedos e insertar la mano hasta la muñeca. 5. Limpiar suavemente la vulva con una toalla de papel, para quitar el exceso de estiércol. 6. Con la mano izquierda, formar un puño, se hace presión vertical sobre la vulva. Esto abrirá los labios de la vulva y permitirá insertar la pistola de inseminación varios centímetros, antes de tocar las paredes de la vagina. 7. Insertar la pistola en un ángulo ascendente de 30 grados, para así evitar penetrar a la uretra y a la vejiga. 8. Una vez que la punta de la pistola haya entrado unos 15 a 20cm en la vagina levantar la parte trasera de la pistola hasta una posición casi horizontal, avanzar la pistola hasta hacerla tocar la parte posterior del cérvix. Esta puede localizarse mediante suave presión con el extremo del dedo índice. 9. Para depositar el semen, empuje el émbolo de la pistola para que el semen se deposite en el cuerpo uterino. Si la punta de la pistola se encuentra a una pulgada adelante del cérvix al momento de depositar el semen, este será depositado en un solo cuerno. 10. La pipeta será retirada cuidadosamente. Figura 44. Técnica de Inseminación Artificial en vacas.26 26 Realizado por Alcantar , UNAM. 2007. 150 Figura 45. Forma de depositar el semen en el cuerpo del útero.27 Técnica de inseminación vaginal en ovejas y cabras. 1. Se sujeta a la hembra, colocándola sobre una caja, paca o tubos, para que la parte posterior de la paciente que en alto. 2. La vulva de la hembra se limpia con una toalla de papel. 3. Se introduce un vaginoscopio desinfectado y lubricado, con suavidad y extremo cuidado, el cérvix es localizado con facilidad manipulando el vaginoscopio. 4. La pipeta de inseminación debe ser cargada por un ayudante. 5. Se introduce la pipeta, cerca del cérvix, se deposita el semen empujando el embolo de la pistola. 6. Se retira con cuidado la pajilla, y se retira con cuidado el vaginoscopio. 7. La hembra se baja con cuidado de la superficie en la que se encuentra Figura 46. Técnica de Inseminación Artificial en ovejas y cabras.28 27 28 Realizado por Alcantar, UNAM. 2007. Adaptado de Delgadillo, J. A.; 2005. 151 Diagrama Ecológico Práctica XVII. Técnica de Inseminación Artificial en rumiantes. Sujeción de las hembras VACA OVEJA Y CABRA Localización del cérvix por palpación utilizando guante de palpación con o sin guante de látex Se localiza el cérvix con ayuda de un vaginoscopio. Introducir la pipeta de inseminación, depositar el semen en el cuerpo del útero Introducir la pipeta inseminación, depositar semen cerca del cérvix. de el Fin de la práctica Recolectar y depositar los guantes y pipetas de inseminación en una bolsa amarilla. Incineración 152 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVII TÉCNICA DE INSEMINACIÓN ARTIFICIAL EN RUMIANTES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 153 PRACTICA XVIII. Recuperación, evaluación, clasificación y manipulación de embriones. Duración: 4 horas OBJETIVO. El alumno adquirirá la habilidad de recuperar, evaluar, clasificar y manipular los embriones de coneja. GENERALIDADES. RECUPERACIÓN DE EMBRIONES. Consiste en recolectar del aparato reproductor de la hembra donante los huevos fecundados después que descienden al útero y antes que comience el proceso de anidación o fijación su definitiva. En circunstancias especiales la recolección de embriones se realiza postmortem (después de sacrificar a la hembra donadora para aislar el aparato reproductor y obtener con toda comodidad los embriones; sin embargo, esta técnica cae dentro del campo experimental y como es lógico, no es utilizada desde el punto práctico (Pérez, 1985; Noden, 1990; Ruchebuch, 1991). EVALUACIÓN DEL HUEVO Y DEL EMBRIÓN (Illera, 1994; Tribulo, 2006). La valoración de los embriones permite seleccionar aquellos hipotéticamente mejores para transferirlos a las mejores receptoras. Algunas de las características que se analizan para calificar a los embriones se describen a continuación: 1. Comprensión de las células o blastómeros 2. Regularidad en la forma del embrión 3. Variación del tamaño celular 4. Color y textura del citoplasma 5. Presencia de grandes vesículas 6. Presencia de células extruidas 7. Diámetro 154 8. Regularidad de la zona pelúcida 9. Presencia de restos celulares Los blastómeros siempre deberán tener el mismo tamaño, una coloración similar y una textura parecida, no deben ser ni transparentes ni opacos. El citoplasma es granular, desigualmente distribuido y contiene vesículas de tamaño moderado. El espacio previtelino está vacío con un diámetro regular la zona pelúcida será lisa, sin arrugas y no estará colapsada. No deben existir restos celulares (Martín, 1994). CLASIFICACION DE EMBRIONES (Görlach, 1999). Los embriones recolectados se clasifican según su edad y su estadio de desarrollo de la siguiente manera: M= Mórula temprana MM= Mórula compacta. BB= Blastocisto inicial. UE= Ovocito no fecundado DE= Embrión total o mayoritariamente degenerado. 155 Cuadro 5. Diferentes estadios del desarrollo embrionario. Según se descripción cualitativa se dará la clasificación de los embriones de la siguiente manera: Mórula Temprana Mórula compacta Blastocisto inicial Blastocisto maduro Blastocisto expandido Blastocisto en eclosión 156 Según se descripción cualitativa siguiente manera (Cuadro 6): se dará la clasificación de los embriones de la Clase 1 Calidad excelente. Embrión esférico, zona pelúcida intacta, cúmulo celular perfectamente estructurado con células del mismo tamaño color y textura. Clase 2 Calidad buena Embrión esférico o ligeramente elipsoidal, zona pelúcida intacta algún blastómero suelto, cúmulo celular perfecto. Clase 3 Calidad regular Zona pelúcida intacta o dañada, blastómeros de diferentes tamaños, cúmulo celular con un 30 hasta un 60% de blastómeros intactos, ligero retraso en el desarrollo Estadio de 32 células. Clase 4 Calidad mala Zona pelúcida intacta o dañada, blastómeros degenerados y sueltos en número considerable, cúmulo celular suelto y con menos del 30% de blastómeros intactos, desarrollo retardado con estadios embrionarios de blastómeros grandes (32,16 células). Clase 5 Embrión degenerado Zona pelúcida normalmente intacta, cúmulo celular con aspecto desorganizado y suelto ,blastómeros de diferentes tamaños y pignóticos en muchos casos , estadios de desarrollo ya paralizado ( 2,4,8 hasta 16 células) Clase 6 Ovocito no dividido Ovocito fertilizado o no, pero no dividido, rodeado de una zona pelúcida intacta o no, perfectamente esférica. 157 MANIPULACIÓN DE EMBRIONES. La micromanipulación de embriones se puede definir como el manejo aplicado a los embriones entre los que se incluyen la sección de sus tejidos, la agregación de sustancias o células de su interior, así como la separación de alguna de sus partes, entre las que se puede incluir la zona pelúcida, que, de alguna manera, van a modificar su morfología, pero manteniendo su funcionalidad (Peters, 1991; Wilmut, 1994). MATERIAL DE LABORATORIO: 1 Bandeja , 3 cajas de Petri de 1000mm, 2 Bisturí con navaja, 1 pinzas, aguja 18G, 2 jeringas de 10ml , Guantes de látex estériles, toallas de papel. MATERIAL BIOLÓGICO: 2 conejas y 1 macho REACTIVOS: Gonadotropina coriónica equina (Folligon 1000UI), GnRH 1 frasco, 1litro de Solución Ringer. PROCEDIMIENTO. 1. Las conejas serán superovuladas con eGC (Folligon), con el siguiente protocolo: Servicio (68 h) + GnRH Inyec. eGC -4 -3 -2 -1 0 72 h. Recuperación de embriones 1 2 3 4 5 2. En el día cero se les dará monta. 3. Las hembras serán sacrificadas 72 horas posteriores al servicio. 158 4. Los embriones se recuperan a través de un lavado del oviducto y útero. Se utilizará como medio de lavado 40 ml de solución Ringer suplementada con 5% de suero bovino que será vertida por el infundíbulo con la jeringa de 20 cc y aguja punta roma de 18G de 1½ pulgadas. 5. El líquido resultado del lavado se deposita directamente en la caja de Petri. 6. El líquido recuperado será revisado bajo un estereoscopio a 20X para buscar embriones. 7. Ya localizados se procederá a evaluarlos morfológicamente a 40X. 8. Clasificar los embriones de acuerdo a criterios establecidos por Gölarch (1999). 159 EVALUACION DE LA PRÁCTICA XVIII. Evaluación Visual de la práctica XVII. 1. Mencione lo que observa en las diapositivas: a) b) c) 2. Esquematiza los diferentes estadios embrionarios. 3. Califique y clasifique el siguiente grupo de embriones. 160 Diagrama Ecológico Práctica XVIII. Recuperación, evaluación, clasificación y manipulación de embriones. Superovulación y monta a las 68 h Recolección de las jeringas, agujas y frascos vacíos Sacrificio de las conejas Incineración Necropsia, disección del aparato reproductor de la hembra, lavado del oviducto y útero. Recuperación, manipulación y clasificación de embriones Fin de la Práctica Colocar en el recipiente rojo los desechos punzo-cortantes El sobrante del lavado se desecha en la tarja. Depositar en bolsas amarillas los cadáveres y los guantes de látex. Incineración 161 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVIII. RECUPERACIÓN, EVALUACIÓN, CLASIFICACIÓN Y MANIPULACIÓN DE EMBRIONES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 162 PRACTICA XIX. Transferencia de embriones. Duración: 4 horas OBJETIVO. El alumno conocerá las técnicas de superovulación y transferencia embrionaria y será capaz de aplicar uno de los métodos de transferencia en la coneja, a nivel experimental. GENERALIDADES. El transplante de embriones es un método de reproducción artificial basado en la transferencia de embriones producidos por una hembra donante (madre genética superior) a hembras receptoras (madres portadoras) que lo gestan hasta su nacimiento. La producción de embriones ha sido propuesta como una metodología tendiente a la preservación de especies en peligro de extinción, que brinda la posibilidad de disponer de bancos genéticos para su conservación y un seguro sanitario para evitar la transmisión de enfermedades. A su vez, el incremento en la eficiencia de la producción y congelamiento de embriones podrá ser utilizado para constituir rebaños con el mínimo riesgo de ser portadores de enfermedades y permitir una amplia difusión mundial de animales con alto mérito genético. Los tratamientos hormonales para inducir la ovulación múltiple y la transferencia de embriones permiten utilizar de manera intensiva a las hembras genéticamente superiores, en forma similar al aprovechamiento que se realiza con los machos por medio de la inseminación artificial (Gibbons, 1995). Los primeros intentos de la transferencia de embriones, fueron enfocados más hacia la experimentación que hacia la práctica. En 1980 Heape consiguió transferir embriones de coneja, esto ocurrió casi 50 años antes de que Warwick, Berry y Horlacher experimentaran con ovejas, ya en 1940 esta técnica era de gran interés para los investigadores. La transferencia de embriones, al igual que la inseminación artificial, es una técnica que bien puede clasificarse como manipulación genética. La principal 163 ventaja es aumentar la capacidad reproductora de las hembras que poseen un gran valor genético (Warwick, 1980; Sorensen, 1982; Illera, 1994). La transferencia de embriones consiste en recoger embriones de alta calidad genética del aparato del aparato genital de una hembra donante y depositarlos en el de otra hembra receptora, por lo general de inferior condición genética, siendo ésta la que mantiene la gestación a término (Sorensen, 1982; Noden, 1990; Illera, 1994). VACAS DONADORAS. El valor de la donadora puede ser definido de acuerdo a diferentes criterios según los beneficiarios. Sin embargo, en el caso de la aplicación práctica de la técnica para el mejoramiento genético del ganado, debemos escoger a las vacas más productivas como donadoras. No deben presentar enfermedades hereditarias, tener excelente historial reproductivo y salud, alto valor en el mercado, ciclos estrales regulares, no tener enfermedades que afecten la fertilidad, no ser demasiado viejas (Illera, 1994). VACAS RECEPTORAS. La receptora ideal es una vaca joven, libre de enfermedades, de probada fertilidad y habilidad materna. Además, debe tener un tamaño adecuado para no presentar problemas al parto. Aunque la raza no es un factor importante, generalmente se acepta que las vacas cruzadas tienen mayor fertilidad (Hafez, 1993). La Transferencia de Embriones incluye varias etapas, desde la selección de donadoras hasta la transferencia del embrión. Las principales etapas relacionadas son (Ruchebusch, 1991; Tribulo, 2006): Inducción de la superovulación (donadora). Fertilización Sincronización del ciclo estral (receptoras). Recolección de los embriones (donadora). Clasificación de los embriones. Almacenamiento por corto plazo y cultivo. Criopreservación. Transferencia de los embriones (receptoras). 164 La superovulación es proceso mediante el cual los ovarios son estimulados para producir mayor numero que el normal de folículos ovulatorios y, por lo tanto, liberación de ovocitos (Peters, 1991). EQUIPO E INSTRUMENTOS: Material de cirugía. Dos jeringas desechables de 20 ml. una caja de Petri de 200 ml., 8 cajas de Petri de 100 ml. cuadriculadas, 3 equipos Venoset para terapia de fluidos, agujas calibre 22, catéter endovenoso (punzocat) de calibre 17 ó 18, 2 matraces de Erlenmeyer de 100 ml., 2 matraces de Erlenmeyer de 250 ml., 2 microscopios estereoscópicos, un microscopio óptico, un portaobjeto cóncavo, 2 jeringas insulínicas con agujas, 5 pipetas Pasteur, una estufa bacteriológica (37º C), un baño maría (37° C), una mesa de cirugía, una tabla de madera, tres paños de algodón. MATERIAL BIOLÓGICO: 2 conejas adultas con ciclos estrales regulares, 1 conejo adulto REACTIVOS: Un frasco de 1000 UI de PMSG, un frasco de 2500 UI de HCG, un litro de solución Hartman, 3600 ó 400 ml. de suero sanguíneo de conejo o bovino inactivado, un frasco de propiopromazina, 1 frasco de pentobarbital sódico, 2 frascos con 800 UI de penicilina G sódica, SOLUCIONES ANTISÉPTICAS. Yodo 5%, benzal, jabón quirúrgico. 165 PROCEDIMIENTO. Por razones de recursos y tiempo, esta práctica será demostrativa, realizándola únicamente un equipo de alumnos voluntarios asesorados por el maestro. La metodología que se seguirá es según el modelo didáctico-teórico experimental elaborado por Villegas, por lo cual sólo se enumeran los pasos (para ampliar la metodología ase sugiere consultar el modelo del autor antes citado como complemento de esta práctica: • Plática general explicativa. • Selección de donadoras y receptoras. • Superovulación. • Detección de celos. • Fertilización. • Sincronización estral. • Recolección de embriones. • Identificación y evaluación de embriones. • Transferencia de embriones. 166 EVALUACIÓN DE LA PRÁCTICA XIX. Los alumnos entregaran un trabajo escrito de la técnica de transferencia de embriones, por equipo, donde se describa la técnica. El trabajo deberá contener: Portada (Con el nombre de los alumnos de cada equipo) Índice Generalidades Comentarios Bibliografía. 167 Diagrama Ecológico Práctica XIX. Transferencia de embriones. Selección de donadoras y receptoras. Recolección de las jeringas, agujas y frascos vacíos Superovulación. Incineración Detección de celos y Fertilización Recuperación, manipulación y clasificación de embriones Transferencia de embriones El sobrante del lavado se desecha en la tarja. Fin de la Práctica Colocar en el recipiente rojo los desechos punzo-cortantes Depositar en bolsas amarillas los cadáveres y los guantes de látex. Incineración 168 HOJA DE CONTROL DE LABORATORIO REPRODUCCIÓN ANIMAL E INSEMINACIÓN ARTIFICIAL PRÁCTICA XVIII. TRANSFERENCIA DE EMBRIONES. Nombre del alumno: Fecha: Grupo: Equipo: SI NO Cumple con los lineamientos del laboratorio Investigó previamente Cumplió con el material solicitado Trabajo individual Trabajo en equipo Observaciones: Puntos obtenidos: 10 9 8 7 6 5 4 3 2 1 0 Nombre y Firma del profesor de laboratorio 169 REFERENCIAS 1. Aguirre, F.V. 2004. Efectos de la estacionalidad, frecuencia de colección y jerarquías en algunas variables reproductivas de carneros pelibuey (Ovis aries). Tesis de doctorado, Universidad de Colima, México. 2. Aisen, E.G.,Venturino, A. 2004. Recolección y evaluación del semen. En: Reproducción ovina y caprina, Inter-México, Buenos aires, Argentina. 55-71 3. Aisen, E.G. 2004. Procesamiento y conservación del material seminal. En: Reproducción ovina y caprina, Inter-México, Buenos aires, Argentina. 73-85 4. Angulo, M.R.B., Ortiz, H.A., Berruecos, V.J.M., Feldman, S.D., Valencia, M.J. 1999. Motilidad y fertilidad del semen de carnero, descongelado a dos diferentes ritmos de temperatura. Veterinaria México, 30 (3): 265-268 5. Allen, E.W. 1994. Diagnostico de la gestación. En: Fertilidad y obstetricia equina. Acribia, España. 53-58 6. Allen, W.E. 1992. Semen evaluation. En: Fertility and Obstetrics in the dog. Blackwell Scientific Publications. London. 43-55 7. Allen, E.W. 1994. Diagnostico de la gestación. En: Fertilidad y obstetricia equina. Acribia, España. 8. Arbiza, A.S. 1986. Producción de caprinos. AGT Editores. México. 222-225 9. Ashdown, R.R., Hafez, E.S.E. 2000. Anatomía del aparato reproductor masculino. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E. y Hafez, B. (Eds). McGraw-Hill Interamericana, México. 170 10. Aspron, P.M.A. 1985. Manual de Inseminación Artificial en ovinos. Universidad Nacional Autónoma de México. 11. Banks, W.J. 1986. Aparato reproductor de la hembra. En: Histología Veterinaria aplicada. El manual moderno. México. 629-640 12. Barberán, M. 1981. Parto natural. En: Parto de la vaca y manejo del ternero. Aedos. Barcelona, España. 13. Barberán, M. 1981. Operación o sección cesárea. En: Parto de la vaca y manejo del ternero. Aedos. Barcelona, España. 14. Bearden, H.J., Fuquay, J. 2000. Insemination Thechniques. En: Applied Animal Reproduction. Prentice-Hall, USA. 208-215 15. Blanchard T.L., Vainer D.D., Schumacher J. 1998. Manual of equine reproduction. Mosby, USA. 16. Bowen, J.A., Hunt, J. S. 2000. The Role of Integrins In Reproduction. Society For Experimental Biology And Medicine. (223): 331-343. 17. Camacho, P. A., Mata, G. J., Martín, T. B. 1995. Fecundación y gestación. En: Zootecnia bases de producción animal. Tomo II: Reproducción y alimentación. Buxadé, C. C. Mundi-prensa, Barcelona, España. 58-59 18. Carvajal, R. J. L. 2000. Anatomía del aparato genital masculino. En: Zootecnia bases de producción animal. Tomo I: Estructura, Etnología, Anatomía y Fisiología. Acribia, Zaragoza, España. 137-148 19. Cavestany, D. 2006. Parto. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México.175-186 171 20. Ciria, C. J. 2000. Anatomía del aparato genital Femenino. En: Zootecnia bases de producción animal. Tomo I: Estructura, Etnología, Anatomía y Fisiología. Acribia, Zaragoza, España. 149-160 21. Climent, S., Sarasa, M. 2005. Órganos genitales del macho. En: Manual de Anatomía y Embriología de los Animales Domésticos, Conceptos Básicos y Aplicativos. Acribia, Zaragoza España. 329-361 22. Climent, S; Sarasa, M. 2005. Órganos genitales de la hembra. En: Manual de anatomía y embriología de los animales domésticos, conceptos básicos y aplicativos. Acribia, Zaragoza España. 367-388 23. Cunningham, J.G. 1999. Control del desarrollo gonadal y de los gametos. En: Fisiología Veterinaria. McGraw-Hill Interamericana. México. 510-517 24. Cunningham, J.G. 2003. Gestación y Parto. En: Fisiología Veterinaria. Elsevier. España. 398-521 25. De Buen, A. N. 2001. Citología de mucosas. En: Citología diagnóstica veterinaria. Manual moderno. México. 19-22 26. Días, C. P., Valencia, J. 2006. Inseminación Artificial. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México. 215-230 27. De Alba, J. 1985. Reproducción Animal. Ediciones Científicas, México. 28. Delgadillo, J. A. 2005. Pruebas de diagnóstico de gestación. En: Inseminación Artificial en caprinos. Trillas, México. 79-80 29. Dellmann, H.D., Carithers, J.R. 1999. Aparato reproductor femenino. En: Citología e Histología. Intermédica, Argentina. 311-313 172 30. Dyce, K.M., D.V.M. 1999. Anatomía Veterinaria. McGraw-Hill Interamericana, México. 31. Derivaux, J.1976.Dilución y conservación del esperma fresco. En: Reproducción de los animales domésticos. Acribia. Zaragoza, España. 184-201 32. Derivaux, J., Ectors, F. 1997. Fisiopatología de la gestación y obstetricia veterinaria, Acribia, Zaragoza, España. 33. Estrada, S. 2006. Distocia. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México. 249-260 34. Engelhardt, W., Breves G. 2002. Fisiología veterinaria. Acribia, España. 35. Evans, G., Maxwell, W.M.C. 1990. Introducción a la Inseminación Artificial. En: Inseminación Artificial de ovejas y cabras. Acribia. Zaragoza, España. 1-7 36. Evans, G., Maxwell, W.M.C. 1990. Recogida del semen. En: Inseminación Artificial de ovejas y cabras. Acribia. Zaragoza, España. 85-92 37. Evans, G., Maxwell, W.M.C. 1990. Iseminacion. En: Inseminación Artificial de ovejas y cabras. Acribia. Zaragoza, España. 143-161 38. Farstad, W. 2000. Cubrición e inseminación artificial en el perro. En:. Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., Harvey, M.(Eds). Harcourt. México. 39. Fayez, M. I. 1994. Diagnóstico de gestación y determinación del número de fetos. En: Nuevas técnicas de reproducción ovina. Marai, Zaragoza, España. 227-231 173 40. Fernández, B., Suárez, I., Rubio, M., Muñiz, E., Bodega, G. 2003. Sistema reproductor femenino. En: Organografía microscópica animal comparada. Editorial Síntesis, España. 41. Ferrugem, M. J. C. 2006. Implantación y placentación. En: Reproducción de animales domésticos. Galina, C. y Valencia, J. (Eds). Limusa, México. 153-162 42. Fradson, R. D., Spurgeon, T.L. 1992. Anatomía del sistema reproductor del macho. En: Anatomía y Fisiología de los animales domésticos. Interamericana McGraw-Hill, México. 43. Fradson, R. D., Spurgeon, T.L. 1992. Anatomía del sistema reproductor de la hembra. En: Anatomía y Fisiología de los animales domésticos. Interamericana McGraw-Hill. México. 410-419 44. Fradson, R. D., Spurgeon, T.L. 1992. Gestación y parto. En: Anatomía y Fisiología de los animales domésticos. Interamericana McGraw-Hill. México. 45. Gadea, M.J., Matás, P.C., Ruiz, L.S., Coy, F.P. 2003. Citologia vaginal en la perra. En: Prácticas de Fisiología veterinaria. ICE, Universidad de Murcia.115120 46. Geoffrey H. A., Noakes, D. E., Pearson, H. 1990. Veterinary Reproductión and Obstetrics, Bailliere Tindall, Canada. 47. Gibbons, A., Cueto, M. 1995. Transferencia de Embriones en Ovinos. NTA Bariloche, Río negro. 79- 82 48. Gordón, I. 2006. Diagnóstico de gestación Reproducción controlada del ganado vacuno. En: del ganado vacuno y búfalos. Acribia, Zaragoza, España. 178-181 174 49. Gordón, I. 2006. Tecnología de las pruebas de detección de la gestación. En: Tecnología de la reproducción de los animales de granja. Acribia, Zaragoza, España. 300-310 50. Görlach, A. 1999. Recogida de embriones. En: Transferencia de embriones en el ganado vacuno. Acribia. Zaragoza, España. 44-56 51. Grunert, E., Bove, S., Stopiglia, A.V. 1976. Guía de obstetricia veterinaria. Editorial Universitaria de Buenos Aires. Argentina. 52. Gürtler, H., Ketz, A., Kolb, E., Schöder, L., Seidel, H. 1979. Fisiología de la reproducción. En: Fisiología Veterinaria. Acribia. Zaragoza, España. 758-763 53. Habel, R. E. 1968. Genitales femeninos. En: Anatomía y Manual de disección de los rumiantes domésticos. Acribia, Zaragoza, España. 85-94 54. Habel, R. E. 1988. Pene, glándulas accesorias y fosa isquiorrectal. En: Anatomía Veterinaria aplicada. Acribia, Zaragoza, España. 287-296 55. Hafez, E.S.E. 1993. Tecnología reproductiva asistida, manipulación de ovulación, fecundación in vitro y transferencia de embriones. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B. (Eds).McGrawHill Interamericana, México. 56. Hafez, E.S.E. 2000. Anatomía del aparato reproductor femenino. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B. (Eds).McGraw-Hill Interamericana, México. 57. Hafez, E.S.E. 2000. Reproducción, hormonas y factores de crecimiento. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B. (Eds) McGraw-Hill Interamericana, México. 175 58. Hafez, E.S.E. 2000. Foliculogénesis, maduración del óvulo y ovulación. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B.(Eds). McGraw-Hill Interamericana, México, 2000. 108-120 59. Hansel, W., McEntee, K. 1981. Procesos reproductivos en la hembra. En: Fisiología de los animales domésticos. Funciones de la Integración y Reproducción. Tomo II. Dukes, H.H., Swenson, M.J (Eds). Aguilar. México. 1608-1621 60. Hernández, M., Bolarín, A., Gil, M.A., Almiñana, C., Cuello, C., Parrilla, I., García, E., Caballero, I., Sánchez-Osorio, J, Lucas, X., Vázquez, J.M., Martínez, E.A. y Roca, J. 2006. Criopreservación espermática. En: Biotecnología de la reproducción porcina. Manual de técnicas de reproducción asistida en porcino. Bonet, S., Martínez, E., Rodríguez, J.E. y Barrera, X. (Eds). Universidad de Girona. 185-200 61. Herman, H.A. 1996. Pregnancy Determination in the Cow. En: The artificial insemination and embryotransfer of dairy and catte; a handbook and laboratory manual. Interstate publishers. 185-195 62. Hill, J., Andrews, A. 2001. Cuidados de la vaca lechera gestante. Acribia, España 63. Hunter, R.H.F. 1987. La hembra, pubertad y ciclo estral. En: Reproducción de los animales de granja. Acribia. Zaragoza, España. 64. Hunter, R.H.F. 1987. Reproducción de los animales de granja, Acribia, Zaragoza España. 65. Igwebuike, U.M. 2006. Trophoblast cells of ruminant placentas a minireview. Animal Reproduction Science, 93: 185–198 176 66. Illera, M.M. 1994. Transferencia de embriones. Reproducción de los animales domésticos. Aedos. Barcelona, España. 241-281 67. Jainuden, M.R., Hafez, E.S.E. 2000. Gestación, fisiología prenatal y parto. En: Reproducción e Inseminación Artificial en animales. Hafez, E.S.E., Hafez, B.(Eds). McGraw-Hill Interamericana, México. 68. Jeffcoate, I. 2000. Fisiología y endocrinología de la reproducción en la perra. En: Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., England, G.C.W., Harvey, M.J. (Eds). Harcourt. México. 1-12 69. Jeffcoate, I. 2000. Infertilidad en la hembra. En: Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., England, G.C.W., Harvey, M.J. (Eds). Harcourt. México. 39-41 70. Köing, I. 1979. Biología de la reproducción del cerdo. En: Inseminación de la cerda. Biología, Técnica, Organización. Acribia, Zaragoza, España. 27-89 71. Köing, I. 1979. Producción de esperma. En: Inseminación de la cerda. Biología, Técnica, Organización. Acribia, Zaragoza, España. 72. König, H.E., Liebich, H.G. 2005. Órganos genitales femeninos (Organa genitalia feminina).En: Anatomía de los animales domésticos. Editorial medica Panamericana. México. 135-142 73. Laurence, R.J. 2000. Infertilidad en el macho. En: Manual de reproducción y neonatología en pequeños animales. Simpson, G.M., Harvey, M.(Eds). Harcourt. México.114-119 74. Lebas, F. Coudert, P. 1996. El conejo. Cría y patología. FAO, México. 177 75. Linde-Forsberg, C. 2006. Inseminación Artificial. En: Caninos y felinos domésticos. Wanke, M.M., Gobello, C.R. (Eds). Inter-médica. Buenos Aires. Argentina. 175-193 76. Noakes, D.E. 1997. Dystocia. En: Fertility and obstetrics in cattle. Blackwell. University ot London. 86-98 77. Noakes, D.E. 1999. Animal normal no gestante. En: Fertilidad y obstetricia del ganado vacuno. Acribia, Zaragoza, España. 17-31 78. Noakes, D.E. 1999. Gestación normal. En: Fertilidad y obstetricia del ganado vacuno. Acribia, Zaragoza, España. 33-42 79. Noakes, D.E. 1999. Inseminación Artificial. En: Fertilidad y obstetricia del ganado vacuno. Acribia, Zaragoza, España. 157-161 80. Noden, D.M., De lahta, A. 1990. Estadios iniciales del desarrollo en aves y mamíferos. En: Embriología de los animales domésticos. Acribia, Zaragoza, España. 36-37 81. Malcolm, D., Roderick, E. 1999. Reproductive system. En: Manual of Small animal clinical pathology. Bristish small animal veterinary association. 339-340 82. Martín, R.S. 2000. Inseminación Artificial porcina. En: Porcicultura intensiva y extensiva. En: Tomo VI en: Zootecnia animal. Acribia, Zaragoza, España. 135147 83. McDonald, L.E. 1989. Veterinary Endocrinology and Reproduction; Lea and Febiger. U.S.A. 84. McGlone, J. Pond, W. 2003. Pig producction: Biological principles and applications. Thomson learning, Australia. 178 85. Medway, W. 1973. Patología Clínica Veterinaria. Unión Tipográfica editorial. México. 489-491 86. Mesquita, H.M., Fritsch, M. 2006. Gametogénesis. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds) Limusa, México. 87. Morel, D. 2005. Fisiología de la reproducción de los équidos, cría y manejo de la yegua; Acribia, España. 88. Moya, J.L., Vidal R.S. 2004. Aparato genital femenino. En: Tratado de Histología Veterinaria. Gazquez, O.A., Blanco, R.A.(Eds) Masson. Barcelona, España. 381-390 89. Olivera, M. 2006. Puerperio y establecimiento de la dinámica folicular postparto. En: Reproducción de animales domésticos. Galina, C. Valencia, J.(Eds). Limusa, México. 189-200 90. Ortega, A., Pacheco, R., Montes, P.J.F., Torres, A.A., Aguilar, C.E., Avalos, B.1999. Diagnóstico de gestación en cabras criollas (Capra hircus) mediante determinación de los niveles sanguíneos de progesterona y ultrasonografía de tiempo real. Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Yucatán. Mérida, Yucatán México. Revista biomédica, 10: 229234. 91. Páramo, R.M. 2006. Morfofisiología de los órganos genitales del macho y de la hembra. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 27-42 92. Páramo, R.M. 2006. Aspectos reproductivos del perro domestico (Canis familiaris). En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 469-495 179 93. Páramo, R.M. 2006. Aspectos reproductivos de los felinos. En: Reproducción de animales domésticos. Galina, C. Valencia, J.(Eds). Limusa, México. 511-519 94. Paul M. Fricke, Ph.D. 2000. Aplicaciones prácticas del ultrasonido para el manejo reproductivo en ganado lechero. Departamento de Ciencia Lechera, Universidad de Wisconsin - Mádison, Mádison, WI, USA, 53 :706-1284 95. Perea G.F. 2005. Ecografía reproductiva. En: Manual de Ganadería Doble Propósito. Núcleo Universitario Rafael Rangel, Universidad de Los Andes, Venezuela. 96. Pérez, F., Pérez, G.J.F. 1985. Tecnología de la recolección de embriones. En: Reproducción animal: Inseminación Artificial y Transplante de embriones. Científico-médica. España. 726-757 97. Pérez, C.R., Porras, A.A. 2006. Reproducción de ovinos. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 439-465 98. Peter, C., Godoy, B. 1976. Vísceras torácicas, abdominales y pelvianas del macho plano superficial derecho. En: Anatomía del caballo. Acribia, Zaragoza, España. 70-71 99. Peter, C., Godoy, B. 1976. Vísceras torácicas abdominales y pélvicas. Hembra plano profundo izquierdo. En: Anatomía del caballo. Acribia, Zaragoza, España. 67-69 100. Peters, A.R., Ball, P.J.H. 1991. Fisiología especial del sistema nervioso. En: Reproducción del ganado vacuno. Acribia. Zaragoza, España. 180 101. Peters, A. R., Ball, P.J.H. 1991. Inseminación Artificial. En: Reproducción del ganado vacuno. Acribia. Zaragoza, España. 73-86 102. Peters, A. R., Ball, P. J. H. 1991. Fertilización, concepción, gestación y su diagnostico. En: Reproducción del ganado vacuno. Acribia, Zaragoza, España. 116-118 103. Peters, A. R., Ball, P. J. H. 1991. Parto y lactación. En: Reproducción del ganado vacuno. Acribia, Zaragoza, España. 125-135 104. Peters, A. R., Ball, P. J. H. 1991. Transferencia de embriones y técnicas relacionadas. En: Reproducción del ganado vacuno. Acribia, Zaragoza, España. 173-185 105. Phillips, C.J.C. 2003. Cría y reproducción. En: Principios de producción bovina, Acribia, Zaragoza, España. 168-169 106. Powell, D.G. 2000. Manejo de la reproducción en las explotaciones equinas. En: El caballo, salud y cuidados. Acribia. Zaragoza, España. 184-185 107. Priedkalns, J. 1980. Sistema Reproductor Femenino. En: Histología Veterinaria. Dellmann, D.H., Brown, E.M.(Eds).Acribia. Zaragoza, España. 347-358 108. Radostits, O.M., Mayhem, I. G., Houston, D.M. 2002.Examen y diagnostico clínico en veterinaria. Harcourt. Madrid, España. 669-670 109. Rodríguez, M.J.M. 2005. Diagnóstico precoz de gestación. En: Manual de Ganadería Doble Propósito. Unidad de Investigaciones en Ciencias Morfológicas. Facultad de Ciencias Veterinarias. Universidad del Zulia. Estado Zulia. Venezuela 181 110. Ruckebusch, Y., Phaneuf, L.P., Dunlop, R. 1991. Periodos de gestación de cigoto y embrión; transferencia de embriones. En: Fisiología de pequeñas y grandes especies, El manual moderno, México. 733-741 111. Ruckebusch, Y. 1994. Unidad fetomaterna de gestación. En: Fisiología de pequeñas y grandes especies. El manual moderno, México. 752-753 112. Ruckebusch, Y., Phaneuf, L.P., Dunlop, R. 2000. Fisiología de pequeñas y grandes especies, El manual moderno, México. 113. Salomón, S. 1990. Manejo y valoración del semen. En: Inseminación artificial de ovejas y cabras. Acribia, Zaragoza, España. 95-105 114. Salisbury, G.W., VanDemark, N.L., Lodge, J.R. 1978. Recogida de semen. En: Fisiología de la reproducción e Inseminación Artificial de los Bóvidos. Acribia Zaragoza, España. 403-409 115. Schwarze, E. Et al. 1984. Compendio de anatomía veterinaria. En: El sistema visceral. Acribia, Zaragoza, España. 116. Sloss, V., Dufty, J.H. 1987. Procedimientos sobre el feto. E: Manual de obstetricia bovina. Continental. México. 205-225 117. Sisson, S., Grossman, J.D. 1981.Órganos genitales de la vaca. En: Anatomía de los animales domésticos. Salvat Editores. México. 594-599 118. Sisson, S., Grossman, J.D. 1981.Órganos genitales de la perra. En: Anatomía de los animales domésticos. Salvat Editores. México. 604-605 119. Sorensen, A.M. 1982. Fecundación y transplante de embriones. En: Reproducción animal principios y practicas. McGraw-Hill, México. 359-380 182 120. Sorensen, A.M. 1984. Eyaculación y recolección de semen. En: Reproducción animal principios y practicas. McGraw-Hill, México. 97-115 121. Sorensen, A.M. 1984. P procesamiento y almacenaje del semen. En: Reproducción animal principios y practicas. McGraw-Hill, México. 157-185 122. Sorensen, A.M. 1984. Gestación y diagnostico de la preñez. En: Reproducción animal principios y practicas. McGraw-Hill, México. 414-435 123. Squires, J.E. 2006. Hormona y receptor. Estructura y función. En: Endocrinología animal aplicada. Acribia. Zaragoza, España. 124. Stabenfeldt, G.H., Edqvist, L.E. 1999. Procesos de la reproducción de la hembra. En: Fisiología de los animales domésticos de Dukes. Swenson, M.J., Reece, W.O. (Eds). Noriega Editores. México. 681-689 125. Stephen, J.R. 1979. Distocia: Sus causas. En: Obstetricia veterinaria y patología de la reproducción Teriogenelogia. Hemisferio Sur. Argentina. 299311 126. Swenson M. J. 1999. Fisiología de los animales domésticos de Dukes. Uteha, México. 127. Tamayo, T. M., 2000. La ecografía como medio diagnostico y evaluación de los procesos reproductivos en el bovino. Departamento de Clínica, Facultad de Medicina Veterinaria, Universidad Agraria de La Habana. San José, La Habana. 128. Trejo, G.A., 1990. Variación estacional de la libido y calidad del semen en cinco razas ovinas del estado de México. UNAM. Tesis de maestría. Cuautitlán Izcalli. Estado de México. 9-13 183 129. Tribulo, H., Bo, G. 2006. Biotecnologías Reproductivas. En: Reproducción de animales domésticos. Galina, C. Valencia, J. (Eds). Limusa, México. 539-565 130. Vatti, G.1981. El Parto patológico. En: Ginecología y Obstetricia Veterinaria. Hispano-americana. México. 350-434 131. Vatti, G. 1992. Ginecología y Obstetricia Veterinarias, Grupo Noriega Editores, México. 132. Villar, S.V. López, M.F. 2004. Protocolos de anatomía veterinaria. Bellisco, Madrid, España. 390-400 133. Warwick, E.J., Legates, J.E. 1980. Proceso reproductivo. En: Cria y mejoramiento del ganado. Mc Graw-Hill. México. 82-84 134. Weisbasch, H.S.A. 1993. Tratado de obstetricia veterinaria comparada. Celsus. Santa Fe de Bogotá. Colombia. 135. Wilmut, I. 1994. Transferencia de embriones. En: Nuevas técnicas de producción ovina. Fayez, M.M., Owen, J.B.(Eds). Acribia. Zaragoza, España. 89-111 136. Wittke, G. 1978. Fisiología de los animales domésticos. Hemisferio sur. Buenos Aires, Argentina. 141-148 137. Zemjanis, R. 1987. Examen del embarazo. En: Reproducción animal, Diagnostico y técnicas terapéuticas. Limusa. México. 43-59 184
© Copyright 2026