DEPARTAMENTO DE QUÍMICA SERIE DE EJERCICIOS Tema 2
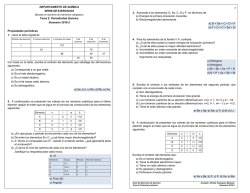
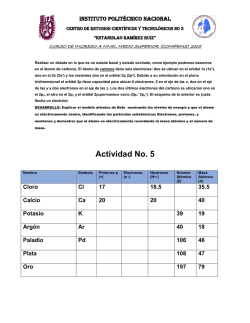
DEPARTAMENTO DE QUÍMICA SERIE DE EJERCICIOS 2 (Basada en reactivos de exámenes colegiados) 3. Acomode a los elementos O, Se, C, Si y F, en términos de: a) Energía de primera ionización creciente. b) Electronegatividad decreciente. Tema 2: Periodicidad Química Semestre 2016-1 a) Si < Se < C < O < F b) F > O > C > Se > Si Propiedades periódicas 1. Llene la tabla siguiente: Símbolo del elemento Z (número atómico) A (número de masa) I # de protones # de neutrones # de electrones 127 54 78 86 49 45 37 58 Con base en la tabla, escriba el símbolo del elemento que satisfaga las afirmaciones siguientes: a) Corresponde a un gas noble. b) Es el más electronegativo. c) Es un metal alcalino. d) Es el de mayor radio atómico. e) Es diamagnético. a) Xe; b) I; c) Rb; d) Rb; e) Xe 2. A continuación se presentan los valores de los números cuánticos para el último electrón (según el orden que se sigue en el principio de construcción) de los elementos siguientes: Elemento n l m S A 1 0 0 +1/2 B 2 1 0 -1/2 C 3 1 -1 -1/2 D 3 2 -2 -1/2 a) ¿En qué grupo y periodo se encuentran cada uno de los elementos? b) De entre los elementos B y C, ¿cuál tiene mayor electronegatividad? c) A+ forma un compuesto con C2-, siendo C el átomo central, ¿qué geometría tiene el compuesto? d) ¿Cuál es el nivel de valencia de cada uno de los elementos? Justifique su respuesta para cada inciso. a), d) Elemento: Grupo: Periodo: Nivel de Valencia: A IA 1 1 B VII A 2 2 C VI A 3 3 D VIII A 4 4 b) Flúor (B) c) Angular 4. Un científico ha predicho las propiedades de un nuevo elemento X con un número atómico de 219. Diga con base a la configuración electrónica del elemento X, si las afirmaciones del científico son verdaderas o falsas y argumente su respuesta. a) El elemento se encontraría en el periodo 8. b) El elemento se encontraría en el grupo 2 de la tabla periódica. c) El óxido del elemento tendría la fórmula X2O. d) La electronegatividad de ese elemento sería un valor muy alto. a) Falso b) Falso c) Verdadero d) Falso 5. Para los elementos de la familia V A, conteste: a) ¿Cuál de ellos posee la mayor energía de ionización (primera)? b) ¿Cuál de ellos posee la mayor afinidad electrónica? c) Acomódelos en orden creciente de electronegatividad. d) Acomódelos en orden creciente de radio atómico. Argumente sus respuestas. a) Nitrógeno b) Nitrógeno c) Bi < Sb < As < P < N d) N < P < As < Sb < Bi 6. Escriba el símbolo o los símbolos de los elementos del segundo periodo, que cumplen con el enunciado de cada inciso. a) Son diamagnéticos. b) Tiene la energía de primera ionización más grande. c) Los números cuánticos de su electrón diferencial son: n=2, l= 1, m= 0 y s= -1/2. d) Los números cuánticos de su electrón diferencial son: n=2, l= 1, m= -1 y s= +1/2. e) Tiene el radio atómico más grande. a) Be y Ne; b) Ne; c) F; d) B; e) Li 7. Acomode los iones siguientes en orden creciente de tamaño iónico: F1-, Mg2+, Na 1+, O2Serie de Ejercicios de Química Tema II: Estructura atómica Compiló: Alfredo Velásquez Márquez Semestre 2016-1 3 Mg2+ < Na 1+ < F1- < O2- 4 11. A continuación se presentan los valores de los números cuánticos para el último electrón (según el orden que se sigue en el principio de construcción) de los elementos siguientes: 8. A continuación se presentan los valores de los números cuánticos para el último electrón (según el orden que se sigue en el principio de construcción) de los elementos siguientes: Elemento n l m S A 5 0 0 +1/2 B 4 1 -1 +1/2 C 6 1 +1 +1/2 D 3 1 0 E 6 1 +1 -1/2 -1/2 Escriba los símbolos de los elementos que cumplen con las características siguientes: a) No metálicos. b) Paramagnéticos. c) Son del sexto periodo. d) Es gas noble. e) Es el más electronegativo. a) Cl y Rn; b) Rb, Ga, Bi y Cl; c) Bi y Rn; d) Rn; e) Cl 9. Considere al elemento con 119 protones y con base en su configuración electrónica, indique: a) Los números cuánticos para su electrón diferencial. b) La forma de su óxido. c) Su ubicación en la tabla periódica (mencione grupo o familia). d) Su carácter magnético. e) Su electronegatividad con respecto a los elementos de su familia. a) n=8, l=0, m=0 y s=+½ b) X2O c) Familia 1A d) Paramagnético e) Es el menos electronegativo 10. Escriba el símbolo del elemento que cumple con el enunciado de cada inciso. a) Es del tercer periodo y tiene el radio atómico más grande. b) Es del cuarto periodo y tiene la energía de primera ionización más grande. c) Es del quinto periodo y su electrón diferencial tiene los valores siguientes, para cada uno de sus números cuánticos: n= 5, l= 1, m= +1 y giro= +1/2. d) Es del sexto periodo y figura como gas noble. e) Es del séptimo periodo y es el menos electronegativo. a) Na; b) Kr; c) Sb; d) Rn; e) Fr Serie de Ejercicios de Química Tema II: Estructura atómica Compiló: Alfredo Velásquez Márquez Semestre 2016-1 Elemento n l m s A 2 1 0 -1/2 B 4 1 +1 +1/2 C 5 1 +1 -1/2 D 6 0 0 -1/2 Escriba el símbolo del elemento que: a) Es el menos electronegativo. b) Tiene la afinidad electrónica mayor. c) Tiene un radio atómico menor. d) Es gaseoso y diamagnético. e) Pertenece al sexto periodo. a) Xe y Ba; b) F; c) F; d) Xe; e) Ba 12. El número de protones para los elementos A, B, C y D son: Elemento A B C D # de protones 17 54 56 13 Indique cuál elemento: a) Corresponde a un gas noble. b) Es el más electronegativo. c) Es un metal alcalino-terreo. d) Presenta valencia 3. e) Forma un nitrato cuya fórmula es X(NO3)2. a) Xenón (B); b) Cloro (A); c) Bario (C); d) Aluminio (D); e) Bario (C) 13. La primera energía de ionización de un átomo es de 8.17x10-19 [J]. Determine: a) La longitud de onda que le corresponde a dicha energía. b) El átomo del cual se trata. Considere que su electrón diferencial tiene como valor de sus números cuánticos n = 3, l = 0, m = 0 y s = +½. c) Ordene a los elementos del periodo al cual pertenece dicho átomo, de menor a mayor radio atómico. d) Ordene a los elementos del periodo al cual pertenece dicho átomo, de menor a mayor electronegatividad. e) Proponga la configuración electrónica del átomo ionizado 1+. a)= 243.3110x10-9 [m] b) Sodio c) Ar < Cl < S < P < Si < Al < Mg < Na d) Ar < Na < Mg < Al < Si < P < S < Cl e) 1s2, 2s2, 2p6 Serie de Ejercicios de Química Tema II: Estructura atómica Compiló: Alfredo Velásquez Márquez Semestre 2016-1
© Copyright 2026