8° BIOLOGIA GUIA 2 VICENTE CASTELLANOS
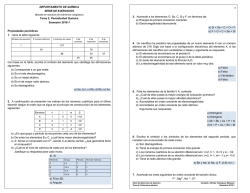
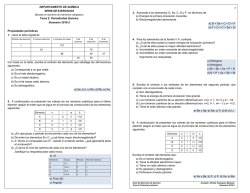
Subdirección de Educación Departamento de Educación Contratada Colegio CAFAM “Bellavista” CED GUIA DE APRENDIZAJE Fecha: Guía No: 7 Docente: Vicente Castellanos Castro Pensamiento: Científico tecnológico Asignatura: Ciencias Grado: Octavo Saber- Saber: Comprender la periodicidad de algunas de las propiedades que tienen los elementos. Saber Hacer: Reconocer la estructura de los átomos y sus propiedades, así como la ubicación en la tabla periódica de los diferentes elementos. Saber Ser: Relacionar la importancia de la química con el bienestar de todas las personas y de los seres vivos. ACTIVADOR COGNITIVO Resolver la siguiente sopa de letras, relaciona las palabras en un mapa conceptual. ATOMO COMPUESTOS ELECTRONES ELEMENTOS FORMULAS GRUPOS NIVELES NOTACION PERIODOS PROTONES SUBNIVELES TABLAPERIODICA Prerrequisitos y preconceptos: Tabla periódica La tabla periodica de los elementos es una forma de organizar los elementos quimicos el fin de entender la es una forma de organizar los elementos químicos de acuerdo con sus propiedades físicas y químicas. Estructura de la tabla periódica moderna Con el descubrimiento de nuevos elementos químicos, la tabla periódica propuesta por Mendeleiv fue presentando inconvenientes debido a que no había lugar en la tabla para ellos, a pesar de los espacios en blanco que él había propuesto acertadamente. Por ejemplo, el descubrimiento del argón y otros elementos de la misma familia de este, llamados gases inertes, y el descubrimiento de las llamadas tierras raras, por la baja frecuencia con que se encontraban. Todos estos elementos tenían pesos atómicos muy cercanos, entonces no se podían colocar dentro de una misma columna o fila, por lo que debieron ser ubicados fuera de la estructura principal de la tabla y se les coloco el nombre de lantánidos y actínidos, atendiendo al nombre del primer elemento de cada serie. En 1914, el físico británico Henry Moseley, demostró que las propiedades de los elementos dependen de sus números atómicos y de sus pesos atómicos. El nuevo ordenamiento de la tabla periódica corregía las irregularidades que se presentaban con el potasio, el argón, el níquel, el cobalto, el yodo y el telurio. Este replanteamiento de la tabla periódica también modifico la ley periódica de Mendeleiev, enunciando que las propiedades físicas y químicas de los elementos varían regularmente según su número atómico, y no de acuerdo con el peso atómico, como se había asegurado anteriormente. Con todos estos ajustes la tabla periódica se organizo en grupos y períodos. Grupos Los grupos son las columnas verticales de la tabla periódica que incluyen los elementos con propiedades químicas similares. Periodos Los periodos son siete filas horizontales de la tabla. El número del periodo indica el número de niveles de energía del átomo. Agrupación de los elementos según la configuración electrónica La tabla periódica, además de estar organizada en grupos y periodos, también tiene en cuenta la configuración electrónica de los elementos y los subniveles de energía. 1. 2. 3. Los elementos de un mismo grupo presentan la misma configuración electrónica en su nivel más externo. El número de electrones del último nivel indica el grupo al que pertenece el elemento. Los elementos que son del mismo periodo, empiezan con un elemento del grupo 1 y el número de electrones varía de 1 hasta 8 cuando se pasa de un grupo a otro. Las regiones s, p, d y f Existe una relación entre la ubicación de los elementos y el subnivel al que pertenecen los electrones de su último nivel, por eso hablamos de las regiones s, p, d y f, como se muestra a continuación: Región s: a esta región pertenecen los elementos de los grupos IA y IIA. Región p: a esta región pertenecen los elementos de los grupos que van desde el grupo IIIA hasta el VIIIA. Región d: a esta región pertenecen los elementos de los grupos IIIB hasta el IIB. Región f: a esta región pertenecen los elementos de los grupos de las tierras raras. Nueva Información: Propiedades periódicas Como su nombre lo indica, las propiedades periódicas son aquellas que se repiten secuencialmente en los elementos de la tabla periódica. Las principales propiedades periódicas son: potencial de ionización, afinidad electrónica y electronegatividad. Potencial de ionización: Es la energía necesaria para remover un electrón del último nivel de energía del átomo. Cuando el átomo pierde un electrón, queda con carga positiva y se llama ion positivo o catión. El potencial de ionización aumenta en los periodos de izquierda a derecha al aumentar el número atómico y el número de electrones del último nivel. En los grupos disminuye de arriba hacia abajo por ser mayor la distancia entre el núcleo y los electrones periféricos. El potencial de ionización más elevado se encuentra en los gases nobles, que, por tener ocho electrones en su último nivel, poseen gran estabilidad y, por lo tanto, se necesita de una gran cantidad de energía para remover un electrón. Cuando se arranca el primer electrón, se llama primer potencial de ionización, para el segundo electrón, segundo potencial de ionización, y así sucesivamente. Afinidad electrónica La afinidad electrónica o electroafinidad es la cantidad de energía que se libera cuando un átomo gana un electrón. Si el átomo esta neutro y gana dicho electrón, se convierte se convierte en un ion negativo o anión. La electroafinidad aumenta en los periodos de izquierda a derecha y en los grupos disminuye de abajo hacia arriba. Electronegatividad Es la capacidad de un elemento para atraer los electrones de otros elementos hacia él y formar un enlace químico. Generalmente la electronegatividad de los elementos se reporta en la escala de Pauling. Con esta escala, el elemento más electronegativo es el flúor que tiene un valor de 4.0 y se ubica en la parte superior derecha de la tabla periódica, y el menos electronegativo es el francio, que tiene un valor de 0,7. En los periodos la electronegatividad aumenta de izquierda a derecha y en los grupos, disminuye de arriba hacia abajo. La electronegatividad es una propiedad importante para determinar el tipo de enlace químico que pueden formar los elementos. Integración: 1. Busca en la tabla periódica a que elemento corresponde cada una de las siguientes coordenadas y regístralo en este cuadro. Coordenadas Elementos Grupo 11, período 6 Grupo 8, período 4 Grupo 14, período 3 Grupo 17, período 5 Grupo 5, período 5 Grupo 10, período 7 2. Escribe el nombre de tres elementos más electronegativos y tres menos electronegativos que el oxígeno. ACCESO AAPLICACIÓN LA INFORMACION Recordación: Propiedades periódicas Refinamiento: 1. Reorganiza la información entendida por medio de un organizador grafico o un mapa conceptual. 2. Realice la configuración electrónica de los siguientes elementos e indique a qué grupo y periodo pertenecen: S, P, Na, MO, Re, Ge, Br, Sr 3. Escribe V, si el enunciado es verdadero o F, si es falso según corresponda. Justifica tu respuesta. ___ Los elementos de un mismo grupo tienen propiedades químicas similares. ___ El número de electrones del último nivel indica el grupo al que pertenece el elemento. ___ Los elementos del grupo IA pertenecen a la región p de la tabla periódica. ___ El número de electrones en los periodos disminuyen como mientras el número atómico aumenta. ___ La configuración electrónica es ajena a la disposición de los elementos en la tabla periódica. 4. Identifica un grupo de tres elementos con propiedades semejantes entre sí. 5. Contesta: a. ¿Cuál es la diferencia entre un elemento electronegativo y uno electropositivo? b. ¿Cuál es la diferencia entre los grupos y los periodos de la tabla? c. ¿Cómo está organizada la tabla periódica moderna? Construcción en Pequeño Grupo Leer el siguiente texto: El calcio es el mineral más importante en nuestro cuerpo. Es necesario para llevar a cabo diferentes funciones intracelulares y extracelulares, como por ejemplo, las contracciones musculares, las conexiones nerviosas y la coagulación de la sangre. El organismo obtiene el calcio de los alimentos y lo almacena principalmente en los huesos y en los dientes. Por eso es fundamental incluir en la dieta diversos nutrientes que lo contengan, como la leche y sus derivados, así como vegetales de hojas verdes como el brócoli. Para una mejor asimilación del calcio es importante la vitamina D. la deficiencia de calcio o su poca absorción dificulta la formación del hueso y los tejidos óseos que pueden llegar a provocar, junto con otros factores asociados, osteoporosis, una enfermedad que debilita los huesos. 1. Contesten las siguientes preguntas en una cartelera: a. ¿Qué importancia tiene el avance científico y el desarrollo del conocimiento de la química para la salud humana? b. ¿Consideran que la dieta diaria de cada uno de los miembros del grupo incluye una cantidad apropiada de calcio para mantener una buena salud? 2. Realicen una encuesta de mínimo cinco preguntas sobre la dieta de los estudiantes del grado octavo, con la finalidad de conocer el consumo de calcio de los estudiantes, la muestra debe tener mínimo 20 repeticiones. 3. Grafiquen los datos obtenidos de la encuesta en una cartelera. ACCESORECAPITULACIÓN A LA INFORMACION Socialización al Gran Grupo: 1. Cada grupo realiza la presentación de sus carteleras al grupo en forma de galería. 2. Cada grupo explica la grafica obtenida con los datos de la encuesta Verificación: 1. Revisión de todos los puntos de la guía. 2. Entrega y revisión del trabajo en grupo. Reflexión: resuelve 1. ¿Qué sabia? 2. ¿Qué se? 4. El tema tratado en clase es importante para mi vida ¿Por qué? Regulación: La guía se debe desarrollar en su totalidad en el aula de clases Escribe los comentarios generales que le quieras expresar al profesor, con respecto al trabajo desarrollado.
© Copyright 2026