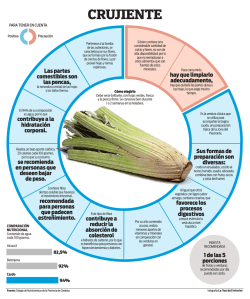
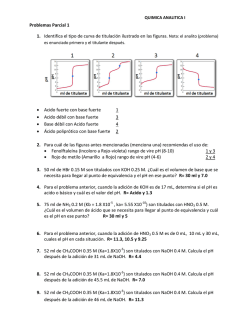
Ejercicios_para_la_A5U1
Química Analítica Cuaderno de prácticas y ejercicios Ejercicios Educación Superior Abierta y a Distancia • Ciencias de la Salud, Biológicas y Ambientales 1 Química Analítica Cuaderno de prácticas y ejercicios Actividad 5. Ejercicios. Resuelve los siguientes ejercicios de porcentaje. 1.- Una muestra de NaOH que pesa 5g se disuelve en 45g de agua (un gramo de agua es aproximadamente igual a un mililitro). Calcula el por ciento en peso del NaOH en la solución. 2.- Una muestra pesa 1.2304 gramos y contiene 0.1012 gramos de hierro. ¿Cuál es el contenido de hierro en porcentaje P/P? 3.- ¿Qué porcentaje de peso en volumen de proteína se obtiene al disolver 1.25g de proteína en 250ml de disolución? 4.- Una solución stock (madre) de KI (yoduro de potasio) contiene 107.6g de KI por litro. La densidad de la solución a 20 0C es 1.0781 g/ml. ¿Cuál es la concentración de la solución en: a) porcentaje P/V y en b) porcentaje P/P? 5.- Una muestra de NaOH que pesa 15g se disuelve en 75g de agua (un gramo de agua es aproximadamente igual a un mililitro). Calcule el por ciento en peso del NaOH en la solución. 6.- Una muestra pesa 12.304 gramos y contiene 0.2024 gramos de hierro. ¿Cuál es el contenido de hierro en porcentaje P/P? 7.- ¿Qué porcentaje de peso en volumen de proteína se obtiene al disolver 5g de proteína en 250ml de disolución? 8.- Una solución stock (madre) de KI (yoduro de potasio) contiene 215.20g de KI por litro. La densidad de la solución a 20 0C es 1.0781 g/ml. ¿Cuál es la concentración de la solución en: a) porcentaje P/V y en b) porcentaje P/P? Educación Superior Abierta y a Distancia • Ciencias de la Salud, Biológicas y Ambientales 2 Química Analítica Cuaderno de prácticas y ejercicios Resuelve los siguientes ejercicios de molaridad. 1.- Describe como prepararías 2 litros de cloruro de bario (BaCl2) 0.108 M. 2.- Calcular la concentración molar en una solución al 70% en peso de ácido nítrico (HNO3); la densidad de la solución es de 1.42 g/ml. 3.-Describe la preparación de 100ml de HCl 6M a partir del HCl concentrado cuya botella indica 1.18 g/ml y 37% P/P. 4.-Calcula la molaridad de una solución de ácido sulfúrico concentrado al 98% en peso y densidad de 1.15g/ml. 5.-Calcula la molaridad de la solución que resulta de mezclar 15ml de una solución 0.240M con 35ml de agua. Resuelve los siguientes ejercicios de normalidad. 1.- Calcula el peso equivalente del Al(OH)3. 2.-Calcula el peso equivalente del H2SO4. 3.-Describe como prepararía 250ml de una disolución 0.1 M y 0.1 N de HCl, si el ácido concentrado esta a 37% en peso y tiene una densidad de 1.18 g/ml. 4.- ¿Cuál es la normalidad del H3PO4 cuya etiqueta dice 35% en peso y densidad 1.38 g/ml? Educación Superior Abierta y a Distancia • Ciencias de la Salud, Biológicas y Ambientales 3 Química Analítica Cuaderno de prácticas y ejercicios 5.- ¿Cuál será la normalidad de 250ml de disolución que se preparó disolviendo 16g de dicromato de potasio (K2Cr2O7) en agua? 6.- ¿Cuántos gramos de BaCl2 se requieren para preparar 125ml de una solución 0.25 N de dicha sal? 7.- ¿Cuál es la normalidad de una solución que se prepara agregando 50ml de agua a 25ml de KMnO4 0.5 N? 8.-Calcula la normalidad de una solución de H2SO4 1.4 M. 9.- ¿Cuántos moles y cuántos equivalentes de soluto hay en 225ml de HCl 0.15 M? 10.- ¿Cuántas moles y equivalentes hay en 44 ml de una solución de H2SO4 1.28 M? Educación Superior Abierta y a Distancia • Ciencias de la Salud, Biológicas y Ambientales 4
© Copyright 2026