Clasificación atendiendo a cómo están unidos - fyqpolitecnico
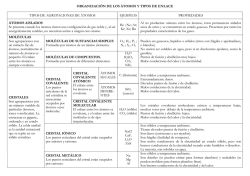
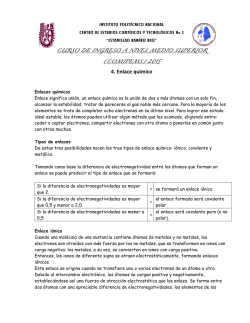
Resumen enlace químico 1º CI ENLACE Atomos aislados ENLACE IÓNICO Sustancias iónicas noviembre 2011 * ¿Qué es? …………………………… * ¿Para qué? …………………………… * ¿Qué reglas? ……………………… * ¿Pueden encontrase átomos aislados? .. * ¿Hay enlace? ………………………… * ¿Algunos ejemplos? ……………….. * ¿Entre qué tipo de átomos? …………… * ¿En qué consiste?.. …………………… * ¿Qué estructura presentan? ………….. * ¿Hay moléculas individuales? ………… * ¿Cuál es su estado físico? …………… * ¿Qué propiedades físicas tienen? …… ……… …… …… ……… * ¿Algunos ejemplos? ………………… * ¿Entre qué tipo de átomos?…………… * ¿En qué consiste? ……………………. * ¿Qué estructura presentan?................ ENLACE COVALENTE * ¿Hay moléculas individuales? ……… Sustancias moleculares * ¿Cuál es su estado físico? …………... * ¿Qué propiedades físicas tiene? ……… * Algunos ejemplos? ………………… * ¿Entre qué tipo de átomos? …………. ENLACE METÁLICO Sustancias atómicas * ¿En qué consiste? ……………………. * ¿Qué estructura presentan?................ * ¿Hay átomos o moléculas individuales? * ¿Cuál es su estado físico? …………… * ¿Qué propiedades físicas tienen? ……... * ¿Algunos ejemplos? …....................... Uniones entre átomos Para lograr mayor estabilidad La regla del octete Si, sólo los gases nobles Y en los metales en estado de vapor. No no hay enlace He, Ne, Ar, Fe (vapor), Cu (vapor) Separados en la tabla periódica Cesión / ganancia de electrones Forman una red inmensa de iones No hay moléculas individuales Suelen ser sólidos Tienen aspecto cristalino, son duros, frágiles Poseen elevadas temperaturas fusión y ebullición Conducen la corriente eléctrica fundidos o disueltos NO conducen la corriente eléctrica en estado sólido. En el caso de ser solubles, lo son en disolventes polares como el agua Sales, óxidos, hidróxidos, NaCl, CaO, NaOH Cercanos y situados en la parte de la derecha de la tabla periódica Compartir de electrones entre dos átomos Moléculas individuales Y en algunos casos cristales continuos En los gases las moléculas están casi aisladas En los líquidos forman como racimos más o menos numerosos En los sólidos se forma un a red continua sin diferenciación molecular Pueden ser gases, líquidos o sólidos Los gases y líquidos tienen temperaturas de fusión y de ebullición bajas Los sólidos covalentes tienen temperaturas de fusión y ebullición elevadas No conducen la corriente eléctrica Sólo se disuelven en agua en el caso de tener cierta polaridad la molécula Gases: N2,C12,NH3, CH4 Líquidos: H2O, CH3OH (metanol), gasolina Sólidos: azúcar, naftalina Sólidos que formen redes: SiO2 (sílice), diamante (C puro) Los de la parte central e izquierda de la tabla periódica consigo mismo. Compartir electrones entre todos los átomos Red continua de átomos No, los átomos forman un continuo Suelen ser sólidos, el Hg es líquido Conducen bien el calor y la corriente eléctrica Son dúctiles y maleables Muy densos y brillo metálico Suelen tener temperaturas de fusión y de ebullición elevadas Fe, Cu, Au, Na, Ni Resumen enlace químico 1º CI noviembre 2011 El caso del hidrógeno Un caso especial es el del hidrógeno que puede ganar 1 electrón o puede compartirlo (es un no metal) a pesar de ser su configuración 1s1. Con los alcalinos (IA) y alcalino-térreos (IIA) forma enlaces iónicos. Con estos elementos gana un electrón y forma aniones H1-. Ca → Ca2+ + 2 eH + 1 e- → HH + 1 e- → H(CaH2)x Con elementos de los demás grupos comparte su electrón para tener 2 e- y así completar su capa. Así el O que tiene 6 e- en su capa externa comparte 2 e- (un par) con dos H para unirse mediante un enlace covalente sencillo con cada uno de ellos y formar la molécula de agua. H× O H O O H Cómo proceder ante una cuestión de enlace químico Consigo mismo Enlace covalente Con un metal Enlace iónico El hidrógeno gana electrones Si Con flúor, oxígeno, nitrógeno, carbono, cloro, ...... Enlace covalente ¿Está el hidrógeno? No Elementos de la izquierda: metales consigo mismo Enlace metálico Elementos de la derecha: Enlace covalente Enlace covalente no metales consigo mismo con otro no metal Elementos separados: metal y no metal Enlace iónico El metal pierde electrones El no metal gana electrones Ejercicio tipo de enlaces: Sin mirar en la tabla periódica resuelve estas cuestiones: Rellena la siguiente tabla (alguna columna puede ser igual a cero) Z Configuración período grupo e- última capa Metal o No metal Número de eque ganará Número de eque perderá 1 7 11 16 17 20 Deduce los siguientes enlaces, indicando si es iónico, covalente o metálico y escribe su diagrama de formación. Z 1 y Z 1; Z 7 y Z 7; Z11 y Z 11; Z17 y Z 17 Z 1 con Z 7; Z 1 con Z 11; Z 1 con Z 16; Z 1 con Z 17; Z 1 con Z 20 Z 11 con Z 16; Z 11 con Z 17 Z 20 con Z 16; Z 20 con Z 17 Elemento
© Copyright 2026