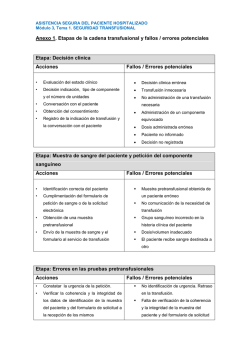
Descargar
Nº 92 Volumen 26 (1); 2016 Boletín de la Sociedad Española de Transfusión Sanguínea y Terapia Celular EDITORIAL Cien años de medicina transfusional. Retos en el futuro E l arranque de la transfusión sanguínea como herramienta terapéutica reconocida tuvo lugar en 1916. Desde entonces han pasado cien años, o mejor, dos tramos de cincuenta. Al final del primer tramo, en 1966, estaba bien establecida la transfusión indirecta, el ACD, el tipaje inmunológico, el fraccionamiento en componentes, el antígeno Australia, la donación voluntaria y los productos del plasma, todo listo para la siguiente etapa que debutó con euforia y una gran expansión, uso intensivo de la transfusión, del plasma fresco, de los eritrocitos, de las plaquetas, de los productos plasmáticos, incluso de los granulocitos. La irrupción del VIH cortó todo esto en seco, supuso una cura de humildad y la recapitulación que tuvo lugar en los noventa: el donante era más importante de lo que se supuso al principio, el control analítico tenía que ser mucho más amplio, las indicaciones de la transfusión más rigurosas, y los métodos, sujetos a rígidos sistemas de calidad obsesionados con el control de procesos. Tiempo de consolidación y de parada. Con el cambio de siglo se ha reanudado el movimiento y producido una maduración. Controlar procesos es un método y no un objetivo. Es evidente que hay que salir del centro de transfusión y enfocar todo hacia la resolución de los problemas del banco de sangre del hospital, de los servicios clínicos, y en definitiva de los pacientes, los verdaderos objetivos. En estas circunstancias nos encontramos con el interrogante: ¿Cuáles son los retos de la medicina transfusional actual? ¿Qué nos encontraremos en el siguiente tramo de cincuenta años? En primer lugar las necesidades de los pacientes. El uso de eritrocitos crece en medicina y disminuye en cirugía mientras que el uso de plaquetas y de plasma se mantendrá sin cambios bastantes años. Con más eritrocitos para enfermos crónicos será preciso elaborar poblaciones específicas, tales como determinados fenotipos, transfusión de neocitos o subpoblaciones eritrocitarias tratadas. Habrá una mayor necesidad de productos derivados del plasma, albúmina, gammaglobulinas, no tanto factores de coagulación como proteínas específicas que no puedan elaborarse por ingeniería. Se necesitan ya programas de donación de plasma que vayan bastante más allá de las necesidades de eritrocitos. Sin duda habrá que atender a una creciente demanda de terapia celular, bien en el área de la inmunomodulación, bien en el área de la medicina regenerativa. Los centros de transfusión están dotados de infraestructura, sistemas de calidad implantados, organización para un servicio territorial, que les permitirá el desarrollo de la terapia celular “en serie”. Será sin duda el principal reto en cuanto a las necesidades de los pacientes se refiere Para cumplir con estas necesidades tiene que continuar la actividad de los elementos esenciales actuales: el cuidado de la base de donantes habituales y altruistas, la robotización de la inmunohematología, serología, de la PCR y del procesamiento de componentes. El sistema informático será más y más importante interconectando la actividad del centro y la transfusión hospitalaria, supeditados ambos al control informático de la clínica. También se han activado herramientas nuevas tales como el genotipado de los antígenos eritrociarios y demás células sanguíneas, el Luminex y las técnicas de amplificación genómica. En cuanto al procesamiento de componentes podemos hablar de la inactivación de gérmenes, pero sobre todo de las aféresis selectivas autólogas u homólogas y su posterior modificación in vitro. Hay que añadir las células madres de cordón y las iPSCs como Continúa en página 3 SUMARIO Nº 92 Volumen 26 (4); 2016 Boletín de la Sociedad Española de Transfusión Sanguínea y Terapia Celular EDITORIAL Cien años de medicina transfusional. Retos en el futuro E l arranque de la transfusión sanguínea como herramienta terapéutica reconocida tuvo lugar en 1916. Desde entonces han pasado cien años, o mejor, dos tramos de cincuenta. Al final del primer tramo, en 1966, estaba bien establecida la transfusión indirecta, el ACD, el tipaje inmunológico, el fraccionamiento en componentes, el antígeno Australia, la donación voluntaria y los productos del plasma, todo listo para la siguiente etapa que debutó con euforia y una gran expansión, uso intensivo de la transfusión, del plasma fresco, de los eritrocitos, de las plaquetas, de los productos plasmáticos, incluso de los granulocitos. La irrupción del VIH cortó todo esto en seco, supuso una cura de humildad y la recapitulación que tuvo lugar en los noventa: el donante era más importante de lo que se supuso al principio, el control analítico tenía que ser mucho más amplio, las indicaciones de la transfusión más rigurosas, y los métodos, sujetos a rígidos sistemas de calidad obsesionados con el control de procesos. Tiempo de consolidación y de parada. Con el cambio de siglo se ha reanudado el movimiento y producido una maduración. Controlar procesos es un método y no un objetivo. Es evidente que hay que salir del centro de transfusión y enfocar todo hacia la resolución de los problemas del banco de sangre del hospital, de los servicios clínicos, y en definitiva de los pacientes, los verdaderos objetivos. En estas circunstancias nos encontramos con el interrogante: ¿Cuáles son los retos de la medicina transfusional actual? ¿Qué nos encontraremos en el siguiente tramo de cincuenta años? En primer lugar las necesidades de los pacientes. El uso de eritrocitos crece en medicina y disminuye en cirugía mientras que el uso de plaquetas y de plasma se mantendrá sin cambios bastantes años. Con más eritrocitos para enfermos crónicos será preciso elaborar poblaciones específicas, tales como determinados fenotipos, transfusión de neocitos o subpoblaciones eritrocitarias tratadas. Habrá una mayor necesidad de productos derivados del plasma, albúmina, gammaglobulinas, no tanto factores de coagulación como proteínas específicas que no puedan elaborarse por ingeniería. Se necesitan ya programas de donación de plasma que vayan bastante más allá de las necesidades de eritrocitos. Sin duda habrá que atender a una creciente demanda de terapia celular, bien en el área de la inmunomodulación, bien en el área de la medicina regenerativa. Los centros de transfusión están dotados de infraestructura, sistemas de calidad implantados, organización para un servicio territorial, que les permitirá el desarrollo de la terapia celular “en serie”. Será sin duda el principal reto en cuanto a las necesidades de los pacientes se refiere Para cumplir con estas necesidades tiene que continuar la actividad de los elementos esenciales actuales: el cuidado de la base de donantes habituales y altruistas, la robotización de la inmunohematología, serología, de la PCR y del procesamiento de componentes. El sistema informático será más y más importante interconectando la actividad del centro y la transfusión hospitalaria, supeditados ambos al control informático de la clínica. También se han activado herramientas nuevas tales como el genotipado de los antígenos eritrociarios y demás células sanguíneas, el Luminex y las técnicas de amplificación genómica. En cuanto al procesamiento de componentes podemos hablar de la inactivación de gérmenes, pero sobre todo de las aféresis selectivas autólogas u homólogas y su posterior modificación in vitro. Hay que añadir las células madres de cordón y las iPSCs como Continúa en página 3 Dirección: Erkuden Aranburu Equipo de Redacción: EDITORIAL 1 1 Cien años de medicina transfusional. Retos en el futuro Presentación de la nueva Directora del Boletín ARTÍCULOS 5 btención, almacenamiento, inspección y control de calidad de los O concentrados de plaquetas procedentes de sangre total: situación en España 11 H ematíes de fenotipo “raro” en España: actividad 2014 y estado actual (Marzo 2015) Erkuden Aranburu Miquel Lozano Carmen Martín Vega Eduardo Muñiz-Díaz Julia Rodríguez Villanueva Iñigo Romón Miguel Angel Vesga 13 R esumen del informe "Actividad Centros y servicios de transfusión" Colaboran en este número: PREMIOS SETS 2015 Dra Erkuden Aranburu Dr. Jose Luis Bueno Dra Virginia Callao Dr. José Manuel Cárdenas Dra Ana Castrillo Fernández y grupo de Procesamiento Dra. N. Nomen Calvet y grupo Premio SETS año 2015 Dr. Iñigo Remón Dra. Aurora Viejo 17 A ctuaciones para disminuir las reacciones vasovagales con pérdida Edita: HEMEROTECA CLÍNICA SETS - Sociedad Española de Transfusión Sanguínea y Terapia Celular C/ Mariano Cubí, 4 08006 – Barcelona [email protected] 22 M edicina Transfusional en los pacientes geriátricos: Correspondencia con el Editor: josemanuel.cardenasdiazdeespada @osakidetza.net Maquetación: Texto y Color 65, s.l. [email protected] Depósito Legal: B46.283/99 2 www.sets.es INFORMES (año 2014) de conocimiento en donantes UNA IMAGEN VALE MÁS QUE MIL PALABRAS 21 Una imagen vale más que mil palabras Necesidades específicas OBITUARIO 26 Dr. Don Crisógono de la Cámara Mendizábal AGENDA 28 Agenda de eventos EDITORIAL fuentes de células regenerativas. La impresión es que a mediados del tramo de cincuenta años entrante, hacia 2040, la producción de plaquetas, de eritrocitos o quizás hemoglobina encapsulada, de proteínas, de células mononucleares modificadas, irán ocupando el espacio que hoy tiene la sangre donada. Al final pasaremos al siguiente tramo con la ingeniería celular como fuente general de transfusión sanguínea. Todo puede cambiar si surgen circunstancias imprevistas, tales como una nueva enfermedad emergente que se difunda de modo inadvertido, como pasó con el VIH. O bien nuevas patologías que requieran componentes sanguíneos nuevos que forzarán la tecnología en un sentido inesperado. La hemovigilancia activa será quien de la alerta. Entre tanto la transfusión basada en la colaboración de las personas que donan su sangre para ayudar, y las buenas prácticas, son presente y desde luego también futuro inmediato. Este tema fue debatido durante la Reunión Anual de la Asociación Valenciana de Hematología y Hemoterapia, Castellón 2015. José Manuel Cárdenas San Sebastián Presentación de la nueva Directora del Boletín Q uerido lector del Boletín de la SETS. La Dra. Erkuden Aranburu, del Banco de Sangre y Tejidos de Navarra y veterana colaboradora del Boletín de la SETS, ha aceptado la responsabilidad de ser la nueva Directora del Boletín a propuesta de la Junta Directiva de nuestra Sociedad. Será una época nueva, diferente de la anterior por cuanto el Boletín pasará a difundirse únicamente en formato electrónico. Fue una decisión tomada por la anterior Junta Directiva tras múltiples consultas, además de una encuesta realizada ente los socios. Quizás eches de menos tener en tus manos el tradicional y cercano Boletín impreso que nos ha acompañado tantos años. Piensa cómo en su lugar se abren nuevas posibilidades de acceso a la información, de difusión de noticias relevantes de nuestra Sociedad, y también un nuevo campo para nuestros socios protectores de la SETS por cuanto pueden ampliar considerablemente la información técnica sobre avances tecnológicos y acceso de los lectores a los mismos mediante links electrónicos. Todavía más que antes, el Boletín estará vinculado a la Página Web de la Sociedad, dirigida por la Dra. Carmen Fernández, con la que actuará sinérgicamente. Para la Dra. Erkuden Aranburu la dirección del Boletín será sin duda un reto estimulante, sabiendo además que está respaldada por tantos profesionales y amigos como tiene en la SETS. Lector, hace siete años tuve el honor y el placer de hacerme cargo del Boletín tratando de continuar el magnífico trabajo realizado por mi predecesor el Dr. Eduardo Muñiz continuador a su vez del no menos extraordinario iniciado por nuestro añorado Paco Carbonell. Los siete años transcurridos han sido para mí un continuo ejercicio científico, con la vista fijada en lo que para ti como lector del Boletín pudiera tener más interés. En este punto no puedo dejar de mencionar a una serie de personas que han contribuido sin descanso a mantener la tensión informativa de cada número, Mercedes Corral, Eduardo Muñiz, Joan Ramon Grifols, Iñigo Romón, Virginia Callao, la propia Erkuden, y tantos otros colaboradores. Con mis nuevas responsabilidades como presidente de la SETS he tenido que ceder el testigo a una buena amiga y colega como Erkuden Aranburu. Es una buena oportunidad de renovación y cambio con un nuevo enfoque. Sólo me queda invitarte a que sigas colaborando como lector y también, porqué no, enviando reflexiones, ideas, trabajos, y darlos a conocer a tus colegas a través de esta publicación cercana y amiga. José Manuel Cárdenas Presidente de la SETS www.sets.es 3 ARTÍCULOS Obtención, almacenamiento, inspección y control de calidad de los concentrados de plaquetas procedentes de sangre total: situación en España Castrillo Fernández, A; Pérez Vaquero, MA; Arroyo Rodríguez, JL; Ayape Puyales, ML; Aznar Martín, JM; Casado Calderón MS; Delgado Calvo-Flores, C; Díaz Gallardo, S; Girona Llobera, E; Jiménez Alonso, MA; Jurado del Campo, M; Larrea González, L; Maymo Bofill, MR; Monge Ruíz, J; Muñoz Turrillas, C; Ortiz de Salazar, M; Pajares Herraiz, A; Pérez Aliaga, AI; Polo Escriche, A; Rivera Pozo, J; Yáñez Izquierdo, M. Grupo de trabajo de procesamiento y producción de componentes sanguíneos de la SETS E n la elaboración de CP a partir de la sangre total (ST) hay dos fases principales a considerar, una relacionada con la separación del buffy coat (BC) o plasma rico en plaquetas (PRP) y otra con la obtención final del concentrado de plaquetas (CP). Este consiste en la mezcla de varias unidades de BC o PRP en un medio de suspensión, que se filtra. Las dos fases de la elaboración están sujetas a variables como el método de fraccionamiento de la ST, uso de soluciones aditivas (SA), métodos de preparación del CP, bolsa de almacenamiento, filtración (tipos de filtros), tratamientos adicionales y rangos de temperatura. Todas ellas pueden influir en el mantenimiento de la fisiología de la plaqueta. Un buen control de esas variables y la elección de condiciones propicias evitara su activación. Con el objetivo de obtener información relativa a los CP procedentes de ST, también llamados CP recuperadas - mezcla - leucodeplecionadas (denominación que se asigna en el RD 1088/20051), se envío un cuestionario por correo electrónico a los 22 centros de transfusión (CT) de España. El cuestionario contiene 17 preguntas, algunas con varios apartados, y contempla aspectos relacionados con las condiciones de la obtención, la inspección, el almacenamiento y datos relativos al control de calidad del componente. La respuesta consiste en un número, una o dos palabras, o elección entre opciones propuestas. Para los datos de control de calidad se adjuntó una tabla (verla en el anexo). Respondieron 20 centros (90,91%). Todos los CT cumplimentaron más del 95 % de las cuestiones, excepto uno que contestó al 75%. Las respuestas se resumen y comentan a continuación. 1ª pregunta: ¿Qué tipo de fraccionador utiliza para procesar la sangre total? Compomat G 5 en 11 CT (55%), Macopress Smart en 5 CT (25%), Reveos en 3 CT (15%) y Tace II plus en 1 CT (5%). 2ª pregunta: ¿Qué tipo de producto intermedio obtiene para la elaboración del CP? Buffy coat (BC) en el 85% de los CT, y plasma rico en plaquetas (PRP) en el 15% restante, éstos son los CT que procesan la ST con el sistema Reveos. Uno de los CT obtiene CP unitario para uso pediátrico a partir de PRP. 3ª, 4ª y 5ª preguntas, relacionadas con los tiempos de inicio del procesamiento de la sangre total, preparación del CP y manipulación del BC. •• En el 75% de los CT trascurren 16-20 horas desde la extracción de la sangre total (ST) hasta el fraccionamiento y obtención de BC y/o PRP. En el 55% de los CT este periodo es de 6-8 horas. Hay que reseñar que el 30% de los CT fraccionan en estas dos franjas de tiempo, según sea la colecta de mañana o de tarde. •• El tiempo que pasa desde la extracción de ST hasta la preparación del CP es, en general, de un mínimo de 12-18 horas hasta un máximo de 24 horas y, excepcionalmente, 30 horas. •• El BC y/o PRP, una vez obtenido, se mantiene en reposo un tiempo mínimo de 1-2 horas en el 95% de los CT, un tiempo máximo de 2-10 horas en el 70% y, excepcionalmente, más de 18 horas. •• Después de la fase de reposo, se procede a la agitación del BC y/o PRP, por un tiempo variable entre 15 minutos y 2 horas, en el 50 % de los CT. En el otro 50 % no se contempla esta fase de agitación. 6ª pregunta: ¿Los CP se suspenden en SA y plasma? ¿En qué tipo de SA y proporción SA/plasma? •• Se suspenden en SA y plasma en el 100 % de los CT. •• Tipos de SA: PAS II (= PAS B), en el 5% de los CT; PAS III (= PAS C), en el 5 % de los CT; www.sets.es 5 ARTÍCULOS •• PAS IIIM (= PAS E), en el 50% de los CT; Composol (=PAS D), en el 45% de los CT. Uno de los CT utiliza dos tipos de SA. •• En el 95% de los CT se utiliza una proporción de SA/ plasma de 65-70/35-30. Tan solo un CT aplica la proporción 57/43. 7ª pregunta: ¿Qué sistema utiliza para la elaboración de CP? Y ¿qué tipo de dispositivo? •• El 25% de los CT lo hace de forma manual, se incluyen los tres CT que hacen procesamiento de la ST con el sistema automático Reveos. •• El 75% de los CT utilizan sistemas semiautomáticos: el dispositivo Tacsi (60%) y el Orbisac (15%). Las preguntas 8ª a 13ª hacen referencia a la manipulación del componente tras la obtención, inspección y aspectos que se valoran. •• Después de la obtención, los CP se mantienen en reposo entre 1 y 2 horas, previamente a la fase de agitación, en el 70% de los CT. •• Cuando se aplican técnicas de reducción de patógenos, se procede de la misma forma. •• En todos los CT se mantiene controlada la temperatura (22 ± 2 ºC) desde la colección hasta la distribución). •• La inspección macroscópica del CP se lleva a cabo en todos los CT: -- en las primeras horas tras la obtención, en el 80% -- a las 24 horas de la obtención, en el 20% -- en el momento de la distribución, en el 75% -- el 60% de los CT realizan la inspección en las primeras horas post obtención y en el momento de la distribución. -- Un CT (5%) lo hace en los tres tiempos señalados •• En todos los CT, la inspección del CP contempla la presencia de “remolino”, agregados y coloraciones anómalas (lipemia, coloración verdosa o amarillenta intensa, presencia de hematíes). •• En el 80% de los CT la inspección no sigue ningún método. El resto sigue algunas pautas: inspección estandarizada sobre una fuente de luz, valoración de la coloración según guías publicadas, o procedimiento escrito. •• En base a los hallazgos de la inspección, se desecha el componente: -- si hay coloración anómala (100% de los CT) -- si hay agregados (40% de los CT) -- si no hay “remolino” (25% de los CT) La cuestión 14ª está relacionada con la presencia de agregados. •• En el 65% de los CT se estima que la presencia de agregados tiene importancia. •• En el 60% de los CT se hace una valoración cuantitativa (escasos o abundantes) y cualitativa (pequeños o 6 www.sets.es grandes) de los agregados. •• No se utiliza una escala de medición objetiva, que especifique el tamaño y número de agregados. •• En relación a la prevalencia de visualizar agregados a las 24 horas postproducción, la respuesta más general (55% de los CT) es que se visualizan raramente o “menos del 1%”; en los CT que lo tienen cuantificado, un solo CT los detecta en el 1,1% de los CP, el resto de los CT no los detectan. •• En general, los CP con agregados, especialmene si son pequeños, se distribuyen a los servicios de transfusión. Tres centros declaran que, si los detectan, no los distribuyen. •• Debido a la baja incidencia de agregados, no se han analizado o no se ha detectado relación de variables que puedan influir en su aparición. Un CT comunica relación con la agitación insuficiente de los IPUs (interim platelet units, PRP obtenido por el sistema Reveos). Otro centro encuentra relación con la SA añadida, siendo más frecuente con PAS IIIM que con PAS II o PAS III, en este caso los agregados se observan, inmediatamente después de la retirada del CP-pool del dispositivo de realización, no son compactos y desaparecen con agitación manual2. •• Las potenciales estrategias que se señalan para minimizar la formación y/o presencia de agregados consisten principalmente en controlar la temperatura ambiente, mantener los tiempos de reposo del BC y atemperar la SA. •• En todos los CT se extrae el aire tras la obtención de los CP. Las preguntas 15ª y 16ª se centran en la aplicación de medidas para aumentar la seguridad transfusional •• En el 75% de los CT, se realiza una inspección sistemáticamente antes de la distribución. •• En ocho CT (40%) se aplican TRP, Mirasol® (riboflavina + luz UV) en cinco de ellos e Intercept® (amotosaleno + luz UVA) en los otros tres. En dos de estos últimos no se aplica a la totalidad de los CP. En todos los CT que utilizan TRP, la caducidad asignada al CP es de 7 días y se ha eliminado la irradiación gamma del componente. •• En un centro se aplica la tecnología BACTEC™ para detección de bacterias, y solo se amplía la caducidad del CP excepcionalmente (puentes, navidades). •• En un centro se aplica la tecnología BDS™ para la detección indirecta de bacterias, y se amplía la caducidad del CP. Pregunta 17ª, acerca del porcentaje que representan los CP recuperadas sobre el suministro total y el contenido medio de plaquetas por unidad. •• Para el 55 % de los CT, este componente representa el 96-100 % del suministro total de CP (CP-pool + CP aféresis); para el 30 % de CT el 80-90% y para el 15% de CT el 40-65%. •• La cantidad media de plaquetas final por unidad, en los CP procedentes de ST, se halla entre 3 y 3,5 x 1011 en el 80 % de los CT. •• El dato anterior no figura en la etiqueta en el 80% de los CT. Sí se refleja en el resto, donde se hace una estimación media y la cifra aparece preimpresa en la etiqueta final del componente. Control de calidad de los CP procedentes de sangre total •• Los CT utilizan como normativa de referencia las recomendaciones de la Guía del CE3 (CE = Consejo de Europa) y los estándares del CAT4 de ámbito nacional (CAT = Comité de acreditación en transfusión). •• En el 75% de los CT, el control de calidad de los CP se hace en la fase de postproducción y a la caducidad. A las 24-48 horas postproducción se hace el registro de volumen, recuento celular y cuantificación de leucocitos residuales. •• A la caducidad del componente se determina el pH y se realizan cultivos microbiológicos, y, en algunos casos, también se hace recuento celular, que se añade a los registros de la fase postproducción. •• En el 15% de los CT, el control de calidad de los CP se hace solo a la caducidad. •• En el 10% de los CT, el control de calidad de los CP se hace solo en la fase de postproducción. •• La toma de la muestra, cuando el CP se va a distribuir, se hace de una bolsa de muestreo en el 75% de los CT. En el 25% restante, la muestra procede de tubular. En estos casos se procede a su arrastre un mínimo de 6 veces. •• La cifra mínima de plaquetas por CP que está establecida en las especificaciones de cada CT varía entre 2,4 y 3 x 1011. El valor más frecuente que se considera es de 2,5 x 1011 plaquetas/unidad. •• El 90% de los CT utilizan 5 BC o PRP para la obtención del CP-pool. Tres de estos CT utilizan esporádicamente 4 BC. El 10% de los CT utilizan sistemáticamente 4 BC para formar el CP-pool. •• En relación con el registro del volumen y número de plaquetas (x 1011) por unidad, todos los centros cumplen las normativas de referencia, en cuanto al número de muestras mensuales chequeadas y al valor medio alcanzado. En el 100% de los CT se hace recuento celular en al menos el 1% de la producción, y en el 60% se realiza en más del 5% de la producción. Al menos el 75% de las unidades tiene más de 2,5 x 1011 plaquetas/ unidad en todos los CT, y en el 80% de ellos se cumple en el 90% de las unidades. •• Los leucocitos residuales se cuantifican por citome- tría de flujo (CF). Se considera que cumplen requisitos si hay menos de 1 x 106 leucocitos/unidad. El 85% de los CT chequean 10 ó más unidades al mes, que es la cifra mínima requerida, y el 15% restante chequean menos de 10 unidades. El resultado es óptimo, ya que más del 90% de las unidades testadas tienen menos de 1 x 106 leucocitos. •• La inspección del “remolino” se realiza y registra en al menos el 1% de las unidades en el 80 % de los CT, y no se hace en el 20%. En general, se valora la presencia o ausencia de remolino. En tres CT se utiliza una escala de 0 a 2 (0 = no remolino, 1 = intermedio y 2 = patente) y en cuatro CT una escala de 0 a 3. En un centro se aplica una escala propia con puntuación más amplia. En los CT que aplican escala de medición, se comunica un valor medio de 2 ó 3 (es decir, la puntuación máxima) en las 48 horas siguientes a la obtención, y se mantiene en niveles óptimos a lo largo del almacenamiento. •• El pH al final del período de almacenamiento, medido a 22ºC, debe ser mayor de 6,4, lo cual se cumple en todos los CP estudiados. Deben testarse al menos 4 unidades al mes, o el 1% de la producción. En el 90% de los CT se chequean 4 unidades/mes como mínimo, y en dos CT es variable (a veces no se alcanza el mínimo). •• Cultivos microbiológicos, considerando el control microbiológico de los CP que se realiza al final de la caducidad. -- Se incluyó la cuestión de si el número de muestras para cultivo se calcula en base a un proceso estadístico, tal como recomienda la Guía del CE, para asegurar con un grado de confianza establecido la conformidad del proceso para el nivel basal de contaminación que se acepte. Esta premisa la contemplan dos centros (10%), en los que se cultivan 1012 unidades al mes, esto supone más del 1% de la producción. En general, se toma como referencia de muestreo el 1% de la producción, según señalan los estándares del CAT. Los datos comunicados señalan un cumplimiento variable. En el 30% de los CT se hace cultivo de CP que caducan y suele ser menos del 1% de la producción; y en el 60% restante se cultiva el 1% de la producción. -- El medio de cultivo utilizado es aerobio + anaerobio en el 80% de los CT; en el 20% es aerobio. -- En el 40% de los CT el volumen de muestra sembrado en cada medio suele ser de 8-10 mL. En el resto, el volumen es inferior (2-5 mL). Hay 2 CT que no contestan. -- En el 45% de los CT se conserva muestra original, para tener la posibilidad de confirmar o no resultados inicialmente positivos. www.sets.es 7 ARTÍCULOS -- En dos CT se cultivan los CP que caducan en los hospitales. En esta situación, la siembra se hace casi siempre 48 horas después de la caducidad. -- En los los dos últimos años, se detecto crecimiento de bacterias “Staphylococcus coagulasa negativo” en 9 CP y en otros 2 CP crecimiento de otras bacterias gram positivo, estos hallazgos corresponden a 5 CT. Un solo CT confirmo un resultado inicialmente positivo. En 14 CT todos los cultivos efectuados fueron negativos, no respondió 1 CT. •• Respecto a la realización de otros controles -- Se realiza control (volumen, recuento celular) del BC, como producto intermedio, de forma sistemática mensualmente en 4 CT (20%), en uno (5%) trimestralmente, en otros cuatro (20%) con carácter esporádico, motivado por cambios en el dispositivo de fraccionamiento o por procesos de validación. En el resto de CT no se realiza control celular del BC. -- En un CT se cuantifican hematíes por CF. -- En un CT se estudia mensualmente el valor de CD62 al 2º y 5º día, en otros dos se determinan CD62 y parámetros metabólicos ocasionalmente, en el contexto de procesos de validación para introducir alguna modificación, como por ejemplo el tipo de SA. •• Sobre la necesidad de añadir algún otro parámetro al chequeo sistemático, en dos CT se sugiere cuantificar los hematíes en el producto final por CF. •• En relación con la posible planificación de trabajos cooperativos para realizar estudios más exhaustivos de los CP, como cuantificar niveles de citoquinas o micropartículas en muestras que hayan estado implicadas en reacciones transfusionales, o registrar los agregados y analizar las variables que puedan influir, la opinión general es de aceptación, aunque en algún CT se expresa que sería difícil su ejecución. En resumen, de la información recopilada se desprende que: •• Los tipos de fraccionador utilizados son los de última generación, con apertura automática de cánulas, ausencia de compresor y, en algunos casos, sistema automático. •• La elaboración de CP-pool procede de BC en el 85% de los CT, esto representa el 75% de los CP procedentes de ST y el 67% de la producción total de plaquetas. •• En todos los CT se mantienen controladas las condiciones de temperatura (22 ± 2 ºC) desde la colección de ST hasta la distribución del CP. •• Desde la extracción de ST hasta el fraccionamiento trascurre un período de 16-20 horas en el 75% de los CT, lo cual está generalmente condicionado por el horario de las colectas. •• En el 95% de los CT, una vez obtenido el BC o PRP, se 8 www.sets.es mantiene en reposo un mínimo de 1-2 horas. •• Después de la fase de reposo, el BC o PRP se pone en agitación en el 50% de los CT. No parece que la ausencia de agitación tenga repercusión en el componente final. •• El 90 % de los CT utilizan 5 BC para la formación del CP. •• Los medios de suspensión (tipo de SA) que se aplican con más frecuencia son los que tienen en su composición sales de potasio y magnesio (PAS D y E). Tanto las SA como la proporción SA/plasma son muy similares en todos los CT. •• Para la elaboración del CP se utilizan dispositivos semiautomáticos en el 75% de los CT. •• En todos los CP se efectúa inspección macroscópica del CP, especialmente en las primeras horas tras la obtención y antes de la distribución. •• En la inspección del CP se valora la presencia de remolino, agregados y coloraciones anómalas (lipemia, coloración verdosa o amarillenta intensa, presencia de hematíes) en el 100% de los CT. En general no se sigue un método de inspección, aunque hay excepciones. •• Atendiendo a los hallazgos de la inspección, la coloración anómala es el factor que con mayor frecuencia determina el desecho de CP. •• La cantidad media de plaquetas final por unidad oscila entre 3 y 3,5 x 1011, en los CT que inactivan esta cifra es postinactivación. Este dato no se refleja en la etiqueta en la mayoría de los CT. •• Las TRP están implantadas en el 40% de los CT. En estos casos, la caducidad asignada al CP es de 7 días y se elimina la irradiación gamma. •• En dos centros se aplican técnicas de detección de bacterias. •• En relación con la presencia de agregados: -- El 65 % de los CT estiman que su presencia tiene importancia. -- No hay una escala de medición objetiva. -- Raramente se visualizan. Solo un centro los detecta en el 1 % de los CP. -- Los CP con agregados, si estos son pequeños, se distribuyen a los servicios de transfusión. -- Las variables que puedan estar relacionadas con los agregados se citan en dos casos. Un CT encuentra relación con agitación deficiente del PRP y otro con el tipo de SA añadida, si bien en este caso los agregados no son compactos y desaparecen. Algunos centros encuentran asociación con baja temperatura (en algún momento desde la obtención hasta el almacenamiento). •• En relación con los parámetros recomendados para el control de calidad, el grado de cumplimiento, en cuanto a número de unidades chequeadas y valores medios alcanzados en todos los parámetros, se puede considerar aceptable en todos los CT. El apartado de muestras para cultivos microbiológicos es una excepción, ya que el número de unidades a testar debería determinarse de una forma más protocolizada y no solo de forma circunstancial, como ocurre en el 30% de los CT. El marco normativo relacionado con la seguridad microbiológica de los componentes sanguíneos (CS) se apoya en la “Guía de preparación, uso y aseguramiento de la calidad de los CS” del CE (18ª edición, 2015). Indica que cada centro establecerá el número de las muestras a chequear en base a un proceso estadístico y que es prudente retener una muestra. En nuestro entorno, el apartado 4.4.3.6. sobre control microbiológico de los CS de los estándares en transfusión sanguínea (CAT, 4ª edición, 2012) recomienda realizar control bacteriológico al final de la producción o, preferiblemente, al final de la caducidad, al menos a un 1 % de los CP producidos. Hay que señalar que ninguna de las normativas hace referencia, en el apartado del control microbiológico, al nuevo componente (CP tratado con TRP), que es distinto del CP no tratado. •• Se realiza determinación de hemoglobina en todos los CT y hemograma completo a todos los donantes en 7 CT (35%), y se procede en base a los resultados. Así, ante cifras de leucocitos y/o plaquetas fuera de rango, o fórmula leucocitaria anómala, no se da validez al BC o incluso a todos los componentes. •• Algunos CT llevan a cabo controles adicionales, como recuento celular del BC o grado de activación de las plaquetas con el almacenamiento, que sin duda aportan información muy valiosa en relación con la elaboración y almacenamiento del componente. Se pueden establecer algunas consideraciones: •• La exposición a temperaturas bajas en el proceso de obtención, manipulación y almacenamiento, tiene un efecto negativo sobre la plaqueta, propiciando más activación y formación de agregados. Los CP no deben colocarse en superficies frías, y es necesario un cuidado especial si son superficies metálicas. La SA debe estar atemperada, por lo que deben estar vigiladas las condiciones térmicas durante su almacenamiento. •• Se deben mantener controladas las condiciones de temperatura (22 ± 2 ºC) desde la colección hasta la distribución. •• Es importante mantener el BC o PRP en reposo tras la obtención, al menos una hora. •• Es conveniente colocar los CP con la etiqueta hacia abajo, durante el almacenamiento, de forma que haya más superficie de bolsa libre para favorecer el inter- cambio gaseoso a través del plástico. •• La inspección de los CP debería estandarizarse lo máximo posible para que los hallazgos obtenidos sean comparables. Así, podría establecerse: -- La realización sistemática de la inspección del remolino por su fácil ejecución, y utilizar una escala de valoración única como puede ser de 0 a 2 (0 = no remolino, 1 = intermedio y 2 = patente) según estableció el grupo BEST (Biomedical Excellence for Safer Transfusion ).5 -- La eliminación de los CP con presencia de agregados evidentes, y que persisten a las 24 horas postproducción. -- La eliminación de los CP con ausencia total de remolino. •• El control del BC (volumen, recuento celular) es importante para conocer la recuperación de plaquetas y el valor del hematócrito, que nos sirve para hacer una estimación del volumen de plasma por BC, y así poder aquilatar la proporción final de plasma/SA en el CP. •• Finalmente, una reseña sobre las pruebas in vitro que se pueden aplicar a los CP, ya que la fisiología in vivo de las plaquetas transfundidas es un campo de difícil estudio, no solo en la ejecucción sino también por las cuestiones de índole ética que plantea. Hay algunos test in vitro que guardan cierta correlación con la viabilidad de la plaqueta tras la transfusión, como son la respuesta al shock hipotónico6 (HSR, hypotonic shock response), el mantenimiento de la morfología después de la estimulación con ADP (ESC, extend of shape change), la visualización del “remolino”7, el valor del pH8, la concentración de lactato, la expresión de CD62, los niveles de glucosa o los mediadores bioactivos. No obstante, solamente algunos pueden aplicarse en rutina. También se ha intentado dar una puntuación a la combinación de algunos de ellos (lactato, CD62, anexina V, pH) y relacionarla con la calidad de las plaquetas9. •• En los últimos años se han probado tecnologías como el ThromboLUX™, que utiliza el principio de la dispersión dinámica de la luz para valorar la forma y la respuesta de la plaqueta al estrés de la temperatura10. La aplicación de la técnica es fácil, pero los resultados aún no son concluyentes10,11. •• En resumen, aunque no existe un único test capaz de predecir el comportamiento de la plaqueta in vivo, sí disponemos de una batería de pruebas in vitro que, elegidas convenientemente, pueden predecir en parte la eficacia de la transfusión. Las pruebas in vitro siguen realizándose porque constituyen un chequeo del proceso y aportan información útil para eliminar los productos que sean claramente deficientes. Sería importante estandarizar las pruebas mencionadas, www.sets.es 9 ARTÍCULOS para que no haya diferencias en la metodología y sea posible la compatibilidad inter-laboratorio. Además se deberían compartir los resultados y experiencias entre los distintos centros como herramienta de mejora. Bibliografía 1. Real Decreto 1088/2005 de 16 de septiembre. BOE núm. 225 del 20 de septiembre de 2005. 2. Castrillo A, Alvarez I, Tolksdorf F. In vitro evaluation of platelet concentrates suspended in additive solution and treated for pathogen reduction: effects of clumping formation. Blood Transfus. 2015; 13: 281-6. 3. Guide to the preparation, use and quality assurance of blood components. 18th edition. Strasbourg, Council of Europe, 2015. 4. Estándares en transfusión sanguínea. CAT, 4ª edición, 2012. 5. Bertolini F, Murphy S. A multicentre evaluation of reproducibility of swirling. Biomedical excellence for safer Transfusion (BEST). Transfusion 1994; 34: 796801. 6. Holme S, Moroff G, Murphy S. A multi-laboratory evaluation of in vitro platelet assays: the tests for extend of shape change and response to hypotonic shock. Transfusion. 1998; 38: 31-40. 7. Bertolini F, Agazzi A, Peccatori F, et al. The absence of swirling in platelet concentrates is highly predictive of poor post-transfusion platelet count increments 10 www.sets.es and increased risk of a transfusion reaction. Transfusion. 2000; 40: 121. 8. van der Meer PF, Pietersz RNI, Reesink HW. Storage of platelets in additive solution for up to 12 days with maintenance of good in vitro quality. Transfusión 2004; 44: 1204-11. 9. van der Meer PF, Kerkhoffs J, Curvers J, et al. In vitro comparison of platelet storage in plasma and in four platelet additive solutions, and the effect of pathogen reduction: a proposal for an in vitro rating system.Vox Sang. 2010; 98: 517-24. 10. Kraemer L, Raczat T, Weiss DR, et al. Correlation of the hypotonic shock response and extent of shape change with the new ThromboLUX™. Vox Sang. 2015; 109: 194-6. 11. Galloway-Haskins R, Heaton W, Maurer E, et al. Dynamic light scattering evaluation of pre-transfusion PAS & plasma platelet concentrates. Vox Sang. 2014; 10 ARTÍCULOS Hematíes de fenotipo “raro” en España: actividad 2014 y estado actual (Marzo 2015) E Muñiz-Diaz1, ML Ayape2, A Castro3, E Flores4, L Larrea5, M Pérez-Vaquero6, F Puente7 Banc de Sang i Teixits de Cataluña1, Banco de Sangre de Navarra2, Centro de Transfusión de Galicia3, Centro de Transfusión de la Comunidad de Madrid4, Centro de Transfusión de la Comunidad Valenciana5, Centro Vasco de Transfusión y Tejidos humanos6, Banco de Sangre y Tejidos de Aragón7. E n la Tabla 1 se presenta la relación de unidades criopreservadas con fenotipo poco común (Marzo 2015) conservadas en el Banc de Sang i Teixits de Cataluña, en el Centro de Transfusión de Galicia, en el Centro de Transfusión de la Comunidad de Madrid y en el Centro de Transfusión de la Comunidad Valenciana. A estos Centros se han sumado el Banco de Sangre de Navarra, el Banco de Sangre y Tejidos de Aragón y, en el último año, el Centro Vasco de Transfusión aportando donantes con fenotipos raros. En el presente informe también se incluye la actividad desarrollada en el curso del año 2014 (Tabla 2) que consistió en la distribución de un total de 108 unidades de fenotipo poco común (50 congeladas-descongela- das y 58 en fresco) con la distribución de los fenotipos según el grupo ABO. En la Tabla 3 se muestra la relación de fenotipo “raros” presentes en los donantes de seis de los siete Centros de Transfusión que conforman el “Grupo de trabajo de hematíes de fenotipo poco común de la SETS”. Actualmente la relación incluye un total de 466 donantes susceptibles de ser convocados en situaciones de urgencia. Finalmente, queremos recordar que esta misma información puede consultarse permanentemente en la página web de la SETS, así como el procedimiento de solicitud y los correspondientes formularios para la solicitud de unidades y para la confirmación de la recepción de las mismas. Tabla 1. Relación de unidades de fenotipo raro criopreservadas en España (Marzo 2015) ISBT KEL: - 2 KEL: - 4 KEL: -1,-2,-3,-4 LU: - 2 LU: - 1, - 2 P1P1pk neg Vel neg FY: - 1, - 2 JK: - 1, - 2 CO: - 1 DI: - 2 YT: -1 Jra neg JMH Lan neg MNS: -3, -4 MNS: - 5 GLOB GLOB Descripción KK Kp (a+ b-) Ko Lu (a+ b-) Lu ( a- b-) Tj ( a -) Vel neg Fy ( a- b-) Jk (a- b-) Co ( a-) Di ( b-) Yt ( a-) Jr ( a-) JMH Lan (-) S (-) s (-) UPk +, anti P P- , anti P Bombay (Oh) r’ r’ r’’ r’’ r’ r’’ Rz Rz -D-/-D- A+ 25 12 12 17 4 8 5 6 5 12 A18 2 10 1 3 3 9 3 O+ 86 15 38 4 32 21 32 25 16 17 8 5 6 5 6 4 6 O60 38 2 43 5 15 38 3 4 6 9 1 2 1 19 7 2 AB + 1 1 1 1 AB 1 1 B+ 19 2 B 3 TOTAL: TOTAL 189 69 2 96 4 74 51 79 7 34 18 32 22 6 8 6 7 0 0 4 28 10 2 6 12 766 www.sets.es 11 ARTÍCULOS Tabla 2. Relación de unidades de concentrados de hematíes con fenotipos raros que se distribuyeron durante el año 2014 en España. La relación incluye tanto los hematíes descongelados como los frescos. ISBT KEL: - 2 KEL: - 4 LU: - 2 P1P1pk neg Vel neg FY: - 1, - 2 YT: -1 Jra neg MNS: - 5 TOTAL Descripción KK Kp (a+ b-) Lu (a+ b-) Tj ( a -) Vel neg Fy ( a- b-) Yt ( a-) Jr ( a-) UBombay (Oh) r’ r’ Descongelados 4 21 2 2 1 2 7 1 7 1 2 50 Frescos 8 16 1 2 16 9 4 2 58 TOTAL 12 37 3 4 17 11 11 1 7 1 4 108 Tabla 3. Relación de donantes con fenotipo poco común en España (Marzo 2015). ISBT KEL: - 2 KEL: - 4 LU: - 2 LU: - 1, - 2 P1P1pk neg Vel neg FY: - 1, - 2 JK: - 1, - 2 CO: - 1 DI: - 2 YT: -1 Jra neg MNS: -3, -4 MNS: - 5 GLOB 12 www.sets.es Descripción KK Kp (a+ b-) Lu (a+ b-) Lu ( a- b-) Tj ( a -) Vel neg Fy ( a- b-) Jk (a- b-) Co ( a-) Di ( b-) Yt ( a-) Jr ( a-) S (-) s (-) UP- , anti P Bombay (Oh) r’ r’ r’ r’’ r’’ r’’ Rz Rz -D-/-DDOLCHPA- (1a-) A+ 32 6 6 0 11 5 1 0 4 0 2 1 0 3 0 0 2 0 0 0 0 0 23 A10 0 6 0 0 4 3 1 2 0 0 0 0 1 0 0 0 0 1 0 5 0 9 O+ 52 7 34 2 10 5 10 0 15 3 8 2 1 2 2 1 1 0 0 1 0 1 11 O33 14 28 0 1 7 13 1 6 0 0 2 1 2 0 0 10 2 1 0 0 0 19 AB + 2 1 1 0 2 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 B+ 2 0 0 0 3 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 B0 1 0 0 0 0 1 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 TOTAL 131 29 75 2 27 22 29 2 27 3 10 5 2 9 2 1 14 2 2 1 5 1 65 TOTAL: 466 INFORMES Resumen del informe "Actividad Centros y servicios de transfusión" (año 2014) Unidad de Hemoterapia Subdirección General de Promoción de la Salud y Epidemiología. Dirección General de Salud Pública, Calidad e Innovación. L a unidad de Hemoterapia del Ministerio de Sanidad ha publicado el informe correspondiente a la actividad de los Centros y Servicios de Transfusión correspondiente al año 2014. Considerando la importancia del mismo se ha redactado un resumen en los que se recogen los datos más relevantes especialmente la variación detectada en los dos últimos años (2013-14). El Sistema de Información del Sistema Nacional para la Seguridad Transfusional (SI-SNST) se alimenta del registro de Actividad de los Centros y Servicios de Transfusión (objeto del presente informe), y del registro del Sistema de Hemovigilancia. Los datos han sido aportados por los 23 Centros de Transfusión Sanguínea pertenecientes a las 17 CCAA*, y por más de 400 Servicios Hospitalarios de Transfusión (públicos y privados), a través de la aplicación Web desarrollada por el MSSSI. La información ha sido previamente validada por cada CCAA. El informe incluye datos de los últimos 5 años al objeto de reflejar tendencias, y resalta expresamente el último año considerado (2014). A efectos comparativos se han utilizados dos fuentes de datos complementarias: 1. Council of Europe.“Questionnaire on the collection, testing and use of blood components”. Final report 2012 data (2015), y 2.Commission European. DG SANTE D4. SARE annual reporting 2014 data. Preliminary Results. Previo a su publicación, ha sido revisado y analizado por el Comité Científico para la Seguridad Transfusional (CCST). Donaciones El 97% de las donaciones obtenidas proceden de sangre total. El índice de donación ha sido de 36,21 por 1000 hab. Si bien se observa una tendencia descendente, igual que ocurre en el resto de Europa, esta se corresponde con una disminución de la actividad transfusional. Media europea: 36 por 1000 hab. Media europea: 3,9 litros plasma por 1000 hab. rango 0-47, mediana 0,4 litros España: 0,6 litros por 1000 hab. Aféresis La obtención de componentes sanguíneos por aféresis sigue manteniéndose en cifras bajas. La obtención de plasma por plasmaféresis en el 2014 ha sido 26.663 litros. Se destaca un acusado descenso en los procesos de tromboféresis. % Variación 2013-2014 Plasmaféresis Multicomponente Eritroféresis Tromboféresis Leucocitoféresis 22,63 -0,63 -10,99 -31,03 0,00 Obtención de componentes sanguíneos Se observa una ligera disminución en la obtención de unidades de hematíes, acorde con la menor demanda hospitalaria actual. Media europea. 36 CH por 1000 hab. España: 34 CH por 1.000 hab. Transfusión En el 2014, la cantidad total de CS transfundidos ha sido de 1.874.121. Media UE. 42,7 CS por 1000 hab.:75% Hematíes, 9,96% plaquetas; 14, 23% plasma España. 40,48 CS por 1000 hab.:79,6% Hematíes, 10,3% plaquetas, 9,9% plasma. Plasma enviado a Industria Fraccionadora Conforme al objetivo de alcanzar la autosuficiencia en derivados plasmáticos basada en DVNR, los CTS envían a la industria fraccionadora el excedente de plasma no utilizado en transfusión. El volumen enviado en 2014 ascendió a 367.235 litros, que a efectos comparativos corresponde a 8 litros por 1000 habitantes (99% de plasma recuperado). % Variación 2013-2014 PFC (L) PC (L) Total -0,92 0,00 -0,92 www.sets.es 13 INFORMES Media en Europa: 10 litros por 1000 habitantes. 60% de plasma recuperado (rango 0-100, mediana 65). Marcadores Obligatorios Derivados Plasmáticos Producción Albúmina (Gr) Igs (Gr) Factor VIII (Ul) % Variación 2013-2014 14,25 7,96 10,97 Consumo Las cifras que se presentan corresponden al consumo de toda la red hospitalaria (centros públicos y privados),e incluye tanto el consumo de derivados elaborados a partir del plasma obtenido en los CTS del país, como el consumo procedente de las compras de los hospitales a las compañías farmacéuticas. % Variación 2013-2014 Albúmina (Gr) Igs (Gr) Factor VIII (Ul) 5,96 5,50 8,50 Donantes El número y evolución de los donantes registrados según categorías queda recogido en el cuadro siguiente. En 2014 el nº de donantes activos en la población general ha sido de 25 por 1000 hab. Esta cifra indica la existencia de una base de donantes suficiente para garantizar el suministro de sangre. De estos, el 18,5% han sido donantes de primera vez. La tasa total de exclusión (porcentaje total de donantes excluidos de forma temporal o permanente) ha sido en el último año del 16%. Los porcentajes de distribución en temporal y permanente son similares a los países de nuestro entorno. Media europea: 24 donantes por 1000 hab.; rango 3 - 44; 23% donantes nuevos. Media europea: tasa de exclusión 15%, rango 6 - 28%. Excl. Temporal 90%, permanente 10% % Variación 2013-2014 Donantes Nuevos -2,15 Donantes Habituales -0,10 Donantes Conocidos -0,26 Total Donantes -0,50 Donantes excluidos Indice exc temporal Indice exc. Permanente Indice exclusión 14 www.sets.es Laboratorio 2014 14,54 1,91 16,44 Prevalencia x 100.000 hab 7,84 11,25 24,41 37,87 VIH VHC VHB LUES Donaciones (+) detectadas en periodo ventana últimos 5 años VIH (+) Excl. NAT VHC (+) Excl. NAT VHB (+) Excl. NAT 2010 2011 2012 2013 2014 4 5 4 6 4 1 4 2 0 5 72 100 71 64 78 Otros Marcadores Los resultados de la detección del T. Cruzi (Enf. De Chagas) y del Paludismo comienzan a registrase por el SISNST a partir del 2004 y 2010 respectivamente. En la actualidad, todos los CTS realizan testado de ambos marcadores de forma selectiva. 5 CTS han incluido en su rutina habitual el test de detección del HTLV-I-II y se realiza selectivamente en 8. No ha sido necesario cribado del VNO al no haberse producido casos humanos. En el 2014 la prevalencia de dichos marcadores es la reflejada en la siguiente tabla: T. CRUZI MALARIA HTLV-I-II VNO U. Testadas 98.554 14.033 512.757 0 Positivos 77 109 16 - % 0,0781 0,7767 0,0031 - Autotransfusión Prosigue la tendencia decreciente en donación autóloga. En el 2014 ha constituido el 0,28% de las donaciones totales, resultados coincidentes con los comunicados en la mayoría de los países europeos. Control de Calidad Centros de Transfusión Sistemas de Calidad e Inspección Los Sistemas de Calidad (SQ) deben asegurar que los productos obtenidos cumplen los requisitos previamente establecidos, e incluyen un conjunto de actividades dirigidas al control directo de la calidad. La inspección es parte fundamental del procedimiento para garantizar su cumplimiento, y actividad clave de los Sistemas de Calidad. Los CTS se someten a certificaciones periódicas por diferentes organismos. Sistemas de Identificación de Componentes Sanguíneos (CS) y Trazabilidad 11 CTS utilizan el sistema de codificación ISBT-128, dando cobertura al 75% de las donaciones totales en España en el 2014. 14 CTS disponen de aplicaciones informáticas conectadas con los ST como medio de garantizar la trazabilidad donante – receptor. Servicios de Transfusión El 60,61 % de los ST disponen de un Sistema de Gestión de la Calidad, que incluye procedimientos normalizados de trabajo. En el 65,36% se trata del Sistema ISO 9000. Al mismo tiempo, la práctica totalidad de los ST disponen de una Guía clínica para transfusión de componentes (84,2%). El 63,64 % de los ST han sido inspeccionados por la autoridad sanitaria de la CA correspondiente, y 88 Servicios indican que han sido certificados por el CAT (19,05%). En 356 hospitales existe Comité Hospitalario de Transfusión (77,06%), siendo la media del nº de reuniones de 2,67, la mediana 2 y la moda 2. 408 Hospitales tienen implantado un sistema de Hemovigilancia (88,31%), y de estos, 197 cuentan con personal específicamente asignado a esta tarea. El 78,79% de ST disponen de aplicación informática específica para el control transfusional y el 75,11% tienen implantado algún tipo de sistema de seguridad para evitar errores en la administración de componentes. www.sets.es 15 PREMIOS SETS 2015 Actuaciones para disminuir las reacciones vasovagales con pérdida de conocimiento en donantes N.Nomen Calvet, M.Sáez Bruguera, M.N.Vilanova Cabayol, S.García Núñez, A.Mingo Sánchez, S.Tejedor Pages, J.A.Pellejero Gómez, C.Pastoret Pascal, G.Cortel Mañé, P.Ortíz Murillo, Ll.Massuet Bosch. Banc de Sang i Teixits. Barcelona Objetivos Conocer las reacciones vasovagales (RVV) retardadas con pérdida de conocimiento, que se producen fuera de la unidad de donación y fuera de la atención del personal de donación, tras una donación de sangre o aféresis. Material y Métodos En febrero de 2012 se inició en nuestro Centro de Transfusión un proyecto de seguimiento de los donantes de primera vez con una doble finalidad: fidelizar a los donantes y detectar las reacciones adversas retardadas (después de abandonar unidad de donación). Hasta diciembre de 2014, se contactaron telefonicamente, en los 15 días postdonación 46.859 donantes, detectándose 4.064 reacciones adversas retardadas (RAR), de éstas 2.969 fueron RVV, 148 de las cuales presentaron pérdida de conocimiento, representa el 0,31% de los donantes contactados. Resultados Tabla.1- Resultados de las RVV con pérdida de conocimiento de las llamadas telefónicas por centro. Centro 1 Centro 2 Centro 3 Centro 4 Centro 5 Centro 6 Centro 7 Centro 8 Centro 9 E. Móvil 1 E. Móvil 2 E. Móvil 3 E. Móvil 4 Total Donantes Pérdidas de Hombres Mujeres contactados conocimiento 1.796 5 (0,27%) 2 3 2.335 11 (0,47%) 3 8 1.987 7 (0,35%) 3 4 5.485 45 (0,82%) 4 41 4.752 22 (0,46%) 2 20 3.116 13 (0,41%) 1 12 1.657 5 (0,30%) 3 2 3.311 6 (0,18%) 3 3 704 1 (0,14%) 0 1 6.803 17 (0,25%) 0 17 2.901 3 (0,10%) 1 2 7.862 9 (0,11%) 3 6 4.150 4 (0,10%) 1 3 46.859 148 (0,31%) 26 (17,5%) 122 (82,5%) Si comparamos los resultados de los distintos centros fijos vemos una variabilidad que oscila entre el 0,14% y el 0,82%, por el contrario el resultado en los equipos móviles es mucho más homogéneo y con un porcentaje menor, variabilidad entre el 0,10% y el 0,25%. El 82,5% son mujeres y el 17,5% son hombres. Con estos resultados se creó un grupo de trabajo para estudiar estrategias de cómo disminuir las RVV retardadas y incorporarlas en la atención al donante. Se realizó una revisión bibliográfica y se consensuaron los siguientes puntos: •• La necesidad de informar a los donantes de cómo actuar en caso de RVV, explicando la forma de reconocer y de actuar ante los primeros síntomas de una RVV, ya que aunque esto aumente la incidencia, disminuye la gravedad. •• Los donantes no han de estar en ayunas y han de estar bien hidratados. •• Identificar a los donantes más susceptibles de RVV (mujeres, primera donación, antecedentes de RVV, tensión arterial superior a la habitual por nerviosismo, stress, poco tiempo disponible, etc), a los que se explicarán los ejercicios de tensión muscular para favorecer el retorno venoso, mediante movimientos de contracción periódica (cruzar las piernas y contraerlas cada 5 segundos movilizando toda la musculatura). Esta información debe abarcar cada paso de la donación: selección, extracción y refrigerio. Durante la selección, el entrevistador ha de comprobar que el donante no esté en ayunas, ofreciéndole un pequeño refrigerio en este caso y su correcta hidratación en la hora previa a la donación, recomendando la ingesta de agua principalmente si el donante no ha bebido lo suficiente o dice tener sed. Es el entrevistador quien identificará a los más susceptibles de RVV y lo marcará en la ficha. Durante la donación el enfermero potenciará los cuidados: •• Atendiendo de manera personalizada al donante, www.sets.es 17 PREMIOS SETS 2015 Fig. 1-2 posición en Trendelemburg + ejercicio de tensión muscular el enfermero se ha de presentar y ha de aprender el nombre del donante. •• Adecuando las prendas de ropa a la temperatura de la sala. •• Realizando una atención psicológica. •• Explicando cómo reaccionar ante los primeros síntomas de RVV, informar, no asustar. •• Aplicando a los donantes más susceptibles que vendrán marcados por el entrevistador o ante la aparición de síntomas de RVV los ejercicios de tensión muscular para favorecer el retorno venoso. Estos donantes se instalarán en posición Trendelemburg. Al donante, se le entregará un documento con las recomendaciones postdonación, se utiliza la hoja anexa del cuestionario de donación que contiene el consentimiento y los criterios de autoexclusión para añadir estas recomendaciones. 18 www.sets.es Fig. 3 Acción sobre las venas y el flujo sanguíneo de la tensión muscular. •• No fumar ni beber alcohol durante las primeras horas. •• Incorporar líquidos abundantes y elementos salados a la dieta habitual durante las 24-48 horas siguientes. •• No realizar deporte ni actividades de riesgo durante las siguientes 12-24 horas. •• Reemprender, lo más pronto posible, una actividad normal evitando el exceso de calor y de ejercicio y las situaciones de peligro. En la zona de refrigerio se dispone de dicha información en formato sobremesa tamaño Din A4. Conclusiones El contacto telefónico posterior a la donación nos ayuda a conocer y cuantificar todas las reacciones adversas retardadas. El grupo de trabajo ha sido una herramienta para que el personal que atiende al donante tome conciencia del riesgo de estas reacciones retardadas y se comunique activamente con el donante para realizar una atención personalizada. Bibliografía • Analysis of a questionnaire on adverse reactions to blood donation in Japan S. Inaba *, M. Takanashi, K. Matsuzaki, Y. Ono, K. Nakajima, R. Shibata, K. Tadokoro,Y. Ishikawa, N. Kinukawa Japanese Red Cross, Kanagawa Blood Center, Tokyo Metropolitan Blood Center, Headquarters of the Japan Blood Center,Central Blood Research Institute, Information Service of Kyushu University Hospital, Japan Transfusion and Apheresis Science 48 (2013) 21–34 • Effects of applied muscle tension on the likelihood of blood donor return Blaine Ditto, Christopher R. France, Michael Albert, Nelson Byrne, and Julie Smyth-Laporte TRANSFUSION 2009;49:858-862 • Predonation hydration and applied muscle tension combine to reduce presyncopal reactions to blood donation Christopher R. France, Blaine Ditto, Mary Ellen Wissel, Janis L. France, Tara Dickert, Aaron Rader, Kadian Sinclair, Sarah McGlone, Zina Trost, and Erin Matson TRANSFUSION 2010;50:1257-1264. • Interventions to reduce the vasovagal reaction rate in young whole blood donors Peter Tomasulo, Hany Kamel, Marjorie Bravo, Robert C. James, and Brian Custer TRANSFUSION 2011;51:1511-1521. www.sets.es 19 UNA IMAGEN VALE MÁS QUE MIL PALABRAS Una imagen vale más que mil palabras Dra. Virginia Callao S e presenta en esta ocasión unas imágenes proporcionadas a la CGIAMT por Isabel Terrón. Técnico especialista de laboratorio, Luisa Más. Técnico especialista de laboratorio Dra. Virginia Callao, Médico especialista en Hematología y Hemoterapia. Laboratorio de Inmunohematología. Centro de Transfusión de la Comunidad Valenciana Fenotipaje eritrocitario en casos de pdag positiva La determinación del fenotipo extendido en los hematíes de los pacientes o donantes que tienen una prueba directa de antiglobulina positiva es difícil, ya que dicha positividad interfiere con los resultados de los fenotipos que requieren de una técnica de antiglobulina (ej. sistemas Duffy y MNS). Para conseguir unos resultados correctos, se puede realizar una técnica de elución previa de los hematíes, con lo que se conseguiría eliminar las interferencias con la técnica del fenotipo. La técnica de elución elegida debería ser capaz de disociar las inmunoglobulinas adheridas a la membrana de los hematíes, con el mínimo daño de la misma y sin alterar la expresión antigénica. La técnica de EDTA glicina ácida ha demostrado ser el método de elección, frente a otros métodos como el método de calor y el de cloroquina. En nuestras manos, la técnica de elución con EDTA-Glicina convencional, produce una hemólisis importante de los hematíes, que atribuimos a la acidez del suero salino y que dificulta en gran manera el tipaje posterior. La modificación de la técnica de EDTA glicina ácida, utilizando una solución tampón para los lavados y conservación de los hematíes durante todo el proceso (“Tampón de monocapas formado por NaCl 0.07M, Glucosa 0.1M, ác, bórico 0.02M, Citrato tri-sódico 0.035M, EDTA tetrasódico 0.002M, Neomicina, Cloranfenicol y agua destilada, ph: 7.2-7.3. (Llopis et al)), en lugar de suero salino, nos permite obtener hematíes libres de inmunoglobulinas y complemento dispuestos para su fenotipaje, con la mínima afectación de la membrana. Hemos realizado el estudio de 58 muestras, 23 de donantes y 35 de pacientes, con PDAG positiva (en la gran mayoría por IgG, con intensidad >3+), obteniendo en el 85% y 54% de casos respectivamente la negativización total de la PDAG y facilitándose el fenotipaje de los antígenos Fya, Fyb, S y s. En caso de los 23 donantes, se ha podido demostrar una concordancia del fenotipo con el histórico en el 100% de casos. A la vista de nuestros resultados, se evidencia que nuestra técnica de EDTA-Glicina modificada, permite despegar las moléculas adheridas a los hematíes problema, dejando los hematíes intactos y con las membranas libres para su posterior fenotipado sin interferencias, en la mayoría de casos. Referencias • LLopis F et al. A new microplate red blood cell monolayer technique for screening and identifying red blood cell antibodies • Vox Sang 1996;70:152-156 • Burin des Rozier, Squalli S. Removing IgG antibodies from intact red cells: comparison of acid EDTA, heat, and chloroquine elution methods. • Transfusion. 1997;37:497-501 • Kosanke J. EDTA glycine acid treatment of red blood cells. • Immunohematology. 2012;28(3):95-6. • Katharia R, Chaudary RK. Removal of antibodies from red cells: comparison of three elution methods. • Asian J Transfus Sci. 2013 Jan-Jun; 7(1):29-32 www.sets.es 21 HEMEROTECA CLÍNICA Medicina Transfusional en los pacientes geriátricos: Necesidades específicas Dr. Iñigo Romón. Hospital Marqués de Valdecilla. Santander M uchos Servicios de Salud han implantado o están implantando sistemas de información corporativos con la intención de mejorar la atención a los pacientes. Se supone que la informatización de las actividades permitirá tanto gestionarlas mejor (evitando duplicaciones, errores o ayudando a la petición de pruebas mediante algoritmos expertos) como mejorar el análisis de la actividad (actividad, tendencias, datos individualizados de pacientes…) Sin embargo, se detecta falta de preparación para aprovechar las ventajas que aporta este cambio: las implantaciones se hacen sin contar con los profesionales, o no se cuenta con las competencias o profesional experto para aprovecharlas. El artículo que comentamos es muy sencillo, pero plantea problemas con los que nos vamos a enfrentar en breve. K. Pendry. The use of big data in transfusion medicine. Transfusion Medicine, 2015, 25, 129–137 El término Big Data se refiere a la enorme cantidad de datos almacenados que describen la actividad humana. En el ámbito sanitario, los datos contenidos en la Historia Clínica Electrónica que puede ser utilizada para la mejora de los resultados de los pacientes. Este aprovechamiento se enfrenta a grandes retos, que pueden ser: Los retos del “Big data”: •• Governanza de la información: protección de la confidencialidad, el uso únicamente asistencial y sobre todo cesión de los datos a terceros. •• Preparar al personal para el manejo de esta información, a todos los niveles profesionales, formar personal técnico informático capacitado para comprender el medio sanitario, etc. •• Barreras tecnocráticas: las relacionadas con la propia tecnología, el almacenamiento (nube, etc.), e interoperatividad, capacidad de búsqueda mediante lenguaje natural (en el que se encuentra la mayoría de las historias clínicas…) 22 www.sets.es La innovación digital en el laboratorio: Los laboratorios tienen una gran capacidad para mejorar la atención de los pacientes. Sin embargo, en la actualidad existe una gran división de sistemas infomáticos entre laboratorios y no existe un standard común para esos sistemas. En el UK se ha organizado un grupo de trabajo para crear un standard común. Ejemplos de la innovación digital en el laboratorio de transfusión La innovación digital en la transfusión puede tener aplicación para : •• Benchmarking: identificar y usar datos nacionales relevantes para mediante talleres periódicos específicos mejorar la atención. El movimiento PBM y el descenso en las trasfusiones pueden ser un buen ejemplo de este uso. Existen experiencias de este tipo en Finlandia y Escocia, donde la transfusión perioperatoria se analiza junto con los datos de los pacientes entre distintos hospitales. Hay proyectos en marcha en Australia y USA. •• Detección de eventos adversos relacionados con la transfusión: el “big data” permite tanto recolectar más fácilmente los datos estructurados de eventos adversos asociados a la transfusión (p. Ej. púrpura postransfusional) como el uso de algoritmos diagnósticos para detectarlos (p. Ej. TACO, TRALI, etc.) •• Caracterización de la práctica transfusional asociando la transfusión a los códigos de ingreso, motivos de transfusión… Los trabajos publicados han demostrado descensos en la transfusión, pero siguen existiendo grandes diferencias en el uso entre hospitales. •• Pruebas de compatibilidad perioperatoria: desde los años 70, cuando se crearon las “órdenes máximas de reserva” se han añadido muchos procedimientos y todos han variado. La revisión de los datos en grandes poblaciones ha permitido ahorros en todos los procesos que no precisan reserva de sangre porque no se usa. El apoyo electrónico a la toma de decisiones: los sistemas electrónicos pueden ayudar a los clínicos a tomar decisiones en función del diagnóstico, situación del paciente y datos analíticos. Existen publicaciones que avalan el descenso de las transfusiones cuando se utilizan estos algoritmos, pero evidentemente hace falta validar estos datos con más estudios. Los retos de cara al futuro (en el Reino Unido): hasta ahora la recogida de datos sobre transfusión ha sido laboriosa y procedente de auditorías muy cuidadosas. Podremos disponer de grandes cantidades de datos que unen la transfusión con la situación clínica del paciente de forma inmediata. Esto también mejorará la elaboración de guías clínicas. Las inversiones para crear una herramienta de este tipo sobre transfusión no son costosas, tanto en su diseño como en la formación del personal como de su mantenimiento y expansión. Se trataría de crear una web donde los servicios de transfusión vieran sus propios resultados y los pudieran comparar con los datos generales. El mínimo de datos necesario sería: •• Diagnóstico del paciente y motivo de e indicación de la transfusión. •• Datos del episodio transfusional (componente, número, etc.) •• Datos de laboratorio pre y post transfusión. •• Datos del ingreso (duración, incidentes, procedimientos aplicados…) Limitaciones: •• Los proyectos de Big Data no pueden ser asumidos por un único hospital, sino que deben ser una apuesta estratégica sanitaria. •• La precisión de los datos depende siempre de los datos que se introduzcan el sistema. Si bien esto puede no tener importancia a nivel general, a nivel de cada paciente puede influenciar la toma de decisiones. Conclusiones: el uso de grandes masas de datos ayudará a la caracterización y la toma de decisiones en transfusión (PBM). El momento de diseñar y poner a punto estas herramientas es ahora, antes de que el despliegue informático sea completo en todo el sistema sanitario, y necesitará un importante esfuerzo de coordinación. Se lanzan las siguientes preguntas: •• ¿Será posible consensuar un conjunto mínimo de datos transfusionales y hacerlos confluir en una única base? •• ¿Será posible crear un modelo único de petición de transfusión que ayude a esta tarea? •• ¿Será posible crear un conjunto mínimo de indicadores de calidad en transfusión? •• ¿Podremos determinar los beneficios del Big Data en la transfusión? Patricia M. Kopko, Paul Warner, Lesley Kresie, and Carol Pancoska. Methods for the selection of platelet products for alloimmune-refractory patients. TRANSFUSION 2015; 55:235–244. La refractariedad a la transfusión de plaquetas es relativamente frecuente, y por lo general multifactorial. La refractariedad de origen inmune no es hablitual, pero presenta un riesgo muy importante para los pacientes, y un elevado consumo de recursos. Este artículo es un resumen del simposio conjunto realizado entre la AABB y la Asociación Americana de Histocompatibilidad e Histogenética sobre la refractariedad plaquetar de origen inmune realizado en 2012. Se analizan tanto los fundamentos teóricos como la situación en diversos hospitales, a la vez que se realiza una encuesta en setenta hospitales sobre los medios de los que disponen y los problemas a los que se enfrentan. Finalmente, se propone un algoritmo de actuación. ¿Por qué es interesante este artículo? Por varios motivos: •• Reafirma la necesidad de caracterizar bien la refractariedad mediante controles seriados, en el momento adecuado (incremento corregido). •• Se explican los fundamentos teóricos y prácticos de las técnicas utilizadas para detectar anticuerpos anti plaquetares, tanto anti HLA como anti HPA (Elisa y Luminiex). Igualmente, se explican las técnicas para tipaje HLA •• Se explican los procedimientos para obtener plaquetas compatibles: realización de una prueba cruzada, la búsqueda de donantes HLA idénticos y el grado de compatibilidad buscado, así como la búsqueda de donantes sin los antígenos HLA indeseados, o la búsqueda de plaquetas basadas en un algoritmo sobre epítopos HLA. En la encuesta se detectan problemas que nos son familiares: •• Diversidad de técnicas para analizar la causa de la refractariedad. •• Técnicas no disponibles en el hospital. •• Los médicos no tienen formación sobre la necesidad o momento de solicitar plaquetas HLA compatibles o seleccionadas. •• Las peticiones innecesarias que complican la situación (p.Ej. solicitud de plaquetas CMV negativas en este tipo de pacientes) Finalmente, propone un algoritmo de actuación que puede ser de gran ayuda en particular en los hospitales o centros de transfusión para gestionar adecuadamente estos casos e incluso plantear proyectos de investigación sobre este grupo de pacientes. El papel de los anticuerpos y sobre todo de la prueba cruzada se ve reforzado www.sets.es 23 HEMEROTECA CLÍNICA En resumen: un interesante artículo, básico pero muy sencillo y pedagógico sobre un problema y una realidad que periódicamente pone a los pacientes en un serio compromiso vital. Gavin J. Murphy y los investigadores del TITRe2. Liberal or Restrictive Transfusion after Cardiac Surgery. N Engl J Med 2015; 372:997-1008. Este es un artículo importante porque traerá cola, esperamos. ¿Por qué? Porque añade un toque de prudencia a la tendencia de la última década sobre la transfusión restrictiva. En los últimos años, los distintos estudios han afirmado que en la mayor parte de los contextos clínicos la transfusión “restrictiva” no sólo era idéntica a la transfusión “liberal”, sino que incluso era mejor. Algunos autores han llegado a proponer realizar ensayos clínicos que permitan verificar si es posible utilizar un umbral de transfusión por debajo del nivel 7 g/dl de Hb. Es cierto que durante todo este tiempo se ha mantenido una zona gris: los pacientes con patología cardiovascular severa crónica o aguda. Este estudio destaca que la transfusión restrictiva no fue superior a la liberal en cuanto a disminución de la mortalidad o de los costes. Los pacientes, mayores de 16 años, se sometían a cirugía cardiaca no urgente. Si el nivel de hemoglobina era menor de 9g/dl, se aleatorizaban para una estrategia liberal (mantener 9 g/dl Hb) o restrictiva (7.5 g/dl). El resultado primario era la infección severa o el accidente isquémico de cualquier territorio. Se calculan los Visita nuestra web: www.sets.es 24 www.sets.es costes no directamente imputables a la cirugía. Ambos resultados se calculan durante los tres primeros meses de la intervención. Se reclutan 1000 pacientes en cada rama. La tasa de transfusión es del 54% en la rama restrictiva vs 92% en la rama liberal. Los resultados primarios del estudio fueron algo más frecuentes en el grupo restrictivo que en el liberal pero sin significatividad estadística. No hubo diferencia en los costes. En cambio, la mortalidad fue mayor en el grupo restrictivo que en liberal (4.2% vs 2.6%) El estudio está rigurosamente realizado, el número de pacientes enrolado supera con mucho a todos los estudios previos, recoge datos analíticos periquirúrgicos, y aborda el seguimiento perioperatorio. ¿Quiere decir que la transfusión liberal es la nueva norma en la cirugía cardiovascular? No, el estudio no encuentra diferencia entre ambos grupos, cuando el enfoque liberal da por supuesto que la cifra más elevada mejoraría el estatus del paciente. Es cierto que se detectó una menor mortalidad con este enfoque, pero es un hallazgo secundario y que no se preveía en función de las complicaciones perioperatorias. En resumen, un importante artículo para leer rigurosamente y para poner en valor una vez más eso que se llama “criterio clínico” que no es arbitrariedad sino la aplicación del sentido común a la práctica clínica. Os gustará el editorial que se merece: John Spertus . “TITRe”ing the Approach to Transfusions after Cardiac Surgery. N Engl J Med 372; 11:106-70. BOLETÍN DE INSCRIPCIÓN DE LA SETS Boletín de inscripción de la SETS Remitir a: SETS – C/ Marià Cubí, 4 – 08006 Barcelona Tel. 932 388 777 – Fax 932 387 488 [email protected] DATOS PERSONALES 1. Apellidos y nombre:_____________________________________________________________________________________ 2. Domicilio particular:___________________________________________________________ D.P.:______________________ Localidad:_________________________________ Provincia:__________________________ Teléfono:__________________ Email:_____________________________________ DATOS DE LA INSTITUCIÓN O LUGAR DE TRABAJO 3.Denominación_________________________________________________________________________________________: Dirección:_________________________________________________________________________ D.P.:________________ Localidad:_________________________________ Provincia:__________________________ Teléfono:__________________ E-mail____________________________________ 4. Indique la dirección preferida para su correspondencia: c Particular c Laboral 5. Marque si desea recibir publicidad de las empresas del sector: c SI c NO CURRICULUM DEL SOLICITANTE: Profesión:_____________________________________ Título:_________________ Grado académico:_______________________ Especialidad:___________________________________________ Otros títulos:________________________________________ Puesto que ocupa en su organización:__________________________________________________________________________ Áreas principales de trabajo:__________________________________________________________________________________ Otros puestos desempeñados con anterioridad y fechas:___________________________________________________________ SOCIOS QUE AVALAN SU SOLICITUD DE INGRESO EN LA SETS: A) Apellidos y nombre:________________________________________________ Lugar de trabajo:____________________________________________________ Provincia:______________________________ B) Apellidos y nombre:________________________________________________ Lugar de trabajo:____________________________________________________ Provincia:______________________________ De ser admitida mi solicitud, declaro aceptar los estatutos de la SETS y comprometerme a su cumplimiento. Adjunto orden a mi entidad bancaria para el cobro de las cuotas de la SETS. ! Fecha:________________________________________________ Firma:_____________________________________________ Sr. Director: Entidad:____________________________________________________________ Oficina:________________________________ Domicilio:_______________________________________ Localidad:_______________________ Provincia:__________________ Autorizo el cobro de los recibos que con cargo a mi cuenta bancaria cuyo código IBAN es:________________________________ de esa entidad, pase periódicamente la Sociedad Española de Transfusión Sanguínea. Fecha:________________________________________________ Firma:_____________________________________________ NOTA: Los datos que nos facilite el usuario se incorporarán a un fichero de Grupo Pacífico, inscrita en el Registro General de Protección de Datos (Agencia de Protección de datos). Grupo Pacífico es una mera depositaria del fichero de datos, la propiedad pertenece a la SETS y lo utilizará con el fin exclusivo de mantener informado al usuario de actividades relacionadas con la Sociedad Española de Transfusión Sanguínea y Terapia Celular. De conformidad con la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal. Cualquier usuario puede ejercitar los derechos de oposición, acceso, rectificación y cancelación de los datos facilitados dirigiéndose por escrito al siguiente domicilio: Grupo Pacífico, Marià Cubí, 4. 08006 Barcelona. www.sets.es 25 OBITUARIO Dr. Don Crisógono de la Cámara Mendizábal Aurora Viejo Llorente. Jefe de Sección de Hematología-Hemoterapia. Hospital Universitario La Paz. R ecientemente ha fallecido el Dr. Crisógono de la Cámara Mendizábal, conocido familiarmente, por todos los hematólogos, especialmente por los dedicados a la Medicina Transfusional, por el nombre de “Criso”. Ejerció su actividad profesional tanto en la medicina pública como en la privada. En el Hospital Universitario La Paz se incorporó procedente de la Sanidad Militar, desde la creación de este hospital en 1964 hasta su ju- Fotografía cedida por el Dr. Antonio González. De izquierda a derecha Dr. Félix Omeñaca, neonatólogo; Dr. Antonio González, obstetra; Dr. Criso de la Cámara. 26 www.sets.es bilación en diciembre de 2001, contribuyendo por tanto, en parte, al nacimiento y desarrollo de los grandes hospitales de la Seguridad Social. Durante todos estos años desarrolló una fecunda labor. Trabajó en la implantación y desarrollo de la medicina transfusional y participó en la formación de centenares de especialistas, no solo de su hospital, sino también de rotantes de otros centros en los que despertó la ilusión por el conocimiento de la Inmunohematología y, de manera muy especial, en el diagnóstico y manejo multidisciplinar-todo ello en estrecha colaboración con los Servicios de Obstetricia y Neonatología, de la Enfermedad Hemolítica del Recién Nacido- así como en su prevención, donde fue pionero en la implantación de la profilaxis IgG anti-D en nuestro país, tanto a nivel postnatal como prenatal. Su inquietud científica le mantuvo siempre en primera línea a través de una relación constante con numerosos centros españoles y extranjeros. Entre otras realizo una estancia en 1982 en el Centro de Transfusión de Nueva York. Su trabajo ha quedado plasmado en múltiples publicaciones entre ellas destaca especialmente una sobre el tratamiento con imnunoglobulinas intravenosas en la isoinmunización Rh grave, que fue publicado en el NEJM 1988 318; 519 -20. Asimismo participo en numerosos congresos de la especialidad siendo uno de los organizadores de la I Reunión Nacional de Hemoterapia que se celebró en Madrid en Mayo-Junio de 1979, a la que acudieron figuras muy relevantes de la Hematología nacional e internacional. Contribuyó de forma decisiva, junto a otros compañeros de otros centros, en la Hemoterapia madrileña, para dar el impulso inicial para la creación del germen de lo que posteriormente sería el Centro de Transfusión de la Comunidad de Madrid. Desde el punto de vista de la calidad participó activamente en la implantación de los sistemas de calidad el antiguo PABAS, antecesor del actual CAT. Desde el recuerdo y el agradecimiento, la figura de Criso siempre estará presente en nuestro quehacer profesional como ejemplo del trabajo bien hecho y para la formación de las nuevas generaciones. Conocí a Criso en Diciembre de 1997, cuando aún era Jefe de Sección del Banco de Sangre del Hospital de La Paz; ya en las postrimerías de su brillante carrera profesional como Hematólogo, y de su reconocido papel en el tratamiento y la prevención de la Enfermedad Hemolítica del Recién Nacido en nuestro país. (Ver publicación adjunta). La Hemoterapia madrileña de aquellos años se caracterizaba por una crónica carestía de hemocomponentes en una Comunidad Autónoma pequeña, en la que dos descoordinados y competitivos Centros de Transfusión trataban de dar respuesta a una enorme demanda de hemocomponentes por parte de los grandes hospitales que actuaban de forma independiente en la Hemodonación, -como reinos de Taifas- así como de múltiples clínicas y hospitales privados con una demanda hemoterápica creciente. Criso era -en esa arena- una opinión respetada e imprescindible de Directores, Gerentes, Jefes de Servicio y políticos, entre los que mediaba con su discreta diplomacia y amable autoridad. De algunas de sus recomendaciones de entonces, es consecuencia la actual Hemoterapia de Madrid, más tranquila y organizada. Yo –entonces- acababa de llegar al Centro de Donación de Sangre de Cruz Roja de Madrid en mi primer trabajo como Hematólogo, a donde acudía Criso casi a diario a recoger el pedido de sangre para las clínicas Ruber, cuyos Bancos de Sangre dirigía por las tardes. En esas idas y venidas tranquilas y sin prisa conocí al colega Hematólogo, pero especialmente a la persona y al amigo: Criso era fundamentalmente un hombre bueno. Extraordinariamente irónico e inteligente, era amable, cariñoso y paciente con residentes y amigos, pero severo e intransigente con los idiotas. Buen amante de la buena mesa, era clásico en sus gustos y exigente con los vinos. A nivel personal, Criso fue el colega al que muchos hematólogos quisimos emular. Yo además disfruté del privilegio de ser honrado con su buena influencia -siempre discreta- en mi carrera profesional, a lo que siempre le estaré agradecido. Su virtud más admirable fue su estoicismo; especialmente en los difíciles momentos personales que le tocó vivir, y que solo se explican por su antigua formación militar y su religiosidad, que era real y profunda; aunque sin beatería. Vivió compartiendo su saber y su amistad, fue feliz y volvió a serlo más tarde, en sus últimos años, hasta su muerte. Murió tranquilo cerca de los suyos. ¿qué más se le puede pedir a una vida?. Murió con elegancia y discreción, como siempre vivió; en los días del puente de la Almudena, sin avisarnos, sin despedirnos, sin enterarnos. Sírvate que te envíe, pues, como epitafio -querido Criso-, el mismo deseo que el de los antiguos romanos cuando se despedían de sus amigos para siempre: «Sit tibi terra levis» (Que la tierra te sea leve). Cuídate. José Luis Bueno Hematólogo Hospital Puerta de Hierro-Majadahonda Madrid Æ Socios protectores de la SETS Octapharma, S.A Diagast Ibérica, S.L Fenwal España, S.L Cerus Abbott Menarini Ortho Novartis Vaccines and Diagnostics S.L. Terumo Europe España Grupo Grífols Movaco Maco Spania Gambro Immucor, S.L. www.sets.es 27 AGENDA Agenda de eventos VII Curso de Aféresis Terapéutica. Barcelona 2 – 3 de junio de 2016. Información en www.sets.es LVIII Congreso Nacional de la SEHH. Santiago de Compostela, 20 – 22 de octubre de 2016. Información en [email protected] 27 Congreso Anual de la SETS. Bilbao, 22 – 24 de junio de 2016. Información en www.sets.es 2016 AABB Annual Meeting. Orlando, Florida. EEUU. 22 - 25 de octubre de 2015. Información en www.aabb.org 34 Congreso Internacional de la ISBT. Dubai, 3 – 8 de septiembre de 2016. Información, en www.eurocongres.com VII Curso básico de Transplante de Progenitores Hematopoyéticos. Barcelona 17 y 18 de noviembre de 2016. Información en www.sets.es II Curso sobre la producción de componentes: revisión y aplicaciones. Madrid, 6 y 7 de octubre. Información en www.sets.es 28 Congreso Anual de la SETS y 2º Hispanoportugués. Oporto, 1 – 3 de junio de 2017. Se informará próximamente a través de www.sets.es Todos los asociados que deseen ver publicados en la Agenda los eventos que organicen o tengan noticia de ellos, se ruega comunicarlo a: [email protected] 28 www.sets.es Bienvenida a los nuevos socios de la SETS • Agea Merino, Aida. Madrid • Ahmed, Nadia Johanna.Buenos Aires • Alves Magalhaes, Claudia. Vila Nova de Gaia, Portugal • Andujar Troncoso , Giselle Victoria. Ciudad Real • Benaiges Renom, Celia. Terrassa, Barcelona • Benitez Diaz, Juan Pedro. Madrid • Bustamante Sánchez, Gisella. Barcelona • Calderón Cabrera, Cristina. Sevilla • Cid, Emili .Badalona, Barcelona • Coello de Portugal Casana, Carmen .Toledo • Cotorruelo Sainz, Carlos Miguel. Rosario, Argentina • de Miguel Jiménez, Carlos .Madrid • De Ramón Sánchez, Cristina. Valladolid • Diaz Galvez, Francisco Javier. Valladolid • Dopazo Robelo, Belen. Porto, Portugal • Ferrer Caro, Francisca. Alicante • Fusté Nebot, Enric. Castelldefelts, Barcelona • Galindo Bejarano, Ricardo Hernan. Alhambra, Colombia • García García, Sónia. Terrassa, Barcelona • García Recio, Marta. Palma de Mallorca • González Díaz, José María. Las Palmas de Gran Canaria • Martinez Cadena, Maria del Carmen. Quito, Ecuador • Martinez Hellin, Angela. Baza, Granada • Martinez Millan, Diana Cristina. Alcantarilla, Murcia • Martínez Redondo, Consolación. La Alberca, Murcia • Melians Abreu, Silvia María. Pinar del Río, Cuba • Navarro Henze, Jose Luis. Hermosilla, Mexico • Obando Atalaya, Julio César. Lima, Perú • Parreño Marchante, Alfredo. Madrid • Plasencia Núñez, Miguel Alejandro. Valdivia, Chile • Rifon Roca, Jose Juan. Pamplona/Iruña • Rodríguez Arias, María. Mérida, Badajoz • Romera Martínez, Marta. Murcia • Romero Valdeón, Manuela. Villafranca de los Barros, Badajoz • Rosas Leon, Leonela Patricia. Guayaquil, Ecuador • Sola Lapeña, Carlos. Lardero, La Rioja • Sola Soto, María. Murcia • Torrents Vallés, Nuria. Barcelona • Vaca Criollo, Marco Vinicio. Ambato, Ecuador • Valdés Muñoz, Ruth. Stockport, Reino Unido • Valverde Calderón, Giselle. San José, Costa Rica • Vidan Estevez, Julia. Carbajal de la Legua, León • Guzman Sánchez, Victorina. Jerez de la Frontera, Cádiz • Villarreal Castellanos, Sonia. La Pobla de Mafumet, Tarragona • Hernández de León de Castro, Natalia Carolina. Albacete • Vives Rivero, Giovanna Rocío. Breña, Perú • Zapata Rodríguez, José Mª. Vigo, Pontevedra • MAK SYSTEM S.A. Bruselas, Bélgica • Herrera Calderón, Guillermo .Santiago de Chile • Hinostroza Solano, Jhony Alberto. Mendaro, Gipuzkoa • Lerma Vecrdejo, Ana. Madrid • López Aliaga de Cebrecos, Beatríz Zelodia. Surquillo, Perú • Martín Hernández, María Paz. Las Rozas, Madrid www.sets.es 29 www.sets.es
© Copyright 2026