1 Uso previsto 2 Descripción del método 3 Especificaciones 4
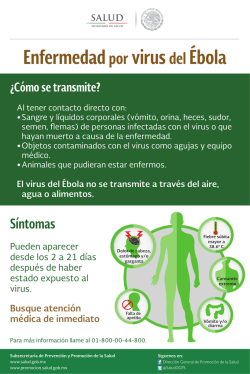
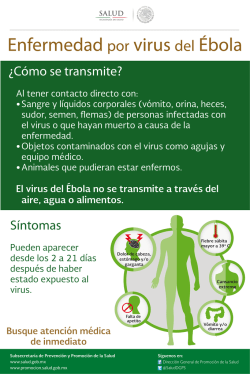
ENHEVA v.4 1 Uso previsto RealCycler ENHEVA es un kit de reactivos que permite la detección cualitativa por PCR a tiempo real del ARN de Enterovirus y del ADN de virus Herpes Simple (tipo 1 + tipo 2) y de virus Varicela-Zoster (VZV) en muestras clínicas, utilizando un equipo SmartCycler® (Cepheid®). El sistema incluye un control interno CHIC (Competitive Heterologous Internal Control) para prevenir los falsos negativos debidos a la inhibición de la reacción. Componente Viales Volumen AmpliMix 24 16,67 μL Retrotranscriptasa 1 60 μL Control Positivo 1 60 μL 2 Descripción del método 5 Estabilidad y almacenamiento La reacción en cadena de la polimerasa (PCR) está basada en la amplificación de una región específica del ADN/ARN usando oligonucleótidos complementarios a la secuencia diana. En la PCR a tiempo real se utilizan sondas marcadas con fluoróforos que emiten fluorescencia en caso de amplificación. El ciclo de la PCR en el que se detecta inicialmente un aumento significativo en la señal de fluorescencia es proporcional a la cantidad de ADN/ARN presente en la muestra. Este valor se denomina Ciclo umbral (Ct -Cycle Tresholdo Cq -Cycle Quantification-). Todos los componentes del kit RealCycler ENHEVA deben ser almacenados a -20 °C. El kit es estable a -20 °C hasta la fecha de caducidad que consta en la etiqueta externa del kit. 6 Material y equipamiento adicional requerido y no suministrado - Equipo de PCR a tiempo real SmartCycler® (Cepheid®). - Microcentrífuga para tubos SmartCycler®. - Gradillas para tubos SmartCycler®. - Kit de purificación de ADN/ARN. - Guantes desechables. - Pipetas calibradas. - Puntas de pipeta con filtro. - Congelador (-20 °C). - Control negativo (ADN/ARN de muestras negativas, agua o tampón de elución). La amplificación de Enterovirus se detecta en el canal correspondiente al fluoróforo FAM, la de CHIC en el correspondiente al fluoróforo Alx532, la del virus Herpes Simple (tipo 1 + tipo 2) en el correspondiente al fluoróforo TxR y la del virus Varicela-Zoster en el correspondiente al fluoróforo Alx647. 3 Especificaciones Sensibilidad Enterovirus: 1 copia/µL. Virus Herpes Simple tipo 1: 10 copias/µL. Virus Herpes Simple tipo 2: 100 copias/µL. Virus Varicela-Zoster: 100 copias/µL. 7 Advertencias y precauciones - Todos los componentes del kit deben mantenerse en frío mientras se están manipulando. - Después de añadir el ADN/ARN, minimizar el tiempo necesario para iniciar el programa de amplificación. - Los tubos con la mezcla de amplificación no deben exponerse a la luz durante un periodo de tiempo prolongado. - Descongelar y congelar repetidas veces los reactivos puede disminuir la sensibilidad del kit. - Usar guantes desechables. - Usar pipetas calibradas y puntas de pipeta con filtro. - Los ensayos deben llevarse a cabo por personal cualificado y siguiendo las buenas prácticas de laboratorio. - Se recomienda que se lleven a cabo controles positivos y negativos cada vez que se realice un análisis. - Se recomienda atemperar los tubos durante 5 minutos a temperatura ambiente antes de abrirlos. En caso contrario puede producirse la rotura del tapón. - No usar el kit después de la fecha de caducidad. - La presencia de polimorfismos en las secuencias de unión de las sondas u oligonucleótidos al ADN/ARN del patógeno puede generar resultados erróneos. En el caso de discordancia entre las observaciones clínicas y los resultados obtenidos se aconseja comprobar los resultados mediante métodos alternativos. - Los resultados obtenidos con este kit de diagnóstico deben utilizarse e interpretarse en el contexto de un cuadro clínico general y no deben ser el único criterio para la toma de decisiones clínicas. - Uso para diagnóstico in vitro. La sensibilidad analítica ha sido determinada por el método de dilución límite. La sensibilidad ha sido obtenida en ensayos repetitivos con una reproducibilidad superior al 95%. Especificidad Enterovirus: región 5’ UTR. Virus Herpes Simple tipo 1: gen US6. Virus Herpes Simple tipo 2: gen DNA polimerase. Virus Varicela-Zoster: gen Single-stranded DNA-binding protein (ORF 29). La validación de la especificidad ha sido realizada mediante ensayos experimentales y el análisis BLAST (www.ncbi.nlm.nih.gov/blast). 4 Composición RealCycler ENHEVA incluye la mezcla de reacción AmpliMix dispensada en tubos de amplificación, una retrotranscriptasa y un Control Positivo ENHEVA, el cual contiene una mezcla de ARN de Enterovirus y de ADN de virus Herpes Simple (tipo 1 + tipo 2) y virus Varicela-Zoster. Todos los reactivos están listos para su uso sin añadir ni reconstituir ningún componente. 1 RealCycler ENHEVA v.4 2 - Cepheid® y SmartCycler® son marcas registradas de Cepheid Corporation. - QIAamp es una marca registrada del Grupo QIAGEN. - Maxwell® es una marca registrada de Promega Corporation. - NucliSENS® easyMAG® es una marca registrada de bioMérieux. c) Preparación de la reacción - Descongelar los tubos AmpliMix necesarios para amplificar las muestras y el Control Positivo. Utilizar como control negativo ADN/ARN de muestras negativas, agua o tampón de elución de ADN/ARN (no proporcionados). - Añadir 2 μL de retrotranscriptasa a cada tubo. - Añadir 8 μL del ADN/ARN de cada muestra o control a cada tubo. - Centrifugar los tubos para que la reacción pase a la zona óptica del tubo. Verificar que no se forman burbujas en la zona óptica. - Colocar los tubos en el equipo. - Create Run > Dye Set > FATA25. - Add/Remove Sites: asignar el protocolo “ENHEVA” a las posiciones correspondientes a las muestras y los controles. - Start Run: iniciar el programa de amplificación. 8 Muestras clínicas - Recoger las muestras en tubos estériles. - Almacenarlas y transportarlas congeladas a -20 °C hasta su uso. - El kit es compatible con cualquier muestra en la cual el patógeno esté presente y se pueda extraer un ADN/ARN de calidad. Muestras clínicas validadas: ● Enterovirus: cultivo, heces, lavado broncoalveolar, líquido cefalorraquídeo y medio de transporte de virus (VTM). ● Virus Herpes Simple (tipo 1 + tipo 2): exudado genital, lavado broncoalveolar, líquido cefalorraquídeo, medio de transporte de virus (VTM) y orina. ● Virus Varicela-Zoster: líquido cefalorraquídeo y medio de transporte de virus (VTM). d) Ajustar el umbral de fluorescencia - Analysis settings > Manual Thresh Fluor Units > fijar el valor a 30.0. e) Interpretación del resultado de los controles - Resultados válidos de los controles 9 Procedimiento Canales a) Purificación de los ácidos nucleicos Control El ADN y ARN deben purificarse a partir de las muestras clínicas utilizando un procedimiento adecuado. En el mercado se encuentran disponibles gran cantidad de sistemas de purificación de ácidos nucleicos. Realizar el procedimiento de purificación siguiendo las instrucciones del fabricante y partir del volumen de muestra recomendado. POS NEG Ch1 Ch2 Ch3 Ch4 FAM Alx532 CHIC TxR Alx647 POS POS POS (Ct dentro Indiferente (Ct dentro (Ct dentro del rango) del rango) del rango) NEG POS (Ct dentro del rango) NEG NEG Interpr. VÁLIDO VÁLIDO Sistemas de purificación validados: ● QIAamp DNA Blood Mini kit (referencias 51104, 51106). QIAGEN. Este sistema sólo está indicado para la purificación de virus Herpes Simple y virus Varicela-Zoster. ● QIAamp Viral RNA Mini kit (referencias 52904, 52906). QIAGEN. ● Maxwell® 16 Cell LEV DNA Purification kit (referencia AS1140). Promega Corporation. Este sistema sólo está indicado para la purificación de virus Herpes Simple y virus Varicela-Zoster. - Resultados inválidos de los controles Sistemas de purificación compatibles: En el caso de obtener en algún canal del control negativo (excepto en CHIC) un valor de Ct > 0, los resultados obtenidos en las muestras incluidas en la serie de trabajo deben ser descartados (no valorables). En el caso de obtener en algún canal del Control Positivo (excepto en CHIC) un resultado negativo o un Ct fuera del rango indicado en la etiqueta interna se considera que ese control es inválido. Los resultados obtenidos en las muestras incluidas en la serie de trabajo deben ser descartados (no valorables). ● Maxwell® 16 Viral Total Purification kit. Promega Corporation. ● BioRobot EZ1. QIAGEN. ● QIAcube. QIAGEN. ● NucliSENS® easyMAG®. bioMérieux. b) Protocolo Programar el protocolo de amplificación “ENHEVA” de acuerdo con las siguientes especificaciones: 3 RealCycler ENHEVA v.4 4 f) Interpretación de los resultados de las muestras Interpretar el resultado obtenido en cada muestra o control según la combinación de señales indicada en la siguiente tabla: Canales Ch1 Ch2 Ch3 Ch4 FAM Alx532 CHIC TxR Alx647 POS Indiferente NEG NEG POSITIVO Enterovirus NEG Indiferente POS NEG POSITIVO Herpes Interpretación NEG Indiferente NEG POS POSITIVO VZV POS Indiferente POS NEG POSITIVO Enterovirus y Herpes POS Indiferente NEG POS POSITIVO Enterovirus y VZV NEG Indiferente POS POS POSITIVO Herpes y VZV POS Indiferente POS POS POSITIVO Enterovirus, Herpes y VZV NEG Ct dentro del rango NEG NEG NO SE DETECTA NEG Ct fuera del rango NEG NEG NO VALORABLE NEG 0,00 NEG NEG NO VALORABLE Gráfica 2 (Canal Alx532: CHIC): Resultado obtenido al amplificar un control negativo, un control positivo Enterovirus, un control positivo Herpes y un control positivo VZV. Control negativo (A9 en azul): se observa una señal con Ct=28,15. Control positivo Enterovirus (A10 en gris): se observa señal con Ct=26,40. Control positivo Herpes (A11 en naranja): se observa señal con Ct=28,29. Control positivo VZV (A12 en verde): se observa señal con Ct=28,04. Gráfica 3 (Canal TxR: Herpes): Resultado obtenido al amplificar un control negativo, un control positivo Enterovirus, un control positivo Herpes y un control positivo VZV. Control negativo (A9 en azul): ausencia de señal. Control positivo Enterovirus (A10 en gris): ausencia de señal. Control positivo Herpes (A11 en naranja): se observa señal con Ct=33,15. Control positivo VZV (A12 en verde): ausencia de señal. g) Ejemplo de resultado Gráfica 1 (Canal FAM: Enterovirus): Resultado obtenido al amplificar un control negativo, un control positivo Enterovirus, un control positivo Herpes y un control positivo VZV. Control negativo (A9 en azul): ausencia de señal. Control positivo Enterovirus (A10 en gris): se observa señal con Ct=23,14. Control positivo Herpes (A11 en naranja): ausencia de señal. Control positivo VZV (A12 en verde): ausencia de señal. Gráfica 4 (Canal Alx647: VZV): Resultado obtenido al amplificar un control negativo, un control positivo Enterovirus, un control positivo Herpes y un control positivo VZV. Control negativo (A9 en azul): ausencia de señal. Control positivo Enterovirus (A10 en gris): ausencia de señal. Control positivo Herpes (A11 en naranja): ausencia de señal. Control positivo VZV (A12 en verde): se observa señal con Ct=32,88. 5 RealCycler ENHEVA v.4 6 10 Interpretación de los resultados utilizando la aplicación informática Visor RealCycler a) Exportación de resultados a.1) Desde el equipo SmartCycler® Dx - Export > se abre la ventana Export data > Export (dejar por defecto la opción Export Optics Data, Export Results Tables y Export Assay Settings). b) Preparación Visor RealCycler - Abrir el Visor RealCycler e introducir nombre de usuario y contraseña. - Seleccionar el instrumento utilizado > Options > Setup. - Data > Lot input > seleccionar AmpliMix ENHEVA. - Introducir el valor de lote indicado en la etiqueta externa del kit RealCycler ENHEVA. - Introducir los valores de Ct para cada canal indicados en la etiqueta interna del kit RealCycler ENHEVA (obviar el signo “<“) > guardar y salir. - Columna AmpliMix > desplegar con el botón derecho y seleccionar AmpliMix ENHEVA. Se mostrarán automáticamente los patógenos detectados en cada canal. - Columna Lot > seleccionar el lote de la AmpliMix. - Save (opcionalmente cambiar el nombre del archivo). c) Importación de resultados - Data > Import Run Data > seleccionar fichero CSV. - Elegir Use Preanalytical Data from SmartCycler® (esta opción borrará los datos de las muestras que se hayan introducido en el Visor) o Use Preanalytical Data from Visor (esta opción no importará la identificación de muestras del SmartCycler®). - Import data. - En la columna Sample identificar los controles y opcionalmente las muestras de la serie. a.2) Desde el equipo SmartCycler® I+D - Export > Se abre la ventana Export data > Export (dejar por defecto la opción Export Optics Data y Export Results Table and Analysis Settings). d) Generar informe - File > Reports > Seleccionar las muestras que se quieren imprimir. - Save (opcionalmente cambiar el nombre del archivo). 7 RealCycler ENHEVA v.4 8 e) Interpretación de resultados - Detección de los patógenos La aplicación informática Visor RealCycler indicará en qué canal se detecta o no señal. En controles y muestras las señales pueden ser válidas (VAL) o inválidas (INV). En CHIC la señal puede ser VAL (Ct dentro del rango en las muestras negativas) o VAL* (Ct indiferente en las muestras positivas). Si se obtiene señal se considerará positivo para ese patógeno siempre y cuando el estatus de la muestra sea válido. - Estatus de la muestra ESTATUS Interpretación CHIC Control Positivo Control Negativo VÁLIDO Ct dentro del rango Ct dentro del rango Ct=0 ADVERTENCIA Ct dentro del rango Ausente Ct=0 ADVERTENCIA Ct dentro del rango Ct dentro del rango Ausente ADVERTENCIA Ct dentro del rango Ausente Ausente INVÁLIDO Ct fuera del rango Válido Válido INVÁLIDO Ct dentro del rango Inválido Válido INVÁLIDO Ct dentro del rango Válido Inválido INVÁLIDO Ct dentro del rango Inválido Inválido Si las curvas que superan el umbral son anómalas (no sigmoideas) o lineales, no son aptas para el análisis y los resultados obtenidos en esas muestras deben descartarse. El Visor RealCycler realiza un análisis para detectarlas, en cuyo caso las clasificará como inválidas. No obstante, el usuario debe valorar individualmente si las curvas son aptas o no para el análisis, y descartar aquéllas que tengan una forma anómala (no sigmoideas) o lineales. 11 Control de calidad Para validar los resultados, los valores de Ct obtenidos en el control positivo y en los controles internos deben encontrarse dentro de los rangos especificados en la etiqueta interna del kit. Cada lote del kit RealCycler ENHEVA ha sido testado según las especificaciones de la PCR a tiempo real utilizando el equipo SmartCycler® (Cepheid®). Fecha de publicación: Septiembre, 2015. Progenie Molecular Edificio Progenie. Valle de la Ballestera 56. 46015. Spain T: +34 902 91 05 05 F: +34 902 91 05 06 www.progenie-molecular.com 9 RealCycler ENHEVA v.4 10 8
© Copyright 2026