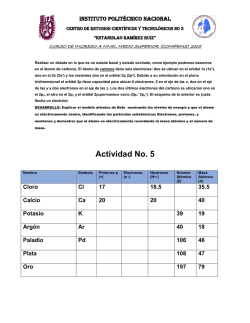
Primeras Aproximaciones al Modelo Atómico Actual.
Primeras Aproximaciones al Modelo Atómico Actual. Evolución del Átomo. El concepto de átomo existe desde la antigua Grecia, propuesto por los filósofos griegos, Demócrito, Leucipo y Epicuro. Fue descubierto por necesidades filosóficas, no lo demostró ningún experimento. Ellos decían que el átomo no podía dividirse indefinidamente, por lo que debía existir una unidad o bloque indivisible e indestructible. Empédocles, explicó la composición de la materia de otra forma, decía que la materia estaba compuesta de 4 sustancias básicas o " elementos": Tierra, Aire, Fuego y Agua; misma que fue apoyada por Aristóteles. El Átomo. Definición: Etimología del griego: a=sin y tomo=división, común para toda la materia. Es la porción más pequeña de un elemento químico que conserva sus propiedades. Sin embargo se ha demostrado que el átomo tiene una estructura muy compleja, que es divisible y de naturaleza eléctrica. El siguiente avance, se realizó en 1773, el químico francés Antoine- Laurent de Lavoisier, postuló su enunciado, " La materia no se crea ni se destruye, simplemente se transforma". La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. Leyes ponderales y la teoría atómica de Dalton. A finales del siglo XVIII John Dalton publica su obra “Nuevo Sistema de Filosofía Química”, la base de la hipótesis expuesta está en el establecimiento de una relación de los conceptos de elemento químico y átomo. Tomó como punto de partida los siguientes hechos y evidencias experimentales: La ley de la conservación de la masa de Lavoisier. (Ley ponderal) Ley de las proporciones constantes de Proust. (Ley ponderal) Los elementos no pueden descomponerse en otras sustancias. En la formación de un compuesto, los elementos no desaparecen, pueden volverse a recuperar por descomposición del compuesto. Para explicar estos hechos, propuso su modelo atómico mediante cuatro postulados: Toda materia está formada por átomos. Todos los átomos de cualquier elemento son iguales entre sí, pero diferentes a otros elementos. Los cambios químicos son cambios en las combinaciones de los átomos entre sí. Los átomos son como esferas de materia indivisibles. Estudió, también, la forma en que los diversos elementos se combinan entre sí para formar compuestos químicos. Dalton, representa al átomo como un esfera compacta indivisible e indestructible. Según Dalton, los elementos están formados por átomos, y que cada átomo para un mismo elemento es igual. Introduce la idea de la discontinuidad de la materia. Esta es la primera teoría científica que considera que la materia está dividida en átomos. El siguiente científico que propone una teoría sobre el átomo es, Joseph John Thomson. Thomson postula que, el átomo es una esfera homogénea de electricidad positiva, que los electrones están incrustados en ella. Su modelo atómico lo asemeja a un budín de pasas. Thomson investigó la naturaleza de los rayos catódicos y demostró que los campos eléctricos podían provocar la desviación de éstos. Como Thomson demostró existencia del electrón, se determinó que la materia se componía de dos partes, una negativa y otra positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model). Ernest Rutherford. Estudió las emisiones radioactivas e identificó sus tres componentes principales a los que denominó rayos alfa, beta y gamma. Su contribución más importante fueron sus estudios de la dispersión de los rayos alfa. Esta investigación le condujo, en 1911, a un nuevo modelo atómico. Según el modelo Rutherford, el átomo está constituido por un núcleo central que es la región donde se encuentran las cargas positivas (protones), y alrededor se encuentra el electrón girando en órbitas circulares. Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, por lo que también es llamado modelo atómico planetario. Los experimentos de Rutherford demostraron que el núcleo es muy pequeño comparándolo con el tamaño de todo el átomo, por lo que podemos decir que el átomo está prácticamente hueco. Rutherford sugirió que en los núcleos de los átomos tenían que existir otras partículas de masa casi igual a la del protón, pero sin carga eléctrica, por lo que las llamó neutrones. El neutrón no fue descubierto experimentalmente hasta 1932 por chadwick. Niels Borh En 1913 Niels Bohr discípulo de Rutherford propone un nuevo modelo para el átomo de Hidrógeno aplicando acertadamente la Teoría Cuántica de la radiación de Planck. Bohr supuso que el átomo solo puede tener ciertos niveles de energía definidos, establece que los electrones solo pueden girar en ciertas órbitas. Estas órbitas son estacionarias, en ellas el electrón no emite energía. Los saltos de los electrones desde niveles de mayor energía a otros de menor energía o viceversa producen fotones de luz. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser desechada. Para desarrollar su modelo Bohr se apoyó en: • El modelo atómico nuclear diseñado por Rutherford. • La teoría cuántica de la radiación del físico Max Planck. • La interpretación del efecto fotoeléctrico dada por Albert Einstein. El modelo de Bohr es un modelo cuántico, decimos que un sistema es cuántico si sólo puede poseer ciertos valores definidos de energía. Bohr, calculó los radios de las órbitas permitidas y las energías de dichas órbitas. Mientras un electrón gira en una órbita permitida no absorbe ni emite energía, pero cuando pasa de una órbita a otra más alejada del núcleo, absorbe energía y cuando desciende a una órbita más próxima al núcleo emite energía radiante. Puesto que conoce las energías de cada nivel puede calcular la energía que corresponde a cada salto electrónico y la frecuencia de la luz emitida. Modelo Cuántico Ondulatorio Actual. Las ecuaciones del modelo mecano-cuántico describen el comportamiento de los electrones dentro del átomo, y recogen su carácter ondulatorio y la imposibilidad de predecir sus trayectorias exactas Así establecieron el concepto de orbital región del espacio del átomo donde la probabilidad de encontrar un electrón es muy grande. Características de los orbitales: • La energía está cuantizada. • Lo que marca la diferencia con el modelo de Böhr es que este modelo no determina la posición exacta del electrón, sino la mayor o menor probabilidad. • Dentro del átomo, el electrón se interpreta como una nube de carga negativa, y dentro de esta nube, en el lugar en el que la densidad sea mayor, la probabilidad de encontrar un electrón también será mayor. Este modelo que se conoce como el modelo de Schrödinger y Heisemberg, concluye que no es posible predecir la trayectoria exacta de un electrón, quedando el modelo planetario anterior desfasado. Se introduce el concepto de orbitales atómicos. Es este modelo el que sigue en nuestros días, donde se acepta la distinción entre 4 números cuánticos (n, l, m,ms ) • Es un modelo matemático probabilístico. • Está basado en los principios de Louis de Broglie, Werner Heisenberg y Erwin Schrodinger. • Establece el concepto "orbital".
© Copyright 2026